双氢青蒿素的应用、抑制药物及其应用的制作方法
本发明属医药领域,具体涉及抗疟药物—双氢青蒿素(DHA)在抑制STAT3异常激活药物中的应用。同时,本发明还涉及一种含有该双氢青蒿素的抑制药物,以及该抑制药物的应用。
背景技术:
DHA是抗疟中药青蒿素的重要衍生物和主要活性成分,其药效是其他青蒿素类衍生物的3~5倍。DHA和青蒿素由著名药学家屠呦呦教授所发现并由此获得了2015年的诺贝尔生理医学奖,两者已被用于治疗多种疟疾尤其是恶性疟疾、耐药疟疾和脑型疟疾并取得了良好效果,被认为是治疗疟疾的一线药物。在体内,青蒿素及其衍生物迅速转变成DHA后才能发挥抗疟活性,分子结构中的过氧化物键是DHA消灭疟原虫的关键所在。在肝胆小管内,DHA被UDP-葡糖醛酸基转移酶葡糖醛酸化,然后经胆总管排入小肠内,经过多次肝肠循环最终通过尿液和粪便排出体外。其分布特点是脾脏中浓度最高,其次为肾脏、肾上腺和肝脏。研究发现,除了抗疟和抗血吸虫病,DHA还有调节炎症反应、改善红斑狼疮、抗菌和抗病毒等多重药效。
众多研究已经证实,STAT3(Signal transducers and activators of transcription 3,STAT3)对肿瘤的发生发展有重要的促进作用。生理状态下,单体的STAT3位于细胞质内,且无活性,需要磷酸化激活发挥效应。STAT3分子有Tyr 705和Ser 727两个磷酸化激活位点,Tyr 705为STAT3二聚化、核转位和结合DNA的关键位点;Ser 727则为ERK1/2和JNK等激活STAT3的位点。Jak2、EGFR和SRC等通过受体/非受体激活途径激活单体STAT3,二聚化形成同源或异源二聚体,进入胞核内与特定靶基因结合激活转录,调控下游蛋白的表达。正常组织内,STAT3的激活迅速而短暂,在肿瘤细胞内,STAT3则持续被激活。激活的STAT3不仅促进正常细胞恶变、肿瘤血管生成和癌细胞迁移,而且维持乳腺癌和头颈部肿瘤细胞(HNSCC)等肿瘤干细胞的“干细胞”特性。肺癌、肝癌、头颈鳞癌、乳腺癌、前列腺癌和白血病等均发现了高表达的、激活的STAT3,其发生率在肝癌、肺癌和乳腺癌中大于50%,而在HNSCC细胞则高达95%以上。众多研究结果提示,STAT3的激活是正常细胞恶变的必需条件,是维持肿瘤细胞及其干细胞特性的必需条件,是维持肿瘤细胞增殖生长的必需条件,是其他一些癌基因激活的必需条件。此外,STAT3对肿瘤细胞产生放疗和化疗抵抗也有重要促进作用,如用抑制剂或Decoy寡核苷酸阻断其激活则能逆转这种放化疗抵抗。
许多因素可以激活STAT3,如SRC、EGFR、IL-6、IL-10、CXCL12和COX-2等蛋白和因子能直接或间接激活STAT3,而在低氧等环境时,同样可以活化STAT3。由于STAT3是许多信号通路的交汇点和共用信号蛋白,因此,除了肿瘤,其还与多种疾病密切相关。IL-6等炎症因子激活STAT3释放发热物质或影响免疫细胞进而导致急性炎症。STAT3能靶向调控血管内皮生长因子(VEGF)的表达,故其对心脏和血管疾病的发生发展有重要影响,且是扩张性心肌病进展加重的必要条件。研究还发现,STAT3激活后可以加重系统性红斑狼疮的临床症状,并加重类风湿性关节炎的炎症表现,导致病情的加重。此外,STAT3的自身状态还与克罗恩病和溃疡性结肠炎的发生有关,且促进溃疡性结肠炎向恶性肿瘤转变。
在肿瘤细胞及炎症组织中STAT3被持续激活,将其阻断能逆转疾病的发生发展和转归。目前,已开发了多种直接和间接抑制剂阻断STAT3的激活。直接抑制剂包括Stattic、S3I-1757和BP-1-102等,此类抑制剂与STAT3分子结合,使之不能发挥激活功能;间接抑制剂则通过调控SRC、EGFR和Jak2等蛋白间接抑制STAT3激活,AG490、AZD1480、葫芦素B和姜黄素等属于间接抑制剂。尽管上述抑制剂显著的抗癌效果,但由于稳定性、水溶性和毒副作用等原因,只有极少数抑制剂用于动物实验及临床试验研究。
技术实现要素:
本发明目的是提供一种抗疟常用药物—双氢青蒿素(Dihydroartemisinin,DHA)在抑制STAT3异常激活中的应用。
双氢青蒿素用于抑制STAT3异常激活,所述双氢青蒿素的分子式如下:
相较其他STAT3抑制剂,来源于植物的DHA已经可以大规模合成,药物成本相对较低,对降低治疗费用及医疗负担、提高药物治疗的经济性有很大的帮助。
DHA已经在临床上应用很长时间,对其药物本身的药物动力学和药效学已清楚掌握,这些临床经验能帮助选择最佳药物剂量、用药周期和用药方法等,能够大大缩短临床试验时间,是其他任何STAT3抑制剂不能比及的。
DHA对STAT3激活的抑制作用显著且有较高的特异性,只对异常的细胞和组织STAT3激活有重要的抑制作用,正常细胞和组织受其影响很小,有利于临床降低毒副作用提高病人的耐受度。
进一步的,双氢青蒿素用于抑制在低氧或/和IL-6蛋白因子刺激时的STAT3激活。
低氧是细胞内常见的微环境,双氢青蒿素不仅在常氧时选择性抑制STAT3激活,此作用在低氧条件下也能发挥。IL-6蛋白因子能直接或间接激活STAT3,而在低氧等环境时,同样可以活化STAT3,双氢青蒿素对STAT3异常激活的抑制作用在低氧条件或/和IL-6蛋白因子刺激时也能发挥。
一种抑制药物,所述抑制药物含有双氢青蒿素。
进一步的,所述抑制药物含有药物赋形剂或载体。
进一步的,所述药物赋形剂或载体包括甘油、乙醇、缓冲盐水、二甲基亚砜、生理盐水中的一种或几种。
进一步的,所述抑制药物中双青青蒿素浓度为40-200μmol/L。
进一步的,所述的抑制药物用于对具有STAT3异常激活特性的疾病干预中。
进一步的,所述的抑制药物用于对具有STAT3异常激活特性的疾病干预时间≥12h。
进一步的,所述STAT3异常激活特性的疾病包括肿瘤、自身免疫性疾病、炎症性疾病。
所述自身免疫系统疾病和炎症性疾病,包括溃疡性结肠炎、系统性红斑狼疮、类风湿性关节炎、强直性脊柱炎、自发性血小板减少性紫癜、银屑病、多发性硬化症、慢性肾炎、胃炎、胰腺炎、炎症性肺病、支气管哮喘、梗阻性肾病、视网膜炎等疾病。
所述肿瘤包括肝癌、乳腺癌、胰腺癌、多发性骨髓瘤、白血病、淋巴瘤、肺癌、胃癌、食道癌、直肠癌、结肠癌、皮肤癌、黑色素瘤、前列腺癌、脑瘤和宫颈癌等。
进一步的,所述抑制药物与抗癌药物或抗炎药物联合使用。
本发明首先进行体外实验,选用三种具有代表性的头颈鳞癌细胞,采用免疫印迹(Western blotting)和质粒转染等技术,证明了DHA能抑制Jak2/STAT3信号通路的激活,这种作用在炎症因子IL-6刺激、低氧环境下也能发挥。接着将其与最常用的STAT3抑制剂AG490和AZD1480比较,发现三种药物随着药物浓度增加均能抑制STAT3激活,表明DHA是一种STAT3激活抑制剂。最后建立移植瘤动物模型,进一步证明DHA能显著抑制移植瘤的生长,并下调Jak2和STAT3的激活蛋白,实验动物无明显的毒副作用。体外和体内的实验结果显示,通过特异性抑制Jak2/STAT3信号激活,DHA可显著抑制HNSCC细胞的生长。
附图说明
图1为常氧状态下DHA抑制HNSCC细胞STAT3的激活。
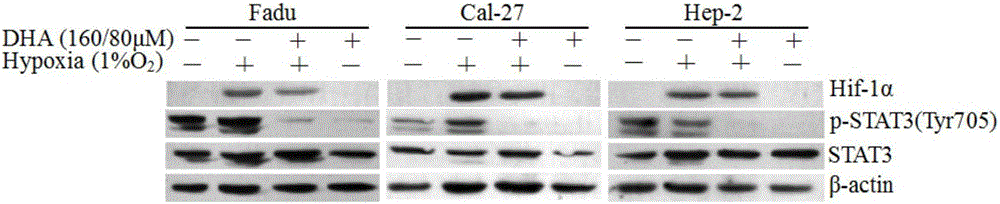
图2为低氧状态下DHA抑制HNSCC细胞STAT3的激活。
图3为DHA抑制HNSCC细胞p-STAT3表达具有特异性。
图4为DHA抑制STAT3信号通路上游p-Jak2蛋白表达。
图5为DHA抑制IL-6引起的Jak2和STAT3激活。
图6为DHA作为一种新型Jak2/STAT3信号通路抑制剂。
图7为DHA抑制动物移植瘤组织内Jak2/STAT3信号通路的激活。
具体实施方式
实施例一
常氧状态下DHA抑制HNSCC细胞STAT3的激活。
配制DHA溶液。称取DHA粉剂1g,加入二甲基亚砜(DMSO)溶液17.584ml,无菌环境下用1ml移液器反复吹吸将药物完全溶解,制备成200mM/L的DHA溶液,分装入无菌小瓶,置于-80℃冻存备用,用时现配。
Western blotting检测DHA对HNSCC细胞相关蛋白表达情况。细胞蛋白的提取:选取对数生长期Fadu、Cal-27和Hep-2头颈鳞癌细胞,消化计数后以4×105/2ml/well细胞密度接种到6孔培养板中,待细胞贴壁后加入现配制的、含不同浓度DHA的培养基2ml。药物干预结束后加入RAPI裂解液100μl提取细胞蛋白。瘤组织蛋白提取:从液氮中取出瘤组织,将其切成细小碎块后置入匀浆器匀浆,加入500μl含PMSF的RIPA裂解液,冰上放置30min,裂解过程中反复匀浆研磨彻底裂解组织细胞。然后将组织裂解物移入离心管中,4℃条件下,12000rpm离心15min,吸取上清液置于液氮中保存备用。采用BCA法定量蛋白浓度,计算出提取的各样品的蛋白浓度,分装入200μ1离心管内,每管含有40μg蛋白,而后进行蛋白变性。配制8~12%的分离胶,室温放置30min。待胶凝结呈果冻状,配制4%浓缩胶,插入梳子。待胶凝结后拔出梳子,倒入电泳液,进样器加入蛋白样品和标准品蛋白Marker作为对照,接通电流,进行SDS-PAGE电泳,时间约2h。结束后依次放入滤纸、PVDF膜、凝胶,注意正负极,倒入电转液,将分离胶上的蛋白转膜至PVDF膜,时间约为4h。然后用脱脂奶粉封闭1h并用含一抗的脱脂奶粉与PVDF膜4℃孵育过夜。次日洗膜并孵育二抗1h,采用ECL方法显影。
常氧状态下DHA抑制HNSCC细胞STAT3的激活。三种肿瘤细胞Fadu、Hep-2、Cal-27用DHA干预24h,Fadu用DHA浓度为0、20、40、80、160μmol/L,Hep-2和Cal-27用DHA浓度为0、10、20、40、80μmol/L;抑或一定剂量的DHA作用三种癌细胞,Fadu用DHA浓度为160μmol/L,Hep-2和Cal-27用DHA浓度为80μmol/L,用Western blotting检测0、6h、12h、24h和48h时p-STAT3的表达情况。结果如图1所示:肿瘤细胞内的p-STAT3随着DHA浓度和干预时间的增加而减少,对照组无明显变化。这说明,DHA明显抑制STAT3的激活,且与干预剂量和时间呈依赖关系。
实施例二
低氧状态下DHA抑制HNSCC细胞STAT3的激活。
低氧是恶性肿瘤细胞内常见的微环境,能促进肿瘤细胞增殖、侵袭、转移及产生放化疗抵抗,故在低氧条件下研究DHA的抗瘤作用有重要意义。
配制DHA溶液。称取DHA粉剂1g,加入二甲基亚砜DMSO溶液10.284ml,乙醇溶液7.3ml,无菌环境下用1ml移液器反复吹吸将药物完全溶解,制备成200mM/L的DHA溶液,分装入无菌小瓶,置于-80℃冻存备用,用时现配。
低氧装置及低氧条件。微生物培养箱内的低氧设备为自制装置,低氧装置由六块厚8mm的有机玻璃板粘接而成,分为室和盖两部分,在室的两侧分别有控制气体进出的管道,进气道靠近底部,出气道靠近顶部,关闭上盖并垫上一层软橡皮垫,以防漏气,拧紧固定螺丝,确保缺氧箱完全密闭。我实验室以往进行的低氧相关实验研究可以证实该装置用于研究低氧的可行性。本次实验低氧条件为37℃、5%CO2、1%O2、94%N2。进气流量及容器内所需氧分压达标时间又氧化锆氧分析仪测定。由进气道通入混合气(95%N2,5%CO2),同时打开出气管道,通气速度为3L/min,通气8min后,再向低氧装置内通入(1%O2,94%N2,5%CO2)混合气,通气速度为3L/min,通气5min后,箱内氧浓度变化由氧化锆氧分析仪全程监测,最终为实验所需低氧浓度。当低氧装置内氧分压达标时,通气速度改为低气流通气0.8L/min,以维持低氧箱内氧浓度,以保证低氧箱内氧浓度的稳定。通过配制不同氧含量的混合气获得相应的低氧浓度,本模型误差极小(<0.02),尤其是可获得稳定的低氧浓度。本模型方便易行,可满足各种不同细胞低氧研究的需要。另外,本模型制作经济,操作简单,可进行高压灭菌等消毒处理,便于推广应用。
Western blotting检测DHA对HNSCC细胞相关蛋白表达情况。细胞蛋白的提取:选取对数生长期Fadu、Cal-27和Hep-2头颈鳞癌细胞,消化计数后以4×105/2ml/well细胞密度接种到6孔培养板中,待细胞贴壁后加入现配制的、含不同浓度DHA的培养基2ml。药物干预结束后加入RAPI裂解液100μl提取细胞蛋白。瘤组织蛋白提取:从液氮中取出瘤组织,将其切成细小碎块后置入匀浆器匀浆,加入500μl含PMSF的RIPA裂解液,冰上放置30min,裂解过程中反复匀浆研磨彻底裂解组织细胞。然后将组织裂解物移入离心管中,4℃条件下,12000rpm离心15min,吸取上清液置于液氮中保存备用。采用BCA法定量蛋白浓度,计算出提取的各样品的蛋白浓度,分装入200μ1离心管内,每管含有40μg蛋白,而后进行蛋白变性。配制8~12%的分离胶,室温放置30min。待胶凝结呈果冻状,配制4%浓缩胶,插入梳子。待胶凝结后拔出梳子,倒入电泳液,进样器加入蛋白样品和标准品蛋白Marker作为对照,接通电流,进行SDS-PAGE电泳,时间约2h。结束后依次放入滤纸、PVDF膜、凝胶,注意正负极,倒入电转液,将分离胶上的蛋白转膜至PVDF膜,时间约为4h。然后用脱脂奶粉封闭1h并用含一抗的脱脂奶粉与PVDF膜4℃孵育过夜。次日洗膜并孵育二抗1h,采用ECL方法显影。
本实验选择低氧的条件为1%O2,DHA干预Fadu、Hep-2、Cal-27三种HNSCC细胞24h,Fadu用DHA干预浓度为160μmol/L,Cal-27和Hep-2用DHA干预浓度为80μmol/L。结果如图2所示,p-STAT3蛋白表达仍受到明显抑制(“+”为加入相应药物或低氧处理,“-”为加入溶剂对照,Actin为蛋白内参)。因此,在低氧环境下,DHA也能抑制STAT3蛋白的激活。
实施例三
DHA抑制HNSCC细胞p-STAT3表达具有特异性。
配制DHA溶液。称取DHA粉剂1g,加入甘油10.584ml,缓冲盐水7ml,无菌环境下用1ml移液器反复吹吸将药物完全溶解,制备成200mM/L的DHA溶液,分装入无菌小瓶,置于-80℃冻存备用,用时现配。
Western blotting检测DHA对HNSCC细胞相关蛋白表达情况。细胞蛋白的提取:选取对数生长期Fadu、Cal-27和Hep-2头颈鳞癌细胞,消化计数后以4×105/2ml/well细胞密度接种到6孔培养板中,待细胞贴壁后加入现配制的、含不同浓度DHA的培养基2ml。药物干预结束后加入RAPI裂解液100μl提取细胞蛋白。瘤组织蛋白提取:从液氮中取出瘤组织,将其切成细小碎块后置入匀浆器匀浆,加入500μl含PMSF的RIPA裂解液,冰上放置30min,裂解过程中反复匀浆研磨彻底裂解组织细胞。然后将组织裂解物移入离心管中,4℃条件下,12000rpm离心15min,吸取上清液置于液氮中保存备用。采用BCA法定量蛋白浓度,计算出提取的各样品的蛋白浓度,分装入200μ1离心管内,每管含有40μg蛋白,而后进行蛋白变性。配制8~12%的分离胶,室温放置30min。待胶凝结呈果冻状,配制4%浓缩胶,插入梳子。待胶凝结后拔出梳子,倒入电泳液,进样器加入蛋白样品和标准品蛋白Marker作为对照,接通电流,进行SDS-PAGE电泳,时间约2h。结束后依次放入滤纸、PVDF膜、凝胶,注意正负极,倒入电转液,将分离胶上的蛋白转膜至PVDF膜,时间约为4h。然后用脱脂奶粉封闭1h并用含一抗的脱脂奶粉与PVDF膜4℃孵育过夜。次日洗膜并孵育二抗1h,采用ECL方法显影。
三种肿瘤细胞Fadu、Hep-2、Cal-27用DHA干预24h,Fadu用DHA浓度为0、20、40、80、160μmol/L,Hep-2和Cal-27用DHA浓度为0、10、20、40、80μmol/L,结果如图3所示,p-STAT3明显被抑制,而p-Erk1/2和p-Akt蛋白无明显变化。
实施例四
DHA抑制STAT3信号通路上游p-Jak2蛋白表达。
配制DHA溶液。称取DHA粉剂1g,加入甘油7.584ml,生理盐水10ml,无菌环境下用1ml移液器反复吹吸将药物完全溶解,制备成200mM/L的DHA溶液,分装入无菌小瓶,置于-80℃冻存备用,用时现配。
Western blotting检测DHA对HNSCC细胞相关蛋白表达情况。细胞蛋白的提取:选取对数生长期Fadu、Cal-27和Hep-2头颈鳞癌细胞,消化计数后以4×105/2ml/well细胞密度接种到6孔培养板中,待细胞贴壁后加入现配制的、含不同浓度DHA的培养基2ml。药物干预结束后加入RAPI裂解液100μl提取细胞蛋白。瘤组织蛋白提取:从液氮中取出瘤组织,将其切成细小碎块后置入匀浆器匀浆,加入500μl含PMSF的RIPA裂解液,冰上放置30min,裂解过程中反复匀浆研磨彻底裂解组织细胞。然后将组织裂解物移入离心管中,4℃条件下,12000rpm离心15min,吸取上清液置于液氮中保存备用。采用BCA法定量蛋白浓度,计算出提取的各样品的蛋白浓度,分装入200μ1离心管内,每管含有40μg蛋白,而后进行蛋白变性。配制8~12%的分离胶,室温放置30min。待胶凝结呈果冻状,配制4%浓缩胶,插入梳子。待胶凝结后拔出梳子,倒入电泳液,进样器加入蛋白样品和标准品蛋白Marker作为对照,接通电流,进行SDS-PAGE电泳,时间约2h。结束后依次放入滤纸、PVDF膜、凝胶,注意正负极,倒入电转液,将分离胶上的蛋白转膜至PVDF膜,时间约为4h。然后用脱脂奶粉封闭1h并用含一抗的脱脂奶粉与PVDF膜4℃孵育过夜。次日洗膜并孵育二抗1h,采用ECL方法显影。
三种肿瘤细胞Fadu、Hep-2、Cal-27用DHA干预24h,Fadu用DHA浓度为0、20、40、80、160μmol/L,Hep-2和Cal-27用DHA浓度为0、10、20、40、80μmol/L,观察p-EGFR、p-Jak2、p-SRC以及p-STAT3蛋白表达情况。结果如图4提示,三种肿瘤细胞p-Jak2和p-STAT3蛋白表达随着DHA剂量的增加而下降,而p-EGFR和p-SRC两种蛋白则无明显改变。
实施例五
DHA抑制IL-6引起的Jak2和STAT3激活。
配制DHA溶液。称取DHA粉剂1g,加入二甲基亚砜DMSO溶液6.584ml,甘油11ml,无菌环境下用1ml移液器反复吹吸将药物完全溶解,制备成200mM/L的DHA溶液,分装入无菌小瓶,置于-80℃冻存备用,用时现配。
Western blotting检测DHA对HNSCC细胞相关蛋白表达情况。细胞蛋白的提取:选取对数生长期Fadu、Cal-27和Hep-2头颈鳞癌细胞,消化计数后以4×105/2ml/well细胞密度接种到6孔培养板中,待细胞贴壁后加入现配制的、含不同浓度DHA的培养基2ml。药物干预结束后加入RAPI裂解液100μl提取细胞蛋白。瘤组织蛋白提取:从液氮中取出瘤组织,将其切成细小碎块后置入匀浆器匀浆,加入500μl含PMSF的RIPA裂解液,冰上放置30min,裂解过程中反复匀浆研磨彻底裂解组织细胞。然后将组织裂解物移入离心管中,4℃条件下,12000rpm离心15min,吸取上清液置于液氮中保存备用。采用BCA法定量蛋白浓度,计算出提取的各样品的蛋白浓度,分装入200μ1离心管内,每管含有40μg蛋白,而后进行蛋白变性。配制8~12%的分离胶,室温放置30min。待胶凝结呈果冻状,配制4%浓缩胶,插入梳子。待胶凝结后拔出梳子,倒入电泳液,进样器加入蛋白样品和标准品蛋白Marker作为对照,接通电流,进行SDS-PAGE电泳,时间约2h。结束后依次放入滤纸、PVDF膜、凝胶,注意正负极,倒入电转液,将分离胶上的蛋白转膜至PVDF膜,时间约为4h。然后用脱脂奶粉封闭1h并用含一抗的脱脂奶粉与PVDF膜4℃孵育过夜。次日洗膜并孵育二抗1h,采用ECL方法显影。
Fadu用DHA浓度为160μmol/L,Hep-2和Cal-27用DHA浓度为80μmol/L,DHA干预24h后,加入人重组IL-6(20ng)干预1h(“+”为加入相应药物处理,“-”为加入溶剂对照,Actin为蛋白内参)。结果如图5提示,IL-6能使三种癌细胞内的p-Jak2和p-STAT3蛋白表达明显增加,而DHA则明显减少两种蛋白。
实施例六
DHA可作为一种新型Jak2/STAT3信号通路抑制剂。
配制DHA溶液。称取DHA粉剂1g,加入乙醇17.584ml,无菌环境下用1ml移液器反复吹吸将药物完全溶解,制备成200mM/L的DHA溶液,分装入无菌小瓶,AZD1480和AG490均为100mM/L浓度的二甲基亚砜DMSO溶液,三种药物置于-80℃冻存备用,用时现配。
Western blotting检测DHA对HNSCC细胞相关蛋白表达情况。细胞蛋白的提取:选取对数生长期Fadu、Cal-27和Hep-2头颈鳞癌细胞,消化计数后以4×105/2ml/well细胞密度接种到6孔培养板中,待细胞贴壁后用不同浓度的DHA、AZD1480及AG490分别干预实验的三种鳞癌细胞。药物干预结束后加入RAPI裂解液100μl提取细胞蛋白。瘤组织蛋白提取:从液氮中取出瘤组织,将其切成细小碎块后置入匀浆器匀浆,加入500μl含PMSF的RIPA裂解液,冰上放置30min,裂解过程中反复匀浆研磨彻底裂解组织细胞。然后将组织裂解物移入离心管中,4℃条件下,12000rpm离心15min,吸取上清液置于液氮中保存备用。采用BCA法定量蛋白浓度,计算出提取的各样品的蛋白浓度,分装入200μ1离心管内,每管含有40μg蛋白,而后进行蛋白变性。配制8~12%的分离胶,室温放置30min。待胶凝结呈果冻状,配制4%浓缩胶,插入梳子。待胶凝结后拔出梳子,倒入电泳液,进样器加入蛋白样品和标准品蛋白Marker作为对照,接通电流,进行SDS-PAGE电泳,时间约2h。结束后依次放入滤纸、PVDF膜、凝胶,注意正负极,倒入电转液,将分离胶上的蛋白转膜至PVDF膜,时间约为4h。然后用脱脂奶粉封闭1h并用含一抗的脱脂奶粉与PVDF膜4℃孵育过夜。次日洗膜并孵育二抗1h,采用ECL方法显影。
AZD1480及AG490是两种STAT3信号通路特异抑制剂,本部分研究先将这两种药物以不同的剂量干预Fadu、Cal-27和Hep-2细胞24h,而后用MTT法观察三种肿瘤细胞活力受抑制情况,根据其结果计算出AZD1480及AG490相应的IC50值。再根据IC50值确定两种抑制剂的干预浓度(参考DHA浓度选择,即最大剂量大于IC50值,而其余值小于IC50值,浓度梯度倍比设定)。抑制剂浓度设定后,用不同浓度的DHA、AZD1480及AG490分别干预实验的三种鳞癌细胞24h。p-Jak2和p-STAT3蛋白的表达均随着实验药物的浓度而下降。此结果如图6所示,与特异性STAT3抑制剂AZD1480和AG490作用相似,DHA同样能明显抑制头颈鳞癌细胞Jak2和STAT3蛋白的激活。而且,在同样的浓度,DHA对Hep-2细胞抑制较AG490对两种激活的蛋白抑制更显著。
实施例七
DHA抑制动物移植瘤组织内Jak2/STAT3信号通路的激活。
配制DHA溶液。称取DHA粉剂1g,加入乙醇9.584ml,生理盐水8ml,无菌环境下用1ml移液器反复吹吸将药物完全溶解,制备成200mM/L的DHA溶液,分装入无菌小瓶,置于-80℃冻存备用,用时现配。
BALb/c雄性裸鼠的饲养和移植瘤模型的建立。14只BALb/c雄性裸鼠(4~6周,18~20g重),饲养于白求恩国际和平医院实验动物中心(SPF级),饲养室为24℃恒温且隔音处理,每天的明暗时间为12/12h,空气层流过滤,无菌饲料和灭菌水供动物自由食用,动物饲养于笼中,每个笼最多5只动物,定期更换垫料。裸鼠到达实验动物中心饲养1周,待其适应新的环境且观察动物一般情况良好后,消化收集对数生长期的Cal-27细胞,计数后将其浓缩为5×107/ml Hanks单细胞溶液,按每只0.2ml接种于左侧腹股沟外侧皮下,成功建立移植瘤动物模型。动物实验全程均在白求恩国际和平医院伦理委员会的监督和认可下进行。动物分组和DHA干预:裸鼠移植瘤直径长至5mm左右时用随机表进行分组,即DHA组和对照组(n=7)。DHA组给予50mg/kg,对照组则给予DMSO,两组动物均采用腹腔内注射给药,连续注射2/3天休息1天,每周注射5次,干预时间共计28天。移植瘤体积和动物体重的测量:每天观察动物精神状态、饮食及排便等一般情况,特别注意有无咬伤、肿瘤局部皮肤有无破溃等。每4天用电子游标卡尺测量一次肿瘤体积,同时用电子秤称动物体重,登记和统计测量数据,注意对照组和实验组体重有无显著差异。肿瘤体积用以下公式进行计算:体积(cm3)=宽2(cm2)×长(cm)/2。最后一次DHA腹腔注射24h后,先用CO2麻醉动物,然后采用断颈方法处死实验裸鼠。剥取的移植瘤组织分为两部分,一部分置于多聚甲醛溶液用于免疫组织化学染色;另一部分置于液氮中用于Western blot分析Jak2/STAT3信号通路相关蛋白变化。
免疫组织化学染色方法。动物瘤组织标本按4μm厚度连续切片,然后附于经多聚赖氨酸处理的载玻片上,60℃过夜。将切片用二甲苯中脱蜡20min 2次;浸于100%乙醇2min 2次;95%乙醇2min 2次;90%乙醇2min 3次;85%乙醇2min 2次;75%乙醇2min 2次。将切片置于枸橼酸修复液中,于高压锅内加热;高压锅煮沸2~3min后停止加热,然后降至室温,用PBS洗涤切片5min,共3次。滴加3%过氧化氢封闭过氧化物酶的活性,接着用PBS洗涤5min3次,滴加山羊血清室温封闭20min。滴加p-Jak2(Tyr1007/1008)和p-STAT3(Tyr705)一抗,按1:100比例稀释,4℃冰箱内孵育过夜。用PBS洗涤切片5min 3次,滴加山羊抗兔二抗,室温孵育20min,再用PBS洗涤5min 3次。于切片上滴加辣根酶标记链霉卵白素工作液,37℃孵育20min,PBS洗涤5min 3次。显微镜下用DAB控制显色,用自来水彻底冲洗切片。苏木精复染3min,1%盐酸酒精分化,氨水返蓝,梯度酒精脱水,每次2min,二甲苯浸泡5min2次,中性树胶封片。DHA实验组和DMSO对照组的阳性和阴性组织相采用400×的显微镜照相保存。
Western blotting检测DHA对HNSCC细胞相关蛋白表达情况。细胞蛋白的提取:选取对数生长期Fadu、Cal-27和Hep-2头颈鳞癌细胞,消化计数后以4×105/2ml/well细胞密度接种到6孔培养板中,待细胞贴壁后加入现配制的、含不同浓度DHA的培养基2ml。药物干预结束后加入RAPI裂解液100μl提取细胞蛋白。瘤组织蛋白提取:从液氮中取出瘤组织,将其切成细小碎块后置入匀浆器匀浆,加入500μl含PMSF的RIPA裂解液,冰上放置30min,裂解过程中反复匀浆研磨彻底裂解组织细胞。然后将组织裂解物移入离心管中,4℃条件下,12000rpm离心15min,吸取上清液置于液氮中保存备用。采用BCA法定量蛋白浓度,计算出提取的各样品的蛋白浓度,分装入200μ1离心管内,每管含有40μg蛋白,而后进行蛋白变性。配制8~12%的分离胶,室温放置30min。待胶凝结呈果冻状,配制4%浓缩胶,插入梳子。待胶凝结后拔出梳子,倒入电泳液,进样器加入蛋白样品和标准品蛋白Marker作为对照,接通电流,进行SDS-PAGE电泳,时间约2h。结束后依次放入滤纸、PVDF膜、凝胶,注意正负极,倒入电转液,将分离胶上的蛋白转膜至PVDF膜,时间约为4h。然后用脱脂奶粉封闭1h并用含一抗的脱脂奶粉与PVDF膜4℃孵育过夜。次日洗膜并孵育二抗1h,采用ECL方法显影。
图7为DHA抑制动物移植瘤组织内Jak2/STAT3信号通路的激活,结果表明,对照组Jak2和STAT3激活是高表达的,而DHA组两种蛋白的激活受到显著抑制。
以上所述仅为本发明的较佳实施例而已,并不用以限制本发明,凡在本发明的精神和原则之内,所作的任何修改、等同替换、改进等,均应包含在本发明的保护范围之内。
- 还没有人留言评论。精彩留言会获得点赞!