一种可缓释、靶向应用于神经退行性疾病的纳米药物的制作方法
本发明涉及医药技术领域,具体涉及一种纳米粒,包含载体材料、活性成分和靶向分子,所述载体材料为人血清白蛋白,所述活性成分是能够预防和/或治疗神经退行性疾病的活性成分。本发明还涉及制备所述纳米粒的方法,含有所述纳米粒的药物组合物,以及所述纳米粒或药物组合物在制备用于预防和/或治疗受试者的神经退行性疾病的药物中的用途。
背景技术:
1、阿尔茨海默症胆碱能假说
阿尔茨海默症(AD)是以记忆和认知能力进行性减退为主要特征的神经退行性疾病,目前,对于AD发生的病因仍没有明确的定论,主要集中在胆碱能学说及β-淀粉样蛋白(Aβ)学说。
中枢胆碱能系统与学习、记忆密切相关,乙酰胆碱是中枢胆碱能系统中重要的神经递质之一,其主要功能是维持意识的清醒,在学习记忆中起重要作用。尽管AD的确切病因还仍是未知,但是患者特定脑区神经元大量丢失是导致认知和记忆能力进行性减退的直接原因,尤其是海马区胆碱能神经元的丢失。目前,美国FDA批准上市用于治疗AD的药物共有五种,分别为他克林、新斯的明、加兰他敏、多奈哌齐和美金刚,前四种均为可逆性乙酰胆碱酯酶抑制剂。乙酰胆碱酯酶抑制剂可较牢固地与体内乙酰胆碱酯酶相互作用,占据酶位点,使酶失去分解乙酰胆碱的功能,从而间接升高突触间隙内乙酰胆碱的浓度,达到缓解AD的疗效。
2、现有药物应用的局限
目前,用于治疗AD的药物仍很局限,不仅是因为其始发机制不明确,还由于大脑复杂的防御体系,造成药物无法穿透血脑屏障(blood-brain barrier,BBB),靶向进入中枢;此外,即使有部分药物透过BBB,在膜外排转运体(如:p-糖蛋白)作用下仍会被泵出。普通药物的这些局限虽然可以通过化学修饰得以克服,但是,修饰后药效下降、修饰过程中可能引入毒副产物及修饰过程复杂等问题也会应运而生。对于蛋白及多肽类药物,它们在外周蛋白酶的作用下很快分解失活,限制了大量效应分子的应用。
以AD为代表的神经退行性疾病是一类慢性疾病,患者在确诊后,需长期不间断服药,甚至终身服药。现有AD治疗药物血浆半衰期较短、血脑屏障穿透能力差、代谢速度快等问题,使患者需每日按时、按量服药,这对记忆力日益减退的病人来说是很困难的。所以,制备高效、缓释、靶向性强的治疗AD的药物刻不容缓。
3、纳米药物研究进展
现有的以中枢神经系统为靶向目标的纳米药物中,多数是采用人工合成聚合物类材料作为载体,即在目标药物外层包裹载体材料,当载体材料在靶位点降解时,内核药物即被释放。此类纳米药物制备简单,稳定性高,在一定程度上无毒且易于降解。
但是,以AD为代表的神经退行性疾病属于老年慢性疾病,患者脑代谢能力减退,这些外源性人工合成聚合物类材料及其降解产物无疑会增加脑的负担,因此在制备AD纳米药物时,应更加重视材料的生物相容性以及材料代谢产物的毒性。
基于如上原因,印度的ShrinidhA.Joshi研究组采用生物相容性较好的聚乳酸-羟基乙酸共聚物(PLGA)作为载体,装载AD治疗药物利斯的明,利用沉降法制备包裹型纳米粒。从材料的安全性角度来看,虽然PLGA在一定程度上增强了生物相容性,但中枢靶向性差、药物释放迅速,依然不能满足慢性疾病的治疗需求(Shrinidh A.Joshi,Sandip S.Chavhan等,Rivastigmine-loaded PLGA and PBCA nanoparticles:Preparation,optimization,characterization,in vitro and pharmacodynamic studies,European Journal of Pharmaceuticsand Biopharmaceutics 76(2010)189–199)。
英国的Helen F.Stanyon研究组发现在生理水平上,人血清白蛋白(HSA)不仅可以与外周血浆中95%的Aβ结合,还可与脑脊液中近一半的Aβ单体结合,有效抑制β-淀粉样蛋白纤维的形成,并显著降低原纤维的总量;除此之外,HSA还可通过剥夺Aβ-Cu(Ⅱ)复合物中的Cu(Ⅱ),降低金属离子的催化作用,双重机制抑制原纤维的形成(Helen F.Stanyon and John H.Viles,Human Serum Albumin Can Regulate Amyloid-βPeptide Fiber Growth in the Brain Interstitium,J.Biol.Chem.2012,287:28163-28168)。
综上所述,目前无论是分子药物还是现有的纳米药物,均无法满足神经退行性疾病高效、缓释、靶向的治疗需求。人血清白蛋白作为一种天然蛋白质,展现出了良好的材料属性及针对Aβ的靶向属性。因此,亟需开发利用人血清白蛋白纳米粒作为载体材料的纳米药物,来满足高效、缓释、靶向的治疗需求。
技术实现要素:
在本发明中,除非另有说明,否则本文中使用的科学和技术名词具有本领域技术人员所通常理解的含义。并且,本文中所涉及的实验室操作步骤均为相应领域内广泛使用的常规步骤。同时,为了更好地理解本发明,下面提供相关术语的定义和解释。
如本文中使用的,术语“纳米粒”(nanoparticle,NP)是指粒径在纳米级的粒子,例如粒径不大于1000nm的粒子,例如粒径在10nm~100nm、100nm~200nm、200nm~300nm、300nm~400nm、400nm~500nm、500nm~600nm、600nm~700nm、700nm~800nm、800nm~900nm或900nm~1000nm之间的粒子。
如本文中使用的,术语“粒径”即“等效粒径”,是指当被测粒子的某种物理特性或物理行为与某一直径的同质球体(或组合)最相近时,就把该球体的直径(或组合)作为被测粒子的等效粒径(或粒度分布)。
如本文中使用的,术语“平均粒径”是指对于一个由大小和形状不相同的粒子组成的实际粒子群,与一个由均一的球形粒子组成的假想粒子群相比,如果两者的粒径全长相同,则称此球形粒子的直径为实际粒子群的平均粒径。平均粒径的测量方法是本领域技术人员已知的,例如光散射法;平均粒径的测量仪器包括但不限于光散射粒度仪。
如本文中使用的,术语“胆碱能递质补充剂”是指外源性地对胆碱能神经递质(胆碱能递质)进行补充的活性成分(例如药物)。
如本文中使用的,术语“前体药物”是指化合物经修饰后得到的在体外无活性或活性较小、在体内经酶或非酶的转化释放出活性药物而发挥药效的化合物。前体药物的设计原理以及制备方法为本领域技术人员已知。
如本文中使用的,术语“药学上可接受的盐”是指(1)化合物中存在的酸性官能团(例如-COOH、-OH、-SO3H等)与适当的无机或者有机阳离子(碱)形成的盐,例如化合物与碱金属或碱土金属形成的盐、化合物的铵盐,和化合物与含氮有机碱形成的盐;以及(2)化合物中存在的碱性官能团(例如-NH2等)与适当的无机或者有机阴离子(酸)形成的盐,例如化合物与无机酸或有机羧酸形成的盐。
因此,本申请中,“药学上可接受的盐”包括但不限于,碱金属盐,如钠盐、钾盐、锂盐等;碱土金属盐,如钙盐、镁盐等;其他金属盐,如铝盐、铁盐、锌盐、铜盐、镍盐、钴盐等;无机碱盐,如铵盐;有机碱盐,如叔辛基胺盐、二苄基胺盐、吗啉盐、葡糖胺盐、苯基甘氨酸烷基酯盐、乙二胺盐、N-甲基葡糖胺盐、胍盐、二乙胺盐、三乙胺盐、二环己基胺盐、N,N’-二苄基乙二胺盐、氯普鲁卡因盐、普鲁卡因盐、二乙醇胺盐、N-苄基-苯乙基胺盐、哌嗪盐、四甲基胺盐、三(羟甲基)氨基甲烷盐;氢卤酸盐,如氢氟酸盐、盐酸盐、氢溴酸盐、氢碘酸盐等;无机酸盐,如硝酸盐、高氯酸盐、硫酸盐、磷酸盐等;低级烷磺酸盐,如甲磺酸盐、三氟甲磺酸盐、乙磺酸盐等;芳基磺酸盐,如苯磺酸盐、对苯磺酸盐等;有机酸盐,如醋酸盐、苹果酸盐、富马酸盐、琥珀酸盐、柠檬酸盐、酒石酸盐、草酸盐、马来酸盐等;氨基酸盐,如甘氨酸盐、三甲基甘氨酸盐、精氨酸盐、鸟氨酸盐、谷氨酸盐、天冬氨酸盐等。
如本文中使用的,术语“神经退行性疾病”是指由神经系统进行性病变所引起的疾病,包括但不限于阿尔兹海默症(AD)、帕金森氏症、亨廷顿氏病、肌萎缩性侧索硬化和脑脊髓多发性硬化。如本文中使用的,术语“良溶剂”是指能够溶解人血清白蛋白的溶剂,所述良溶剂包括但不限于水和氯化钠溶液。
如本文中使用的,术语“不良溶剂”是指不能溶解人血清白蛋白的溶剂,所述不良溶剂包括但不限于乙醇。
如本文中使用的,术语“室温”是指25±5℃。
如本文中使用的,术语“约”应该被本领域技术人员理解,并将随其所用之处的上下文而有一定程度的变化。如果根据术语应用的上下文,对于本领域技术人员而言,其使用不是清楚的,那么“约”的意思是不超过所述特定数值或范围的正负10%。
为了满足阿尔兹海默症等神经退行性疾病的治疗需求,发明人通过深入的研究和创造性的劳动,得到了本申请的纳米粒,其可以用于递送血脑屏障透过性差和/或血浆半衰期短的药物,有效地实现了药物的中枢靶向与缓释目标,由此提供了下述发明:
在一个方面,本发明提供了一种纳米粒,包含载体材料、活性成分和靶向分子,所述载体材料为人血清白蛋白,所述活性成分是能够预防和/或治疗神经退行性疾病的活性成分。
发明人发现,在载体材料的选择上,天然蛋白类药物载体人血清白蛋白纳米粒可以有效地满足中枢靶向给药的各项要求。首先,人血清白蛋白与Aβ单体具有较高的亲和力,具有针对Aβ的靶向属性,在保证能大量包裹药物分子的同时,可迅速靶向病灶部位,实现了材料自身的优良靶向性能。
另外,天然蛋白类材料的生物安全性高,满足药学领域的使用要求,无免疫原性,分解产物为氨基酸,可作为人体自身的营养成分重新利用或转化为其他含氮物,最大程度地降低了外源性有机或无机高分子材料对中枢神经系统的损伤与负担。
在某些实施方案中,所述活性成分装载在载体材料中,形成人血清白蛋白载药纳米粒。
在某些实施方案中,所述人血清白蛋白载药纳米粒是通过包含以下步骤的方法形成的:
步骤(1-1):将人血清白蛋白和活性成分溶解或分散于良溶剂中,形成溶液(1);
步骤(1-2):将溶液(1)滴加至不良溶剂中,并加入交联剂进行反应,得到人血清白蛋白载药纳米粒。
在某些实施方案中,所述纳米粒的载药率为15%至25%,例如15%、16%、17%、18%、19%、20%、21%、22%、23%、24%或25%。
在某些实施方案中,所述活性成分选自胆碱能递质补充剂和胆碱酯酶抑制剂。
在某些实施方案中,所述胆碱能递质补充剂选自乙酰胆碱、乙酰胆碱的前体药物或乙酰胆碱药学上可接受的盐(例如盐酸盐)。
在某些实施方案中,所述胆碱能递质补充剂为乙酰胆碱或氯化乙酰胆碱。
在某些实施方案中,所述胆碱酯酶抑制剂选自利斯的明、加兰他敏或多奈哌齐,或这些化合物药学上可接受的盐(例如酒石酸盐)。
在某些实施方案中,所述胆碱酯酶抑制剂为重酒石酸利斯的明。
为保证足够的中枢输入剂量,增强纳米粒的中枢靶向性,纳米粒的表面修饰有靶向分子,以增加纳米粒对血脑屏障的通透性,实现高效的中枢靶向输运。
在某些实施方案中,所述靶向分子选自表面活性剂、聚乙二醇类高分子和血脑屏障特异性抗体。
在某些实施方案中,所述靶向分子为表面活性剂。
在某些实施方案中,所述靶向分子为吐温-80。
在某些实施方案中,所述靶向分子修饰在纳米粒的表面。
在某些实施方案中,所述靶向分子修饰在人血清白蛋白载药纳米粒的表面。
在某些实施方案中,所述靶向分子通过吸附作用修饰在纳米粒的表面。
在某些实施方案中,所述纳米粒的直径为150nm至250nm;例如,150nm至180nm、180nm至200nm、200nm至220nm或220nm至250nm;例如150nm、160nm、170nm、180nm、190nm、200nm、210nm、220nm、230nm、240nm或250nm。
在某些实施方案中,所述纳米粒的zeta电位为-30mV至+20mV,例如-30mV至-20mV、-20mV至-10mV、-10mV至0、0至+10mV或+10mV至+20mV;例如-30mV、-25mV、-20mV、-15mV、-10mV、-5mV、0、+5mV、+10mV、+15mV或+20mV。
在某些实施方案中,所述纳米粒的包封率为40%至50%,例如40%、41%、42%、43%、44%、45%、46%、47%、48%、49%或50%。
图1示例性地显示了本申请的纳米粒的一种结构。图中所示的纳米粒中,以具有Aβ靶向属性的HSA作为纳米载体,包裹装载了能够治疗AD的药物,并且,在HSA纳米粒的表面修饰有靶向分子,以提高HSA纳米粒的血脑屏障(BBB)透过性,并延长体内循环时间。
在一个方面,本申请提供了制备上述纳米粒的方法,所述方法包括以下步骤:
步骤(1):制备人血清白蛋白载药纳米粒;
步骤(2):在人血清白蛋白载药纳米粒的表面修饰靶向分子。
在某些实施方案中,所述步骤(1)中,制备人血清白蛋白载药纳米粒的方法为反溶剂法。。
在某些实施方案中,所述步骤(1)包括以下步骤:
步骤(1-1):将人血清白蛋白和活性成分溶解或分散于良溶剂中,形成溶液(1);
步骤(1-2):将溶液(1)滴加至不良溶剂中,并加入交联剂进行反应,得到人血清白蛋白载药纳米粒。
在某些实施方案中,所述步骤(1-1)中,人血清白蛋白与活性成分的质量比为1:1至10:1,例如1:1、2:1、3:1、4:1、5:1、6:1、7:1、8:1、9:1或10:1。
在某些实施方案中,所述步骤(1-1)中,所述良溶剂为氯化钠溶液。
在某些实施方案中,所述步骤(1-1)中,氯化钠溶液的浓度为1mmol/L至20mmol/L,例如1mmol/L至5mmol/L、5mmol/L至10mmol/L、10mmol/L至15mmol/L或15mmol/L至20mmol/L。
在某些实施方案中,所述步骤(1-1)还包括:调节溶液(1)的pH。
在某些实施方案中,所述不良溶剂为乙醇。
在某些实施方案中,所述步骤(1-2)在搅拌下进行。
在某些实施方案中,所述步骤(1-2)中的交联剂为戊二醛。
本发明中,加入交联剂可以使人血清白蛋白颗粒发生交联固化,使其在水溶液中不会立即溶胀散开,避免过快地释放出颗粒内包裹的药物。
在某些实施方案中,所述步骤(1)还包括步骤(1-3):对人血清白蛋白载药纳米粒进行分离。
在某些实施方案中,所述步骤(1-3)中,通过离心对人血清白蛋白载药纳米粒进行分离。
在某些实施方案中,所述步骤(2)包括以下步骤:
步骤(2-1):将人血清白蛋白载药纳米粒分散于生理盐水中;得到溶液(2);
步骤(2-2):将溶液(2)与靶向分子或其溶液混合。
在某些实施方案中,所述靶向分子的溶液为靶向分子的生理盐水溶液。
在某些实施方案中,所述靶向分子的溶液中,靶向分子的质量百分浓度为0.1%至10%,例如0.1%至0.5%、0.5%至1%、1%至5%或5%至10%。
在某些实施方案中,在步骤(2-2)中,通过搅拌和/或超声进行混合。
在某些实施方案中,在步骤(1)之后,对装载药物的人血清白蛋白纳米粒的载药率和包封率进行测试。
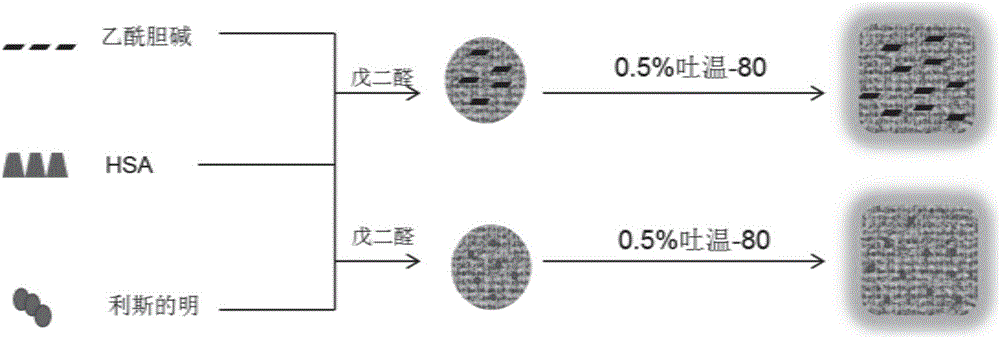
图2示例性地显示了制备本申请的纳米粒的方法。图中所述的方法包括:将活性成分(例如乙酰胆碱或利斯的明)与HSA进行混合,在戊二醛的作用下,HSA发生交联,形成HSA载药纳米粒;在HSA载药的表面修饰靶向分子(例如吐温-80),得到修饰后的载药纳米粒。
在一个方面,本申请提供了一种药物组合物,其含有上述纳米粒。
本发明中,任选地,所述药物组合物还包含药学上可接受的辅料(例如载体和/或赋形剂)。在某些实施方案中,所述载体和/或赋形剂选自:离子交换剂,氧化铝,硬脂酸铝,卵磷脂,血清蛋白(例如人血清蛋白),甘油,山梨酸,山梨酸钾,饱和植物脂肪酸的部分甘油酯混合物,水,硫酸鱼精蛋白,磷酸氢二钠,磷酸氢钾,氯化钠,锌盐,胶态氧化硅,三硅酸镁,聚乙烯吡咯烷酮,纤维素物质,聚乙二醇,羧甲基纤维素钠,聚丙烯酸酯,蜂蜡,聚乙烯-聚氧丙烯嵌段聚合物和羊毛脂。
本发明中,所述药物组合物可以制成药学上可接受的任一剂型。例如,本发明的药物组合物可以配制为片剂、胶囊剂、丸剂、颗粒剂、溶液剂、混悬剂、糖浆剂、注射剂(包括液体注射剂、注射用粉剂或注射用片剂)、栓剂、吸入剂或喷雾剂。
此外,本发明的所述药物组合物还可以以任何合适的给药方式,例如口服、胃肠外、直肠、经肺或局部给药等方式施用于受试者。在某些优选的实施方案中,所述药物组合物适用于口服、胃肠外(静脉内、肌肉或皮下)、经皮、经舌或呼吸给药。
当用于口服给药时,所述药物组合物可制成口服制剂,例如口服固体制剂,如片剂、胶囊剂、丸剂、颗粒剂等;或,口服液体制剂,如口服溶液剂、口服混悬剂、糖浆剂等。当制成口服制剂时,所述药物组合物还可包含适宜的填充剂、粘合剂、崩解剂、润滑剂等。当用于肠胃外给药时,所述药物组合物可制成注射剂,包括包括液体注射剂、注射用粉剂或注射用片剂。当制成注射剂时,所述药物组合物可采用现有制药领域中的常规方法来进行生产。当配制注射剂时,所述药物组合物中可以不加入附加剂,也可根据药物的性质加入适宜的附加剂。当用于直肠给药时,所述药物组合物可制成栓剂等。用于经肺给药时,所述药物组合物可制成吸入剂或喷雾剂等。
在某些优选的实施方案中,本发明的纳米粒以单位剂量的形式存在于药物组合物中。
在某些优选的实施方案中,给予受试者有效量的所述药物组合物。如本文中所使用的,术语“有效量”是指足以获得或至少部分获得期望的效果的量。例如,预防疾病有效量是指,足以预防,阻止,或延迟疾病的发生的量;治疗疾病有效量是指,足以治愈或至少部分阻止已患有疾病的患者的疾病和其并发症的量。测定这样的有效量完全在本领域技术人员的能力范围之内。例如,对于治疗用途有效的量将取决于待治疗的疾病的严重度、患者自己的免疫系统的总体状态、患者的一般情况例如年龄,体重和性别,药物的施用方式,以及同时施用的其他治疗等等。
在一个方面,本申请提供了上述纳米粒或药物组合物在制备用于预防和/或治疗受试者的神经退行性疾病的药物中的用途。
在一个方面,本申请提供了一种预防和/或治疗受试者的神经退行性疾病的方法,包括给受试者施用如上所述的纳米粒。
在一个方面,本申请提供了如上所述的纳米粒,所述纳米粒用于预防和/或治疗受试者的神经退行性疾病。
在某些实施方案中,所述神经退行性疾病选自阿尔兹海默病、帕金森氏症、亨廷顿氏病、肌萎缩性侧索硬化和脑脊髓多发性硬化。
在某些实施方案中,所述受试者为哺乳动物,例如牛科动物、马科动物、羊科动物、猪科动物、犬科动物、猫科动物、啮齿类动物、灵长类动物;例如,所述受试者为人。
本申请的纳米粒,特别适合于递送因水溶性强而难以透过血脑屏障的药物,或血浆半衰期短而无法满足长期持续释放要求的药物。因此,在另一个方面,本申请提供了上述纳米粒的用途,所述纳米粒用于提高活性成分透过受试者血脑屏障的能力,和/或延长活性成分在受试者体内的释放时间;所述活性成分是能够预防和/或治疗受试者的神经退行性疾病的活性成分。
在某些实施方案中,所述活性成分选自胆碱能递质补充剂和胆碱酯酶抑制剂。
在某些实施方案中,所述胆碱能递质补充剂选自乙酰胆碱、乙酰胆碱的前体药物或乙酰胆碱药学上可接受的盐(例如盐酸盐)。
在某些实施方案中,所述胆碱能递质补充剂为乙酰胆碱或氯化乙酰胆碱。
在某些实施方案中,所述胆碱酯酶抑制剂选自利斯的明、加兰他敏或多奈哌齐,或这些化合物药学上可接受的盐(例如酒石酸盐)。
在某些实施方案中,所述胆碱酯酶抑制剂为重酒石酸利斯的明。
在某些实施方案中,所述神经退行性疾病选自阿尔兹海默病、帕金森氏症、亨廷顿氏病、肌萎缩性侧索硬化和脑脊髓多发性硬化。
在某些实施方案中,所述受试者为哺乳动物,例如牛科动物、马科动物、羊科动物、猪科动物、犬科动物、猫科动物、啮齿类动物、灵长类动物;例如,所述受试者为人。
有益效果
本申请的纳米粒具有以下有益效果中的一个或多个:
1.本申请的纳米粒解决了水溶性强的药物难以通过血脑屏障的问题,和/或血浆半衰期短的药物无法实现长期缓慢释药的问题。
2.本申请的纳米粒安全性高。本申请的纳米粒所使用的纳米载体为天然蛋白类材料,无免疫原性、生物相容性高,降解产物为多种人体必需氨基酸,无毒副作用。
3.本申请的纳米粒的载药方式优化。文献报道的载药方式多以纳米粒外层吸附药物分子为主,载药率低且易解吸;而本发明采用纳米粒包裹药物分子,药物分子包裹缠绕于纳米载体之中,随着纳米粒的逐步崩解,药物分子缓慢释放。
4.本申请的纳米粒可有效改善小鼠的空间学习及记忆能力,维持胆碱能系统相关酶的活性及乙酰胆碱含量的动态平衡,降低氧化应激水平,尤其对额颞叶皮层具有明显保护作用。
下面将结合附图和实施例对本发明的实施方案进行详细描述,但是,本领域技术人员将理解,下列附图和实施例仅用于说明本发明,而不是对本发明的范围的限定。根据附图和优选实施方案的下列详细描述,本发明的各种目的和有利方面对于本领域技术人员来说将变得显然。
附图说明
图1示例性地显示了本申请的纳米粒的一种结构。图中所示的纳米粒中,以具有Aβ靶向属性的HSA作为载体材料,包裹装载了能够治疗AD的药物,并且,在HSA纳米粒的表面修饰有靶向分子,以提高HSA纳米粒的BBB透过性,并延长体内循环时间。
图2示例性地显示了制备本申请的纳米粒的方法。图中所述的方法包括:将活性成分(例如乙酰胆碱或利斯的明)与HSA进行混合,在戊二醛的作用下,HSA发生交联,形成HSA载药纳米粒;在HSA载药的表面修饰靶向分子(例如吐温-80),得到修饰后的载药纳米粒。
图3为实施例1中未修饰吐温-80的装载乙酰胆碱的HSA纳米粒的扫描电镜照片。如图所示,未修饰的HSA载药纳米粒呈球形,直径约为200nm。
图4为实施例1中修饰了吐温-80的装载乙酰胆碱的HSA纳米粒的扫描电镜照片。如图所示,修饰了吐温-80的HSA载药纳米粒呈规则正方体,边长为200nm左右。
图5为实施例1中修饰了吐温-80的装载乙酰胆碱的HSA纳米粒的扫描电镜照片。如图所示,修饰了吐温-80的HSA载药纳米粒呈规则正方体,边长为200nm左右。
图6显示了实施例3中,ACh水溶液、HSA水溶液、未装载药物且未修饰吐温-80的空白HSA纳米粒,以及未修饰吐温-80的HSA-ACh纳米粒的紫外吸收曲线。图中,HSA溶液在280nm附近有明显特征吸收峰(曲线1),而Ach溶液在280nm附近没有吸收(曲线2)。HSA形成纳米粒后,280nm附近的吸收峰仍明显可见(曲线3);而装载了Ach的HSA纳米粒,280nm附近的吸收峰明显降低(曲线4)。结果表明,药物分子成功掺杂包裹在纳米载体之中。
图7显示了实施例3中,未装载药物且未修饰吐温-80的空白HSA纳米粒,未修饰吐温-80的HSA-Ach纳米粒,吐温-80修饰的未装载的药物HSA纳米粒以及吐温-80修饰的HSA-Ach纳米粒的XRD谱图。图中,经吐温-80修饰后的HSA纳米粒,在2θ=31.6°可见明显尖峰(曲线3和曲线4),而未修饰的纳米粒在此处无峰值(曲线1和曲线2)。结果证明,靶向分子吐温-80已成功修饰于纳米粒表面。
图8为实施例4中,用紫外分光光度法测定的多柔比星的标准曲线。
图9为实施例4中,多柔比星样品的体外累计释放率曲线。如图所示,多柔比星溶液组在10h左右达到累计释放率最大值,回收率达90%以上,证明多柔比星已完全释放;而多柔比星载药纳米粒组在80h内的累计释放率稳定持续上升,且在中性生理盐水溶液中的累计释放率仅为载药率的30%。由此推断,载药纳米粒在体液运输中可保持结构的稳定,保证了进入中枢的纳米粒仍能维持较高的载药率。
图10为实施例5中水迷宫行为学评价训练期4天内各组小鼠找到平台时间的趋势图。训练期内,各组小鼠在第1天时找到平台时间没有较大差异;而在第3天及第4天时,空白对照组找到平台时间为20s,模型组、ACh溶液组及RT溶液组找到平台时间明显长于空白对照组,而HSA-ACh纳米粒组及HSA-RT纳米粒组找到平台时间与空白对照组相比无明显差异,且明显低于模型组。实验证明,在分别给予HSA-ACh纳米粒及HSA-RT纳米粒后,小鼠的短期空间学习能力得到改善。
图11显示了实施例5中水迷宫行为学评价测试期内各组小鼠第一次找到平台的潜伏期。如图所示,空白对照组小鼠的潜伏期最短,方差分析结果显示,模型组、ACh溶液组及RT溶液组潜伏期明显长于空白对照组(P<0.05),而HSA-ACh纳米粒组及HSA-RT纳米粒组与空白对照组无明显统计学差异。
图12显示了实施例5中水迷宫行为学评价测试期内各组小鼠在60s内穿越平台的次数。如图所示,空白对照组小鼠穿台次数明显多于模型组、ACh溶液组及RT溶液组(P<0.01),而与HSA-ACh纳米粒组及HSA-RT纳米粒组无明显统计学差异。
图13显示了实施例5中水迷宫行为学评价测试期内各组小鼠在目标象限游泳的时间。如图所示,模型组及ACh溶液组与空白对照组相比具有明显统计学差异(P<0.05),而其他组与空白对照组无明显统计学差异。
图14为实施例6中各组小鼠左半脑H.E.染色病理切片照片,图A-L分别对应空白对照组海马(A)、皮层(B),模型组海马(C)、皮层(D),ACh溶液组海马(E)、皮层(F),HSA-ACh纳米粒组海马(G)、皮层(H),RT溶液组海马(I)、皮层(J),HSA-RT纳米粒组海马(K)、皮层(L)。
图15为实施例7中的激光共聚焦显微镜照片。图A-C分别对应心脏注射生理盐水组(对照组)、乙酰胆碱纳米粒组和利斯的明纳米粒组。从图中可以明显观察到,正常斑马鱼体内无荧光分布;对于乙酰胆碱纳米粒组和利斯的明纳米粒组,虽经过心脏注射,但在斑马鱼的脑部出现了明显的绿色荧光,因此证明药物可顺利通过血脑屏障进入中枢。
具体实施方式
下面将结合实施例对本发明的实施方案进行详细描述,但是本领域技术人员将会理解,下列实施例仅用于说明本发明,而不应视为限定本发明的范围。实施例中未注明具体条件者,按照常规条件或制造商建议的条件进行。所用试剂或仪器未注明生产厂商者,均为可以通过市购获得的常规产品。
实施例1:装载乙酰胆碱(Ach)的纳米粒的制备
本实施例以人血清白蛋白(HSA)为纳米载体材料,包裹装载乙酰胆碱。所使用的活性成分为氯化乙酰胆碱,选用的良溶剂为10mmol/L的氯化钠溶液,选用的不良溶剂为乙醇,选用的交联剂为10%戊二醛,选用的靶向分子为吐温-80,以人血清白蛋白(HSA)纳米粒作为载体材料。制备过程如下。
步骤(1):利用反溶剂法制备HSA载药纳米粒:将20mg HSA与10mg ACh溶解于1mL氯化钠溶液(10mmol/L)中,以0.22μm水系滤膜过滤后,在600rpm转速下,将此溶液以50μL/min滴速滴加于10mL乙醇中;滴加结束后,加大搅拌速度为800rpm,加入10%戊二醛20μL,避光反应24h。反应样品以13600rpm速度离心10min,去除上清,收集沉淀,等量生理盐水离心样品3遍,收集沉淀,得到装载乙酰胆碱(Ach)的HSA纳米粒,4℃保存。
利用差量法测定产物质量,计算纳米药物包封率及载药率,方法如下:
将步骤(1)所制样品中的溶剂旋干,固体粉末重新分散于8mL生理盐水,以13600rmp速度离心10min,吸取1mL上清液于8mL生理盐水中,摇匀,碱性羟胺比色法(或紫外分光光度法)测定上清未被包裹的药量,通过总药量与上清未被包裹的药量的差值,计算纳米药物包封率及载药率,公式如下:
包封率=(m总药量-m上清药量)/m总药量×100%;
载药率=(m总药量-m上清药量)/m产物×100%。
测量一定时间内的上清未被包裹的药量。经过24小时,上清未被包裹的药量达到稳定。计算得到,装载Ach的HSA纳米粒的包封率为46.14±1.13%,载药率为21.95±1.26%。
使用扫描电镜对HSA载药纳米粒进行观察,结果如图3所示。未修饰的纳米粒呈球形,直径为200nm左右。
步骤(2):HSA载药纳米粒的表面修饰:将步骤(1)中制备得到的纳米粒分散于1mL生理盐水中,加入0.1%的吐温-80生理盐水溶液1mL,800rpm转速搅拌30min,超声15min,最终得到修饰有吐温-80并负载Ach的HSA纳米粒(HSA-ACh NPs)。
使用扫描电镜对修饰后的HSA载药纳米粒进行观察,结果如图4和图5所示。修饰后的载药纳米粒呈规则正方体,边长为200nm左右。
使用动态光散射粒径仪(带有zeta电位测试功能)对修饰有吐温-80的HSA载药纳米粒进行测定,平均粒径约为198.5nm,粒径均一稳定,zeta电位约为-28.4mV。测试结果如表1所示。
表1
实施例2:装载利斯的明(RT)的纳米粒的制备
本实施例以人血清白蛋白(HSA)纳米粒作为药物载体,制备了装载利斯的明(RT)的纳米粒。所使用的活性成分为重酒石酸利斯的明,选用的良溶剂为10mmol/L的氯化钠溶液,选用的不良溶剂为无水乙醇(纯度大于99.7%),选用的交联剂为10%戊二醛,选用的靶向分子为吐温-80。制备过程如下。
(1)利用反溶剂法制备HSA载药纳米粒:将20mg HSA与10mg RT溶解于1ml氯化钠溶液(10mmol/L)中,用0.1mol/L氢氧化钠溶液调节溶液pH值为8.3,以0.22μm水系滤膜过滤后,在600rpm转速下,将溶液以50μL/min滴速滴加于10mL无水乙醇中;滴加结束后,加大搅拌速度为800rpm,加入10%戊二醛20μL,避光反应24h。反应样品以13600rpm速度离心10min,去除上清,收集沉淀,等量生理盐水离心样品3遍,收集沉淀,得到球形HSA载药纳米粒,4℃保存。
(2)HSA载药纳米粒的表面修饰:将步骤(1)中制备得到的纳米粒分散于1mL生理盐水中,加入0.1%的吐温-80的生理盐水溶液1mL,800rpm转速搅拌30min,超声15min,最终得到修饰有吐温-80的负载RT的HSA纳米粒(HSA-RT NPs),其为正方体。
使用动态光散射粒径仪(带有zeta电位测试功能)对修饰有吐温-80的载药HSA纳米粒进行测定,平均粒径约为198.6nm,粒径均一稳定,zeta电位约为+17.4mV。测试结果如表1所示。
实施例3:纳米粒的结构表征
(1)紫外吸收光谱分析
分别对ACh水溶液、HSA水溶液、未装载活性成分且未修饰吐温-80的空白HSA纳米粒(制备过程参考实施例1的步骤(1)),以及实施例1的步骤(1)制备的未修饰吐温-80的HSA-ACh纳米粒进行紫外吸收光谱分析,样品的紫外吸收曲线如图6所示。HSA溶液在280nm附近有明显特征吸收峰(曲线1),而Ach溶液在280nm附近没有吸收(曲线2)。HSA形成空白纳米粒后,280nm附近的吸收峰仍明显可见(曲线3);而装载了Ach的HSA纳米粒,280nm附近的吸收峰明显降低(曲线4)。所以,当HSA纳米粒中掺杂包裹了药物分子(ACh)后,与药物分子之间相互影响,HSA自身的紫外特征吸收峰会降低或消失。结果表明,药物分子成功掺杂包裹在纳米载体之中。
(2)XRD分析
对以下样品进行XRD测试:1.未装载活性成分且未修饰吐温-80的空白HSA纳米粒(制备过程参考实施例1的步骤(1)),2.实施例1的步骤(1)制备的未修饰吐温-80的HSA-Ach纳米粒,3.吐温-80修饰的未装载活性成分的HSA纳米粒(过程参考实施例1的步骤(1)和步骤(2)),4.实施例1制备的吐温-80修饰的HSA-Ach纳米粒。各样品的XRD谱图如图7所示。
图中,经吐温-80修饰后的HSA纳米粒,在2θ=31.6°可见明显尖峰(曲线3和曲线4),而未修饰的纳米粒在此处无峰值(曲线1和曲线2)。结果证明,靶向分子吐温-80已成功修饰于纳米粒表面。
实施例4:装载多柔比星的人血清白蛋白纳米粒的制备及体外释放效果评价
本实施例采用紫外光谱法来定量测定纳米粒的释放量。由于乙酰胆碱无紫外吸收峰,而利斯的明在263nm处有明显紫外吸收峰(HSA自身的特征吸收峰在280nm附近,两者相互重合),故无法利用紫外光谱法进行精确定量分析。因此,需要选用模拟替代药物来表征纳米粒的释放效果。
本实施例选用的模拟替代药物为多柔比星,一方面,是由于多柔比星具有和乙酰胆碱和利斯的明等药物相似的溶解性(均为水溶性良好的小分子药物),另一方面,是由于多柔比星具有合适的紫外吸收峰。根据2010年版药典二部附录Ⅳ,多柔比星在233nm、252nm、288nm、480nm、495nm与530nm的波长处有较大吸收峰,其中480nm处吸收峰强度最大且杂质干扰小。因此,本实施例以装载多柔比星的人血清白蛋白纳米粒作为体外释药模型,采用紫外分光光度法,以480nm处吸收值作为定量指标,评价本申请的纳米粒的体外释药效果。
以盐酸多柔比星(Dox)代替目标药物进行纳米粒的制备,合成操作步骤与实施例1相同。
测试过程:首先,用梯度稀释法制备一系列浓度梯度的多柔比星标准液,波长480nm下测定其紫外吸收值,制备多柔比星标准曲线,如图8所示(y=0.020x-0.000,R2=0.998)。
设置多柔比星溶液组和装载有多柔比星的载药纳米粒组。按照纳米粒载药率为10%计算,多柔比星溶液组浓度为0.5mg/mL(共4mL,相当于多柔比星2mg),载药纳米粒组浓度为5mg/mL(共4mL,相当于多柔比星2mg)。两组分别固定于分子量为3000的半透膜中,并分别置于900mL的生理盐水释放体系中,200rpm转速下持续释放。每隔一定时间分别取2mL释放液,测定480nm处的紫外吸收值,并重新补充等量生理盐水。
图9显示了释放结果。多柔比星溶液组在10h左右达到累计释放率最大值,回收率达90%以上,证明多柔比星已完全释放;而多柔比星载药纳米粒组在80h内的累计释放率稳定持续上升,且在中性生理盐水溶液中的累计释放率仅为载药率的30%。由此推断,载药纳米粒在体液运输中可保持结构的稳定,保证了进入中枢的纳米粒仍能维持较高的载药率。
实施例5:纳米粒对D-半乳糖致认知障碍小鼠行为学评价
5.1实验分组与饲养
昆明小鼠,♂,按体重随机分为6组,每组各10只动物,包括空白对照组(不建模不给药)、模型组(只建模不给药)、ACh水溶液对照组(建模后给予乙酰胆碱水溶液)、HSA-ACh纳米粒组(建模后给予吐温-80修饰的装载乙酰胆碱的人血清白蛋白纳米粒)、RT溶液组对照组(建模后给予利斯的明水溶液)、HSA-RT纳米粒组(建模后给予吐温-80修饰的装载利斯的明的人血清白蛋白纳米粒)。
饲养环境为:温度为(24±2)℃;湿度为(60±10)%;每日光照/黑暗各12h;自由摄食及饮水。
5.2动物建模及给药治疗
①动物建模:除空白对照组,其他5组每天皮下注射D-半乳糖溶液100mg/kg/d,灌胃注射氯化铝溶液20mg/kg/d;正常对照组给予等量的水。建模周期为90天。
②给药治疗方案:建模60天后,ACh溶液组给予乙酰胆碱水溶液(1mg/kg),HSA-ACh纳米粒组给予吐温-80修饰的装载乙酰胆碱的纳米粒(10mg/kg,装载ACh的含量相当于1mg/kg),RT溶液组给予利斯的明水溶液(1.25mg/kg),HSA-RT纳米粒组给予吐温-80修饰的装载利斯的明纳米粒(12.5mg/kg,装载RT的含量相当于1.25mg/kg);给药周期为每周2次,连续4周。
5.3Morris水迷宫行为学评价方法
①Morris水迷宫(MWM)试验周期为5天,前4天为训练期,第5天为测试期;
②游泳池直径为1m,分为4个象限,并在4个象限中分别固定4个入水点;游泳池水深约0.6m,水温为22±2℃;
③训练期内,将直径为0.1m的黑色平台放于第3象限,且低于水面约2cm;每只小鼠每天接受四次训练,具体过程如下:首先,将小鼠面朝池壁,放入第一象限固定入水点,自由游泳1min。若1min内,小鼠找到平台位置并停留至少3s,时间立即停止,记录潜伏期、游泳速度等数据;若1min内,小鼠未能找到平台或找到平台后未能停留3s,人工辅助小鼠找到平台并停留15s,此时,记录的潜伏期为60s。一次游泳后立即擦干小鼠,待所有小鼠游泳后,依次进行2、3、4象限的训练。
④测试期内,将平台移去,固定入水点,小鼠自由游泳1min,记录小鼠第一次找到平台位置的潜伏期、穿台次数及在目标象限游泳时间等数据。
实验结果:
各组小鼠找到平台时间如图10所示。训练期内,各组小鼠在第1天时找到平台时间没有较大差异;而在第3天及第4天时,空白对照组找到平台时间为20s,模型组、ACh溶液组及RT溶液组找到平台时间明显长于空白对照组,而HSA-ACh纳米粒组及HSA-RT纳米粒组找到平台时间与空白对照组相比无明显差异,且明显低于模型组。实验证明,在分别给予HSA-ACh纳米粒及HSA-RT纳米粒后,小鼠的短期空间学习能力得到改善。
测试期内,小鼠找到原平台位置的时间进一步缩短,但各组之间已存在明显统计学差异,如图11所示,空白对照组小鼠的潜伏期最短,方差分析结果显示,模型组、ACh溶液组及RT溶液组潜伏期明显长于空白对照组(P<0.05),而HSA-ACh纳米粒组及HSA-RT纳米粒组与空白对照组无明显统计学差异。
穿台次数及目标象限游泳时间是判断小鼠长期空间记忆能力的另外两个指标。穿台次数是实验动物在60s内穿越原平台区域次数,动物穿台次数越多,说明其空间学习记忆能力越好。如图12所示,空白对照组小鼠穿台次数明显多于模型组、ACh溶液组及RT溶液组(P<0.01),而与HSA-ACh纳米粒组及HSA-RT纳米粒组无明显统计学差异。
目标象限游泳时间是实验动物在原平台及周边区域活动的时间之和,时间越长,说明其空间学习记忆能力越好,如图13所示,模型组及ACh溶液组与空白对照组相比具有明显统计学差异(P<0.05),而其他组与空白对照组无明显统计学差异。
以上MWM实验数据证明:模型组小鼠学习记忆能力明显低于正常组小鼠,D-半乳糖致认知障碍小鼠模型建模成功;给予乙酰胆碱水溶液或利斯的明水溶液后,认知障碍没有得到改善;而给予HSA-ACh纳米粒或HSA-RT纳米粒后,小鼠的短期学习能力及长期空间记忆能力均得到显著改善,证明HSA-ACh纳米粒及HSA-RT纳米粒达到了缓解认知障碍并长效释放的目的。
实施例6:纳米粒对D-半乳糖致认知障碍小鼠脑生化指标的影响
6.1样品前处理
①准确称量实施例5的6组小鼠的体重并记录;
②拔眼球取血,收集于5mL肝素钠抗凝采血管中,置于冰浴中保存;
③断头取脑,去除脑干后,精确称量脑重并记录;在冰盒上切开左右半脑,左半脑浸泡于4%中性甲醛溶液中;右半脑以滤纸压碎去除血液及微血管,加入20倍重量的胆碱酯酶提取液匀浆;胆碱酯酶提取液在4℃,5000rpm下离心10min,收集上清,置于4℃保存。
6.2脑乙酰胆碱酯酶(AChE)活力的测定
①准确吸取10μL脑上清液稀释于0.5mL PBS中,反复冲洗枪头后涡旋混匀;
②加板,每个样品设置4个复孔,每孔加入20μL样品,前两个复孔加入80μL PBS,后两个复孔加入50μL PBS和30μL碘化硫代乙酰胆碱(ATCH);
③离心1min除去气泡,置于37℃恒温水浴箱中孵育30min;
④取出后,每孔加入20μL 5,5’-二硫代双(2-硝基苯甲酸)(DTNB),震荡30s,412nm下测量吸收值。
6.3脑乙酰胆碱转移酶(ChAT)活力的测定
①ChAT的测定采用试剂盒进行(南京建成,货号:A079-1),依次加入试剂1至试剂6,混匀,37℃水浴预温5min;
②测定管内加入25μl组织匀浆上清液,与之对应的对照管加入等量煮沸的匀浆上清液,混匀,37℃水浴20min,100℃沸水水浴2min终止反应;
③每管反应体系中加入425μl蒸馏水,混匀,4000rpm离心10min后取上清500μL,加入10μL试剂7显色剂,混匀后,静置15min,在324nm处,1cm光径,2mm内径的石英比色皿,蒸馏水调零,测定各管的吸光度值。
6.4乙酰胆碱(ACh)含量的测定
①ACh含量的测定采用碱性羟胺比色法,样品首先加入胆碱酯酶抑制剂,阻止胆碱酯酶对乙酰胆碱的分解作用,之后立刻加入三氯乙酸沉淀蛋白;
②测定管及标准管中分别加入样品上清及ACh标准溶液,加入碱性羟胺溶液后37℃恒温水浴30min,加入盐酸终止反应,最后加入三氯化铁显示;对照管及空白管中分别加入样品上清及水,37℃恒温水浴30min,加入盐酸及三氯化铁,最后加入碱性羟胺;
③加板,每孔加入200μL,在540nm处测定其吸光度值。
6.5丙二醛(MDA)含量的测定
①MDA的测定采用试剂盒进行(南京建成,货号A003-1),测定管加入0.1mL匀浆上清液,空白管加入等量无水乙醇,标准管加入等量10nmol/mL标准品,依次加入0.1mL试剂1,3mL试剂2应用液,1mL试剂3应用液,涡旋混匀;
②试管口用保鲜膜扎紧,用针头刺一小孔,95℃水浴40min,取出后流水冷却,4000rpm离心10min,取上清532nm处,1cm光径,双蒸水调零,测定各管吸光度值。
6.6总超氧化物歧化酶(T-SOD)活力的测定
①T-SOD的测定采用试剂盒进行(南京建成,货号A001-1),依次加入试剂1至试剂4及样品,涡旋混匀,置于37℃恒温水浴40min;
②加入显色剂,混匀,室温放置10min,于波长550nm处,1cm光径比色杯,双蒸水调零,测定各管吸光度值。
6.7脑组织病理学检测
4%中性甲醛液固定的左半脑经过洗涤、脱水、浸蜡、包埋、切片与粘片、脱蜡、苏木精-伊红染色、脱水、透明、封片等步骤,最终获得细胞核蓝染、胞质红染的脑组织切片。
实验结果:
胆碱能系统相关酶活及脑内氧化应激水平是评价认知能力的重要脑生化指标。各指标的测定结果如表2所示。
表2
*p<0.05,**p<0.01,***p<0.001,与空白对照组比较。
#p<0.05,##p<0.01,###p<0.001,与模型组比较;n=8。
由表2可知,在正常脑组织中,ChAT、ACh及AChE的活力与含量维持在相对稳定的水平;模型组中,ChAT活力显著升高(p<0.05),而HSA-ACh纳米粒组、HSA-RT纳米粒组及RT溶液组仍维持在正常值水平,证明本发明的纳米粒有效维持了脑胆碱能系统中ChAT、ACh及AChE的活力与含量的相对平衡。从氧化应激实验结果可知,与空白对照组比较,模型组及ACh溶液组MDA的含量明显升高(p<0.001),而HSA-ACh纳米粒组、HSA-RT纳米粒组及RT溶液组仍维持在正常值水平,证明本发明的纳米粒可有效降低脑内氧化应激水平,保护神经元。
图14显示了脑组织病理学检测结果。正常海马CA2区及额颞叶皮层神经元细胞呈圆形或椭圆形,核浆比值大,细胞核核膜明显,呈圆形或椭圆形,着色均匀为浅蓝紫色(图14A、图14B);而模型组及ACh溶液组小鼠海马神经元排列疏松,海马及皮层区可见较多的神经元胞体缩小,胞浆浓缩,核固缩,整个细胞深染成紫红色(图14C、图14D、图14E、图14F);在给予HSA-ACh纳米粒、HSA-RT纳米粒或RT溶液后,上述现象明显改善,额颞叶皮层神经元核固缩显著减少(图14G、图14H、图14I、图14J、图14K、图14L)。实验证明,本发明的纳米粒对神经元细胞的保护作用显著。
实施例7:纳米粒的中枢靶向性及穿透血脑屏障研究
将异硫氰酸荧光素(FITC)修饰到人血清白蛋白上,按照实施例1和2的方法,制备吐温-80修饰的负载乙酰胆碱的纳米粒,以及吐温-80修饰的负载利斯的明的纳米粒,从而得到带有FITC的纳米粒。将各组带有FITC的纳米粒稀释至0.1mg/mL后,取10nL心脏注射于斑马鱼体内,选择注射成功且存活的斑马鱼,固定于凝胶中,利用激光共聚焦显微镜观察斑马鱼体内荧光的分布。
图15A-15C分别为心脏注射生理盐水组(对照组)、乙酰胆碱纳米粒组和利斯的明纳米粒组的激光共聚焦显微镜照片。FITC是一种水溶性荧光染料,其通过化学键牢固的键合在了纳米粒内,因为是化学键结合,该荧光素不能自由的从纳米粒上脱离为自由小分子进入体系中,因此在显微镜下观察到的荧光均来自纳米粒,体系内不存在游离的FITC小分子。从图中可以明显观察到,正常斑马鱼体内无荧光分布(图15A);对于乙酰胆碱纳米粒组和利斯的明纳米粒组,虽经过心脏注射,但在斑马鱼的脑部出现了明显的绿色荧光,因此证明药物可顺利通过血脑屏障进入中枢。
以上实施例多角度全面评价了本申请的纳米粒对小鼠认知能力的改善效果,既在整体水平上观测小鼠行为学的变化,又进行了脑生化指标的测定及病理学检测。综合以上实验结果可以得出:本申请的纳米粒可以将原本不能进入中枢的乙酰胆碱输运至中枢后缓慢释放,以实现长期低剂量补充外源性神经递质的目的;将原本易迅速分解的利斯的明输运至中枢后缓慢释放,实现长效给药的目的。
尽管本发明的具体实施方式已经得到详细的描述,但本领域技术人员将理解:根据已经公开的所有教导,可以对细节进行各种修改和变动,并且这些改变均在本发明的保护范围之内。本发明的全部范围由所附权利要求及其任何等同物给出。
- 还没有人留言评论。精彩留言会获得点赞!