一种抗非小细胞肺癌的药物组合物及其应用的制作方法
本发明属于医药应用领域,特别是涉及一种抗非小细胞肺癌的药物组合物及其应用。
背景技术:
目前全球各国肺癌的发病率和死亡率均呈逐年上升趋势,据世界卫生组织WHO统计,肺癌的发病率已居恶性肿瘤之首,严重威胁着人类的健康。肺癌按病理分型可分为小细胞肺癌(small cell lung cancer,SCLC)和非小细胞肺癌(non-small cell lung cancer,NSCLC),其中NSCLC约占肺癌的80%-90%。在很长一段时间里,晚期NSCLC患者只能接受“含铂类药物的化疗”,与支持治疗相比,虽然一定程度上增加了患者总生存期,但它的上限也仅限于20%的反应率和8-10个月的中位生存期。近年来,随着分子遗传学研究的不断进展,NSCLC被细分为各种不同的分子亚型,占据NSCLC总数50%以上的肺腺癌可以根据相关驱动基因突变进一步细分成更多的亚群,这些驱动基因包括EGFR,KRAS,HER2,PIK3CA,BRAF,MET基因突变和ALK,ROS1和RET基因重排,并由此诞生了各类分子靶向治疗药物。分子靶向治疗药物以其靶向性、安全性等优点在NSCLC治疗上取得了显著的疗效,有益于个体化治疗。
在肺癌靶向治疗的探索中,EGFR突变驱动基因的发现及相应靶向治疗药物表皮生长因子受体酪氨酸激酶抑制剂(简称EGFR-TKI)的问世,是晚期NSCLC治疗历史上的一个里程碑事件。EGFR突变是最常见的驱动基因之一,尤其在亚裔人群的不吸烟腺癌患者中EGFR突变比例高达60%左右。EGFR突变的晚期NSCLC一线EGFR-TKI治疗,与传统的含铂双药化疗方案相比,可明显改善患者的客观缓解率(ORR)和无进展生存期(PFS),更重要的是将具有EGFR突变的晚期NSCLC的中位生存期延长至20-30个月,所以EGFR-TKI是这部分患者最重要的治疗药物。然而与化疗药物相似,EGFR-TKI治疗也存在耐药问题。临床上EGFR突变晚期NSCLC在EGFR-TKI一线治疗9-13个月后,通常会因TKI获得性耐药而出现疾病进展。TKI耐药进展后的治疗是临床实践中医生非常关注的问题,但目前还缺乏标准统一的治疗方案。
青蒿属菊科又名黄花蒿(Artemisia anaua L)是一年生草本植物。青蒿素是我国药学工作者于20世纪70年代初从中药青蒿中提取的倍半萜内酯类抗疟药物,并在此结构基础上又相继合成、半合成出一系列具有抗疟活性的衍生物,如双氢青蒿素、青蒿琥酯、蒿甲醚、蒿乙醚。青蒿素及其衍生物的抗疟活性已得到世界公认,具有起效快、药效高、毒副作用低等优点。除广泛应用于抗疟治疗外,青蒿素类药物还具有其它多种药理作用,如抗血吸虫作用,抗心律失常、平喘,抗内毒素,抗变态反应、红斑狼疮、免疫抑制等作用。随着对青蒿素及其衍生物活性研究的不断深入,揭示了该类化合物还具有一定的抗肿瘤作用,对多种肿瘤细胞的生长具有抑制作用。青蒿素及其衍生物的抗肿瘤作用机制主要有细胞毒性、阻滞或延缓肿瘤细胞的生长周期、诱导细胞凋亡、抵抗血管生成、抑制肿瘤的侵袭与转移等。
迄今为止,未见有关联合青蒿素类衍生物和EGFR-TKI的药物组合物应用于抗肺癌治疗的报道。
技术实现要素:
本发明所要解决的技术问题是针对表皮生长因子受体酪氨酸激酶抑制剂(EGFR-TKI)的耐药缺陷,提供一种具有良好协同效果的抗非小细胞肺癌的药物组合物。
本发明所述的抗非小细胞肺癌的药物组合物,其活性成分包括青蒿素类衍生物和表皮生长因子受体酪氨酸激酶抑制剂(EGFR-TKI)。
其中,所述青蒿素类衍生物可以为双氢青蒿素(DHA)、青蒿琥酯(Artesunate)、蒿甲醚(Artemether)、蒿乙醚(Artemotil),或其可药用的盐、水合物或衍生物等;表皮生长因子受体酪氨酸激酶抑制剂(EGFR-TKI)可以为吉非替尼(Gef)、厄洛替尼(Erl)、阿法替尼(Afa)、奥希替尼(Osi),或相应的结构类似物、衍生物。
优选的,所述青蒿素类衍生物选自双氢青蒿素(DHA)、青蒿琥酯(Artesunate)、蒿甲醚(Artemether)和蒿乙醚(Artemotil)中的一种。
其相应的结构式分别如下所示:
优选的,所述表皮生长因子受体酪氨酸激酶抑制剂(EGFR-TKI)选自吉非替尼(Gef)、厄洛替尼(Erl)、阿法替尼(Afa)和奥希替尼(Osi)中的一种。
EGFR-TKI耐药包括原发性耐药和继发性耐药。原发性耐药是指首次使用EGFR-TKI治疗未见获益,占7%-13%。获得性耐药是指接受EGFR-TKI治疗后出现疗效(肿瘤缓解、进展延迟、症状改善等)而后又出现疾病进展,获得性耐药的机制主要涉及以下方面:EGFR二次突变(如T790M突变的出现),EGFR下游信号分子活化(如PI3K/AKT、PTEN、ERK/MAPK等),旁路激活(如c-MET扩增、Her-2扩增)和表型转化(如NSCLC转化为SCLC)等。其中,T790M突变和c-MET扩增占EGFR-TKI获得性耐药的50%以上,另外近一半的机制仍未完全明确。
本发明过程中发现,在含EGFR突变的多种NSCLC肿瘤细胞株上予以EGFR-TKI干预后,可见显著的STAT3活化,且该活化并非瞬时,而是逐渐加强,提示STAT3的活化是一种反馈机制。而选用青蒿素类衍生物能够有效抑制非小细胞肺癌细胞内STAT3的磷酸化水平,同时,所用的青蒿素衍生物并不影响EGFR-TKI抑制EGFR磷酸化的效果,能够达到显著的促进非小细胞肺癌细胞死亡效果。因此本发明的抗非小细胞肺癌的药物组合物联合使用青蒿素类衍生物作为STAT3信号通路抑制剂堵住STAT3反馈激活通路,由此对付EGFR-TKI耐药,起到增敏EGFR-TKI的治疗疗效。
本发明试验所用的非小细胞肺癌细胞为PC-9和H1975,均由西班牙肺癌协会主席Rafael Rosell教授馈赠。
上述抗非小细胞肺癌的药物组合物在制备治疗抗非小细胞肺癌药物中的应用也在本发明的保护范围内。
所述应用是指所述药物组合物在不影响EGFR-TKI抑制EGFR磷酸化的情况下,能够有效抑制非小细胞肺癌细胞内STAT3的磷酸化水平,达到优于EGFR-TKI单独使用的药效。
有益效果:本发明提供了青蒿素类衍生物的制药新用途,即作为非小细胞肺癌治疗增敏剂,与EGFR-TKI联用增加其抗肺癌作用。所述联用的药物组合物在不影响EGFR-TKI抑制EGFR磷酸化的情况下,能够有效抑制非小细胞肺癌细胞内STAT3的磷酸化水平,达到优于EGFR-TKI单独使用的药效,解决了非小细胞肺癌EGFR-TKI的部分耐药问题,为研制新的药物提供了科学依据。
附图说明
图1是双氢青蒿素、青蒿琥酯、蒿甲醚和蒿乙醚均呈浓度依赖性抑制PC-9细胞内STAT3的磷酸化;
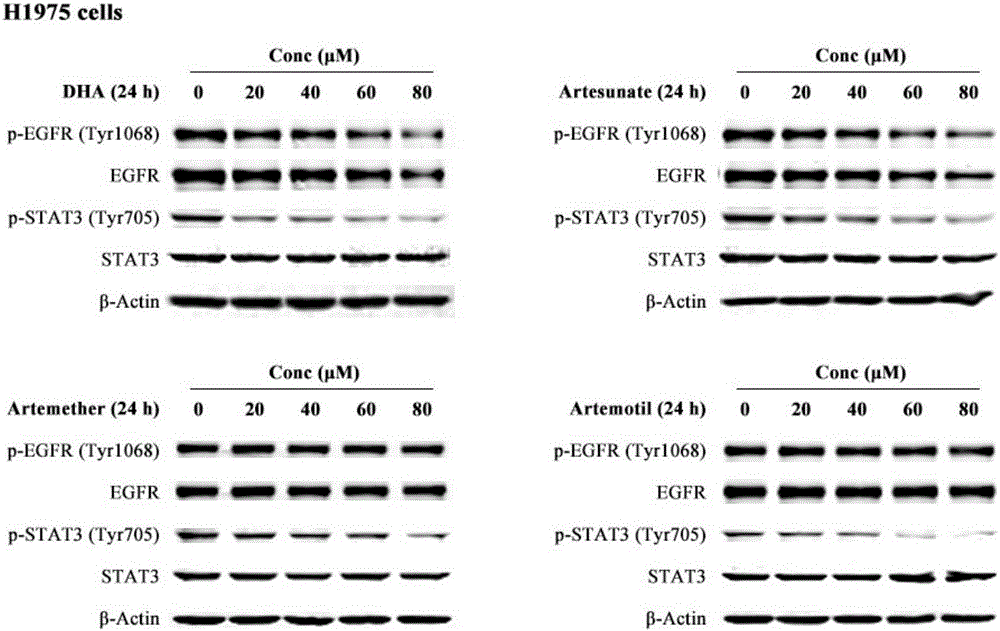
图2是双氢青蒿素、青蒿琥酯、蒿甲醚和蒿乙醚均呈浓度依赖性抑制H1975细胞内STAT3的磷酸化;
图3是在PC-9细胞中,双氢青蒿素抑制EGFR-TKI诱导激活的STAT3磷酸化;
图4是在H1975细胞中,双氢青蒿素抑制EGFR-TKI诱导激活的STAT3磷酸化;
图5是青蒿素衍生物和EGFR-TKI单独或联合作用对PC-9细胞存活率的影响。
具体实施方式
结合以下实施例对本发明作进一步的阐述。
实验材料:
细胞株:非小细胞肺癌细胞株PC-9,H1975均由西班牙肺癌协会主席Rafael Rosell教授馈赠。
实验试剂:细胞培养所用的培养基、胰酶、青链霉素及胎牛血清(FBS)均购买自Life公司。二甲基亚砜(DMSO)、噻唑蓝(MTT)均购自Sigma公司。所有一抗均购自Cell Signaling Technology公司,红外荧光二抗DyLight 680标记羊抗鼠和DyLight 800标记羊抗兔购自KPL公司。
双氢青蒿素(DHA)、青蒿琥酯(Artesunate)购自Sigma公司,蒿甲醚(Artemether)、蒿乙醚(Artemotil)购自MedChemExpress公司。吉非替尼(Gef)、厄洛替尼(Erl)、阿法替尼(Afa)、奥希替尼(Osi)购自Selleck公司。
青蒿素衍生物和EGFR-TKI均用DMSO配制成20mmol/L的储存液,用于后续所有的实施例。
实验耗材:所有细胞培养用培养皿,培养板,离心管均购自Corning公司。
实施例1:青蒿素衍生物抑制STAT3磷酸化
取PC-9、H1975细胞用含10%FBS,100U/mL青霉素和100μg/mL链霉素的RPMI 1640培养基,在37℃,5%CO2的培养箱中维持培养。待细胞长至对数生长期,用0.25%胰酶-EDTA溶液消化制备单细胞悬液,以4×105个细胞/孔的细胞密度接种六孔板,培养24h后,加入不同浓度的青蒿素衍生物,在IC50值左右共选取4个浓度,具体为:20μM,40μM,60μM,80μM,DMSO作为溶剂对照组。药物干预24h后,去掉上清,PBS洗两次,加入含蛋白酶、磷酸酶抑制剂的RIPA裂解液,冰上裂解30min。细胞刮刀收集细胞裂解物,4℃,12000r/min离心10min。取上清,用NanoDrop 1000测定蛋白浓度后将各个样品浓度调至一致。蛋白免疫印迹法检测EGFR、p-EGFR(Tyr1068)、Stat3、p-Stat3(Tyr705)、和β-Actin的表达水平。用LI-COR Odyssey双色红外激光成像系统摄像。
结果显示如图1和图2,由图可见,上述四种青蒿素衍生物均能抑制非小细胞肺癌PC-9和H1975细胞内STAT3的磷酸化水平。
实施例2:青蒿素衍生物可抑制EGFR-TKI诱导的STAT3磷酸化
取PC-9、H1975细胞用含10%FBS,100U/mL青霉素和100ug/mL链霉素的RPMI 1640培养基,在37℃,5%CO2的培养箱中维持培养。待细胞长至对数生长期,用0.25%胰酶-EDTA溶液消化制备单细胞悬液,以4×105个细胞/孔的细胞密度接种六孔板,培养24h后,加入各化合物的IC50值浓度,具体为:DHA(40μM)、EGFR-TKI(对于PC-9细胞,Gef浓度为0.1μM,Erl浓度为0.1μM,Afa浓度为0.0038μM,Osi浓度为0.04μM;对于H1975细胞,Gef浓度为8μM,Erl浓度为8μM,Afa浓度为0.3μM,Osi浓度为0.04μM)或两者联合,DMSO作为溶剂对照组。药物干预24h后,去掉上清,PBS洗两次,加入含蛋白酶、磷酸酶抑制剂的RIPA裂解液,冰上裂解30min。细胞刮刀收集细胞裂解物,4℃,12000r/min离心10min。取上清,用NanoDrop 1000测定蛋白浓度后将各个样品浓度调至一致。蛋白免疫印迹法检测EGFR、p-EGFR(Tyr1068)、Stat3、p-Stat3(Tyr705)、和β-Actin的表达水平。用LI-COR Odyssey双色红外激光成像系统摄像。
结果显示如图3和图4,由图可见,EGFR-TKI在抑制EGFR磷酸化的同时激活了STAT3,但诱导激活的STAT3可被联合使用的青蒿素衍生物抑制。同时,青蒿素衍生物并不影响EGFR-TKI抑制EGFR磷酸化的效果。
实施例3:青蒿素衍生物与EGFR-TKI协同促进非小细胞肺癌细胞死亡
取PC-9细胞用含10%FBS,100U/mL青霉素和100ug/mL链霉素的RPMI1640培养基,在37℃,5%CO2的培养箱中维持培养。待细胞长至对数生长期,用0.25%胰酶-EDTA溶液消化制备单细胞悬液,以每孔100μL体积,2×103个细胞的细胞浓度接种于96孔板中。培养24h后,分别用不同浓度的青蒿素衍生物(双氢青蒿素浓度梯度如下:5、10、20、25、30、35、40、60、80μM;蒿甲醚浓度梯度如下:12.5、25、50、62.5、70、87.5、100、150、200μM;蒿乙醚浓度梯度如下:12.5、25、50、62.5、70、87.5、100、150、200μM)和不同浓度的EGFR-TKI(吉非替尼浓度梯度如下:0.0125、0.025、0.05、0.0625、0.075、0.0875、0.1、0.15、0.2μM;阿法替尼浓度梯度如下:0.000475、0.00095、0.0019、0.002379、0.00285、0.003325、0.0038、0.0057、0.0076μM;奥希替尼浓度梯度如下:0.02、0.04、0.08、0.1、0.12、0.14、0.16、0.24、0.32μM)以单独或联合形式干预细胞,以DMSO作为溶剂对照组。培养3d后,加入10μL MTT(5mg/mL)继续孵育4h,吸掉上清,加入100μL DMSO振荡10min。用全波长酶标仪(Thermo Multiskan Spectrum)在测定波长570nm和参比波长630nm处检测吸光值。根据公式:抑制率=(1-(A570nm-A630nm)treated/(A570nm-A630nm)control)×100%计算抑制率。
结果显示如图5,由图可见,在抑制PC-9细胞生长方面,青蒿素衍生物和EGFR-TKI的组合明显优于单独给药,表1列举了上述浓度内不同青蒿素衍生物和不同EGFR-TKI的最佳浓度比例。例如,由表1可见阿法替尼(Afa)在0.0019μM时抑制率为6.4%,双氢青蒿素(DHA)在20μM时抑制率为5.8%,而两者按此浓度联合给药时抑制率为33.8%,产生显著的协同作用。
表1
同时,根据公式:存活率=(A570nm-A630nm)treated/(A570nm-A630nm)control×100%计算存活率。应用CalcuSyn软件计算联合用药指数(Combination Index,CI),根据Chou-Talalay定义,CI<1定义两药为协同效应,CI=1定义两药为叠加效应,CI>1定义两药为拮抗效应。测定结果见表2,由此可见,本发明的药物组合物在上述浓度内均具有协同效应。
表2
- 还没有人留言评论。精彩留言会获得点赞!