用于维生素D缺乏症和相关障碍的方法、组合物、用途和试剂盒与流程
本申请是申请日为2009年4月2日、国家申请号为200980120404.1、发明名称为“用于维生素D缺乏症和相关障碍的方法、组合物、用途和试剂盒”的发明专利申请的分案申请。
相关申请的交叉引用
本申请根据美国35USC§119(e)要求于2008年4月2日递交的美国临时专利申请第61/041,898号和2009年3月18日递交的美国临时专利申请第61/161,292号的权益,它们全部内容通过引用并入本文。
技术领域
本公开大体上涉及用于诊断和治疗疾病和障碍的方法,以及其所用的相关组合物和试剂盒。更具体地,本公开涉及用于诊断和治疗分解代谢相关的维生素D缺乏症和其易感性的方法、相关的组合物和试剂盒,和用于预防和治疗相关障碍的方法。
背景技术:
人类从饮食来源和7-去羟基胆固醇向维生素D3的UV光依赖性转化中获得维生素D。维生素D3(或胆钙化甾醇)和维生素D2(或麦角钙化甾醇)统称为“维生素D”,它们是活性维生素D激素的脂溶性前体。维生素D3和维生素D2的代谢主要发生在肝中,以分别产生25-羟基维生素D3和25-羟基维生素D2(文中统称为“25-羟基维生素D”),它们为各自活性维生素D激素的激素原。这些维生素D激素原的进一步代谢活化主要通过细胞色素P450酶(CYP27B)发生在肾中。CYP27B也在表达在许多肾外维生素D靶组织中,且可实现25-羟基维生素D的局部活化,以产生自分泌和/或旁分泌激素响应。具体地,25-羟基维生素D3代谢为活性激素1,25-二羟基维生素D3(或骨化三醇),且25-羟基维生素D2代谢为活性激素1,25-二羟基维生素D2(文中统称为“1,25-二羟基维生素D”)。
维生素D激素经由与维生素D受体(VDR)的相互作用调节多种细胞过程。特别地,维生素D激素通过小肠控制膳食钙的吸收和通过肾控制钙的再吸收来调节血液钙水平。过量的激素水平可导致尿钙(高钙尿症)、血液钙(高钙血症)和血液磷(高磷血症)的异常升高。另一方面,维生素D缺乏症与继发性甲状旁腺功能亢进症、甲状旁腺增生、低钙血症、慢性肾病(CKD)和代谢性骨病如囊性纤维性骨炎、骨软化、软骨病、骨质疏松和骨骼外钙化有关。已报导维生素D激素对甲状旁腺激素系统具有许多与其“经典”作用不同的“非经典”生物学作用。已报导此类作用与细胞增殖、包括肾素-血管紧张素系统的免疫系统和心血管系统、血压、细胞生长和分化、抗纤维化、血红细胞形成、毛发生长和肌肉功能有关。
维生素D激素原、激素和类似物的分解代谢通过细胞色素P450酶的作用来完成。细胞色素P450酶CYP24催化各种维生素D化合物分解代谢中的第一步。特别地,例如CYP24进行25-羟基维生素D3向24,25-二羟基维生素D3的转化和1,25-二羟基维生素D3(骨化三醇)向1,24,25-三羟基维生素D3的转化,最终产生维生素D3-23羧酸(calcitroic acid)。CYP24也可23位羟基化,导致最终代谢产物1,25-二羟基维生素D3-26,23-内酯的生成。由Ⅱ相分解代谢酶的进一步加工最终将维生素D化合物从身体中清除。
技术实现要素:
本公开一方面为诊断患者中分解代谢相关的维生素D缺乏症的易感性的方法,包括如通过从患者中获取组织、血液或细胞样本和分析所述样本的CYP24表达和/或活性或其指标,来测定患者的CYP24表达和/或活性水平或其指标水平,其中CYP24表达和/或活性的异常升高预示分解代谢相关的维生素D缺乏症的易感性。在一个实施方式中,所述患者的维生素D充足,且所述方法进一步包括通过针对异常升高的CYP24表达和/或活性,对患者施用CYP24抑制剂来抑制和/或预防维生素D缺乏症。在另一个实施方式中,所述患者缺乏维生素D,且所述方法进一步包括通过针对异常升高的CYP24表达和/或活性,对患者施用CYP24抑制剂来治疗维生素D缺乏症。
本公开另一方面为诊断患者中分解代谢相关的维生素D缺乏症的易感性的方法,包括如通过从患者中获取组织、血液或细胞样本和分析所述样本的FGF23浓度来测定患者的FGF23水平,其中FGF23浓度的异常升高预示分解代谢相关的维生素D缺乏症的易感性。所述方法可进一步包括本文所述治疗或预防方法的任意一种。
本公开另一方面为诊断和治疗患者的方法,包括测定患者的CYP24表达和/或活性,或CYP24表达和/或活性的指标,和对响应CYP24表达和/或活性异常升高的患者施用CYP24抑制剂。所述方法可进一步包括从所述患者中获取组织、血液或细胞样本,和分析所述样本的CYP24表达和/或活性或其指标。
优选地,在测定CYP24表达和/或活性或其指标时,所述患者未在接受活性维生素D治疗。
优选地,所述患者未患有癌症。
所述方法可进一步包括测定所述患者的25-羟基维生素D水平,和通过对维生素D缺乏患者施用所述CYP24抑制剂来治疗维生素D缺乏症。
所述方法可进一步包括对所述患者施用维生素D前激素、激素原和前述任一种的类似物中的一种或多种,优选选自胆钙化甾醇、麦角钙化甾醇、25-羟基维生素D2、25-羟基维生素D3和它们的组合的化合物。例如,所述治疗可包括施用25-羟基维生素D3。优选地,所述治疗包括施用治疗有效量的25-羟基维生素D3,以将所述患者的25-羟基维生素D水平恢复到至少30ng/mL。
所述方法可进一步包括测定所述患者的25-羟基维生素D水平,和通过对维生素D充足的患者施用所述CYP24抑制剂来抑制和/或预防维生素D缺乏症。
在一种类型的实施方式中,所述患者具有如选自1期和2期,或选自3期和4期的慢性肾病。
在一种类型的实施方式中,所述患者具有甲状旁腺功能亢进。例如,所述患者的PTH水平高于患者CKD期的目标范围。
在一种类型的实施方式中,所述患者缺乏1,25-二羟基维生素D3。
所述方法可进一步包括避免活性维生素D治疗,或者,如果所述患者正在接受活性维生素D治疗,则降低活性维生素D治疗的水平,或停止活性维生素D治疗。
所述方法可进一步包括对所述患者施用足以增加1,25-二羟基维生素D水平的量的25-羟基维生素D。
在一个实施方式中,所述CYP24抑制剂也是维生素D受体激动剂。
所述方法可包括测定所述患者中作为CYP24表达和/或活性水平指标的FGF23的水平,其中FGF23水平大于正常范围上限预示异常升高的CYP24表达。例如,FGF23水平为正常范围上限的至少2倍、至少4倍、至少10倍或至少40倍预示异常升高的CYP24表达。
所述方法可包括测定血清或其它体液中CYP24的一种或多种分解代谢副产物的浓度,以作为CYP24活性指标。
所述方法可进一步包括测定血清或其它体液中CYP24的一种或多种分解代谢副产物的一种或多种前体的浓度,并计算CYP24的一种或多种分解代谢副产物浓度与一种或多种对应前体的血清浓度的比例,以作为CYP24活性指标。
在一个实施方式中,CYP24的分解代谢副产物包括24,25-二羟基维生素D和/或1,24,25-三羟基维生素D。
在一个实施方式中,CYP24活性测定包括测定选自由24,25-二羟基维生素D与25-羟基维生素D的比例和1,24,25-三羟基维生素D与1,25-二羟基维生素D的比例组成的组中的一个或多个比例。
在一个实施方式中,CYP24的分解代谢副产物包括选自由帕立骨化醇、度骨化醇、22-奥沙骨化三醇、二氢速甾醇和26,26,26,27,27,27-六氟骨化三醇(氟骨三醇)组成的组中的一种或多种成员的24-羟基化和/或23-羟基化分解代谢副产物。
在一个实施方式中,CYP24表达和/或活性或其指标的测定在短期或长期施用CYP24底物之后。在此实施方式中,如下所述,优选该CYP24底物不为双重作用抑制剂和VDR激动剂。
在一个实施方式中,一种或多种测定包括血清浓度。
在一个实施方式中,CYP24表达的测定包括测定组织、血浆或细胞中的CYP24mRNA。
在一个实施方式中,CYP24表达的测定包括测定组织、血浆或细胞中的CYP24蛋白质。
在一个实施方式中,CYP24活性的测定包括测定组织、血浆或细胞中的CYP24的酶活性。
在一个实施方式中,所述组织或细胞选自由肾组织、肝组织、甲状旁腺组织、外周血单核细胞和口部细胞组成的组中。
在一个实施方式中,异常升高的CYP24表达和/或活性是正常CYP24表达和/或活性的至少2倍、至少3倍、至少4倍、至少10倍或至少100倍。
本公开另一方面包括试剂盒,所述试剂盒包括用于测定一种或多种CYP24分解代谢副产物水平的试剂,和实施本文所述方法的说明书。所述试剂盒可进一步包括用于测定一种或多种对应前体水平的试剂。
本公开另一方面包括试剂盒,所述试剂盒包括用于测定CYP24蛋白质水平的试剂,和实施本文所述方法的说明书。所述试剂可包括固定的抗CYP24抗体和标记的抗CYP24抗体。
本公开另一方面包括用于治疗或预防维生素D缺乏症的药物制剂,所述药物制剂包括有效量的CYP24抑制剂。所述制剂可进一步包括有效量的25-羟基维生素D3。
本公开另一方面包括用于治疗或预防甲状旁腺功能亢进的药物制剂,所述药物制剂包括有效量的CYP24抑制剂。所述制剂可进一步包括有效量的25-羟基维生素D3。所述药物制剂可用于治疗慢性肾病如3期或4期CKD继发的甲状旁腺功能亢进。
本公开另一方面包括用于治疗或预防维生素D缺乏症的CYP24抑制剂。
本公开另一方面包括用于治疗或预防甲状旁腺功能亢进,如慢性肾病如3期或4期CKD继发的甲状旁腺功能亢进的CYP24抑制剂。
本公开另一方面包括CYP24抑制剂在制备用于治疗或预防维生素D缺乏症的药物中的应用。
本公开另一方面包括CYP24抑制剂在制备用于治疗或预防甲状旁腺功能亢进,如慢性肾病如3期或4期CKD继发的甲状旁腺功能亢进的药物中的应用。
对于本文所述的组合物、方法、应用和试剂盒,优选特征如组分、其组成范围、替代物、病症(如患病群体的特征)和方法步骤可选自本文提供的各种实施例。
从以下详细说明并结合附图,本领域普通技术人员将明白其它方面和优点。尽管本发明方法可有各种形式的实施方式,但是以下说明包括具体实施方式,应理解本公开是说明性的,且并非意在将本发明限制为本文所述的具体实施方式。
附图说明
为了进一步帮助理解本发明,附上九个附图。
图1显示了在用富含腺嘌呤的食物或对照食物喂养的大鼠中,血清甲状旁腺激素(PTH)水平在随时间变化的图。
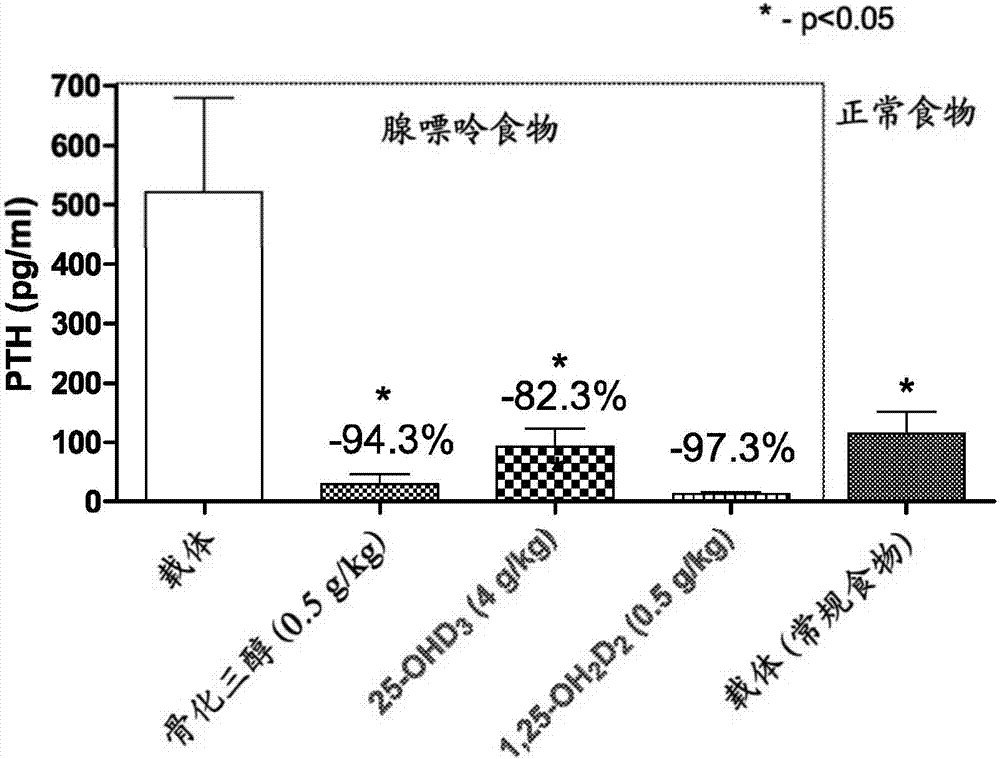
图2显示了在用三种不同维生素D化合物处理1周的喂腺嘌呤的大鼠中,血清甲状旁腺激素(PTH)水平的图。
图3显示了在喂腺嘌呤的食物和用对照食物喂养的大鼠中,以及在用三种不同维生素D化合物处理的用腺嘌呤喂养的动物中,1,25-(OH)2-D3(骨化三醇)水平的图。
图4显示了来自用腺嘌呤喂养和用对照食物喂养的大鼠、以及来自用三种不同维生素D化合物处理的用腺嘌呤喂养的动物的肾组织中CYP24表达的图。RFI表示相对诱导倍数(relative fold induction)。
图5显示了来自用腺嘌呤喂养和用对照食物喂养的大鼠、以及来自用三种不同维生素D化合物处理的用腺嘌呤喂养的动物的甲状旁腺组织中CYP24表达的图。
图6显示了在用腺嘌呤喂养和用对照食物喂养的大鼠中,以及在用三种不同维生素D化合物处理的用腺嘌呤喂养的动物中,血清FGF23水平的图。
图7显示了来自用腺嘌呤喂养和用对照食物喂养的大鼠的肾组织中FGF23水平和骨钙蛋白水平的图。
图8显示了在用维生素D(25-羟基维生素D2和25-羟基维生素D3)处理2周的大鼠中,相对CYP24诱导的图。
图9显示了在响应于安慰剂和(5Z,7E,16Z,23E)-(1S,3R)-25-降-25-叔丁基磺酰基-9,10-断(seco)-5,7,10(19),16,23-胆甾五烯(cholestapentaene)-1,3-二醇给药的人中,25-OH-D水平的变化。
图10显示了在正常和腺嘌呤诱导的尿毒症大鼠的肾组织中相对CYP24诱导的图,此图显示了CYP24的基础表达(载体)和1,25-二羟基维生素D3(1α,25(OH)2D3)诱导的CYP24的表达。
图11显示了在正常和腺嘌呤诱导的尿毒症大鼠的甲状旁腺组织中相对CYP24诱导的图,此图显示了CYP24的基础表达(载体)和1,25-二羟基维生素D3(1α,25(OH)2D3)诱导的CYP24的表达。
图12显示了在正常大鼠、腺嘌呤诱导的尿毒症大鼠和伴随产生了维生素D缺乏症的恶化的用1,25-二羟基维生素D3处理的腺嘌呤诱导的尿毒症大鼠中CYP24和CYP27B1的相对表达。
图13显示了在正常大鼠和采用维生素D缺乏食谱的正常大鼠中,以及在食物正常和食物缺乏维生素D的腺嘌呤诱导的尿毒症大鼠之间,CYP24和CYP27B1的相对表达。
图14显示了在用1,25-二羟基维生素D3单独孵育或用1,25-二羟基维生素D3和CYP24抑制剂一起孵育的HEK细胞中,CYP24表达的相对诱导。
图15显示了在用不同浓度的1,25-二羟基维生素D3单独处理或用不同浓度的1,25-二羟基维生素D3和CYP24抑制剂一起孵育的HEK细胞中,3H-胸腺嘧啶的掺入(%)。
图16显示了在用1,25-二羟基维生素D3单独处理或用1,25-二羟基维生素D3和FGF23一起处理的HPK1a-ras细胞中,CYP24的相对表达。
图17显示了在正常大鼠、用缺乏维生素D的食物喂养的正常大鼠,和用缺乏维生素D的食物喂养且用不同浓度的1,25-二羟基维生素D3处理的正常大鼠中,CYP24的相对诱导。
图18显示了在用添加有腺嘌呤(“腺嘌呤载体”)的正常食物喂养的大鼠、用添加有腺嘌呤的缺乏维生素D的食物喂养的大鼠,和用添加有腺嘌呤的缺乏维生素D的食物喂养且用不同浓度的25-羟基维生素D3处理的大鼠中,CYP24的相对诱导。
图19显示了25-羟基维生素D3对尿毒症维生素D缺乏大鼠和正常维生素D缺乏大鼠中1,25-二羟基维生素D3浓度的影响。
具体实施方式
通常将“维生素D缺乏症”定义为人患者或其它哺乳动物中血清25-羟基维生素D水平低于30ng/mL的病症(参见National Kidney Foundation guidelines,NKF,Am.J.Kidney Dis.42:S1-S202(2003),其通过引用并入本文)。“维生素D缺乏症”包括:“维生素D不足”,其定义为血清25-羟基维生素D至少为16ng/mL但小于30ng/mL,“轻微”维生素D缺乏症,其定义为血清25-羟基维生素D为5-15ng/mL,和“严重”维生素D缺乏症,其定义为血清25-羟基维生素D小于5ng/mL。
如本文所用,将术语“维生素D充足”定义为人患者或其它哺乳动物中血清25-羟基维生素D水平大于或等于30ng/mL的病症。
本文所用术语“有风险”通常是指具有维生素D缺乏症相关特征或疾病的那些患病人群。具体实例包括但不限于具有1、2、3、4或5期慢性肾病的对象;未饮用维生素D强化奶的婴儿、儿童和成人(如乳糖不耐症对象、奶过敏的对象、不吃奶的素食者和母乳喂养的婴儿);患有软骨病的对象;具有黑色皮肤的对象(例如,在美国,相比于4%的白种妇女,年龄在15和49岁间的42%的非洲裔美国妇女缺乏维生素D);老年人(他们合成维生素D的能力降低且也更经常待在室内);患有慢性或急性和严重病的成人(他们更经常待在室内、医院、重病特护区、特设的和辅助护理区,包括患有阿尔莫茨海默症或精神病的对象);将全部暴露皮肤遮盖的对象(如某些宗教或文化的成员);经常使用遮光剂的对象(如使用防晒系数(SPF)为8的遮光剂会降低95%的维生素D产生,较高的SPF值可进一步降低维生素D);患有脂肪吸收不良综合症的的对象(包括但不限于囊性纤维化病、胆汁郁积型肝病、其它肝病、胆囊疾病、胰酶缺乏症、Crohn’s病、炎性肠病、口炎性腹泻或乳糜泻,或部分或全部胃和肠的手术切除);患有炎性肠病的对象;患有Crohn’s病的对象;小肠被切除的对象;患有齿龈疾病的对象;服用包括苯妥英、磷苯妥英、苯巴比妥、卡马西平和利福平等增加维生素D分解代谢的药的对象;服用包括消胆胺、考来替泊、奧利司他、矿物油和脂肪替代物等降低维生素D吸收的药的对象;服用包括酮康唑等抑制维生素D活化的药的对象;服用包括皮质类固醇等降低钙吸收的药的对象;患有肥胖、糖尿病、胰岛素抵抗综合症、内皮功能紊乱(沉积在身体脂肪储存中的维生素D的生物利用率较低)的对象;患有骨质疏松的对象;绝经后的妇女;患有心血管病、动脉硬化和/或心力衰竭的个体;和/或危重病住院的对象。
在一个实施方式中,患者未患有癌症。“癌症”是指存在具有癌症引起的细胞典型特征的细胞,如不可控的增殖、永生、转移潜力、快速生长和增殖速率以及某些特有的形态特征。通常,癌细胞为肿瘤形式,但这类细胞可在人或动物内单独存在,或可为致瘤的癌细胞,如白血病细胞。癌症包括但不限于乳腺癌、肺癌、支气管癌、结肠直肠癌、前列腺癌、胰腺癌、胃癌、卵巢癌、膀胱癌、脑或中枢神经系统癌、周围神经系统癌、食管癌、宫颈癌、黑色素瘤、子宫或子宫内膜癌、口腔或咽癌、肝癌、肾癌、睾丸癌、胆道癌、小肠或阑尾癌、唾液腺癌、甲状腺癌、肾上腺癌、骨肉瘤和软骨肉瘤。
如本文所用,术语“甲状旁腺功能亢进”是指原发性甲状旁腺功能亢进、继发性甲状旁腺功能亢进、慢性肾病(3、4或5期)继发的甲状旁腺功能亢进,和维生素D缺乏症继发的甲状旁腺功能亢进。
本文所用术语“对象”和“患者”通常包括人、哺乳动物(如狗、猫、啮齿类、绵羊、马、母牛、山羊)、兽医动物(veterinary animals)和动物园中的动物(zoo animals),优选人。
本文所用术语“CYP24表达和/或活性”通常包括转录产生CYP24mRNA,翻译产生CYP24蛋白质,和转录和翻译结合产生CYP24蛋白质,以及直接得出的CYP24酶活性,或通过计算CYP24产物与CYP24底物的比例得出的CYP24酶活性。
如本文所用,术语“维生素D化合物”通常包括维生素D前激素(如胆钙化甾醇和麦角钙化甾醇)、维生素D激素原(如1α-羟基维生素D3、1α-羟基维生素D3、25-羟基维生素D3和25-羟基维生素D2)、活性维生素D激素、前述化合物的类似物,和前述化合物的任意组合。具体实例包括但不限于维生素D3(胆钙化甾醇)、维生素D2(麦角钙化甾醇)、25-羟基维生素D3、25-羟基维生素D2、1α,25-二羟基维生素D3、1α,25-二羟基维生素D2、1α,25-二羟基维生素D4和维生素D类似物(包括全部羟基和二羟基形式),包括1,25-二羟基-19-去甲-维生素D2、22-氧杂骨化三醇、二氢速甾醇和26,26,26,27,27,27-六氟骨化三醇(氟骨三醇)。
如本文所用,术语“活性维生素D”和“活化的维生素D”是指至少在1α位置上被羟基化的维生素D化合物。活性维生素D化合物包括骨化三醇、1,25-二羟基维生素D2、阿法骨化醇、度骨化醇、22-氧杂骨化三醇和帕立骨化醇。
如本文所用,短语“治疗有效量”是指治疗或预防药(如CYP24抑制剂或双重作用CYP24抑制剂和VDR激动剂)这样的量,所述量适用于本发明的实施方式,且当根据所需治疗方案施用时,将会引起所需的治疗或预防作用或响应。更具体地,“治疗有效量”是指有效预防相关病症如维生素D缺乏症发展的量,去除、消除或延缓相关病症如维生素D缺乏症的进展的量。本领域技术人员有能力确定治疗有效量,尤其是根据本文的详细公开来确定。
“治疗有效剂量”是指实现所需效果的活性成分的量。此活性成分的毒性和治疗功效可在细胞培养物或实验动物中通过标准制药过程,如通过测定LD50(50%群体的致死剂量)和ED50(50%群体的治疗有效剂量)来确定。毒性效果和治疗效果之间的剂量比为治疗指数,可用LD50和ED50间的比例表示。优选高治疗指数。所得数据可用于制定人用剂量的范围。活性成分的剂量优选在包括ED50且毒性很小或无毒性的循环浓度范围内。剂量可根据所用剂型和所用给药途径在此范围内变化。
如本文所用,术语“包括”是指除所详述的那些外,还可能包括其它试剂、成分、步骤或特征。
本公开一方面提供了用于诊断分解代谢相关的维生素D缺乏症的方法。此方法包括测定维生素D缺乏患者中CYP24表达和/或活性,和将CYP24表达和/或活性的异常升高与分解代谢相关的维生素D缺乏症相关联。针对CYP24表达和/或活性的异常升高,此方法可进一步包括对维生素D缺乏的患者施用CYP24抑制剂。
本公开一方面提供了用于诊断分解代谢相关的维生素D缺乏症的易感性的方法。此方法包括测定患者中CYP24表达和/或活性,和将CYP24表达和/或活性的异常升高与分解代谢相关的维生素D缺乏症的易感性相关联。针对维生素D充足患者中CYP24表达和/或活性的异常升高,此方法可进一步包括对维生素D充足的患者施用CYP24抑制剂来抑制和/或预防维生素D缺乏症。针对维生素D缺乏患者中CYP24表达和/或活性的异常升高,此方法可进一步包括对维生素D缺乏的患者施用CYP24抑制剂来治疗维生素D缺乏症。
本公开另一方面提供了用于治疗或预防维生素D缺乏症和/或甲状旁腺功能亢进的方法。此方法包括测定患者中的CYP24表达和/或活性或其指标,并针对CYP24表达和/或活性异常升高的患者施用CYP24抑制剂。此方法可包括通过对CYP24表达和/或活性异常升高的维生素D缺乏的患者施用CYP24抑制剂来治疗维生素D缺乏症。此方法可进一步包括通过对CYP24表达和/或活性异常升高的维生素D充足的患者施用CYP24抑制剂来抑制和/或预防维生素D缺乏症。此方法可包括通过对CYP24表达和/或活性异常升高的患者施用CYP24抑制剂来抑制和/或预防甲状旁腺功能亢进。此方法也可包括通过对CYP24表达和/或活性异常升高的患者施用CYP24抑制剂来抑制和/或预防1,25-二羟基维生素D缺乏。
本公开另一方面提供了用于治疗或预防患者中维生素D缺乏症的方法。此方法包括测定患者中的CYP24表达和/或活性,并针对CYP24表达和/或活性异常升高的患者施用CYP24抑制剂。此方法进一步包括针对CYP24表达和/或活性异常升高的患者,如通过外界影响,例如通过降低、避免(停止)或中止施用活性维生素D化合物来降低、避免(停止)或中止维生素D结合受体(VDR)的活化,以避免加剧CYP24水平的增加和维生素D缺乏症。此方法可进一步包括对患者施用维生素D补充剂,例如通过对患者施用25-羟基维生素D(25-羟基维生素D3)。此方法可进一步包括测定患者中完整甲状旁腺激素(PTH)的水平和25-羟基维生素D水平。在一个实施方式中,患者具有异常升高的PTH水平和正常的25-羟基维生素D水平。在另一个实施方式中,患者具有异常升高的PTH水平和异常降低的25-羟基维生素D水平(如维生素D缺乏症)。在一个实施方式中,患者具有正常的PTH水平和异常降低的25-羟基维生素D水平。此方法可进一步包括测定患者的肾小球滤过率(GFR)以确定慢性肾病的时期。在一个实施方式中,患者将具有选自1至5期的CKD。在另一个实施方式中,患者将具有选自1和2期的CKD。在另一个实施方式中,患者将具有选自3和4期的CKD。
本公开的一个实施方式提供了通过测定患者中成纤维细胞生长因子-23(FGF23)的水平来测定CYP24活性。另一个实施方式提供了通过测定CYP24的一种或多种分解代谢副产物(包括但不限于24,25-二羟基维生素D3、25-羟基维生素D3-26,23-内酯、1,24,25-三羟基维生素D3、24,25-二羟基维生素D2或1,24,25-三羟基维生素D2,或CYP24活性作用于包括维生素D3-23羧酸或1,25-(OH)2D3-26,23-内酯的维生素D3代谢物而产生的终产物),来测定CYP24表达和/或活性。另一个实施方式提供了通过测定CYP24的一种或多种分解代谢副产物与一种或多种相应前体的比例(如24,25-二羟基维生素D与25-羟基维生素D的比例,或1,24,25-三羟基维生素D与1,25-二羟基维生素D的比例),来测定CYP24活性。另一个实施方式提供了通过测定患者中CYP24mRNA的水平、患者中CYP24蛋白质的水平和/或患者中CYP24酶活性的水平来测定CYP24表达。另一个实施方式提供了通过测定其它CYP24底物的CYP24代谢物来测定CYP24活性,所述其它CYP24底物可被引入(如通过注射)、被CYP24代谢并随后被测定。
本公开另一方面提供了用于诊断分解代谢相关的维生素D缺乏症的试剂盒。在一个实施方式中,试剂盒包括用于测定CYP24mRNA、蛋白质或酶促活性的试剂或其它设备,和例如根据本文公开方法使用的说明书。
除非另有说明,希望本文公开的诊断试剂盒和方法包括含下述(包括图中所示的那些)其它可选成员、特征和步骤中任意一种或多种组合的多个实施方式。
也清楚地明白本文所用任何数值包括从下限值至上限值的全部值,即认为在所列举的最低值和最高值之间全部可能的数值组合清楚地表述在本申请中。例如,如果称浓度范围或有益效果范围为1%至50%,意思是诸如2%至40%、10%至30%或1%至3%等数值清楚地列举在本申请中。这些仅是优选的示例。
在一个方面,本公开提供了诊断分解代谢相关的维生素D缺乏症的方法。此方法包括测定维生素D缺乏患者中CYP24表达和/或活性,和将CYP24表达和/或活性的异常升高与分解代谢相关的维生素D缺乏症相关联。针对CYP24表达和/或活性的异常升高,此方法可进一步包括对维生素D缺乏的患者施用CYP24抑制剂。
在另一个方面,本公开提供了诊断分解代谢相关的维生素D缺乏症的易感性的方法。此方法包括测定患者中CYP24表达和/或活性,和将CYP24表达和/或活性的异常升高与分解代谢相关的维生素D缺乏症的易感性相关联。针对维生素D充足患者中CYP24表达和/或活性的异常升高,此方法可进一步包括对维生素D充足的患者施用CYP24抑制剂来抑制和/或预防维生素D缺乏症。针对维生素D缺乏患者中CYP24表达和/或活性的异常升高,此方法可进一步包括对维生素D缺乏的患者施用CYP24抑制剂来治疗维生素D缺乏症。
另一方面,本公开提供了用于治疗或预防维生素D缺乏症和/或甲状旁腺功能亢进的方法。此方法包括测定患者中的CYP24表达和/或活性或其指标,并针对CYP24表达和/或活性异常升高的患者施用CYP24抑制剂。此方法可包括通过对CYP24表达和/或活性异常升高的维生素D缺乏的患者施用CYP24抑制剂来治疗维生素D缺乏症。此方法可包括通过对CYP24表达和/或活性异常升高的维生素D充足的患者施用CYP24抑制剂来抑制和/或预防维生素D缺乏症。此方法可包括通过对CYP24表达和/或活性异常升高的患者施用CYP24抑制剂来抑制和/或预防甲状旁腺功能亢进。此方法也可包括通过对CYP24表达和/或活性异常升高的患者施用CYP24抑制剂来抑制和/或预防1,25-二羟基维生素D缺乏。
维生素D缺乏症与许多其它疾病和障碍有关,包括继发甲状旁腺功能亢进、甲状旁腺增生、低钙血症、牛皮癣、慢性肾病(CKD)和代谢性骨病,如骨纤维发育不全、囊性纤维性骨炎、骨软化症、软骨病、骨质疏松症、骨质减少、骨硬化、肾性骨营养不良症和骨骼外钙化。根据本公开的方法也可用于治疗或预防与维生素D缺乏症有关的疾病或障碍。
当前护理CKD患者的标准认为应测定患者的PTH和25-羟基维生素D水平。在3期和4期患者中,如果血浆完整甲状旁腺(PTH)水平升高(如高于CKD时期的目标范围)且25-羟基维生素D降低(<30ng/ml),随后用维生素D2补充剂(麦角钙化甾醇)治疗患者。参见慢性肾病中骨代谢和疾病的国家肾基金会K/DOQI临床实践标准“Guideline 7:Prevention And Treatment Of Vitamin D Insufficiency And Vitamin D Deficiency In People With CKD(Algorithm 1)”,Am J Kidney Dis 42:S1–S202,2003(Suppl 3),其通过引用并入本文。对于CKD 3期(GFR范围30-59ml/min/1.73m2),目标PTH水平为35-70pg/ml(3.85-7.7pmol/L)。对于CKD 4期(GFR范围15-29ml/min/1.73m2),目标PTH水平为70-110pg/ml(7.7-12.1pmol/L)。
另一方面,如果PTH水平高于CKD时期的目标范围,且25-羟基维生素D的血清水平为>30ng/ml,随后用活性维生素D激素(如骨化三醇、阿法骨化醇或度骨化醇)治疗患者。参见慢性肾病中骨代谢和疾病的国家肾基金会K/DOQI临床实践指南“Guideline 8A:Active Vitamin D Therapy In Stages3And 4CKD(Algorithm 2)”,Am J Kidney Dis 42:S1–S202,2003(Suppl 3),其通过引用并入本文。
不受任何特定理论束缚,图12显示了如果25-羟基维生素D的水平正常,按照指南用活性维生素D激素治疗将增加CYP24的水平,因此尽管降低了PTH水平,但将加剧维生素D缺乏症。在患有慢性肾病且PTH水平升高的患者中,CYP24活性过高应通过(a)使用CYP24抑制剂和/或(b)避免进一步加剧CYP24水平的增加和维生素D缺乏症来控制。
因此,本公开另一方面提供了用于治疗或预防患者中慢性肾病(优选3和4期)继发的甲状旁腺功能亢进的方法。此方法包括测定患者中的CYP24表达和/或活性,并针对CYP24表达和/或活性异常升高的患者施用CYP24抑制剂。此方法优选进一步包括通过避免施用活性维生素D来避免CYP24水平增加和维生素D缺乏症(如果有的话)的加剧。此方法可进一步包括对患者施用维生素D补充剂,优选25-羟基维生素D(如25-羟基维生素D3)。此方法可进一步包括测定患者中25-羟基维生素D水平。在一个实施方式中,患者具有异常升高的PTH水平和正常的25-羟基维生素D水平。在另一个实施方式中,患者具有异常升高的PTH水平和异常降低的25-羟基维生素D水平。在另一个实施方式中,患者具有正常的PTH水平和异常降低的25-羟基维生素D水平。此方法可进一步包括测定患者的肾小球滤过率(GFR)以确定慢性肾病的时期。
在一个实施方式中,不束缚于任何特定理论,将FGF23水平用作CYP24表达和/或活性的指标。在另一个实施方式中,不束缚于任何特定理论,与任何特定原因无关(即无论是否通过CYP24的分解代谢),升高的FGF23本身作为维生素D缺乏症易感性的标志。从患者获得的生物样本中FGF23的水平可通过本领域技术人员已知的各种技术来测定。例如,完整FGF-23(iFGF23)和中间C末端FGF-23(cFGF23)的浓度可使用购自IMMUTOPICS(San Clemente,CA,USA)的ELISA试剂盒测定。虽然浓度可在血浆、血清或其它体液(如唾液)或组织中测定,但前述物质的测定结果优选为血清浓度。对于健康的成人,正常iFGF23水平在0至90pg/mL的范围内(Fliser et al.J.Am.Soc.Nephrol.18:2601-2608(2007),Ibrahim et al.Int.Urol.Nephrol.41(1):163-169(2009))。对于健康的成人,正常cFGF23水平在0至85参考单位(RU)/mL的范围内(Tebbin et al.Mayo Clin.Proc.80(6):745-751(2005))。FGF23的水平大于正常范围的上限值表示CYP24表达的异常升高。FGF23的水平距正常范围的上端越远,与CYP24表达异常升高的关联度越大。根据本文所述的方法,升高的FGF23将至少为正常FGF23的2倍,如3倍、4倍、5倍、10倍、50倍、100倍或1000倍。
在另一个实施方式中,CYP24活性通过测定CYP24的一种或多种分解代谢副产物的水平来测定。从患者获得的生物样本中CYP24分解代谢副产物的水平可通过本领域技术人员已知的各种技术来测定。例如,CYP24分解代谢副产物可通过免疫分析,如酶联免疫吸附分析(ELISA)、放射免疫分析(RIA)、免疫荧光分析等来测定。测定CYP24副产物如25-羟基维生素D3-26,23-内酯或1,25-二羟基维生素D3-26,23-内酯的另一种方法将利用它们与天然维生素D结合蛋白如维生素结合蛋白(DBP)或维生素D受体的高亲和性。这类蛋白质也可通过本领域技术人员已知的方法来修饰,以对这类维生素D产物具有更高的亲和性或选择性。与目标维生素D代谢物具有亲和性的合成抗体或蛋白质也可使用如噬菌体展示或酵母展示等技术来产生,且可加入试剂盒中以测定微生物D代谢物和CYP24分解代谢副产物的浓度。测定CYP24分解代谢副产物的其它技术包括高效液相色谱(HPLC)联用紫外-可见光光谱、荧光光谱、质谱等。CYP24活性也可通过测定CYP24的一种或多种分解代谢副产物与一种或多种相应前体的比例来测定。CYP24分解代谢副产物包括24-羟基化的天然和合成维生素D化合物。天然CYP24分解代谢副产物的实例包括24,25-二羟基维生素D3、1,24,25-三羟基维生素D3、24,25-二羟基维生素D2和1,24,25-三羟基维生素D2。CYP24的其它产物也可被23-羟基化,如25-羟基维生素D3-26,23-内酯或1,25-二羟基维生素D3-26,23-内酯。CYP24分解代谢副产物的其它实例包括对合成的维生素D化合物进行24-羟基化获得的产物。合成的维生素D化合物包括帕立骨化醇度骨化醇22-氧杂骨化三醇、阿法骨化醇和26,26,26,27,27,27-六氟骨化三醇(氟骨三醇)。虽然浓度可在血清或其它体液(如唾液)中测定,但前述物质的测定优选为测定血清浓度。测定可在短期或长期施用CYP24底物之后进行。
CYP24分解代谢副产物的对应前体化合物包括如25-羟基维生素D3、1,25-二羟基维生素D3、25-羟基维生素D2和1,25-二羟基维生素D2。对应前体化合物的水平可与CYP24催化分解副产物一起测定,且可通过CYP24的一种或多种分解代谢副产物与一种或多种相应前体的比例来获得CYP24活性的值。例如,可测定24,25-二羟基维生素D与25-羟基维生素D的比例,以及1,24,25-三羟基维生素D与1,25-二羟基维生素D的比例,且可使用这些比例来获得CYP24活性。虽然浓度可在血清或其它体液(如唾液)中测定,但前述物质的测定优选为测定血清浓度。测定可在短期或长期施用CYP24底物之后进行。
在一个实施方式中,CYP24表达通过测定患者中CYP24mRNA的水平来确定。从患者获取的生物样本中mRNA的水平可通过本领域技术人员已知的各种技术测定。在Northern印迹中,例如,mRNA水平可通过将放射活性或荧光标记的探针与mRNA样本杂交,所述mRNA样本经电泳分离和/或结合到膜或其它固体支持物上。DNA微阵列技术提供了另一种定量mRNA水平的方法,其将荧光标记的mRNA样本与以预定模式固定在固体支持物上的数千DNA寡核苷酸中的数十个至数百个DNA寡核苷酸杂交。当存在低水平的mRNA时,提供信号放大的技术特别有用。例如,实时定量聚合酶链式反应(qRT-PCR)通过将靶mRNA转化为相应的DNA分子,随后通过聚合酶链式反应扩增来将mRNA量化。通过使用荧光标记的引物,在扩增过程中可实时检测mRNA水平。
在一个实施方式中,CYP24表达通过测定患者中CYP24蛋白质的水平来确定。从患者获取的生物样本中蛋白质的水平可通过本领域技术人员已知的各种技术测定。在Western印迹中,例如,蛋白质水平可通过检测靶蛋白特异性抗体与蛋白质样本的结合来定量,所述蛋白质样本经电泳分离和/或结合到膜或其它固体支持物上。依赖于特异性抗体与靶抗原(如CYP24)结合的分析可采用各种形式,除Western印迹(免疫印迹)外,这类分析的实例还包括酶联免疫分析(ELISA)、放射免疫分析(RIA)、免疫荧光分析等。蛋白质水平也可通过各种染色、分光光度法和光谱检测技术,可选地结合各种分离技术来测定。检测技术的实例包括考马斯染色、银染色、紫外可见光谱、荧光光谱、质谱等。这些检测技术可与以下分离技术联用,如电泳、毛细管电泳、高效液相色谱(HPLC)、快速蛋白质液相色谱(FPLC)、薄层层析(TLC)、用于基因定量的倍增技术等。
在一个实施方式中,CYP24活性通过测定患者中CYP24酶活性的水平来确定。从患者获取的生物样本中酶活性的水平可通过本领域技术人员已知的各种技术测定。对于CYP24,酶活性可通过测定25-羟基维生素D3向对应24-羟基化的产物的转化来测定。例如,25-羟基维生素D3向24,25-二羟基维生素D3的转化可通过将来自患者的生物样本与放射活性标记的25-羟基维生素D3底物一起孵育、将反应产物通过HPLC分离,和测定相比于总放射活性的24,25-二羟基维生素D3峰的放射活性来分析。
一方面,CYP24表达和/或活性可在维生素D缺乏或维生素D充足的患者的一种或多种组织、血浆和细胞中测定。CYP24表达和/或活性可在通过活组织检查获得的组织中测定,且所述组织可包括,例如但不限于皮肤组织、肾组织、肝组织、甲状旁腺组织等。在一个实施方式中,优选肾组织。在另一个实施方式中,优选甲状旁腺组织。CYP24表达和/或活性可在细胞中测定,所述细胞包括获得自血液的细胞,如外周血单核细胞,和从组织拭取获得的细胞,如口腔细胞。在本文方法的一个实施方式中,相比于基于组织的过表达测定,CYP24表达和/或活性优选通过可在肿瘤生长中出现的系统性指示物(如外周血单核细胞或血清)来测定。
一方面,CYP24表达和/或活性异常升高。基于来自50-100个“正常”供体的CYP24表达和/或活性的平均值,将测定的CYP24表达和/或活性的正常水平定义为1个相对单位(RU),在“正常”供体中,制备CYP24mRNA并将其用作对照。
CYP24的基准水平可从收集自正常个体中的样本(如肾、皮肤、血液、血清、血浆、唾液、口腔拭取物)建立,所述正常个体从基于如性别、种族和/或年龄的不同种群的正常个体中收集。CYP24RNA水平可通过实时PCR、倍增技术技术或其它技术从组织(如肾或皮肤活组织检查)或细胞(如口腔拭取物)中建立。通过使用诸如倍增技术和Western印记等技术在这些组织中测定CYP24蛋白质水平。将CYP24RNA水平或CYP24蛋白质水平的平均值记为1RU。
24-羟基化的天然和合成维生素D化合物如24,25-二羟基维生素D3、1,24,25-三羟基维生素D3或内酯绝对量的正常水平可基于标准曲线使用诸如HPLC、气相色谱、质谱和前述方法等技术从样本(如血液、血浆、唾液)确立。医生将24-羟基化的天然和合成维生素D化合物的绝对值作为正常水平。
如果患者中CYP24RNA的水平、CYP24蛋白质的水平或24-羟基化的天然和合成维生素D化合物的绝对值落在“正常”范围外,则患者具有异常升高的CYP24表达和/或活性。例如,CYP24表达和/或活性可为正常CYP24表达和/或活性的至少2倍、至少3倍、至少4倍、至少5倍或至少10倍。预期异常升高的CYP24表达和/或活性可为正常CYP24表达和/或活性的数百倍或数千倍(如100x、500x、1000x、5000x等)。
在一个实施方式中,医生通过收集来自患者的至少一种样本(如血液、血浆、唾液、血清、口腔拭取物)并测定CYP24RNA水平、CYP24蛋白质水平或24-羟基化天然或合成维生素D化合物的绝对值,将确定是否患者具有异常升高的CYP24表达和/或活性。如上所述,如果测得的一个或若干个参数落在“正常”范围外,且优选增加为至少2倍、3倍、4倍等,医生将患者诊断为具有异常升高的CYP24活性和/或表达,且可开CYP24抑制剂的处方。
CYP24抑制剂可包括有机分子、单链或双链核酸(如正义、反义或错义寡核苷酸;适配子;正义、反义或错义多核苷酸;正义、反义或错义DNA;正义、反义或错义RNA;和siRNA)、肽、碳水化合物和蛋白质(如抗体、抗体片段、激素、激素类似物、糖蛋白和凝集素)。在一个实施方式中,CYP24抑制剂包括美国专利第6,380,408号(第6栏)中作为式IX(化合物1)公开的化合物,其为(5Z,7E,16Z,23E)-(1S,3R)-25-去甲-25-叔丁基磺酰基-9,10-断-5,7,10(19),16,23-胆甾五烯-1,3-二醇。在一个实施方式中,CYP24抑制剂包括氮杂茂化合物,如(R)-N-(2-(1H-咪唑-1-基)-2-苯乙基)-4′-氯联苯-4-羧酰胺、酮康唑、甲硝唑、氯美噻唑、伊曲康唑和氟康唑。
CYP24的一类有机分子抑制剂包括维生素D化合物的类似物。具有CYP24抑制活性的1,25-二羟基维生素D3类似物的实例公开在美国专利第6,380,408号、第7,101,865号、第7,166,585号和第6,982,258号以及美国专利申请第10/738,248号中(它们整体通过引用并入本文),且包括23,23-二氟-24-砜维生素D3化合物、25-砜维生素D3化合物、24,24-二氟-25-砜维生素D3化合物、24-亚砜亚胺维生素D3化合物、16-烯-25-肟维生素D3化合物和16-烯-25-肟醚维生素D3化合物、24-砜维生素D3化合物和24,24-二氟维生素D3化合物。在方法的一个方面,分子可选自纯CYP24抑制剂,如(5Z,7E)-(1S,3R)-24-(S)-苯基亚砜亚胺-25-去甲-9,10-断-5,7,10(19)-胆甾三烯-1,3-二醇(参见美国专利第7,101,865号,化合物I(a))。在方法的另一个方面,分子可选自同时为CYP24抑制剂和维生素D激动剂的化合物,如(5Z,7E,16Z,23E)-25-去甲-25-叔丁基磺酰基-9,10-断-5,7,10(19),16,23-胆甾五烯-1,3β-二醇(参见美国专利第6,380,408号,式IX,化合物1)和(5Z,7E,16Z)-(1S,3R)-25-(O-烯丙基)-N-叔丁基肟-9,10-断-5,7,10(19),16-胆甾五烯-1,3β-二醇(参见美国专利第6,982,258号,化合物I(g))。
CYP24抑制剂可选地与增加体内维生素D水平的其它试剂联合给药。本领域已知的增加体内维生素D水平的试剂包括在本公开范围内,且包括如维生素D2、25-羟基维生素D2、1,25-二羟基维生素D2、维生素D3、25-羟基维生素D3和1,25-二羟基维生素D3。优选地,避免维生素D化合物,以有利于维生素D前激素、维生素D激素原和其类似物。
胆钙化甾醇和麦角钙化甾醇均通过主要位于人体内肝中的酶代谢为激素原。胆钙化甾醇代谢为激素原25-羟基维生素D3,且麦角钙化甾醇代谢为激素原25-羟基维生素D2和24(S)-羟基维生素D2。在某些细胞如肠上皮细胞中,胆钙化甾醇和麦角钙化甾醇也通过与肝中相同或类似的那些酶在肝外代谢为激素原。提高任一前体的浓度增加激素原的产生;类似地,降低前体的浓度降低激素的产生。胆钙化甾醇和/或麦角钙化甾醇(“胆钙化甾醇/麦角钙化甾醇”)血液水平的激增可暂时提高细胞内维生素D浓度,加速激素原的产生,且升高细胞内和血液的激素原浓度。
1,25-二羟基维生素D的血液水平由PTH参与的反馈机制来精确地调节。肾的1α-羟化酶(或CYP27B1)被PTH刺激且被1,25-二羟基维生素D抑制。当1,25-二羟基维生素D的血液水平降低,甲状旁腺通过细胞内维生素D受体感知这种变化,并分泌PTH。分泌出的PTH刺激肾CYP27B1的表达,并以此增加维生素D激素的产生。随着1,25-二羟基维生素D血液浓度的再次升高,甲状旁腺进一步降低PTH分泌。随着血液PTH水平降低,肾产生的维生素D激素下降。提高1,25-二羟基维生素D血液浓度也直接抑制CYP27B1进一步产生维生素D激素。
胆钙化甾醇、麦角钙化甾醇和25-羟基维生素D血液水平的显著激增也可引起CYP24的上调响应,以代谢分解暂时过量的维生素D底物。类似地,提高1,25-二羟基维生素D血液水平可引起CYP24活性的上调。
不想受任何具体的操作模式的限制,认为CYP24的过表达是至少一些维生素D缺乏类型的原因,其与物质或阳光的缺乏无关,但可能由于物质或阳光的缺乏而复杂化。
因此,在本文公开方法的一类实施方式中,将单独施用CYP24抑制剂,或不施用维生素D化合物(如胆钙化甾醇、麦角钙化甾醇、维生素D激素原、维生素D激素或其类似物),最优选不施用活性维生素D激素或其类似物。在在本文公开方法的另一个实施方式中,将单独施用CYP24抑制剂,或当也施用维生素D化合物(如胆钙化甾醇、麦角钙化甾醇、维生素D激素原、维生素D激素或其类似物)时,将维生素D化合物以控释制剂给药以避免化合物(如缓释或延长释放制剂)的血液水平激增,或经由慢推IV递送方法给药。
一方面,本公开提供了用于诊断分解代谢相关的维生素D缺乏症的试剂盒。根据本公开的试剂盒提供了CYP24表达和/或活性的测定,且包括测定以下一种或多种性质的试剂盒,所述性质包括CYP24分解代谢副产物或此分解代谢副产物前体的水平、CYP24mRNA的水平、CYP24蛋白质的水平和/或CYP24酶活性的水平。在一个实施方式中,试剂盒包括固定的抗CYP24抗体、标记的抗CYP24抗体和用于使用如本文公开方法的说明书。涉及基于抗体检测的其它试剂盒也在本公开预料内。例如,用于测定CYP24表达的试剂盒可测定CYP24催化分解副产物的水平。试剂盒可包括用于测定催化分解副产物的一种或多种对应前体水平的试剂。一种此类试剂盒可包括特异于CYP24分解代谢副产物的抗体(其功能性片段),和特异于包括CYP24分解代谢副产物的维生素D化合物的抗体。预期对维生素D代谢物和CYP24分解代谢副产物具有高亲和性的蛋白,如DBP或VDR或合成衍生的蛋白质或大分子也可用于替代此类试剂盒中的抗体。预期将前述抗体之一固定在固体支持物上,且其它抗体具有检测用的标记。在另一个实例中,用于测定CYP24表达的试剂盒可包括固定的CYP24分解代谢副产物和抗CYP24抗体。使用上述试剂盒,通过测定CYP24分解代谢副产物与固定的CYP24分解代谢副产物竞争结合抗CYP24抗体的能力来测定CYP24活性。
另一方面,本公开包括用于治疗或预防维生素D缺乏症的药物制剂,所述药物制剂包括有效量的CYP24抑制剂。此制剂可进一步包括有效量的25-羟基维生素D3。
另一方面,本公开包括用于治疗或预防甲状旁腺功能亢进的药物制剂,所述药物制剂包括有效量的CYP24抑制剂。此制剂可进一步包括有效量的25-羟基维生素D3。此药物制剂可用于治疗慢性肾病如1期或2期CKD继发的甲状旁腺功能亢进。
每个医生可根据患者的情况确定确切的制剂、给药途径和剂量。剂量和间隔可根据个人调整,以提供足以保持治疗或预防效果的活性成分的水平。
此类制剂可为如颗粒、散剂、片剂、胶囊、糖浆、栓剂、注射剂、乳剂、酏剂、混悬剂或溶液的形式。可配置用于各种给药途径,如经口服给药、经鼻给药、经直肠给药、经皮下注射、经静脉注射、经肌肉注射或经腹腔注射的制剂。以下剂型通过举例给出,且不构成对本发明的限制。
对于口服、含服和舌下给药,散剂、混悬剂、颗粒、片剂、丸剂、胶囊、软胶囊和锭为可接受的固体剂型。这些剂型可通过将一种或多种CYP24抑制剂或双功能CYP24抑制剂和本发明的VDR激动剂与至少一种添加剂如淀粉或其它添加剂混合来制备。适合的添加剂为蔗糖、乳糖、纤维素糖、甘露醇、麦芽糖醇、葡聚糖、淀粉、琼脂、海藻酸、几丁质、壳聚糖、果胶、黄蓍胶、阿拉伯胶、明胶、胶原、酪蛋白、白蛋白、合成或半合成的聚合物或甘油酯。可选地,口服剂型可包含辅助给药的其它成分,如无活性的稀释剂,或润滑剂如硬脂酸镁,或防腐剂如对羟基苯甲酸酯或山梨酸,或抗氧化剂如抗坏血酸、生育酚或半胱氨酸,崩解剂、粘结剂、增稠剂、缓冲剂、甜味剂、调味剂或加香剂。片剂和丸剂可进一步用本领域已知的适合包衣材料处理。
用于口服给药的液体剂型可为药学上可接受的乳剂、糖浆、酏剂、混悬剂和溶液形式,所述液体剂型可包含无活性的稀释剂,如水。药物制剂和药剂可使用无菌液体,例如但不限于油、水、醇和它们的组合制备成悬浮液或溶液。可加入药学上适合的表面活性剂、混悬剂、乳化剂以用于口服或肠胃外给药。
如上所述,混悬剂可包括油。此类油包括但不限于花生油、芝麻油、棉籽油、玉米油和橄榄油。混悬制剂可也包括脂肪酸的酯,如油酸乙酯、肉豆蔻酸异丙酯、脂肪酸甘油酯和乙酰化的脂肪酸甘油酯。混悬制剂可包括醇,例如但不限于乙醇、异丙醇、十六醇、甘油和丙二醇。醚例如但不限于聚乙二醇、石油烃如矿物油和石油,和水也可用在混悬制剂中。
对于经鼻给药,药物制剂和药剂可为喷雾剂或气溶胶,所述喷雾剂或气溶胶包含适合的溶剂和可选地其它化合物,例如但不限于稳定剂、抗菌剂、抗氧化剂、pH调节剂、表面活性剂、生物利用度调节剂(bioavailability modifiers)和它们的组合。用于气溶胶制剂的推进剂可包括压缩空气、氮气、二氧化碳或烃类低沸点溶剂。
可注射剂型通常包括可使用适合的分散剂或湿润剂和悬浮剂制备的含水混悬剂或含油混悬剂。可注射剂型可为使用溶剂或稀释剂制备的溶液相或混悬剂形式。可接受的溶剂或载体包括灭菌水、Ringer溶液或等渗压的盐水溶液。或者,无菌油可用作溶剂或悬浮剂。优选地,油或脂肪酸为非挥发性的,包括天然或合成油、脂肪酸、甘油单酯、甘油二酯或甘油三酯。
对于注射,药物制剂和/或药剂可为适于用上述适合溶液重建的散剂。这些散剂的实例包括但不限于冻干粉、旋转干燥粉或喷雾干燥粉、无定形粉末、颗粒、沉淀物或微粒。对于注射,制剂可选地包含稳定剂、pH调节剂、表面活性剂、生物利用度调节剂和它们的组合。
对于直肠给药,药物制剂和药剂可为用于在肠、乙状结肠和/或直肠中释放化合物的栓剂、软膏剂、灌肠剂、片剂或乳膏剂。直肠栓剂可通过将本发明的一种或多种化合物或此化合物的药学上可接受的盐或互变异构体与可接受的载体如可可脂或聚乙二醇混合来制备,所述直肠栓剂在正常存储温度下以固相存在,且在适用于体内如直肠内释放药物的那些温度下以液相存在。油也可用于制备软明胶型和栓剂制剂。水、盐水、葡萄糖水溶液和相关糖溶液以及甘油可用于制备混悬制剂,所述混悬制剂也可包含悬浮剂,如果胶、卡波姆、甲基纤维素、羟丙基纤维素或羧甲基纤维素,以及缓冲剂和防腐剂。
可将本发明的制剂设计为下述的速效、速释、长效和缓释型。因此,也可配制用于控释和慢释的药物制剂。
本发明组合物也可包括如胶束或脂质体,或一些其它包裹的形式,或可以延迟释放的形式给药以提供更长的存储和/或递送效果。因此,可将药物制剂和药剂压缩为小球或圆柱体,并经肌肉或经皮下作为积存注射剂(depot injections)植入或作为植入物如支架。此类植入物可采用已知的惰性材料,如硅酮和生物可降解性聚合物。
具体剂量可根据对象的病情、年龄、体重、一般健康情况、性别和饮食、服药间隔、给药途径、排泄率和药物的组合来调节。包含有效量的任何以上剂型都在常规实验范围内,因此也在本发明的范围内。
除了上述那些代表性的剂型外,药学上可接受的赋形剂和载体通常是本领域技术人员已知的,因此也包含在本发明内。这类赋形剂和载体描述在如"Remingtons Pharmaceutical Sciences"Mack Pub.Co.,New Jersey(1991)中,其通过引用并入本文。
维生素D化合物的适合的控释制剂公开在申请PCT/US2008/061579中,此申请作为WIPO公开WO 2008/134512(2008年11月6日)公布,且其公开通过引用全部并入本文。预期此类制剂也可包括相容性CYP24抑制剂和双功能CYP24抑制剂和VDR激动剂。
实施例
提供以下实施例是用于说明而非要限制本发明的范围。
以下实施例支持以下结论。
在来自正常和尿毒症大鼠的组织中,1,25-二羟基维生素D3强力地诱导CYP24基因表达。
与其它组织相比,CYP24的组成型表达在健康肾中相对较高。然而,尿毒症大鼠中,CYP24的基础表达显著升高。这提示与尿毒症状态有关的机理可能涉及CYP24表达的调节。
与正常动物的甲状旁腺相比,在尿毒症动物的甲状旁腺中1,25-二羟基维生素D3显著地诱导CYP24,提示重复给药可导致抗性增加。
尿毒症大鼠中CYP27B1的表达与1,25-二羟基维生素D3水平降低无关,这提示CYP24在降低尿毒症维生素D水平中起更重要的作用。
在正常动物中,CYP24表达依赖于维生素D的状况;维生素D缺乏症显著地降低CYP24表达水平。尿毒症动物显示出较高的CYP24表达基础水平,此水平在维生素D缺乏症状态下不改变。这提示在尿毒症中,独立于维生素D的机理调节CYP24水平。这会对尿毒症中维生素D状态产生影响。
尿毒症肾中CYP24基础表达的升高可能是导致潜在25(OH)D3和1,25-二羟基维生素D3缺乏症以及抵抗维生素D激素替补疗法的主要机理。抑制CYP24的化合物可用于保持维生素D状态和克服CYP24对治疗的抗性。
FGF23与1,25-二羟基维生素D协同作用以诱导CYP24RNA产生。在尿毒症的情况中,高水平的FGF23可能导致进一步升高CYP24,使得患者抵抗维生素D治疗。
CYP24水平在维生素D缺乏的动物中降低,并在用25-羟基维生素D治疗后增至正常或较高水平。
CYP24水平在尿毒症维生素D缺乏的大鼠中不改变,且在用25-羟基维生素D治疗后不增加,这提示尿毒症大鼠中缺乏对维生素D的控制。
与维生素D缺乏的动物相比,在维生素D缺乏的尿毒症大鼠中CYP24RNA水平增加。这可以解释为何在施用25-羟基维生素D3两周后,与维生素D缺乏的动物相比,在维生素D缺乏的尿毒症大鼠中1,25-二羟基维生素D3的水平较低。
实施例1
维生素D缺乏症的动物模型
为了获得维生素D缺乏症的动物模型,用富含腺嘌呤的食物喂养大鼠。在7天后,与用对照食物喂养的动物相比,通过完整PTH(iPTH)Elisa试剂盒在用腺嘌呤喂养的大鼠中观察到甲状旁腺激素(PTH)水平升高,且在29天后,继发性甲状旁腺功能亢进已出现在用腺嘌呤喂养的大鼠中,但未出现在用对照食物喂养的动物中(图1)。通过用维生素D化合物治疗用腺嘌呤喂养的动物,显著降低iPTH水平。如图2所示,通过用1,25-(OH)2-D3(骨化三醇或1,25-二羟基维生素D3)、25-OH-D3(骨化二醇或25-羟基维生素D3)或1,25-(OH)2-D2(1,25-二羟基维生素D2)治疗用腺嘌呤喂养的动物,在用腺嘌呤喂养的动物中iPTH水平恢复至与用对照食物喂养的动物类似的水平。
通过用质谱测定活性形式的维生素D,即1,25-(OH)2-D3(骨化三醇或1,25-二羟基维生素D3)的水平来分析用腺嘌呤喂养的动物和对照动物的维生素D激素状态。与用对照食物喂养的动物相比,用腺嘌呤喂养的动物显示出维生素D激素状态的降低(图3)。通过用1,25-(OH)2-D3治疗用腺嘌呤喂养的动物,用腺嘌呤喂养的动物中维生素D状态恢复至用对照食物喂养的动物的水平。相反,用25-(OH)2-D3(骨化二醇或25-羟基维生素D3)或1,25-(OH)2-D2(1,25-二羟基维生素D2)治疗用腺嘌呤喂养的动物未显著影响这些动物的1,25-(OH)2-D3水平(图3)。
实施例2
维生素D缺乏症中的CYP24表达
为了确定维生素D缺乏症和CYP24水平间的关系,在用腺嘌呤喂养的大鼠和用对照食物喂养的动物中通过qRT-PCR测定CYP24表达。与用对照食物喂养的动物的肾组织相比,在用腺嘌呤喂养的大鼠的肾组织中CYP24表达异常升高为约7倍。用维生素D化合物治疗用腺嘌呤喂养的动物进一步诱导CYP24。如图4所示,通过用1,25-(OH)2-D3(骨化三醇或1,25-二羟基维生素D3)、25-OH-D3(骨化二醇或25-羟基维生素D3)或1,25-(OH)2-D2(1,25-二羟基维生素D2)治疗用腺嘌呤喂养的动物,使得CYP24表达活性升高为2倍至25倍。与用对照食物喂养的动物的甲状旁腺相比,在用腺嘌呤喂养的动物的甲状旁腺组织中CYP24表达活性异常升高为约3倍(图5)。用维生素D化合物治疗用腺嘌呤喂养的动物显著诱导CYP24。如图5所示,通过用1,25-(OH)2-D3(骨化三醇或1,25-二羟基维生素D3)、25-OH-D3(骨化二醇或25-羟基维生素D3)或1,25-(OH)2-D2(1,25-二羟基维生素D2)治疗用腺嘌呤喂养的动物,使得CYP24表达活性升高为50倍至14,000倍。
实施例3
维生素D缺乏症中的FGF23表达
为了确定维生素D缺乏症和成纤维细胞生长因子-23(FGF23)水平间的关系,在用腺嘌呤喂养的大鼠和用对照食物喂养的动物中测定血清FGF23水平。与用对照食物喂养的动物相比,在用腺嘌呤喂养的动物中血清FGF23水平异常升高为至少53倍(图6)。用维生素D化合物治疗用腺嘌呤喂养的动物也显示出FGF23水平升高。如图6所示,与用对照食物喂养的动物相比,通过用1,25-(OH)2-D3(骨化三醇或1,25-二羟基维生素D3)、25-OH-D3(骨化二醇或25-羟基维生素D3)或1,25-(OH)2-D2(1,25-二羟基维生素D2)治疗用腺嘌呤喂养的动物,使得FGF23水平升高为74倍。
在来自用腺嘌呤喂养的大鼠和用对照食物喂养的动物的肾组织中,测定骨形成生物标志物,即FGF23和骨钙蛋白的水平。与用对照食物喂养的动物相比,在用腺嘌呤喂养的动物中FGF23升高为约55倍且骨钙蛋白升高为约1.5倍(图7)。
实施例4
25-羟基维生素D治疗中的CYP24表达
图8显示了在用维生素D(25-羟基维生素D2和25-羟基维生素D3)处理2周的大鼠中,相对CYP24诱导的图。对正常大鼠经静脉施用16μg/kg 25-羟基维生素D2、25-羟基维生素D3和对照载体2周。采集血液并通过实时PCR测定CYP24表达。
实施例5
在人对象中分析(5Z,7E,16Z,23E)-(1S,3R)-25-去甲-25-叔丁基磺酰基-9,10-断-5,7,10(19),16,23-胆甾五烯-1,3-二醇对25-羟基维生素D水平的影响。对这些对象在第1、3、5、8和10天时施用安慰剂或此化合物。在此化合物最后施用24小时后,测定25-羟基维生素D水平。血清25-羟基维生素D的百分数变化显示在图9中(对于90mcg和180mcg,p=0.1)。
实施例6
每天用载体或0.5mcg/kg 1,25-二羟基维生素D3经静脉治疗SD大鼠,持续1周。在最后一次给药后24小时采集器官。CYP24基因表达通过实时PCR测定。结果显示在图10中。
用标准食物(正常)或含0.75%腺嘌呤的诱导尿毒症的食物(尿毒症)喂养SD大鼠。随后每天用载体或0.5mcg/kg 1,25-二羟基维生素D3经静脉对动物给药,持续7周。在最后一次给药后24小时采集器官。CYP24基因表达通过实时PCR测定,并相对于GAPDH水平进行标准化。相对于载体治疗组标准化相对表达值(相对表达=1)。结果显示在图11中。
图10和11显示,与正常大鼠相比,在尿毒症大鼠中CYP24的基础表达在肾中显著升高(图10),但在甲状旁腺中未显著升高(图11)。然而,与正常动物相比,尿毒症动物甲状旁腺中1,25-二羟基维生素D3(1α,25(OH)2D3)诱导的CYP24表达显著增加。“*”是指在正常和尿毒症大鼠中,载体和1,25-二羟基维生素D3治疗间CYP24表达有显著差异。“**”是指载体治疗的正常大鼠和尿毒症大鼠之间有显著差异。是指在用1,25-二羟基维生素D3治疗的正常大鼠和尿毒症大鼠之间CYP24诱导水平之间有显著差异。将p值<0.05设为显著的界限。数据用平均值±SEM表示。每个柱上的数值代表相对于正常-载体的相对诱导倍数。
实施例7
使用与对应于图11的以上实施例6所述相同的方法测定CYP24和CYP27B1表达。25(OH)D3和1,25-二羟基维生素D3的血清水平通过LC-MS测定。血清PTH根据制造商的说明书通过ELISA IMMUTOPICS(San Clemente,CA,USA)测定。简言之,将血清样本用[26,27-2H6]25(OH)D3或[25,26-2H6]1,25-二羟基维生素D3加同位素,并溶解在乙腈以作为内标。使用Accubond II ODS-C18 100mg,1mL SPE滤柱(Agilent Technologies)从血清中提取1,25-二羟基维生素D3或25(OH)D3和内标。收集的馏分在稳定的氮气流下蒸发至干燥,将剩余物再溶解于50μL甲醇/H2O(80/20;v/v)中并用LC-MS/MS(Waters Alliance HPLC-Waters Quattro Ultima mass spectrometer)分析。相对于载体治疗组标准化相对表达值(相对表达=1)。结果显示在图12中。
图12显示在CYP27B1不变的情况下,尿毒症大鼠中CYP24基础表达的增加可导致较低的1,25-二羟基维生素D3水平。用1,25-二羟基维生素D3治疗引起血清25-(OH)D3水平的降低。用1,25-二羟基维生素D3治疗引起PTH降低,但也显著诱导CYP24表达。对于CYP27B1(*)和CYP24(**),星号代表正常和尿毒症组之间在统计学上有显著差异。在上面的表格中,(*)是指正常和尿毒症大鼠之间维生素D水平有显著差异。使用以p值<0.05为界限的student’s独立t检验来检验其统计学显著性。数据用平均值±SEM表示。
实施例8
通过用缺乏维生素D的食物喂养SD大鼠6周来诱导维生素D缺乏症。用含维生素D的标准食物喂养正常大鼠。通过在最后2周持续口服给药(管饲法)0.2%的腺嘌呤溶液来诱导尿毒症。通过经口管饲法对非尿毒症的对照大鼠施用载体。在最后一次施用腺嘌呤后24小时采集血清和器官。基因表达通过实时PCR测定。实施例7详述了25(OH)D3和1,25-二羟基维生素D3的血清水平的测定。结果显示在图13中。
图13显示CYP24基础表达的增加不依赖于尿毒症大鼠中维生素D代谢物的水平。“*”是指各个组与非尿毒症的正常组之间有显著差异。“**”代表CYP27B1正常食物和CYP27B1维生素D缺乏(VD Def)食物之间有显著差异。使用以p值<0.05为界限的student’s独立t检验来检验其统计学显著性。数据用平均值±SEM表示。不可检测的水平表示为“ND”。
实施例9
将HEK细胞以每孔(24孔板)25,000个细胞接种,并用1,25-二羟基维生素D3(10nM)单独孵育,或用1,25-二羟基维生素D3(10nM)与CYP24抑制剂((MK-24(S)-S(O)(NH)-Ph-1,参见美国专利第7,101,865号,化合物I(a))(10nM)一起孵育6、24、48和72小时。收集细胞,并使用试剂制备RNA。使用实时PCR定量CYP24。结果显示在图14中。
结果显示,在CYP24抑制剂MK-24(S)-S(O)(NH)-Ph-1存在下,1,25-二羟基维生素D3显著延长了CYP24诱导。
实施例10
将HEK细胞以2000细胞/孔的密度转移至96孔板中。在96孔板中生长2天后,将细胞用终浓度为10-6-10-11的1,25-二羟基维生素D3和终浓度分别为0、1、10和50nM的MK-24(S)-S(O)(NH)-Ph-1化合物共同处理。在过夜处理后,持续16小时向细胞中加入[3H]-胸腺嘧啶,KGM培养基浓度为0.2mCi/孔。在加入25ml闪烁液体后,使用闪烁计数器来计算放射活性的加入。结果显示在图15中。数据表示取决于1,25-二羟基维生素D3浓度的以cpm计的胸腺嘧啶加入。每个数据点代表至少4个独立的试验。
结果显示抑制CYP24活性可将所培养HEK细胞中1,25-二羟基维生素D3的抗增殖效果增加约3个数量级。
实施例11
将HPK1a-ras细胞用含或不含100ng/mL FGF23的0、1、10和100nM1,25-二羟基维生素D3(骨化三醇)处理,并在8小时后测定CYP24RNA表达。结果显示FGF23的存在可协同1,25-二羟基维生素D3一起诱导CYP24RNA产生(图16)。
实施例12
用标准食物或维生素D缺乏的食物喂养SD大鼠4周。随后按图17中每个轴的标记,在2周内持续每天对动物注射0.6、3或18mcg/kg 25-羟基维生素D3或载体。在随后一次注射后24小时采集肾,并通过实时PCR测定CYP24mRNA水平。结果显示在图17中。
实施例13
用标准食物(腺嘌呤载体组)或维生素D缺乏的食物(维生素D缺乏/腺嘌呤载体组)喂养SD大鼠4周。在此处理后,持续2周每天对动物口服给予100mg腺嘌呤。随后按图18中每个轴的标记,在另外2周内持续每天对动物注射0.6或18mcg/kg 25-羟基维生素D3或载体。在随后一次注射后24小时采集肾,并通过实时PCR测定CYP24mRNA水平。结果显示在图18中。
实施例14
图19显示与持续2周施用6或18mcg/kg 25-羟基维生素D的维生素D缺乏的大鼠相比,在维生素D缺乏的尿毒症大鼠中1,25-二羟基维生素D3的水平。
以上描述是仅用于理解清楚,且不应从中理解为不必要的限制,本发明范围内的修改对本领域普通技术人员是显而易见的。
在全文中,当组合物被描述为包括组分或材料时,除非另有说明,预计组合物也可基本上由所述组分或材料的任意组合组成,或由所述组分或材料的任意组合组成。
本文公开方法的实施和其单独步骤可手动和/或在电子装置辅助下进行。虽然已参照具体实施方式描述了方法,但本领域技术人员很容易明白可使用其它方式进行与方法相关的方案。例如,除非另有说明,可改变各步骤的顺序而不背离所述方法的范围或精神。此外,一些单独的步骤可组合、省略或进一步细分为附加步骤。
在禁止对在人体上实施的方法授予专利权的司法权中,向人类对象“施用”组合物的含义应被限制为将受控的物质开处方,其中人类对象能够通过任何技术(例如口服、吸入、局部施用、注射、插入等)自己施用所述物质。希望有一种最宽泛的合理解释,这种解释符合限定可授予专利的主题的法律或法规。在不禁止对在人体上实施的方法授予专利权的司法权中,组合物的“施用(给药)”既包括在人体上实施的方法也包括上述行为。
本文引用的全部专利、出版物和参考文献通过引用全部并入本文。在本公开与所并专利、出版物和参考文献冲突的情况下,应遵循本公开。
- 还没有人留言评论。精彩留言会获得点赞!