一种磁共振/核医学双模态分子影像探针及其制备方法与流程
本发明涉及一种磁共振/核医学双模态分子影像探针,特别涉及利用金属离子与磁性纳米颗粒表面配体分子的相互作用,交联磁性纳米颗粒表面配体分子,增强表面配体分子与磁性纳米颗粒的结合力,并在此基础上获得高稳定性的磁共振/核医学双模态分子影像探针。
背景技术:
癌症是威胁人类健康的重要疾病之一,其早期诊断是人类攻克癌症的关键之一。目前,磁共振成像和核医学成像是临床上肿瘤诊断的重要手段,然而它们都具有各自的优缺点,例如磁共振成像技术(mri,magneticresonanceimaging)具有安全、无创、空间分辨率高(10-100um)、不受组织深度限制等优点,但其敏感性低。核医学成像(pet/spect)则具有很高的特异性和灵敏度,但是成像空间分辨率低(1-2mm),给病灶的准确定位带来困难。由此可见,使用单一的磁共振或者核医学影像技术已经已然不能满足目前肿瘤早期诊断的需求,甚至可能导致肿瘤的漏诊、误判和误诊,耽误最佳的治疗时间。因此,利用磁共振成像和核医学成像的优势互补性,发展磁共振/核医学双模态分子影像技术,克服两者单模态成像的缺陷已经成为提高肿瘤诊断准确率的重要手段。
得益于纳米技术和医学影像学的快速发展,能够实现磁共振/核医学双模态成像的影像设备已经走向临床,然而与之配套使用的磁共振/核医学双模态分子影像探针仍处在基础研究阶段,有待进一步开发。从目前已公开报道的文献来看,磁共振/核医学双模态分子影像探针的构建主要有以下两种方法:第一种是以纳米磁共振造影剂为基础,利用纳米磁共振造影剂表面修饰的配体分子,进一步将放射性核素连接在其表面,实现核医学成像的功能(如:bioconjugatechemistry,2010,21,715-722);另一种方法是在制备纳米磁共振造影剂的同时,将放射性核素负载或者掺杂到纳米磁共振造影剂的内部,实现两种成像功能的结合(如:chemicalcommunications,2014,50,2170-2172)。以上两种制备方式各有优缺点,前者过程较为简便,但是受限于表面配体分子和纳米磁共振造影剂的结合能力,放射性核素容易连同表面配体分子一起从纳米磁共振造影剂表面脱落,因此所得到的磁共振/核医学双模态分子影像探针的稳定性有待提高。后一种制备方法由于将放射性核素固定在纳米磁共振造影剂内部,所得探针的稳定性较好,但是整个合成过程都将涉及到放射性核素,实际操作步骤非常复杂,其应用也将受到极大限制。因此,发展一种既简单方便、又能够得到稳定的磁共振/核医学双模态分子影像探针的方法,已成为推进磁共振/核医学双模态成像技术临床广泛应用的关键。
技术实现要素:
目的:为了克服现有技术中存在的不足,针对磁性纳米颗粒表面配体分子容易脱落,导致放射性核素对磁性纳米颗粒的标记稳定性较差这一问题,本发明提供一种磁共振/核医学双模态分子影像探针,以磁性纳米颗粒为核心,在其表面上创新性地引入配位金属离子,利用配位金属离子与磁性纳米颗粒表面配体分子的配位作用,交联表面配体分子,增强表面配体分子和磁性纳米颗粒的结合能力,从而提高放射性核素对磁性纳米颗粒的标记稳定性;提高所得磁共振/核医学双模态分子影像探针的放射性标记稳定性。
技术方案:为解决上述技术问题,本发明采用的技术方案为:
一种磁共振/核医学双模态分子影像探针,包括磁性纳米颗粒、表面配体分子、放射性核素,其特征在于:还包括配位金属离子,在磁性纳米颗粒表面引入配位金属离子,利用配位金属离子与磁性纳米颗粒表面配体分子的配位作用,交联表面配体分子,增强表面配体分子和磁性纳米颗粒的结合能力,从而提高放射性核素对磁性纳米颗粒的标记稳定性。
所述放射性核素包括金属放射性核素和非金属放射性核素;能够放射γ射线或者正电子,优选99mtc、123i、124i、125i、131i、111in、188re、67ga、68ga、18f、64cu、90y、59fe、192ir、60co、201tl。
当放射性核素为金属放射性核素时,配位金属离子为该放射性核素金属离子(如99mtc、111in、188re等的离子),可直接利用放射性核素金属离子与表面配体分子的配位作用,交联磁性纳米颗粒表面配体分子,在提高放射性核素标记稳定性的同时,利用放射性核素金属离子放出的γ射线进行核医学显像。
当放射性核素为非金属放射性核素时,则引入新的配位金属离子。所述配位金属离子选自过渡金属离子或稀土金属离子,优选gd3+,dy3+,yb3+,y3+,in3+,fe3+,fe2+,mn2+,cu2+,co2+,ni2+中的一种或几种。
所述磁性纳米颗粒选自磁性过渡金属及其氧化物、磁性镧系稀土金属氧化物、过渡金属或稀土金属掺杂型磁性氧化物、磁性镧系稀土金属氟化物、磁性镧系稀土金属掺杂的氟化物,优选铁及其氧化物,钴、镍、锰或它们的氧化物,钆、镝、铽、钬、铒、铥的氧化物或氟化物,钆、镝、铽、钬、铒、铥的掺杂的氟化物。
所述磁性纳米颗粒的粒径为1~100纳米,更优选为2~20纳米;所述磁性纳米颗粒具有顺磁性、超顺磁性、亚铁磁性或铁磁性,优选顺磁性或超顺磁性磁性纳米颗粒。
所述表面配体分子可以是小分子(如巯基丁二酸、巯基乙酸等)、高分子聚合物(如双磷酸聚乙二醇、双羧基聚乙二醇、聚丙烯酸等)、嵌段共聚物以及它们的衍生物。表面配体分子具有水溶性或双亲性。所述表面配体分子含有一个或多个配位基团,并通过配位作用连接在磁性纳米颗粒表面;所述配位基团为羧基、氨基、巯基、磷酸基团、双磷酸基团、邻苯二酚基团、邻苯三酚基团、异羟肟酸基团、丁二酮肟基团、乙酰丙酮基团、苯甲酰丙酮基团、水杨醛基团、1,10-二氮菲基团、2,2'-联吡啶基团、8-羟基喹啉基团及其衍生基团中的一种或几种。配位基团可以与配位金属离子作用,交联表面配体分子。配位基团还可以用作与磁性纳米颗粒表面配位,连接表面配体分子和磁性纳米颗粒。
具有表面配体分子修饰的磁性纳米颗粒,可以是通过一步反应合成得到的,也可以是首先获得磁性纳米颗粒,再通过配体交换等方式,将表面配体分子连接到磁性纳米颗粒上。具有表面配体分子修饰的磁性纳米颗粒具有水溶性。
所述配位金属离子选自过渡金属离子或稀土金属离子,配位数大于或等于2,与表面配体分子中的配位基团配位,连接2个或以上的表面配体分子。配位金属离子在使用时通常采用无机金属盐或者有机金属盐的形式,包括但不限于金属卤化物、硝酸盐、硫酸盐、醋酸盐。
本发明还提供所述的磁共振/核医学双模态分子影像探针的制备方法:
a、当放射性核素为非金属放射性核素时,包括以下步骤:
(1)将具有表面配体分子修饰的磁性纳米颗粒溶于水,颗粒质量浓度在1ug/ml~100mg/ml,优选0.1mg/ml~10mg/ml;将配位金属离子对应的无机金属盐或者有机金属盐溶于水,配置成金属离子浓度为1ug/ml~50mg/ml的配位金属离子水溶液;配位金属离子浓度优选0.1mg/ml~10mg/ml;
(2)将配位金属离子的水溶液,加入到具有表面配体分子修饰的磁性纳米颗粒水溶液中,交联表面配体分子,配位金属离子与磁性纳米颗粒的质量比为0.0001~5,优选0.001~0.1,混匀后反应1分钟~24小时;更优选5分钟~1小时;
(3)在表面配体分子交联后的颗粒上标记放射性核素,放射性核素的标记量在0.1uci/(mg磁性纳米颗粒)~100mci/(mg磁性纳米颗粒),优选10uci/(mg磁性纳米颗粒)~10mci/(mg磁性纳米颗粒);标记后的样品,即得到磁共振/核医学双模态分子影像探针,或进一步经超滤纯化或者脱盐柱纯化即得。
b、当放射性核素为金属放射性核素时,包括以下步骤:
1)将具有表面配体分子修饰的磁性纳米颗粒溶于水,颗粒质量浓度在1ug/ml~100mg/ml;优选0.1mg/ml~10mg/ml。
2)对具有表面配体分子修饰的磁性纳米颗粒,进行放射性核素金属离子标记;放射性核素金属离子的标记量在0.1uci/(mg磁性纳米颗粒)~100mci/(mg磁性纳米颗粒),优选10uci/(mg磁性纳米颗粒)~10mci/(mg磁性纳米颗粒);标记后的样品,即得到磁共振/核医学双模态分子影像探针,或进一步经超滤纯化或者脱盐柱纯化即得。
上述放射性核素的标记,采用目前常用的放射性核素标记方法,如99mtc和188re标记采用氯化亚锡还原法,125i与131i采用氯胺-t法或者iodogen法,111in、64cu采用直接混合标记法。
上述磁共振/核医学双模态分子影像探针的制备方法中,在标记率高的情况下,所得产品也可不经纯化直接使用。
本发明的磁共振/核医学双模态分子影像探针可用于磁共振和核医学双模态成像。
所述的表面配体分子中若含有可供进一步功能化修饰的基团,如羧基、氨基、巯基、炔基、马来酰亚胺基团、叠氮基团等,则所得到的磁共振/核医学双模态分子影像探针可以进一步耦联抗体、多肽等靶向分子,实现病灶部位的靶向现象。
所述的放射性核素若具有放射治疗作用,则所得磁共振/核医学双模态分子影像探针还可以在显像的同时,实现肿瘤的放射治疗。
有益效果:本发明提供的磁共振/核医学双模态分子影像探针,(1)通过简单的制备方法得到既具有磁共振成像又能核医学成像的双模态分子影像探针,有利于规模化制备;
(2)双模态分子影像探针中引入配位金属离子,与磁性纳米颗粒表面配体分子交联,能提高放射性核素对磁性纳米颗粒的标记稳定性。。
附图说明
图1.实施例1和实施例2所得水溶性磁性氧化铁纳米颗粒的电镜照片及粒径分布图;
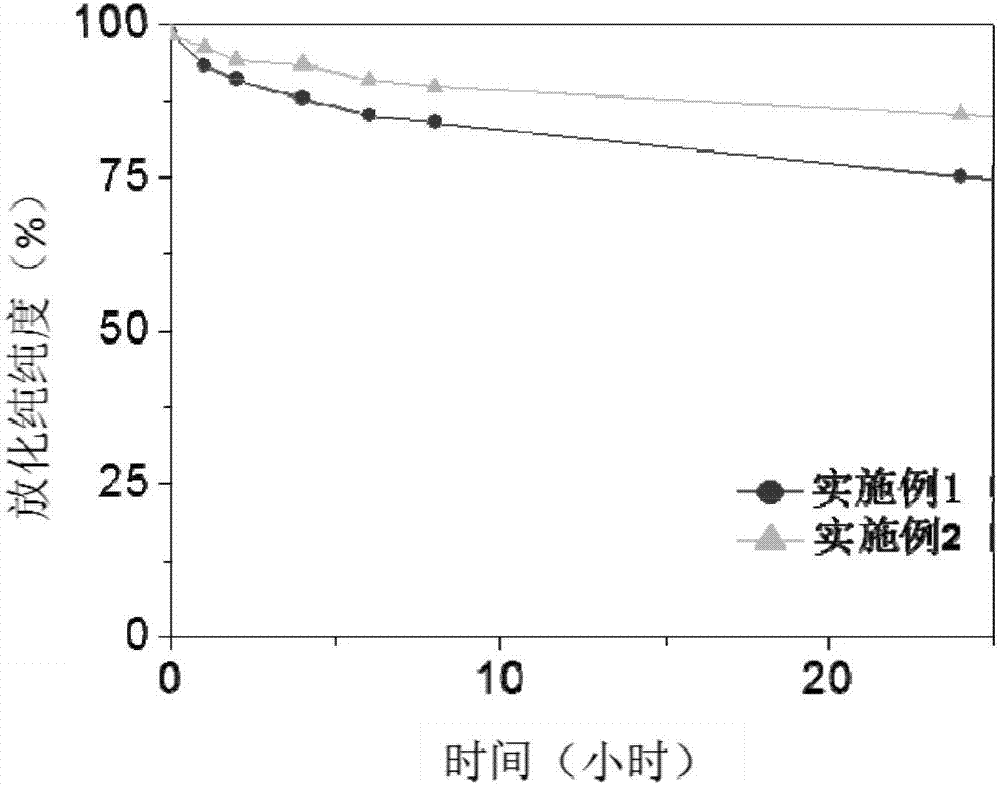
图2.实施例1和实施例2所得磁共振/核医学双模态分子影像探针的放射性标记稳定性曲线;
图3.实施例3所得磁共振/核医学双模态分子影像探针的放射性标记稳定性曲线;
图4.实施例3所得磁共振/核医学双模态分子影像探针在3t磁共振成像系统中的t1加权像和t2加权像;
图5.实施例3所得磁共振/核医学双模态分子影像探针经尾静脉注射到小鼠体内5分钟后所采集到的spect-ct图像;
图6.实施例5所得磁共振/核医学双模态分子影像探针经尾静脉注射到荷瘤鼠体内4小时后所采集到的spect-ct图像;
图7.实施例6所得油溶性磁性nagdf4:yb,er纳米颗粒的电镜照片及粒径分布图;
图8.实施例6所得磁共振/核医学双模态分子影像探针在3t磁共振成像系统中的t1加权像;
图9.实施例6所得磁共振/核医学双模态分子影像探针经尾静脉注射到小鼠体内1小时后所采集到的spect-ct图像。
具体实施方式
下面结合具体实施例对本发明作更进一步的说明。
实施例1
本实施例为对比试验,用以验证本专利的方案的可行性。
根据文献(advancedmaterials,2014,26,2694-2698)合成得到平均粒径为8nm的油溶性磁性氧化铁纳米颗粒,并通过配体交换的方式将一端为双磷酸基团、另一端为酚羟基的聚乙二醇2000修饰到磁性氧化铁纳米颗粒表面,而后配置成含铁浓度为1mg/ml的磁性纳米颗粒水溶液,所得水溶性磁性氧化铁纳米颗粒的电镜照片及粒径分布图如图1所示。取200ul上述纳米颗粒溶液,加入20ul超纯水,30min之后,采用氯胺-t法在纳米颗粒上进行放射性125i标记,具体步骤如下:在上述磁性纳米颗粒水溶液中,加入50ul浓度为100mm的tb缓冲溶液(ph=7.2),再加入10ul的na125i溶液(放射性活度1mci),混合均匀,再加入10ul10mg/ml的氯胺-t溶液(采用500mmpb缓冲液配置,ph=7.3),震荡反应2min后,采用100kd的超滤管超滤纯化2次即可得到125i标记的磁性氧化铁纳米颗粒,即磁共振/核医学双模态分子影像探针。纯化后所得产物的放化纯纯度为98.5%,其在水溶液中的放射性标记稳定性曲线如图2中所示。
实施例2
根据文献(advancedmaterials,2014,26,2694-2698)合成得到平均粒径为8nm的油溶性磁性氧化铁纳米颗粒,并通过配体交换的方式将一端为双磷酸基团、另一端为酚羟基的聚乙二醇2000修饰到磁性氧化铁纳米颗粒表面,而后配置成含铁浓度为1mg/ml的磁性纳米颗粒水溶液,所得水溶性磁性氧化铁纳米颗粒的电镜照片及粒径分布图如图1所示。取200ul上述纳米颗粒溶液,加入20ulgd离子浓度为1mg/ml的gdcl3水溶液,混合均匀后反应30min。之后采用氯胺-t法在纳米颗粒上进行放射性125i标记,具体步骤如下:在上述gd离子交联之后的磁性纳米颗粒水溶液中,加入50ul浓度为100mm的tb缓冲溶液(ph=7.2),再加入10ul的na125i溶液(放射性活度1mci),混合均匀,再加入10ul10mg/ml的氯胺-t溶液(采用500mmpb缓冲液配置,ph=7.3),震荡反应2min后,采用100kd的超滤管超滤纯化2次即可得到125i标记的磁性氧化铁纳米颗粒,即磁共振/核医学双模态分子影像探针。纯化后所得产物的放化纯纯度为98.3%,其在水溶液中的放射性标记稳定性曲线如图2中所示。
与实施例1中对比试验得到的125i标记的磁性氧化铁纳米颗粒相比,本实施例中得到的产物放射性标记稳定性更好,说明配位金属离子gd离子的加入,能够通过与双磷酸基团的配位作用交联磁性氧化铁纳米颗粒表面的聚乙二醇分子,增强聚乙二醇分子与磁性氧化铁纳米颗粒的结合能力,从而提高所得产物的放射性标记稳定性。
实施例3
根据文献(advancedmaterials,2014,26,2694-2698)合成得到平均粒径为3.5nm的油溶性磁性氧化铁纳米颗粒,并通过配体交换的方式将一端为双磷酸基团、另一端为甲氧基的聚乙二醇5000修饰到磁性氧化铁纳米颗粒表面,而后配置成含铁浓度为1mg/ml的磁性纳米颗粒水溶液。取200ul上述纳米颗粒溶液,采用氯化亚锡还原法在纳米颗粒上进行放射性99mtc标记,具体步骤如下:取100ul的na99mtco4溶液(放射性活度2mci),加入20ul1mg/ml的氯化亚锡溶液(采用0.1m的盐酸配置),混匀反应5min,而后加入所取磁性纳米颗粒水溶液,混合均匀,室温反应30min后,采用100kd的超滤管超滤纯化2次即可得到99mtc标记的磁性氧化铁纳米颗粒。纯化后所得产物的放化纯纯度为99.2%,其在水溶液中的放射性标记稳定性曲线如图3中所示。
本实施例中首先制备油溶性的磁性氧化铁纳米颗粒,而后通过配体交换方法获得水溶性的磁性氧化铁纳米颗粒,利用99mtc离子与双磷酸基团的配位作用,将99mtc离子标记到磁性氧化铁纳米颗粒的表面配体分子上,99mtc不仅可以放射γ射线进行核医学成像,同时99mtc离子与双磷酸基团的配位可以交联磁性纳米颗粒表面的聚乙二醇分子,增强其与磁性纳米颗粒的结合能力,获得高放射性标记稳定性的磁共振/核医学双模态分子影像探针。与实施例1中得到的125i标记的磁性氧化铁纳米颗粒相比,本实施例中得到的产物放射性标记稳定性更好。同时,本实施例也比实施例2中的所得的产物放射性标记稳定性好,这是由于放射性99mtc离子作为配位金属离子,其比gd离子具有更强的与双磷酸基团的结合能力,能够进一步增强聚乙二醇分子与磁性氧化铁纳米颗粒的结合能力,因此放射性标记稳定性更高。
图4是采用3t磁共振成像系统得到的不同浓度磁共振/核医学双模态分子影像探针的t1加权像和t2加权像,由于所制备的磁性氧化铁纳米颗粒尺寸较小,因此既有t1磁共振增强性能,也具有t2磁共振增强性能。图5是所得磁共振/核医学双模态分子影像探针经尾静脉注射到小鼠体内5分钟后,利用spect成像系统采集到的图像。
实施例4
根据文献(journaloftheamericanchemicalsociety,2011,133,19512-19523),通过“一锅法”合成得到平均粒径为8nm的双羧基聚乙二醇2000修饰的磁性氧化铁纳米颗粒,将所得磁性氧化铁纳米颗粒配置成含铁浓度为2mg/ml的水溶液,采用直接标记法进行放射性111in标记,具体步骤如下:取20ul111incl3溶液(放射性活度300uci),直接加入到100ul上述磁性氧化铁纳米颗粒水溶液中,混匀室温反应10min后,采用30kd的超滤管超滤纯化2次即可得到111in标记的磁性氧化铁纳米颗粒。纯化后所得产物的放化纯纯度为99.5%。
本实施例中采用一步法制备得到磁性氧化铁纳米颗粒,利用111in离子与羧基的配位作用,通过简单的混合就可以将111in离子标记到磁性氧化铁纳米颗粒的表面配体分子上,111in不仅可以放射γ射线进行核医学成像,同时111in离子与羧基的配位可以交联磁性纳米颗粒表面的双羧基聚乙二醇分子,增强其与磁性纳米颗粒的结合能力,获得高放射性标记稳定性的磁共振/核医学双模态分子影像探针。
实施例5
根据文献(advancedfunctionalmaterials,2012,22,2387-2393),通过一步反应合成得到平均粒径为3nm的巯基功能化聚甲基丙烯酸7500修饰的磁性氧化铁纳米颗粒,将所得磁性氧化铁纳米颗粒配置成含铁浓度为2mg/ml的水溶液,采用氯化亚锡还原法在纳米颗粒上进行放射性99mtc标记,具体步骤如下:取100ul的na99mtco4溶液(放射性活度2mci),加入20ul1mg/ml的氯化亚锡溶液(采用0.1m的盐酸配置),混匀反应5min,而后加入100ul上述磁性纳米颗粒水溶液,混合均匀,室温反应30min后,采用100kd的超滤管超滤纯化2次即可得到99mtc标记的磁性氧化铁纳米颗粒。纯化后所得产物的放化纯纯度为98.4%。
本实施例中采用一步法制备得到磁性氧化铁纳米颗粒,利用99mtc离子与羧基以及巯基的配位作用,将99mtc离子标记到磁性氧化铁纳米颗粒的表面配体分子上,99mtc不仅可以放射γ射线进行核医学成像,同时99mtc离子与羧基以及巯基的配位可以交联磁性纳米颗粒表面的巯基功能化聚甲基丙烯酸分子,增强其与磁性纳米颗粒的结合能力,获得高放射性标记稳定性的磁共振/核医学双模态分子影像探针。图6是所得磁共振/核医学双模态分子影像探针经尾静脉注射到荷瘤鼠体内4小时后,利用spect成像系统采集到的图像,可以看到肿瘤部位有明显的信号富集,说明所得探针具有很好的核医学成像效果。
实施例6
根据文献(acsnano,2013,7,7227-7240)合成得到平均粒径为16nm的油溶性磁性nagdf4:yb,er纳米颗粒,其电镜照片及粒径分布图如图7所示。并通过配体交换的方式将一端为双磷酸基团、另一端为甲氧基的聚乙二醇2000修饰到磁性nagdf4:yb,er纳米颗粒表面,而后配置成含gd浓度为1mg/ml的磁性纳米颗粒水溶液采用氯化亚锡还原法在纳米颗粒上进行放射性99mtc标记,具体步骤如下:取100ul的na99mtco4溶液(放射性活度2mci),加入20ul1mg/ml的氯化亚锡溶液(采用0.1m的盐酸配置),混匀反应5min,而后200ul上述磁性纳米颗粒水溶液,混合均匀,室温反应15min后,采用100kd的超滤管超滤纯化2次即可得到99mtc标记的磁性nagdf4:yb,er纳米颗粒。纯化后所得产物的放化纯纯度为98.9%。图8是采用3t磁共振成像系统得到的不同浓度磁共振/核医学双模态分子影像探针的t1加权像,从图中可以看到,所得探针具有较好的t1磁共振增强效果。图9是所得磁共振/核医学双模态分子影像探针经尾静脉注射到小鼠体内1小时后,利用spect成像系统采集到的图像。
实施例7
根据文献(advancedmaterials,2014,26,2694-2698)合成得到平均粒径为11nm的油溶性磁性氧化铁纳米颗粒,并通过配体交换的方式将一端为邻苯三酚基团、另一端为甲氧基的聚乙二醇5000修饰到磁性氧化铁纳米颗粒表面,而后配置成含铁浓度为1mg/ml的磁性纳米颗粒水溶液。取200ul上述纳米颗粒溶液,加入10ulfe离子浓度为1mg/ml的fecl3水溶液,混合均匀后反应10min。之后采用氯胺-t法在纳米颗粒上进行放射性131i标记,具体步骤如下:在上述fe离子交联之后的磁性纳米颗粒水溶液中,加入50ul浓度为100mm的tb缓冲溶液(ph=7.2),再加入50ul的na131i溶液(放射性活度1mci),混合均匀,再加入10ul10mg/ml的氯胺-t溶液(采用500mmpb缓冲液配置,ph=7.3),震荡反应2min后,采用100kd的超滤管超滤纯化2次即可得到131i标记的磁性氧化铁纳米颗粒,即磁共振/核医学双模态分子影像探针。纯化后所得产物的放化纯纯度为99.1%。
实施例8
根据文献(acsnano,2013,7,330-338)合成得到平均粒径为15nm的油溶性磁性nagdf4纳米颗粒,并通过配体交换的方式将一端为双磷酸基团、另一端为甲氧基的聚乙二醇2000修饰到磁性nagdf4纳米颗粒表面,而后配置成含gd浓度为2mg/ml的磁性纳米颗粒水溶液。采用氯化亚锡还原法在纳米颗粒上进行放射性188re标记,具体步骤如下:取50ul的na188reo4溶液(放射性活度2mci),加入10ul1mg/ml的氯化亚锡溶液(采用0.1m的盐酸配置),混匀反应5min,而后加入100ul上述磁性纳米颗粒水溶液,混合均匀,室温反应15min后,采用100kd的超滤管超滤纯化2次即可得到188re标记的磁性nagdf4纳米颗粒。纯化后所得产物的放化纯纯度为99.0%。
本实施例中利用188re离子与双磷酸基团的配位作用,将188re离子标记到磁性nagdf4纳米颗粒的表面配体分子上,188re不仅可以放射γ射线进行核医学成像,同时188re离子与双磷酸基团的配位可以交联磁性纳米颗粒表面的聚乙二醇分子,增强其与磁性纳米颗粒的结合能力,获得高放射性标记稳定性的磁共振/核医学双模态分子影像探针。此外,188re在放射γ射线的同时,还可以放射β射线,具有肿瘤细胞杀伤作用,因此,所得的磁共振/核医学双模态分子影像探针在进行双模成像的同时,还可以用作肿瘤的放射治疗。
实施例9
根据文献(naturemedicine,2007,13,95-99)合成得到平均粒径为12nm的油溶性磁性mnfe2o4纳米颗粒,并通过配体交换的方式将巯基丁二酸修饰到磁性氧化铁纳米颗粒表面,而后配置成含铁浓度为2mg/ml的磁性纳米颗粒水溶液。采用氯化亚锡还原法在纳米颗粒上进行放射性99mtc标记,具体步骤如下:取100ul的na99mtco4溶液(放射性活度2mci),加入20ul1mg/ml的氯化亚锡溶液(采用0.1m的盐酸配置),混匀反应5min,而后100ul上述磁性纳米颗粒水溶液,混合均匀,室温反应15min后,采用100kd的超滤管超滤纯化2次即可得到99mtc标记的磁性mnfe2o4纳米颗粒。纯化后所得产物的放化纯纯度为99.2%。
以上所述仅是本发明的优选实施方式,应当指出:对于本技术领域的普通技术人员来说,在不脱离本发明原理的前提下,还可以做出若干改进和润饰,这些改进和润饰也应视为本发明的保护范围。
- 还没有人留言评论。精彩留言会获得点赞!