一种利格列汀及其盐、酯、衍生物的药物组合物及其制备方法与流程
本发明涉及一种包含利格列汀及其盐、酯、衍生物的药物组合物及其制备方法,属于药物领域。
背景技术:
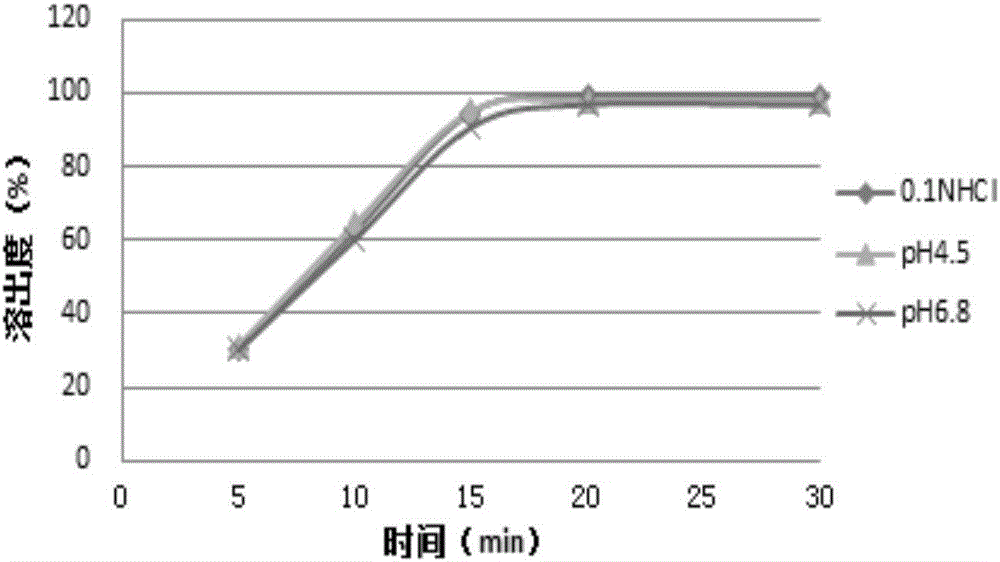
:肠促胰岛素(glp-1)因其有促进β-细胞分化、抑制胃排空等多种功能,被认为是治疗糖尿病很有前景的新药之一,但因人体内的dppⅳ(二肽基肽酶4)可以快速地使glp-1失活,所以其应用受到限制。近年来,研究发现dppⅳ抑制剂可以成功抑制dppⅳ活性,促进β-细胞再生,抑制β-细胞凋亡,dppⅳ因此成为了治疗ⅱ型糖尿病新的靶点,dppⅳ抑制剂成为治疗糖尿病的新药。利格列汀是勃林格殷格翰公司研发的一种选择性dppⅳ抑制剂。与其他已上市的dppⅳ抑制剂相比,该药物具有明显的优势:主要经粪便排泄,因此其使用者无需定期检查肾功能和相应调整用药剂量,所有用药者可统一固定剂量,更便于开处方;耐受性良好,不会增加药物间相互作用风险;而更为重要的是,其单用或与其他降糖药物联用均不会增加低血糖风险,且与二甲双胍联用时可产生强效作用。技术实现要素:本发明提供了一种利格列汀药物组合物。针对现有技术中存在的缺陷,本发明避免了预胶化淀粉、共聚乙烯吡咯烷酮的使用,同时解决了原造粒方法工序繁琐以及粘合剂加入量不确定等问题。本发明的利格列汀药物组合物,包含利格列汀或其盐、酯、衍生物以及可药用的稀释剂、粘合剂、崩解剂及润滑剂,其中所述稀释剂包含一种稀释剂。本发明所述组合物主要包含下述重量百分含量的原辅料:利格列汀或其盐、酯、衍生物0.5-20%优选地:利格列汀或其盐、酯、衍生物0.5-10%其中,本发明所述的稀释剂为纤维素粉末、无水磷酸氢钙、二水合磷酸氢钙、木糖醇、羟丙基纤维素、甘露醇或者木糖醇中的一种,优选为甘露醇或木糖醇中一种;所述润滑剂为滑石粉、聚乙二醇、山嵛酸钙、硬脂酸钙、氢化蓖麻油或硬脂酸镁中的一种或多种,优选为硬脂酸镁或滑石粉的两种或一种;所述粘合剂为淀粉、羟丙基甲基纤维素或羟丙基纤维素中的一种或多种;所述崩解剂为淀粉、羧甲淀粉钠、交联羧甲基纤维素钠或羟丙基纤维素中的一种或多种。进一步地,上述利格列汀药物组合物由下述重量百分含量的原辅料制备而成:或,或,或或或或或本发明所述利格列汀药物组合物还可以由下述重量百分含量的原辅料制备而成:或或或或或或或或或或应当说明,本发明上述百分比为重量百分比。本发明的药物组合物可为口服制剂,任选为胶囊剂、颗粒剂、片剂或膜包衣片剂,优选为片剂。本发明的利格列汀药物组合物用于制备治疗糖尿病的药物的用途,本发明的利格列汀药物组合物可任选与二甲双胍和/或磺脲类药物联合使用治疗糖尿病。所述糖尿病特别是ii型糖尿病,特别伴有肾功能或肝功能受损患者的ii型糖尿病;本发明还提供了一种利格列汀药物组合物的制备方法如下:1)将利格列汀或其盐、酯、衍生物,稀释剂、粘合剂、崩解剂混合,制备成预混物;采用任选润湿剂对预混物进行造粒处理;然后向制得的颗粒中添加润滑剂,混合;最后经压片,包衣,即得利格列汀药物组合物;或2)将利格列汀或其盐、酯、衍生物,稀释剂、崩解剂、润滑剂、粘合剂依次混合,不经过造粒处理直接进行压片、包衣,进而得到利格列汀药物组合物;进一步地,所述生产工艺包含如下步骤:a、预混物:将利格列汀、稀释剂、粘合剂、崩解剂混合,制备成预混物;b、造粒:向预混物中加入任选润湿剂润湿,经过制粒、干燥及整粒等步骤制备得到颗粒;其中所述润湿剂为任选水、乙醇、甲醇、异丙醇或丙酮中一种或多种,优选为水;应当说明,润湿剂为挥发性组分,其并不保留于最终产物中。将步骤b混合物通过湿法混合制粒机进行制粒,干燥工艺任选在流化床干燥器中进行;所述干燥温度为40-75℃。任选包含步骤c、过筛:将步骤b制备得到的颗粒过筛;d、混合:向颗粒中添加润滑剂,混合均匀;e、压片:将步骤d中的混合物压制成为片剂;任选的,所述片剂还可包含如下步骤:f、制备包衣悬液,包衣;其中,包衣悬液中主要包含成膜剂、增塑剂、遮光剂、着色剂;步骤c中,所述过筛的筛孔尺寸为不大于0.6mm;步骤f中,所述包衣悬液的重量百分含量为利格列汀组合物的2-5%;所述成膜剂选自羟丙甲纤维素、羟丙基纤维素、丙基甲基纤维素、甲基纤维素和乙基纤素中的一种或多种;增塑剂选自聚乙二醇,丙二醇,柠檬酸三乙酯、三乙酸甘油酯中的一种或多种;遮光剂选自二氧化钛;着色剂选自颜料、无机颜料、fd&c红色3号、fd&c红色20号、fd&c黄色6号、fd&c蓝色2号、d&c绿色5号、d&c橙色5号、d&c红色8号、焦糖、氧化铁红、氧化铁黄和二氧化铁中的一种或多种;进一步地。包衣悬液中主要包含欧巴代i或欧巴代ii;可选地,在步骤f的混合之前添加作为外加颗粒的部分赋形剂,例如部分崩解剂和/或稀释剂。在此方法的另一替代形式中,步骤a至d的颗粒在一锅高切应力造粒方法中产生且随后在一锅造粒机中干燥。对于制备胶囊而言,将步骤d所得的混合物进一步填充至胶囊中即可。在尝试制备dppⅳ抑制剂的药物组合物中,发明人发现dppⅳ抑制剂在制剂过程中出现了不同程度稳定性问题,例如降解或萃取问题等,特别是具有伯氨基或仲氨基的dppⅳ抑制剂表现特别明显,而本发明的利格列汀作为dppⅳ抑制剂中的一种,具备这类化合物的核心骨架,其结构中存在的氨基、仲胺基、叔胺基等官能团使得利格列汀在制剂时同样面临着上述的困难。因此,选择合适的辅料或者优化制剂的工艺成为了一个亟待解决的问题。cn101437493a公开的dppⅳ抑制剂的药物组合物及其制备方法,其中存在着明显的缺陷。首先,发明人发现,cn101437493a的组合物中使用的稀释剂种类较多,尤其是第二稀释剂预胶化淀粉不仅增加了制剂的风险还增加了制剂成本。虽然预胶化淀粉作为一种性质优良的多功能辅料在片剂与胶囊等固体制剂的生产中得到了广泛应用,但是由于现有技术中对预胶化程度控制不严格,导致不同厂家生产的预胶化淀粉的预胶化程度不同,造成药物溶出受预胶化淀粉的种类、来源影响较大,质量控制较为困难,而国外的预胶化淀粉价格较高,使用会明显增加成本。其次,发明人在研究dppⅳ抑制剂制剂稳定性的过程中,发现作为粘合剂使用的共聚乙烯吡咯烷酮中含有大量酰胺基团,该基团会与dppⅳ抑制剂中的n原子形成分子内氢键,从而影响药物的溶出;此外,共聚维酮杂质中含有的醛基,也会对药物的稳定性及溶出产生一定影响。最后,发明人在制剂过程中,发现现有技术制备该药物组合物时需先将粘合剂溶解于溶剂中以产生造粒液,然后以造粒液体润湿预混物随后进行造粒。这种造粒方式的缺陷,一是工序较多,影响生产效率;二是可能导致粘合剂的加入量不确定。现有技术中存在的以上三方面的缺陷为制剂带来了诸如生产成本和工序增加、产品质量和生产效率下降等问题。本发明通过对现有技术的改进,主要带来了以下的有益效果:本发明结合原料药利格列汀的理化特点,对辅料进行了筛选,通过对稀释剂、粘合剂、崩解剂及润滑剂的巧妙选择,减少了辅料的种类,避免了预胶化淀粉的使用,克服了预胶化淀粉带来的风险大、质量难以控制的缺陷;本发明还克服了国内的共聚维酮来源少,进口价格昂贵的缺陷,在本发明处方中避免使用共聚维酮、或者将几乎全靠进口的共聚维酮替换为羟丙基纤维素,其价格不到共聚维酮的1/4,显著地降低了成本,避免了共聚维酮对本发明活性成分带来的质量问题;。现有技术在制备同类型药物组合物时通常做法是先将粘合剂溶解于溶剂中以产生造粒液,然后以造粒液体润湿预混物,随后进行造粒。由于预混物溶解于少量溶剂中的速度较慢,花费时间长,会导致生产周期延长,降低生产效率;此外,在制备过程中需要对溶剂用量进行调节,这样会导致已与部分造粒液混合的预混物中的粘合剂的加入量不准确。本发明在制备时将粘合剂直接与利格列汀、稀释剂及崩解剂混合,然后再加入润湿剂,避免了多次润湿操作,简化了工序,提高了生产效率和产品质量。本发明制备的利格列汀药物组合物显示具有较优的溶出度,有利于提高利格列汀药物的生物利用度;药物组合物中利格列汀含量更高,在60℃温度放置10天后,本发明制备的利格列汀药物组合物的单杂和总杂含量升高很少,降低了药物毒性,提高用药安全性;本申请的利格列汀药物组合物、制剂处方及其制备工艺方法稳定,重现性好,多批次生产的一致性高,能够确保产品质量稳定可控;改善了不同批次产品对于不同人群(如胃酸分泌不足患者)可能造成体内吸收的差异,有利于实现制剂放大工业化。显然,根据本发明的上述内容,按照本领域的普通技术知识和惯用手段,在不脱离本发明上述基本技术思想前提下,还可以做出其它多种形式的修改、替换或变更。附图说明图1对比例1制备的利格列汀药物组合物产品在不同溶出介质中的溶出曲线图2实施例3制备的利格列汀药物组合物产品在不同溶出介质中的溶出曲线图3不同批次市售利格列汀制剂产品在0.1n的hcl溶液中的溶出曲线图4实施例3制备的不同批次的利格列汀药物组合物产品在0.1n的hcl溶液中的溶出曲线具体实施方式以下通过实施例形式的具体实施方式,对本发明的上述内容作进一步的详细说明。但不应将此理解为本发明上述主题的范围仅限于以下的实例。凡基于本发明上述内容所实现的技术均属于本发明的范围。以下实施例中润湿剂为水;包衣悬液中主要包含羟丙甲纤维素、滑石粉、二氧化钛、聚乙二醇。实施例1本发明药物组合物的制备[制备工艺]a、将利格列汀、甘露醇、羟丙基纤维素混合制备成预混物;b、将硬脂酸镁添加至以上混粉中进行最终混合;c、将该最终混合物压制成片芯;d、制备包衣悬液;e、将该片芯以该包衣悬浮液包衣至增重约2-4%以产生膜包衣片剂。实施例2本发明药物组合物的制备[制备工艺]a、将利格列汀、甘露醇、羟丙基甲基纤维素及淀粉混合制备成预混物;b、将a步骤制备的预混物,加入润湿剂润湿,造粒;c、过筛:将b步骤制备的颗粒通过筛孔尺寸20目的筛进行筛分,将颗粒于约60℃以下干燥,直至所需干燥失重值达到0.5-2%的范围内为止,将干燥颗粒经20目筛进行筛分;d、将硬脂酸镁添加至颗粒中进行最终混合;e、将该最终混合物压制成片芯;f、制备包衣悬液,将该片芯以该包衣悬浮液包衣至增重约2-4%以产生膜包衣片剂。实施例3本发明药物组合物的制备[制备工艺]a、将利格列汀、甘露醇、羟丙基甲基纤维素及淀粉混合制备成预混物;b、将a步骤制备的预混物,加入润湿剂润湿,造粒;c、过筛:将b步骤制备的颗粒通过筛孔尺寸20目的筛进行筛分,将颗粒于约60℃以下干燥,直至所需干燥失重值达到0.5-2%的范围内为止,将干燥颗粒经20目筛进行筛分;d、将硬脂酸镁添加至颗粒中进行最终混合;e、将该最终混合物压制成片芯;f、制备包衣悬液,将该片芯以该包衣悬浮液包衣至增重约2-4%以产生膜包衣片剂。实施例4本发明药物组合物的制备[制备工艺]a、将利格列汀、甘露醇、羟丙基甲基纤维素混合制备成预混物;b、将淀粉加水制为约10%浓度淀粉浆,向预混物中加入淀粉浆造粒;c、过筛:将b步骤制备的颗粒通过筛孔尺寸20目的筛进行筛分,将颗粒于约60℃以下干燥,直至所需干燥失重值达到0.5-2%的范围内为止,将干燥颗粒经20目筛进行筛分;d、将硬脂酸镁添加至颗粒中进行最终混合;e、将该最终混合物压制成片芯;f、制备包衣悬液,将该片芯以该包衣悬浮液包衣至增重约2-4%以产生膜包衣片剂。实施例5本发明药物组合物的制备[制备工艺]a、将利格列汀、甘露醇、羟丙甲基纤维素、羟丙基纤维素混合制备成预混物;b、将a步骤制备的预混物,加入润湿剂润湿,造粒,c、过筛:将b步骤制备的颗粒通过筛孔尺寸20目的筛进行筛分,将颗粒于约60℃以下干燥,直至所需干燥失重值达到0.5-2%的范围内为止,将干燥颗粒经20目筛进行筛分;d、将硬脂酸镁添加至颗粒中进行最终混合;e、将该最终混合物压制成片芯;f、制备包衣悬液,将该片芯以该包衣悬浮液包衣至增重约3-4%以产生膜包衣片剂。实施例6本发明药物组合物的制备[制备工艺]a、将利格列汀、甘露醇、羟丙甲基纤维素、羧甲基淀粉钠混合制备成预混物;b、将a步骤制备的预混物,加入润湿剂润湿,造粒;c、过筛:将b步骤制备的颗粒通过筛孔尺寸20目的筛进行筛分,将颗粒于约60℃以下干燥,直至所需干燥失重值达到0.5-2%的范围内为止,将干燥颗粒经20目筛进行筛分;d、将硬脂酸镁添加至颗粒中进行最终混合;e、将该最终混合物压制成片芯;f、制备包衣悬液,将该片芯以该包衣悬浮液包衣至增重约3-4%以产生膜包衣片剂实施例7本发明药物组合物的制备[制备工艺]a、将利格列汀、甘露醇、羟丙甲纤维素、交联羧甲基纤维素钠混合制备成预混物;b、将a步骤制备的预混物,加入润湿剂润湿,造粒;c、过筛:将b步骤制备的颗粒通过筛孔尺寸20目的筛进行筛分,将颗粒于约60℃以下干燥,直至所需干燥失重值达到0.5-2%的范围内为止,将干燥颗粒经20目筛进行筛分;d、将硬脂酸镁添加至颗粒中进行最终混合;e、将该最终混合物压制成片芯;f、制备包衣悬液,将该片芯以该包衣悬浮液包衣至增重约3-4%以产生膜包衣片剂实施例8本发明药物组合物的制备[制备工艺]a、将利格列汀、木糖醇、低取代羟丙基纤维素及淀粉混合制备预混物;b、将a步骤制备的预混物,加入润湿剂润湿,造粒;c、过筛:将b步骤制备的颗粒通过筛孔尺寸20目的筛进行筛分,将颗粒于约60℃以下干燥,直至所需干燥失重值达到0.5-2%的范围内为止,将干燥颗粒经20目筛进行筛分;d、将硬脂酸镁添加至颗粒中进行最终混合;e、将该最终混合物压制成片芯;f、制备包衣悬液,将该片芯以该包衣悬浮液包衣至增重约3-4%以产生膜包衣片剂。实施例9本发明药物组合物的制备[制备工艺]a、将利格列汀、木糖醇、羟丙基甲基纤维素及淀粉混合制备预混物;b、将a步骤制备的预混物,加入润湿剂润湿,造粒;c、过筛:将b步骤制备的颗粒通过筛孔尺寸20目的筛进行筛分,将颗粒于约60℃以下干燥,直至所需干燥失重值达到0.5-2%的范围内为止,将干燥颗粒经20目筛进行筛分;d、将硬脂酸镁添加至颗粒中进行最终混合;e、将该最终混合物压制成片芯;f、制备包衣悬液,将该片芯以该包衣悬浮液包衣至增重约2-4%以产生膜包衣片剂。实施例10本发明药物组合物的制备[制备工艺]a、将利格列汀、木糖醇、羟丙基纤维素及交联羧甲基纤维素钠混合制备预混物;b、将a步骤制备的预混物,加入润湿剂润湿,造粒;c、过筛:将b步骤制备的颗粒通过筛孔尺寸20目的筛进行筛分,将颗粒于约60℃以下干燥,直至所需干燥失重值达到0.5-2%的范围内为止,将干燥颗粒经20目筛进行筛分;d、将硬脂酸镁添加至颗粒中进行最终混合;e、将该最终混合物压制成片芯;f、制备包衣悬液,将该片芯以该包衣悬浮液包衣至增重约3-4%以产生膜包衣片剂。实施例11本发明药物组合物的制备[制备工艺]a、将利格列汀、木糖醇、羟丙基甲基纤维素及羧甲淀粉钠混合制备预混物;b、将a步骤制备的预混物,加入润湿剂润湿,造粒;c、过筛:将b步骤制备的颗粒通过筛孔尺寸20目的筛进行筛分,将颗粒于约60℃以下干燥,直至所需干燥失重值达到0.5-2%的范围内为止,将干燥颗粒经20目筛进行筛分;d、将硬脂酸镁添加至颗粒中进行最终混合;e、将该最终混合物压制成片芯;f、制备包衣悬液,将该片芯以该包衣悬浮液包衣至增重约2-4%以产生膜包衣片剂。对比例1[制备工艺]a、将利格列汀、甘露醇、淀粉、预胶化淀粉混合制备预混物;将共聚维酮溶于纯水中作为粘合剂使用;b、将a步骤制备的预混物,加入粘合剂润湿后造粒;c、过筛:将b步骤制备的颗粒通过筛孔尺寸20目的筛进行筛分,将颗粒于约60℃以下干燥,直至所需干燥失重值达到0.5-2%的范围内为止,将干燥颗粒经20目筛进行筛分;d、将硬脂酸镁添加至颗粒中进行最终混合;e、将该最终混合物压制成片芯;f、制备包衣悬液,将该片芯以该包衣悬浮液包衣至增重约2-4%以产生膜包衣片剂。以下通过试验检测对比本发明利格列汀组合物以及对比例1的相关质量参数,以证明本发明的有益效果。1.溶出度检测方法:参照中国药典2015年版四部附录0931第一法进行检验。中国药典2015年版四部附录0931第一法为篮法,转速为50rpm。2.含量及杂质测定方法:参照中国药典2010年版二部附录vd测定。试验例1:根据上述检测方法,在溶出介质为0.1n的hcl溶液中,对由本发明制备的利格列汀药物组合物和对比例1制备的利格列汀药物组合物的溶出度和利格列汀含量进行检测,检测结果见表1。表1实施例3实施例4实施例5实施例6对比例1溶出度(%)98.098.998.699.195.3利格列汀含量(%)99.699.799.899.698.7表1试验数据显示,在0.1n的hcl溶液中,本发明制备的利格列汀药物组合物溶出度在98%以上,优于对比例1的95.3%的溶出度;本发明制备的利格列汀药物组合物中利格列汀含量在99.5%以上,高于对比例1的98.7%的含量。根据上述检测方法,以本发明实施例4为例,将由本发明制备的利格列汀药物组合物和对比例1制备的利格列汀药物组合物在60℃温度下进行放置10天后对杂质含量(有关物质)进行检测,分析比较组合物中杂质含量相比于0天时的杂质增长率,结果见表2。最大单杂增长率%=(10天时最大单杂含量-0天时最大单杂含量)/0天时最大单杂含量%;总杂增长率%=(10天时总杂含量-0天时总杂含量)/0天时总杂含量%;表2实施例4对比例1最大单杂增长率:(%)0200总杂增长率(%)33.3100表2试验数据显示,在60℃温度放置10天后,相对于对比例1制备的利格列汀药物组合物中,最大单杂含量增长了200%,总杂含量增长了100%;本发明实施例4制备的利格列汀药物组合物中最大单杂含量无增长,总杂的含量增长了33.3%;本发明实施例4制备的利格列汀药物组合物的最大单杂和总杂的含量增长率明显低于对比例1制备的利格列汀药物组合物中最大单杂和总杂含量增长率。综合表1和表2结果表明,相对于对比例1制备的利格列汀药物组合物,本发明制备的利格列汀药物组合物显示具有较优的溶出度;药物组合物中利格列汀含量更高;在60℃温度放置10天后,本发明制备的利格列汀药物组合物的单杂和总杂含量的增长率显著低于对比例1制备的利格列汀药物组合物单杂和总杂含量的增长率。有利于提高利格列汀药物的生物利用度,降低药物毒性,提高用药安全性;有利于实现利格列汀药物组合物的制剂放大工业化。本申请技术方案的利格列汀药物组合物具有与上述相类似的溶出度和杂质含量特性,同样有利于利格列汀药物的生物利用度,降低药物毒性,提高用药安全性和实现制剂放大工业化。试验例2:根据上述检测方法,对由本发明制备的利格列汀药物组合物和对比例1制备的利格列汀药物组合物和市售利格列汀制剂产品进行不同介质中溶出曲线的检测。将同批次的对比例1制备的利格列汀药物组合物和本发明实施例3制备的利格列汀药物组合物,在0.1n的hcl溶液(ph1.0)、ph4.5醋酸盐缓冲液和ph6.8磷酸盐缓冲液中分别进行溶出曲线测定,如图1和图2所示。取不同批次的市售利格列汀制剂产品,和三个批次的本发明以实施例3制备的利格列汀药物组合物,在0.1n的hcl溶液中对上述产品进行溶出曲线测定,考察产品不同批次的批间一致性,如图3和图4所示。图1的溶出曲线显示,同一批次的对比例1制备的利格列汀药物组合物在不同溶出介质0.1n的hcl溶液(ph1.0)、ph4.5醋酸盐缓冲液和ph6.8磷酸盐缓冲液中溶出曲线之间存在较大差异。图2的溶出曲线显示,同一批次的本发明实施例3制备的利格列汀药物组合物在不同溶出介质0.1n的hcl溶液(ph1.0)、ph4.5醋酸盐缓冲液和ph6.8磷酸盐缓冲液中溶出曲线基本一致。图3的溶出曲线显示,在0.1n的hcl溶液中,三批不同批次的市售利格列汀制剂产品的溶出曲线具有明显差异性,批间差异较大。图4的溶出曲线显示,在0.1n的hcl溶液中,三批次的本发明实施例3制备的利格列汀药物组合物的溶出曲线基本一致。综合图1至图4的溶出曲线说明,与对比例1制备的利格列汀药物组合物以及市售的利格列汀制剂产品相比,本发明实施例3制备的利格列汀药物组合物产品,不同批次的利格列汀药物组合物产品溶出行为具有很好的一致性;同批次的利格列汀药物组合物产品在不同介质中溶出行为同样具有较好的一致性。说明本申请的利格列汀药物组合物、制剂处方及其制备工艺方法稳定,重现性好,多批次生产的一致性高,能够确保产品质量稳定可控;改善了不同批次产品对于不同人群(如胃酸分泌不足患者)可能造成体内吸收的差异。本申请技术方案的利格列汀药物组合物具有与上述相类似的溶出性质。当前第1页12
相关技术
网友询问留言
已有0条留言
- 还没有人留言评论。精彩留言会获得点赞!
1