疫苗制剂的制作方法
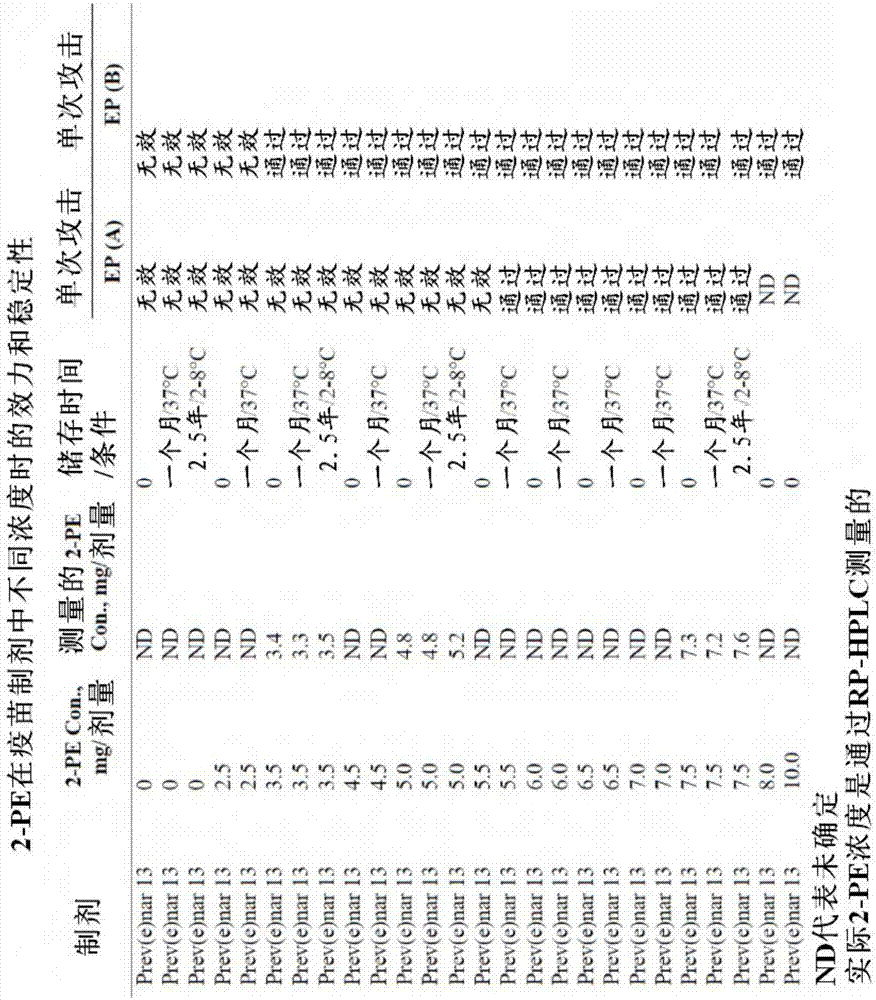
本申请是申请日为2011年5月25日的第201180027663.7号发明名称为“疫苗制剂”的中国专利申请的分案申请。发明背景由细菌肺炎链球菌(streptococcuspneumoniae)(也被称为肺炎球菌(pneumococcus))导致的肺炎球菌疾病是全球较重要的细菌病原体之一。该疾病负担在没有疫苗的发展中国家的5岁以下儿童中是高的。肺炎球菌疾病是复合的病群,包括侵袭性感染诸如菌血症/脓毒症、脑膜炎、肺炎和中耳炎,其既侵袭儿童又侵袭成人。prevnar13(也称为“prevenar13”,以及在本文被称为“prev(e)nar13”)是来自13种肺炎球菌血清型(1,3,4,5,6a,6b,7f,9v,14,18c,19a,19f和23f)、分别与crm19(来自白喉棒状杆菌(corynebacterimdiphtheriae)突变株的交叉反应物质)缀合的多糖制剂。prev(e)nar13被推荐用于婴儿和幼儿的主动免疫以提供对任何肺炎球菌缀合疫苗的宽广血清型覆盖。尤其是,prev(e)nar13中的血清型19a在世界的许多地区流行,并经常与抗生素抗性有关。参见,例如wo2006/110381;wo2008/079653;wo2008/079732;wo2008/143709以及其中引用的参考文献。硫柳汞(thimerosal)(也称为邻乙汞硫基苯酸钠(thiomersal)、硫柳汞(merthiolate))是含乙基汞的防腐剂,其从20世纪30年代早期已被添加至许多多剂量可注射制剂和局部溶液以保护它们在暴露期以及当给予多重个体时免受潜在的污染。在美国和世界的其他国家,硫柳汞作为强制免疫的部分以及在其他药物产品中继续被施用。据称它在疫苗领域的产品多次使用期间是用于消除潜在的污染菌的有效防腐剂,与疫苗的抗原结构和特性有最小限度的相互作用。由于关于乙基汞对婴儿和青年人的脑发育的潜在安全问题和副作用逐渐增加的争论,一些机构开始建议鉴定具有较低或可以忽略的安全风险的可替代防腐剂。在1999年,由美国国会托管的美国食品药品监督管理局的审查发现,与依据一些国立指南被认为可接受的汞相比,一些婴儿可能从疫苗中接受更多的汞。美国儿科学会(aap)和美国公共卫生署(usphs)关于疫苗中的硫柳汞签署了一份联合声明,然后aap向临床医生发布了一份临时报告,建议尽快从疫苗中去除硫柳汞,同时保持努力以确保高水平的疫苗接种继续在全球实施,而不影响安全性。通过制备和使用仅单剂量的疫苗制剂可以降低或消除将防腐剂添加至疫苗的需要。然而,使用单剂量、无防腐剂的制剂增加了疫苗接种的总费用,并且危及发展中国家免疫规划的效果。此外,从多剂量瓶完全去除防腐剂不被认为是优先的选择,特别是在冷藏条件有限以及健康保健标准不理想的国家(drainetal.,bullworldhealthorgan81(10):726–731(2003)。在1928年,接种过受污染的白喉疫苗的21名儿童中有12名死于多发性葡萄球菌脓肿和毒血症(wilson,thehazardsofimmunization,athlonepress,london.pp.75–78(1967)。因此,尽管多剂量瓶看起来是最适合用于生产较廉价的疫苗,但理想的是配制具有至少一种防腐剂的多剂量疫苗以便保护个体免于感染在多次使用期间或者一个或多个非无菌事件后无意引入疫苗的微生物。然而,防腐剂在抵制细菌和其他微生物污染方面的功效必须与特定防腐剂对所选免疫原性组合物的免疫原性以及对每一不同抗原决定簇长期稳定性的影响相平衡。prev(e)nar13制剂与防腐剂间的相容性之前没有讨论过。制备包含至少一种保护和/或稳定prev(e)nar13中存在的肺炎球菌抗原血清型的抗原决定簇的防腐剂的优化制剂是理想的。发明概述在第一方面,本发明提供了多价免疫原性组合物,其包含来自肺炎链球菌血清型的多种荚膜多糖和2-苯氧乙醇(2-pe)。在某些实施方案中,荚膜多糖来自选自1,3,4,5,6a,6b,7f,9v,14,18c,19a,19f和23f的一种或多种肺炎链球菌血清型。在某些实施方案中,荚膜多糖来自七种或更多种选自1,3,4,5,6a,6b,7f,9v,14,18c,19a,19f和23f的肺炎链球菌血清型。在某些实施方案中,荚膜多糖来自肺炎链球菌血清型1,3,4,5,6a,6b,7f,9v,14,18c,19a,19f和23f的每一种。在发明的某些实施方案中,组合物包含浓度为7mg/ml-15mg/ml、约10mg/ml、不低于7mg/ml、不低于10mg/ml、或者不低于15mg/ml的2-pe。在某些实施方案中,本发明的免疫原性组合物还可以包含佐剂、缓冲剂、冷冻保护剂、盐、二价阳离子、非离子去垢剂、和自由基氧化抑制剂的一种或多种。在某些实施方案中,佐剂是磷酸铝。本发明优选的多价免疫原性组合物是分别缀合至crm19的来自血清型1,3,4,5,6a,6b,7f,9v,14,18c,19a,19f和23f的肺炎球菌荚膜多糖的制剂,其中多价免疫原性组合物配制在无菌液体中以包含:约4.4μg/ml的每种多糖,除外约8.8μg/ml的6b;约58μg/mlcrm197载体蛋白;约0.25mg/ml的磷酸铝形式的元素铝;约0.85%氯化钠;约0.02%聚山梨醇酯80;ph为5.8的约5mm琥珀酸钠缓冲剂;以及约10mg/ml的2-苯氧乙醇。在本发明的某些实施方案中,免疫原性组合物的抗原性在2-8℃、20-25℃或37℃温度下稳定不少于1年、1.5年、2年或2.5年。在本发明的某些实施方案中,免疫原性组合物接种一种或多种微生物后,所述微生物的浓度随着时间降低。在某些实施方案中,用一种或多种细菌菌株接种后,组合物在24小时呈现从初次微生物计数的至少1.0的对数下降(logreduction),在7天时呈现从先前测量的值的至少3.0的对数下降,以及28天后,呈现从先前测量的值的不超过0.5的对数增加(logincrease).在某些实施方案中,用一种或多种细菌菌株接种后,组合物在6小时呈现从初次计算的计数的至少2.0的对数下降,在24小时呈现从先前测量的值的至少3.0的对数下降,以及在28天没有恢复。微生物菌株包括一种或多种选自铜绿假单胞菌(p.aeruginosa)、金黄色葡萄球菌(s.aureus)、大肠杆菌(e.coli)和枯草芽孢杆菌(b.subtilis)的菌株。在某些实施方案中,免疫原性组合物被接种多次。某些实施方案中,第二次接种发生在初次接种后6小时,第三次接种发生在初次接种后24小时,第三次接种发生在初次接种后7天,以及第四次接种发生在初次接种后14天。在第二方面,本发明还提供了含本发明的多价免疫原性组合物的小瓶。小瓶可以包含单剂量或多次剂量的免疫原性组合物。本发明还提供了包含本发明的多价免疫原性组合物的预填充疫苗递送装置。在某些实施方案中,预填充疫苗递送装置是注射器或包含注射器。本发明的疫苗递送装置可以包含双室或多室注射器或小瓶或其组合。在某些实施方案中,预填充疫苗递送装置包含配制用于肌内或皮下注射的多价免疫原性组合物。在第三方面,本发明还提供了用于制备本发明的免疫原性组合物的试剂盒,其中该试剂盒包含(i)在冻干形式的组合物中的多种荚膜多糖,以及(ii)用于重建(reconstitute)组分(i)的水性物质,以便提供水性组合物。在第四方面,本发明提供了在小瓶中包含四次剂量疫苗的多剂量疫苗,每一剂量包含4-20mg/ml、优选10mg/ml的2-苯氧乙醇,其中一剂量是0.5ml的疫苗。在第五方面,本发明还提供了在疫苗组合物的一些或全部免疫原性和非免疫原性组分存在的情况下,测量包含一种或多种选择的防腐剂的疫苗制剂功效的方法,其中测试包括至少以下两步:用选择的微生物群接种测试组合物,以及将接种的微生物或微生物们随着时间和在特定环境条件下(例如温度)的对数下降与在缺乏测试防腐剂的对照组合物中的对数下降相比较。附图简述图1-硫柳汞作为疫苗防腐剂在多种制剂中的效力。图2-2-苯氧乙醇(2-pe)作为疫苗防腐剂在多种制剂中以及在不同浓度时的效力和稳定性。图3-单次微生物攻击后,在20-25℃下,不含防腐剂的prev(e)nar13疫苗制剂中微生物菌落计数减少的时程(表示为在t=0、6小时、24小时、7天、14天和28天时与攻击时间相比的平均log10变化)。图4-单次微生物攻击后,在20-25℃下,含0.01%硫柳汞的prev(e)nar13疫苗制剂中微生物菌落计数减少的时程(表示为在t=0、6小时、24小时、7天、14天和28天时与攻击时间相比的平均log10变化)。图5-单次微生物攻击后,在20-25℃下,含0.02%硫柳汞的prev(e)nar13疫苗制剂中微生物菌落计数减少的时程(表示为在t=0、6小时、24小时、7天、14天和28天时与攻击时间相比的平均log10变化)。图6-单次微生物攻击后,在20-25℃下,含0.02%硫柳汞的盐水中微生物菌落计数减少的时程(表示为在t=0、6小时、24小时、7天、14天和28天时与攻击时间相比的平均log10变化)。图7-单次微生物攻击后,在20-25℃下,含5mg/0.5ml2-苯氧乙醇的prev(e)nar13疫苗制剂中微生物菌落计数减少的时程(表示为在t=0、6小时、24小时、7天、14天和28天时与攻击时间相比的平均log10变化)。图8-多次微生物攻击后,在(a)22–24℃或在(b)2–8℃下,在t=0、6小时、24小时、7天、14天和28天时不含防腐剂的prev(e)nar13疫苗制剂中微生物菌落计数减少的时程(表示为在t=0、6小时、24小时、7天、14天和28天时与攻击时间相比的平均log10变化)。图9-多次微生物攻击后,在(a)22–24℃或在(b)2–8℃下,在t=0、6小时、24小时、7天、14天和28天时含0.01%硫柳汞的prev(e)nar13疫苗制剂中微生物菌落计数减少的时程(表示为在t=0、6小时、24小时、7天、14天和28天时与攻击时间相比的平均log10变化)。图10-多次微生物攻击后,在(a)22–24℃或在(b)2–8℃下,在t=0、6小时、24小时、7天和14天时含0.02%硫柳汞的prev(e)nar13疫苗制剂中微生物菌落计数减少的时程(表示为在t=0、6小时、24小时、7天、14天和28天时与攻击时间相比的平均log10变化)。图11-多次微生物攻击后,在(a)22–24℃或在(b)2–8℃下,在t=0、6小时、24小时、7天和14天时含0.02%硫柳汞的盐水中微生物菌落计数减少的时程(表示为在t=0、6小时、24小时、7天、14天和28天时与攻击时间相比的平均log10变化)。图12-金黄色葡萄球菌在多种攻击研究中消减的非线性回归分析。图13-2-pe和硫柳汞作为疫苗防腐剂抵抗单次或多次微生物攻击的比较:通过或未通过ep5.1.3标准b。图14-来自每种血清型的肺炎链球菌多糖制剂的抗原性在配制有5mg2-pe的prev(e)nar13中的长期稳定性。图15-2-pe在prev(e)nar13疫苗制剂中的长期稳定性。发明详述如本申请所用的百分比浓度是质量与体积比(w/v)或质量与质量比(w/w)。除非另外规定,“剂量”指0.5ml的疫苗剂量。术语“多剂量”指包含超过一次剂量的疫苗的组合物,其可以以不同的给药步骤或随着时间给予一个个体或多个个体。本发明提供了包含来自肺炎链球菌(也称为肺炎球菌)血清型的多种荚膜多糖和防腐剂的多价免疫原性组合物。该组合物还可以被称为疫苗,以及用于诱导抗肺炎球菌的免疫反应并保护个体例如人类个体、优选为人类儿童或婴儿免受感染。多种任何肺炎链球菌荚膜多糖适用于本发明的组合物。在本发明的某些实施方案中,多价免疫原性组合物包含从肺炎链球菌血清型4,6b,9v,14,18c,19f和23f制备的荚膜多糖。在某些实施方案中,荚膜多糖从血清型4,6b,9v,14,18c,19f,23f以及至少一种另外的肺炎链球菌血清型制备。在某些实施方案中,荚膜多糖从至少4种、至少5种、至少6种、至少7种、至少8种或至少9种选自肺炎链球菌血清型1,4,5,6b,7f,9v,14,18c,19f和23f的血清型制备。在某些实施方案中,荚膜多糖从肺炎链球菌血清型1,3,4,5,6a,6b,7f,9v,14,18c,19a,19f和23f制备。利用已知的技术从肺炎链球菌血清型制备本发明的荚膜多糖。参见,例如国际专利申请wo2006/110381;wo2008/079653;wo2008/079732和wo2008/143709,其每一篇都通过引用并入本文。在本发明的某些实施方案中,荚膜多糖与载体蛋白缀合。这些肺炎球菌缀合物可以分别制备。例如,在一个实施方案中,每种肺炎球菌多糖血清型生长在大豆培养基中。然后通过离心、沉淀、超滤和柱色谱法纯化单独的多糖。用化学方法活化纯化过的多糖,从而使得糖类能够与所选载体蛋白反应以形成肺炎球菌缀合物。一旦被活化,每种荚膜多糖分别与载体蛋白缀合以形成糖缀合物。在某些实施方案中,每种不同的荚膜多糖与相同的载体蛋白缀合。在这类实施方案中,可以通过例如还原胺化法实现缀合。多糖的化学活化以及随后与载体蛋白的缀合通过常规的方法完成。参见,例如美国专利号4,673,574和4,902,506,其通过引用并入本文。载体蛋白优选是无毒和无反应原性以及可以足够的量和纯度获得的蛋白。载体蛋白应顺从标准的缀合程序。在本发明的某些实施方案中,crm197用作载体蛋白。crm197(pfizer,sanford,nc)是从生长在酪蛋白氨基酸和酵母膏培养基中的白喉棒状杆菌(corynebacteriumdiphtheria)菌株c7(crm197)培养物分离的白喉毒素的无毒变体(即类毒素)。crm197通过超滤、硫酸铵沉淀和离子交换色谱法纯化。可选地,按照例如通过引用并入本文的美国专利号5,614,382重组制备crm197。其他的白喉类毒素也适用于作为载体蛋白。其他合适的载体蛋白包括灭活的细菌毒素,诸如破伤风类毒素、百日咳类毒素、霍乱类毒素(例如,如在国际专利申请wo2004/083251中描述的)、大肠杆菌lt、大肠杆菌st和来自铜绿假单胞菌的外毒素a。还可以利用细菌外膜蛋白诸如外膜复合物c(ompc)、孔蛋白、转铁蛋白结合蛋白、肺炎球菌溶血素、肺炎球菌表面蛋白a(pspa)、肺炎球菌粘附蛋白(psaa)、来自a组或b组链球菌的c5a肽酶、或者流感嗜血杆菌(haemophilusinfluenzae)蛋白d。其他蛋白诸如卵清蛋白、钥孔戚血蓝素(klh)、牛血清白蛋白(bsa)或纯化的结核菌素的蛋白衍生物(ppd)也可以用作载体蛋白。荚膜多糖与载体蛋白缀合后,该多糖-蛋白缀合物通过多种技术来纯化(即在多糖-蛋白缀合物量方面进行富集)。这些技术包括浓缩/透析过滤操作、沉淀/洗脱、柱色谱法和深层过滤。如下文更详细讨论的,本发明的免疫原性组合物包含用于制备多剂量疫苗制剂的至少一种防腐剂,其在多价肺炎球菌荚膜多糖-蛋白缀合物的一种或多种抗原决定簇的长期稳定性方面具有有利特性,并且通过在给予有需要的个体前赋予对一种或多种微生物的抗性有利地保护组合物免受污染。可以利用本领域公认的方法取得本发明包含防腐剂的免疫原性组合物另外的制剂。例如,可以将十三种单独的肺炎球菌缀合物与生理学上可接受的载体配制以制备组合物。这种载体的实例包括但不限于水、缓冲盐、多元醇(例如,甘油、丙二醇、液体聚乙二醇)和右旋糖溶液,如下文更详细描述的。本发明的免疫原性组合物除多种肺炎球菌荚膜多糖-蛋白缀合物外还包含一种或多种防腐剂。fda要求多重剂量(多剂量)瓶的生物产品包含防腐剂,仅有少数例外情况。含防腐剂的疫苗产品包括含以下物质的疫苗:苄索氯铵(炭疽疫苗)、2-苯氧乙醇(无细胞百白破疫苗(dtap)、甲肝疫苗、莱姆病疫苗、脊髓灰质炎疫苗(肠胃外的))、苯酚(肺炎疫苗、伤寒疫苗(肠胃外的)、牛痘疫苗)和硫柳汞(无细胞百白破疫苗、白破疫苗(dt)、破伤风-白喉疫苗(td)、乙肝疫苗、b型流感嗜血杆菌疫苗(hib)、流感疫苗、乙型脑炎疫苗(je)、流脑疫苗、肺炎疫苗、狂犬病疫苗)的疫苗。批准用于可注射药物的防腐剂包括,例如氯丁醇、间甲酚、尼泊金甲酯、尼泊金丙酯、2-苯氧乙醇、苄索氯铵、苯扎氯铵、苯甲酸、苯甲醇、苯酚、硫柳汞和硝酸苯汞。测试了多种包含用于增强prev(e)nar13免疫原性组合物效力和稳定性的防腐剂的潜在合适的制剂后,本文公开的本发明提供了包含浓度为约2.5-10mg/剂量(0.5–2%)的2-苯氧乙醇(2-pe)的这种肺炎球菌免疫原性组合物。在某些实施方案中,2-pe的浓度为约3.5–7.5mg/剂量(0.7–1.5%)。在某些实施方案中,2-pe的浓度为约5mg/剂量(1%)。在某些实施方案中,2-pe的浓度不低于3.5mg/剂量(0.7%),不低于4.0mg/剂量(0.8%),不低于4.5mg/剂量(0.9%),不低于5.0mg/剂量(1%),不低于5.5mg/剂量(1.1%),不低于6.0mg/剂量(1.2%),不低于6.5mg/剂量(1.3%),不低于7.0mg/剂量,不低于7.5mg/剂量(1.5%),不低于8.0mg/剂量(1.6%),不低于9.0mg/剂量(1.8%)或者不低于10mg/剂量(2%)。在本发明的某些实施方案中,肺炎球菌免疫原性组合物包含一种或多种另外的防腐剂,包括但不限于硫柳汞和福尔马林。在某些实施方案中,免疫原性组合物可以包含一种或多种佐剂。如本文定义的,“佐剂”是用于增强本发明的免疫原性组合物免疫原性的物质。因此,佐剂常被用于加强免疫反应,并且是本领域技术人员熟知的。增强组合物效力的合适佐剂包括,但不限于:(1)铝盐(矾),诸如氢氧化铝、磷酸铝、硫酸铝等;(2)水包油型乳化制剂(含有或不含有其他特异性免疫刺激剂诸如胞壁肽(如下文定义的)或细菌细胞壁组分),诸如例如,(a)mf59(pct申请wo90/14837),其包含利用微流化仪诸如型号110y的微流化仪(microfluidics,newton,ma)配制在亚微米颗粒中的5%角鲨烯、0.5%吐温80和0.5%司盘(span)85(任选地包含不同量的mtp-pe(参见下文,尽管不是必需的)),(b)saf,其包含10%角鲨烯、0.4%吐温80、5%普朗尼克嵌段共聚物l121和thr-mdp(见下文),被微流化在亚微米颗粒乳剂或被涡旋以生成更大粒度的乳剂,以及(c)ribi佐剂系统(ras),(corixa,hamilton,mt),其包含2%角鲨烯、0.2%吐温80和一种或多种细菌细胞壁组分,所述细胞壁组分来自由美国专利号4,912,094描述的3-o-脱酰基单磷酰脂质a(mpl)(corixa)、海藻糖二霉菌酸酯(tdm)和细胞壁骨架(cws)组成的组,优选为mpl+cws(detox);(d)聚山梨醇酯80(吐温80);(3)皂素佐剂,诸如quila或stimulonqs-21(antigenics,framingham,ma)(美国专利号5,057,540)可以利用或者从其产生的颗粒诸如iscoms(免疫刺激复合物);(4)细菌脂多糖;合成的脂质a类似物诸如氨烷基葡萄糖胺磷酸化合物(agp)、或其衍生物或类似物,其可以从corixa购买到,并且在美国专利号6,113,918中描述过,一种这样的agp是2-[(r)-3-十四酰氧基十四酰氨基]乙基2-脱氧-4-o-磷酰基-3-o-[(r)-3-十四酰氧基十四酰基]-2-[(r)-3-十四酰氧基十四酰氨基]-b-d-吡喃葡萄糖苷,其还被称为529(以前被称为rc529),其被配制为水性形式或配制为稳定的乳剂;合成的多核苷酸诸如包含cpg基序的寡核苷酸(美国专利号6,207,646);(5)细胞因子,诸如白介素(例如il-1,il-2,il-4,il-5,il-6,il-7,il-12,il-15,il-18等)、干扰素(例如γ干扰素)、粒细胞巨噬细胞集落刺激因子(gm-csf)、巨噬细胞集落刺激因子(m-csf)、肿瘤坏死因子(tnf)、共刺激分子b7-1和b7-2等;(6)细菌adp-核糖基化毒素的去毒突变体,所述细菌adp-核糖基化毒素诸如野生型或突变形式的霍乱毒素(ct),例如按照公布的国际专利申请号wo00/18434(还参见wo02/098368和wo02/098369)其中氨基酸位置29的谷氨酸被另一氨基酸取代,优选被组氨酸取代;百日咳毒素(pt);或大肠杆菌热不稳定毒素(lt),特别是lt-k63、lt-r72、ct-s109、pt-k9/g129(参见例如wo93/13302和wo92/19265);以及(7)作为免疫刺激剂增强组合物效力的其他物质,诸如钙盐、铁、锌、酰化酪氨酸悬液、酰化糖、衍生化糖/糖类、聚磷腈、生物可降解的微球、单磷酰基脂质a(mpl)、脂质a衍生物(例如具有降低的毒性)、3-o-脱酰基mpl、quila、皂素、qs21、母育酚、弗氏不完全佐剂(difcolaboratories,detroit,mi)、merck佐剂65(merckandcompany,inc.,rahway,nj)、as-2(smith-klinebeecham,philadelphia,pa)、cpg寡核苷酸(优选未甲基化的)、生物粘附剂和粘膜粘附剂、微粒、脂质体、聚氧乙烯醚制剂、聚氧乙烯酯制剂和胞壁肽或咪唑并喹诺酮化合物。胞壁肽包括但不限于n-乙酰-胞壁酰-l-苏氨酰-d-异谷酰胺(thr-mdp)、n-乙酰-正胞壁酰-l-丙氨酸-2-(1'-2'二棕榈酰基-sn-甘油-3-羟基磷酰氧)-乙胺(mtp-pe)等。在某些实施方案中,佐剂组合物是相对h2-型细胞因子有利于更大程度诱导thl-型细胞因子(例如,ifn-γ,tnfα,il-2和il-12)的佐剂组合物,这可以有利于诱导针对给予的抗原的细胞介导的免疫反应。主要促进thl反应的特定佐剂系统包括但不限于脂质a衍生物,诸如单磷酰脂质a(mpl)或其衍生物,例如3-脱-o-酰基化mpl(3d-mpl);mpl和/或3d-mpl与铝盐和/或皂素衍生物的组合(例如在wo94/00153公开的与3d-mpl组合的qs21,或者如在wo96/33739中公开的qs21和胆固醇);三萜系化合物以及水包油型乳剂诸如包含生育酚的乳剂(如在wo95/17210中公开的)。佐剂可以任选地被本发明的防腐疫苗制剂的一种或多种免疫原性组分吸附或者与其组合。如本文所用的,术语“吸附的抗原”指其中大于20%,30%,40%,50%,60%,70%,80%或90%的抗原吸附至佐剂的混合物。在某些实施方案中,佐剂是吸附的磷酸铝(al+)或羟基磷酸铝。通常,总的铝含量是每0.5ml剂量有200-1000μg、300-900μg、400-800μg、500-700μg或大约630μgal+,其可以全部是氢氧化铝或全部是磷酸铝。可选地,al+含量可以来自多种比例的氢氧化铝和磷酸铝的混合物,例如磷酸铝:氢氧化铝为1:8-8:1,1:4-4:1,3:8-8:3,1:2-2:1或1:1。尽管在混合前通过预吸附的抗原提供了大多数铝以形成组合疫苗,一些铝可以在本发明的组合疫苗配制期间以游离形式加入,例如在本文所述的ph调整步骤前加入。通常,每0.5ml剂量游离的铝含量可以是0-300μg,50-250μg,75-200μg,100-150μg或大约120μg的al3+。游离的al3+可以全部是al(oh)3或全部是alpo4、或者为多种比例的al(oh)3和a1po4的混合物。疫苗抗原组分可以在混合前分别预先吸附到铝盐上。在另一实施方案中,抗原混合物可以在与另外的佐剂混合前预先吸附。可选地,本发明的疫苗的某些组分可以配制为非有意吸附至佐剂上。本发明的制剂还可以包含缓冲剂、盐、二价阳离子、非离子去污剂、冷冻保护剂诸如糖、以及抗氧化剂诸如自由基清除剂或螯合剂,或者其任一多个组合的一种或多种。任何一种组分例如螯合剂的选择可以确定是否需要另一种组分(例如,清除剂)。配制用于给药的最终组合物应是无菌的和/或无热原的。本领域技术人员可以基于经验确定这些和其他组分的哪些组合用于包括在本发明的含防腐剂疫苗组合物中是最优的,这取决于诸如所需的特定储存和给药条件的多种因素。在某些实施方案中,与肠胃外给药相容的本发明的制剂包含一种或多种生理学上可接受的缓冲剂,其选自但不限于三羟甲基氨基甲烷(三甲胺)、磷酸盐、醋酸盐、硼酸盐、柠檬酸盐、甘氨酸、组氨酸和琥珀酸盐。在某些实施方案中,制剂被缓冲至约6.0至约9.0的ph范围,优选从约6.4至约7.4。在某些实施方案中,需要调整本发明的免疫原性组合物或制剂的ph。可以利用本领域标准的技术调整本发明的制剂的ph。制剂的ph可以调整至3.0-8.0。在某些实施方案中,制剂的ph可以是或者可以调整为3.0-6.0、4.0-6.0、或5.0-8.0。在其他实施方案中,制剂的ph可以是或者可以调整为约3.0、约3.5、约4.0、约4.5、约5.0、约5.5、约5.8、约6.0、约6.5、约7.0、约7.5、或约8.0。在某些实施方案中,ph可以是或者可以调整为4.5-7.5、或4.5-6.5、5.0-5.4、5.4-5.5、5.5-5.6、5.6-5.7、5.7-5.8、5.8-5.9、5.9-6.0、6.0-6.1、6.1-6.2、6.2-6.3、6.3-6.5、6.5-7.0、7.0-7.5或7.5-8.0的范围。在特定实施方案中,制剂的ph是约5.8。在某些实施方案中,与肠胃外给药相容的本发明的制剂包含浓度为约0.1mm至约10mm、优选高达约5mm的一种或多种二价阳离子,包括但不限于mgcl2、cacl2和mncl2。在某些实施方案中,与肠胃外给药相容的本发明的制剂包含一种或多种盐,包括但不限于氯化钠、氯化钾、硫酸钠和硫酸钾,所述盐存在的离子强度在肠胃外给药时对个体而言是生理学上可接受的,并包括在最终浓度以在终制剂中产生所选的离子强度或同渗容摩。制剂的最终离子强度或同渗重摩通过多种组分(例如来自缓冲化合物和其他非缓冲盐的离子)来确定。优选的盐nacl存在的范围高达约250mm,选择的盐浓度补充其他组分(例如糖)从而使得制剂的最终总同渗容摩与肠胃外给药(例如,肌内或皮下注射)相容,并且会促进疫苗制剂的免疫原性组分在多种温度范围的长期稳定性。无盐制剂会容许一种或多种选择的冷冻保护剂的范围增加以维持所需的最终同渗容摩水平。在某些实施方案中,与肠胃外给药相容的本发明的制剂包含一种或多种选自但不限于双糖类(例如,乳糖、麦芽糖、蔗糖或海藻糖)和多羟烃类(例如半乳糖醇、甘油、甘露醇和山梨醇)的冷冻保护剂。在某些实施方案中,制剂的同渗容摩的范围为约200mos/l至约800mos/l,优选的范围为约250mos/l至约500mos/l、或者约300mos/l–约400mos/l。无盐制剂可以包含例如约5%至约25%的蔗糖,优选地约7%至约15%、或者约10%至约12%的蔗糖。可选地,无盐制剂可以包含例如约3%至约12%的山梨醇,优选地约4%至7%、或者约5%至约6%的山梨醇。如果添加诸如氯化钠的盐,那么蔗糖或山梨醇的有效范围相对减小。这些和其他这种同渗重摩和同渗容摩注意事项完全在本领域技术范围内。在某些实施方案中,与肠胃外给药相容的本发明的制剂包含一种或多种自由基氧化抑制剂和/或螯合剂。多种自由基清除剂和螯合剂是本领域已知的,并适用于本文描述的所用的制剂和方法。实例包括但不限于乙醇、edta、edta/乙醇组合、三乙醇胺、甘露醇、组氨酸、甘油、柠檬酸钠、肌醇六磷酸盐、三聚磷酸盐、抗坏血酸/抗坏血酸盐、琥珀酸/琥珀酸盐、苹果酸/马来酸盐、甲磺酸去铁胺、eddha和dtpa、以及以上两种或更多种的多种组合。在某些实施方案中,可以以有效地增强制剂长期稳定性的浓度添加至少一种非还原性自由基清除剂。一种或多种自由基氧化抑制剂/螯合剂还可以以多种组合添加,诸如清除剂和二价阳离子。螯合剂的选择会决定是否需要添加清除剂。在某些实施方案中,与肠胃外给药相容的本发明的制剂包含一种或多种非离子型表面活性剂,包括但不限于聚氧化乙烯山梨糖醇酐脂肪酸酯类聚山梨醇酯-80(吐温80)、聚山梨醇酯-60(吐温60)、聚山梨醇酯-40(吐温40)和聚山梨醇酯-20(吐温20),聚氧乙烯烷基醚类包括但不限于brij58、brij35、以及其他诸如曲拉通(triton)x-100;曲拉通x-114,np40,司盘85和非离子型表面活性剂的普朗尼克系列(例如,普朗尼克121),其中优选的组分为浓度约0.001%至约2%(高达约0.25%是优选的)的聚山梨醇酯-80,或者浓度为约0.001%至1%(高达约0.5%是优选的)的聚山梨醇酯-40。在某些实施方案中,本发明的制剂包含一种或多种适于肠胃外给药的另外稳定剂,例如包含至少一个硫醇(-sh)基团(例如,半胱氨酸、n-乙酰半胱氨酸、还原型谷胱甘肽、硫代乙醇酸钠、硫代硫酸盐、硫代甘油或其混合物)的还原剂。可选地或任选地,可以通过从储存容器去除氧、保护制剂避光(例如,通过利用琥珀色玻璃容器)来进一步稳定本发明包含防腐剂的疫苗制剂。本发明含防腐剂的疫苗制剂可以包含一种或多种药学上可接受的载体或赋形剂,其包括本身不诱导免疫反应的任何赋形剂。合适的赋形剂包括但不限于大分子诸如蛋白、糖类、聚乳酸、聚乙醇酸、聚合氨基酸、氨基酸共聚物、蔗糖(paolettietal,2001,vaccine,19:2118)、海藻糖、乳糖和脂质聚合物(诸如油滴或脂质体)。这种载体是本领域技术人员熟知的。药学上可接受的赋形剂例如在gennaro,2000,remington:thescienceandpracticeofpharmacy,20thedition,isbn:0683306472中被讨论。本发明的组合物可以被冻干或为水性形式,例如溶液或悬液。液体制剂可以方便地从它们的包装形式直接给药,以及由此对于注射是理想的,不需要否则如本发明的冻干组合物那样需要在水性介质中重溶解。在本发明的特定实施方案中,疫苗是多价免疫原性组合物,其包含一种或多种选自血清型1,3,4,5,6a,6b,7f,9v,14,18c,19a,19f和23f的肺炎球菌荚膜多糖,分别与crm197缀合。疫苗被配制为包含:1至5μg、优选约4.4μg/ml的每种多糖,但优选约8.8μg/ml的6b;20-100μg/ml、优选约58μg/ml的crm197载体蛋白;0.02-2mg/ml、优选0.25mg/ml的磷酸铝形式的元素铝;0.5-1.25%、优选约0.85%的氯化钠;0.002-0.2%、优选约0.02%聚山梨醇酯80;1-10mm、优选约5mm的琥珀酸钠缓冲剂,ph为4-7、优选ph为5.8;以及4-20mg/ml、优选约10mg/ml的2-苯氧乙醇。在本发明的某些优选实施方案中,疫苗是多价免疫原性组合物,其包含选自血清型1,3,4,5,6a,6b,7f,9v,14,18c,19a,19f和23f的肺炎球菌荚膜多糖,分别与crm197缀合。疫苗被配制为包含:约4.4μg/ml的每种糖,除6b为约8.8μg/ml外;约58μg/ml的crm197载体蛋白;约0.25mg/ml的磷酸铝形式的元素铝;约0.85%的氯化钠;约0.02%的聚山梨醇酯80;ph为5.8的约5mm琥珀酸钠缓冲剂;以及约10mg/ml的2-苯氧乙醇。本发明的组合物可以包含的许多物质的量可以表示为重量/剂量、重量/体积或百分比浓度(如重量/体积或重量/重量)。所有这些值可以相互转换。为了转换为重量/剂量单位或从重量/剂量单位转换,规定了剂量的体积。例如,给定0.5ml的剂量,5.0mg/剂量2-pe相当于10mg/ml或1.0%(g/100ml)的浓度。疫苗制剂还可以表示为多糖:2-pe的比例。例如,0.5ml剂量的具有4.4μg/ml每种多糖(除8.8μg/ml的6b外)和10mg/ml2-pe的优选制剂会有30.8μg多糖(2.2μgx12血清型+血清型6b的4.4μg)和5000μg2-pe。因此,多糖:2-pe的重量比为30.8:5000。在本发明的某些实施方案中,疫苗的多糖:2-pe重量比为5:5000至100:5000。在本发明的优选实施方案中,所述多糖:2-pe重量比为约30.8:5000。疫苗制剂的递送还提供了利用公开的包含至少一种防腐剂的药物组合物和制剂以在哺乳动物个体诸如人类个体、优选儿童或婴儿中诱导抗肺炎球菌的免疫反应,并因此保护避免感染的方法。通过经由全身或粘膜途径给予疫苗,本发明的疫苗制剂可以用于保护人类个体不受肺炎球菌感染影响。这些给药可以包括例如肠胃外给药或粘膜给药至口腔/消化道、呼吸道或泌尿生殖道。可以通过肠胃外给药(肌内、腹腔内、皮内、皮下、静脉内或至组织间隙给药),或者通过直肠、口腔、阴道、局部、经皮、鼻内、眼睛、耳朵、肺或其他粘膜给药实现将本发明的疫苗制剂直接递送至个体。在优选的实施方案中,肠胃外给药是通过肌内注射例如至个体的大腿或上臂。注射可以经由针(例如皮下针),但可选地,可以利用无针注射。通常的肌内剂量是0.5ml。本发明的组合物可以制备为多种形式,例如用于注射的液体溶液或悬液。在某些实施方案中,组合物可以制备为用于呼吸道给药的粉末或喷雾剂,例如在吸入器中。在其他实施方案中,组合物可以制备为栓剂或阴道栓,或者用于鼻、耳或眼睛给药,例如制备为喷雾剂、滴剂、凝胶或粉末。在一个实施方案中,鼻内给药可以用于预防肺炎或中耳炎(因为肺炎球菌的鼻咽运输能够被更有效地预防,由此在它的初期减轻了感染)。每一疫苗剂量的缀合物的量被选择为诱导免疫保护反应而没有明显副作用的量。取决于肺炎球菌血清型,这种量可以变化。一般地,每一剂量会包含0.1-100μg的多糖,特别是0.1-10μg,以及更特别地是1-5μg。可以通过包括对个体适当免疫反应的观测的标准研究来确定特定疫苗的组分的最佳量。初次免疫接种后,个体可以接受一次或几次充分间隔的加强免疫。用于婴儿和幼儿抵抗因为包括在prev(e)nar13疫苗中的血清型由肺炎链球菌导致的侵袭性疾病的常规时间表是2,4,6和12-15个月龄。本发明的组合物还适用于较大的儿童、青春期少年、青少年和成人,其中根据熟练的专业人员的决定可以应用相同或不同的常规时间表。包装和剂型本发明的疫苗可以包装在单位剂量或多剂量形式(例如,2次剂量、4次剂量或更多)中。对于多剂量形式,小瓶通常但并不必然优于预填充注射器。合适的多剂量样式包括但不限于:每一容器2-10剂量,每一剂量0.1-2ml。在某些实施方案中,剂量是0.5ml剂量。参见,例如,国际专利申请wo2007/127668,其通过引用并入本文。组合物可以存在于小瓶中或其他合适的储存容器中,或者可以存在于预填充的递送装置中,例如单或多组件注射器,其可以配备有或不配备针。注射器通常但不必然需要包含单剂量的本发明的含防腐剂疫苗组合物,尽管多剂量、预填充的注射器也在考虑中。同样,小瓶可以包括单次剂量,但可选地可以包括多次剂量。可以常规地确立有效的剂量体积,但用于注射的组合物的通常剂量具有0.5ml的体积。在某些实施方案中,配制剂量用于人类个体的给药。在某些实施方案中,配制剂量用于成人、青少年、青春期少年、幼儿或婴儿(即不超过1岁)的人类个体给药,以及在优选的实施方案汇总,可以通过注射给药。本发明的液体疫苗还适用于重建以冻干形式存在的其他疫苗。如果疫苗要用于这种即时的重建,本发明提供了以下试剂盒:具有两个或更多个小瓶、两个或更多个现成填充的注射器、或者每种的一个或多个,其中注射器的内容物用于在注射前重建小瓶中的内容物,或者反之亦然。可选地,本发明的疫苗组合物可以冻干和重建,例如利用本领域熟知的用于冷冻干燥的多种方法之一,从而形成干燥的、规则形状的(例如球形的)颗粒,诸如微丸或微球,其具有诸如平均直径大小的颗粒特征,这些特征可以通过改变用于制备颗粒的确切方法来选择和控制。疫苗组合物还可以包含佐剂,其任选地由单独的干燥的、规则形状的(例如球形的)颗粒诸如微丸或微球制备或包含在所述颗粒之内。在这种实施方案中,本发明还提供了疫苗试剂盒,其包含包括稳定的干燥疫苗组合物、任选地还包含本发明的一种或多种防腐剂的第一组分,以及包含用于重建第一组分的无菌水性溶液的第二组分。在某些实施方案中,水性溶液包含一种或多种防腐剂,以及可以任选地包含至少一种佐剂(参见,例如wo2009/109550(其通过引用并入本文))。仍在另一实施方案中,多剂量样式的容器选自以下物体的一种或多种,但不限于以下物体:一般实验室玻璃器皿、长颈瓶、烧杯、量筒、发酵器、生物反应器、管、管道、袋、罐、小瓶、小瓶闭具(例如,橡胶塞、盖上的螺钉)、安瓶、注射器、双或多-室注射器、注射器塞、注射器活塞、橡胶闭具、塑料闭具、玻璃闭具、套筒和一次性笔等。本发明的容器不受加工材料的限制,包括诸如玻璃、金属(例如,钢、不锈钢、铝等)和聚合物(例如,热塑性塑料、弹性体、热塑性弹性体)的材料。在特定实施方案中,该样式的容器是具有丁基胶塞的5mlschott1型玻璃瓶。熟练的技术人员会认识到,上述样式决不是详尽的列举,而仅仅作为对技术人员关于本发明可以利用的多种样式的指南。预期用于本发明的另外样式可以在来自实验室设备供应商和生产商诸如unitedstatesplasticcorp.(lima,oh),vwr.的公开目录中找到。用于评价疫苗组合物中防腐剂功效的方法本发明还提供了在疫苗组合物的一些或全部免疫原性和非免疫原性组分的存在的情况下,用于测量包含一种或多种选择的防腐剂的疫苗制剂功效的新方法。关于防腐剂功效的who协议利用usp和ep测试,并且包括进行某些测试时的开瓶政策(openvialpolicy)条件。通常的防腐剂功效测试是单次攻击测试,其中测试的组合物用选择的微生物群接种一次,以及将接种的微生物随着时间和在特定环境条件(例如温度)下的对数下降与接种的微生物在缺乏测试防腐剂的对照组合物中的对数下降比较。参见,例如下文的实施例2和3。然而,还没有额外的测试被要求用来解决防腐剂对多次污染的功效问题,例如通过多次接种相同的小瓶解决小瓶和塞子的问题。因此,本发明提供了多次攻击测试,用于评价免疫原性组合物中一种或多种防腐剂的功效,其中该测试包括至少以下两步:用选择的微生物群接种测试组合物,以及将接种的微生物随着时间和在特定环境条件(例如温度)下的减少与在缺乏测试防腐剂的对照组合物中的减少比较。参见,下文的实施例4和5。防腐剂效力本发明含防腐剂的疫苗制剂适用于填充在例如与肠胃外给药相容的多剂量疫苗小瓶或容器中,并且在2-8℃、室温或37℃长期保持稳定,其中活性的损伤与缺乏防腐剂的相同制剂相比时降低或可以忽略。将制剂中防腐剂的量选择为满足疫苗安全性需要的量,如美国(u.s.)、欧洲或世界卫生组织(who)药典或者其组合所定义的。为了确定依据美国和欧洲药典(分别为usp和ep)的防腐剂的水平,在时间为0时用约105-106cfu/ml(cfu=菌落形成单位)的以下菌接种一次疫苗制剂:1.金黄色葡萄球菌(细菌;atcc#6538;"sa")2.铜绿假单胞菌(细菌;;atcc#9027;"pa")3.白色念珠菌(candidaalbicans)(酵母;atcc#10231;"ca")4.黑曲霉菌(aspergillusniger)(霉菌;atcc#16404;"an")为了代表实践中在多剂量制剂重复使用期间可能发生的污染的最坏合理情况,who要求利用细菌菌株铜绿假单胞菌("pa")、金黄色葡萄球("sa")、大肠杆菌("ec")和枯草芽孢杆菌("ba"),有意暴露于多次污染事件的安全性测试。在初次攻击后的时间0、6小时、24小时、7天和14天时在制剂中加入5x103cfu/ml的每种生物体,并储存在2–8℃或22–24℃以模拟实践中的潜在储存条件。usp29nf24增补版2(usp)要求,接种细菌微生物后,在7天时有从初次计算的计数(即接种的时间)的至少1.0的对数下降,在14天时有从先前测量的值的至少3.0的对数下降,以及在28天时与先前测量的值相比没有增加。参见表1。对于酵母和真菌,usp的要求是在7、14和28天时,没有从接种时间的增加。ep的要求更为严格。ep第5版5.6(5.1.3)对肠胃外和眼用制剂的要求有两部分:类目a和类目b。类目a(ep-a)要求,对于细菌,在接种后6小时有从初次计算的计数至少2.0的对数下降;在24小时有从先前测量的值至少3.0的对数下降以及在28天没有恢复。类目b(ep-b)要求,对于细菌,在24小时有从初次计算的计数至少1.0的对数下降,在7天时有从先前测量的值至少3.0的对数下降,以及在28天时有从先前测量的值不超过0.5对数增加(即没有增加)。参见表1。对于酵母和真菌,类目a要求在7天时有从初次计算的计数的至少2.0的对数下降,以及在28天时没有从先前测量的值的增加;以及类目b要求在14天时有从初次计算的计数至少1.0的对数下降,以及在28天时没有从先前测量的值的增加。表1:美国、欧洲和日本药典间对防腐剂效力测试的验收标准*a标准表达了待实现的推荐的功效。在合理的情形下,如果不能达到a标准,必须满足b标准。**ni:没有增加:它被定义为比先前测量的值不超过0.5log10的升高。***nr:没有恢复在本发明的某些实施方案中,本发明的防腐剂在降低免疫原性制剂中微生物浓度方面是有效的。在本发明的某些实施方案中,与不含有一种或多种防腐剂的疫苗制剂相比,包含至少一种防腐剂的疫苗制剂在用一种或多种微生物接种后,降低了所述微生物的浓度。在本发明特定的实施方案中,制剂在24小时呈现从初次微生物计数的至少1.0的对数下降,在7天时呈现从先前测量的值至少3.0的对数下降,以及在28天时呈现从先前测量的值不超过0.5的对数增加。在本发明的另一特定实施方案中,制剂在6小时呈现从初次计算的计数的至少2.0的对数下降,在24小时呈现从先前测量的值的至少3.0的对数下降,以及在28天时与初次微生物计数相比没有呈现出恢复。在本发明另一实施方案中,制剂满足欧洲药典(ep)对于肠胃外和眼用制剂的要求,特别是ep第5版5.6(5.1.3)的类目a(ep-a)和/或类目b的要求。在本发明的另一实施方案中,制剂满足美国药典(usp)29nf24增补版2对于肠胃外制剂的要求。在本发明的某些实施方案中,当用微生物攻击时,本发明的至少一种防腐剂在降低制剂中的微生物浓度方面是有效的,与缺乏一种或多种防腐剂的制剂相比。不受限制,微生物可以是下述的一种或多种:铜绿假单胞菌、金黄色葡萄球、大肠杆菌、枯草芽孢杆菌、白色念珠菌、黑曲霉菌以及其它。在本发明的某些实施方案中,微生物可以在不同的间隔引入或接种在疫苗中一次或多次。接种可以发生在计划的实验性接种情况下或者发生在污染的皮下针进入多剂量疫苗制剂的容器的情况下。接种间的间隔可以在1分钟和1个月之间。在特定的实施方案中,初次接种后,多次接种发生在初次接种后6小时、初次接种后24小时,初次接种后7天以及初次接种后14天。疫苗和防腐剂稳定性的参数在本发明的某些实施方案中,疫苗制剂中至少一种抗原决定簇(即来自肺炎链球菌血清型的多糖制剂)的抗原性在储存时间和温度范围内是稳定的。抗原性可以通过本领域已知的方法来测量。例如,可以通过利用型-特异性抗血清来确定总抗原性,如在实施例3中所描述的。在本发明的某些实施方案中,疫苗制剂中的至少一种抗原决定簇的抗原性稳定不少于4周、不少于6周、不少于8周、不少于10周、不少于12周、不少于18周、不少于24周、不少于48周、不少于1年、不少于1.25年、不少于1.5年、不少于1.75年、不少于2年、不少于2.25年或者不少于2.5年。优选地,制剂中疫苗多数抗原决定簇,例如至少50%、75%、80%、85%、90%、95%或更多的抗原决定簇的抗原性稳定不少于4周、不少于6周、不少于8周、不少于10周、不少于12周、不少于18周、不少于24周、不少于48周、不少于1年、不少于1.25年、不少于1.5年、不少于1.75年、不少于2年、不少于2.25年或者不少于2.5年。在本发明的某些实施方案中,疫苗制剂中至少一种抗原决定簇的抗原性当在约-25℃至约37℃、或者-20至-10℃、或2至8℃、或约室温、或22℃至28℃、或约37℃储存时是稳定的。在本发明的特定实施方案中,疫苗制剂中的至少一种抗原决定簇的抗原性在2至8℃温度下储存不少于2.5年是稳定的。在本发明的某些实施方案中,本发明的防腐剂的浓度在疫苗于上述时间段和储存温度下储存后是稳定的。在本发明的特定实施方案中,疫苗制剂中的防腐剂的浓度在疫苗于2至8℃温度下储存不少于2.5年是稳定的。防腐剂的浓度可以通过本领域已知的方法来测量。例如,硫柳汞可以利用冷蒸气原子吸收光谱测定法(cvaas)来测量,如实施例3中描述的。可以用反相hplc测定来测量2-ep的浓度,同样如在实施例3中描述的。可以以下述方式进行反相hplc测定:将样品涡旋并以1:10稀释于5mm在盐水中的琥珀酸盐缓冲剂,然后将样品离心并再次以1:10稀释于5mm在盐水中的琥珀酸盐缓冲剂(测试样品的中最终稀释度为1:100)。然后利用agilenteclipsexdb-c18hplc柱和含三氟乙酸的水和乙腈的线性梯度分析样品。然后将防腐剂的量与标准曲线相比较。还参见,sharmaetal.,biologicals36(1):61–63(2008)。以上公开内容对本发明进行了一般描述。可以通过参考下文具体实施例获得更为透彻的理解。描述这些实施例仅用于示例目的,而不是意欲限制本发明的范围。实施例实施例1–初步的防腐剂筛选研究多剂量prev(e)nar13疫苗的配方开发起始于防腐剂的初步筛选,所述防腐剂包括在prev(e)nar13制剂中的苯酚(0.25%)、2-苯氧乙醇(5mg/ml)、间甲酚(0.3%)、尼泊金甲酯和尼泊金丙酯(分别为0.18%和0.12%)。为了测试防腐剂的效力,等份的疫苗被接种以下生物体:1.金黄色葡萄球(细菌;atcc#6538)2.铜绿假单胞菌(细菌;atcc#9027)3.白色念珠菌(酵母;atcc#10231)4.黑曲霉菌(霉菌;atcc#16404)将有或没有所示浓度的硫柳汞或2-pe的30毫升(ml)每种疫苗制剂或者含0.02%硫柳汞的盐水一式三份接种每种测试的生物体悬液以使接种体的密度在时间为0时达到约105至106cfu/ml(cfu=菌落形成单位)。每种接种体的体积在每次有意攻击期间不超过产物体积的1%。将样品混合以确保攻击的生物体的均匀分布。将一式三份的另外30ml疫苗(含有和不含有防腐剂)用作阴性对照,并加入单独的培养基以评价可能存在于样品或培养基的固有污染。然后将三个系列的疫苗的每种、以及阳性和阴性对照分别在20-25℃孵育。在时间为0时以及在接种后的6小时、24小时、7天、14天和28天的间隔,通过平板计数法一式两份地计数等份(1ml)的攻击的样品和对照(或者它们适当的连续10倍稀释液)。usp29nf24增补版2(usp)要求,接种细菌微生物后,在7天时有从初次计算的计数(即接种的时间)至少1.0的对数下降,在14天时有从先前测量的值的至少3.0的对数下降,以及在28天时没有从先前测量的值的增加。参见表1。对于酵母和真菌,usp的要求是从接种时间到7、14和28天时没有增加。ep的要求更为严格。ep第5版5.6(5.1.3)对于肠胃外和眼用制剂的要求有两部分:类目a和类目b。类目a(ep-a)要求,对于细菌,在接种后6小时有从初次计算的计数至少2.0的对数下降,在24小时有从先前测量的值至少3.0的对数下降以及在28天没有恢复。类目b(ep-b)要求,对于细菌,在24小时有从初次计算的计数至少1.0的对数下降,在7天时有从先前测量的值至少3.0的对数下降,以及在28天时有从先前测量的值不超过0.5的对数增加(即没有增加)。参见表1。对于酵母和真菌,类目a要求在7天时有至少2.0的对数下降,以及在28天时没有从先前测量的值的增加;以及类目b要求在14天时有至少1.0的对数下降,以及在28天时没有从先前测量的值的增加。在计数时,对于细菌,使用含<300cfu的平板,或者对于酵母或霉菌,使用含<100cfu的平板。对于单次攻击研究,测量了一式三份并且在二重平板上的所有存活微生物(每一时间点6个值)加上它们稀释的样品的算术平均计数,并标准化为cfu/ml。结果表示为平均log10cfu/ml下降(与时间为0时相比)。在这种情况下,将时间为0时的存活微生物计数评价为基线并与6小时、24小时、7天、14天和28天的孵育时间比较。除显示出降低prev(e)nar13结合的抗原性的尼泊金类(尼泊金甲酯和尼泊金丙酯)外,测试的防腐剂没有显示对prev(e)nar13稳定性的明显影响。此外,苯酚、间甲酚、尼泊金甲酯和尼泊金丙酯干扰改进型lowry蛋白测定(疫苗的蛋白浓度通过商购的改进型lowry蛋白测定来确定)。防腐剂效力测试(pet)结果显示,所有测试的防腐剂满足usp的要求,但不满足ep标准(ep-a或ep-b)。参见表2。2-pe为已知在较高剂量是安全的唯一候选防腐剂。因此,用较高剂量的2-pe对防腐剂效力进行了进一步的测试。表2:单次微生物攻击后,潜在的防腐剂在满足usp和ep*疫苗安全性要求方面的效力*ep-b实施例2–通过单次攻击方法的防腐剂效力测试:2-pe和硫柳汞在美国许可的大多数疫苗中通常使用0.01%浓度的硫柳汞。利用上文实施例1中描述的相同单次攻击方法测试了作为防腐剂的硫柳汞的效力。含0.01%硫柳汞(相当于每0.5ml剂量25μg汞)的prev(e)nar13疫苗制剂不满足通过ep的防腐剂抗微生物效力方法确立的欧洲验收标准ep-a或ep-b。然而,它却通过了美国或日本药典确立的验收范围,因为通过这些法定方法确立的验收范围不如ep中确立的验收范围严格。参见图1。相当于一些美国许可的疫苗中硫柳汞推荐浓度2倍的0.02%的硫柳汞(每剂量含50μg汞),或者相当于一些美国许可的疫苗中硫柳汞推荐浓度4倍的0.04%的硫柳汞(每剂量含100μg汞)满足ep验收标准b,但不满足更为严格的a验收标准(用单次微生物攻击)。参见图1。2-pe作为防腐剂比硫柳汞更为有效。尽管2.5mg/剂量的2-pe不能满足ep验收标准a和b,浓度为3.5至5.5mg/剂量的2-pe满足ep验收标准b。在6.0mg/剂量以上的浓度,2-pe满足ep-a和ep-b抗微生物效力验收标准(图2)。实施例3–用2-pe和硫柳汞的单次攻击方法:污染物水平的变化在20–25℃下,prev(e)nar13疫苗制剂中防腐剂的缺乏在28天攻击期间导致铜绿假单胞菌的缓慢生长、没有改变白色念珠菌和黑曲霉菌的水平,以及缓慢减少了金黄色葡萄球菌菌落形成单位(图3)。0.01%硫柳汞(每剂量含25μg汞)的存在降低了所有四种接种的微生物的污染水平。然而,对金黄色葡萄球菌和白色念珠菌的抑制弱于对铜绿假单胞菌和黑曲霉菌的抑制(图4)。观察到了prev(e)nar13疫苗制剂中硫柳汞抗微生物作用的速率的剂量反应关系,特别是抵抗白色念珠菌,其中污染水平的降低在用0.02%硫柳汞时更为显著(图5)。含0.02%硫汞的盐水制剂中prev(e)nar13的缺乏轻度提高了硫柳汞抗金黄色葡萄球菌和白色念珠菌的生长抑制效力(图6)。2-pe作为防腐剂比硫柳汞更有效。例如,与硫柳汞使金黄色葡萄球菌缓慢消减相比,5.0mg/剂量2-pe的抗微生物功效导致金黄色葡萄球菌在接种后24小时内下降到基线(图7)。尽管2-pe作为防腐剂抗黑曲霉菌不如硫柳汞有效(图7),以及与硫柳汞相比黑曲霉菌污染消减速率较慢(图4和5),2-pe对于其他菌株更优的效力使得它在浓度为3.5和5mg/剂量时满足防腐剂验收标准ep-b(图2),而0.01%硫柳汞不满足(图1)。当制剂储存在37℃一个月或储存在2–8℃两年半时,3.5至5.0mg/剂量的2-pe的防腐剂效力仍持续存在(图2)。2-pe在制剂中的浓度同样稳定(图15)。prev(e)nar13制剂中存在的13种血清型的每种的免疫活性(总抗原性)在这些储存条件下也是稳定的(图14)。对于每种血清型,总抗原性来自疫苗中存在的结合的和未结合的多糖。型-特异性的抗原性通过利用型-特异性抗血清来确定。在测定前,首先溶解与磷酸铝配制的13-价疫苗。然后中和溶液以避免碱诱导的降解。利用比浊计,该测定测量了来自抗体-抗原复合物形成的光散射强度的变化率。利用在样品分析前或后立即测量的标准曲线,通过线性回归来确定测试样品的抗原性。为了弄清prev(e)nar13疫苗和盐制剂的硫柳汞含量,通过冷蒸汽原子吸收光谱测定(cvaas)方法确定一些制剂中的汞浓度。测量的汞浓度非常接近它的预期值,表明这些制剂中的硫柳汞浓度是正确的,并没有被低估。测量的2-pe的浓度也非常接近它的预期值,并没有在prev(e)nar13制剂于2-8℃或37℃储存时随着时间而变化。利用反相hplc测定来测量2-pe浓度。将样品涡旋并以1:10稀释于5mm在盐水中的琥珀酸盐缓冲剂,然后将样品离心并再次以1:10稀释于5mm在盐水中的琥珀酸盐缓冲剂。测试样品的中最终稀释度为1:100。该测定利用agilenteclipsexdb-c18hplc柱以及含三氟乙酸的水和乙腈的线性梯度。相对2-pe标准曲线定量13vpnc多剂量疫苗样品中的2-pe。还参见,sharmaetal.,biologicals36(1):61–63(2008)。实施例4–通过多攻击方法的防腐剂效力测试:硫柳汞为了评价who多-剂量疫苗开瓶政策在最长达4周的多次免疫期中的适宜性,应用了who提供的实验设计。在该研究中,评价了硫柳汞在大多数美国许可的疫苗中存在的浓度(0.01%)、以及在0.02%更高的浓度时的效力。为了代表实践中在多剂量制剂重复使用期间可能发生的污染的最坏合理情况,以及为了测试who要求,利用who推荐的细菌菌株:铜绿假单胞菌、金黄色葡萄球菌、大肠杆菌和枯草芽孢杆菌,将含有0.01或0.02%硫柳汞或者含有5.0mg/剂量2-pe的prev(e)nar13疫苗制剂有意暴露于多次污染事件。在初次攻击后时间0、6小时、24小时、7天和14天时,制剂加入5x103cfu/ml的每种生物体,并储存在2–8℃或22–24℃以模拟实践中的潜在储存条件。含0.02%硫柳汞的盐水制剂还用作对照以评价prev(e)nar13对制剂中硫柳汞抗微生物功效的潜在影响。prev(e)nar13疫苗制剂的多次有意污染在缺乏防腐剂的情况下,铜绿假单胞菌和大肠杆菌生物体的水平随着研究进程增加,特别是当储存在22–24℃时(图8a和8b)。存储在22–24℃下的制剂中的金黄色葡萄球菌水平缓慢消减,与在单次攻击研究中观测到的类似(图8a,与图3比较)。枯草芽孢杆菌的活力消减更为显著(图8a和8b)。这些结果表明,枯草芽孢杆菌不是该制剂中的强健生物体以至于不能用作防腐剂效力测试中这种攻击研究的模型,尽管它被who所推荐。在prev(e)nar13疫苗制剂中,0.01%硫柳汞抗细菌效力对枯草芽孢杆菌是最高的,随后是铜绿假单胞菌。然而,金黄色葡萄球菌和大肠杆菌的减少缓慢,特别是当制剂储存在2–8℃时(图9a和9b)。如图12总结的金黄色葡萄球菌活力消减的非线性回归分析所示的,与储存在22-24℃(每天-1.39log10的消减,在6.2天中消减50%)的制剂相比,当制剂储存在2-8℃时金黄色葡萄球菌消减率大大减慢(每天-5.98log10的消减,在30.28天中消减50%)(图12)。这些结果表明,在多剂量递送期间在实地被污染并进一步储存在冷藏温度的prev(e)nar13疫苗制剂中的0.01%硫柳汞在降低细菌污染方面是无效的。硫柳汞的效力既是浓度依赖性的又是温度依赖性的(图9和10)。硫柳汞在更高的0.02%浓度是更为有效的防腐剂。它在更高的储存温度22–24℃下也是更为有效的防腐剂。然而,如上文讨论的,即便以0.02%浓度储存在22-24℃,硫柳汞也不满足ep-a或ep-b的ep要求,当在多攻击研究中应用这种标准时(图1)。为了研究疫苗本身是否影响硫柳汞的防腐作用,在盐水和prev(e)nar13疫苗制剂间比较了多次攻击时0.02%硫柳汞的效力。在0.02%硫柳汞存在的情况下,金黄色葡萄球菌和大肠杆菌两者在盐水制剂中的消减率比在疫苗制剂中更为显著(图11,与图10和图12比较),这证实了疫苗的存在在一定程度上抑制硫柳汞作为防腐剂的效力。然而,即便在不含疫苗的盐水对照制剂中,0.02%硫柳汞仍然在多次攻击时不满足ep-a或ep-b的验收标准(图1)。实施例5–通过多攻击方法的防腐剂效力测试:2-pe与硫柳汞作为防腐剂效力的缺乏相比,尤其是当多次接种或储存在2-8°时,含5mg/剂量作为防腐剂的2-pe的prev(e)nar13疫苗制剂更强地使金黄色葡萄球菌活力失活,不管攻击方法(即单次或多次的)或者储存温度(图12)。事实上,不管储存温度,用多攻击方法时,以及用所有测试的生物体(铜绿假单胞菌、金黄色葡萄球菌、大肠杆菌和枯草芽孢杆菌),5mg/剂量的2-pe作为防腐剂优于0.01%的硫柳汞。在不同攻击研究中金黄色葡萄球菌消减的非线性回归分析中,在50%消减和消减的平均斜率(log10消减/天)方面,含有2-pe的疫苗制剂比起含有硫柳汞的疫苗制剂具有更快的微生物污染物消减率。参见图12。此外,5mg/剂量的2-pe满足多攻击下的ep-b标准,而任何形式的硫柳汞在相同条件下都不满足(图13)。硫柳汞在保护多剂量制剂中的prev(e)nar13避免可能在分配期间引入的潜在污染方面是无效的防腐剂。当在多剂量制剂中为个体给药期间多次引入污染时,这一点更为明显。硫柳汞具有缓慢的灭活率,特别是针对金黄色葡萄球菌和大肠杆菌,在清除普通医师可能在恶劣的卫生条件下从多剂量瓶中取出疫苗时产生的潜在污染生物体时具有滞后的即时效应。然而,3.5至5mg/剂量的2-pe是稳定的,与硫柳汞相比具有高得多的抗微生物效力速率,并且由此会保护产品免于为个体给药时的无意污染。实施例6–通过含有或不含有作为防腐剂的2-苯氧乙醇的prevenar13疫苗的免疫在非人灵长类中引发的免疫反应在食蟹猴(cynomolgusmacaques)中评价了prevenar13和含2-苯氧乙醇的prevenar13诱导免疫反应的能力。将总共20只食蟹猴分为两个免疫组,每组10只猕猴,用于表3中详述的研究。表3组别猕猴/组疫苗终体积递送11013vpnc0.5mlim21013vpnc+5mg2pe0.5mlim将预先筛选的动物基于它们的体重和基线效价随机分组。给予猕猴临床剂量的含0或5mg作为防腐剂的2-苯氧乙醇的13vpnc。在每只猴子的四头肌的单个部位肌内给予疫苗。递送的终体积是0.5ml。所有的猕猴接受三次剂量并在第2、4和8周接种疫苗。取血时间表:在第0、6、8、10、12和16周取外周血以便监测对疫苗的免疫反应的诱导。通过进行下述对研究期间收集的血清的测定来监测通过疫苗接种引发的免疫反应:·体外结合和功能性抗体o通过elisa的血清型-特异性igg(参见例如fernstenp,etal.,humvaccin.2011jan1;7:75-84)o血清型-特异性调理吞噬测定(opa)(参见例如fernstenp,etal.,humvaccin.2011jan1;7:75-84)·在幼鼠攻击模型中的体内保护(参见例如fernstenp,etal.,humvaccin.2011jan1;7:75-84):o评价收集的猕猴血清的血清型-特异性保护。当前第1页12
相关技术
网友询问留言
已有0条留言
- 还没有人留言评论。精彩留言会获得点赞!
1