肿瘤疫苗、树突细胞肿瘤疫苗及其制备方法与流程
本发明属于医疗技术领域,具体涉及肿瘤疫苗、树突细胞肿瘤疫苗及其制备方法。
背景技术:
树突细胞(dendriticcells,dcs)是体内功能最强大的专职抗原提呈细胞,具有免疫原性和耐受性双重作用。dcs的免疫原性体现在作为专职apc对自身抗原异常提呈,引起机体免疫系统紊乱。
用制备的肿瘤抗原负载dcs,利用dcs强大的加工、呈递抗原的能力去激活机体的细胞及体液免疫,从而期望对肿瘤起到预防和治疗的目的。这样的研究已经普遍在实验室和临床开展,dcs肿瘤疫苗被证明是安全的,但是效果却不尽如人意。在针对癌症病人的免疫治疗中,诱导抗肿瘤t细胞反应显得十分重要。若想用肿瘤细胞或经修饰的肿瘤/自身抗原(tumor/self-ags)诱导抗肿瘤免疫反应,最大挑战在于dcs能否有效摄取和处理抗原以激活免疫效应细胞并限制调节性t细胞活性的产生。
dcs摄取抗原的途径有:吞噬、小胞饮、大胞饮、以及内吞,介导内吞的受体包括fc受体(i型fcγ受体cd64和ii型fcγ受体cd32)、整合素(αvβ3或αvβ5)、c型凝集素受体(c-typelectinreceptors,clrs,包括甘露糖受体和dec205)、凋亡细胞受体、清道夫受体。抗原或者通过内源性途径被加工成肽以便mhci分子呈递给cd8+t细胞,或者通过外源性途径通过mhcii分子呈递给cd4+t细胞。dcs也可通过两个途径交叉呈递加工抗原。此外它们能通过clrs识别和获取含糖结构的抗原,包括mmr(macrophagemannosereceptor,巨噬细胞甘露糖受体)、dec205和dc-sign(dendriticcell-specificintercellularadhesionmolecule-3-grabbingnon-integrin)。clrs可作为内吞受体内化抗原以便抗原的加工和呈递,但是有一些clrs,如micl(myeloidc-typelectin-likereceptor)和dicr(dendriticcellimmunoreceptor)可能是抑制性的。最近,maurizioperdicchioa等人发现,被唾液酸修饰的抗原可通过抑制t细胞增殖和诱导调节性t细胞产生造成免疫耐受。肿瘤抗原常发生过度的唾液酸化修饰,dcs通过siglecs(sialicacid-bindingig-typelectins)摄入唾液酸化抗原就会抑制效应cd4+和cd8+t细胞的形成。因此,抗原进入树突细胞的途径不同,最终产生的免疫应答情况就会不同,可以是激活性的,也可以是抑制性的。
目前制备树突细胞肿瘤疫苗的主要方法是先将单核细胞或cd34+细胞在体外培养制备dcs,然后负载抗原,以tlr配体、细胞因子组合物进行激活,最后注射回输给病人。根据用于负载树突细胞的肿瘤抗原的特点可以将其分为两大类,一类是已经鉴定出的、但数量甚少的肿瘤相关抗原,另一类是未知的、可能是数量庞大的肿瘤相关抗原。对于前者,人们可以通过各种手段将其递送给树突细胞,甚至可以选择特定的递送途径;但是,对于后者,目前无法做到将其明确地通过特定的递送途径输入树突细胞,而只能是含混地将其与树突细胞共同孵育,任由树突细胞以各种方式摄取。这种含混的摄入抗原方式极有可能造成树突细胞通过抑制性的摄入抗原途径将抗原摄入胞内,特别是过度唾液酸化的肿瘤抗原以抑制性摄入途径的进入,最终造成肿瘤疫苗治疗效果的低下。
鉴于只有少量预测的肿瘤抗原被证明具有免疫刺激功能,可以被精准递送给dcs,而那些未被鉴定出来的肿瘤特异性抗原则无法以这种精确的方式递送给树突细胞,进而致敏cd4+和cd8+t细胞应答。因此,如何使那些未知的肿瘤相关抗原也通过精准的激活性途径进入树突细胞是亟待解决的关键问题,可能关系到树突细胞肿瘤疫苗免疫治疗的成败。
技术实现要素:
发明目的:本发明所要解决的第一个技术问题是提供了一种前体物质,该前体物质先通过用含叠氮基团的非天然糖或非天然氨基酸对广谱的肿瘤细胞抗原进行代谢标记获得带有叠氮基团的肿瘤细胞表面抗原,再通过与炔烃修饰的吞噬受体的配体交联获得。
本发明还要解决的技术问题是还提供了一种前体物质,该前体物质先通过用含叠氮基团的非天然糖或非天然氨基酸对广谱的肿瘤细胞抗原进行代谢标记获得带有叠氮基团的肿瘤细胞表面抗原,再通过生物正交反应将生物素与掺入到肿瘤细胞表面抗原的叠氮基团交联,最后通过与生物素/链亲和素修饰的吞噬受体的配体交联获得。
本发明还要解决的技术问题是提供了上述前体物质在制备肿瘤疫苗或树突细胞肿瘤疫苗中的应用。
本发明还要解决的技术问题是提供了一种肿瘤疫苗,该肿瘤疫苗由上述的前体物质制成。
本发明还要解决的技术问题是提供了一种树突细胞肿瘤疫苗,该树突肿瘤疫苗由上述的前体物质制成。
本发明还要解决的技术问题是提供了肿瘤疫苗和树突细胞肿瘤疫苗的制备方法。
本发明与疫苗有关,如抗肿瘤疫苗、抗致病微生物疫苗。本发明主要与制备人抗肿瘤疫苗相关。用本发明所述方法可以:1.生产用于制备肿瘤疫苗的前体物;2.生产直接用于免疫接种的肿瘤疫苗;3.生产树突细胞(dendriticcells,dcs)肿瘤疫苗。本发明适用于制备各种人抗肿瘤疫苗。本发明的特殊之处在于,用本发明制备的疫苗可以将广谱的肿瘤细胞表面抗原通过特定的树突细胞表面激活性吞噬受体途径递送给树突细胞。这是已有的向树突细胞负载肿瘤抗原制备疫苗方法所无法做到的。
技术方案:为了解决上述技术问题,本发明采用的技术方案如下:一种前体物质,所述前体物质先通过用含叠氮基团的非天然糖或非天然氨基酸对广谱的肿瘤细胞抗原进行代谢标记获得带有叠氮基团的肿瘤细胞表面抗原,再通过与吞噬受体的配体交联获得。
其中,上述吞噬受体的配体为经炔烃修饰的吞噬受体的配体。本发明通过用含能与叠氮基团发生生物正交反应的炔烃基团的化合物去修饰吞噬受体的配体,修饰的部位可以在配体的c端,也可以是是在配体蛋白的n端。经这样修饰的配体可以直接与叠氮化的肿瘤细胞表面抗原通过生物正交反应缀合。
其中,可与叠氮基团发生生物正交反应的化合物是指含有能与叠氮基团发生生物正交反应的基团并含有与吞噬受体配体的游离氨基(或游离羧基或游离巯基)发生交联反应的基团的化合物。
本发明内容还包括另外一种前体物质,所述前体物质先通过用含叠氮基团的非天然糖或非天然氨基酸对广谱的肿瘤细胞抗原进行代谢标记获得带有叠氮基团的肿瘤细胞表面抗原,再通过生物正交反应将生物素与掺入到肿瘤细胞表面抗原的叠氮基团交联,最后通过与吞噬受体的配体交联获得。其中,上述吞噬受体的配体为用亲和素或链亲和素修饰的吞噬受体的配体。
本发明内容还包括上述的两类前体物质在制备肿瘤疫苗或树突细胞肿瘤疫苗中的应用。
一种肿瘤疫苗,所述肿瘤疫苗由上述的两类前体物质中的一种制成。
一种树突细胞肿瘤疫苗,所述树突肿瘤疫苗由上述的两类前体物质中的一种制成。
本发明具备通过将广谱的肿瘤细胞表面抗原通过特定吞噬受体途径递送给树突细胞的技术和方法。
本发明的肿瘤疫苗的制备方法,包括以下两种途径中的一种:
用含叠氮基团的非天然糖或非天然氨基酸对广谱的肿瘤细胞抗原进行代谢标记获得带有叠氮基团的肿瘤细胞表面抗原;再通过与经炔烃修饰的吞噬受体的配体交联获得;
或,用含叠氮基团的非天然糖或非天然氨基酸对广谱的肿瘤细胞抗原进行代谢标记获得带有叠氮基团的肿瘤细胞表面抗原,再通过生物正交反应将生物素与掺入到肿瘤细胞表面抗原的叠氮基团交联,最后通过与用亲和素或链亲和素修饰的吞噬受体的配体交联获得。
其中,上述树突细胞肿瘤疫苗的制备方法是将两种途径中的一种制备得到的产物直接用于向树突细胞递送肿瘤抗原从而制备树突细胞肿瘤疫苗。
上述的第二种肿瘤疫苗的制备方法,具体包括以下步骤:
1)用含叠氮基团的非天然糖或非天然氨基酸对广谱的肿瘤细胞抗原进行代谢标记获得带有叠氮基团的肿瘤细胞表面抗原;
2)利用生物正交反应将生物素与掺入到肿瘤细胞表面抗原的叠氮基团交联得到生物素标记的肿瘤细胞表面抗原;
3)将吞噬受体的配体与亲和素或链亲和素化学交联或将二者制备成重组融合蛋白得到交联物或重组蛋白;
4)将步骤3)得到的交联物或重组蛋白与步骤2)得到的生物素标记的肿瘤细胞表面抗原交联即得。
上述的第二种树突细胞肿瘤疫苗的制备方法,步骤1)~4)与肿瘤疫苗的制备方法相同,步骤5)将步骤4制得的产物直接用于向树突细胞递送肿瘤抗原制备树突细胞肿瘤疫苗。
本发明内容提供生产制备能直接使用的、可通过特定吞噬受体途径负载树突细胞的肿瘤细胞表面抗原,即新型肿瘤抗原疫苗的方法。
本发明内容提供生产制备可用于生产新型肿瘤抗原疫苗的前体物质的方法,用这些前体物质可以方便地、个性化地制备新型肿瘤抗原疫苗。
本发明内容还提供了程序化生产制备新型肿瘤抗原疫苗产品的技术,使产品可以直接用于临床肿瘤病人的免疫治疗和肿瘤的预防免疫。
本发明内容还包括上述的吞噬受体的配体与肿瘤细胞表面抗原的交联物及交联后的细胞和交联后的细胞裂解物。
本发明内容还包括上述交联后的细胞和交联后的细胞裂解物可直接用于向树突细胞(体内树突细胞或从体内分离得到的树突细胞)递送肿瘤抗原,这种递送是吞噬受体特异性的。靶向体内树突细胞的递送可用于治疗相应肿瘤病人或作为预防免疫接种;靶向从体内分离得到的树突细胞的递送可用于制备树突细胞肿瘤疫苗。
其中,上述含叠氮基团的非天然糖是指在与细胞共培养后能通过细胞糖代谢途径掺入到肿瘤抗原所修饰的糖链中的非天然糖或其前体物,包括非天然的含叠氮基团的唾液酸、葡萄糖、半乳糖、盐藻糖、甘露糖或其前体物;含叠氮基团的非天然氨基酸是指在与细胞共培养后能通过细胞蛋白代谢途径掺入到肿瘤蛋白抗原中的非天然氨基酸或其前体物。
其中,上述吞噬受体的配体是指能与人或哺乳动物fc受体(即:i型fcγ受体cd64和ii型fcγ受体cd32)结合的抗体和蛋白、能与人或哺乳动物clec9a(dcnklectingroupreceptor-1)结合的抗体和蛋白、能与人或哺乳动物整合素(αvβ3或αvβ5)结合的抗体和蛋白、能与人或哺乳动物甘露糖受体结合的抗体和蛋白、能与人或哺乳动物dec205结合的抗体和蛋白中的一种。
其中,上述肿瘤细胞为人黑色素瘤细胞、人肺癌细胞、人乳腺癌细胞、人子宫癌细胞、人宫颈癌细胞、人结直肠癌细胞、人胰腺癌细胞、人前列腺癌细胞、人胃癌细胞、人膀胱癌细胞、人肾癌细胞、人骨癌细胞、人肝癌细胞、人食管癌细胞、人脑癌细胞、人睾丸癌细胞、人卵巢癌细胞、人白血病癌细胞或人淋巴瘤癌细胞中的一种或几种。
概括而言,本发明涉及以下几个方面:用含叠氮基团的非天然化合物对肿瘤细胞进行代谢标记;吞噬受体的配体的修饰、制备(即用于制备新型肿瘤抗原疫苗的前体物质);经修饰的吞噬受体的配体与肿瘤细胞表面抗原的交联;细胞裂解物疫苗或纯化的吞噬受体的配体与肿瘤细胞抗原的交联物疫苗的制备,以及此类疫苗在肿瘤动物模型的治疗效果评价;树突细胞肿瘤疫苗的制备,以及此类疫苗在肿瘤动物模型的治疗效果评价。如上文所述,本发明的实施同样也适用于各种人类肿瘤疫苗的制备和应用,包括但不限于以下肿瘤细胞:人黑色素瘤细胞、肺癌细胞、乳腺癌细胞、子宫癌细胞、宫颈癌细胞、结直肠癌细胞、胰腺癌细胞、前列腺癌细胞、胃癌细胞、膀胱癌细胞、肾癌细胞、骨癌细胞、肝癌细胞、食管癌细胞、脑癌细胞、睾丸癌细胞、卵巢癌细胞、白血病癌细胞或淋巴瘤癌细胞。本发明的实施还适用于针对各种人类致病微生物疫苗的制备与应用,包括致病菌、病毒、真菌以及其它微生物。
有益效果:相对于现有技术,本发明具备以下优点:
1、使用本发明所述方法制备的新型肿瘤疫苗具有靶向特定树突细胞吞噬受体的特点。这种递送方式可以是只靶向激活性树突细胞吞噬受体,因而能够避免由于抗原进入抑制性树突细胞吞噬受体途径所产生的免疫抑制;
2、使用本发明所述方法制备的新型肿瘤疫苗能将几乎所有肿瘤抗原(涵盖已知和未知的肿瘤特异性抗原)靶向递送给激活性树突细胞吞噬受体。这与已有的靶向树突细胞的肿瘤疫苗有本质差别,后者只能将已知的、单一的、特定肿瘤抗原靶向递送给树突细胞;而本发明是针对广谱的肿瘤细胞抗原;
3、使用本发明所述方法制备的吞噬受体的配体可用于特定病人自身肿瘤疫苗的制备;
4、使用本发明所述方法制备的新型肿瘤疫苗(包括吞噬受体的配体与肿瘤抗原的交联物或细胞裂解液)既可以直接接种使用,也可以用于进一步制备树突细胞肿瘤疫苗;
5、用本发明所述方法制备疫苗时可使用肿瘤细胞系进行,而用肿瘤细胞系来制备疫苗具有持续性、可重复性,可满足商品化生产的要求;
6、对肿瘤细胞进行标记及检测的各种试剂均有现成的商品供应,可满足商品化生产的要求;
7、本发明所述方法中用于制备与标记的肿瘤细胞偶联的吞噬受体的配体的试剂、生物学信息均可获得,容易实现程序化的、特定吞噬受体的配体的修饰和制备;
8、采用本发明所述方法制备疫苗过程的各个环节均容易实现质量监控;
9、采用本发明所述方法也可制备各种病原体疫苗,即将代谢标记的病原体抗原与特定吞噬受体配体相偶联,用于刺激树突细胞,进而激活机体免疫系统,包括体液免疫和细胞免疫。
附图说明
图1.叠氮化非天然糖代谢掺入肿瘤细胞分析。a.ac4mannaz掺入原理(参照invitrogen,mp10186,fig.2)。b.alexafluor488diboalkyne通过无铜点击反应缀合叠氮分子原理(参照invitrogen,mp10405,fig.1)。c.ac4mannaz掺入4t1细胞分析。按照2×105cells/ml在96孔板接种4t1细胞(购自中国科学院上海生命科学研究院细胞库),每孔100μl,培养24h。吸去上清后,加入如图所示不同浓度的ac4mannaz(购自thermofisher,c33366)或sialicacid(sigma-aldrich,19023)与培养基【含90%rpmi1640、10%胎牛血清(fbs)、100u/ml青霉素和100μg/ml链霉素】混合物,继续共培养24h。用含1%fbs的pbs洗3次。加入含1%fbs(胎牛血清)、50μmalexafluor488diboalkyne(购自thermofisher,c10405)的pbs,轻轻吹打混匀,室温、避光、共孵育60min。用含1%fbs的pbs洗4次。用含4%多聚甲醛的pbs固定细胞15min。用pbs洗细胞3次。避光、4℃保存。高内涵荧光酶标仪检测,激发波长488nm。
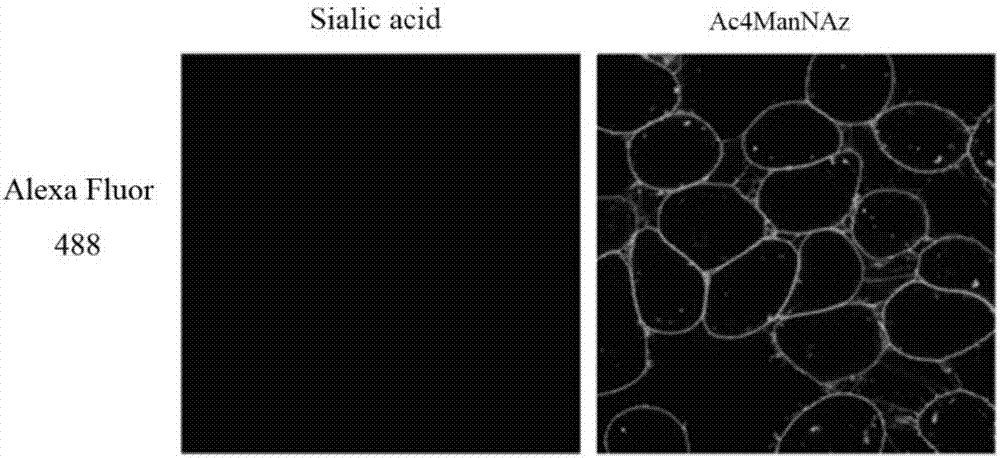
图2.叠氮化非天然糖代谢掺入肿瘤细胞荧光图像分析。按照2×105cells/ml接种4t1细胞到腔室培养玻片(electronmicroscopysciences,70423)上,每孔100μl,培基中含3mm的ac4mannaz或sialicacid,培养24h。用含1%fbs的pbs洗细胞4次。用50μmalexafluor488diboalkyne染色,室温、避光、孵育60min。用3%bsapbs洗细胞,3次。4%多聚甲醛pbs固定细胞,室温、15min。用含1%bsa的pbs洗细胞3次。荧光显微镜观察、采集图像。
图3.吞噬受体的配体的修饰策略1。
图4.吞噬受体的配体的修饰策略2。
图5.migg1fc与neutravidin偶联及鉴定。按照试剂盒(protein-proteincrosslinkingkit,thermofisher,p6305)操作手册步骤,将migg1fc(sinobiological,10690-mnah-100)与neutravidin(thermofisher,31000)偶联,交联产物用排阻层析柱纯化。sds-page后考马斯亮蓝染色。migg1fc与neutravidin分子量分别约为32kda和60kda,交联后产物约为100kda。
图6.生物素与肿瘤细胞表面叠氮唾液酸交联检测。a.生物素与肿瘤细胞表面叠氮唾液酸交联及检测原理。b.按照2×105cells/ml接种4t1细胞到96孔板,每孔100μl,培基中含3mm的ac4man-naz或sialicacid,培养24h。用含1%fbs的pbs洗细胞4次。加入50mmclick-itdibo-biotin(thermofisher,c10412),室温、避光、孵育60min。用3%bsapbs洗细胞,3次。加入fitc(异硫氰酸荧光素)标记的anti-biotin,室温下孵育15min。用含1%bsa的pbs洗细胞3次。4%多聚甲醛pbs固定细胞,室温、15min。用含1%bsa的pbs洗细胞3次。高内涵荧光酶标仪测定荧光强度。
图7.蛋白印迹法检测肿瘤细胞生物素-唾液酸化蛋白表达。a.链亲和素树脂免疫沉淀生物素-唾液酸化蛋白原理。b.按照2×105cells/ml在6孔板接种细胞,每孔1000μl,培养24h。更新培基,培基中含3mm的ac4mannaz或sialicacid,培养24h。用含1%fbs的pbs洗细胞4次。裂解细胞:向培养孔加入冰浴的200μlripa裂解缓冲液【1%nonidetp40,1%sodiumdeoxycholate,0.1%sds,50mmtriethanolamineph7.4,150mmnacl,1×edta-freepiercenthalttmproteaseinhibitorcocktail(无edta的蛋白酶和磷酸酶抑制剂)(thermofisher,货号78425),和50u(0.5μl)
图8.migg1fc-neutravidin与生物素-唾液酸化肿瘤细胞结合的检测。按照2×105cells/ml接种4t1细胞到96孔板,每孔100μl,培基中含3mm的ac4manaz或sialicacid,培养24h。用含1%fbs的pbs洗细胞4次。加入50μmclick-itdibo-biotin,室温、避光、孵育60min。用含1%fbs的pbs洗细胞4次。加入含5μg/mlmigg1fc-neutravidin的pbs100μl(migg1fc作为对照),室温、孵育20min。用3%bsapbs洗细胞,3次。加入fitc标记的anti-migg1fc,室温下孵育15min。用含1%bsa的d-pbs洗细胞3次。4%多聚甲醛pbs固定细胞,室温、15min。用含1%bsa的pbs洗细胞3次。高内涵荧光酶标仪测定荧光强度。
图9.sds-page法检测migg1fc-neutravidin与生物素-唾液酸化肿瘤细胞结合;按照2×105cells/ml在6孔板接种细胞,每孔1000μl,培养24h。更新培基,培基中含3mm的ac4mannaz,培养24h。用含1%fbs的pbs洗细胞4次。加入50μmclick-itdibo-biotin,室温、避光、孵育60min。用含1%fbs的pbs洗细胞4次。加入含5μg/mlmigg1fc-neutravidin的pbs500μl(migg1fc作为对照),室温、孵育20min。用3%bsapbs洗细胞,3次。裂解细胞:向培养孔加入冰浴的500μlripa裂解缓冲液(1%nonidetp40,1%sodiumdeoxycholate,0.1%sds,50mmtriethanolamineph7.4,150mmnacl,1×edta-freepiercenthalttmproteaseinhibitorcocktail)和50u
图10.新型肿瘤细胞裂解物疫苗对乳腺癌小鼠生存的影响。三组balb/c小鼠(每组n=10)分别采用pbs(pbs组)、冻融法制备新型肿瘤细胞裂解液疫苗(fc-4t1组)及传统肿瘤细胞裂解液疫苗(4t1组)在小鼠接种肿瘤细胞后7天、14天和21天进行免疫。kaplan–meier生存分析结果显示,新型肿瘤细胞裂解物疫苗与其它两组相比,p<0.05。
图11.新型肿瘤细胞裂解物疫苗对乳腺癌小鼠肿瘤生长分析。三组动物(n=10)的处理同图10。分别在动物荷瘤后不同时间(如图所示)测量、计算肿瘤体积。各点数据为均数±sd。组间比较采用单因素方差分析和dunnett's检验。p<0.05,新型疫苗治疗组与其它两组在相应时间点比较(15、18、21天)。
图12.新型肿瘤细胞裂解物疫苗对结直肠癌小鼠生存的影响。三组balb/c小鼠(每组n=10)分别采用pbs(pbs组)、冻融法制备新型肿瘤细胞裂解液疫苗(fc-ct26.wt组)及传统肿瘤细胞裂解液疫苗(ct26.wt组)在小鼠接种肿瘤细胞后7天、14天和21天进行免疫。kaplan–meier生存分析结果显示,新型肿瘤细胞裂解物疫苗与其它两组相比p<0.05。
图13.新型肿瘤细胞裂解物疫苗对结直肠癌小鼠肿瘤生长分析。三组动物(n=10)的处理同图12。分别在动物荷瘤后不同时间(如图所示)测量、计算肿瘤体积。各点数据为均数±sd。组间比较采用单因素方差分析和dunnett's检验。p<0.05,新型疫苗治疗组与其它两组在相应时间点比较(15、18、21天)。
图14.新型树突细胞肿瘤疫苗对乳腺癌小鼠生存的影响。三组balb/c小鼠(每组n=10),分别采用pbs(pbs组)、新型肿瘤细胞裂解液负载的树突细胞(fc-4t1dc组)及传统肿瘤细胞裂解液负载的树突细胞(4t1dc组)在小鼠接种肿瘤细胞后7天、14天和21天进行免疫。kaplan–meier生存分析结果显示,新型树突细胞肿瘤疫苗与其它两组相比,p<0.05。
图15.新型树突细胞肿瘤疫苗对乳腺癌小鼠肿瘤生长分析。三组动物(n=10)的处理同图13。分别在动物荷瘤后不同时间(如图所示)测量、计算肿瘤体积。各点数据为均数±sd。组间比较采用单因素方差分析和dunnett's检验。p<0.05,新型疫苗治疗组与其它两组在相应时间点比较(15、18、21天)。
图16.新型树突细胞肿瘤疫苗对结直肠癌小鼠生存的影响。三组balb/c小鼠(每组n=10),分别采用pbs(pbs组)、新型肿瘤细胞裂解液负载的树突细胞(fc-ct26.wtdc组)及传统肿瘤细胞裂解液负载的树突细胞(ct26.wtdc组)在小鼠接种肿瘤细胞后7天、14天和21天进行免疫。kaplan–meier生存分析结果显示,新型树突细胞肿瘤疫苗与其它两组相比p<0.05。
图17.新型树突细胞肿瘤疫苗对结直肠癌小鼠肿瘤生长分析。三组动物(n=10)的处理同图15。分别在动物荷瘤后不同时间(如图所示)测量、计算肿瘤体积。各点数据为均数±sd。组间比较采用单因素方差分析和dunnett's检验。p<0.05,新型疫苗治疗组与其它两组在相应时间点比较(15、18、21天)。
图18.基于生物正交反应靶向特定树突细胞吞噬受体递送肿瘤抗原的方法。a.新型肿瘤疫苗制备策略1:①用非天然糖或氨基酸对抗原进行代谢标记,使抗原带有叠氮基团;②用可与叠氮基团发生生物正交反应的炔烃基团修饰吞噬受体的配体,此修饰物用于进一步制备肿瘤疫苗;③吞噬受体的配体与抗原缀合的产物,可以直接用作新型肿瘤疫苗或用于进一步制备树突细胞肿瘤疫苗;④新型树突细胞肿瘤疫苗。b.新型肿瘤疫苗制备策略2:①用非天然糖或氨基酸代谢标记抗原后,进一步使抗原生物素化;②用亲和素或链亲和素修饰吞噬受体的配体,此修饰物用于进一步制备肿瘤疫苗;③吞噬受体的配体与抗原缀合的产物,可以直接用作新型肿瘤疫苗或用于进一步制备树突细胞肿瘤疫苗;④新型树突细胞肿瘤疫苗。
具体实施方式
下面将结合实施例对本发明的实施方案进行详细描述,但是本领域技术人员将会理解,下列实施例仅用于说明本发明,而不应视为限定本发明的范围。实施例中未注明具体条件者,按照常规条件或制造商建议的条件进行。所用试剂或仪器未注明生产厂商者,均为可以通过市购获得的常规产品。
实施例1稳定的吞噬受体的配体-亲和素-生物素-抗原缀合物的制备
1、肿瘤细胞的代谢标记
1.1代谢标记物的选择
对肿瘤细胞进行代谢标记的目的是使肿瘤细胞表面抗原掺入含叠氮基团化合物。可供选择的化合物包括非天然糖和非天然氨基酸。例如,在与细胞共培养后能通过细胞糖代谢途径掺入到肿瘤抗原所修饰的糖链中的非天然糖或其前体物,包括含叠氮基团的唾液酸、葡萄糖、半乳糖、盐藻糖、甘露糖或其前体物中的一种。
1.2我们将肿瘤细胞与ac4mannaz共培养。
共培养体系:按照2×105cells/ml在96孔板接种4t1细胞,每孔100μl,培养24h。吸去上清后,加入如图1所示不同浓度(0mm、0.1mm、0.25mm、0.5mm、1mm、2mm、3mm)的ac4mannaz或sialicacid与培养基(该培养基含90%rpmi1640、10%胎牛血清(fbs)、100u/ml青霉素和100ug/ml链霉素)混合物,继续共培养24h。用含1%fbs的pbs洗3次。加入含1%fbs、50μmalexafluor488diboalkyne的pbs,轻轻吹打混匀,室温、避光、共孵育60min。用含1%fbs的pbs洗4次。用含4%多聚甲醛的pbs固定细胞15min。用pbs洗细胞3次。避光、4℃保存;采用高内涵荧光酶标仪检测,激发波长488nm;结果参见图1;
含叠氮的非天然糖会利用细胞糖代谢途径发生转化,并以叠氮化唾液酸形式掺入到细胞表面含有唾液酸的糖蛋白中(图1a);肿瘤细胞表面表达的叠氮化唾液酸可以与荧光素修饰的炔烃(alexafluor488diboalkyne)通过无铜点击反应相缀合(图1b)。经酶标仪荧光检测、荧光显微镜检测,即可分析ac4mannaz在肿瘤细胞的掺入动力学。
我们的实验结果表明,ac4mannaz的浓度为3mm、与肿瘤细胞共孵育时间为24h,肿瘤细胞表面叠氮化唾液酸的表达达到峰值(图1c。图示为4t1细胞实验结果;ct26.wt实验结果与4t1类似,故未展示)。
我们按照2×105cells/ml接种4t1细胞到腔室培养玻片(electronmicroscopysciences,70423)上,每孔100μl,培养基(该培养基含90%rpmi1640、10%胎牛血清(fbs)、100u/ml青霉素和100ug/ml链霉素)中含3mm的ac4mannaz或sialicacid,培养24h。用含1%fbs的pbs洗细胞4次。用50mmalexafluor488diboalkyne染色,室温、避光、孵育60min。用3%bsapbs洗细胞,3次。4%多聚甲醛pbs固定细胞,室温、15min。用含1%bsa的pbs洗细胞3次。免疫荧光显微镜观察、采集图像;结果参见图2;
免疫荧光显微镜观察显示:经荧光素染色,ac4mannaz掺入细胞表面表达多量的叠氮化唾液酸,而对照的唾液酸掺入细胞无叠氮化物(图2)。
2、吞噬受体的配体的修饰、制备
2.1吞噬受体的配体的选择
根据文献报道的激活型吞噬受体的种类,本发明涵盖的可供选择制备疫苗的吞噬受体的配体包括:能与fc受体(即:i型fcγ受体cd64和ii型fcγ受体cd32)结合的抗体和蛋白(如igg1fc蛋白);能与clec9a(dcnklectingroupreceptor-1)结合的抗体和蛋白;能与整合素(α和蛋白或α和蛋白)结合的抗体和蛋白;能与甘露糖受体结合的抗体和蛋白;能与dec205结合的抗体和蛋白。
2.2吞噬受体的配体的修饰策略
用含能与叠氮基团发生生物正交反应的炔烃基团的化合物去修饰吞噬受体的配体,修饰的部位可以在配体的c端(图3a),也可以是在配体蛋白的n端(图3b)。经这样修饰的配体可以直接与叠氮化的肿瘤细胞表面抗原通过生物正交反应缀合。
将配体蛋白与亲和素(或链亲和素)交联或制备成融合蛋白。这样制备的蛋白可以与生物素-叠氮化的抗原(即先代谢标记叠氮基团,再缀合生物素的抗原)通过生物素-亲和素以很强的结合力偶联在一起(图4)。
在本实施方案,我们将商品化的小鼠igg1fc(mouseigg1fc,migg1fc)蛋白分子与中性亲和素(neutravidin)分子交联。按照蛋白交联试剂盒(protein-proteincrosslinkingkit,thermofisher,p6305)操作手册步骤,将migg1fc与中性亲和素蛋白neutravidin偶联,形成migg1fc-neutravidin杂合蛋白;交联产物用排阻层析柱纯化。sds-page后考马斯亮蓝染色,考察杂合蛋白的产生情况;migg1fc与neutravidin分子量分别约为32kda和60kda,交联后产物约为100kda;我们的实验结果表明,migg1fc与neutravidin成功交联,纯化得到migg1fc-neutravidin杂合蛋白(图5)。图5中,fc代表migg1fc,avidin代表neutravidin,fc-avidin代表migg1fc-neutravidin杂合蛋白。
实施例2:生物素与肿瘤细胞表达的叠氮化唾液酸的交联
如实施例1中所述,修饰吞噬受体的配体的策略有两类,第一类对相应的肿瘤细胞代谢标记的要求是实现肿瘤细胞表面抗原的叠氮化;第二类对相应的肿瘤细胞代谢标记的要求是实现肿瘤细胞表面抗原的生物素化。
在本实施方案,我们采用实施例1制备得到的migg1fc-neutravidin杂合蛋白与肿瘤细胞表面抗原偶联。
首先我们按照2×105cells/ml接种4t1细胞到96孔板,每孔100μl,培养基(该培养基同实施例1)中含3mm的ac4man-naz或sialicacid,培养24h。用含1%fbs的pbs洗细胞4次。加入50μmclick-itdibo-biotin(thermofisher,c10412),室温、避光、孵育60min。用3%bsapbs洗细胞,3次。加入fitc(异硫氰酸荧光素)标记的anti-biotin,室温下孵育15min。用含1%bsa的pbs洗细胞3次。4%多聚甲醛pbs固定细胞,室温、15min。用含1%bsa的pbs洗细胞3次。高内涵荧光酶标仪测定荧光强度;结果参见图6b。
然后,按照2×105cells/ml在6孔板接种细胞,每孔1000μl,培养24h。更新培养基,培养基中含3mm的ac4mannaz或sialicacid,培养24h。用含1%fbs的pbs洗细胞4次。裂解细胞:向培养孔加入冰浴的200μlripa裂解缓冲液【1%nonidetp40(乙基苯基聚乙二醇),1%sodiumdeoxycholate(脱氧胆酸钠),0.1%sds,50mmtriethanolamine(三乙醇胺)ph7.4,150mmnacl,1×edta-freepiercenthalttmproteaseinhibitorcocktail】和50u(0.5μl)
因此,本实施例先利用生物正交反应,将修饰有炔烃的生物素(click-itdibo-biotin)通过无铜点击反应与肿瘤细胞表面唾液酸中的叠氮基团交联(图6a)。再利用荧光素标记的抗生物素抗体进行检测、利用亲和素树脂免疫沉淀生物素化蛋白(图7a)和蛋白印迹检测,分析生物素与叠氮化唾液酸的交联情况。我们实验结果表明(图示为4t1细胞实验结果;ct26.wt实验结果与4t1类似,故未展示),通过前述操作可使生物素与肿瘤细胞表面叠氮化唾液酸有效交联(图6b),亦即成功实现了肿瘤细胞表面含叠氮唾液酸的肿瘤细胞表面抗原的生物素化(图7b)。
实施例3经修饰的吞噬受体的配体与肿瘤细胞表面抗原的缀合
如实施例1中所述,修饰吞噬受体的配体的策略有两类。第一类是采用含正交反应基团(炔烃)的化合物对吞噬受体的配体进行修饰,这样修饰的配体可以直接与叠氮化的肿瘤细胞表面抗原通过生物正交反应缀合;第二类是采用与亲和素(或链亲和素)修饰吞噬受体的配体,形成杂合蛋白或重组融合蛋白,这样修饰的配体不能与叠氮化的肿瘤细胞表面抗原直接缀合,而需要对叠氮化的肿瘤细胞表面抗原进一步以生物素加以修饰,然后再利用生物素-亲和素(链亲和素)的高亲和特性实现修饰的配体与肿瘤抗原的缀合。
在本实施方案中,我们将实施例1制备的migg1fc-neutravidin杂合蛋白与生物素化肿瘤抗原进行缀合。将实施例1制备的migg1fc-neutravidin与实施例2制备的生物素化肿瘤细胞(或细胞裂解物)共同孵育,利用亲和素与生物素的高亲和特点,通过migg1fc-neutravidin-biotin-tag(简写为migg1fc-tag)的形式,实现吞噬受体的配体与肿瘤抗原(tumorantigen,tag)的交联,即得到migg1fc-tag(实验设计原理如图4所示)。
我们按照2×105cells/ml接种4t1细胞到96孔板,每孔100μl,培养基(同实施例1的培养基)中含3mm的ac4manaz或sialicacid,培养24h。用含1%fbs的pbs洗细胞4次。加入50μmclick-itdibo-biotin,室温、避光、孵育60min。用含1%fbs的pbs洗细胞4次。加入含5μg/mlmigg1fc-neutravidin的pbs100μl(migg1fc作为对照),室温、孵育20min。用3%bsapbs洗细胞,3次。加入fitc标记的anti-migg1fc,室温下孵育15min。用含1%bsa的d-pbs洗细胞3次。4%多聚甲醛pbs固定细胞,室温、15min。用含1%bsa的pbs洗细胞3次。高内涵荧光酶标仪测定荧光强度;结果参见图8。图8中,fc代表migg1fc,control代表sialicacid,fc-avidin代表migg1fc-neutravidin杂合蛋白。
我们按照2×105cells/ml在6孔板接种细胞,每孔1000μl,培养24h。更新培养基,培基中含3mm的ac4mannaz,培养24h。用含1%fbs的pbs洗细胞4次。加入50μmclick-itdibo-biotin,室温、避光、孵育60min。用含1%fbs的pbs洗细胞4次。加入含5μg/mlmigg1fc-neutravidin的pbs500μl(migg1fc作为对照),室温、孵育20min。用3%bsapbs洗细胞,3次。裂解细胞:向培养孔加入冰浴的500μlripa裂解缓冲液(1%nonidetp40,1%sodiumdeoxycholate,0.1%sds,50mmtriethanolamineph7.4,150mmnacl,1×edta-freepiercenthalttmproteaseinhibitorcocktail)和50u(0.5μl)
我们的实验结果表明(图示为4t1细胞实验结果;ct26.wt实验结果与4t1类似,故未展示):经免疫荧光观察证实(图8),migg1fc-neutravidin与生物素-唾液酸化的肿瘤细胞有明显的结合(图9);proteina/g免疫沉淀及sds-page分析证实,生物素-唾液酸化的肿瘤细胞表面抗原被migg1fc-neutravidin结合,形成migg1fc-tag(图8)。
实施例4新型肿瘤细胞疫苗的制备以及此类疫苗在肿瘤动物模型的治疗效果评价
4.1新型肿瘤细胞疫苗的制备策略
4.1.1肿瘤细胞裂解物:通过实施例3制备出吞噬受体配体缀合的肿瘤细胞后,将细胞通过反复冻融的办法制成细胞裂解液,这种裂解液中含有大量与吞噬受体配体交联的肿瘤细胞表面抗原。因此,这样的制备物与适当的佐剂混合就可以制成新型的肿瘤疫苗,进行预防或治疗接种。
4.1.2吞噬受体的配体与肿瘤细胞表面抗原的交联物:通过实施例3制备出吞噬受体配体缀合的肿瘤细胞后,用细胞裂解液将细胞裂解,然后纯化裂解物中的蛋白。这种纯化的裂解物蛋白含有大量与吞噬受体配体交联的肿瘤细胞表面抗原。因此,这样的制备物与适当的佐剂混合就可以制成新型的肿瘤疫苗,进行预防或治疗接种。
4.1.3在本实施方案,我们考察了新型肿瘤细胞裂解物疫苗对小鼠乳腺癌模型的治疗效应。将实施例1制备的migg1fc-neutravidin与生物素化的4t1肿瘤细胞缀合;缀合完成后,通过6轮冻融制备细胞裂解液;最后将细胞裂解液与适量polyiclc(polyinosinic-polycytidylicacidsodiumsalt,sigma,p1530)混合,经肌肉注射接种荷瘤小鼠。
4.1.4在三组雌性balb/c小鼠(每组10只)皮下乳房垫处原位种植4t1细胞5×104个(100μl),建立乳腺癌小鼠荷瘤模型。按照4.1.3方法制备治疗疫苗,对照疫苗用未经处理的4t1细胞冻融液(经6轮冻融)制备。在小鼠接种4t1细胞7天、14天、21天各进行一次疫苗注射,每只小鼠腿部肌肉注射50μl疫苗工作液(蛋白含量4mg/ml)。
本实施例中三组balb/c小鼠(每组n=10)分别采用pbs(pbs组)、冻融法制备新型肿瘤细胞裂解液疫苗(fc-4t1组)及传统肿瘤细胞裂解液疫苗(4t1组);同时分别在动物荷瘤后不同时间(如图11所示)测量、计算肿瘤体积。各点数据为均数±sd。组间比较采用单因素方差分析和dunnett's检验。p<0.05,新型疫苗治疗组与其它两组在相应时间点比较(15、18、21天);
每天观察小鼠肿瘤生长状况,记录肿瘤体积及小鼠的生存时间。我们的实验结果表明,采用新型肿瘤细胞裂解液疫苗明显迟滞肿瘤的生长,延长荷瘤动物的生存时间(图10、图11),效果明显优于传统方法制备的肿瘤裂解物疫苗。
4.1.5在本实施方案中我们还考察了新型肿瘤细胞裂解物疫苗对小鼠结直肠癌模型的治疗效。将实施例1制备的migg1fc-neutravidin与生物素化的ct26.wt肿瘤细胞缀合;缀合完成后,通过6轮冻融制备细胞裂解液;最后将细胞裂解液与适量polyiclc混合,经肌肉注射接种荷瘤小鼠。本实施例中三组balb/c小鼠(每组n=10)分别采用pbs(pbs组)、冻融法制备新型肿瘤细胞裂解液疫苗(fc-ct26.wt组)及传统肿瘤细胞裂解液疫苗(ct26.wt组);
4.1.5在三组雄性balb/c小鼠(每组10只)皮下原位种植ct26.wt肿瘤细胞5×104个(100μl),建立结直肠癌小鼠荷瘤模型。按照4.1.3方法制备治疗疫苗,对照疫苗用未经处理的ct26.wt细胞冻融液(经6轮冻融)制备。在小鼠接种ct26.wt细胞7天、14天、21天各进行一次疫苗注射,每只小鼠腿部肌肉注射50μl疫苗工作液(蛋白含量4mg/ml)。同时分别在动物荷瘤后不同时间(如图13所示)测量、计算肿瘤体积。各点数据为均数±sd。组间比较采用单因素方差分析和dunnett's检验。p<0.05,新型疫苗治疗组与其它两组在相应时间点比较(15、18、21天);每天观察小鼠肿瘤生长状况,记录肿瘤体积及小鼠的生存时间。我们的实验结果表明,采用新型肿瘤细胞裂解液疫苗明显迟滞肿瘤的生长,延长荷瘤动物的生存时间(图12、图13),效果明显优于传统方法制备的肿瘤裂解物疫苗。
实施例5新型树突细胞肿瘤疫苗的制备以及此类疫苗在肿瘤动物模型的治疗效果评价
5.1树突细胞肿瘤疫苗制备的策略
5.1.1直接向体内树突细胞负载抗原:可采取的做法是先用适宜的细胞因子(如flt3l)动员骨髓中的树突细胞前体进入外周血,然后将制备好的肿瘤抗原通过一定的途径(如静脉注射、淋巴结内注射、瘤内注射、皮下或皮内注射)输入体内,意在使较多的树突细胞捕获抗原以便加工、呈递抗原。对于本发明而言,用实施例4制备的新型肿瘤细胞裂解液疫苗及吞噬受体的配体与肿瘤抗原的交联物就可以按照这种方式使用。
5.1.2经体内(exvivo)树突细胞肿瘤疫苗制备方法:首先从外周血分离得到树突细胞前体(如单核细胞),在体外采用细胞因子组合刺激细胞使其分化成为活化的树突细胞(对于实验动物,还可以从骨髓、脾脏、淋巴结获得树突细胞);然后用制备好的肿瘤抗原负载活化的树突细胞;接下来是用促成熟剂(如刺激性tlr配体lps等)促使树突细胞成熟;最后通过一定途径(如静脉注射、淋巴结内注射、瘤内注射、皮下或皮内注射)将树突细胞再回输到体内。对于本发明而言,用实施例4制备的新型肿瘤细胞裂解液疫苗及吞噬受体的配体与肿瘤抗原的交联物就可以按照这种方式使用。
5.2在本实施方案,我们考察了新型树突细胞肿瘤疫苗对小鼠乳腺癌模型及小鼠结直肠癌模型的治疗效应。
5.2.1新型树突细胞肿瘤疫苗对乳腺癌小鼠模型的治疗效应。
将将实施例1制备的migg1fc-neutravidin与生物素化的4t1肿瘤细胞缀合;缀合完成后通过6轮冻融制备细胞裂解液;将细胞裂解液负载分离得到的小鼠树突细胞,制备新型疫苗;最后将树突细胞肿瘤疫苗接种荷瘤小鼠。对照疫苗用未经处理的4t1细胞冻融液(经6轮冻融)负载树突细胞进行制备。
小鼠树突细胞的制备及处理:从balb/c小鼠骨髓中提取出骨髓细胞,经红细胞裂解液处理后,将剩下的细胞用含12%fbs的rpmi-1640培养基培养,培养基中加入终浓度均为10ng/ml的细胞因子rmgm-csf和rmil-4刺激分化;负载肿瘤抗原后,用10ng/ml的细胞因子rmtnf-α刺激树突细胞成熟。
树突细胞肿瘤疫苗的接种:待树突细胞成熟后,在荷瘤小鼠腋下淋巴结附近接种负载肿瘤抗原树突细胞1×106个(100μl),接种为小鼠荷瘤后7天、14天、21天各进行一次;未经处理的4t1细胞冻融液负载的树突细胞作为对照。
乳腺癌小鼠模型:在雌性balb/c小鼠(3组,每组10只)皮下乳房垫处原位种植4t1细胞5×104个(100μl),建立乳腺癌小鼠荷瘤模型。三组小鼠分别采用pbs(pbs组)、新型肿瘤细胞裂解液负载的树突细胞(fc-4t1dc组)及传统肿瘤细胞裂解液负载的树突细胞(4t1dc组)。在小鼠接种肿瘤细胞后7天、14天和21天进行免疫。同时分别在动物荷瘤后不同时间(如图15所示)测量、计算肿瘤体积。各点数据为均数±sd。组间比较采用单因素方差分析和dunnett's检验。动物存活情况采用kaplan-meier法分析。
我们的实验结果表明,采用新型树突肿瘤细胞疫苗明显迟滞肿瘤的生长,延长荷瘤动物的生存时间(图14、图15),效果明显优于传统方法制备的树突细胞肿瘤疫苗。
5.2.2新型树突细胞肿瘤疫苗对结直肠癌小鼠模型的治疗效应。
将实施例1制备的migg1fc-neutravidin与生物素化的ct26.wt肿瘤细胞缀合;缀合完成后通过6轮冻融制备细胞裂解液;将细胞裂解液负载分离得到的小鼠树突细胞,制备新型疫苗;最后将树突细胞肿瘤疫苗接种荷瘤小鼠。对照疫苗用未经处理的ct26.wt细胞冻融液(经6轮冻融)负载树突细胞进行制备。
小鼠树突细胞的制备及处理:从balb/c小鼠骨髓中提取出骨髓细胞,经红细胞裂解液处理后,将剩下的细胞用含12%fbs的rpmi-1640培养基培养,培养基中加入终浓度均为10ng/ml的细胞因子rmgm-csf和rmil-4刺激分化;负载肿瘤抗原后,用10ng/ml的细胞因子rmtnf-α刺激dc成熟。
树突细胞肿瘤疫苗的接种:待dc成熟后,在荷瘤小鼠腋下淋巴结附近接种负载肿瘤抗原dc疫苗1×106个(100μl),接种为小鼠荷瘤后7天、14天、21天各进行一次;未经处理的ct26.wt细胞冻融液负载的树突细胞作为对照。
结直肠癌小鼠模型:在雄性balb/c小鼠(3组,每组10只)背部皮下种植ct26.wt细胞1×106个(100μl),建立结直肠癌小鼠荷瘤模型。三组小鼠分别采用pbs(pbs组)、新型肿瘤细胞裂解液负载的树突细胞(fc-ct26.wtdc组)及传统肿瘤细胞裂解液负载的树突细胞(ct26.wtdc组);在小鼠接种肿瘤细胞后7天、14天和21天进行免疫。同时分别在动物荷瘤后不同时间(如图15所示)测量、计算肿瘤体积。各点数据为均数±sd。组间比较采用单因素方差分析和dunnett's检验。动物存活情况采用kaplan-meier法分析。
我们的实验结果表明,采用新型树突肿瘤疫苗明显迟滞肿瘤的生长,延长荷瘤动物的生存时间(图16、图17),效果明显优于传统方法制备的树突细胞肿瘤疫苗。
根据已经公开的所有教导,可以对以上细节进行各种修改和替换,这些均在本发明的保护范围内。本发明的全部范围由所附专利要求及其任何等同物给出。
- 还没有人留言评论。精彩留言会获得点赞!