一种仿生骨组织工程支架及其制备方法与应用与流程
本发明属于生物医药材料技术领域。更具体地,涉及一种以琼脂糖凝胶和有序化多壁碳纳米管为基础的仿生骨组织工程支架及其制备方法与应用。
背景技术:
骨组织的重要性和骨相关疾病带来的危害,加速了骨组织工程的发展。在此大背景下,骨组织工程因具有治疗骨相关损伤或疾病的巨大潜力,而成为修复损伤器官的新的前沿的方法。通常而言,骨组织工程的研究包含了三大元素:支架、细胞和生长因子。上述三者中,对支架的研究是目前研究较为活跃的领域之一。骨组织工程要求所用支架既是理想的骨替代物,又同时具有能够诱导骨细胞形成矿化组织的性能。
目前,市场上以灭活异种骨替代物为产品主流,该类型支架是对已有异种动物的成型骨组织进行灭活处理,得到无或少免疫排斥反应的支架材料。但材料形状不可控和灭活的高成本是其最明显的两个缺点。此外,以羟基磷灰石(ha)和磷酸三钙为基础的支架材料是另一类主流产品。该产品可结合前期诊断中的磁共振成像结果,通过3d打印技术打造出与骨损部位相匹配的形状。然而,打印所采用的煅烧探头决定了该技术只能使用无机材料作为原材料,仿生程度不高,同时,高昂的诊断、构建和植入成本也成为这一治疗手段的弊端。因此,作为关键因素之一,构建和修饰支架同样值得我们关注。而能否构建更接近于生理骨组织结构的仿生支架材料,便成了这一领域主要的研究课题之一。骨组织工程包含三大元素:细胞、支架和生长因子。在支架设计上,如何仿造正常生理结构特点以构建与其相仿的骨组织工程支架以促进骨细胞更好的生长,是当前研究的一大热点。
尽管目前已开发出多种修饰骨组织工程支架的方案,但开发出最接近理想的技术仍然是一种挑战。
技术实现要素:
本发明要解决的技术问题是克服现有仿生骨组织工程支架的缺陷和不足,采用琼脂糖凝胶(ag)作为支架本体,利用电泳技术使表面矿化的多壁碳纳米管(cnts)在其内部形成有序化的结构以此修饰支架构建了ag-o-cnts仿生骨组织工程支架。该支架能够有效促进骨间充质干细胞(bmscs)的生长,在骨组织工程支架材料或骨替代材料方面具有很好的应用前景。
本发明的目的是提供一种以琼脂糖凝胶和有序化多壁碳纳米管为基础的仿生骨组织工程支架及其制备方法。
本发明另一目的是提供所述仿生骨组织工程支架在作为或制备骨组织工程支架材料或骨替代材料方面的应用。
本发明上述目的通过以下技术方案实现:
一种以琼脂糖凝胶和有序化多壁碳纳米管为基础的仿生骨组织工程支架的制备方法,首先对碳纳米管(cnts)依次进行羧基化和多巴胺化表面修饰,然后在模拟体液环境中使得多巴胺化cnts表面形成羟基磷灰石颗粒,构建得到生物矿化cnts;最后利用琼脂糖(ag)构建本体支架,并在此基础上利用电泳技术使得矿化cnts在支架内部泳动,形成有序化平行排列的阵列,以此构建得到仿生骨组织工程支架ag-o-cnts。
具体地,上述以琼脂糖凝胶和有序化多壁碳纳米管为基础的仿生骨组织工程支架的制备方法,包括如下步骤:
s1.对cnts进行羧基化处理得到羧基化cnts;
s2.对羧基化cnts进行多巴胺化处理得到多巴胺化cnts;
s3.多巴胺化cnts在模拟体液中浸泡处理,形成羟基磷灰石化cnts(h-cnts);
s4.将h-cnts进行琼脂糖凝胶电泳,然后静置,得到ag-o-cnts支架。
其中,优选地,步骤s1是利用体积比为1:3~1:5的浓硝酸与浓硫酸的混酸进行羧基化处理。
优选地,步骤s2是利用edc、hhs和左旋多巴胺共处理进行多巴胺化修饰。
优选地,步骤s3所述浸泡处理的时间为4~12周。
优选地,步骤s4所述电泳的条件为140mv恒压电泳0.5~1.5h,静置时间为3~5h。
更优选地,步骤s1的具体方法是:
s11.将cnts超声分散于2.0~3.0mol/l硝酸中,交替进行超声与磁搅拌处理24~48h,离心分离并用去离子水洗至中性后干燥;
s12.将s11干燥后的产物超声分散于体积比1:3~1:5的浓硝酸与浓硫酸的混酸中,交替进行超声与磁搅拌处理2~6h,离心分离并用去离子水洗至中性后干燥;
s13.将s12干燥后的产物超声分散于质量分数为10~25%的过氧化氢水溶液中,交替进行超声与磁搅拌处理1.5~2.5h,用去离子水洗至中性后干燥,得到羧基化cnts。
其中,优选地,步骤s11中cnts和硝酸的质量体积比为0.1~0.3g:10~30ml。
优选地,步骤s12中干燥后的产物和混酸的质量体积比为0.1~0.3g:10~30ml。
优选地,步骤s13中干燥后的产物和过氧化氢水溶液的质量体积比为0.1~0.3g:10~30ml。
另外,优选地,步骤s2的具体方法是:
s21.将羧基化cnts加入无水乙醇中并超声分散制成分散液,然后加入edc与nhs,交替进行超声与磁搅拌处理1~3h;然后加入左旋多巴胺,继续交替进行超声与磁搅拌处理1~3h;
s22.步骤s21得到的产物离心分离并用去离子水洗涤至中性后干燥,得到多巴胺化cnts。
其中,优选地,步骤s21所述羧基化cnts和无水乙醇的质量体积比为0.1~0.3g:10~30ml。
优选地,步骤s21所述羧基化cnts、edc、nhs和左旋多巴胺质量比为10~30:6~18:9~27:9~27。
另外,优选地,步骤s3所述多巴胺化mwcnts和模拟体液的质量体积比为:0.001~0.003g:0.5~5ml。
更优选地,步骤s3的具体操作为:取多巴胺化mwcnts浸泡于模拟体液(sbf)中,处理完成后将mwcnts离心分离并用去离子水洗涤至中性后干燥,得h-cnts。
优选地,所述模拟体液(sbf)的配方为:nacl6~10g/l;nahco30.1~0.4g/l;kcl0.1~0.4g/l;k2hpo4·3h2o0.1~0.4g/l;mgcl2·6h2o0.1~0.5g/l;1.0mhcl10~50ml/l;cacl20.1~0.5g/l;na2so40.05~0.15g/l;tris5~10g/l。
优选地,步骤s4的具体操作为:在水平电泳槽中制备0.5%~5%的琼脂糖凝胶,然后加入tae电泳缓冲液,于电泳孔中添加h-cnts支架,采用140mv恒压电泳0.5~1.5h后,静置3~5h,得到ag-o-cnts支架。
其中,0.5%~5%的琼脂糖凝胶的制备方法为:tae缓冲液中加入0.5%~5%琼脂糖粉末,80~320℃加热至粉末溶解并持续沸腾0.5~1.5h后,静置20~50min,待液体温度下降至60~80℃,倒入电泳槽,静置,使其自然凝结。
优选地,所述tae缓冲液的配方为:tris1~10g/l;na2edta·2h2o0.5~1.0g/l;冰醋酸0.5~3ml/l。
另外,优选地,上述碳纳米管(cnts)为多壁碳纳米管(mwcnts)。
另外,作为一种优选地可实施方案,上述以琼脂糖凝胶和有序化多壁碳纳米管为基础的仿生骨组织工程支架(ag-o-cnts)的制备方法,包括如下步骤:
s1.cnts羧基化(即混酸化学功能化cnts):
将0.1~0.3gcnts超声分散于10~30ml浓度为2.0~3.0mol/l的硝酸中,超声与磁搅拌交替处理24~48h后,将cnts离心分离并用去离子水洗至中性后干燥;再将0.1~0.3g干燥后的cnts超声分散于10~30ml混酸中(浓硝酸与浓硫酸体积比为1:3~1:5),并将cnts混酸分散液交替进行超声与磁搅拌处理2~6h,处理后将cnt离心分离并用去离子水洗至中性后干燥,将0.1~0.3g干燥后的cnts超声分散于10~30ml质量分数为10~25%的过氧化氢水溶液,超声与磁搅拌交替处理1.5~2.5h,用去离子水洗至中性后干燥后,得到羧基化cnts;其中,超声与磁搅拌交替处理的间隔时间为0.5h~1h交换一次;
s2.cnts多巴胺化(即edc、hhs和左旋多巴胺共处理化学功能化cnts):
在10~30ml无水乙醇中加入0.1~0.3g羧基化cnts并超声分散制成分散液,加入60~180mgedc与90~270mgnhs后,超声与磁搅拌交替处理1~3h,加入左旋多巴胺90~270mg,继续超声与磁搅拌交替处理1~3h;处理完成后将cnts离心分离并用去离子水洗涤至中性后干燥,得到多巴胺化cnts;其中,超声与磁搅拌交替处理的间隔时间为0.5h~1h交换一次;
s3.制备羟基磷灰石化cnts(h-cnts)
取0.001~0.003g多巴胺化cnts浸泡于0.5~5ml模拟体液(sbf)中4~12周;处理完成后将cnts离心分离并用去离子水洗涤至中性后干燥,得h-cnts;
其中,模拟体液(sbf)的配方为:nacl6~10g/l;nahco30.1~0.4g/l;kcl0.1~0.4g/l;k2hpo4·3h2o0.1~0.4g/l;mgcl2·6h2o0.1~0.5g/l;1.0mhcl10~50ml/l;cacl20.1~0.5g/l;na2so40.05~0.15g/l;tris5~10g/l;
s4.构建ag-o-cnts支架:
在水平电泳槽中制备0.5%~5%的琼脂糖凝胶:tae缓冲液中加入0.5%~5%琼脂糖粉末,80~320℃加热至粉末溶解并持续沸腾0.5~1.5h后,静置20~50min,待液体温度下降至60~80℃,倒入电泳槽,静置,使其自然凝结;
电泳槽中加入tae电泳缓冲液,于电泳孔中添加h-cnts支架,采用140mv恒压电泳0.5~1.5h后,静置3~5h,得到ag-o-cnts支架;
其中,标准tae缓冲液的配方为:tris1~10g/l;na2edta·2h2o0.5~1.0g/l;冰醋酸0.5~3ml/l。
根据上述方法制备得到的仿生骨组织工程支架,及其在在作为或制备骨组织工程支架材料或骨替代材料方面的应用,也均应在本发明的保护范围之内。
在本发明的研究过程中,为更好的设计骨组织工程支架,我们需要更好的了解骨组织的组成成分和结构特征。骨组织的成分可分为有机成分和无机成分两大类,各自比例分别为35%和65%。其中,95%的有机成分为胶原纤维(col),另外约5%为无定型凝胶状机制,其主要成分为糖胺聚糖和钙结合蛋白。无机成分的大部分为ha,是由成骨细胞的胞外基质钙化所得。在骨组织中,两分子胶原原纤维互相缠绕形成胶原纤维。钙化的胶原纤维平行排列,形成片层结构,即骨板。各骨板交错叠加,围绕形成骨单位,从而构成密质骨的基本结构。由此可见,该结构中起主要作用的成分有两种:ha和col。为了达到仿生的目的,我们可以从两方面入手:一者是材料成分上的仿生,二者是材料结构上的仿生。
在本发明的研究过程中,显示了cnts对bmscs的生长促进作用(图12-图14),经过6天培养,原始支架上的细胞数目可以增加约50%,而有序化cnts修饰的支架更使得细胞数目增加近一倍。进一步地,由于cnt存在毒性和生物相容性问题,我们对cnts进行了表面修饰处理。
首先,我们对cnts进行了多巴胺修饰处理,其后在模拟体液环境中利用多巴胺上的酚羟基促使羟基磷灰石结晶在cnts表面成型,得到了cnts表面的羟基磷灰石结晶,即构建了h-cnts。我们的理化表征结果表面这一构建是成功的:cnts管径加大,表面上形成突起,cns之间相互连接,以及最重要的是saed结果显示出规则的六边形结构,提示了单晶的存在(图1-图4)。
另外,在解决了分散性的问题的基础上,为了进一步提升碳纳米管的性能,使其更加适合适应骨组织工程的要求,我们对利用cnts对支架材料进行修饰,而且是有序化的修饰以实现结构上的仿生,是我们探讨的另一个重点。琼脂糖凝胶电泳是用琼脂糖作支持介质的一种电泳方法。其分析原理与其他支持物电泳的最主要区别是:它兼有“分子筛”和“电泳”的双重作用。琼脂糖凝胶具有网络结构,物质分子通过时会受到阻力,大分子物质在涌动时受到的阻力大,因此在凝胶电泳中,带电颗粒的分离不仅取决于净电荷的性质和数量,而且还取决于分子大小,这就大大提高了分辨能力。但由于其孔径相当大,对大多数蛋白质来说其分子筛效应微不足道,现广泛应用于核酸的研究中。在本发明的研究中,碳纳米管首先经过矿化处理,其次在凝胶支架中形成有序化阵列,使得支架更接近骨头的生理生化特性,以便骨细胞在其上的生长。当前结果表面,ag-o-cnts支架确实能够引导bmscs呈现有序化的排布,同时提高了细胞数目,即促进了细胞的生长。将琼脂糖凝胶用于组织工程领域的支架构建,发现琼脂糖膜阻止细胞的勃附和伸展,从而保持细胞的圆形形态,同时,细胞在琼脂糖表而直接接触,加强了细胞之间的信息交流,有利于维持细胞的表型。
本发明在制备ag-o-cnts支架后,通过扫描电镜、透射电镜、电子衍射、红外光谱、管径检测、白光干涉等多种理化表征结果表明,多壁碳纳米管表面修饰成功,有序化ag-o-cnts支架得以成功构建;同时,有序化碳纳米管阵列改变了支架的力学性能。然后,体外实验中,将bmscs细胞接种于支架上,并通过dapi染色和细胞计数实验检测支架对该细胞的生长促进作用;结果显示支架能有效地促进bmscs的生长,表现为细胞数量的增加和生长更加有序化。
本发明具有以下有益效果:
1、首次在cnts上进行矿化处理,构建了表面ha修饰的cnts;这一处理丰富了cnts表面修饰的可能性,实现了支架成分上的仿生,为后续提高支架强度奠定了基础。
2、在电泳条件下实现了h-cnts在支架上的有序排布,实现支架材料结构上的仿生,提高支架的力学性能。
3、本发明制备得到的仿生骨组织工程支架ag-o-cnts应用于骨组织工程的研究发现,该支架能够有效促进骨间充质干细胞(bmscs)的生长,在骨组织工程支架材料或骨替代材料方面具有很好的应用前景。
附图说明
图1为仿生骨组织工程支架ag-o-cnts的制备过程示意图。
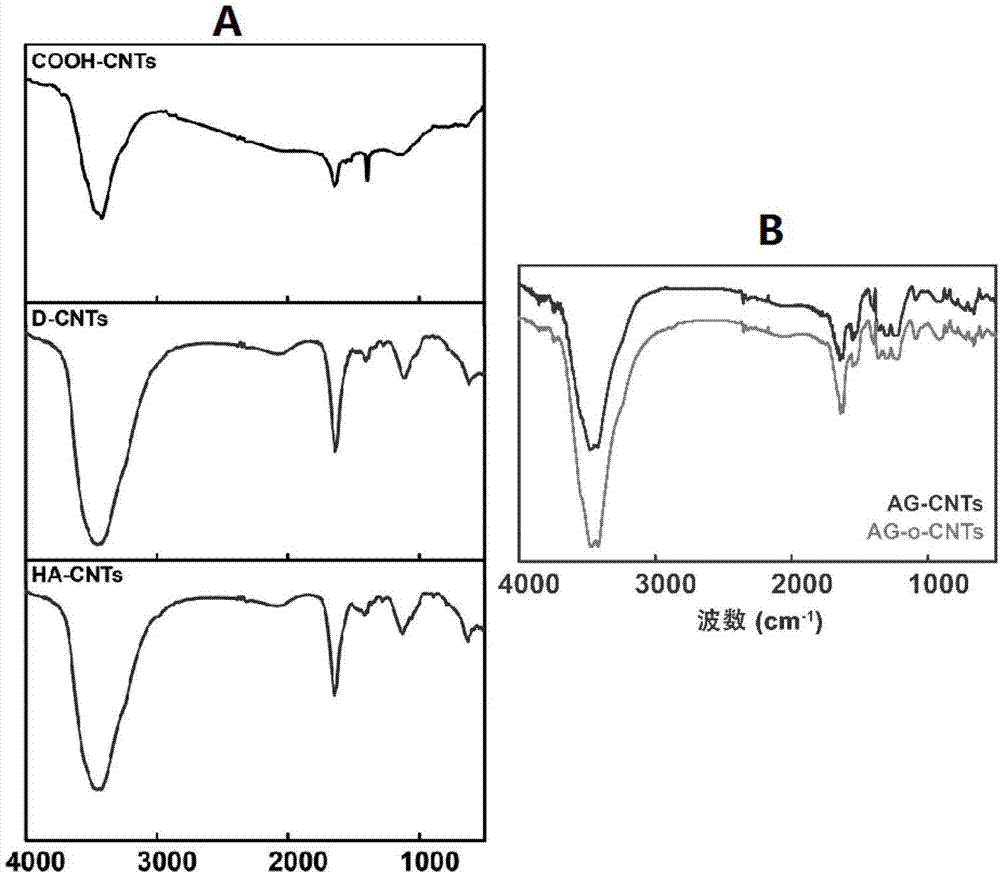
图2为红外表征结果,a图为羧基化、多巴胺化、矿化多壁碳纳米管后的红外表征结果,b图为有序化ha-col-cnt支架的红外结果。
图3为羧基化、多巴胺化、矿化多壁碳纳米管后的扫描电镜(sem)与透射电镜(tem)结果。
图4为羧基化、多巴胺化、矿化多壁碳纳米管后的管径对比。
图5为羧基化、多巴胺化、矿化多壁碳纳米管后的选区电子衍射图谱。
图6为多巴胺化多壁碳纳米管琼脂糖电泳后的扫描电镜(sem)检测结果。
图7为支架材料sem图像的fft分析结果。
图8为不同修饰方法修饰支架后,单位支架上cnt加载量。
图9为支架表面形貌表征结果。
图10为支架热失重情况分析结果。
图11为支架硬度检测结果。
图12为支架弹性模量检测结果。
图13为支架上bmscs细胞的dapi荧光检测结果。
图14为支架上bmscs细胞的生长情况。
图15为支架上培养bmscs细胞的流式细胞检测结果。
图16为流式细胞术统计支架上培养bmscs的数量(左)和细胞周期(右)。
具体实施方式
以下结合说明书附图和具体实施例来进一步说明本发明,但实施例并不对本发明做任何形式的限定。除非特别说明,本发明采用的试剂、方法和设备为本技术领域常规试剂、方法和设备。
除非特别说明,以下实施例所用试剂和材料均为市购。
以下实施例所用细胞株为:大鼠骨间充质干细胞(bmscs),由中山大学医学院动物中心提供,经本实验室传代培养。
以下实施例所用主要试剂为:
多壁碳纳米管(mwcnts):分为粗短、细长两种类型,粗短型(以下简称短碳管s碳管)直径90-100nm、长1-2μm,细长型(以下简称长碳管l碳管)直径10-20nm、长10-20μm,购自深圳市纳米港有限公司;常规琼脂糖g-10粉剂购自biowest公司;低糖dmem培养基均为gibcobrl公司产品;新生小牛血清购自杭州四季青生物工程材料有限公司;24孔聚苯乙烯组织培养基板为美国corning康宁公司产品;凝胶回收试剂盒购自康维世纪生物技术有限公司。
以下实施例所用主要仪器为:
德国leo公司场发射扫描电镜:leo1530vp,nikon显微镜,日本olympus公司光学倒置显微镜,sigma32184高速冷冻离心机,thermoco2培养箱,江苏省金坛市医疗仪器厂78-1磁力搅拌器,hv-85高压灭菌器,无菌操作台,广州科桥实验技术设备有限公司恒温水浴锅等。
以下实施例统计学分析本实验采用用spss19.0统计软件进行方差分析,分析函数为lsd和duncan,p<0.05表示差异显著。
实施例1仿生骨组织工程支架ag-o-cnts的制备
本发明仿生骨组织工程支架的制备过程如图1所示,首先对羧基化多壁碳纳米管(cooh-cnts)进行多巴胺化修饰,形成多巴胺化多壁碳纳米管(dopamine-cnts,d-cnts)。其后,将该类型碳纳米管置于模拟体液中4-8周,模拟体液中的磷离子和钙离子将在多巴胺上酚羟基的引导下形成羟基磷灰石,因此,构建得到矿化多壁碳纳米管(hydroxyapatite-cnts,h-cnts,即搭载了羟基磷灰石的多壁碳纳米管)。其后,以电泳的方式使得h-cnts在琼脂糖凝胶中形成有序化平行排列的阵列,以此构建得到仿生有序化琼脂糖-碳纳米管支架(ag-o-cntsscaffold)。
具体地,本发明仿生骨组织工程支架ag-o-cnts的制备方法如下:
1、多壁碳纳米管(mwcnts)的化学功能化
(1)mwcnts羧基化(即混酸化学功能化mwcnts):
将0.1~0.3gmwcnts超声分散于10~30ml浓度为2.0~3.0mol/l的硝酸中,超声与磁搅拌交替处理24~48h后,将mwcnts离心分离并用去离子水洗至中性后干燥。再将0.1~0.3g干燥后的mwcnts超声分散于10~30ml混酸中(浓硝酸与浓硫酸体积比为1:3~1:5),并将mwcnts混酸分散液交替进行超声与磁搅拌处理2~6h,处理后将mwcnt离心分离并用去离子水洗至中性后干燥,将0.1~0.3g干燥后的mwcnts超声分散于10~30ml质量分数为10~25%的过氧化氢水溶液,超声与磁搅拌交替处理1.5~2.5h,用去离子水洗至中性后干燥后,得到羧基化mwcnts,备用。
其中,超声与磁搅拌交替处理的间隔时间为0.5h~1h交换一次。
(2)mwcnts多巴胺化(即edc、hhs和左旋多巴胺共处理化学功能化mwcnts):
在10~30ml无水乙醇中加入0.1~0.3g羧基化mwcnts并超声分散制成分散液,加入60~180mgedc与90~270mgnhs后,超声与磁搅拌交替处理1~3h,加入左旋多巴胺90~270mg,继续超声与磁搅拌交替处理1~3h。处理完成后将mwcnts离心分离并用去离子水洗涤至中性后干燥,得到多巴胺化mwcnts,备用。
其中,超声与磁搅拌交替处理的间隔时间为0.5h~1h交换一次。
2、羟基磷灰石化cnts(h-cnts)的制备
取0.001~0.003g多巴胺化mwcnts浸泡于0.5~5ml模拟体液(sbf)中4~12周。处理完成后将mwcnts离心分离并用去离子水洗涤至中性后干燥,得h-cnts,备用。
其中,模拟体液(sbf)的配方为:nacl6~10g/l;nahco30.1~0.4g/l;kcl0.1~0.4g/l;k2hpo4·3h2o0.1~0.4g/l;mgcl2·6h2o0.1~0.5g/l;1.0mhcl10~50ml/l;cacl20.1~0.5g/l;na2so40.05~0.15g/l;tris5~10g/l。
3、支架构建
(1)ag-o-cnts支架构建:
在水平电泳槽中制备0.5%~5%的琼脂糖凝胶:tae缓冲液中加入0.5%~5%琼脂糖粉末,80~320℃加热至粉末溶解并持续沸腾0.5~1.5h后,静置20~50min,待液体温度下降至60~80℃,倒入电泳槽,静置,使其自然凝结。
电泳槽中加入tae电泳缓冲液,于电泳孔中添加h-cnts支架,采用140mv恒压电泳0.5~1.5h后,静置3~5h,得到ag-o-cnts支架。
其中,标准tae缓冲液的配方为:tris1~10g/l;na2edta·2h2o0.5~1.0g/l;冰醋酸0.5~3ml/l。
(2)另外,构建了ag-cnts支架进行对比试验:
将0.001~0.003gh-cnts超声分散于2~10ml标准tae缓冲液中配制成cnts悬浮液。
向体积比1:50~1:100的cnts悬浮液和tae的混合液中加入0.5%~5%琼脂糖粉末,80~320℃加热至粉末溶解并持续沸腾0.5~1.5h后,静置20~50min,待液体温度下降至60~80℃,倒入电泳槽,静置,使其自然凝结,生成ag-cnts支架。
实施例2仿生骨组织工程支架ag-o-cnts的表征
1、红外光谱检测
(1)将各试样和kbr在干燥机中进行干燥处理,将1-2mg试样与200mg纯kbr混合并研磨均匀,并将混合物研磨到粒度小于2μm,以免散射光影响。将混合物置于模具中,在油压机上用5-10mpa压力将混合物压成透明薄片,上机待定;同时,将空白支架与经过修饰的支架进行干燥处理,上机测定。
(2)cnts多巴胺化和羟基磷灰石修饰后的红外检测
为了进一步确定在sh-cnts表面生成的结构的成分,我们首先采用傅里叶红外光谱检测对样品进行分析。
实验如图2中的a图所示,结果表明,普通cooh-cnts的红外特征峰和其后经修饰的二者存在明显不同,表明多巴胺和羟基磷灰石成功的修饰在cooh-cnts表面。d-cnts的红外特征峰和h-cnts的基本一致,唯一差异在于h-cnts样品在1043.45cm-1处存在特征峰。这些结果初步表明,sh-cnts经矿化后,其表面确实形成了主要包含多巴胺和羟基磷灰石,可初步断定,实验如我们预想,sh-cnts的表面被成功矿化。
(3)有序化ha-col-cnt支架的红外检测
为了解支架修饰的结果,我们采用红外光谱实验对支架经行表征。如图2中的b图所示,实验中对h-cnts的电泳作用并未引起红外图谱中相应特征峰的变化。这证明支架有序化的构建过程未涉及化学反应。
2、电镜观察
(1)扫描电镜(sem)观察:将修饰后cnts或支架进行自然风干,将风干后的样品黏贴固定于样品台上并做喷金处理,将样品置于扫描电镜样品室内,将样品室抽成真空,进行扫描电镜观察。
透射电镜(tem)观察:将修饰后cnts或支架进行自然风干,将风干后的支架样品固定于样品台上,置于透射电镜样品室内,将样品室抽成真空,进行观察。并后续生成选区电子衍射(saed)图样,用以分析。
(2)cnts多巴胺化和羟基磷灰石修饰后的电镜观察结果
为了在sh-cnts表面进行生物矿化处理,我们首先对sh-cnts进行多巴胺修饰。此后,我们又将该cnts浸泡于模拟体液环境中。如图3所示,经过6周处理,sh-cnts表面可形成矿化结构:扫描电镜和透射电镜结果同时表明,单纯的多巴胺修饰未能引起sh-cnts形貌上较大的变化。扫描电镜下,c-cnts和d-cnts呈现出离散的管状结构,纳米管之间彼此相互独立,有相互缠绕的现象存在,但彼此之间界限分明,未发现更多的相互作用。透射电镜下,c-cnts和d-cnts大小均一,高放大倍数下可见明显而平滑的内外管壁,且如图4所示,外管径约为40nm。矿化处理后的sh-cnts发生明显变化:扫描电镜下,纳米管之间界限已不分明,h-cnts外周相互连接,形成片状结构,甚至能发现明显的颗粒结构;透射电镜下,h-cnts外壁存在大量的颗粒、突起,高放大倍数下,外表面不再平滑或均一,内管壁界限模糊,同时图4的统计结果表明,纳米管的外管径增大约50%,达到了约60nm。
上述结果从结构上初步证明了sh-cnts在多巴胺修饰和fbs浸泡的条件下,其表面可形成片状结构或突起,继而改变sh-cnts原有的形貌。
(3)cnts多巴胺化和羟基磷灰石修饰后的电子衍射图谱
如图5所示,因材料的修饰会引起材料选区电子衍射(saed)图谱的变化,尤其是有晶体生成的情况下,变化更加明显,所以,为进一步检测cnts表面羟基磷灰石的结构,我们采用saed对三种碳纳米管进行表征。通过该实验我们发现,单纯c-cnts和d-cnts图谱呈圆形或圆环形,周边不存在点状亮斑,这是因为这两种碳纳米管本身不具有晶体结构,材料本身原子排列不规整,无法形成规则的电子光栅,电子束经过材料后汇集到中央,汇集呈环状,不存在更具特征的衍射图样。然而,经过模拟体液的矿化后,结果有了明显不同:环状亮斑消失,取而代之的是呈正六边形分布的点状亮斑。这说明对应于前述的扫描电镜或透射电镜结果,sh-cnts管壁上增加的物质应为具有六边形晶体结构的单晶羟基磷灰石,晶体纯度高,在sh-cnts管壁上分布均匀。
综上,我们发现,模拟体液环境下,多巴胺化sh-cnts上的酚羟基有利于羟基磷灰石在sh-cnts管壁上结晶,用这种方法能得到理想的矿化h-cnts。
(4)有序化ag-o-cnts支架的电镜检测结果
为了使h-cnts在琼脂糖支架中呈现更有序的排列,我们采用琼脂糖凝胶电泳技术对其进行处理。我们采用120mv恒压电流,使h-cnts在0.5-5%的琼脂糖凝胶中进行电泳,并使用扫描电镜实验检测电泳结果。如图6所示,对比于未经电泳的ag-cnts组,h-cnts经电泳后形成了平行阵列:凝胶垂直面(纵剖面)可见密布的点状颗粒,水平面(横剖面)可见平行排列的h-cnts。该结果表明在电泳作用下的有序化的h-cnts阵列构建成功,可用于对琼脂糖支架的修饰。
4、快速傅里叶转换(fft)分析
为了进一步表明h-cnts在支架上的有序性,我们对图6中的sem结果进行快速傅里叶变换处理(fft)。得到上述sem结果后,采用imagej软件的fft功能对图像进行处理,得fft图像。这种方法可以对图像的数字信号进行简化处理,得到其傅里叶频域图谱,而越规则的图像处理后得到的图像越具规律性。
处理结果如图7所示:左图中由ag-cnts支架电镜图得到的fft图像只有深色的背景和中央亮斑,表明原图样规则性不强;但右图中ag-o-cnts支架电镜图得到的fft图像则不同,中央亮斑呈现波纹样变化,表明原图样具备更高的规律性。故我们可以得到以下结论:电泳的方法使得h-cnts在支架上呈现有规则的排布,即有序化cnts阵列得以实现。
5、改性后支架的cnts加载量分析
从两种类型支架上分别切取1-10cm3块状材料4-10个,采用胶回收试剂盒溶解材料,离心、真空冷冻干燥后,称量cnts质量。
单位支架材料上h-cnts的加载量检测结果如图8。经过测算我们发现,h-cnts接近100%的被修饰到了支架上,每立方厘米支架上的h-cnts约为8mg。是否经过有序化并不会影响h-cnts的加载量(图8)。
6、支架的表面形貌检测
接着,我们采用白光干涉技术检测了支架的外表面形貌。结果发现,从宏观上来看,支架形貌并未发生明显的变化,即有序化过程没有引起支架粗糙度的改变。图9左侧显示了两种支架材料的三维立体形貌,ag-cnts支架在这种视图下呈现不均一的起伏,在本体支架约2.6μm的基底高度上(白色),可见约为2.8μm的颗粒起伏(黑色)。相比较而言,ag-o-cnts支架较为均一,整体支架呈白色,未发现明显突起。然而,如图9右侧显示,当我们随机对样本片层进行采样并做统计分析后发现,两种支架的粗糙度差别并不明显:ag-cnts支架的平均ra值为3.68±0.71nm,而ag-o-cnts支架的平均ra值为3.40±0.83nm,两者间不具有统计学差异;同样,对于两种支架的平均ry值而言,该差异依然不明显(ag-cnts:ry=25.44±2.70μm;ag-o-cnts:ry=28.48±0.25μm)。我们更相信该实验所得的定量结果,并由此得出结论:虽然在纳米尺度上,电泳的过程引起了碳纳米管有序的排布,但在微米和毫米尺度上,这种有序化的处理对于支架的形貌并无明显的影响,支架依然保持原有的粗糙度不变。
7、支架热重分析
如图10,有序化的过程虽未发生化学反应,没有新物质生成,但h-cnts的有序排布却增加了材料的热稳定性。在我们进行的热失重检测中,ag-cnts支架在34.83℃时质量已损失了20%,且很快,在环境温度约100℃的情况下,支架质量下降至20%以下。对比而言,ag-o-cnts支架热重曲线的80%质量点出现在100.73℃处,而直到140℃左右,质量才低于20%。
8、支架的力学性能测定
分别采用国家质量检验标准gb/t18258-2000和gbt531.1-2008对支架进行杨氏模量检测和邵氏硬度检测。杨氏模量主要通过材料拉伸试验中的应力和应变测量获得,邵氏硬度主要通过硬度计测量获得。
为了检测支架的力学性能,我们对其硬度、应力和应变进行检测,并发现有序化前和有序化后,支架的硬度发生了改变。较为显著的变化是邵氏硬度测试中,有序化支架的硬度下降了约5度(图11),于此同时,该支架的杨氏模量也略有下降,但与未经有序化处理的支架不存在统计学差异,两者均在270kpa左右(图12)。我们推测其原因是:h-cnts未经电泳容易在支架中形成团聚,使得支架整体硬度增加,而平行化处理的h-cnts允许支架更大范围的拉伸变化,所以呈现出这样的力学检测结果。
实施例3仿生骨组织工程支架ag-o-cnts的应用
研究ag-o-cnts仿生支架促进mscs生长的作用,并以未经电泳处理的碳纳米管修饰琼脂糖支架(ag-cntsscaffold)为对照。
1、细胞培养
24孔细胞培养板中分别放入空白与经修饰支架1×1×1cm3,细胞在在培养瓶中融合培养至60-90%后,以1×104-3×104/孔的密度接种至24孔板上,培养2,4,6天,以进行后续实验。其它细胞培养条件为:含10%新生牛血清的低糖dmem培养基,37℃,5.0%co2。
为研究两款支架材料对细胞生长的影响,我们将大鼠骨间充质干细胞(bmscs)接种到支架上,并检测其生长状况。
2、免疫荧光(dapi)检测
首先利用dapi染色方法,初步检验细胞在支架上的密度和生长分布。
24孔板中的细胞培养后,pbs溶液摇床清洗3次,每次5min后,采用4%多聚甲醛固定30min,pbs清洗后,将实验组一分为二:直接进行染色或消化细胞后制成细胞涂片(涂片方法:胰酶浸泡样本4min后,含血清培养液终止消化,滴管吹打支架,2500rpm/min离心收集细胞,涂布于载破片上)。0.2%tritonx-100透化20min;pbs再次清洗后,避光dapi染液孵育3min。pbs清洗,镜检。
结果如图13所示,bmscs经过4天培养后,在不同支架上呈现明显不同的生长特征。对比于ag-cnts支架,我们发现,ag-o-cnts支架上的细胞生长有两大特点。一者,细胞数量更多,生长更密集。二者,更重要的是,细胞分布呈现规律性,即基本上沿h-cnts电泳的方向呈现平行分布和生长。h-cnts对细胞生长的引导作用尤为明显。
3、细胞计数与流式细胞(fcm)检测
通过两种定量的方式对支架上的bmscs进行统计。
(1)首先,用细胞计数板计算了单位支架上的细胞数目在经过2、4、6天培养后的变化。
24孔板中的细胞培养后,用胰蛋白酶消化3-5min后,采用细胞计数板统计细胞数。或用胰蛋白酶消化3-5min后,pbs溶液摇床清洗3次,每次5min后,在流式细胞仪中检测细胞周期。初始接种密度分别为:细胞计数1.0×104-3.0×104/孔;fcm0.5×105-2.0×105/孔。
结果如图14,数据表明,经过2天培养后,二实验组的单位面积细胞数均达到约2.4×104个。但其后,ag-o-cnts组的细胞显著增加,在第4和第6天分别达到了3.4×104和3.7×104个,明显多于ag-cnts组。
(2)其次,流式细胞仪对细胞数目进行统计,得到的结果类似,如图15-16。
与此同时,我们发现,ag-o-cnts组中s期和g1期的细胞显著增加,表明大部分细胞处在分裂的过程之中。
因此,我们可以发现,有序化的h-cnts确实有利于细胞的定向生长,且这种定向生长有效地提高了细胞数目,成功构建的ag-o-cnts支架材料是一种理想的骨组织工程支架。
综上实验研究结果可得出如下结论:
(1)在模拟体液环境下,表面修饰多巴胺的多壁碳纳米管(d-cnts)可以被矿化为表面覆盖羟基磷灰石的多壁碳纳米管(h-cnts)。
(2)以有序化h-cnts和琼脂糖凝胶为基础的ag-o-cnts骨组织工程支架可在电泳条件下成功构建。
(3)经有序化h-cnts阵列修饰后,支架具有良好的理化特性,适合后续体内植入需要。
(4)体外促进bmscs生长的效果在ag-o-cnts支架上得以实现。
(5)ag-o-cnts支架具有很好的应用潜力,可作为骨组织工程支架材料或骨替代材料进一步研究和开发。
- 还没有人留言评论。精彩留言会获得点赞!