一种拥有对电刺激和pH双重响应性能的抗菌可注射水凝胶及其制备方法和应用与流程
本发明属于可降解生物医用材料技术领域,具体涉及一种拥有对电刺激和ph双重响应性能的抗菌可注射水凝胶及其制备方法和应用。
背景技术:
通常的化学疗法中,在常规制剂给药后,药物自由分布于人体全身,只有少部分能够到达病灶部位,分散于非病灶部位的药物不但造成一定副作用,也极大减弱治疗效果。(upadhyayal,singhj,agarwalv,etal.journalofcontrolledrelease,2014,186:54-87.)同时,一些需要长期且频繁给药的慢性疾病也给病人带来极大痛苦,因此,制备一种能够使得化疗药物在原位注射并且在病灶部位释放的材料,同时兼备智能控制释放的需求是具有重要的临床意义。
近些年,一些新型水凝胶基于其优良的药代动力学以及多种可实践的优点,如易于调控机械性能、易于注射、药物包埋率高和药物定点释放等优点,在药物转运应用中得到了广泛的关注和深度的研究。其中基于海洋无毒天然生物材料壳聚糖(chitosan)及其改性的衍生物,制备可注射水凝胶的案例并不少见。(taht,dasscr,larsoni,choongpfm,dunstande.biomaterials.2009;30:3605-13;ruel-gariépye,shivem,bicharaa,etal.europeanjournalofpharmaceuticsandbiopharmaceutics,2004,57(1):53-63.l.zhao,l.zhu,f.liu,c.liu,d.shan,q.wang,int.j.pharmacol.2011;410;83–91.)。然而,近些年基于壳聚糖及其衍生物的可注射水凝胶存在着以下的不足:第一,一些慢性疾病需要长期且多次给药,甚至需要在特定时间段精准释放一定量的药物,与此对应,病人也希望在最合适的时间段补给足量药物并能够尽可能多的减少给药次数,而这些凝胶并不能实现这些需求;第二,由于人体体液在不同环境下ph会有轻微浮动,大部分是弱碱性,少部分如胃液约1~3,肠道组织约为5~7,而偶有出现的癌症肿瘤部位的酸碱值约在6以下,这些ph的浮动都会对用作药物控释的水凝胶造成结构损伤和毁坏,从而极大影响药物的传递,降低治疗效果;第三,常见微生物的感染,甚至一些耐药细菌的出现,也在一定程度上限制了这些水凝胶在临床上的应用。
技术实现要素:
本发明的目的在于克服现有技术中存在的问题,提供一种拥有对电刺激和ph双重响应性能的抗菌可注射水凝胶及其制备方法和应用,该方法工艺简单,价格低廉,同时制得的水凝胶具有对电刺激和ph双重响应性能,能满足药物精准释放的需求,并且拥有优良的抗菌性。
为了达到上述目的,本发明采用如下技术方案:
包括以下步骤:
(1)通过在壳聚糖上接枝聚苯胺,得到壳聚糖-聚苯胺共聚物;
(2)将壳聚糖-聚苯胺共聚物配制成溶液,并与氧化葡聚糖溶液混合,在25~40℃相互交联30~800秒,得到拥有对电刺激和ph双重响应性能的抗菌可注射水凝胶;其中壳聚糖-聚苯胺共聚物和氧化葡聚糖的质量比为(1~5)∶(1~6)。
进一步地,步骤(1)中壳聚糖-聚苯胺共聚物的具体制备步骤包括:先将壳聚糖和苯胺溶解到hcl水溶液中,再加入引发剂,在15~40℃反应18~36h,然后调节反应液的ph值至9~10,向反应液中加入5~8倍体积的乙醇,沉淀完全,最后抽滤并洗涤干燥,得到壳聚糖-聚苯胺共聚物;其中,壳聚糖、苯胺和引发剂的质量比为100∶(1~6)∶(2~12)。
进一步地,hcl水溶液的浓度为0.08mol/l~0.12mol/l;壳聚糖和hcl水溶液的比为100mg∶(8~20)ml。
进一步地,引发剂采用过硫酸铵。
进一步地,氧化葡聚糖的制备步骤具体包括:先将高碘酸钠溶液滴加入葡聚糖水溶液中,再在15~40℃避光反应18~36h,最后进行提纯得到氧化葡聚糖。
进一步地,高碘酸钠溶液是按质量体积比为3.28mg∶(80~150)ml将高碘酸钠溶于去离子水中配成的;葡聚糖水溶液是按质量体积比为1.25mg∶(80~130)ml将葡聚糖溶于去离子水中配成的;高碘酸钠溶液和葡聚糖水溶液体积比为100∶(300~600)。
进一步地,步骤(2)中壳聚糖-聚苯胺共聚物用质量分数1~4%的乙酸溶液配制成溶液,且该溶液中壳聚糖-聚苯胺共聚物的质量浓度为1~5%。
进一步地,步骤(2)中氧化葡聚糖溶液是将氧化葡聚糖用磷酸盐缓冲液配制成的,且氧化葡聚糖溶液中氧化葡聚糖的质量浓度为1~6%。
利用如上所述的制备方法制得的拥有对电刺激和ph双重响应性能的抗菌可注射水凝胶。
如伤所述的拥有对电刺激和ph双重响应性能的抗菌可注射水凝胶在药物控释中的应用。
与现有技术相比,本发明具有以下有益的技术效果:
本发明方法中,以海洋无毒天然生物材料壳聚糖为基础,在室温下接枝生物相容性良好的导电高分子聚苯胺(polyaniline),得到壳聚糖-聚苯胺共聚物(cp)作为水凝胶的主要原料,壳聚糖因为具有良好的生物相容性,生物可降解性和良好的抗菌性能,是一类重要的用于形成生物医用材料的原料,而应用前景广阔的聚苯胺导电高分子也常用于各种智能材料的制备中。天然葡聚糖(dextran)本身拥有无毒、水溶性好、价格低廉的特点,也是一种经典的用于生物医用材料的原料。本发明中,利用接枝聚苯胺的壳聚糖高分子即壳聚糖-聚苯胺共聚物(cp)和氧化葡聚糖聚合物(od)交联反应得到的拥有对电刺激和ph双重响应性能的抗菌可注射水凝胶(cp/od)。
进一步地,本发明使用的交联剂od是天然葡聚糖经高碘酸钠(naio4)氧化后得到的一种高分子葡萄糖聚合物,将其用作水凝胶的交联剂,可以提供稳定交联,且生物相容性极好,不会引起组织的钙化和细胞的毒性反映。
本发明制得的水凝胶具有以下优点:
(1)本发明中cp/od水凝胶对电压刺激的响应是由于聚苯胺链上的正电荷在负电压的刺激下逐渐减少,包埋在水凝胶结构中负电荷药物与聚苯胺链条上的负电荷相互作用,相互排斥,大量的小分子药物从水凝胶中释放;
(2)本发明中cp/od水凝胶对电压刺激的响应表现出来的“智能释放”特征,仅是在施加一定量电压的情况下发生,而电压取消时,水凝胶中聚苯胺链条电荷分布恢复,药物递送速率迅速下降至原始水平,满足特定时间给药的需求;
(3)本发明中壳聚糖-聚苯胺共聚物(cp)和氧化葡聚糖(od)之间交联是通过希夫碱键的作用,在弱酸性环境下,希夫碱键会因为氨基质子化断裂,造成水凝胶部分孔径变大,有利于包埋的药物释放,因而表现出明显的ph响应性能;
(4)本发明中cp/od水凝胶优良的抗菌性能是由于壳聚糖上带正电的氨基基团和被酸掺杂的聚苯胺都可以通过静电吸附的方法从而分解细菌的细胞壁,释放细胞内液,达到杀菌的目的,因而水凝胶cp/od的抗菌活性效果显著。
实验结果证明:本发明方法制得的对电刺激和ph双重响应性能的抗菌可注射水凝胶(cp/od)具有显著的电刺激响应性能和明显的ph响应性能,即在弱酸性环境中和弱碱性环境中药物释放量存在显著差异,在定量电压的刺激下药物释放速率增长显著,而取消电压施加时速率迅速减小到初始数值;在体外抗菌实验表明,本发明制得的对电刺激和ph双重响应的抗菌可注射水凝胶(cp/od),对革兰氏阴性菌大肠杆菌和革兰氏阳性菌的金黄色葡萄球菌有明显的杀灭作用,表现出良好的抗菌性能;同时,该方法制备的水凝胶能够显著促进成纤维细胞(l929)的粘附、增殖,显示出良好较强的生物相容性,因此在药物运输领域有着良好的应用前景。
附图说明
图1是本发明中聚合物cp,od和水凝胶cp/od的ft-ir图。
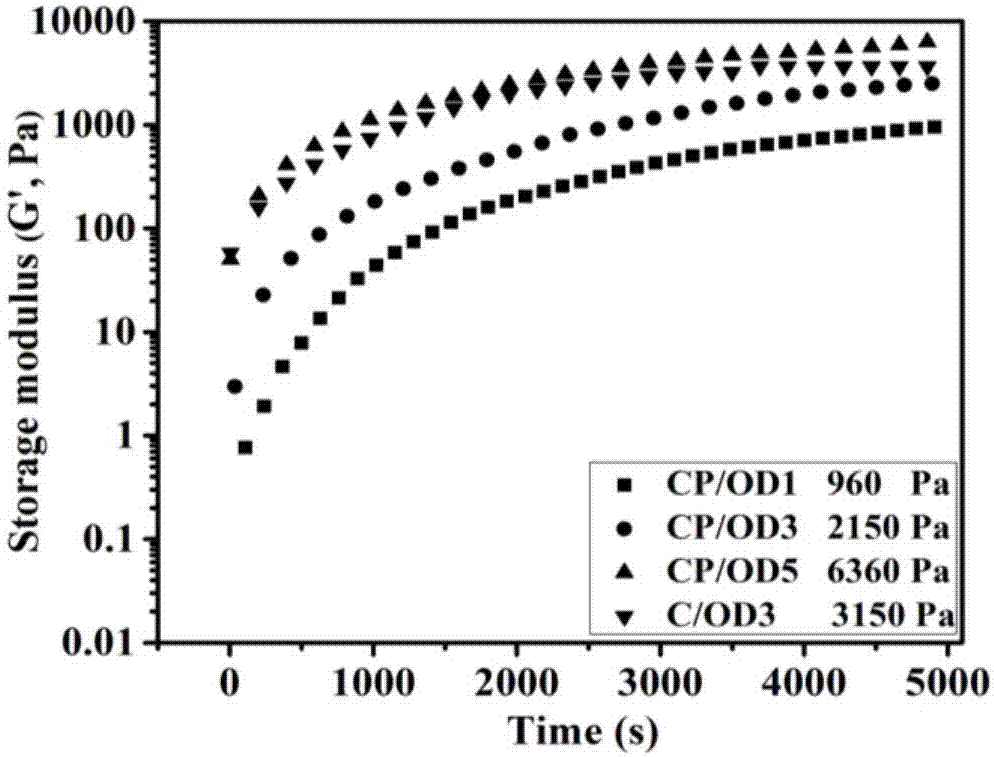
图2为本发明制得的cp/od可注射水凝胶流变学性能(存储模量-时间曲线)。
图3(a)是本发明制得的水凝胶的电化学测试中紫外可见光谱测试图(uv-vis),图3(b)是本发明制得的水凝胶的电化学测试中循环伏安图(cv);图3(c)是本发明制得的水凝胶的电化学测试中导电率图(conductivity)。
图4为本发明制得的可注射水凝胶在不同ph值的生理溶液磷酸盐缓冲液(pbs)中药物阿莫西林的释放曲线。
图5(a)为本发明制得的可注射水凝胶施加电刺激(3v,3分钟),包埋药物阿莫西林的释放曲线;图5(b)为本发明制得的可注射水凝胶施加电刺激(3v,3分钟),包埋药物布洛芬的释放曲线。
图6是水凝胶和成纤维细胞l929共同培养1,3,5天细胞存活数目统计图。
图7为本发明制得的cp/od水凝胶对大肠杆菌(e.coli)和金黄色葡萄球菌(s.aureus)的杀伤率的统计图。
图8(a)是cp聚合物和od聚合物质量比为4∶1的水凝胶(cp/od1)在ph值为5.5的生理溶液磷酸盐缓冲液(pbs)中进浸泡溶胀平衡后水凝胶孔径的扫描电子显微镜图片,图8(b)是cp聚合物和od聚合物质量比为4∶3的水凝胶(cp/od3)在ph值为5.5的生理溶液磷酸盐缓冲液(pbs)中进浸泡溶胀平衡后水凝胶孔径的扫描电子显微镜图片,图8(c)是cp聚合物和od聚合物质量比为4∶5的水凝胶(cp/od5)在ph值为5.5的生理溶液磷酸盐缓冲液(pbs)中进浸泡溶胀平衡后水凝胶孔径的扫描电子显微镜图片,比例尺是200μm。
图8(d)是cp聚合物和od聚合物质量比为4∶1的水凝胶(cp/od1)在ph值为7.4的生理溶液磷酸盐缓冲液(pbs)中进浸泡溶胀平衡后水凝胶孔径的扫描电子显微镜图片,图8(e)是cp聚合物和od聚合物质量比为4∶3的水凝胶(cp/od3)在ph值为7.4的生理溶液磷酸盐缓冲液(pbs)中进浸泡溶胀平衡后水凝胶孔径的扫描电子显微镜图片,图8(f)是cp聚合物和od聚合物质量比为4∶5的水凝胶(cp/od5)在ph值为7.4的生理溶液磷酸盐缓冲液(pbs)中进浸泡溶胀平衡后水凝胶孔径的扫描电子显微镜图片,比例尺是200μm。
具体实施方式
下面结合附图对本发明做进一步详细说明。
本发明致力于制备一种拥有对电刺激和ph双重响应性能的抗菌可注射水凝胶及其制备方法和应用,作为智能药物控释载体。以海洋无毒天然生物材料壳聚糖(chitosan)为基础,在室温下接枝生物相容性良好的导电高分子聚苯胺(polyaniline),得到壳聚糖-聚苯胺共聚物(cp)作为水凝胶的主要原料,壳聚糖因为具有良好的生物相容性,生物可降解性和良好的抗菌性能,是一类重要的用于形成生物医用材料的原料,而应用前景广阔的聚苯胺导电高分子也常用于各种智能材料的制备中。天然葡聚糖(dextran)本身拥有无毒、水溶性好、价格低廉的特点,也是一种经典的用于生物医用材料的原料。氧化葡聚糖(od)是由葡聚糖经高碘酸钠(naio4)氧化后得到的一种高分子葡萄糖聚合物,将其用作水凝胶的交联剂,可以提供持久稳定的交联,且生物相容性极好,不会引起组织的钙化和细胞的毒性反映。因此,在本发明中,利用接枝聚苯胺的壳聚糖高分子即壳聚糖-聚苯胺共聚物(cp)和氧化葡聚糖聚合物(od)交联反应得到的这种拥有对电刺激和ph双重响应性能的抗菌可注射水凝胶(cp/od)。这种水凝胶作为一种智能药物载体,不仅具备壳聚糖水凝胶原本拥有的良好性能(安全无毒、机械性能可调控、生物可降解、药物包埋率高和药物定点释放),又被赋予电刺激响应和ph响应这两种智能响应的特点,同时极好地利用原材料壳聚糖和聚苯胺的良好的抗菌能力从而使其也具有极好的抗菌性能,因此该种方法制备的水凝胶是药物智能控制释放的可降解生物医用材料是极佳选择。
一种拥有对电刺激和ph双重响应性能的抗菌可注射水凝胶及其制备方法和应用,包括以下步骤:
1)cp(chitosan-graft-polyaniline,壳聚糖-聚苯胺共聚物)聚合物的制备:按质量比100mg∶(1~6)mg将壳聚糖和苯胺加入到hcl水溶液(0.08mol/l~0.12mol/l)中,hcl水溶液的添加量以能够溶解壳聚糖和聚苯胺为准,壳聚糖和hcl水溶液的比为100mg∶(8~20)ml,随后加入过硫酸铵,壳聚糖与过硫酸铵的质量比为100mg∶(2~12)mg,在15~40℃反应18~36h,优选反应24h;随后加入1mol/lnaoh水溶液调节ph至9~10,使产物在溶液中逐渐析出并使聚苯胺去掺杂化;用反应液5~8倍体积的乙醇沉淀反应的溶液,使黑紫色固体完全析出,抽滤后用n-甲基-2-吡咯烷酮冲洗3次去除未反应的聚苯胺,再次沉淀后,室温干燥做后用;过硫酸铵用作引发剂;
2)od(oxidizeddextran,氧化葡聚糖)聚合物的制备:按质量体积比3.28mg∶(80~150)ml将高碘酸钠溶于去离子水中配成溶液,按质量体积比1.25mg∶(80~130)ml将葡聚糖溶于去离子水中配成溶液,将高碘酸钠溶液滴加入葡聚糖水溶液中,高碘酸钠溶液和葡聚糖水溶液体积比为100ml∶300~600ml,在15~40℃避光反应18~36h得到od聚合物,优选反应24h;
3)拥有对电刺激和ph双重响应性能的抗菌可注射水凝胶的制备:将cp聚合物用1~4wt%乙酸溶液配制成200μl浓度为1~5wt%的cp聚合物溶液,将od聚合物用0.01mol/l的磷酸盐缓冲液(pbs)配制成200μl浓度为1wt%~6wt%的od聚合物溶液,两种溶液混合,25~40℃相互交联30~800秒,即可得到对电刺激和ph双重响应的抗菌可注射水凝胶。
本发明制备的水凝胶cp/od具有优良的抗菌性能,具体是指水凝胶可以有效杀死革兰氏阴性菌和革兰氏阳性菌。本发明制备的水凝胶cp/od在弱酸性环境下,交联的结构部分断裂,水凝胶部分孔径变大,使得包埋的药物释放,因而表现出明显的ph响应性能。本发明制备的水凝胶cp/od在受到一定电压刺激下,水凝胶中电荷与药物电荷相互作用,使得负载药物在可控时间段内有效释放。本发明中对电刺激和ph双重响应的抗菌可注射水凝胶释放其包埋带负离子电荷药物中的应用,其中释放阿莫西林,布洛芬,阿司匹林,磷酸地塞米松等药物,本发明中主要展示亲水药物阿莫西林和疏水药物布洛芬的释放过程。
为了更好的理解本发明,下面结合具体实施方式对本发明进行详细说明,但本发明的内容不仅仅局限于下面的实施例。
实施例1
1)cp(chitosan-graft-polyaniline,壳聚糖-聚苯胺共聚物)聚合物的制备:将100mg壳聚糖和4.16mg苯胺加入到的10ml的0.1mol/lhcl水溶液中,随后加入10.2mg过硫酸铵,在25℃搅拌反应24h,随后加入1mol/lnaoh水溶液调节ph至9,使产物在溶液中逐渐析出并使聚苯胺去掺杂化;用反应液5倍体积的乙醇沉淀反应的溶液,使黑紫色固体完全析出,抽滤后用n-甲基-2-吡咯烷酮冲洗3次去除未反应的聚苯胺,再次沉淀后,室温干燥做后用;
2)od(oxidizeddextran,氧化葡聚糖)聚合物的制备:将3.28mg的高碘酸钠溶于100ml去离子水中配成溶液,按质量体积比1.25mg∶80ml将葡聚糖溶于去离子水中配成溶液,按高碘酸钠溶液和葡聚糖水溶液体积比为100ml∶400ml,高碘酸钠溶液被逐滴加入到葡聚糖水溶液中,在25℃下,避光搅拌反应24h,随后用二甘醇冲洗未反应的高碘酸钠;反应溶液用平均分子量3000的透析膜在去离子水中透析3天,产物在-80℃冷冻,使用冷冻干燥机两到三天后得到冻干产物;
3)拥有对电刺激和ph双重响应性能的抗菌可注射水凝胶的制备:将cp聚合物用2wt%乙酸溶液配制成200μl浓度为4wt%的cp聚合物溶液,将od聚合物用磷酸盐缓冲液配制成200μl浓度为1wt%的od聚合物溶液,两种溶液混合,涡旋振荡10秒钟,在37℃相互交联450秒,即可得到对电刺激和ph双重响应的抗菌可注射水凝胶,cp/od1。
实施例2
将步骤3)中的od聚合物溶液分别替换成3wt%、5wt%、6wt%和8wt%,交联时间对应为180秒、45秒,35秒,30秒,其它条件同实施例1,分别命名为cp/od3,cp/od5,cp/od6,cp/od8。
经过测试,在od聚合物溶液浓度分别为1wt%、3wt%、5wt%和6wt%时,水凝胶展示适中的存储模量,表明拥有良好的稳定性;超过6wt%后凝胶强度过高,易碎,难以实际应用;其中od聚合物溶液浓度分别为1wt%、3wt%和5wt%的测试结果如图2所示。因此本发明中od聚合物溶液的浓度在为1wt%~6wt%。
实施例3
将步骤3)中的cp聚合物溶液浓度分别替换成1wt%、2wt%、5wt%和6wt%,交联时间对应为800秒、680秒、350秒、300秒,其它条件同实施例1,分别命名为cp1/od1,cp2/od1,cp5/od1,cp6/od1。
经过测试,在cp聚合物溶液浓度分别在1wt%、2wt%、4wt%和5wt%时,水凝胶展示适中的存储模量,表明拥有良好的稳定性;超过5wt%后cp聚合物很难溶解于乙酸溶液中,难以实际操作;因此本发明中cp聚合物溶液的浓度在为1wt%~5wt%。
实施例4
1)cp(chitosan-graft-polyaniline,壳聚糖-聚苯胺共聚物)聚合物的制备:将100mg壳聚糖和1mg苯胺加入到的8ml的0.08mol/lhcl水溶液中,随后加入2mg过硫酸铵,在40℃搅拌反应18h,随后加入1mol/lnaoh水溶液调节ph至10,使产物在溶液中逐渐析出并使聚苯胺去掺杂化;用反应液6倍体积的乙醇沉淀反应的溶液,使黑紫色固体完全析出,抽滤后用n-甲基-2-吡咯烷酮冲洗3次去除未反应的聚苯胺,再次沉淀后,室温干燥做后用;
2)od(oxidizeddextran,氧化葡聚糖)聚合物的制备:将3.28mg的高碘酸钠溶于80ml去离子水中配成溶液,按质量体积比1.25mg∶100ml将葡聚糖溶于去离子水中配成溶液,按高碘酸钠溶液和葡聚糖水溶液体积比为100mg∶300ml,高碘酸钠溶液被逐滴加入到葡聚糖水溶液中,在40℃下,避光搅拌反应18h,随后用二甘醇冲洗未反应的高碘酸钠;反应溶液用平均分子量1000的透析膜在去离子水中透析3天,产物在-80℃冷冻,使用冷冻干燥机两到三天后得到冻干产物;
3)拥有对电刺激和ph双重响应性能的抗菌可注射水凝胶的制备:将cp聚合物用1wt%乙酸溶液配制成200μl浓度为2wt%的cp聚合物溶液,将od聚合物用磷酸盐缓冲液配制成200μl浓度为5wt%的od聚合物溶液,两种溶液混合,涡旋振荡10秒钟,在40℃相互交联85秒,即可得到对电刺激和ph双重响应的抗菌可注射水凝胶,cp2/od5。
实施例5
1)cp(chitosan-graft-polyaniline,壳聚糖-聚苯胺共聚物)聚合物的制备:将100mg壳聚糖和2mg苯胺加入到的15ml的0.12mol/lhcl水溶液中,随后加入5mg过硫酸铵,在30℃搅拌反应30h,随后加入1mol/lnaoh水溶液调节ph至10,使产物在溶液中逐渐析出并使聚苯胺去掺杂化;用反应液8倍体积的乙醇沉淀反应的溶液,使黑紫色固体完全析出,抽滤后用n-甲基-2-吡咯烷酮冲洗3次去除未反应的聚苯胺,再次沉淀后,室温干燥做后用;
2)od(oxidizeddextran,氧化葡聚糖)聚合物的制备:将3.28mg的高碘酸钠溶于120ml去离子水中配成溶液,按质量体积比1.25mg∶120ml将葡聚糖溶于去离子水中配成溶液,按高碘酸钠溶液和葡聚糖水溶液体积比为100ml∶500ml,高碘酸钠溶液被逐滴加入到葡聚糖水溶液中,在30℃下,避光搅拌反应30h,随后用二甘醇冲洗未反应的高碘酸钠;反应溶液用平均分子量4000的透析膜在去离子水中透析3天,产物在-80℃冷冻,使用冷冻干燥机两到三天后得到冻干产物;
3)拥有对电刺激和ph双重响应性能的抗菌可注射水凝胶的制备:将cp聚合物用4wt%乙酸溶液配制成200μl浓度为3wt%的cp聚合物溶液,将od聚合物用磷酸盐缓冲液配制成200μl浓度为5wt%的od聚合物溶液,两种溶液混合,涡旋振荡10秒钟,在30℃相互交联65秒,即可得到对电刺激和ph双重响应的抗菌可注射水凝胶,cp3/od5。
实施例6
1)cp(chitosan-graft-polyaniline,壳聚糖-聚苯胺共聚物)聚合物的制备:将100mg壳聚糖和6mg苯胺加入到的20ml的0.09mol/lhcl水溶液中,随后加入12mg过硫酸铵,在15℃搅拌反应36h,随后加入1mol/lnaoh水溶液调节ph至9.5,使产物在溶液中逐渐析出并使聚苯胺去掺杂化;用反应液5倍体积的乙醇沉淀反应的溶液,使黑紫色固体完全析出,抽滤后用n-甲基-2-吡咯烷酮冲洗3次去除未反应的聚苯胺,再次沉淀后,室温干燥做后用;
2)od(oxidizeddextran,氧化葡聚糖)聚合物的制备:将3.28mg的高碘酸钠溶于150ml去离子水中配成溶液,按质量体积比1.25mg∶130ml将葡聚糖溶于去离子水中配成溶液,按高碘酸钠溶液和葡聚糖水溶液体积比为100ml∶600ml,高碘酸钠溶液被逐滴加入到葡聚糖水溶液中,在15℃下,避光搅拌反应36h,随后用二甘醇冲洗未反应的高碘酸钠;反应溶液用平均分子量2000的透析膜在去离子水中透析3天,产物在-80℃冷冻,使用冷冻干燥机两到三天后得到冻干产物;
3)拥有对电刺激和ph双重响应性能的抗菌可注射水凝胶的制备:将cp聚合物用3wt%乙酸溶液配制成200μl浓度为5wt%的cp聚合物溶液,将od聚合物用磷酸盐缓冲液配制成200μl浓度为5wt%的od聚合物溶液,两种溶液混合,涡旋振荡10秒钟,在25℃相互交联40秒,即可得到对电刺激和ph双重响应的抗菌可注射水凝胶,cp5/od5。
本发明的拥有对电刺激和ph双重响应性能的抗菌可注射水凝胶(cp/od),性能稳定,其抗菌性能在体外抗菌测试中均表现良好,作为药物载体具有明显的ph响应性能和电刺激响应性能,而且该方法制备的水凝胶能够显著促进成纤维细胞(l929)的粘附、增殖,显示出良好较强的生物相容性,下面结合实验数据详细分析。
本发明合成的聚合物和该水凝胶的结构式(cp/od)及合成路线如下所示。
其中本发明制得的cp的结构式如下式a所示:
本发明制得的od的结构式如下式b所示:
本发明制得的cp/od的结构式如下式c所示:
本发明制得的cp的合成路线如下所示:
本发明制得的od的合成路线如下所示:
本发明制得的cp/od的合成路线如下所示:
图1实施例1~6制得的cp和od聚合物以及cp/od水凝胶在傅氏转换红外线光谱图(ft-ir),分析图谱可得:cp聚合物上1572cm-1,1490cm-1峰分别属于醌环和苯环的特征峰,表明聚苯胺成功接枝在壳聚糖链上;od聚合物上1731cm-1处的峰是由c=o的伸缩振动引起,说明葡聚糖中一部分羟基已经被naio4氧化成醛基,因此氧化葡聚糖成功合成;在水凝胶cp/od的红外图谱上新出现的位于1644cm-1的峰则是聚合物cp贡献的氨基和聚合物od贡献的醛基相互反应形成希夫碱的特征振动。以上的ft-ir结果证明水凝胶cp/od的形成,以及聚合物cp和聚合物od的成功合成。
图2为本发明制得的cp/od可抗菌可注射水凝胶流变学性能。通过存储模量(g’)和耗损模量(g”)对时间(t)的模式进行测量。图中分别展示的实施例1,2制得的水凝胶样品的存储模量和时间的关系曲线。显而易见的是,随着交联剂od的浓度增高,水凝胶样品的存储模量不断增高,实施例2中的样品cp/od5,当od的浓度增加至5%时,其水凝胶样品的存储模量高达6360pa,cp/od1和cp/od3的存储模量分别是960pa和2150pa。其中cp/od3与对照组c/od3存储模量结果稍有偏差,是因为聚苯胺消耗壳聚糖链上部分氨基,导致稍小的交联密度。这些结果说明,依照此发明方法制得的拥有ph响应性能和电刺激相应性能的抗菌可注射水凝胶的可以达到一个比较适中的强度,从而拥有一个相对稳定的结构以及稳定的机械性能。
图3(a),图3(b)和图3(c)是本发明制得的水凝胶的电化学测试,其中包括紫外可见光谱测试,循环伏安测试,导电性测试。选择实施例1,2制备的水凝胶样品加以说明。在紫外可见光谱中,当cp聚合物水相分散液出现310nm和590nm的峰属于其化合物中苯环的π–π*跃迁以及苯型到醌型激子的转化。1m的盐酸掺杂之后的cp聚合物水溶液,在紫外光谱中出现435nm的峰以及310nm处的峰蓝移至292nm;在循环伏安测试中,cp聚合物出现2对氧化还原峰,0.32v处的峰对应聚苯胺还原态向中间氧化态的过渡和0.72v处的峰对应聚苯胺中间氧化态向氧化态的过渡;因此,cp聚合物具有良好的电活性。而在导电性测试中,cp/od1,cp/od3,和cp/od5的电导率分别是7.587*10-2±2.07*10-3s/m,7.768*10-2±5.16*10-3s/m和7.905*10-2±2.13*10-3s/m,且优于未添加聚苯胺的对照组c/od。这些结果都表明,该水凝胶具有良好的导电性。
图4为本发明制得的可注射水凝胶在不同ph值的生理溶液磷酸盐缓冲液(pbs)中药物阿莫西林的释放曲线。图中展示的实施例1的cp/od1释放曲线。从图4中可以看出,ph=5.5的弱酸性环境下阿莫西林的累积释放率远高于ph=7.4的弱碱性环境,比如在刚开始释放的45分钟之内,酸性环境的下的阿莫西林的累计释放量高达55%,而碱性环境之下该药的累计释放量约为23%,当释放平衡时,酸性环境下累计释放率接近于碱性环境的2倍。因此,在该水凝胶拥有优良的ph响应性能。
图5(a)和图5(b)为本发明制得的可注射水凝胶包埋不同药物阿莫西林和布洛芬后,接受电刺激后药物的释放曲线。图中展示的实施例2中的cp/od3的释放曲线。如图5(a)所示,阿莫西林在起始的30分钟有一个比较低速率的平稳释放,当施加3分钟的3v的电压时,药物释放速率激增,瞬间释放大量药物,当再次循环这个过程,相同的现象出现;如图5(b)所示,布洛芬在起始的一个小时释放缓慢且平稳,当给水凝胶施加3分钟的3v的电压,布洛芬释放速率迅速增大,当电压取消,药物的释放速率又恢复到未加电压之前水平,以此往复。因此,该水凝胶对电压刺激表现明显,说明具有优良的电刺激响应性能,可以满足特定时间智能控释药物的需求。
图6为成纤维细胞(l929)在cp/od水凝胶表面的细胞粘附和增殖的数目统计。图中展示的实施例1,2中的cp/od1,cp/od3,cp/od5的细胞数据统计。从图6中可以看出,成纤维细胞在与水凝胶cp/od共同培养细胞的1,3,5天之内,细胞增殖良好,且在第五天时实验组cp/od1,cp/od3,cp/od5上的细胞粘附数目大于对照组c/od和空白对照组tcp,显示出较强的生物相容性,该材料无毒无害,可以很好的用做生物医疗材料。
图7为本发明制得的cp/od水凝胶对大肠杆菌和金黄色葡萄球菌的杀伤率的统计。图中展示的实施例1,2中的cp/od1,cp/od3,cp/od5的细菌杀伤率的数据统计。所有的凝胶组都可以100%的杀死其表面的细菌,包括革兰氏阴性菌大肠杆菌和革兰氏阳性菌金黄色葡萄球菌,说明该水凝胶cp/od具有优良的抗菌能力。
从图8的扫描电子显微镜图片(sem)中可以观察到,按照实施例1,2中的制得的水凝胶cp/od1,cp/od3,cp/od5说明,水凝胶cp/od1,cp/od3,cp/od5在ph值为5.5的生理溶液磷酸盐缓冲液(pbs)中进浸泡后的孔径分别为257±51μm,121±32μm和64±15μm,分别如图8(a)、图8(b)和图8(c)所示。水凝胶cp/od1,cp/od3,cp/od5在ph值为7.4的生理溶液磷酸盐缓冲液(pbs)中进浸泡后的孔径分别为124±28μm,83±25μm和61±8μm,分别如图8(d)、图8(e)和图8(f)所示。图中明显观察到,在碱性环境中浸泡的水凝胶样品(图8(d)、图8(e)和图8(f))的孔径小于在弱酸性环境中的样品(图8(a)、图8(b)和图8(c))的孔径,凝胶孔径比较大时更有利于包埋的药物的释放,因此酸性环境下药物释放率会更高一点。
- 还没有人留言评论。精彩留言会获得点赞!