一种抑制经典Wnt/β‑catenin通路的地榆粗提物及制备方法与流程
本发明涉及中药的活性成分领域,具体涉及了中药地榆粗提物抑制经典的wnt/β-catenin通路的活性成分以及制备方法。
背景技术:
地榆为我国传统中药材之一,为蔷薇科地榆属植物以干燥根入药,富含鞣质,皂苷,黄酮类等天然活性成分,在抗菌抗炎,止血止泻以及抗癌等方面都有着明确的药效作用,并且对于癌症放化疗导致的机体白细胞下降具有良好的防治作用,在临床上已得到广泛的应用。
经典的wnt/β-catenin通路是生物在维持生长发育,组织稳态等方面至关重要的信号通路,它的异常表达与多种癌症的发生,发展以及侵袭转移密切相关,因此寻找该通路的有效抑制剂成为目前治疗多种癌症的有效手段之一。从诸多文献报道中可以发现已有多个单一化合物在不同阶段对wnt通路起抑制作用,如xav939通过抑制tankyrase1/2而选择性抑制wnt通路介导的转录过程,icg-001可拮抗wnt/β-catenin/tcf介导的转录过程。而相对于小分子化合物,中药提取物具有多成分的特点,从理论上讲可以从不同环节,不同靶点分别或同时作用于wnt/β-catenin通路,且用量更少,毒性更低,更具有优势。
技术实现要素:
针对上述问题,本发明提供了一种抑制经典wnt/β-catenin通路的地榆粗提物及制备方法。即对地榆粉末进行提取分离,再根据荧光素酶报告基因实验对这些粗提物进行活性筛选,在保留有效成分的情况下尽可能减少粗提物中的无活性物质。
本发明所采用的技术方案是:
1.地榆整体粗提物的制备:先对地榆干燥饮片进行粉碎过筛,以8-12倍的溶剂进行回流提取,回流温度在70℃-90℃之间,回流次数1-3次,过滤合并滤液,旋蒸回收溶剂即得。
2.地榆过大孔树脂柱不同梯度乙醇洗脱部位的制备:地榆干燥粉末用适量水溶解后,上样于d101大孔吸附树脂,不同比例乙醇-水体积比(0∶100,(40-50)∶(60-50),90∶10)依次洗脱3-4个柱体积,收集洗脱液回收有机溶剂,冷冻干燥即得。
3.地榆各粗提物抑制wnt/β-catenin通路的活性检测:各粗提物用超纯水配成一定浓度的溶液,在无菌环境下用0.22μm的微孔滤膜过滤除菌,以3t3细胞为实验对象,将细胞接种于96孔板贴壁24h,将不同药物以系列浓度处理细胞24h,利用mtt法检测药物对细胞的毒性作用。
在20%的细胞毒性浓度范围内,药物处理细胞24h,利用steady-glo@assay试剂检测wnt通路的变化程度。
本发明的有益效果是:本发明方法中寻找到了对wnt通路具有强烈抑制效果的中药地榆提取物,并在分离纯化过程中利用大孔吸附树脂除去了50%以上的无活性成分,有利于中药提取物的质量控制。
附图说明
图1为:地榆整体水提物对3t3细胞毒性作用(图1a),以及在wnt3a刺激剂作用下地榆整体水提物对wnt通路的抑制活性(图1b)。
图2为:地榆过大孔树脂柱乙醇-水体积比0/100洗脱部位对3t3细胞毒性作用(图2c),以及在wnt3a刺激剂作用下对wnt通路的抑制活性(图2d)。
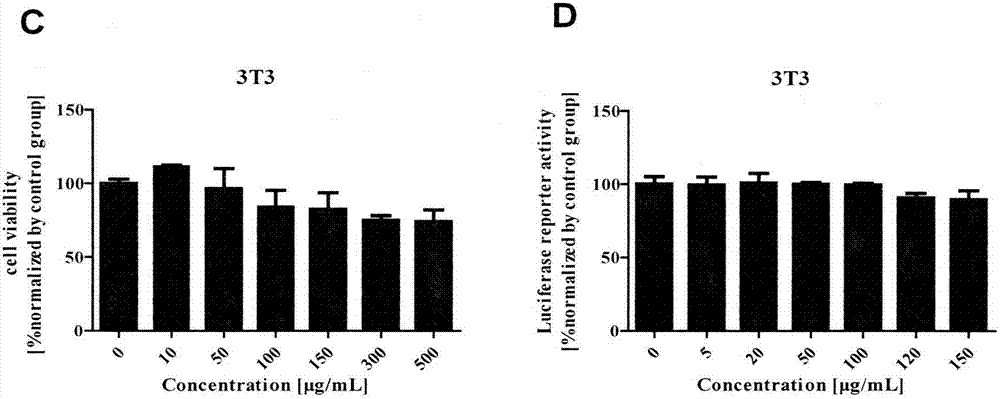
图3为:地榆过大孔树脂柱乙醇-水体积比40/60洗脱部位对3t3细胞毒性作用(图3e),以及在wnt3a刺激剂作用下对wnt通路的抑制活性(图3f)。
图4为:地榆过大孔树脂柱乙醇-水体积比90/10洗脱部位对3t3细胞毒性作用(图4g),以及在wnt3a刺激剂作用下对wnt通路的抑制活性(图4h)。
图5为:地榆过大孔树脂柱乙醇-水体积比40/60洗脱部位重复三次制备所得样品的hplc色谱图。
具体实施方式
实施例1
1.地榆整体水提物制备:
取地榆干燥粉末(过60目筛)30g加300ml的蒸馏水水浴80℃加热回流3次,每次1h,过滤合并滤液,旋蒸至膏状冷冻干燥后收集计算得率41.4%。
2.地榆过大孔树脂柱乙醇梯度洗脱部位的制备:
取地榆整体水提物2.0g用蒸馏水超声溶解30min后上样于d101大孔吸附树脂,用乙醇-水体积比为0/100,40/60,90/10的比例依次洗脱4个柱体积,所得洗脱液回收乙醇后冷冻干燥,体积比为40%乙醇洗脱部位得率48.46%。
3.地榆过大孔树脂柱乙醇-水体积比40/60洗脱部位的hplc分析:
按照第2步实验方法重复3次实验制备地榆过大孔树脂柱体积比为40%乙醇洗脱部位得率分别为45.56%,48.46%,45.17%。用超纯水配成10mg/ml的溶液,10ul进样体积,hplc检测。
液相条件:a:0.2%甲酸水b:甲醇
洗脱程序:0-2min(2%b);2-5min(5%b);5-10min(12%b);10-15min(20%b);15-35min(30%b);35-50min(45%b);50-60min(60%b);60-70min(70%b);70-75min(80%b);75-80min(40%b);80-85min(5%b)
4.药物抑制wnt通路活性检测:
a.细胞培养:3t3细胞,在含10%血清dmem培养基中培养,并放置于含二氧化碳浓度5%,温度为37℃的培养箱中。
b.细胞传代:当细胞密度长至70%-80%,吸去培养基,用无菌pbs洗涤2遍,用0.25%胰酶消化1min左右,加入2ml含血清培养基终止消化,在1000rpm下离心3min,弃去培养基,于10%血清dmem培养基中继续培养。
c.细胞铺板:细胞经胰酶消化后,用培养基重悬,稀释一定倍数后用细胞计数板计数,按2x104个/孔密度接种于96孔板,每孔加入100ul的细胞悬液。
d.细胞给药:细胞接种后贴壁24h,加入设定浓度的地榆粗提物药液继续培养24h。
e.细胞毒性检测:细胞给药24h后弃去培养基,在避光条件下每孔加入20ul5mg/ml的mtt药液于培养箱中4h,取出吸去药液每孔加入150ul的dmso于摇床上震荡10min后,在570nm波长下检测吸光度,计算细胞存活率。
f.抑制wnt通路活性检测:在含100ng/ml的wnt3a刺激剂条件下细胞给药24h后弃去培养基,用pbs洗涤1次,每孔加入30ul事先混合好的steady-glo@assay试剂,室温下于摇床上震荡10min,将steady-glo@assay试剂转移至白板中,在多功能酶标仪的luminescence测定功能下测定荧光素酶的活性。
5.数据分析:
所得数据导入graphpadprism5进行分析。
6.实验结果:
a.地榆整体水提物在20%的细胞毒性范围内对wnt通路具有明显的抑制效果(图1)。
b.地榆经大孔吸附树脂柱分离,纯水洗脱部位对wnt通路没有抑制活性(图2)。
c.地榆经大孔吸附树脂柱分离,乙醇-水体积比40/60的洗脱部位对wnt通路的抑制活性与整体水提物相当(图3)。
d.地榆经大孔吸附树脂柱分离,乙醇-水体积比90/10的洗脱部位对wnt通路没有明显的抑制活性(图4)。
e.地榆经大孔吸附树脂柱分离,乙醇-水体积比40/60的洗脱部位的液相图谱说明本发明使用的制备方法所得的该部位成分相差不大,具有重复性(图5)。
- 还没有人留言评论。精彩留言会获得点赞!