氨溴索在制备肿瘤化疗药物增效制剂中用途的制作方法
本发明属生物医药技术领域,涉及氨溴索在制药中的新用途,具体涉及氨溴索在制备肿瘤化疗药物增效制剂中用途
背景技术:
据统计显示,随着人口老龄化加剧、环境污染加重,恶性肿瘤的发病率和死亡率一直呈上升趋势,严重地威胁人类生命和健康。据卫生部门发布的《第三次全国人口死因调查》数据显示,我国城乡居民恶性肿瘤死亡率处于世界较高水平,而且呈持续的增长趋势。临床实践治疗肿瘤的传统方法有手术切除、化疗、放疗等,其中每一种疗法均具有一定的治疗优势,但也存在有其局限性,例如:手术切除有严格的适应症和适应人群;放疗和化疗缺少选择性,副作用较大且会引发肿瘤细胞的耐药性,往往最终导致临床上肿瘤治疗的失败。目前,肺癌在恶性肿瘤中死亡率居于首位,远高于乳腺癌、胰腺癌和结肠癌等,并且仅有15%的患者生存期能超过5年,其中非小细胞肺癌(nsclc)占肺癌总数的75~80%;患者在诊断时已多为晚期,常需要进行化疗,但传统一线化疗药物的耐药性和毒副作用,致使临床治疗效果较差;分子靶向药物仅对靶点基因突变的患者疗效较好,也存在用药后易产生耐药等问题。因此,发展选择性好、毒副作用小、抑制耐药和适应人群广的肿瘤化疗策略与化疗方法是肿瘤相关领域基础及临床研究的热点。
实践显示,在一些恶性肿瘤化疗过程中(如图9所示),化疗药物在诱导肿瘤细胞凋亡的同时也能诱导肿瘤细胞自噬(autophagy)。肿瘤细胞自噬的发生一方面能作为保护肿瘤细胞抑制凋亡的生存机制;另一方面自噬的持续活化使细胞无法维持其基本结构,导致肿瘤细胞死亡,即自噬性死亡。如,氟尿嘧啶作用于人结肠癌细胞可诱导肿瘤细胞发生保护性自噬,降低肿瘤细胞对药物的敏感性,甚至耐药;紫杉醇(paclitaxel,ptx)在诱导肿瘤细胞凋亡的同时,较低的药物浓度就可以促使肿瘤细胞自噬相关蛋白的mtor及其下游底物p70s6k的磷酸化程度减弱,beclin1和atg5均上调,提示紫杉醇通过beclin1启动肿瘤细胞自噬的产生,导致耐药性和降低化疗治疗效果。
氨溴索临床实践中常用于缓解肺癌患者行肺叶切除术后的临床症状,减少肺部损伤,预防肺癌根治术后肺部并发症的发生。在中国胸外科围手术期肺保护的专家共识中明确指出氨溴索临床上可用于术后肺保护,改善病人肺功能。由于氨溴索与经典的自噬抑制剂氯喹的化学结构相似,并且与细胞自噬过程中溶酶体的调控有关;
基于现有技术的基础,本申请的发明人拟提供氨溴索在制药中的新用途,具体涉及氨溴索在制备肿瘤化疗药物增效制剂中用途,所述氨溴索在化疗药物产生肿瘤细胞凋亡作用基础上能进一步提高化疗药物的肿瘤敏感性和抗肿瘤效果。
技术实现要素:
本发明的目的在于基于现有技术的基础,提供氨溴索在制药中的新用途,具体涉及氨溴索在制备肿瘤化疗药物增效制剂中用途。
本发明所述的氨溴索其化学名称为反式-4-[(2-氨基-3,5-二溴苄基)氨基]环己醇,英文名为ambroxol,通用名为氨溴索。
本发明中依据氨溴索药物可能具有肿瘤细胞自噬调控的作用,利用化疗药物的自噬诱导作用,与氨溴索调节自噬的生物功能产生良好应答,上调自噬小体的形成同时阻断末端自噬小体的降解,使得细胞内自噬小体富集,维持自噬过程持续活化,从而激活肿瘤细胞自噬性死亡通路,在化疗药物产生肿瘤细胞凋亡作用基础上进一步提高化疗药物的肿瘤敏感性和抗肿瘤效果。
在本发明中,氨溴索可增强紫杉醇、多西他赛、阿霉素、顺铂、喜树碱等化疗药物对于非小细胞肺癌、乳腺癌、胃癌、肝癌、黑色素瘤等多种癌症细胞的杀伤作用;
本发明中,建立裸鼠a549非小细胞肺癌皮下瘤模型,利用氨溴索与紫杉醇联合治疗方案,能更明显抑制肿瘤生长,具有较好的抗肿瘤效果,氨溴索剂量越高抑制效果越好;建立了a549-luciferase肺转移瘤模型,利用氨溴索与紫杉醇联合治疗方案,能明显抑制肺部肿瘤病灶的扩大,延长裸鼠的生存时间;氨溴索可调节肿瘤细胞自噬,且氨溴索增强紫杉醇的杀伤作用可能与其调控细胞自噬功能有关;所述氨溴索作为临床上治疗急、慢性支气管炎及支气管哮喘的常用药物,还能缓解肺癌患者行肺叶切除术后的临床症状,毒副作用小,疗效确切,将氨溴索与紫杉醇联合使用治疗肿瘤的临床转化前景良好。
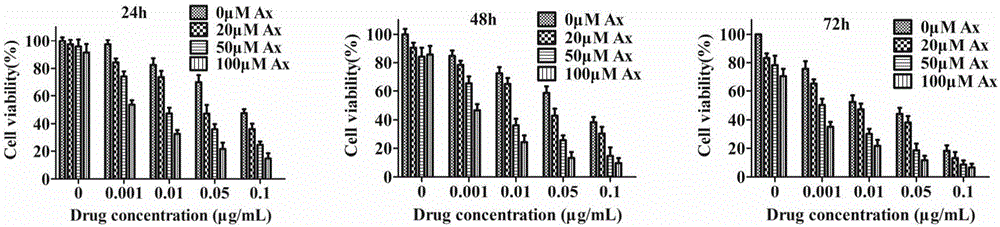
本发明中,采用mtt法考察不同浓度的氨溴索与不同浓度的紫杉醇共同孵育肿瘤细胞后的毒性,如图1所示,随着氨溴索浓度的增加,紫杉醇对肿瘤细胞的杀伤作用逐渐增强,高浓度的氨溴索(100μm)在48h时使紫杉醇的ic50值降低82.79倍,结果证明,氨溴索提高紫杉醇杀伤肿瘤细胞的敏感性,且呈现出浓度依赖性和时间依赖性。
表1为不同浓度氨溴索与紫杉醇共同孵育a549细胞24、48、72h后紫杉醇的ic50值,结果表明氨溴索可明显降低紫杉醇的ic50值,100μm氨溴索与紫杉醇共孵育24h后ic50值从107.00±4.38降至1.49±0.13ng/ml,高浓度的氨溴索使ic50值降低更明显。
表1
本发明中,以annexinv-fitc/pi凋亡检测试剂盒检测不同浓度的氨溴索与不同浓度的紫杉醇共同孵育后细胞凋亡水平,评价氨溴索对紫杉醇诱导凋亡的影响,如图2所示,50μm的氨溴索使0.01μg/ml的紫杉醇凋亡率从27.4%增加到54.7%,结果与mtt实验较为吻合,结果证明,氨溴索能提高紫杉醇诱导肿瘤细胞凋亡的能力。
本发明中,建立了荷有a549皮下瘤的裸鼠为动物模型,通过静脉给予氨溴索、紫杉醇、氨溴索联合紫杉醇等不同给药组,以肿瘤体积、裸鼠体重、肿瘤生长抑制率为指标评价氨溴索与紫杉醇联合使用的抗肿瘤疗效,进行体内药效学评价,图3、4显示了20mg/kg的氨溴索与3mg/kg的紫杉醇合用后可增强皮下瘤抑制效果,而100mg/kg的氨溴索与3mg/kg的紫杉醇合用后可显著增强皮下瘤抑制效果,且抗肿瘤效果强于10mg/kg的紫杉醇;表2所示表明ax100mg/kg组肿瘤生长抑制率为3.54%,ptx3mg/kg为33.79%,ptx3mg/kg+ax20mg/kg组为42.23%,ptx10mg/kg组为68.66%,ptx3mg/kg+ax100mg/kg组为75.48%,结果表明,氨溴索可增强紫杉醇抑制皮下瘤生长的能力,提高抗肿瘤疗效,剂量越高效果越好。
表2为a549皮下瘤模型中,不同给药组的裸鼠的体重、肿瘤重量和肿瘤生长抑制率。3mg/kgptx+100mg/kgax的抑制效果优于10mg/kgptx,且毒性更小。
表2
本发明中,建立了荷有a549肺部肿瘤的裸鼠为动物模型,将裸鼠尾静脉注射a549-luciferase细胞,构建a549-luciferase肺转移肿瘤模型,给药后利用小动物活体成像技术,评价不同时间点肺部肿瘤生长情况。以裸鼠体重、生存期为指标,研究氨溴索与紫杉醇联合使用对于肺部肿瘤的治疗效果,图5显示了活体成像结果,表明20mg/kg的氨溴索与3mg/kg的紫杉醇合用后可减小肺部肿瘤病灶的扩大,而100mg/kg的氨溴索与3mg/kg的紫杉醇合用后可显著减小肺部肿瘤病灶的扩大,且抗肿瘤效果强于10mg/kg的紫杉醇;图6显示了各组中位生存期为25、27.5、30、33、37.5、44天,表明氨溴索能明显延长荷肺部肿瘤裸鼠的生存期,且高剂量效果更为明显,结果表明,氨溴索能增强紫杉醇抑制肺部肿瘤生长的能力,提高抗肿瘤疗效,剂量越高效果越好。
本发明以westernbolt检测自噬标志性蛋白lc3的表达量,图7显示了氨溴索可有效调控细胞自噬结果,且呈现出浓度依赖性和时间依赖性,50μm、8h即可有效影响自噬,当浓度为300μm,时间为24h时效果最为明显,图8所示表明50μm的氨溴索与0.01μg/ml的紫杉醇联用后自噬水平进一步上升,lc3表达量进一步上升。
本发明所述的氨溴索可用于制备肿瘤化疗药物增效制剂中;所述的化疗药物包括紫杉醇、多西他赛、阿霉素、顺铂、喜树碱等,所述的肿瘤包括非小细胞肺癌、乳腺癌、胃癌、肝癌、黑色素瘤等。
附图说明
图1为不同浓度氨溴索与不同浓度紫杉醇共同孵育a549细胞24、48、72h后细胞存活率,显示氨溴索明显增强紫杉醇杀伤肿瘤细胞的能力,高浓度的氨溴索增强效果更明显。
图2为氨溴索与紫杉醇共同孵育a549细胞后细胞凋亡水平,100μm氨溴索与紫杉醇共孵育24h后细胞凋亡率从27.4%升至54.7%。
图3为a549皮下瘤模型中,不同给药组肿瘤体积变化曲线。氨溴索可增强紫杉醇抑制皮下瘤生长的能力,且剂量为100mg/kg的效果更为明显。
图4为a549皮下瘤模型中,给药后第14天肿瘤被剥离后照片。
图5为a549-luciferase肺部肿瘤模型中,不同给药组治疗后肺部肿瘤大小变化。氨溴索可明显增强紫杉醇抑制肺部肿瘤生长的能力,且剂量为100mg/kg的效果更为明显。
图6为a549-luciferase肺部肿瘤模型中,不同给药组治疗后裸鼠的生存时间比较。氨溴索联合紫杉醇可明显延长荷肺部肿瘤裸鼠的生存时间,且剂量为100mg/kg的效果更好。
图7为氨溴索对自噬相关蛋白lc3表达的影响(a:浓度的影响;b:时间的影响),氨溴索可明显促进lc3蛋白表达量的上升,呈现出时间和浓度依赖性,50μm、8h即可有效调控自噬;当浓度为300μm,时间为24h时效果最为明显。
图8为紫杉醇和氨溴索联用后对a549细胞自噬蛋白lc3表达的影响。氨溴索与紫杉醇共孵育细胞后,lc3表达量进一步上升。
图9为细胞自噬通路及干预示意图。
具体实施方式
下面结合实施例对本发明做详细说明,但本发明的保护范围不局限于下述实施例。
实施例1:
采用mtt法评价不同浓度的紫杉醇联合氨溴索孵育a549细胞的毒性:
实验前将紫杉醇用含10%血清的1640培养基配制成0.001、0.01、0.05、0.1μg/ml的系列浓度,在0.001、0.01、0.05、0.1μg/ml的紫杉醇溶液中加入适量的氨溴索,使终浓度分别为0、20、50、100μm;
将对数生长期的细胞以8000cells/well的密度接种于96孔板中,待细胞贴壁后,按以上实验浓度给予含药溶液,每孔100μl,每个浓度设置三个复孔,给药后将细胞板置于37℃培养箱中培养24h,待培养结束后,轻轻吸出培养液,每孔加入0.5μg/ml的mtt溶液(pbs配制)100μl,置于37℃培养箱中培养4h,孵育结束后弃去培养基,每孔加入200μldmso溶液,于37℃避光孵育15min,用酶标仪于570nm处测定吸光度。以不加药的细胞组作为对照,以无细胞但相同处理的孔作为空白组,按以下公式计算细胞存活率:
通过graphpadprism5.0软件,采用logistic模型拟合量效关系,计算半数抑制浓度ic50值。
实施例2:
采用annexinv-fitc/pi凋亡检测试剂盒评价不同浓度的紫杉醇联合氨溴索孵育a549细胞的凋亡水平:实验前将紫杉醇用含10%血清的1640培养基配制成0.01μg/ml的浓度,在0.01μg/ml的紫杉醇溶液中加入适量的氨溴索,使终浓度为50μm。将对数生长期的细胞以50000cells/well的密度接种于6孔板中,待细胞贴壁后,按以上实验浓度给予空白培养基、0.01μg/mlptx、50μmax、0.01μg/mlptx+50μmax溶液,每孔2ml,每个浓度设置三个复孔。给药后将细胞板置于37℃培养箱中培养24h,待培养结束后,收集上层培养液,用pbs洗涤3次后收集洗涤液,加入适量不含edta的0.25%胰酶消化,并与上层培养液和洗涤液合并,离心收集细胞,用pbs重旋2次。取0.5-1×105个细胞,加入200μl的annexinv-fitc/pi结合液吹散混匀细胞,避光加入5μlannexinv-fitc和5μl碘化丙啶(propidiumiodide,pi)染色,室温放置15min后进行流式细胞仪检测。
实施例3:
以荷a549皮下瘤的裸鼠为模型,以肿瘤体积、肿瘤重量、生存期为指标,评价ptx与ax联用后能否提高抗癌药物的治疗效果:
将a549细胞按常规条件培养,待生长至80%-90%融合度时,消化离心并用pbs重悬,制备2×107/ml的单细胞悬液,接种至balb/c裸鼠的右腋皮下,每只200μl。待肿瘤生长至50-100mm3时(记为0天),将荷瘤小鼠随机分为6组,每组6只,分别设生理盐水组(saline)、高剂量氨溴索组(ax:100mg/kg)、低剂量紫杉醇组(ptx:3mg/kg)、低剂量紫杉醇+低剂量氨溴索组(ptx:3mg/kg+ax:20mg/kg)、高剂量紫杉醇组(ptx:10mg/kg)、低剂量紫杉醇+高剂量氨溴索组(ptx:3mg/kg+ax:100mg/kg),于第0、4、8、12天给药,评价指标如下:
(1)肿瘤生长曲线:每两天测量一次肿瘤的长径a和短径b,根据公式v=0.5×a×b2计算肿瘤的体积,并绘制肿瘤生长曲线;
(2)体重变化曲线:每两天称量裸鼠体重,并绘制体重变化曲线。如果小鼠体重降低超过15%,则认为给药方案的毒性较大;
(3)肿瘤生长抑制率(irt%):于第十四天处死裸鼠,剥离肿瘤,拍照并称取肿瘤重量,按以下公式计算肿瘤生长抑制百分率:
wc为生理盐水对照组的瘤重,wt为各治疗组的瘤重;
(4)肿瘤组织lc3表达量:利用免疫组化测定肿瘤组织lc3蛋白的表达量;
(5)肿瘤组织tunel染色检测凋亡:利用tunel染色的方法测定肿瘤组织的凋亡水平。
实施例4:
将a549-luciferase细胞按常规条件培养,待生长至80%-90%融合度时,消化离心并用pbs重悬,制备2×107/ml的单细胞悬液,,尾静脉注射接种至balb/c裸鼠,每只200μl。利用活体成像观察肺部肿瘤生长情况,待肺部肿瘤生长合适大小时(记为0天),将荷瘤小鼠随机分为6组,每组6只,分别设生理盐水组(saline)、高剂量氨溴索组(ax:100mg/kg)、低剂量紫杉醇组(ptx:3mg/kg)、低剂量紫杉醇+低剂量氨溴索组(ptx:3mg/kg+ax:20mg/kg)、高剂量紫杉醇组(ptx:10mg/kg)、低剂量紫杉醇+高剂量氨溴索组(ptx:3mg/kg+ax:100mg/kg),于第0、4、8、12天给药,评价指标如下:
(1)肿瘤生长曲线:利用活体成像技术,每四天于小动物活体成像下观察肺部肿瘤大小,并绘制肿瘤生长曲线;
(2)体重变化曲线:每两天称量裸鼠体重,并绘制体重变化曲线。如果小鼠体重降低超过15%,则认为给药方案的毒性较大;
(3)生存周期:记录各组荷瘤小鼠的死亡时间,利用graphpadprism5.0软件绘制生存曲线,计算并比较各组的平均生存时间(mst)。
实施例5:
以westernbolt检测不同浓度的氨溴索与a549共培养24h后lc3自噬标志性蛋白的表达量、检测氨溴索与a549共培养不同时间后lc3蛋白的表达量、检测50μm的氨溴索与0.01μg/ml的紫杉醇联用后孵育a549细胞24h对lc3蛋白的表达量影响。
- 还没有人留言评论。精彩留言会获得点赞!