一种多功能靶向纳米荧光探针及其制备与应用的制作方法
本发明属于荧光成像材料、生物载药技术领域,具体涉及将双光子共轭寡聚物和透明质酸结合制备多功能纳米荧光探针及药物载体,以及它们在荧光生物成像、生物载药技术方面的应用。
背景技术:
双光子共轭材料因其能够同时吸收两个光子从而实现荧光发射,因此这种材料通常的双光子激发波长都在近红外波段,双光子荧光成像能够具有更好的穿透深度,降低背景杂散光的干扰,同时由于近红外波段的光的能量更低还能够减少对生物组织的损害。双光子水溶性共轭材料实现双光子吸收的同时还具有水溶性,能够在水溶液中保持较强的荧光强度,具有这些优异性质的荧光材料能够很好地作为荧光探针应用到生物体内。
HA及其衍生物在制药和生物医学领域方面具有广泛的应用,它是生物内的一种天然线性多糖,在生物体的功能上有着重要作用,如稳定和组织细胞外基质,调节细胞的粘附性,并介导细胞增殖和分化。在多种肿瘤细胞的表面有HA受体(CD44和RHAMM)过度表达,HA还有多个官能团可用于化学修饰,已有许多研究利用HA的亲水性和肿瘤靶向能力进行抗癌药物递送。
一些研究表明,从达到病理部位的纳米载体快速释放药物可以提高治疗效果,降低癌细胞耐药概率。肿瘤组织处的生理环境与正常组织相比较具有很大的差异,如pH值呈酸性,肿瘤细胞过量表达还原性谷胱甘肽(GSH)、透明质酸酶(HAase)等。基于此,本发明利用还原性GSH能够将打断二硫键,HAase能够降解透明质酸这些特性,将双光子共轭寡聚物和透明质酸结合,制备了一种具有多重响应的多功能靶向纳米荧光探针及药物载体。该纳米荧光探针及药物载体在体内循环时抗降解能力强,具有更高的稳定性,而到达肿瘤细胞时纳米粒子由于被GSH、HAase降解产生荧光增强响应,实现靶向双光子荧光成像,并引发所负载药物的快速释放,使抗肿瘤药物更高效的发挥治疗作用。
技术实现要素:
技术问题:本发明的目的在于提出一种多功能靶向纳米荧光探针及其制备与应用,并且提出其在荧光生物成像和生物载药技术方面的应用。该类多功能靶向纳米荧光探针不但能够靶向输送药物,还能通过还原性响应或酶降解实现药物快速释放,同时还具有靶向双光子荧光成像的功能,从而使其在荧光成像和生物载药方面有着潜在的广泛应用前景。
技术方案:本发明的一种多功能靶向纳米荧光探针,将疏水性的双光子共轭寡聚物通过含二硫键的侧链接枝到亲水性的肿瘤靶向生物分子透明质酸HA上,得到两亲性聚合物;该两亲性聚合物通过超分子自组装形成纳米荧光探针,同时负载抗肿瘤药物;该纳米荧光探针能对肿瘤细胞中高表达的还原性物质谷胱甘肽GSH、透明质酸酶HAase产生荧光增强的响应,实现荧光成像并释放药物。
其中,
所述的两亲性聚合物具有如下分子式:
其中,9位取代的芴基为电子给体,简称D,烯键为共轭桥,窄带隙的芳香杂环Ar为电子受体,简称A,组成一种D-π-A-π-D的共轭结构,具有双光子吸收性质;R选自下列基团: R1CONH,这里R1为下列基团中的一种:烷基、烷氧基;R’选自下列基团R2COOH,R2为下列基团中的一种:烷基、烷氧基;Ar为4,7-双(苯-2基)-2,1,3-苯并噻二唑基团或4,7-双(噻吩 -2基)-2,1,3-苯并噻二唑基团中的一种,HA为透明质酸。
所述的两亲性聚合物,
a.当Ar为4,7-双(苯-2基)-2,1,3-苯并噻二唑基团时,其中一种典型的结构如下:R 的结构是R1CONH,R’的结构是R2COOH,R1和R2相同,均为烷基;其结构式如下:
b.当Ar为4,7-双(噻吩-2基)-2,1,3-苯并噻二唑基团时,其中一种典型的结构如下:R的结构是R1CONH,R’的结构是R2COOH,R1和R2相同,均为烷基,其结构式如下:
本发明的一种多功能靶向纳米荧光探针的制备方法为透析法:
将两亲性聚合物溶解于水中,疏水性抗肿瘤药物溶解于能和水混溶的极性有机溶剂二甲基亚砜DMSO中,然后将DMSO溶液在超声状态下滴加到聚合物水溶液中,在冰水浴中用尖头型超声仪间隔性超声,室温搅拌后移入透析袋中,先分别在体积比为:甲醇:水=2:1,1:1的混合溶液中透析12-15小时,再在去离子水中透析24-26小时,以除去未包裹的药物并形成稳定分散的纳米粒子,用滤膜过滤后冷冻干燥,得到靶向纳米荧光探针。
所述两亲性聚合物的制备方法为:
1)采用有机金属催化的Heck偶联反应,将单溴芴衍生物单体偶联在窄带隙的二乙烯基芳香杂环单体两侧,或者将乙烯基芴衍生物单体偶联在窄带隙的二溴芳香杂环单体两侧,得到D-π-A-π-D共轭结构,然后通过侧链羧酸化反应制备侧链含羧基的双光子共轭寡聚物;
2)由步骤1)制备得到的双光子共轭寡聚物在1-(3-二甲氨基丙基)-3-乙基碳二亚胺盐酸盐EDC和N-羟基琥珀酰亚胺NHS催化下,接枝到胱胺修饰的HA上,得到两亲性聚合物。
本发明的多功能靶向纳米荧光探针的应用,所述的靶向纳米荧光探针应用在肿瘤靶向双光子荧光细胞成像和药物输送中,该应用包括以下步骤:
1)将双光子共轭寡聚物接枝到胱胺修饰的HA上,制备两亲性聚合物;
2)将上述两亲性聚合物与疏水性抗肿瘤药物混合,通过透析法自组装制备得到疏水空腔中包裹药物的纳米荧光探针;
3)将上述靶向纳米荧光探针应用于肿瘤细胞,实现对GSH、HAase的荧光增强响应,并实现肿瘤靶向激光共聚焦双光子荧光成像和药物输送。
有益效果:在本发明中,通过超分子自组装制备得到一种多功能纳米荧光探针及药物载体。其中,自组装形成纳米药物载体之后,双光子共轭寡聚物的荧光因聚集而减弱;多功能纳米荧光探针及纳米药物载体能够稳定地输送到肿瘤部位,再通过HA受体介导的内吞作用选择性地被肿瘤细胞摄取,一旦内化到肿瘤细胞中即可被还原性GSH和HAase降解,从而改善细胞内药物的释放效果和提高抗肿瘤功效;并且双光子共轭寡聚物的荧光增强,达到肿瘤靶向双光子荧光细胞成像和监测药物释放过程协同进行的目的,从而使这种多种功能的纳米材料在荧光成像和生物载药方面有着潜在的广泛应用前景。
附图说明
图1为本发明制备的负载抗肿瘤药物喜树碱CPT的纳米荧光探针HA-TPO/CPT NP的结构示意图。
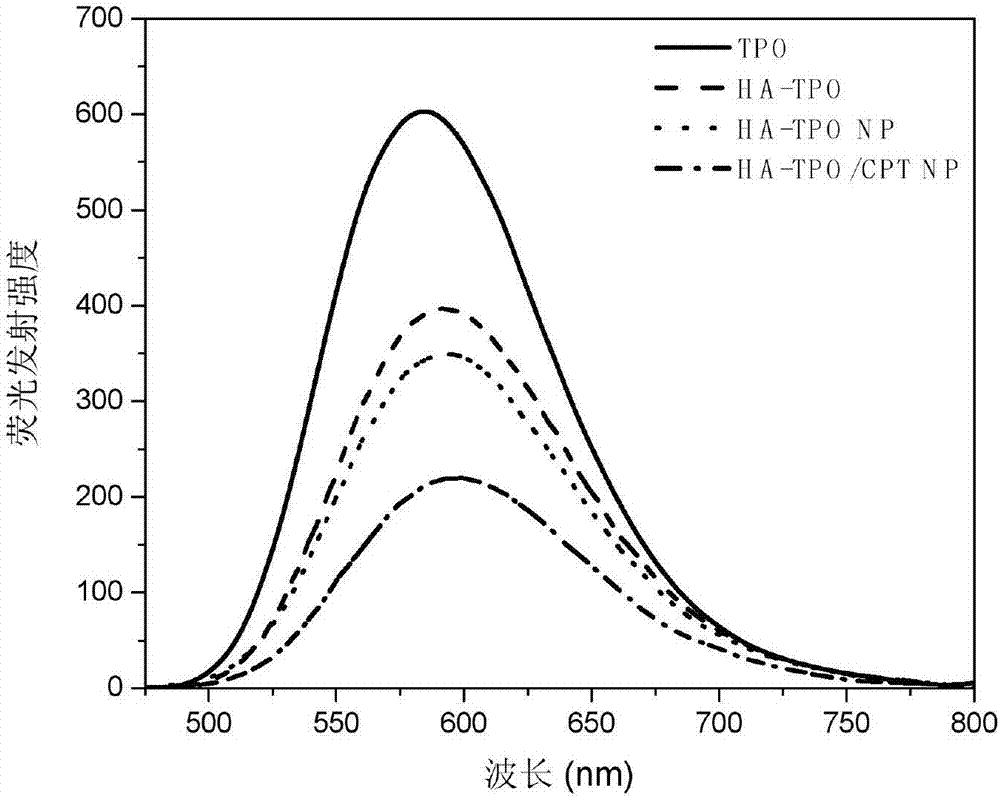
图2为本发明制备的双光子共轭寡聚物TPO、两亲性聚合物HA-TPO、靶向纳米粒子HA-TPO NP和负载CPT的纳米荧光探针HA-TPO/CPT NP在水中的荧光发射光谱(激发波长:425nm),各个材料中TPO浓度均为5×10-6mol/L。
图3.为本发明制备的靶向纳米粒子HA-TPO NP在过量表达GSH、HAase的肿瘤细胞HeLa 中的激光共聚焦荧光显微镜双光子模式下的细胞成像(激发波长:720nm,收集波长范围: 500nm-700nm)。
图4.为本发明制备的靶向纳米粒子HA-TPO NP在含不同浓度还原性二硫苏糖醇(DTT) 环境中:10mM DTT(模拟肿瘤细胞的还原环境)、10uM DTT(模拟人血浆中的还原环境)和不含DTT三种情况下的动态光散射(DLS)粒径随时间的变化。
具体实施方式
为了更好地理解本发明的内容,下面通过具体的实施例进一步说明本发明的技术方案,但不能以此来限制本发明的范围。
实施例:
1)通过如下方法制备单体(1)和(2),将(1)和(2)按物质的量比为1:2投料,然后在Pd(OAc)2/P(o-tolyl)3催化下通过Heck反应将二者偶联起来,反应24小时后,即得到中性双光子共轭寡聚物;进一步用三氟乙酸进行羧酸化反应,反应4小时,得到双光子共轭寡聚物TPO。
2)通过如下方法制备透明质酸-胱胺(HA-Cystamine)后,再将TPO溶于DMSO中,将催化剂EDC和NHS分别溶解在磷酸盐缓冲液(PBS)中,加至TPO上的DMSO溶液中,反应2小时,再加入2-巯基乙醇猝灭EDC的反应活性,反应5分钟后,加入一定量的HA-Cystamine,之后在室温条件下搅拌过夜。将反应瓶中的溶液移入截留分子量(MWCO)3500Da的透析袋中,透析除去未反应的EDC,NHS,2-巯基乙醇,未反应的TPO和其他中间产物,之后冷冻干燥 36小时,获得两亲性聚合物HA-TPO。
3)将步骤2)中制备的HA-TPO溶于DMSO和水的混合溶液中(DMSO:H2O=1:1)中,之后在冰水浴中用尖头型超声仪超声10分钟,搅拌2小时后移入MWCO为3500Da的透析袋中,在去离子水中透析24小时,期间换水3次,之后用0.45μm滤膜过滤并冷冻干燥,得到靶向纳米粒子HA-TPO NP。
4)将抗肿瘤药物CPT溶解于DMSO中,在超声状态下滴加到溶有步骤2)中制备的HA-TPO 的水溶液中,之后在冰水浴中用尖头型超声仪超声10分钟,搅拌2小时后移入MWCO为3500 Da的透析袋中,先分别在甲醇:水=2:1,1:1(V:V)的混合溶液中透析12小时,再在去离子水中透析24小时,之后用0.45μm滤膜过滤并冷冻干燥,最终得到负载CPT的靶向纳米探针HA-TPO/CPT NP。
5)用含有靶向纳米探针HA-TPO/CPT NP的培养基孵育过量表达GSH、HAase的肿瘤细胞 HeLa,4小时后将细胞置于激光共聚焦荧光显微镜下,在双光子模式下以720nm的激光激发,收集500-700nm之间的荧光,拍摄照片,获得细胞成像结果。
- 还没有人留言评论。精彩留言会获得点赞!
- 一种用于判断靶向单克隆抗体治疗肿瘤疗效的预测分子的制造方法与工艺
- 一种检测肺癌相关基因热点突变的试剂盒及其应用的制造方法与工艺
- 一种为肺癌提供离体个体化药物测试的方法及培养基与流程
- 一种谷胱甘肽/超声双重刺激响应纳米聚合物囊泡、其制备方法及应用与流程
- 一种多重刺激响应交联型聚合物纳米水凝胶、其制备方法及应用与流程
- 一种靶向CD47的免疫检查点抑制剂药物组合物及其制备方法与流程
- 具有淋巴靶向功能的生物自组装纳米晶注射剂及制备方法与流程
- 用于检测肝癌的基因标志物及其用途的制造方法与工艺
- 特异性shRNA筛选及其靶向Ang‑2基因抑制肺癌细胞的验证方法与流程
- 一种具有靶向功能仿病毒结构高分子囊泡及其制备与应用的制造方法与工艺
- 阻断UBE2M介导Neddylation修饰在肾细胞癌治疗中的应用的制造方法与工艺
- 无载体共组装肿瘤靶向抗癌纳米药物及其制备方法与应用与流程
- 一种用于判断靶向单克隆抗体治疗肿瘤疗效的预测分子的制造方法与工艺
- 一种靶向CD47的免疫检查点抑制剂药物组合物及其制备方法与流程
- 具有淋巴靶向功能的生物自组装纳米晶注射剂及制备方法与流程
- 用于检测肝癌的基因标志物及其用途的制造方法与工艺
- 特异性shRNA筛选及其靶向Ang‑2基因抑制肺癌细胞的验证方法与流程
- 一种多功能自动化生物细胞提取分离控制系统及采用该系统实现的细胞提取分离方法与流程
- 一种融合蛋白及光敏剂复合物及其制备方法和应用与流程
- 具有可视化和显示光斑边界功能的光动力治疗系统的制造方法与工艺