还原态氧载体及其用于治疗碳氧血红蛋白血症的用途的制作方法
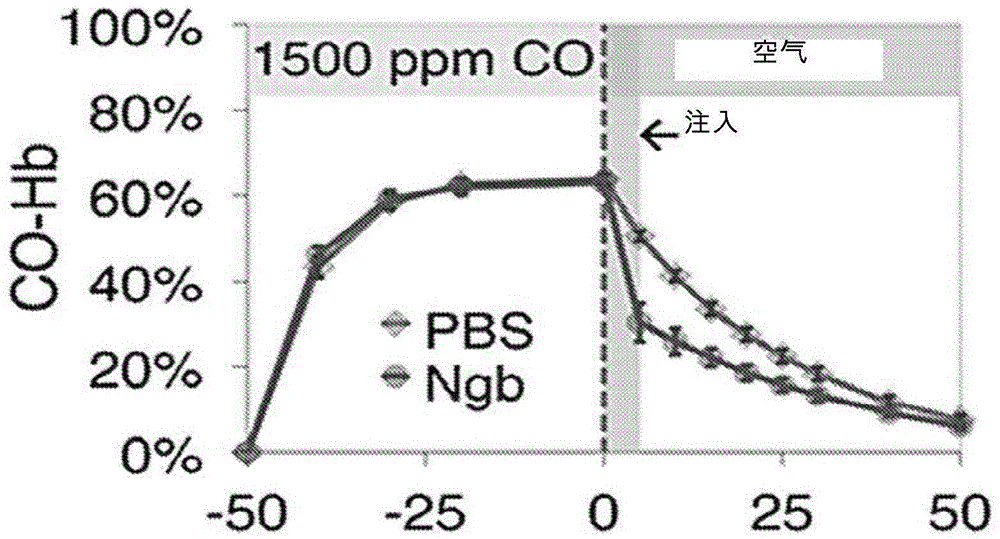
本申请要求2016年5月19日提交的美国临时专利申请号62/338,870的权益,其通过引用整体并入本文。发明领域本发明涉及采用还原形式的天然或人造氧载体治疗碳氧血红蛋白血症的方法。本发明还涉及生产用作氧载体的还原球蛋白的方法。本发明还涉及使用氧载体治疗氰化物中毒和硫化氢中毒的方法。政府支持的确认本发明是在政府资助下进行的,授权号为hl12586、hl110849、hl007563和hl103455,由国家卫生局颁发。政府对本发明有一定的所有权。发明背景吸入暴露于一氧化碳是环境中毒的一个主要原因。个体可在各种不同的情况下暴露于空气中的一氧化碳,如房屋着火、在室内使用发电机或室外烧烤架,或者在密闭的空间内试图自杀。一氧化碳可与细胞中的血红蛋白和血红素蛋白结合,尤其与呼吸运输链的酶结合。与血红蛋白和其他血红素蛋白结合的一氧化碳的积累损害用于氧化磷酸化的氧输送和氧利用。这最终导致重要器官如大脑和心脏发生严重的缺氧和缺血性损伤。血液中积累了超过10%的碳氧血红蛋白的个体有脑损伤和神经认知功能障碍的风险。碳氧血红蛋白水平高的患者通常承受不可逆的脑损伤、呼吸衰竭和/或心血管崩溃。尽管存在通过采用标准的动脉和静脉血液气体分析和co-oximetry来快速诊断一氧化碳中毒的现有方法,并且尽管意识到一氧化碳中毒的风险因素,但目前尚无针对该毒性暴露的解毒剂。目前的疗法是通过面罩给予100%的氧气,且可能将对象暴露于高压氧中。高压氧疗法的机制为氧气将增加一氧化碳从血红蛋白和从组织中的释放率并加速一氧化碳的自然清除。然而,该疗法对一氧化碳清除率的效果一般,并且基于高压氧设施的复杂性,该疗法在现场并不可用并且通常与显著的治疗延迟和运输费相关联。技术实现要素:需要有效、快速和容易获得的疗法来治疗碳氧血红蛋白血症(也称为一氧化碳中毒)、氰化物中毒和硫化氢中毒。本文提供了一种治疗对象中碳氧血红蛋白血症的方法,所述方法包括选择有碳氧血红蛋白血症的对象;以及将治疗有效量的包含天然或人造氧载体的组合物施用于对象,其中,所述氧载体为还原形式。在某些实施方案中,所述组合物还包含还原剂,如无毒性浓度的温和还原剂。本文还提供了从血液或动物组织中的血红蛋白去除一氧化碳的方法。所述方法包括将所述血液或动物组织与包含天然或人造氧载体的组合物接触,其中所述氧载体为还原形式。在某些实施方案中,所述方法为体外方法。在某些实施方案中,所述方法为体内方法。本文还提供了一种制备还原态氧载体的方法。在某些实施方案中,所述方法包括将所述氧载体与第一还原剂接触,以产生氧载体-还原剂组合物;以及将所述氧载体-还原剂组合物通过脱盐柱以形成还原态氧载体组合物。在厌氧环境中进行所述还原态氧载体的制备。本文还提供了一种治疗对象中氰化物中毒的方法,通过如下步骤:选择有氰化物中毒的对象,且将治疗有效量的包含天然或人造氧载体的组合物施用于所述对象,其中所述氧载体为其氧化形式。本文还提供了一种治疗硫化氢(h2s)中毒的方法,通过如下步骤:选择有h2s中毒的对象,且将治疗有效量的包含天然或人造氧载体的组合物施用于所述对象,其中,所述氧载体为其还原形式。根据以下参考附图进行的详细描述,本发明的前述和其他目的、特征和优点将变得更加显而易见。附图说明图1为示出在中等程度co中毒的小鼠模型中来自血红蛋白的co体内结合重组神经珠蛋白的示意图。图2为本文公开的制备还原态氧载体的方法的步骤流程图。图3为使用氧载体和人造氧载体治疗一氧化碳中毒的方法的流程图。图4a-4c为示出来自血红蛋白的co体外结合野生型马肌红蛋白的示意图。于37℃,在5mm连二亚硫酸钠的存在下,将pbs或肌红蛋白(100μl)注入到含有羧基化红细胞的溶液中。在若干时间点处从反应混合物中提取样品,并通过离心将rbc与上清液(含mb)分离。由uv-vis光谱确定每部分中hbco/mbco的量。(图4a)与pbs混合的羧基化rbc。(图4b和图4c)两个样品实验,其中不同量的羧基化rbc与mb混合。黑色和红色点分别表示羧基化hb和mb的浓度。图5为示出在严重co中毒的小鼠模型中将来自血红蛋白的co体内结合野生型马肌红蛋白的示意图。图6为示出严重一氧化碳中毒对心率(hr;顶部)和平均动脉血压(map;底部)的影响的一组示意图,随着肌红蛋白的加入,这种影响被逆转。图7为示出严重一氧化碳中毒对血压和心率的影响的示意图,随着肌红蛋白的加入,这种影响被逆转。示出了两种不同剂量的肌红蛋白。图8为示出严重一氧化碳中毒对血压和心率的影响的示意图,随着血红蛋白的加入,这种影响被逆转。示出了多种不同剂量的血红蛋白。图9为用于本文公开的线粒体呼吸研究的装备的流程图。图10a-10b为示出co对线粒体和心脏组织呼吸的影响的一组示意图。(图10a)与暴露于co(空气)前相比,co抑制了分离的肝线粒体的呼吸,在3次再充氧中持续抑制(co1、co2、co3)。(图10b)与暴露于co(空气)前相比,在3次再充氧中co抑制了心脏呼吸(co、co2、co3)。图11为示出co抑制线粒体呼吸的示意图,随着脱氧血红蛋白的加入,co抑制线粒体呼吸被逆转。与暴露于co前(室内空气)相比,co使分离的肝线粒体呼吸降低了60.5%(co气体)。添加0.5摩尔脱氧血红蛋白使co呼吸抑制率(co气体)增加95%(血红蛋白)(*=统计学显著性)。图12为示出co抑制心脏组织呼吸的示意图,且随着脱氧肌红蛋白的加入,co抑制心脏组织呼吸被逆转。与暴露于co(空气)前相比,co使lv匀浆的呼吸降低了75.6%(co气体)。添加0.5摩尔脱氧肌红蛋白使co呼吸抑制率(co气体)增加199%(已治疗)。未进行治疗,即使在再充氧后,呼吸率仍与暴露于co的呼吸(co气体)一样低(未治疗)。图13为示出在暴露于30,000ppm(3%)co气体并然后用聚乙二醇化血红蛋白(peg-hb)治疗的小鼠中hbco水平的时间进程示意图。图14为示出暴露于30,000ppm(3%)co气体并然后用peg-hb治疗的小鼠的平均动脉压(map)随时间变化的示意图。具体实施方式i.缩写co一氧化碳co-hb碳氧血红蛋白h2s硫化氢hb血红蛋白hbco碳氧血红蛋白hgb血红蛋白iv静脉内ld50半数致死剂量lv左心室mb肌红蛋白mgb肌红蛋白ngb神经珠蛋白peg-hb聚乙二醇化的血红蛋白rbc红细胞rngb重组神经珠蛋白ros活性氧物种ii.术语和方法除非另有说明,根据常规用法使用技术术语。分子生物学中的常用术语的定义可在benjaminlewin的genesv(牛津大学出版社出版,1994(isbn0-19-854287-9)、kendrew等(编辑)的encyclopediaofmolecularbiology(blackwellscienceltd出版,1994(isbn0-632-02182-9)和roberta.meyers(编辑)的molecularbiologyandbiotechnology:comprehensivedeskreference(robera.meyers(编辑),vch出版商出版,1995(isbn1-560181-569-8)中找到。为了便于对本发明各个实施方案进行评述,下面对具体术语进行了解释。施用:通过任何有效途径向对象提供或给予药物,如治疗性药物(例如,氧载体)。示例性施用路径包括但不限于注射或输注(如皮下、肌内、皮内、腹腔、鞘内、静脉、脑室内、纹状体、颅内和脊髓内)、口服、导管内、舌下、直肠、经皮、鼻内、阴道和吸入途径。解毒剂:一种药物,其中和或抵消中毒效果。一氧化碳(co):一种无色、无臭、无味的气体,该气体在浓度足够高时对人和动物有毒。正常动物代谢也产生低水平的co。碳氧血红蛋白(hbco或co-hb):一种一氧化碳(co)与血红蛋白(hb)的稳定复合物,其在正常代谢期间吸入或产生co时在红细胞中形成。碳氧血红蛋白血症或一氧化碳中毒:一种由于血液中存在过量的一氧化碳导致的病症。通常,暴露于100兆北率(ppm)或以上的co中足以引起碳氧血红蛋白血症。轻微的急性co中毒的症状包括头晕(lightheadedness)、混乱、头痛、晕眩和类感冒的症状;大量暴露可导致中枢神经系统和心脏有显著的毒性,且甚至死亡。急性中毒后,通常出现长期后遗症。一氧化碳还可对孕妇的胎儿有严重影响。慢性暴露于低水平的一氧化碳中可导致抑郁、混乱和记忆丧失。一氧化碳主要通过与血红蛋白结合在血液中形成碳氧血红蛋白(hbco)而对人产生不利影响。这阻止了氧与血红蛋白结合,从而降低了血液的携氧能力,导致缺氧。此外,肌红蛋白和线粒体细胞色素c氧化酶被认为受到了不利影响。碳氧血红蛋白可回到血红蛋白中,但由于hbco复合物相当稳定,所以复原需花费时间。目前治疗co中毒的方法包括施用100%氧气或提供高压氧疗法。接触:直接物理联接放置;包括固体形式和液体形式。当在体内方法的上下文中使用时,“接触”还包括施用。氰化物中毒:一种中毒类型,其是由于暴露于氰化物的某些形式如氰化氢气体和氰化物盐中导致的。氰化物中毒可由于吸入住宅火灾的烟、暴露于金属抛光、特殊的杀虫剂和某些种子(如苹果种子)而发生。氰化物中毒的早期症状包括头疼、眩晕、心跳快、呼吸短促和呕吐。晚期症状包括痉挛、心率慢、血压低、失去意识和心脏骤停。细胞珠蛋白:一种球蛋白分子,其在所有组织中普遍表达。细胞珠蛋白为六配位血红蛋白,据报道,其在组织中促进氧扩散、将亚硝酸盐还原为氧化氮并且在缺氧状态和氧化应激下发挥细胞保护作用。球蛋白:一种含亚铁血红素的蛋白质,参与氧的结合和/或运输。球蛋白包括,例如,血红蛋白、肌红蛋白、神经珠蛋白和细胞珠蛋白。血蓝蛋白:一种蛋白质类型,其可在某些无脊椎动物的整个体内运输氧。血蓝蛋白为金属蛋白,其含有两个可逆地结合单个氧分子的铜原子。血蓝蛋白仅存在于软体动物门(phylummollusca)和节肢动物门(phylumarthropoda)中。血红蛋白(hb):脊椎动物和其他动物血液中的红细胞中的含铁输氧金属蛋白质。在人类中,血红蛋白分子为四个球状蛋白质亚基的组合。每个亚基由与非蛋白亚铁血红素基团紧密联系的蛋白链组成。每个蛋白链排列为一组以球蛋白折叠排布方式连接在一起的α-螺旋结构片段,之所以这样称呼是因为这种排布与其他亚铁血红素/球蛋白中使用的折叠基序相同。这种折叠方式含有强烈结合亚铁血红素基团的口袋。血红素蛋白氧载体(hboc):一种作为氧载体发挥功能的纯化的、重组和/或经修饰的血红蛋白的可传输流体。许多hboc是已知的和/或处于临床开发中。hboc的示例包括但不限于dclhb(hemassisttm;baxter)、mp4(hemospantm;sangart)、吡醇羟乙酯化的血红蛋白poe-缀合物(php)+过氧化氢酶&sod(apexbiosciences)、o-r-polyhba0(hemolinktm;hemosol)、polybvhb(hemopuretm;biopure),polyhb(polyhemetm;northfield)、rhb1.1(optrotm;somatogen),peg-hemoglobin(enzon)、oxyvitatm和hboc-201(greenburg和kim,critcare8(suppl2):s61-s64,2004;telintelhekkert等,amjphysiolheartcircphysiol298:h1103-h1113,2010;eisenach,anesthesiology111:946-963,2009)。异源的:异源性蛋白质或多肽是指一种来源于不同来源或物种的蛋白质或多肽。硫化氢中毒:一种中毒类型,其是由于过度暴露于硫化氢(h2s)中导致的。h2s结合线粒体细胞色酶中的铁并阻止细胞呼吸。暴露于低浓度的h2s可引起眼部刺激、咽喉痛、咳嗽、恶心、呼吸短促、肺水肿、疲劳、食欲不振、头疼、易怒、记忆力差和眩晕。较高水平的暴露可引起即刻衰竭、无法呼吸及死亡。分离的:一种“分离的”生物组分(如核酸分子、蛋白质或细胞)已经基本上与有机体的细胞、血液或组织中的其它生物学组分或有机体本身分离或纯化开来,其中所述组分是天然存在的,例如其它染色体和染色体外的dna和rna、蛋白质和细胞。已“分离的”核酸分子和蛋白质包括由标准纯化方法纯化的那些。该术语还包括通过在宿主细胞中进行重组表达制得的核酸分子和蛋白质以及化学合成的核酸分子和蛋白质。高铁血红蛋白:血红蛋白的氧化形式,其中,亚铁血红素组分中的铁从亚铁(+2)状态氧化为铁(+3)状态。这使得血红蛋白分子不能有效地将氧输送和释放至组织中。一般地,高铁血红蛋白形式中共有大约1%的血红蛋白。肌红蛋白(mb):蛋白质的球蛋白家族中的一员。肌红蛋白为在所有脊椎动物和几乎所有哺乳动物的肌肉组织中存在的结合铁和氧的蛋白质。在人类中,肌红蛋白仅存在于肌肉损伤后的血流中。与血红蛋白不同,肌红蛋白仅含有一个氧结合位点(在蛋白质的一个亚铁血红素基团上),但其对氧的亲和性大于血红蛋白对氧的亲和性。神经珠蛋白(ngb):蛋白质的球蛋白家族中的一员。目前还不知晓神经珠蛋白的生理学功能,但认为在缺氧或缺血条件下提供保护。神经珠蛋白在中枢和周围神经系统、脑脊髓液、视网膜和内分泌组织中表达。氧化剂:一种物质,其能够从另一物质(也称为“氧化的”物质)中接受电子。氧化剂获得电子并在化学反应中被还原。氧化剂也称为“电子受体”。氧载体:能够在体内结合、输送和释放氧的分子或化合物。氧载体包括天然蛋白质,如血红蛋白、肌红蛋白和血蓝蛋白,以及人造氧载体,包括血红蛋白氧载体(hboc)、全氟化碳(pfc)、脂质体包裹的血红蛋白(liposome-encapsulatedhemoglobin)和卟啉金属复合物。肽或多肽:一种聚合物,其中,单体为通过酰胺键连接在一起的氨基酸残基。当氨基酸为α氨基酸时,可使用l光学异构体或d光学异构体,优选l异构体。本文使用的术语“肽”、“多肽”或“蛋白质”旨在包含任意氨基酸序列并且包含经修饰的序列,包括经修饰的球蛋白。术语“肽”和“多肽”具体地旨在涵盖天然存在的蛋白质以及通过重组或合成产生的那些。保守性氨基酸取代为制备时最小限度地干扰原蛋白质的性质的那些取代,蛋白质的性质为蛋白质的结构且尤其是其功能是保守的且不会被该取代显著改变。保守性氨基酸取代的示例如下所示。原残基保守性取代alaserarglysasngln,hisaspglucysserglnasngluasphisasn;glnileleu,valleuilel;vallysarg;gln;glumetleu;ilephemet;leu;tyrserthrthrsertrptyrtyrtrp;phevalile;leu通常,保守性取代维持:(a)例如,作为片状或螺旋构象的取代区域中的多肽骨架的结构;(b)靶向位点处分子的电荷或疏水性;或(c)侧链的本体。一般地,期望使蛋白质性质发生最大变化的取代将是非保守性的,例如,以下性质的变化:(a)亲水性残基,例如,丝氨酸或苏氨酸,取代(或被)疏水性残基(取代),例如,亮氨酸、异亮氨酸、苯基丙氨酸、缬氨酸或丙氨酸;(b)半胱氨酸或脯氨酸取代(或被)任意其他残基(取代);(c)具有带正电侧链的残基,例如,赖氨酸、精氨酸或组氨酸取代(或被)带负电的残基(取代),例如,谷氨酰胺、天冬氨酸;或(d)具有庞大侧链的残基,例如,苯基丙氨酸取代(或被)不具有侧链的残基(取代),例如甘氨酸。药物学上可接受的载体:所使用的药物学上可接受的载体是常规的。由e.w.martin,mackpublishingco.,easton(pa,15thedition,1975)出版的remington′spharmaceuticalsciences描述了组合物和适用于本文公开的组合物的药物递送的制剂。一般地,载体的性质将取决于正在采用的具体施用方式。除了生物学上中性的载体,待施用的药物组合物可含有少量的非毒性助剂,如润湿或乳化剂、防腐剂和ph缓冲剂等,例如醋酸钠或山梨醇单月桂酸酯。卟啉:一种含有四个吡咯环的有机化合物,其在血红蛋白、叶绿素和某些酶中作为金属结合辅因子发挥功效。重组的:重组核酸或蛋白质为具有非天然存在的序列或具有通过将序列的另两个分离的片段进行人工组合制得的序列的核酸或蛋白质。该人工组合通常是由化学合成或通过将分离的核酸片段进行人工操作如遗传工程技术完成的。术语重组体包括已通过添加、取代或者缺失天然核酸分子或蛋白质的一部分而发生改变的核酸和蛋白质。还原剂:一种成分或化合物,其在氧化还原化学反应中向另一化学物种失去或“贡献“电子。还原剂通常处于其中一种可能的低氧化状态,并且称为电子供体。还原剂由于在氧化还原反应中失去电子而被氧化。示例性的还原剂包括但不限于连二亚硫酸钠、抗坏血酸、n-乙酰半胱氨酸、亚甲基蓝、谷胱甘肽、细胞色素b5/b5-还原酶、肼苯哒嗪、土金属、甲酸和亚硫酸盐化合物。序列相同性/相似性:根据序列之间的相同性或相似性表示两个或两个以上核酸序列或者两个或两个以上氨基酸序列之间的相同性。以百分比相同性衡量序列相同性;百分比越大,序列越相同。以百分比相似性(其考虑保守性氨基酸取代)衡量序列相似性;百分比越大,序列越相同。核酸或氨基酸序列的同系物或直系同源物在采用标准法进行比对时具有相对高水平的序列相同性/相似性。当直系同源蛋白质或cdna来源于关系更近(如人和小鼠序列)的物种时,该同源性比关系较远的物种(如人和线虫序列)的同源性更加显著。用于比较的序列比对方法在本领域是公知的。在以下文献中记载了各种程序和比对算法:smith&waterman,adv.appl.math.2:482,1981;needleman&wunsch,j.mol.biol.48:443,1970;pearson&lipman,proc.natl.acad.sci.usa85:2444,1988;higgins&sharp,gene,73:237-44,1988;higgins&sharp,cabios5:151-3,1989;corpet等的nuc.acidsres.16:10881-90,1988;huang等的computerappls.生物科学8,155-65,1992;和pearson等的meth.mol.bio.24:307-31,1994.altschul等j.mol.biol.215:403-10,1990,这篇文献详细考虑了序列比对方法和同源性计算。ncbi基本局部比对搜索工具(blast)(altschul等的j.mol.biol.215:403-10,1990)可从包括美国国家生物技术信息中心(ncbi)和网络在内的各种来源获得以与序列分析程序blastp、blastn、blastx、tblastn和tblastx联合使用。也可在ncbi网站找到额外的信息。对象:活的多细胞有机体,其包括脊椎动物有机体、包括人和非人哺乳动物二者的范畴。合成的:在实验室通过人工手段产生的,例如,在实验室化学合成的合成多肽。治疗有效量:足以在正在被治疗的对象中达到期望效果的化合物或组合物(诸如氧载体)的量。例如,治疗有效量可以是清除血液或组织中一氧化碳、降低血液中的hbco含量和/或减少与一氧化碳中毒有关的一个或多个病症或症状所必需的量。除非另有解释,否则本文使用的所有技术和科学术语与本文所属领域的技术人员通常理解的有相同的含义。除非上下文另有清晰指示,否则单数术语“一个”、“一”和“所述”包括复数个参照对象。“包含a或b”意指包括a或b,或a和b。应进一步理解的是,给定的核酸或多肽的所有碱基大小或氨基酸大小以及所有分子重量或分子质量值都是近似值,并且用于描述。尽管在本发明的实践或测试中可使用与本文描述相似或等同的方法和材料,但下文仍描述了适宜的方法和材料。本文提及的所有的公开文本、专利申请和其他参考文献都通过援引整体并入。如有冲突,以本发明说明书,包括术语的解释为准。此外,所述材料、方法和示例仅仅是示例性的,且并不旨在限制。iii.介绍氧载体既包括天然氧载体,也包括人造氧载体。天然氧载体的示例包括血红蛋白,如来自人、牛或其它活的有机体的血红蛋白;来自人、牛或其他活的有机体的浓缩红细胞或肌红蛋白;和来源于,例如,节肢动物门或其他活的有机体的血蓝蛋白。人造氧载体的示例包括源自天然氧载体的高度功能化氧载体,如经修饰的血红蛋白和脂质体包裹的血红蛋白;完全合成的氧载体,如其内的卟啉金属复合物包含在白蛋白、白蛋白二聚体和白蛋白高分子中的化合物,和全氟化碳;以及重组氧载体,如重组/经修饰的血红蛋白。这些氧载体可替代人和其他动物的红细胞。这些氧载体用于向缺血位点或肿瘤组织供氧以向患者(如大量出血的患者)进行血液输送,进而提供器官保存灌注流体或者作为体外循环流体(美国公开2004/028745和2006/0003923)。卟啉金属复合物的示例为2-[8-(2甲基-1-咪唑基)辛酰基氧甲基]-5,10,15,20-四[α,α,α,α-o-(1-甲基环己酰基氨基)苯基]卟啉复合物(美国专利申请公开号2006/0003923)。脂质体包裹的血红蛋白包括包封在由脂质双层形成的脂质体的内层中的血红蛋白,并且已经对各种制备方法及其研究进行了描述(美国专利申请公开号2004/0258745)。肌红蛋白和血红蛋白为五配位的亚铁血红素蛋白质,其只含有一个永久与亚铁血红素结合的组氨酸。肌红蛋白对co的亲和性是o2的60倍。(nelson等″carbonmonoxide″ingoldfrank′stoxicologicemergencies(9thed.),newyork:mcgraw-hill.pp.1658-1670,2011.)。下文描述了来自亚铁血红素基团的铁原子的反应。其中,kon和koff分别为co结合与解离的速率。表1肌红蛋白与血红蛋白的结合和解离常数肌红蛋白数据来自wan等(procnatlacadsciusa95(22):12825-12831,1998)细胞色素c数据来自cooper等(cerebbloodflowmetab19(l):27-38,1999)血红蛋白数据来自pct公开号wo2014/150413肌红蛋白对co的亲和性是氧气的60倍,并因此优选地与组织中的co结合。由于co存在下的还原态hb用作co结合的容器,所以未结合co的hb可作为co的附加靶点。经修饰的血红蛋白或肌红蛋白(人造氧载体)可以类似的方式作为天然存在的化合物。此外,给出的这些药物已经结合了氧,从而结合co的同时增加了递送至组织中的氧。iv.治疗碳氧血红蛋白血症的方法本文提供了治疗对象中碳氧血红蛋白的方法。所述方法包括选择有碳氧血红蛋白的对象,并将治疗有效量的包含还原形式的天然氧载体或人造氧载体的组合物施用于对象。不需要将包含在组合物中的天然或人造氧载体100%还原以将氧载体视为还原形式。在某些实施方案中,至少70%的氧载体被还原,如至少75%、至少80%、至少85%、至少90%、至少95%、至少96%、至少97%、至少98%或至少99%。在具体的实施方案中,75%-100%、80-100%、85-100%、90-100%或95-100%的氧载体被还原。在某些实施方案中,组合物还包含还原剂。还原剂可以是可安全地施用于对象如人对象中的任意还原剂(例如,具有最低和/或可耐受毒性的药物)。在某些实施例中,还原剂包括连二亚硫酸钠、抗坏血酸、n-乙酰半胱氨酸、亚甲基蓝、谷胱甘肽、细胞色素b5/b5还原酶、肼苯哒嗪或其任意组合。在某些实施方案中,所述方法还包括将第二还原剂添加至还原态氧载体组合物中。在大多数情形下,以最低有效浓度(用于使氧载体维持在其还原形式)的浓度将第二还原剂添加至组合物中,所述最低有效浓度可从生理学上安全地耐受,如被人耐受。在某些实施例中,组合物中还原剂的浓度为大约10μm~大约100mm,如大约50μm~大约50mm、大约100μm~大约25mm、大约250μm~大约10mm、大约500μm~大约5mm,或大约750μm~大约1mm。在具体的实施例中,组合物中还原剂的浓度不超过大约1.0mm、不超过大约1.5mm、不超过大约2.0mm或不超过大约2.5mm。在某些实施方案中,天然氧载体包括球蛋白。在某些实施例中,球蛋白包括血红蛋白。在其他实施例中,球蛋白包括肌红蛋白。在另外的其他实施例中,球蛋白包括神经珠蛋白或细胞珠蛋白。在具体的非限制性实施例中,球蛋白为人球蛋白,如人血红蛋白、人肌红蛋白、人神经珠蛋白或人细胞珠蛋白。在其他的非限制性实施例中,球蛋白来自非人动物,如牛球蛋白或马球蛋白。在某些实施方案中,天然氧载体包括血红蛋白,如软体动物血红蛋白或节肢动物血蓝蛋白。在某些实施方案中,人造氧载体包括血红蛋白氧载体(hboc)。许多hboc在本领域是公知的。选择并还原合适的hboc以用于所公开的方法。在某些实施例中,hboc为dclhb(hemassisttm;baxter)、mp4(hemospantm;sangart)、pyridoxylatedhbpoe-缀合物(php)(apexbiosciences)、o-r-polyhba0(hemolinktm;hemosol)、polybvhb(hemopuretm;biopure)、polyhb(polyhemetm;northfield)、rhb1.1(optrotm;somatogen)、peg-hemoglobin(enzon)、oxyvitatm和hboc-201(greenburg和kim,critcare8(suppl2):s61-s64,2004;telintelhekkert等的amjphysiolheartcircphysiol298:h1103-h1113,2010;eisenach,anesthesiology111:946-963,2009)。在某些实施方案中,人造氧载体包括脂质体包裹的球蛋白,如脂质体包裹的血红蛋白或脂质体包裹的肌红蛋白。在其他实施方案中,人造氧载体为经修饰的球蛋白,如经修饰的血红蛋白、经修饰的肌红蛋白、经修饰的神经珠蛋白或经修饰的细胞珠蛋白。在某些实施方案中,人造氧载体包括卟啉金属复合物。例如,人造氧载体可包括通过添加载体蛋白质(例如,白蛋白、血浆铜蓝蛋白、血液结合素)或有机化合物(例如,全氟化碳)而溶解的卟啉金属复合物衍生物。本文还提供了从血液或动物组织中的血红蛋白去除一氧化碳的方法。所述方法包括将血液或动物组织与包含其还原形式的天然氧载体或人造氧载体的组合物接触。在某些实施方案中,所述方法为体内方法,其中将血液或动物组织与包含天然氧载体或人造氧载体的组合物接触包括将治疗有效量的组合物施用于对象。在某些实施例中,所述方法还包括在将包含天然或人造氧载体的组合物施用于对象之前选择有碳氧血红蛋白的对象。在某些实施例中,所选定的有碳氧血红蛋白血症的对象的血液有至少5%、至少10%、至少15%、至少20%、至少30%、至少40%或至少50%的碳氧血红蛋白。在其他的实施方案中,从血液或动物组织中的血红蛋白去除一氧化碳的方法为体外方法。在从血液或动物组织中的血红蛋白去除一氧化碳的方法的某些实施方案中,组合物还包含还原剂。还原剂可以是能安全地施用于对象如人对象中的任意还原剂(例如,具有少量和/或可耐受的毒性的药物)。在某些实施例中,还原剂包括连二亚硫酸钠、抗坏血酸、n-乙酰半胱氨酸、亚甲基蓝、谷胱甘肽、细胞色素b5/b5还原酶、肼苯哒嗪或其任意组合。在从血液或动物组织中的血红蛋白去除一氧化碳的方法的某些实施方案中,天然氧载体包括球蛋白。在某些实施例中,球蛋白包括血红蛋白。在其他实施例中,球蛋白包括肌红蛋白。在另外的其他实施例中,球蛋白包括神经珠蛋白或细胞珠蛋白。在具体的非限制性实施例中,球蛋白为人球蛋白,如人血红蛋白、人肌红蛋白、人神经珠蛋白或人细胞珠蛋白。在其他的非限制性实施例中,球蛋白来自非人动物,如牛球蛋白或马球蛋白。在从血液或动物组织中的血红蛋白去除一氧化碳的方法的某些实施方案中,天然氧载体包括血蓝蛋白,如软体动物血蓝蛋白或节肢动物血蓝蛋白。在从血液或动物组织中的血红蛋白去除一氧化碳的方法的某些实施方案中,人造氧载体包括血红蛋白氧载体(hboc)。许多hboc在本领域是公知的。可选择并还原合适的hboc以用于所公开的方法。在某些实施例中,hboc为dclhb(hemassisttm;baxter)、mp4(hemospantm;sangart)、pyridoxylatedhbpoe-缀合物(php)(apexbiosciences)、o-r-polyhba0(hemolinktm;hemosol)、polybvhb(hemopuretm;biopure)、polyhb(polyhemetm;northfield)、rhb1.1(optrotm;somatogen)、peg-hemoglobin(enzon)、oxyvitatm和hboc-201(greenburg和kim,critcare8(suppl2):s61-s64,2004;telintelhekkert等的amjphysiolheartcircphysiol298:h1103-h1113,2010;eisenach,anesthesiology111:946-963,2009)。在从血液或动物组织中的血红蛋白去除一氧化碳的方法的某些实施方案中,人造氧载体包括脂质体包裹的球蛋白,如脂质体包裹的血红蛋白或脂质体包裹的肌红蛋白。在其他实施方案中,人造氧载体为经修饰的球蛋白,如经修饰的血红蛋白、经修饰的肌红蛋白、经修饰的神经珠蛋白或经修饰的细胞珠蛋白。在某些实施方案中,人造氧载体包括卟啉金属复合物。例如,人造氧载体可包括通过添加载体蛋白质(例如,白蛋白、血浆铜蓝蛋白、血红蛋白血液结合素)或有机化合物(例如,全氟化碳)而溶解的卟啉金属复合物衍生物。v.治疗氰化物中毒的方法已知氰化物以co介导的抑制相似的方式抑制线粒体呼吸,即通过结合细胞色素c氧化酶的亚铁血红素a3中心对线粒体呼吸进行抑制。尽管其可部分地结合还原形式,但是氰化物与细胞色素c氧化酶(电子运输链的复合物iv)的氧化状态的结合最强(leavesley等的toxicolsci101(1):101-111,2008)。与还原态的氧载体清除co的能力相似,通过氧化剂介导的氧化态的氧载体能够清除氰化物。因此,本文设想了天然和人造氧载体的用于从位于红细胞内的氰基-血红蛋白以及体内其他的含亚铁血红素蛋白质中(如细胞色素c氧化酶)去除氰化物的用途。本文提供了治疗对象中氰化物中毒的方法。在某些实施方案中,所述方法包括选择有氰化物中毒的对象;以及将治疗有效量的包含天然或人造氧载体的组合物施用于对象,其中,所述氧载体为其氧化形式。不需要将包含在组合物中的天然或人造氧载体100%氧化以将氧载体视为氧化形式。在某些实施方案中,至少70%的氧载体可被氧化,如至少75%、至少80%、至少90%、至少95%、至少96%、至少97%、至少98%或至少99%。在具体的实施方案中,75%-100%、80-100%、85-100%、90-100%或95-100%的氧载体可被氧化。在某些实施方案中,组合物还包含氧化剂。氧化剂可以是能安全地施用于对象如人对象中的任意氧化剂(例如,具有少量和/或可容许毒性的药物)。在某些实施例中,氧化剂包括含氧的气体混合物、含氧的液体混合物、铁氰化物盐(如铁氰化磷),或其任意组合。在某些实施方案中,所述方法还包括将第二氧化剂添加至氧化态氧载体组合物中。在大多数情形下,以最低有效浓度(用于将氧载体维持在其氧化形式)的浓度将第二氧化剂添加至组合物中,所述最低有效浓度可从生理学上安全地耐受,如被人耐受。在某些实施例中,组合物中氧化剂的浓度为大约10μm~大约100mm,如大约50μm~大约50mm、大约100μm~大约25mm、大约250μm~大约10mm、大约500μm~大约5mm,或大约750μm~大约1mm。在具体的实施例中,组合物中氧化剂的浓度不超过大约1.0mm、不超过大约1.5mm、不超过大约2.0mm或不超过大约2.5mm。在某些实施方案中,天然氧载体包括球蛋白。在某些实施例中,球蛋白包括血红蛋白。在其他实施例中,球蛋白包括肌红蛋白。在另外的其他实施例中,球蛋白包括神经珠蛋白或细胞珠蛋白。在具体的非限制性实施例中,球蛋白为人球蛋白,如人血红蛋白、人肌红蛋白、人神经珠蛋白或人细胞珠蛋白。在其他的非限制性实施例中,球蛋白来自非人动物,如牛球蛋白或马球蛋白。在某些实施方案中,天然氧载体包括血蓝蛋白,如软体动物血蓝蛋白或节肢动物血蓝蛋白。在某些实施方案中,人造氧载体包括血红蛋白氧载体(hboc)。许多hboc在本领域是公知的。选择并还原合适的hboc以用于所公开的方法。在某些实施例中,hboc为dclhb(hemassisttm;baxter)、mp4(hemospantm;sangart)、pyridoxylatedhbpoe-缀合物(php)(apexbiosciences)、o-r-polyhba0(hemolinktm;hemosol)polybvhb(hemopuretm;biopure),polyhb(polyhemetm;northfield)、rhb1.1(optrotm;somatogen)、peg-hemoglobin(enzon)、oxyvitatm和hboc-201(greenburg和kim,critcare8(suppl2):s61-s64,2004;telintelhekkert等的amjphysiolheartcircphysiol298:h1103-h1113,2010;eisenach,anesthesiology111:946-963,2009)。在某些实施方案中,人造氧载体包括脂质体包裹的球蛋白,如脂质体包裹的血红蛋白或脂质体包裹的肌红蛋白。在其他实施方案中,人造氧载体为经修饰的球蛋白,如经修饰的血红蛋白、经修饰的肌红蛋白、经修饰的神经珠蛋白或经修饰的细胞珠蛋白。在某些实施方案中,人造氧载体包括卟啉金属复合物。例如,人造氧载体可包括通过添加载体蛋白质(例如,白蛋白、血浆铜蓝蛋白、血红蛋白血液结合素)或有机化合物(例如,全氟化碳)而溶解的卟啉金属复合物衍生物。本文还提供了从血液或动物组织的含亚铁血红素的蛋白质中去除氰化物的方法。所述方法包括将血液或动物组织与包含氧化形式的天然氧载体或人造氧载体的组合物接触。在某些实施方案中,所述含亚铁血红素的蛋白质为血红蛋白或细胞色素c氧化酶。在某些实施方案中,所述方法为体内方法,其中将血液或动物组织与包含天然氧载体或人造氧载体的组合物接触包括将治疗有效量的组合物施用于对象。在某些实施例中,所述方法还包括在将包含天然或人造氧载体的组合物施用于对象之前选择有氰化物中毒的对象。在其他实施方案中,所述从血液或动物组织的含亚铁血红素蛋白质中去除氰化物的方法为体外方法。在从血液或动物组织的含亚铁血红素的蛋白质中去除氰化物的方法的某些实施方案中,组合物还包含氧化剂。氧化剂可以是能安全地施用于对象如人对象中的任意氧化剂(例如,具有少量和/或可耐受的毒性的药物)。在某些实施例中,氧化剂包括含氧的气体混合物、含氧的液体混合物、铁氰化物盐(如铁氰化磷),或其任意组合。在从血液或动物组织的含亚铁血红素的蛋白质中去除氰化物的方法的某些实施方案中,天然氧载体包括球蛋白。在某些实施例中,球蛋白包括血红蛋白。在其他实施例中,球蛋白包括肌红蛋白。在其他实施例中,球蛋白包括神经珠蛋白或细胞珠蛋白。在具体的非限制性实施例中,球蛋白为人球蛋白。在其他的非限制性实施例中,球蛋白来自非人动物,如牛球蛋白或马球蛋白。在从血液或动物组织的含亚铁血红素的蛋白质中去除氰化物的方法的某些实施方案中,天然氧载体包括血蓝蛋白,如软体动物血蓝蛋白或节肢动物血蓝蛋白。在从血液或动物组织的含亚铁血红素的蛋白质中去除氰化物的方法的某些实施方案中,人造氧载体包括血红蛋白氧载体(hboc)。许多hboc在本领域是公知的。可选择并还原合适的hboc以用于所公开的方法。在某些实施例中,hboc为dclhb(hemassisttm;baxter)、mp4(hemospantm;sangart)、pyridoxylatedhbpoe-缀合物(php)(apexbiosciences)、o-r-polyhba0(hemolinktm;hemosol)、polybvhb(hemopuretm;biopure)、polyhb(polyhemetm;northfield)、rhb1.1(optrotm;somatogen)、peg-hemoglobin(enzon)、oxyvitatm和hboc-201(greenburg和kim,critcare8(suppl2):s61-s64,2004;telintelhekkert等的amjphysiolheartcircphysiol298:h1103-h1113,2010;eisenach,anesthesiology111:946-963,2009)。在从血液或动物组织的含亚铁血红素的蛋白质中去除氰化物的方法的某些实施方案中,人造氧载体包括脂质体包裹的球蛋白,如脂质体包裹的血红蛋白或脂质体包裹的肌红蛋白。在其他实施方案中,人造氧载体为经修饰的球蛋白,如经修饰的血红蛋白、经修饰的肌红蛋白、经修饰的神经珠蛋白或经修饰的细胞珠蛋白。在某些实施方案中,人造氧载体包括卟啉金属复合物。例如,人造氧载体可包括通过添加载体蛋白质(例如,白蛋白、血浆铜蓝蛋白、血红蛋白血液结合素)或有机化合物(例如,全氟化碳)而溶解的卟啉金属复合物衍生物。vi.治疗硫化氢(h2s)中毒的方法已知硫化氢以与co介导的抑制线粒体呼吸的相似的方式来抑制线粒体呼吸。h2s与细胞色素c氧化酶(电子运输链的复合物iv)的还原形式的结合最强(nicholls等的biochemsoctrans41(5):1312-1316,2013)。与还原态的氧载体清除co的能力相似,通过还原剂介导的还原态的氧载体能够清除h2s。因此,本文设想了天然和人造氧载体用于从位于红细胞内的血红蛋白以及体内其他的含亚铁血红素的蛋白质(如细胞色素c氧化酶)中去除h2s的用途。本文提供了治疗对象中硫化氢(h2s)中毒的方法。在某些实施方案中,所述方法包括选择有h2s中毒的对象;以及将治疗有效量的包含天然或人造氧载体的组合物施用于对象,其中,所述氧载体为其还原形式。不需要将组合物中包含的天然或人造氧载体100%还原以将氧载体视为还原形式。在某些实施方案中,至少70%的氧载体被还原,如至少75%、至少80%、至少85%、至少90%、至少95%、至少96%、至少97%、至少98%或至少99%。在具体的实施方案中,75%-100%、80-100%、85-100%、90-100%或95-100%的氧载体被还原。在某些实施方案中,组合物还包含还原剂。还原剂可以是能安全地施用于对象如人对象中的任意还原剂(例如,具有少量和/或可耐受的毒性的药物)。在某些实施例中,还原剂包括连二亚硫酸钠、抗坏血酸、n-乙酰半胱氨酸、亚甲基蓝、谷胱甘肽、细胞色素b5/b5还原酶、肼苯哒嗪或其任意组合。在某些实施方案中,所述方法还包括将第二还原剂添加至还原态的氧载体中。在大多数情形下,以最低有效浓度(用于使氧载体维持在还原形式)的浓度将第二还原剂添加至组合物中,所述最低有效浓度在生理学上安全地被耐受,如被人耐受。在某些实施例中,组合物中还原剂的浓度为大约10μm~大约100mm,如大约50μm~大约50mm、大约100μm~大约25mm、大约250μm~大约10mm、大约500μm~大约5mm,或大约750μm~大约1mm。在具体的实施例中,组合物中还原剂的浓度不超过大约1.0mm、不超过大约1.5mm、不超过大约2.0mm或不超过大约2.5mm。在某些实施方案中,天然氧载体包括球蛋白。在某些实施例中,球蛋白包括血红蛋白。在其他实施例中,球蛋白包括肌红蛋白。在另外的其他实施例中,球蛋白包括神经珠蛋白或细胞珠蛋白。在具体的非限制性实施例中,球蛋白为人球蛋白,如人血红蛋白、人肌红蛋白、人神经珠蛋白或人细胞珠蛋白。在其他的非限制性实施例中,球蛋白来自非人动物,如牛球蛋白或马球蛋白。在某些实施方案中,天然氧载体包括血蓝蛋白,如软体动物血蓝蛋白或节肢动物血蓝蛋白。在某些实施方案中,人造氧载体包括血红蛋白氧载体(hboc)。许多hboc在本领域是公知的。选择并还原合适的hboc以用于所公开的方法。在某些实施例中,hboc为dclhb(hemassisttm;baxter)、mp4(hemospantm;sangart)、pyridoxylatedhbpoe-缀合物(php)(apexbiosciences)、o-r-polyhba0(hemolinktm;hemosol)、polybvhb(hemopuretm;biopure)、polyhb(polyhemetm;northfield)、rhb1.1(optrotm;somatogen)、peg-hemoglobin(enzon)、oxyvitatm和hboc-201(greenburg和kim,critcare8(suppl2):s61-s64,2004;telintelhekkert等的amjphysiolheartcircphysiol298:h1103-h1113,2010;eisenach,anesthesiology111:946-963,2009)。在某些实施方案中,人造氧载体包括脂质体包裹的球蛋白,如脂质体包裹的血红蛋白或脂质体包裹的肌红蛋白。在其他实施方案中,人造氧载体为经修饰的球蛋白,如经修饰的血红蛋白、经修饰的肌红蛋白、经修饰的神经珠蛋白或经修饰的细胞珠蛋白。在某些实施方案中,人造氧载体包括卟啉金属复合物。例如,人造氧载体可包括通过添加载体蛋白质(例如,白蛋白、血浆铜蓝蛋白、血红蛋白血液结合素)或有机化合物(例如,全氟化碳)而溶解的卟啉金属复合物衍生物。本文还提供了从血液或动物组织的含亚铁血红素的蛋白质中去除h2s的方法。所述方法包括将血液或动物组织与包含其还原形式的天然氧载体或人造氧载体的组合物接触。在某些实施方案中,含亚铁血红素的蛋白质为血红蛋白或细胞色素c氧化酶。在某些实施方案中,所述方法为体内方法,其中将血液或动物组织与包含天然氧载体或人造氧载体的组合物接触包括将治疗有效量的组合物施用于对象。在某些实施例中,所述方法还包括在将包含天然或人造氧载体的组合物施用于对象之前选择有h2s中毒的对象。在其他实施方案中,所述从血液或动物组织的含亚铁血红素的蛋白质中去除h2s的方法为体外方法。在从血液或动物组织的含亚铁血红素的蛋白质中去除h2s的方法的某些实施方案中,组合物还包含还原剂。还原剂可以是能安全地施用于对象如人对象中的任意还原剂(例如,具有少量和/或可耐受的毒性的药物)。在某些实施例中,还原剂包括含连二亚硫酸钠、抗坏血酸、n-乙酰半胱氨酸、亚甲基蓝、谷胱甘肽、细胞色素b5/b5还原酶、肼苯哒嗪或其任意组合。在从血液或动物组织的含亚铁血红素的蛋白质中去除h2s的方法的某些实施方案中,天然氧载体包括球蛋白。在某些实施例中,球蛋白包括血红蛋白。在其他实施例中,球蛋白包括肌红蛋白。在其他实施例中,球蛋白包括神经珠蛋白或细胞珠蛋白。在具体的非限制性实施例中,球蛋白为人球蛋白。在其他的非限制性实施例中,球蛋白来自非人动物,如牛球蛋白或马球蛋白。在从血液或动物组织的含亚铁血红素的蛋白质中去除h2s的方法的某些实施方案中,天然氧载体包括血蓝蛋白,如软体动物血蓝蛋白或节肢动物血蓝蛋白。在从血液或动物组织的含亚铁血红素的蛋白质中去除h2s的方法的某些实施方案中,人造氧载体包括血红蛋白氧载体(hboc)。许多hboc在本领域是公知的。可选择并还原合适的hboc以用于所公开的方法。在某些实施例中,hboc为dclhb(hemassisttm;baxter)、mp4(hemospantm;sangart)、pyridoxylatedhbpoe-缀合物(php)(apexbiosciences)、o-r-polyhba0(hemolinktm;hemosol)、polybvhb(hemopuretm;biopure)、polyhb(polyhemetm;northfield)、rhb1.1(optrotm;somatogen)、peg-hemoglobin(enzon)、oxyvitatm和hboc-201(greenburg和kim,critcare8(suppl2):s61-s64,2004;telintelhekkert等的amjphysiolheartcircphysiol298:h1103-h1113,2010;eisenach,anesthesiology111:946-963,2009)。在从血液或动物组织的含亚铁血红素的蛋白质中去除h2s的方法的某些实施方案中,人造氧载体包括脂质体包裹的球蛋白,如脂质体包裹的血红蛋白或脂质体包裹的肌红蛋白。在其他实施方案中,人造氧载体为经修饰的球蛋白,如经修饰的血红蛋白、经修饰的肌红蛋白、经修饰的神经珠蛋白或经修饰的细胞珠蛋白。在某些实施方案中,人造氧载体包括卟啉金属复合物。例如,人造氧载体可包括通过添加载体蛋白质(例如,白蛋白、血浆铜蓝蛋白、血红蛋白血液结合素)或有机化合物(例如,全氟化碳)而溶解的卟啉金属复合物衍生物。vii.制备还原态氧载体的方法本文还提供了一种制备还原态氧载体的方法。所述方法包括将氧载体与第一还原剂接触以产生氧载体-还原剂组合物;和将氧载体-还原剂组合物通过脱盐柱以形成还原态氧载体组合物。在厌氧的环境下进行还原态氧载体的制备。在某些实施方案中,以1:100至5:1的比例(还原剂:氧载体)将第一还原剂与氧载体接触。在具体的实施方案中,还原剂与氧载体的比例为从1:50至4:1、从1:25至3:1、从1:10至2:1或从1:5至1:1。在某些实施例中,还原剂与氧载体的比例为大约5:1、大约4:1、大约3:1、大约2:1、大约1:1、大约1:2、大约1:5、大约1:10、大约1:20、大约1:30、大约1:40、大约1:50、大约1:60、大约1:70、大约1:80、大约1:90或大约1:100。在某些实施方案中,所述方法还包括将第二还原剂添加至还原态氧载体组合物中。在大多数情形下,以最有效浓度(用于将氧载体维持在还原形式)的浓度添加第二还原剂,所述最低有效浓度从生理学上可安全地被耐受,如被人耐受。在某些实施例中,按以下浓度添加第二还原剂:大约10μm至大约100mm,如大约50μm至大约50mm、大约100μm至大约25mm、大约250μm至大约10mm、大约500μm至大约5mm或大约750μm至大约1mm。在具体的实施例中,按以下浓度添加第二还原剂:不超过大约1.0mm、不超过大约1.5mm、不超过大约2.0mm或不超过大约2.5mm。还原剂可以是能安全地施用于对象如人或其他哺乳动物对象(例如,具有少量和/或可耐受的毒性的药物)中的任意还原剂。在某些实施方案中,第一还原剂、第二还原剂或二者都选自连二亚硫酸钠、抗坏血酸、n-乙酰半胱氨酸、亚甲基蓝、谷胱甘肽、细胞色素b5/b5还原酶、肼苯哒嗪或其任意组合。在某些实施方案中,所述方法还包括冷冻还原态氧载体组合物以产生冷冻的还原态氧载体组合物。在某些实施方案中,所述方法还包括解冻冷冻的还原态氧载体组合物。在某些实施方案中,所述方法还包括将还原态氧载体施用于有需要的对象中,如施用于有碳氧血红蛋白血症(一氧化碳中毒)或硫化氢中毒的对象中。在某些实施例中,对象的血液有至少5%、至少10%、至少15%、至少20%、至少30%、至少40%或至少50%的碳氧血红蛋白。viii.制备氧化态氧载体的方法本文还提供了制备氧化态氧载体的方法。所述方法包括将氧载体与第一氧化剂接触以产生氧载体-氧化剂组合物;和将氧载体-氧化剂组合物通过脱盐柱以形成氧化态氧载体组合物。在需氧的环境下进行氧化态氧载体的制备。在某些实施方案中,以1:100至5:1的比例(氧化剂:氧载体)将第一氧化剂与氧载体接触。在具体的实施方案中,氧化剂与氧载体的比例为从1:50至4:1、从1:25至3:1、从1:10至2:1或从1:5至1:1。在某些实施例中,氧化剂与氧载体的比例为大约5:1、大约4:1、大约3:1、大约2:1、大约1:1、大约1:2、大约1:5、大约1:10、大约1:20、大约1:30、大约1:40、大约1:50、大约1:60、大约1:70、大约1:80、大约1:90或大约1:100。在某些实施方案中,通过诸如脱盐或凝胶色谱法等的方法从氧载体中物理地或化学地去除第一氧化剂(例如铁氰化物)。在某些实施方案中,所述方法还包括将第二氧化剂添加至氧化态氧载体组合物中。在大多数情形下,以最低有效浓度(用于将氧载体维持在其氧化形式)的浓度添加第二氧化剂,所述最低有效浓度从生理学上被安全地耐受,如被人耐受。在某些实施例中,按以下浓度添加第二氧化剂:大约10μm至大约100mm,如大约50μm至大约50mm、大约100μm至大约25mm、大约250μm至大约10mm、大约500μm至大约5mm或大约750μm至大约1mm。在具体的实施例中,按以下浓度添加第二氧化剂:不超过大约1.0mm、不超过大约1.5mm、不超过大约2.0mm或不超过大约2.5mm。氧化剂可以是能安全地施用于对象如人或其他哺乳动物对象(例如,具有少量和/或可耐受的毒性的药物)中的任意氧化剂。在某些实施方案中,第一氧化剂、第二氧化剂或二者都选自含氧的气体混合物、含氧的液体混合物、铁氰化物盐(如铁氰化磷),或其任意组合。在某些实施方案中,所述方法还包括冷冻氧化态氧载体以产生冷冻的氧化态氧载体组合物。在某些实施方案中,所述方法还包括解冻冷冻的氧化态氧载体组合物。在某些实施方案中,所述方法还包括将氧化态氧载体施用于有需要的对象中,如施用于有氰化物中毒的对象中。提供以下实施例用以说明某些具体特征和/或实施方案。这些实施例不应被认为是将本发明限制为所描述的具体特征或实施方案。实施例实施例1:一氧化碳(co)清除快速体内去除co中毒小鼠中的碳氧血红蛋白(hbco)先前已显示出,将小鼠暴露于含1500ppmco气体的空气中平均50分钟使hbco水平增加至64%+/-1%(pct公开号wo2014/150413)。在暴露之前,将小鼠通过手术放置股动脉和静脉导管以进行血压监测、血液取样和注入重组神经珠蛋白(rngb)、另一种类型的co清除球蛋白或作为对照的pbs。采用harvard输液泵,在4分钟内,将250μl的8-12mmrngb或pbs注入小鼠体内。注入后立即并且每5分钟收集5μl血液以测量hbco。如图1所示,与pbs对照相比,rngb注入可快速地降低hbco水平。具体地,返回至正常空气中5分钟后,接受了rngb的组中的hbco水平平均下降32.8%,而接了pbs的组中的hbco水平平均下降13.3%(图1)。60分钟后,处死小鼠并发现膀胱中含有毫克分子浓度的rngb。该研究表明rngb作为co体内螯合剂,从而快速地降低hbco水平,并且rngb通过肾脏被过滤。实施例2:材料和方法该实施例描述了用于实施例3-8中描述的研究的方法和实验过程。混合有肌红蛋白的羧基化rbc的动力学将50-100μl的血液用pbs洗涤5-7次,并以1000xg离心5-10分钟,得到红细胞。在1-2ml的pbs中稀释经洗涤的rbc。然后,通过氩气气流,在缓慢搅拌下,在冰上对rbc脱氧达1小时。对于厌氧实验,短暂地通过氩气,并将相对于hb过量的连二亚硫酸钠加入rbc中。以至少4:1的比例稀释羧基化的红细胞溶液,得到羧基化的红细胞包裹的hb。用脱气的pbs(对于厌氧实验,含5-10mm连二亚硫酸)洗涤rbc两次,并在脱气的且覆盖隔膜的15ml离心管内以1000xg离心5分钟,从而去除过量的co。洗涤后,重悬rbc至终浓度100-200μm,对于厌氧实验,使用过量的连二亚硫酸钠。根据用纯hb进行实验描述的相同步骤制备氧合或脱氧的肌红蛋白(mb)。在某些实验中,启动反应后,将红细胞与mb分离来测量吸光光谱。在这种情形下,用isotemp搅拌电炉和水浴组合(fisherscientific)来调节反应温度。在单独的玻璃小瓶内将红细胞包裹的碳氧血红蛋白(hbco)和氧合或脱氧的mb平衡至25或37℃。通过将mb注入rbc溶液中来启动反应,以使两种蛋白质的终浓度都为40μm。将等效体积的pbs(有或没有连二亚硫酸)注入羧基化的rbc的对照样品中。定期提取0.5ml的反应样品和对照样品并在1.5ml微离心管中以5000xg离心30-60秒。去除含mb的上清液(在需氧试验中加入5mm连二亚硫酸钠以防止蛋白质自动氧化)并保存在冰上。将0.5%np40的pbs溶液(对于厌氧实验,有时是需氧实验,一直含有5mm连二亚硫酸钠)加入红细胞团中以使细胞裂解。在1cm光程长度的比色杯中,用cary50分光光度仪测量裂解的rbs溶液的hb吸光度。该循环重复6次,每次1.5-5分钟,得到6个hb的吸光度测量值。连续搅拌对照和反应样品。测量反应中血红蛋白的吸光度的时间被认为是离心(第二次离心分别为30或60秒)开始后注入mb15或30秒后所经过的时间。测量最后第6个时间点后,记录保存的反应上清液样品和对照混合物的吸光度。在某些实验中,rbc不与mb分离。相反,用cary100分光光度仪的积分球附件记录整个混合物的吸光度。该设备收集rbc散射的光,从而得到充分精确进行光谱去卷积的吸光光谱。这些实验的过程与制备羧基化红细胞后在cary50中将mby与纯hbco混合的过程相同。最小平方去卷积获得血红细胞(hb)和肌红蛋白(mb)的氧化(中间态)、脱氧(脱氧的)、氧合(o2)和羧基化(co)形式的标准参考光谱。在冰上解冻蛋白质后,通过与过量的铁氰化钾混合并通过econo-pac10dg脱盐柱(bio-radlaboratories,hercules,ca)得到氧化形式的光谱。将过量的连二亚硫酸钠加入氧化形式后记录脱氧物种的光谱。在需氧条件下,将脱氧物种通过脱盐柱后立即记录氧合形式的光谱。将脱氧物种与co饱和的缓冲液以1:4的比例混合后,测量羧基化形式的光谱。在cary50分光光度仪上,于20℃、25℃和37℃下,收集所有标准光谱。在microsoftexcel中用最小平方拟合程序进行实验光谱的去卷积。因为动力学实验的吸光度的变化相对较小,所以在将或不将hb和mb浓度约束为彼此相等的情况下由hb和mb二者组成的所有光谱在450与700nm、在490与650nm和在510与600nm之间始终是拟合的,以便确认去卷积的准确度。出于相同的目的,在某些情况下,在所述拟合中还包括能使光谱沿波长轴水平变换的参数。利用hb和mb的羧基化和脱氧化标准对来自厌氧实验的吸光光谱进行去卷积。利用hb和mb的氧化、羧基化和氧合形式的标准对来自需氧实验的吸光光谱进行去卷积。对于rbc实验(在该实验中,hb与mb分离,且之后将连二亚硫酸加入需氧实验中的rbc或者厌氧实验中的上清液中),在去卷积中使用脱氧标准而非氧合和氧化形式。在对用停流光谱仪(有时用cary50分光光谱仪)收集的光谱进行去卷积之前,并且有时用hp8453进行去卷积之前,将吸光度值重映射为与用matlab的interp1函数采用分段三次埃尔米特插值(piecewisecubichermiteinterpolation)cary50分光光度仪所使用的那些相同的波长。氧载体的还原为了使氧载体易于结合co,它们必须是fe2+形式(还原形式),而非氧化的fe3+形式。氧化形式不与co相互作用,且因而是无效的。为达到氧载体的还原状态,要加入强还原剂,并然后在施用之前将其去除。为将蛋白质保持在还原形式,可加入抗坏血酸和/或n-乙酰半胱氨酸、能安全且定期在人中施用的较温和的还原剂。图2提供了氧载体制备工艺的流程图。第一步为还原含有强还原剂如连二亚硫酸钠(一般的工业还原剂)的试剂。连二亚硫酸本身在大鼠体内的ld50为2500mg/kg体重。为使所施用的量最小,通过g25分离柱去除连二亚硫酸钠盐。该制备有大约90%的去除率(ge)。其是在机罩下在厌氧条件下用厌氧缓冲液(pbs)制得的。在该步骤后,所述试剂被还原为脱氧状态。然后,加入低浓度的还原剂以将试剂保持在还原状态。所使用的试剂少量地(如在小鼠中应用1.25mm连二亚硫酸)应用于人类中是安全的。预测的人ld50为0.5g/kg,小鼠称重为大约25g,所以小鼠中ld50剂量为大约62.5mg;本研究一共使用0.067mg。在盐酸羟吗啡酮iv(numorphantm)的配方中,存在0.10%连二亚硫酸,这相当于每100ml溶液中有约100mg。用于该过程的其它试剂,例如,为抗坏血酸、n-乙酰半胱氨酸、亚甲基蓝、谷胱甘肽和细胞色素b5/b5还原酶。在人类中,抗坏血酸和n-乙酰半胱氨酸是用于治疗目的的,并且耐受性极好。抗坏血酸的每日最大剂量为6giv,n-乙酰半胱氨酸的每日最大剂量为300mg/kg(或25g)。用于治疗高铁血红蛋白症的亚甲基蓝的推荐剂量为1-2mg/kg或50mg/m2,重复两次iv。然后,将试剂密封并存储在-80℃。解冻时,>95%的试剂仍处于还原形式。图3示出了作为co清除剂的氧载体的制备和施用的流程图。实施例3:co中毒的体外模型氧载体将从co中毒的hbco复合物中清除掉co。在该清除过程的体外模型中,在厌氧条件下将100%hbco置于溶液中。当加入pbs时,由光谱学测量的hbco的浓度不发生变化。当以1:1的比例将100%脱氧肌红蛋白加入该溶液中时,超过一半的hbco被还原,且co被肌红蛋白结合。当加入hbco中的量不足(110.8μmhbcovs85.3μm脱氧肌红蛋白)时,hbco浓度减少三分之一(图4)。实施例4:氧载体逆转血液动力学崩溃并提高严重co中毒小鼠模型中的存活率在啮齿动物中建立co中毒模型。利用这些模型,结果表明肌红蛋白和血红蛋白可作为解毒试剂,其可以:1)从血红蛋白中体内清除co,2)逆转由co中毒诱发的血液动力学崩溃和3)逆转由co毒性引起的线粒体呼吸抑制。为建立心血管和死亡终点的模型,将气管插管的、通气的、麻醉的小鼠暴露于含21%氧气以及1.5%异氟烷的30,000ppm(3%)co气体中4.5分钟。对小鼠手术放置颈静脉导管(用于注入药物)和颈动脉导管(用于血压和心率监测)。在该模型中,暴露后注入300μlpbs的组中死亡率为88.2%(15/17),而注入了11mm肌红蛋白的所有小鼠则存活下来(0%死亡率;n=5)。注入有肌红蛋白的小鼠的存活是由于逆转了由co诱发的血液动力学崩溃和心动过缓导致的(图5)。通过颈静脉导管,用光谱测定法对hbco水平取样。立即暴露于co4.5分钟后,hbco水平平均为84-88%。注入pbs或马肌红蛋白后5分钟,hbco水平已经分别降至72.5%和65.04%。治疗后10分钟,hbco水平分别又进一步降至64.2%和52.8%。针对co的小鼠半衰期比人的半衰期快得多。结果表明,注入肌红蛋白比注入流体和停止暴露更快地降低hbco的水平。如图6所示,通气的小鼠暴露于3%co气体4.5分钟后,注入300μl的pbs导致88.2%的死亡率(用蓝色记录死亡数)。注入300μl的11.5mm还原态肌红蛋白导致0%的死亡率(红色)。注入还原态肌红蛋白的小鼠的存活是恢复心率(顶部)和平均动脉血压(底部)的结果。与pbs(7.69%,n=13)和肌红蛋白浓度大于11mm(100%存活,n=10)相比,肌红蛋白浓度小于11mm并不产生相同的存活益处(0%存活,n=4)(图7)。如图7所示,需要肌红蛋白大于11mm以逆转由严重co中毒诱发的血液动力学崩溃。这是由于co通过还原态氧载体与hbco复合物的化学计量结合导致的。以相似的方式,氧载体的中间-(或氧化)形式并不参与该清除过程,并因此是无效的。因而,为了使该疗法有效,必须制备还原态氧载体。与肌红蛋白类似,将血红蛋白注入严重co中毒模型中的小鼠体内。这也显示出显著的逆转由严重的co中毒诱发的血液动力学崩溃的能力(图8)。如图8所示,注入血红蛋白逆转了由严重co中毒诱发的血液动力学崩溃。由于co清除过程的本质,浓度小于4mm不能逆转这些影响。再者,由于co可以化学计量形式从hbco中清除,所以血红蛋白的浓度具有高的浓度依赖性。逆转血液动力学崩溃所要求的浓度位于拐点处,≥mm至注入有<4mm的小鼠死亡,而注入≥4mm的小鼠全部存活。实施例5:测定氧载体在健康小鼠中的安全性健康小鼠中血红蛋白和肌红蛋白注入具有极好的耐受性。用3%异氟烷气体麻醉健康小鼠,并将肌红蛋白和血红蛋白注入眼眶后的空间。观察小鼠48小时。在随后的24小时中,麻醉和体重减轻后,小鼠的活力轻微降低,但是之后,它们又恢复了正常活力并增加了体重。在48小时时,处死动物,其血清用以血液化学分析,全血用以检验全血球计数。血液学分析揭示了仅血小板轻微减少,对照动物中也存在这种情况。血液化学分析表明肾脏和肝功能正常。这揭示了,即使是大量注入(8-12mm)肌红蛋白和血红蛋白,对小鼠来说也是安全的且耐受性良好。实施例6:测定co清除剂逆转co诱导的线粒体抑制的能力在clark型氧电极呼吸测量系统中,于co气体暴露前后,测定线粒体呼吸。对注入还原态血红蛋白和肌红蛋白二者的效果进行评价。收集来自正常大鼠的新鲜肝脏,并通过差速离心分离线粒体。对于左心室(lv)组织,收集来自正常大鼠的新鲜lv,然后进行均质化。将得到的线粒体和lv组织放入clark型电极气密性反应室中,然后加入底物(琥珀酸盐(线粒体)或苹果酸盐和丙酮酸盐(lv)和adp)。线粒体呼吸至0%氧气,并然后用移液管吸取室内气体对该系统进行再充氧。线粒体呼吸返回至期望的o2浓度。在该点处,以气体形式或饱和pbs溶液形式加入co。然后对该系统再充氧,且呼吸发生下降至0%。将这些呼吸速率与暴露于co前作比较。第一个再充氧步骤的原因是更均等地对已经历能损坏其功能的一些低氧状况的线粒体的速率作比较。该步骤完成后,加入co清除剂,对系统再充氧,并将该最终呼吸速率与co呼吸前后作比较。如图9所示,加入adp/琥珀酸盐后,线粒体呼吸至期望的o2浓度,对系统再充氧,且线粒体再次呼吸至期望的o2水平。然后注入co,对系统再充氧,并比较呼吸速率。呼吸至0%o2后,注入肌红蛋白,对系统再充氧,并比较速率。实施例7:血红蛋白和肌红蛋白逆转线粒体co毒性的能力co中毒对患者有长期的影响,一种理论是认为线粒体中毒会导致通过抑制电子传递链的复合物iv而增加活性氧物种(ros)。研发用于测量由co暴露产生的抑制量和通过呼吸速率对该抑制量量化的模型。在clark电极中,测量分离自大鼠肝脏和左心室(lv)的线粒体的氧呼吸,加入底物琥珀酸盐和adp来测量最大呼吸。结果表明,3次再充氧中在分离的线粒体中(图10a)和lv组织中(图10b)co气体诱导线粒体呼吸持续下降并(回注氧气至呼吸测量系统,并使线粒体再次呼吸至0%氧气)。这种影响在更缺氧状态下更强,与co和o2之间已知的竞争结合细胞色素c氧化酶中的亚铁血红素(缺氧时下降62%vs.常氧时下降50%)相一致。这表明了测定在常氧和缺氧条件下co中毒的线粒体功能以进一步检验在分离的线粒体和心脏组织中不同氧压下co的结合和抑制浓度的能力。实施例8:还原血红蛋白和还原肌红蛋白逆转co毒性在组织呼吸中的影响的能力进一步的研究表明,脱氧hb逆转了co中毒对线粒体的影响。co气体使最大呼吸下降60.5%(p=2.3x10-7)。在0.5等摩尔溶液中加入脱氧hb使中毒呼吸速率增加了95%(p=0.0003,不成对,t检验)(图11)。另一研究表明,脱氧肌红蛋白增加了暴露于co后的lv匀浆的呼吸。如图12所示,co气体使最大呼吸下降了75.6%(p=0.0004)。加入0.5等摩尔的脱氧肌红蛋白使呼吸速率增加了199%(p=0.0096,不成对,t检验)。co暴露后在不治疗的情况下不存在呼吸恢复。实施例9:人造氧载体逆转血液动力学崩溃并提高严重co中毒小鼠模型的存活率在啮齿动物中建立co中毒模型,如实施例4所述。利用这些模型,表明人造氧载体即聚乙二醇化的血红蛋白(peg-hb,聚乙二醇与人血红蛋白的表面缀合)作为解毒剂,所述解毒剂可以:1)从血红蛋白中体内清除co,和2)逆转由co中毒诱发的血液动力学崩溃。peg-hb作为血红蛋白氧载体已在人类中进行了测试(bjorkholm等,haematologica90(4):505-515,2005;olofsson等,anesthesiology105(6):1153-1163,2006;olofsson等,transfusmed18(l):28-39,2008),但还未在co中毒模型中研究过。将气管插管的、通气的麻醉的小鼠暴露于含21%氧和1.5%异氟烷的30,000ppm(3%)co气体中4.5分钟。将小鼠手术放置颈静脉(用于注入药物)和颈动脉(用于血压和心率监测)导管。在该模型中,接受了peg-hb(n=3)的所有小鼠都存活。注入浓度为10mm,体积大约为200-250毫升。通过颈静脉导管,利用光谱测定法对hbco水平进行取样。紧接着co暴露4.5分钟之后,hbco水平平均为84-88%。如图13所示,注入pbs、白蛋白或peg-hb5分钟后,hbco水平分别降至82%、80%和66%。处理10分钟后,hbco水平分别降至76%、75%和62%。对co的小鼠半衰期比对人的半衰期快得多。这些结果表明,注入peg-hb显著地降低了hbco的水平,比注入流体和停止暴露要快。如图14所示,通气的小鼠暴露于3%co气体4.5分钟后,注入200-250μl的10mm还原态peg-hb恢复了平均动脉血压(map)。由于恢复了map,所有施用了peg-hb的小鼠都得以存活。考虑到应用所公开发明的原理的众多可能的实施方案,应认识到所示出的实施方案仅仅是本发明的优选实施例,而不应看做是限制本发明的范围。相反地,由以下权利要求限定本发明的范围。因此要求落入这些权利要求的范围和精神内的全部为我们的发明。当前第1页12
相关技术
网友询问留言
已有0条留言
- 还没有人留言评论。精彩留言会获得点赞!
1