普瑞巴林的延长释放剂型的制作方法
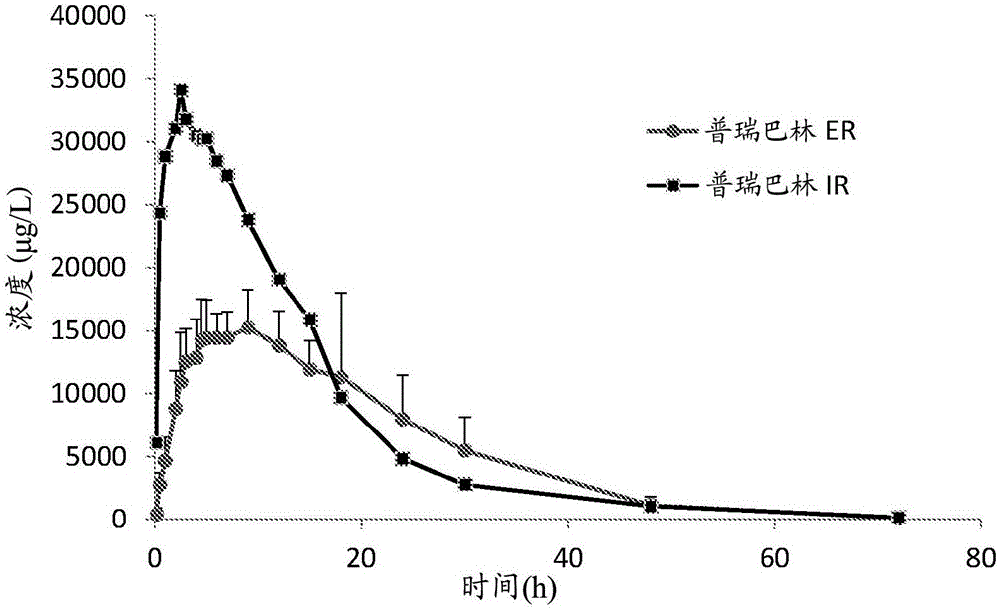
本发明涉及具有双重延长释放概况的普瑞巴林的每日一次的延长释放剂型,以及其在治疗响应于普瑞巴林治疗的状况和紊乱中的用途,所述状况和紊乱例如与糖尿病性周围神经病变(dpn)相关的神经性疼痛、带状疱疹后神经痛(phn)、癫痫、癫痫发作(seizure)和纤维肌痛。发明背景普瑞巴林是用于治疗神经性疼痛的抗惊厥药物并且用作用于部分性癫痫发作的辅助疗法而在成人中有或没有继发性泛化。还已经发现它对广泛性焦虑性紊乱有效,并且在欧盟被批准用于此用途。它典型地被认为是加巴喷丁的继任者。普瑞巴林由pfizer以商品名以包含作为非活性成分的乳糖和淀粉的立即释放硬壳胶囊销售。普瑞巴林还用于治疗癫痫、带状疱疹后神经痛和糖尿病性周围神经病变。最近的研究已经示出了普瑞巴林在治疗例如纤维肌痛和脊髓损伤的紊乱中的慢性疼痛方面是有效的。普瑞巴林是由美国食品和药物管理局批准的第一种专门用于治疗纤维肌痛的药物。普瑞巴林以25mg、50mg、75mg、100mg、150mg、200mg、225mg和300mg胶囊,以及以包含20mg/ml普瑞巴林和掩蔽化学品的苦味的甜味剂的口服溶液可用。在某些适应症中用于普瑞巴林的最大每日推荐剂量是600mg。目前,关于普瑞巴林批准的主要适应症和剂量是:1)管理与糖尿病性周围神经病变(dpn)相关的神经性疼痛,100mg每日3次(300mg);2)带状疱疹后神经痛(phn),75mg-150mg每日2次或50mg-100mg每日3次(最大300mg,在特定的情况下其可以增加到600mg);3)作为用于患有部分发作性癫痫发作的成人的辅助疗法(150mg/天-600mg/天,以2个-3个剂量给予);和4)管理纤维肌痛(300mg/天-450mg/天—以2个-3个剂量给予)。目前每日2个-3个剂量的给药方案由于显著的依从性问题并且由于在立即释放剂量后药物血浆水平的急剧上升所导致的临床副作用是有问题的。此外,大幅波动的药物的血浆浓度可以导致在保守的给药方案中施用小于治疗量的药物,或者在激进的给药方案中施用对于特定的患者太大的量。因此,期望的是开发每日一次剂型,其将替代目前市售的立即释放制剂。然而,开发普瑞巴林的每日一次剂型由于其独特的吸收特性而有挑战性:普瑞巴林在小肠和在结肠的近侧区域(盲肠、升结肠)中良好地吸收。然而,它在远侧结肠(肝曲至直肠)中的吸收很差。此基本特性被认为是开发这种药物的每日一次方案的主要障碍。开发普瑞巴林的每日一次制剂的若干尝试在文献中被提及,大多数基于胃滞留剂型的开发,该胃滞留剂型尝试延长药物在胃肠(gi)的上部部分中的滞留时间,在所述胃肠(gi)的上部部分中药物优选地被吸收。pct国际专利申请wo2005/041924(对应于us2005/0163848)涉及包含普瑞巴林和运输部分例如烷基硫酸酯的复合物(complex)。该复合物在胃肠道,特别地下胃肠道中具有增强的吸收。该复合物,以及使用该复合物制备的组合物和剂型,提供了药物在通常到24小时的时间段内被身体吸收,因此据称能够实现用于普瑞巴林的每日一次剂型。pct国际专利申请wo2006/078811涉及普瑞巴林制剂,其包含多达三种组分,包括立即释放组分、持续释放组分和延迟释放组分。该制剂包含(a)被不依赖ph的可溶性聚合物赋形剂包衣的活性成分例如普瑞巴林;(b)被不依赖ph的不溶性聚合物赋形剂包衣的活性成分例如普瑞巴林;和(c)被ph依赖性的可溶性聚合物赋形剂包衣的活性成分例如普瑞巴林。该制剂适于在三个阶段内释放活性成分。在第一阶段,活性成分在胃中快速地释放;在第二阶段,活性成分主要在胃下部、小肠的十二指肠部分和空肠部分中经过持续释放时间段释放;以及在第三阶段,活性成分的释放被延迟直到小肠的空肠部分和回肠部分,其中普瑞巴林被快速地释放。pct国际专利申请wo2007/052125涉及包含普瑞巴林、基质形成剂和溶胀剂的药物组合物,基质形成剂包含聚乙酸乙烯酯和聚乙烯吡咯烷酮,并且溶胀剂包含交联聚乙烯吡咯烷酮,其中药物组合物适于每日一次口服给药。pct国际专利申请wo2009/066325涉及控制释放药物组合物,该控制释放药物组合物包含普瑞巴林或其盐、疏水性释放控制剂和任选地其他药学上可接受的赋形剂。pct国际专利申请wo2011/049309(对应于us2011/217374)公开了药物组合物,其包含在表面上用水不溶性聚合物包衣的持续释放部分和立即释放部分,所述持续释放部分包含第一活性药物成分、至少一种选自由水不溶性聚合物和水溶性粘性聚合物组成的组的释放控制基底(base)、以及药学上可接受的载体;所述立即释放部分包含第二活性药物成分和药学上可接受的载体。pct国际专利申请wo2011/053003教导了胃滞留持续释放制剂,该胃滞留持续释放制剂包含普瑞巴林或其药学上可接受的盐、聚环氧乙烷和聚乙烯醇-聚乙二醇接枝共聚物,其中基质的溶胀性质和漂浮性通过使用聚环氧乙烷和聚乙烯醇-聚乙二醇接枝共聚物来改进,从而控制药物的释放。美国专利7,731,989涉及剂型,该剂型包含分散在聚合物基质中的在约100mg至约4800mg之间的加巴喷丁,所述聚合物基质包含至少一种可溶胀的亲水性聚合物,该可溶胀的亲水性聚合物在水中在尺寸上不受限制地溶胀至一定尺寸以促进剂型在进食模式下在胃中的胃滞留,其中在与水接触后,加巴喷丁经过至少5小时的时间段通过从剂型中扩散来释放,并且至少40wt%的加巴喷丁在施用之后1小时被保留在剂型中。美国专利申请us2002/0119197涉及药物剂型,其包含含有控制释放组合物中的药物剂的中心芯,所述芯具有两个暴露的相对端部表面和在所述芯的外边缘处在所述两个相对端部表面之间延伸的周边表面,所述周边边缘被扩散限制的套筒包围,其中所述套筒限制流体扩散到所述芯中。中国专利申请cn1857244涉及缓慢释放普瑞巴林组合物,其包含50mg-1000mg的有效治疗剂量的普瑞巴林或其药物盐和至少一种释放速度控制材料。该组合物在至少10小时至24小时内释放普瑞巴林。印度专利申请in2009de01649公开了延长释放漂浮片剂,其包含普瑞巴林、气体产生组分、至少一种速率控制聚合物和其他药物赋形剂,其中片剂提供治疗有效血浆水平的普瑞巴林持续多达约24h的时间段。目前正在进行若干临床试验以测试普瑞巴林的延长释放制剂:1)阶段i和pk比较普瑞巴林er每日一次制剂(剂量82.5mg、165mg、330mg)与每日两次(b.i.d)或每日三次(t.i.d)给予的立即释放制剂;2)阶段ii研究评估用于治疗纤维肌痛的包含165mg-498mg普瑞巴林的每日一次制剂;和3)阶段iii研究评估用于治疗部分性癫痫发作和癫痫的包含82mg、165mg和330mg普瑞巴林的每日一次制剂。目前,没有批准普瑞巴林的控制释放制剂。由于普瑞巴林的独特的吸收特性,这是未满足的医学需求。发明概述本发明涉及包含普瑞巴林或其盐的延长释放药物组合物,其根据双重延长释放概况释放普瑞巴林活性成分。本发明的组合物适于普瑞巴林的独特的释放特性,并且包含两种组分,第一种以短的控制方式提供持续从约4小时至约6小时的活性成分的延长释放,并且第二种提供经过24小时的时间段的活性成分的延长释放。在口服施用至受试者后,制剂中的每种组分的比例可以被调节以实现期望的auc和治疗效果。在一些实施方案中,第一组分(在本文中被命名为“快速er”)是次要部分(即,它构成组合物的小于50%),而第二组分(被命名为“缓慢er”或“维持”)是主要部分(即,它构成制剂的大于50%)。在其他实施方案中,第一组分是主要部分(即,它构成组合物的大于50%),而第二组分是次要部分(即,它构成制剂的小于50%)。本发明还涉及使用药物组合物用于治疗响应于普瑞巴林治疗的状况和紊乱的方法,所述状况和紊乱例如与糖尿病性周围神经病变(dpn)相关的神经性疼痛、带状疱疹后神经痛(phn)、癫痫、癫痫发作和纤维肌痛。由于在口服施用后普瑞巴林的吸收特性,期望的是将该化合物配制成能够实现控制释放的组合物。本发明的制剂提供了活性成分的改进的药代动力学,同时由于较低的波动指数而使副作用最小化。本发明基于普瑞巴林在胃肠的上部部分中的改进的吸收,以及其在结肠的下部部分中的有限吸收。本发明的制剂的释放模式是双相的,并且适于普瑞巴林的独特的释放特性,由此,在一些实施方案中,一部分剂量以“快速er”方式释放并且其余的剂量以“缓慢er”方式释放。根据本发明的原理,制剂以两种单独的但平行的释放概况释放普瑞巴林活性成分:一部分每日剂量以持续约4小时-6小时(快速er)的短的控制方式释放,而其余的每日剂量以控制的24小时释放模式(缓慢er或维持组分)提供。剂型是优选地每日一次给予(优选地在餐后和在睡觉时间给予)的控制释放制剂或延长释放制剂。根据一个方面,本发明提供了口服的延长释放(er)药物组合物,所述口服的延长释放(er)药物组合物包含作为活性成分的普瑞巴林或其盐和药学上可接受的载体或赋形剂,其中组合物包含经过约4小时至约6小时的时间段提供普瑞巴林活性成分的释放的第一组分和经过约24小时的时间段内提供普瑞巴林活性成分的释放的第二组分。优选地,组合物适于每日一次施用。在一些实施方案中,每个剂量中第一组分(经过4小时-6小时的快速或短的延长释放)和第二组分(经过24小时的缓慢或较长的延长释放)之间的比例在约50%:50%(wt/wt)至约10%:90%(wt/wt)之间,优选地从约25%:75%(wt/wt)至约10%:90%(wt/wt),例如约15%:85%(wt/wt)、约30%:70%(wt/wt)或约40%:60%(wt/wt)。每种可能性代表本发明的单独的实施方案。在其他实施方案中,每个剂量中第一组分(经过4小时-6小时的短的延长释放)和第二组分(经过24小时的较长的延长释放)之间的比例在约50%:50%(wt/wt)至约90%:10%(wt/wt)之间,优选地从约75%:25%(wt/wt)至约90%:10%(wt/wt),例如约85%:15%(wt/wt)、约70%:30%(wt/wt)或约60%:40%(wt/wt)。每种可能性代表本发明的单独的实施方案。本发明的组合物通常包含从约50mg至约600mg的总量的普瑞巴林或其盐,其中总剂量在第一组分和第二组分之间分开。在一些实施方案中,第一组分和第二组分中的每种各自独立地包含至少一种选自由以下组成的组的药学上可接受的赋形剂:释放控制聚合物、粘合剂、助流剂、增塑剂、基质形成剂、崩解剂、润滑剂、及其任何组合。在一些实施方案中,制剂的第一组分和/或第二组分各自独立地包含至少一种选自由以下组成的组的释放控制聚合物:羟丙基纤维素(hpc)、羟丙基甲基纤维素(hpmc)、乙基纤维素(ec)、乙酸纤维素、丙烯酸类聚合物、聚乙烯吡咯烷酮(pvp)、或其组合。目前优选的释放控制聚合物是羟丙基纤维素(hpc)、羟丙基甲基纤维素(hpmc)、乙基纤维素(ec)、及其组合。每种可能性代表本发明的单独的实施方案。在其他实施方案中,粘合剂选自由羟丙基纤维素(hpc)和聚乙烯吡咯烷酮(pvp)组成的组。在其他实施方案中,润滑剂选自由硬脂酸镁、山嵛酸甘油酯和硬脂基富马酸钠组成的组。在其他实施方案中,助流剂是二氧化硅。第一组分可以与组合物中的第二组分相同或不同。例如,每种组分可以包含以任何比例的相同或不同的聚合物。在一些实施方案中,两种组分的组成相同,但使用其不同的量以便实现期望的释放概况。为了例证的目的,当使用包衣的延长释放珠或微型片剂时,相同的包衣可以用于快速er群体和缓慢er群体两者,其中每个部分中的每种包衣的量不同。可选择地,快速er组分可以呈未包衣的珠或微型片剂的形式,并且缓慢er组分可以呈包衣的珠或微型片剂的形式。每种可能性代表本发明的单独的实施方案。在多种实施方案中,制剂的每种组分中的活性成分以控制释放顺序释放,所述控制释放顺序选自零、第一释放顺序、第二释放顺序和第三释放顺序及其任何虚拟顺序。每种组分的释放顺序可以与其他组分相同或不同。每种可能性代表本发明的单独的实施方案。在一些实施方案中,普瑞巴林活性成分从药物组合物中释放,以提供与基本上类似剂量的普瑞巴林(例如)的立即释放制剂相比更低的cmax、更小的波动指数和/或降低的副作用概况。在一些实施方案中,本发明的组合物呈选自er珠、微型片剂、双层片剂、硬明胶胶囊或软明胶胶囊、小球或其组合的形式。在一些实施方案中,本发明的组合物呈er珠或微型片剂的形式,所述er珠或微型片剂被填充到硬明胶胶囊或软明胶胶囊中或被压制到可分散的片剂中。还预期了上文的任何的混合物。每种可能性代表本发明的单独的实施方案。在本发明的组合物的一个特定的实施方案中,第一组分和第二组分各自呈er珠或微型片剂的形式,所述er珠或微型片剂被填充到硬明胶胶囊或软明胶胶囊中或被压制到可分散的片剂中。每种组分可以包含以任何比例的相同或不同的聚合物。在一些实施方案中,两种组分的组成相同,但使用其不同的量以便实现期望的释放概况。为了例证的目的,当使用包衣的微型片剂时,相同的包衣可以用于快速er群体和缓慢er群体两者,其中每个部分中的每种包衣的量不同。可选择地,快速er组分可以呈未包衣的微型片剂或er珠的形式,并且缓慢er组分可以呈包衣的微型片剂或er珠的形式。每种可能性代表本发明的单独的实施方案。在一些实施方案中,第一组分和第二组分各自呈er珠或微型片剂的形式,所述er珠或微型片剂包含普瑞巴林、第一释放控制聚合物和至少一种润滑剂和/或基质形成剂,其中第一组分是未包衣的并且其中第二组分还包含含有第二释放控制聚合物的包衣,第二释放控制聚合物可以与第一释放控制聚合物相同或不同。在具体的实施方案中,第一组分和第二组分各自呈er珠或微型片剂的形式,所述er珠或微型片剂包含普瑞巴林、乙基纤维素、山嵛酸甘油酯和硬脂酸镁,其中第一组分是未包衣的并且其中第二组分还包含含有乙基纤维素的包衣。在其他实施方案中,第一组分和第二组分各自呈er珠或微型片剂的形式,包含普瑞巴林、第一释放控制聚合物、至少一种润滑剂和/或基质形成剂、以及含有第二释放控制聚合物的包衣,所述第二释放控制聚合物可以与第一释放控制聚合物相同或不同,其中相同的包衣以不同的量用于第一组分和第二组分。在一些实施方案中,本发明的延长释放剂型通过两种任选的技术制备:挤出机和滚圆,随后例如在wurster柱中包衣;或在惰性糖球(np)上,例如在装配有wurster的流化床中多层包衣。在一些实施方案中,本发明的er珠通过在糖球上分层或通过挤出和滚圆来制备。在其他实施方案中,本发明的微型片剂或双层片剂通过造粒或直接压制来制备。每种可能性代表本发明的单独的实施方案。本发明的药物组合物在治疗响应于普瑞巴林治疗的状况或紊乱中是有用的。因此,在另外的实施方案中,本发明涉及通过施用有效量的如本文描述的本发明的延长释放制剂来治疗响应于普瑞巴林治疗的状况或紊乱的方法。在其他实施方案中,本发明涉及如本文描述的本发明的延长释放制剂用于治疗响应于普瑞巴林治疗的状况或紊乱的用途。在其他实施方案中,本发明涉及如本文描述的本发明的延长释放制剂用于治疗响应于普瑞巴林治疗的状况或紊乱的用途。在一些实施方案中,响应于普瑞巴林治疗的状况或紊乱选自癫痫、疼痛、糖尿病性周围神经病变、带状疱疹后神经痛、与精神运动兴奋剂相关的生理状况、炎症、胃肠损伤、酒精中毒、失眠、纤维肌痛、焦虑、抑郁症、躁狂症和双相紊乱(bipolardisorder)、及其任何组合。每种可能性代表本发明的单独的实施方案。从下文给出的详细描述,本发明的应用性的另外的实施方案和完整范围将变得明显。然而,应理解的是,详细描述和具体实例虽然指示本发明的优选实施方案,但仅通过例证的方式给出,因为在本发明的精神和范围内的多种变化和修改将从该详细描述对于本领域技术人员变得明显。附图简述图1描绘了根据本发明的普瑞巴林延长释放(er)制剂(●)和普瑞巴林立即释放(ir)(■)制剂的血浆浓度相对于时间的概况。图2描绘了根据本发明的普瑞巴林延长释放(er)制剂的体外(◆)和体内(▲)释放概况。发明详述本发明涉及新颖的普瑞巴林的每日一次延长释放剂型,以及其在治疗响应于普瑞巴林治疗的状况和紊乱中的用途,所述状况和紊乱例如与糖尿病性周围神经病变(dpn)相关的神经性疼痛、带状疱疹后神经痛(phn)、癫痫、癫痫发作和纤维肌痛。如本文使用的普瑞巴林是3-氨基甲基-5-甲基己酸的药理学活性s-对映异构体,其是γ-氨基丁酸(gaba)的衍生物。普瑞巴林的结构在下文表示。预期普瑞巴林的任何药学上可接受的形式,包括但不限于盐(例如hcl盐或碱金属盐)、溶剂化物(例如水合物)、同形体、多晶型物、假多晶型物和前药,在本发明的范围内。本发明提供了延长释放制剂,其能够实现根据两个单独的释放概况的活性成分普瑞巴林的控制释放:组合物的第一组分经过4小时-6小时的时间段释放,而制剂的第二组分提供了经过多达24小时的时间段释放的普瑞巴林活性成分的“维持剂量”。总之,两种组分提供了对药物的长期的持续治疗暴露。组合物中的第一组分和第二组分的比例可以根据组合物的预期用途和期望的释放概况而变化。在一些实施方案中,第一(快速er)组分在胃中释放直到升结肠,而第二(缓慢er)组分在整个胃肠道中释放。制剂本文提供了口服药物组合物,其根据双相概况提供活性成分普瑞巴林或其盐的控制释放,该每种组分根据特定的释放概况释放普瑞巴林活性成分。口服的延长释放(er)药物组合物包含作为活性成分的普瑞巴林或其盐,其中组合物包含经过约4小时至约6小时的时间段提供普瑞巴林活性成分的释放的第一组分和经过约24小时的时间段提供普瑞巴林活性成分的释放的第二组分。优选地,组合物适于每日一次施用。在多种实施方案中,制剂的每种组分中的活性成分以控制释放顺序释放,所述控制释放顺序选自零、第一释放顺序、第二释放顺序和第三释放顺序及其任何虚拟顺序。每种组分的释放顺序可以与其他组分相同或不同。每种可能性代表本发明的单独的实施方案。预期在施用后,本发明的药物组合物在受试者的循环中提供与包含基本上相同剂量的常规立即释放剂型相比更低的cmax值和/或更小的活性成分的波动指数,因此导致降低的副作用。在一些实施方案中,本发明的组合物呈选自er珠、微型片剂、双层片剂、硬明胶胶囊或软明胶胶囊、小球或其组合的形式。er珠和微型片剂是目前优选的实施方案。在一些实施方案中,本发明的组合物呈er珠或微型片剂的形式,所述er珠或微型片剂被填充到硬明胶胶囊或软明胶胶囊中或被压制到可分散的片剂中。还预期了上文的任何的混合物。每种可能性代表本发明的单独的实施方案。如本文使用的,术语“控制释放”(cr)指的是口服剂型组合物和释放模式的类型,其中活性成分普瑞巴林或其盐经过一定的时间段或以预定的间隔被逐渐地释放。根据本发明的原理,术语cr还涵盖普瑞巴林或其盐的持续释放(sr)制剂或延长释放(er)制剂。根据一个实施方案,本发明的er药物组合物包含含有至少一种聚合物的第一组分(快速er组分),该第一组分允许活性成分经过约4小时-6小时的短的控制释放时间段释放。优选地,这样的聚合物选自由以下组成的组:羟丙基纤维素(hpc)、羟丙基甲基纤维素(hpmc)、乙基纤维素(ec)、乙酸纤维素、丙烯酸类聚合物(包括丙烯酸聚合物、丙烯酸酯聚合物等)、聚乙烯吡咯烷酮(pvp)、或其组合。在一个目前优选的实施方案中,第一(快速er)组分中的聚合物是羟丙基纤维素(hpc)。在另一个目前优选的实施方案中,第一(快速er)组分中的聚合物是羟丙基甲基纤维素(hpmc),例如羟丙甲纤维素。在另一个目前优选的实施方案中,第一(快速er)组分中的聚合物是乙基纤维素(ec),例如ec分散体或ethoceltm。合适的聚合物的其他实例包括但不限于水解的聚乙烯醇、聚环氧乙烷、乙烯基聚合物、右旋糖酐、瓜尔胶、果胶、淀粉、纤维素聚合物及其任何组合。每种可能性代表本发明的单独的实施方案。丙烯酸类聚合物包括但不限于被称为“卡波姆”的聚合物(例如,来自b.f.goodrich的)和934。聚环氧乙烷包括但不限于sentry水溶性树脂dow。聚丙烯酸酯包括(从rohm可获得)。纤维素聚合物包括但不限于羟丙基甲基纤维素(例如,来自dowchemical公司的);羟丙基纤维素(例如来自hercules的);羟丙基纤维素醚;乙基纤维素;甲基纤维素、羧甲基纤维素钠及类似物。每种可能性代表本发明的单独的实施方案。本发明的药物组合物还包含含有至少一种聚合物的第二组分(缓慢er组分),该第二组分允许活性成分经过约24小时的较长的控制释放时间段释放。缓慢er组分的聚合物选自上文关于快速er组分的聚合物提供的清单。第二组分中的聚合物可以与第一组分中的聚合物相同或不同,其中每种可能性代表本发明的单独的实施方案。在一个目前优选的实施方案中,第二(快速er)组分中的聚合物是羟丙基纤维素(hpc)。在另一个目前优选的实施方案中,第二(快速er)组分中的聚合物是羟丙基甲基纤维素(hpmc)。在另一个目前优选的实施方案中,第二(快速er)组分中的聚合物是乙基纤维素(ec)。为了实现较长的释放时间段,第二组分的释放控制聚合物可以以与第一组分相比不同的量使用,或者聚合物可以被并入到被施加到快速er组分上的缓慢释放包衣层中。可选择地,缓慢er释放组分和快速er释放组分两者可以包含含有释放控制聚合物的包衣,其中包衣以不同的比率被施加以实现期望的释放概况。第一组分可以与组合物中的第二组分相同或不同。例如,每种组分可以包含以任何比例的相同或不同的聚合物。在一些实施方案中,两种组分包含相同的聚合物/其他赋形剂,但使用其不同的量以便实现期望的释放概况。为了例证的目的,当使用包衣的延长释放珠或微型片剂时,相同的聚合物包衣可以用于快速er群体和缓慢er群体两者,其中用于每种组分的每种包衣的量不同。在另一个例证性实例中,当使用延长释放珠或微型片剂时,第一组分可以是未包衣的组合物,并且第二组分可以是与第一组分相同的组合物,还包含含有释放控制聚合物的包衣,包衣的量可以根据期望的释放概况而变化。本发明还涉及每日一次组合物,其中普瑞巴林的auc药物血浆水平基本上与对于常规立即释放普瑞巴林(例如以商标出售的普瑞巴林)的等效累积每日剂量可获得的auc药物血浆水平相同或等效。当从时间零至时间无穷大的数据点是在健康志愿者和/或目标患者群体中单次给药普瑞巴林(以)后血浆中的普瑞巴林的浓度(水平)时,本发明可以通过那些数据点的积分来确定auc。本发明的药物组合物还可以包含本领域技术人员已知的添加剂。例如,组合物还可以包含稳定剂、紧张性增强剂(tonicityenhancingagent)、缓冲物质、防腐剂、增稠剂(粘度增强)、基质形成剂(在本文中还被命名为基质形成剂)、填充剂、助流剂、崩解剂、增塑剂、稀释剂、粘合剂、乳化剂、润滑剂、润湿剂、调味剂、着色剂、络合剂和其他赋形剂例如玉米淀粉、小麦淀粉、大米淀粉、马铃薯淀粉及类似物、明胶、黄蓍胶、巴西棕榈蜡、三硬脂酸甘油酯,基于纤维素的赋形剂如微晶纤维素、羧甲基纤维素、羟甲基纤维素、羟乙基纤维素、甲基羟丙基纤维素、羟丙基纤维素及类似物。每种可能性代表本发明的单独的实施方案。其他赋形剂包括肠溶聚合物和表面活性剂。多种材料可以被用作肠溶聚合物,这样的材料包括大量聚合物酸以及聚合物酸与诸如虫胶、鲸蜡醇和乙酸纤维素的材料的混合物。合适的表面活性剂是例如月桂基硫酸钠。合适的填充剂包括但不限于糖,例如乳糖、蔗糖、甘露醇或山梨醇,乙基纤维素、微晶纤维素、硅化的微晶纤维素及类似物。每种可能性代表本发明的单独的实施方案。合适的助流剂是例如胶体二氧化硅或滑石。合适的紧张性增强剂选自离子剂和非离子剂。例如,离子化合物包括但不限于碱金属卤化物或碱土金属卤化物,诸如例如cacl2、kbr、kcl、licl、nai、nabr或nacl、或硼酸。非离子紧张性增强剂是例如脲、甘油、山梨醇、甘露醇、丙二醇或右旋糖。每种可能性代表本发明的单独的实施方案。防腐剂的实例是季铵盐,例如苯扎氯铵、苯佐氯铵或聚合物季铵盐;硫代水杨酸的烷基汞盐,诸如例如硫柳汞、硝酸苯汞、乙酸苯汞或硼酸苯汞;对羟基苯甲酸酯(parabens),诸如例如对羟基苯甲酸甲酯或对羟基苯甲酸丙酯;醇,诸如例如氯丁醇、苯甲醇或苯基乙醇;胍衍生物,诸如例如氯己啶或聚六亚甲基双胍,或山梨酸。每种可能性代表本发明的单独的实施方案。崩解剂包括但不限于交联聚乙烯吡咯烷酮、交联羧酸甲基纤维素、硅酸钙、羧甲基淀粉钠、甲基纤维素;琼脂;膨润土;碳酸钙;聚氧乙烯脱水山梨醇脂肪酸酯、硬脂酸单甘油酯、玉米淀粉、马铃薯淀粉、二氧化硅、交联羧甲基纤维素钠、交聚维酮、瓜尔胶、羟乙酸淀粉钠和乳糖。每种可能性代表本发明的单独的实施方案。增塑剂包括癸二酸二丁酯、聚乙二醇(例如聚乙二醇400、6000或8000)、聚丙二醇、甘油、山梨醇、麦芽糖醇、葡萄糖、蔗糖、羊毛脂、棕榈酸、油酸、硬脂酸、脂肪酸的金属盐、甘油卵磷脂、单硬脂酸甘油酯、丙二醇单硬脂酸酯、乙酰化甘油酯、柠檬酸的烷基酯(例如柠檬酸三乙酯、柠檬酸三丁酯、乙酰基柠檬酸三丁酯或乙酰基柠檬酸三乙酯)、邻苯二甲酸酯(例如邻苯二甲酸二乙酯)、蜡、氢化植物油、及其混合物。合适的稀释剂包括但不限于脱水磷酸二钙、糖、乳糖、磷酸钙、纤维素、高岭土、甘露醇、氯化钠和干淀粉。每种可能性代表本发明的单独的实施方案。合适的粘合剂包括但不限于水、乙醇、聚乙烯吡咯烷酮(pvp)、羟丙基甲基纤维素(hpmc例如羟丙甲纤维素)、淀粉、明胶或糖。糖包括蔗糖、右旋糖、糖蜜和乳糖。每种可能性代表本发明的单独的实施方案。增稠剂(粘度增强剂)例如聚乙烯醇(pva)还可以用作缓慢释放体系的一部分。合适的润滑剂包括但不限于硬脂酸、聚乙二醇、甘油衍生物例如山嵛酸甘油酯(其还可以作为粘合剂或基质形成剂起作用)或硬脂酸盐,例如硬脂酸镁或硬脂基富马酸钠。每种可能性代表本发明的单独的实施方案。合适的润湿剂包括但不限于甘油、淀粉及类似物。合适的缓冲剂或缓冲物质包括但不限于酸性缓冲剂,例如短链脂肪酸、柠檬酸、乙酸、盐酸、硫酸和富马酸;和碱性缓冲剂例如tris、碳酸钠、碳酸氢钠、氢氧化钠、氢氧化钾和氢氧化镁。每种可能性代表本发明的单独的实施方案。本发明的组合物还可以包含掩味层(taste-maskinglayer)。合适的掩味层包括但不限于包含以下的层:乙基纤维素、聚乙酸乙烯酯(pva)、乙酸纤维素(ca)、乙酸丁酸纤维素(cab)、甲基丙烯酸酯共聚物,例如以商品名“eudragit”可获得的那些共聚物(例如类型l、s、rl、rs和ne30d)、及其组合。每种可能性代表本发明的单独的实施方案。添加的赋形剂的量和类型根据特定的要求,并且通常在组合物的按重量计从约0.0001%至约90%的范围内。在一些实施方案中,制剂还包含将活性药物相与功能性外包衣分离的子包衣层。用于子包衣的赋形剂的实例是聚乙烯醇(pva)。在本发明的范围内的是呈er珠、微型片剂、双层片剂、硬明胶胶囊或软明胶胶囊、小球或其组合的形式的药物组合物。在一些实施方案中,本发明的组合物呈er珠或微型片剂的形式,所述er珠或微型片剂被填充到硬明胶胶囊或软明胶胶囊中或被压制到可分散的片剂中。还预期上文的任何的混合物。每种可能性代表本发明的单独的实施方案。根据本发明的原理,片剂形式包括但不限于双层片剂,该双层片剂包括两个或更多个不同的被压制在一起的颗粒层,其中单独的层一个位于另一个的顶部上,其中每个单独的层包含被配制成以单独的方式释放的活性成分。在一个实施方案中,本发明涉及片剂,在所述片剂中活性剂存在于两个单独的层中,即双层片剂中,其中包含剂的层可以由中间的非活性层分开。在一些实施方案中,本发明的延长释放剂型通过两种任选的技术制备:挤出机和滚圆,随后例如在wurster柱中包衣;或在惰性糖球(np)上,例如在装配有wurster的流化床中多层包衣。因此,在一些实施方案中,本发明的er珠通过在糖球上分层或通过挤出和滚圆来制备。在其他实施方案中,本发明的微型片剂或双层片剂通过造粒或直接压制来制备。每种可能性代表本发明的单独的实施方案。本发明的药物组合物还可以包含微封装的活性成分。根据这些实施方案,活性成分普瑞巴林的小颗粒被包衣或膜包围,以形成在几微米至几毫米范围内的颗粒。本发明的组合物还可以被混合并填充到胶囊或小袋中,或通过常规方法被压制成可分散的片剂。本发明的药物组合物还可以使用如本领域已知的常规工艺来制造。例如,固体组合物例如片剂可以通过湿法造粒、干法造粒、直接压制及类似方式制备。合适的制备包括将主要活性成分与药物赋形剂混合以形成包含均匀混合物的固体预制剂组合物。当提及这些预制剂组合物为均匀的时,其意指将活性成分被均匀地分散在整个组合物中,使得组合物可以被容易地再分成同等有效的单位剂型例如片剂、丸剂和胶囊。施用和治疗用途本发明还提供了将本发明的组合物施用至哺乳动物,优选地人类的方法。预期本文描述的组合物通过口服途径施用,以提供普瑞巴林的透粘膜或胃肠吸收。期望的剂量可以方便地以单个剂量或以适当的间隔施用的分开的剂量呈现,但优选地,本发明的组合物被配制用于每日一次给药。待施用的组合物的量取决于各种因素,包括所治疗的受试者(年龄和性别)、疾病的严重程度,并且可以通过处方医师的判断来确定。在某些实施方案中,组合物呈单位剂型。本发明的药物组合物可以包含任何剂量的普瑞巴林,优选地总共从约50mg至约600mg的普瑞巴林或其盐,其中总量如期望的在组合物的第一组分和第二组分之间分开。本发明的又另一个方面涉及组合物,其中普瑞巴林在总共约600mg、550mg、500mg、450mg、400mg、350mg、300mg、250mg、200mg、200mg、150mg、100mg或50mg的普瑞巴林活性成分的制剂的剂量内。普瑞巴林的剂量根据任何比例在制剂的第一组分和第二组分之间分开。在一些实施方案中,第一组分包含大部分普瑞巴林活性成分,即组合物中大于50%的普瑞巴林。在一些实施方案中,每个剂量中第一组分(经过4小时-6小时的快速延长释放)和第二组分(经过24小时的缓慢延长释放)之间的比例在约50%:50%(wt/wt)至约90%:10%(wt/wt)之间,优选地从约75%:25%(wt/wt)至约90%:10%(wt/wt),例如约85%:15%(wt/wt)、约70%:30%(wt/wt)或约60%:40%(wt/wt)。每种可能性代表本发明的单独的实施方案。优选地,第一组分包含50%或更多的普瑞巴林活性成分,例如55%、60%、65%、70%、75%、80%、85%、90%或95%的总普瑞巴林剂量。优选地,第二组分包含50%或更少的普瑞巴林活性成分,例如45%、40%、35%、30%、25%、20%、15%、10%或5%的总普瑞巴林剂量。这样的比例的任何组合被本发明的范围涵盖。每种可能性代表本发明的单独的实施方案。在其他实施方案中,每个剂量中第一组分(经过4小时-6小时的快速延长释放)和第二组分(经过24小时的缓慢延长释放)之间的比例在约50%:50%(wt/wt)至约10%:90%(wt/wt)之间,优选地从约25%:75%(wt/wt)至约10%:90%(wt/wt),例如约15%:85%(wt/wt)、约30%:70%(wt/wt)或约40%:60%(wt/wt)。每种可能性代表本发明的单独的实施方案。优选地,第一组分包含50%或更少的普瑞巴林活性成分,例如45%、40%、35%、30%、25%、20%、15%、10%或5%的总普瑞巴林剂量。优选地,第二组分包含50%或更多的普瑞巴林活性成分,例如55%、60%、65%、70%、75%、80%、85%、90%或95%的总普瑞巴林剂量。这样的比例的任何组合被本发明的范围涵盖。每种可能性代表本发明的单独的实施方案。在一些实施方案中,组合物在第一组分中包含从约200mg至约550mg普瑞巴林并且在第二组分中包含从约50mg至约250mg普瑞巴林。在其他实施方案中,组合物在第一组分中包含从约200mg至约400mg普瑞巴林并且在第二组分中包含从约50mg至约150mg普瑞巴林。在其他实施方案中,组合物在第一组分中包含约250mg普瑞巴林并且在第二组分中包含约100mg普瑞巴林。每种可能性代表本发明的单独的实施方案。本发明的药物组合物在治疗响应于普瑞巴林治疗的状况或紊乱中是有用的。因此,在另外的实施方案中,本发明涉及通过施用本发明的延长释放制剂来治疗响应于普瑞巴林治疗的状况或紊乱的方法。在其他实施方案中,本发明涉及本发明的延长释放制剂用于治疗响应于普瑞巴林治疗的状况或紊乱的用途。在本发明的范围内的是药物组合物用于治疗响应于普瑞巴林治疗的病况或紊乱的用途。在一些实施方案中,状况或紊乱选自癫痫、疼痛、糖尿病性周围神经病变、带状疱疹后神经痛、与精神运动兴奋剂相关的生理状况、炎症、胃肠损伤、酒精中毒、失眠、纤维肌痛、焦虑、抑郁症、躁狂症和双相紊乱、及其任何组合。每种可能性代表本发明的单独的实施方案。本发明还涉及包含普瑞巴林或其他活性成分的组合物,用于治疗选自由癫痫组成的组的神经紊乱或损伤,治疗继发于中风、头部/脑部创伤或围术期或手术后神经外科手术、多发性硬化症或不自主动作震颤(involuntaryactiontremor)的癫痫。本发明还涉及包含普瑞巴林或其他活性成分的组合物,用于治疗与神经性疼痛、肌肉疼痛和骨骼疼痛相关的慢性疼痛,迟发性运动障碍或偏头痛、交感反射性营养不良综合征(rsd)[也被称为复杂性区域疼痛综合征(crps)]和纤维肌痛或肌肉紊乱。本发明还涉及用于在治疗精神病学紊乱例如但不限于双相疾病、惊恐、焦虑、抑郁症、酒精中毒和躁狂行为中使用的包含普瑞巴林的组合物。制剂或组合物还可以用于治疗在美国专利第6,310,098号(其通过引用并入本文)中描述的状况,以及特别地在热潮红、发热、恶心和呕吐的更年期其他相关综合征中的激素变化。本发明还涉及治疗更年期后女性的症状,所述症状选自由急迫性尿失禁、阴道干涩和干眼综合征组成的组。如本文使用的术语“治疗有效量”或“有效量”指的是足以向化合物被施用至的受试者提供有益作用的该化合物的量。根据本发明的原理的有效量可以由本领域普通技术人员确定,并且可以在体外和体内两者的各种模型上测试。如本文使用的术语“治疗”指的是停止或减缓所治疗的特定疾病或紊乱的进展。术语“治疗”还包括减少与所治疗的疾病或紊乱相关的各种症状的发生。如本文使用的,术语“施用”指的是使受试者与本发明的组合物接触。在一个实施方案中,本发明涵盖将本发明的组合物施用至人类受试者。提出以下实施例以便更充分地例证本发明的某些实施方案。然而,这些实施例绝不应当被解释为限制本发明的宽范围。本领域技术人员可以容易地设想本文公开的原理的许多变型和修改,而不偏离本发明的范围。实施例实施例1:普瑞巴林双层片剂表1:组合物1第一(快速er)层通过混合普瑞巴林、klucel和hpmc,添加100ml水,然后高剪切造粒持续1分钟,在流化床中干燥并且在0.8mm筛中碾磨来制备。第二(缓慢er)层通过混合普瑞巴林、hpmc和乙基纤维素来制备。添加50ml乙醇,随后高剪切造粒持续1分钟,在流化床中干燥并且在0.8mm筛中碾磨。将这两层在picola旋转压片机中压制在一起,以提供期望的双层片剂。实施例2:普瑞巴林微型片剂表2:组合物2第一(快速er)层基于与用于双层片剂的基质类似的基质,但是在筛选与50mghpmck4m、50mgklucellf、1mgsyloid244和0.5mg硬脂酸镁混合的250mg普瑞巴林之后被压制到具有2mm直径的若干微型片剂中,所述微型片剂以不依赖ph的方式释放普瑞巴林持续6小时。第二种类型的微型片剂,缓慢层包含与50mghpmck100m、50mgethocel20cp、1mgsyloid244和0.5mg硬脂酸镁混合的100mg普瑞巴林,其被压制到具有2mm直径的若干微型片剂中,微型片剂以不依赖ph的方式释放普瑞巴林持续24小时。实施例3:普瑞巴林延长释放珠将500g普瑞巴林与15gpvpk30混合。将混合物溶解在2升乙醇/水50%:50%混合物中。将普瑞巴林混合物喷雾在装配有wurster柱的流化床中流化的45/50目糖球上。将hpmc5cp喷雾在普瑞巴林层上,提供2%w/w分离层。将hpmc包衣的珠分成两个子组:1.快速er珠:将乙基纤维素20cp与10%w/w癸二酸二丁酯和作为增塑剂的2%klucellf混合的混合物包衣至基于总珠重量的聚合物层的10%w/w总包衣的水平。2.缓慢er珠:将乙基纤维素20cp与10%w/w癸二酸二丁酯和作为增塑剂的2%klucellf混合的混合物包衣至基于总珠重量的聚合物层的25%w/w总包衣的水平。将两个珠的组以75%快速珠与25%缓慢珠的比率混合,总剂量在从100mg至500mg的范围内。实施例4:普瑞巴林延长释放珠将500g普瑞巴林与500gavicel101(微晶纤维素)和20ghpmc50cp混合。将混合物用0.8升水润湿。将hpmc5cp喷雾在普瑞巴林混合物上,提供2%w/w分离层。然后将普瑞巴林混合物穿过具有1mm筛的挤出机,随后滚圆并在装配有wurster柱的流化床中干燥。将干燥的普瑞巴林珠分成两个子群体:1.快速er珠:将乙基纤维素20cp与10%w/w癸二酸二丁酯和作为增塑剂的2%klucellf混合的混合物包衣在珠上至基于总珠重量的聚合物层的10%w/w总包衣的水平。2.缓慢er珠:将乙基纤维素220cp与10%w/w癸二酸二丁酯和作为增塑剂的2%klucellf混合的混合物包衣在珠上至基于总珠重量的聚合物层的25%w/w总包衣的水平。将两个珠的组以85%快速珠与15%缓慢珠的比率混合,总剂量在从50mg至600mg的范围内。实施例5:普瑞巴林微型片剂表3:快速er微型片剂制剂表4:缓慢xr微型片剂制剂实施例6:普瑞巴林微型片剂表5:快速er微型片剂制剂表6:缓慢xr微型片剂制剂普瑞巴林微型片剂根据以下工艺来制备:将普瑞巴林和ethocel在diosna混合器中混合,根据需要添加水。将湿法造粒混合物放置在流化床干燥器中,并在~50℃干燥。将干燥的混合物通过0.710mm筛来筛选。将山嵛酸甘油酯和硬脂酸镁顺序地添加到混合物中,随后在v-共混器中混合。将获得的粉末混合物在约4.5吨的压制压力下压制,以制备具有3mm直径的未包衣的微型片剂(快速er微型片剂)。将一部分未包衣的片剂用surelease19040(10.0g):水(6.97g)的溶液包衣,导致普瑞巴林缓慢er微型片剂。将对于每种比率的微型片剂的重量称重,并且填充到明胶胶囊(尺寸00)中。可以将“快速”er和“缓慢”er微型片剂之间的比率调节至所需要的人类pk概况。每个剂量中快速er微型片剂和缓慢er微型片剂之间的比例在约50%:50%(wt/wt)至约10%:90%(wt/wt)之间,更优选地40%:60%至30%:70%。实施例7:普瑞巴林微型片剂表7:快速er微型片剂制剂表8:缓慢er微型片剂制剂将普瑞巴林、羟丙甲纤维素(methoceltme50)、羟丙甲纤维素(methoceltme4m)、羟丙甲纤维素(methoceltmk15m)、羟丙基纤维素(klucellf)在diosna混合器中混合,根据需要添加水。将湿法造粒混合物放置在流化床干燥器中,并在~50℃干燥。将干燥的混合物通过0.710mm筛来筛选。将硬脂酸镁顺序地添加到混合物中,随后在v-共混器中混合。在明胶胶囊中的压片、包衣和填充如实施例6中描述的进行。实施例8-狗pk研究本研究的目的是比较根据本发明的普瑞巴林延长释放(er)胶囊和普瑞巴林立即释放(ir)制剂的体内和体外释放概况。制剂在表9中描述。表9:普瑞巴林er和ir制剂对于体内释放确定,将300mg延长释放胶囊或立即释放胶囊的单次口服施用给予至狗,并且在0、10min、30min、1h、1.5h、2h、2.5h、3h、3.5h、4h、4.5h、5h、6h、7h、9h、12h、15h、18h、24h、30h和48h/72h从前肢静脉中收集血液。血液中的普瑞巴林的浓度通过hplc-ms来确定。根据以下参数,体外溶出使用作为流动相的磷酸盐缓冲液ph6.8和乙腈通过hplc来确定:采样时间:1h;6h;9h;16h;和24h采样体积:5ml色谱参数:柱equisilbds-c8,5μm,150mmx4.6mmid流量1.0ml/min波长200nm注射体积20μl运行时间7分钟烘箱温度30℃结果图1描绘了根据本发明的普瑞巴林延长释放(er)制剂(●)和普瑞巴林立即释放(ir)(■)制剂的血浆浓度相对于时间的概况。对于普瑞巴林er,tmax为7.83h,mrt(0-t)为17.07h,cmax为17940.148μg/l,并且血浆浓度在18h内高于10000μg/l。对于普瑞巴林ir,tmax为2.67h,mrt(0-t)为12.32h,并且cmax为35789.67μg/l。图2描绘了根据本发明的普瑞巴林延长释放(er)制剂的体外(◆)和体内(▲)释放概况。结论:根据本发明的延长释放胶囊在狗中的释放速率是相对稳定的,并且平均滞留时间更长,两者示出了良好的延长释放效果。与普通胶囊(立即释放制剂)相比,本发明的延长释放胶囊示出了较低的cmax、较长的tmax、稳定得多的释放速率和长得多的mrt,所有这些都指示其显著的延长释放性质。普瑞巴林在体内和体外的释放速率示出了一定程度的相似性,这指示良好的体内体外相关性。虽然已经例证并且描述了本发明的某些实施方案,但是将清楚的是,本发明不限于本文描述的实施方案。许多修改、变化、变型、替换和等同物将对本领域技术人员是明显的,而不偏离本发明的精神和范围,如通过所附的权利要求描述的。当前第1页12
相关技术
网友询问留言
已有0条留言
- 还没有人留言评论。精彩留言会获得点赞!
1