使用了非感染性副粘病毒粒子的传染病疫苗的制作方法
本发明涉及使用了在囊膜上保持抗原蛋白的非感染性副粘病毒粒子的传染病疫苗、该疫苗的制造方法、以及通过使用该疫苗进行的防御传染的方法等。
背景技术:
抑制传染病的扩大是国际上的重要课题(whoworldhealthstatistics2016(非专利文献1))。特别是以人类免疫缺陷病毒1型(humanimmunodeficiencyvirus,hiv-1)为致病病毒的传染病(获得性免疫缺陷综合症acquiredimmunodeficiencysyndrome,aids)、以由人类t淋巴细胞白血病病毒1型(htlv-1)引起的成人型t细胞白血病/淋巴瘤(atl,adultt-cellleukemia/lymphoma)为代表的囊膜病毒(包覆了来自于细胞膜的脂质双层膜的病毒)所导致的传染病是最需要对策的病毒传染病。因此,在包括上述在内的病原体传染病对策中,疫苗的普及起到了重要的作用,诱导抗体的疫苗的开发是成为重要战略之一。
艾滋病是由属于逆转录病毒科的慢病毒的hiv-1的感染所引起的、并且以严重的全身性免疫缺陷为特征的疾病。由于感染后的高发病率、死亡率和预防/治疗的难度,成为目前人类面临的最严重的医疗问题之一。hiv感染并破坏作为控制获得性免疫的细胞的cd4阳性辅助性t细胞、巨噬细胞,因此,由于获得性免疫的显著功能降低而引起全身性的免疫缺陷状态,导致各种机会性传染病、机会性肿瘤、中枢神经失调等多种严重的全身症状的发病。未进行适当的治疗时,发病后的生存期为6~19个月(unaidsobligationhq/05/422204,2006(非专利文献2))。
作为传染病的艾滋病首先于1981年在美国被报告,但推测在此以前就已在中非地区开始了艾滋病的流行(sharppmandhahnbh,coldspringharbperspectivesinmedicine1(1):a006841,2011(非专利文献3))。随后,自20世纪80年代以来,流行地区扩大至全世界,20世纪90年代在东欧、中国等各地区发生了急剧的hiv流行。
根据联合国艾滋病规划署(unaids)的推算,在2014年,推测全世界的hiv-1感染人数为3,700万人,每年新感染人数为210万人,每年死亡人数为110万人,现在也在持续增加。这意味着,在全世界的推算总人口约70亿人(2011年版“世界人口白皮书”(非专利文献4))中,约200人中1人发生了感染,另外,每一天产生5,700人新增感染者,即15秒钟产生1人新增感染者。特别是非洲集中了2,500万人以上的患者。在非洲的若干国家中,因艾滋病的流行而使平均寿命长度从60岁降至40岁,引起了一个国家存在与否程度的严重社会、经济问题。此外,推算在以中国为中心的亚洲、太平洋地区有510万感染者,欧美也有240万感染者(unaidsfactsheet2016(非专利文献5))。
艾滋病治疗在近年取得快速进步,除了以azt(azidothymidine)为代表的逆转录酶抑制剂(reversetranscriptaseinhibitor,rti)以外,还开发出了优异的蛋白酶抑制剂(proteaseinhibitor,pi)。近年来,整合酶抑制剂(integraseinhibitor,ini)等也达到实用化。其结果是,通过基于这些作用机理不同的多种药物的组合的抗hiv药物治疗(antiretroviraltherapy,art),可以通过控制感染者的病毒复制来阻止艾滋病发病(consolidatedguidelinesontheuseofantiretroviraldrugsfortreatingandpreventing.hivinfection:recommendationsforapublichealthapproachjune2013,who(非专利文献6))。通过art的导入,发达国家的机会性传染病的频率、艾滋病导致的死亡人数自1995年以来已经减少了40%。
但是,art并不是根治性的治疗方法,已知在淋巴结、中枢神经系统等中无法将病毒清除而残留(latentreservoir),停止服药后,病毒会立即再增殖。因此,为了阻止艾滋病发病,感染者需要终生持续给药,但由于副作用、服药条件等问题,患者对药物的依从性(遵守给药时间表)未必容易。另外,由于出现耐药性艾滋病病毒的问题等,即使在美国,每年减半的死亡人数减少已经达到极限(campojeetal.,aidsandclinicalresearchs5:002.doi:10.4172/2155-6113.s5-002,2012(非专利文献7))。而且,近年来,art下的hiv-1感染者的骨质疏松症、心血管疾病、脑认知功能障碍等非艾滋病疾病的发展成为了新的问题。另外,art在药品价格方面也被指出对发展中国家的患者负担过重。
为了克服这样的药物疗法的局限性,开发可抑制住感染细胞内的残留病毒的有效治疗用疫苗是必不可少的。另外,对于艾滋病极度猖獗的发展中国家而言自不必说,东南亚、中国等面临艾滋病感染快速扩大的各国迫切地希望开发作为抑制hiv-1感染扩大的王牌的预防疫苗。与防御hiv-1感染相关的抗体诱导是疫苗开发中的重要战略。
但是,尽管从20世纪80年代hiv-1被鉴定为病原体后就立即开始尽力进行了艾滋病疫苗的开发,但利用hiv-1的蛋白质、其基因的疫苗在目前的临床试验中没有显示出足够的有效性。强烈希望开发出使用了新的概念、方法的有效新型疫苗。
另一方面,逆转录病毒科的htlv-1引起的传染病是感染者的一部分处于成人性t细胞白血病(adultt-cellleukemia,atl)、htlv-1相关性脊髓病(htlv-1-associatedmyelopathy,ham)、htlv-1葡萄膜炎(htlv-1uveitis,hu)这样的严重的病情的传染病。htlv-1引起的传染病的临床过程是多种多样的,特别是在急性型、淋巴瘤型的alt的情况下,预后极差,因此需要立即进行治疗。被诊断为急性型的患者的中位生存期低于1年(tsukasakikandtobinaik,clincancerres.20:5217-25,2014(非专利文献8))。
日本国内的htlv-i的阳性率推测为0.32%,感染者推测为100万人以上。以前感染者(携带者)主要分布于九州,特别是冲绳县、鹿儿岛县、宫崎县、长崎县。例如,已有报告东京都的htlv-1的阳性率为0.15%,与此相对,全国阳性率最高的鹿儿岛县为1.95%。但是,近年来确认了关东、关西等大城市圈中也有所增加,存在今后扩散至全国的隐患(satakemetal.jmedvirol84:327-35,2012(非专利文献9))。除了日本以外,在加勒比海沿岸各国、中非、南美等也有感染者,并且成人t细胞白血病(atl)患者在这些地区也有大量报告。推测新增感染者为每年3000人。在日本,htlv-i携带者当中每年600~700人左右发生atl。一个携带者终生的发病危险率为5%左右。日本的atl导致的每年死亡人数推测为约1,000人,近年也没有观察到减少的倾向。
作为atl的治疗,与急性白血病同样地研究了缓解诱导疗法(remission-inductiontherapy)后的造血干细胞移植。作为缓解诱导疗法,可以使用chop疗法(在3种抗癌剂(环磷酰胺、阿霉素、长春新碱)中组合了肾上腺皮质激素(泼尼松龙)的化学疗法)、进一步组合了多种药物的lsg15疗法这样的化学疗法。另外,作为造血干细胞移植,可以考虑同种异体骨髓移植。atl从首次开始就显示出耐药性的情况不少。另外,通过科学疗法获得完全缓解的病例近年来正在增加,但复发很多,在复发的情况下具有耐药性,因此尚未确立标准的治疗法(goncalvesduetal.,clinicalmicrobiolrev23:577-589,2010(非专利文献10))。
作为htlv-1的感染途径,主要可以举出通过母乳导致的母婴传播、以及通过性交、血液导致的水平传播(carneiro-proiettiabfetal.,journalofthepediatricinfectiousdiseasessociety3:s24-s29,2014(非专利文献11))。最重要的是母婴传播,可以认为主要是母乳中的htlv-1感染淋巴细胞在婴儿的消化道内与婴儿的淋巴细胞接触,从而导致htlv-1的新感染。在携带者的母亲继续进行母乳喂养的情况下,约20%的婴儿成为携带者。近年来,为了预防垂直传播,推荐改为利用人工营养进行哺乳,母婴传播有一定程度的降低,但至今尚未实现完全预防htlv-1感染,暗示了可能有除母乳以外的感染途径。因此,迫切希望开发疫苗来抑制感染扩大。
在以hiv-1、htlv-1为代表的囊膜病毒的感染防御中,以作为病毒表面膜蛋白质的囊膜(env)蛋白质作为靶标的抗体诱导是重要的。env对于识别细胞表面的病毒受体、并使病毒侵入细胞内是必需的,可以认为能够通过用抗体阻碍其功能来抑制(中和)感染(haynesbfetal.,cellhostmicrobe19:292-303,2016(非专利文献12))。
已知,hiv-1根据流行地区而存在多种不同的毒株,编码该env蛋白质的env基因富于多样性,因此可以认为,在hiv-1感染防御中,需要能够识别多种多样的hiv-1毒株的具有广泛交叉性的中和抗体,针对其诱导的疫苗开发研究正在进行(stephensonkeetal.,currentopinioninimmunology41:39-46,2016(非专利文献13))。但是,在使用了灭活病毒粒子、纯化env蛋白gp120等的现有方法中,明确了交叉性高的中和抗体的诱导是困难的,以新方法的开发为目标展开了基础研究。目前,作为用于诱导中和抗体的抗原,与天然病毒表面存在的抗原相同的具有三聚体结构的env抗原是最有希望,但由于平均每1个hiv-1粒子中仅搭载10~20个分子的env三聚体,因此要求能够以更高密度提呈具有三聚体结构的env抗原的系统。另外,在具有广泛交叉性的中和抗体的诱导中,可以认为,env特异性b细胞的成熟是重要的,需要多种多样的抗原的多次刺激,能够多次接种也是重要的。
已知htlv-1通过感染细胞与其它细胞直接接触而传播,此时,env蛋白质与靶细胞受体的相互作用是必要,诱导以htlv-1env为靶标的抗体的疫苗开发是为了抑制htlv-1感染扩大的重要战略(grosscandthomas-kressak,viruses8:74-95,2016(非专利文献14))。
在构建诱导这样的抗体的疫苗时,要求与高效诱导相关的递送系统和抗原的最优化。通常,疫苗的安全性与有效性是相反的关系。使用了病原体的基因dna本身、蛋白质的疫苗虽然安全性高,但效果有限。另一方面,使用减毒了的病原体本身的疫苗虽然可以期待效果,但如在脊髓灰质炎活疫苗的事故中看到的那样,伴随有安全性的问题。特别是对于hiv、htlv-1而言,没有显示出建立不具有致病性的减毒生疫苗的可能性。另外,对于如詹纳(e.jenner)使用牛痘作为天花疫苗那样、使用免疫原性共通且对人完全没有致病性的类似病毒的方法而言,在hiv、htlv-1的情况下,由于不存在适当的类似病毒,因此也是不可能的。
灭活病毒粒子是代表性的诱导抗体的候选疫苗。env形成多聚体(主要是三聚体),与纯化的蛋白质抗原相比,可以期待从粒子内的核心抗原、基因组等带来的佐剂效应的观点考虑是有利的。但是,对于灭活病毒粒子而言,也存在在灭活处理中失去抗原性的情况、病毒粒子上的抗原密度受到限制的情况等问题。此外,灭活处理不充分时的感染的危险性、制造疫苗时的安全性也令人担忧。
另一方面,近年来,基于“病毒载体”的疫苗作为兼具安全性和有效性的疫苗技术而备受关注。利用感染人的细胞、且没有对人的致病性的病毒作为免疫用抗原基因的运载物。该疫苗在接种后的人细胞内由搭载的抗原基因表达抗原蛋白。可以期待该抗原蛋白如从病原体病毒本身表达那样,对体内的免疫系统提呈而引起免疫。
但是,基于“病毒载体”的疫苗也没有取得期待的效果。在泰国卫生部和美军等共同进行的以1万6千人以上作为对象的目前最大规模的三期临床试验(感染预防试验)中,报告了受试者组的艾滋病感染风险约下降了3成(rerks-ngarmsetal.,newenglanjournalofmedicine361:2209-2220,2009(非专利文献15))。在这以前的临床试验中,组合使用了单独时无效的2种现有疫苗(alvac金丝雀痘疫苗和aidsvax蛋白疫苗),其意义在于,对于艾滋病疫苗而言,在世界上首次证明了有效性。但是,30%的预防效果作为预防疫苗是不足的,而且没有观察到减少感染的人的血液中病毒量的效果,因此,为了实用化需要今后进行改善。另外,在基于“病毒载体”的疫苗为给药后病毒载体增殖的复制型病毒载体的情况下,在体内引起对病毒载体本身的免疫,存在妨碍反复给药疫苗的弱点。
另一方面,近年来,被称为vlp疫苗的新疫苗已经实用化。病毒样粒子(virus-likeparticle,vlp)是指,在昆虫、酵母等真核细胞或结核菌等细菌中仅合成病毒的结构蛋白质时,排出至细胞外的粒子。vlp具有与病毒相同的外观、抗原性,但粒子是中空的,由于不具有病毒基因组,因此可以认为没有致病性,安全性高。作为vlp疫苗,用于预防宫颈癌的人乳头状瘤病毒(hpv)疫苗、乙型肝炎病毒等已经实用化。也已经尝试了hiv-1的vlp,但多数没有实现诱导足够的中和抗体(zhaoetal.,vacines4:2-21,2016(非专利文献16))。
现有技术文献
非专利文献
非专利文献1:whoworldhealthstatistics2016.
非专利文献2:zwahlenm,eggerm(2006)reportonunaidsobligationhq/05/422204.
非专利文献3:sharppmandhahnbh,coldspringharbperspectivesinmedicine1(1):a006841,2011.
非专利文献4:世界人口白皮书2011,unfpa.
非专利文献5:unaidsfactsheet2016.
非专利文献6:consolidatedguidelinesontheuseofantiretroviraldrugsfortreatingandpreventing.hivinfection:recommendationsforapublichealthapproachjune2013,who.
非专利文献7:campojeetal.,aidsandclinicalresearchs5:002.doi:10.4172/2155-6113.s5-002,2012.
非专利文献8:tsukasakikandtobinaik,clincancerres.20:5217-25,2014.
非专利文献9:satakemetal.jmedvirol84:327-35,2012.
非专利文献10:goncalvesduetal.,clinicalmicrobiolrev23:577-589,2010.
非专利文献11:carneiro-proiettiabfetal.,journalofthepediatricinfectiousdiseasessociety3:s24-s29,2014.
非专利文献12:haynesbfetal.,cellhostmicrobe19:292-303,2016.
非专利文献13:stephensonkeetal.,currentopinioninimmunology41:39-46,2016.
非专利文献14:grosscandthomas-kressak,viruses8:74-95,2016.
非专利文献15:rerks-ngarmsetal.,newenglanjournalofmedicine361:2209-2220,2009.
非专利文献16:zhaoetal.,vacines4:2-21,2016.
技术实现要素:
发明要解决的课题
本发明的课题在于提供一种克服了上述的现有疫苗技术缺点、在保持了作为免疫的靶抗原的囊膜蛋白等表面抗原多聚体的高级结构的状态下在表面保持高密度、且能够多次给药的免疫诱导用的新疫苗,为了实现该目的,利用副粘病毒的非感染性粒子作为疫苗,提供一种该粒子的制造方法、以及使用了该非感染性粒子疫苗的病原体感染的防御方法。
解决课题的方法
为了解决课题,发明人等想到利用副粘病毒载体的非感染性粒子作为疫苗,成功地提供该粒子的制造方法、以及使用了该非感染性粒子疫苗的诱导对病原体的抗体的方法。
以仙台病毒为代表的副粘病毒是具有单链反义rna作为基因组的囊膜病毒。其增殖复制以rna的状态进行,不经过dna相。而且,不与细胞内的染色体发生相互作用、整个生活周期仅局限于细胞质,因此不会损伤感染细胞的基因。其中,仙台病毒对人没有致病性。这样的副粘病毒、特别是仙台病毒的优异的安全性、和强烈表达导入至基因组上的基因的能力已经由发明人等开发成基因治疗用载体、ips细胞诱导用载体,近年在医疗、研究领域得到了广泛利用。
在该仙台病毒载体开发的过程中,发明人等从其基因组中成功地使囊膜基因(f或hn基因、或者两者)缺失。由于囊膜蛋白在副粘病毒的细胞感染中是必需的,因此,在通常的基因治疗用载体、ips细胞诱导用载体的情况下,通过另行在辅助细胞中表达缺失的囊膜基因,制成在表面具有囊膜蛋白的具有感染性的粒子。
另一方面,不供给囊膜蛋白而复制增殖的副粘病毒在其表面不具有从基因组中除去的囊膜蛋白,因此不具有对细胞进行感染的能力。发明人等着眼于该非感染性粒子,构思了在该非感染性粒子上表达hiv-1、htlv-1的囊膜蛋白并进行递送的系统。在囊膜蛋白缺失型副粘病毒的表面至少未表达1种副粘病毒原本的囊膜蛋白,因此无法预测病毒粒子是否具有主体所具有的粒子稳定性、基因组保持功能。另外,对于因不具有感染能力而无法发挥复制增殖能力的非感染性的副粘病毒粒子而言,无法预测在体内能否如通常的感染性病毒粒子那样发挥免疫诱导性。但是,本发明人等认为,由于非感染性粒子不表达副粘病毒原本的囊膜蛋白,因此,对该粒子本身的免疫诱导能力降低、在重复给药方面非感染性粒子反而比感染性粒子更有利。
为了使hiv-1、htlv-1的囊膜蛋白在作为与它们不同种的病毒的副粘病毒的粒子表面高效率地表达,制备了将与hiv-1、htlv-1的囊膜基因的细胞外结构域相当的部分结合于仙台病毒的囊膜基因的跨膜部分-细胞质部分而得到的杂交基因(以下也称为“融合基因”。将由融合基因表达的蛋白质称为“杂交蛋白质”或“融合蛋白”。)(wo2016/069518)。在该细胞质部分的n末端进一步结合来自仙台病毒f基因的信号序列,谋求高效地向细胞外移动。
通过用蛋白质印迹法(westernblot)对在表面表达这样制备的hiv-1或htlv-1的囊膜蛋白的非感染性仙台病毒粒子(f缺失型)、和将f蛋白供给至辅助细胞而制备的感染性仙台病毒粒子(f缺失型)进行了比较,结果是令人惊讶地发现,与感染性仙台病毒粒子(f缺失型)相比,非感染性仙台病毒粒子(f缺失型)在表面表达了更多的hiv-1/htlv-1的囊膜蛋白。在非感染性粒子上未表达副粘病毒原本的囊膜蛋白,因而易于获取外来的囊膜蛋白,可以认为,对于粒子表面的抗原的提呈而言,比感染性粒子更有利。
另外,对于用感染性仙台病毒粒子(f缺失型)进行了初次免疫的小鼠给药上述非感染性仙台病毒粒子(f缺失型)作为加强免疫,结果是确认了显著的加强免疫效果,显示出非感染性仙台病毒粒子(f缺失型)作为疫苗的可能性。
即,本发明涉及在非感染性病毒粒子上表达病原体的抗原蛋白的技术、该非感染性病毒粒子的制造方法、以及该非感染性病毒粒子作为对病原体的疫苗的用途及用于该用途的组合物等,更具体而言,本发明涉及各项权利要求中记载的发明。需要说明的是,2个或2个以上引用同一权利要求的权利要求中记载的发明的任意组合所构成的发明也是本说明书中考虑的发明。即,本发明涉及以下的发明。
〔1〕一种副粘病毒非感染性粒子,其在病毒粒子表面表达异种病原体的抗原蛋白。
〔2〕根据〔1〕所述的非感染性粒子,其中,该副粘病毒的至少1种囊膜蛋白从病毒粒子表面缺失。
〔3〕根据〔1〕或〔2〕所述的非感染性粒子,其中,该副粘病毒的f蛋白从病毒粒子表面缺失。
〔4〕根据〔1〕~〔3〕中任一项所述的非感染性粒子,其包含缺失了至少1种囊膜蛋白基因的副粘病毒基因组。
〔5〕根据〔4〕所述的非感染性粒子,其中,缺失的囊膜蛋白基因为f基因。
〔6〕根据〔1〕~〔5〕中任一项所述的非感染性粒子,其中,副粘病毒为仙台病毒。
〔7〕根据〔1〕~〔6〕中任一项所述的非感染性粒子,其中,异种病原体的抗原蛋白包含逆转录病毒的囊膜蛋白的一部分或全部。
〔8〕根据〔1〕~〔7〕中任一项所述的非感染性粒子,其中,异种病原体的抗原蛋白包含htlv-1或hiv-1的囊膜蛋白的一部分或全部。
〔9〕一种组合物,其包含〔1〕~〔8〕中任一项所述的非感染性粒子。
〔10〕一种疫苗制剂,其包含〔1〕~〔8〕中任一项所述的非感染性粒子。
〔11〕根据〔10〕所述的疫苗制剂,其用于加强免疫接种的用途。
〔12〕根据〔10〕所述的疫苗制剂,其在加强免疫接种中使用,该病原体与初次免疫接种的抗原的来源病原体不同,用于提高被诱导的抗体的交叉性的用途。
〔13〕〔1〕~〔8〕中任一项所述的非感染性粒子的制造方法,该方法包括:
将缺失至少1种囊膜蛋白基因、且搭载异种病原体的抗原蛋白基因的副粘病毒载体导入细胞的工序、以及
对生成的副粘病毒非感染性粒子进行回收的工序。
〔14〕一种副粘病毒载体,其在基因组中缺失至少1种囊膜蛋白基因,且搭载异种病原体的抗原蛋白基因,其中,
在病毒粒子表面表达异种病原体的抗原蛋白基因。
〔15〕根据〔14〕所述的副粘病毒载体,其中,异种病原体的抗原蛋白基因为htlv-1或hiv-1的囊膜蛋白。
〔16〕根据〔14〕或〔15〕所述的副粘病毒载体,其中,副粘病毒载体为仙台病毒载体。
〔17〕根据〔14〕~〔16〕中任一项所述的副粘病毒载体,其中,缺失的囊膜蛋白基因为f基因。
另外,本发明涉及本发明的非感染性病毒粒子所具有的副粘病毒基因组rna、该基因组rna的反基因组rna(即,由基因组rna的互补序列构成的rna)、以及编码它们中至少任一种rna的dna。另外,本发明提供编码它们中至少任一种rna的载体、以及包含该dna的载体。载体没有特别限定,可以是质粒载体、噬菌体载体、病毒载体、人工染色体等,只要能够保持核酸就可以是希望的载体。具有转录基因组rna、反基因组rna的能力的表达载体对于制造本发明的非感染病毒粒子、病毒载体是有用的。
需要说明的是,本说明书中记载的任意技术事项及其任意组合均包含于本说明书。另外,在这些发明中,除了本说明书中记载的任意事项或其任意组合以外的发明也包含于本说明书。另外,关于本发明,说明书中记载的某个特定方式不仅公开其内容,还公开从包含该方式的更上位的本说明书中公开的发明中除去该方式以外的发明。
发明的效果
根据本发明,可以使用非感染性病毒粒子作为对病原体的疫苗,所述非感染性病毒粒子在表面以与自然界中存在的蛋白质相同的三维结构表达了病原体的抗原蛋白。特别是通过利用env基因缺失型载体,可以将多分子的抗原蛋白搭载在粒子上,通过以疫苗的形式给药,能够高效地进行抗体诱导,从这一点考虑是有用的。
附图说明
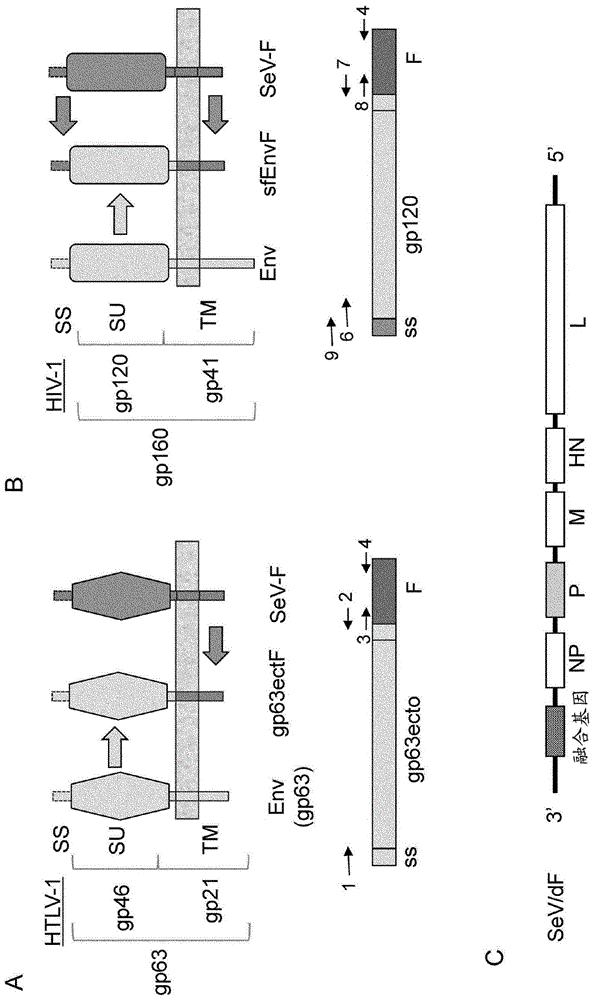
图1是非感染性粒子搭载抗原(hiv-1/htlv-1囊膜)的构建的示意图。a:gp63ectof融合基因的构建。b:sfenvf融合基因的构建。上图是融合基因所编码的融合蛋白在细胞膜上表达的情况的示意图。ss:信号肽、su:细胞外部分、tm:跨膜部分。下图是融合基因的示意图。箭头表示融合基因的构建中使用的引物的位置,编号表示序列号。1:not1_gp63ecto_n,2:gp63ectof_c,3:gp63ectof_n,4:sfenvf_eis_not1_c,6:sfenv_n1,7:envf_c,8:envf_n,9:sf_n2。c是示出sev/df载体的基因组上的融合基因的搭载位置的图。
图2是利用蛋白质印迹法进行的搭载htlv-1囊膜蛋白的f缺失型仙台病毒载体的感染性粒子和非感染性粒子的分析。使用蛋白质印迹法对搭载htlv-1囊膜蛋白的f缺失型仙台病毒载体的感染性粒子(sev18+gp63ectof/df)和非感染性粒子(sev18+gp63ectof/df/nvp)进行了分析。在用丙烯酰胺凝胶对15μl各检体进行了电泳后,使用抗htlv-1gp46抗体检测了粒子上的gp63ectof蛋白。与感染性粒子相比,非感染性粒子上的gp63ectof蛋白的量显著升高。m.magicmaker、1.sev18+gp63ecto/df*、2.sev18+gp63ectof/df、3.sev18+gp63ectof/df/nvp。*sev18+gp63ecto/df是仅搭载了未与仙台病毒f融合的gp63ecto的载体所产生的感染性粒子。
图3是利用蛋白质印迹法进行的搭载htlv-1囊膜蛋白的f缺失型仙台病毒载体的感染性粒子和非感染性粒子的分析。使用蛋白质印迹法对搭载htlv-1囊膜蛋白的f缺失型仙台病毒载体的感染性粒子(sev18+gp63ectof/df)和非感染性粒子(sev18+gp63ectof/df/nvp)进行了分析。在用丙烯酰胺凝胶对1μg各检体进行了电泳后,使用抗htlv-1gp46抗体检测了粒子上的gp63ectof蛋白。与感染性粒子相比,非感染性粒子上的gp63ectof蛋白的量显著升高。左:感染性粒子或非感染性粒子、右:将表达与sevf蛋白融合的(sev18+gp63ectof/df)或未融合的(sev18+gp63ecto/df)htlv-1囊膜蛋白的仙台病毒载体导入而得到的细胞(llc/mk2细胞)的裂解物。左:m.magicmaker、1.sev18+gp63ecto/df、2.sev18+gp63ectof/df、3.sev18+gp63ectof/df/nvp。右:m.magicmaker、4.mk2/control(非感染)、5.mk2/sev18+gp63ecto/df、6.mk2/sev18+gp63ectof/df。
图4是利用蛋白质印迹法进行的搭载hiv-1囊膜蛋白的f缺失型仙台病毒载体的感染性粒子和非感染性粒子的分析。使用蛋白质印迹法对搭载hiv-1囊膜蛋白的f缺失型仙台病毒载体的感染性粒子(sev18+sfenvf/df)和非感染性粒子(sev18+sfenvf/df/nvp)进行了分析。在用丙烯酰胺凝胶对各检体进行了电泳后,使用抗hiv-1gp120抗体检测了粒子上的sfenvf蛋白(系列a)。为了确认应用的各检体中的仙台病毒的量一定,在用丙烯酰胺凝胶进行了电泳后,使用抗仙台病毒抗体检测了仙台病毒蛋白质(系列b)。对待应用的各检体的总蛋白质质量进行调整,使每个泳道的仙台病毒的量一定。与感染性粒子相比,非感染性粒子上的sfenvf蛋白的量显著升高。系列a:利用抗hiv-1gp120抗体进行的sfenvf蛋白的检测。m.magicmaker、1.sev-sfenvf(np)总蛋白质质量1.0μg、2.sev18+sfenvf/df总蛋白质质量1.35μg、3.sev18+sfenvf/df/nvp总蛋白质质量1.5μg。系列b:利用抗仙台病毒抗体进行的仙台病毒蛋白质的检测。m.magicmaker、1.sev-sfenvf(np)总蛋白质质量0.1μg、2.sev18+sfenvf/df总蛋白质质量0.135μg、3.sev18+sfenvf/df/nvp总蛋白质质量0.15μg。
图5是表达htlv-1囊膜蛋白的非感染性粒子的加强免疫效果(elisa法)。示出了利用使用了搭载htlv-1囊膜蛋白的f缺失型仙台病毒载体的感染性粒子(sev18+gp63ectof/df)和非感染性粒子(sev18+gp63ectof/df/nvp)的小鼠(balb/c)进行的免疫诱导实验的结果。将以使用了免疫小鼠血浆的htlv-1gp46蛋白作为靶标的elisa数据去除了背景后的od450测定值的各组的平均值进行比较,与仅进行了1次感染性粒子(sev18+gp63ectof/df)接种的组相比,在进行了1次感染性粒子(sev18+gp63ectof/df)接种后、进行了2次基于非感染性粒子(sev18+gp63ectof/df/nvp)的加强免疫接种的组显示出约3.9倍的值。
图6是表达htlv-1囊膜蛋白的非感染性粒子的加强免疫效果(蛋白质印迹法)。示出了在与图5相同的实验中通过westernblot对免疫小鼠血浆中的htlv-1gp46结合抗体进行检测得到的结果。与仅进行了1次感染性粒子(sev18+gp63ectof/df)接种的组相比,在进行了1次感染性粒子(sev18+gp63ectof/df)接种后、进行了2次基于非感染性粒子(sev18+gp63ectof/df/nvp)的加强免疫接种的组显示出约8.5倍的值。
图7是表达hiv-1囊膜蛋白的非感染性粒子的加强免疫效果。示出了使用表达sfenv-f的f缺失型仙台病毒载体的感染性粒子(sev18+sfenvf/df)和非感染性粒子(sev18+sfenvf/df/nvp)进行的小鼠(balb/c)的免疫诱导实验的结果。将以使用了免疫小鼠血浆的hiv-1gp120蛋白作为靶标的elisa数据去除了背景后的测定值的各组的平均值进行比较,与仅进行了2次感染性粒子(sev18+sfenvf/df)接种的组相比,在进行了2次感染性粒子(sev18+gp63ectof/df)接种后、进行了2次基于非感染性粒子(sev18+sfenvf/df/nvp)的加强免疫接种的组显示出约3.0倍的值,在进行了2次感染性粒子(sev18+gp63ectof/df)接种后、进行了4次基于非感染性粒子(sev18+sfenvf/df/nvp)的加强免疫接种的组显示出约8.0倍的值。
图8表达htlv-1囊膜蛋白的非感染性粒子的抗htlv抗体加强免疫效果。示出了使用表达gp63ectof的f基因缺失型仙台病毒载体的感染性粒子(sev18+gp63ectof/df)和非感染性粒子(sev18+gp63ectof/df/nvp)进行的小鼠(balb/c)的免疫诱导实验的结果。对第1组(sev/sev组)进行了4次感染性粒子(sev18+gp63ectof/df)接种,对第2组(sev/nvp组)进行了1次感染性粒子(sev18+gp63ectof/df)接种并进行了3次非感染性粒子(sev18+gp63ectof/df/nvp)接种。另外,作为阴性对照,对第3组(pbs组)进行了4次pbs接种。在利用elisa进行的对htlv-1gp46蛋白的抗体效价测定中,对于使用了8,000倍稀释的血浆的数据而言,sev/sev组、sev/nvp组均显示出高值,特别是sev/nvp组与对照组相比显示出显著高的值。另外,在终点滴度的比较中,sev/nvp组显示出比sev/sev组显著更高的值。
图9是示出用于制备编码包含来自ad8eo株(hiv-1亚型b)的env的胞外结构域sfad8eoenv的sfad8eoenvf融合蛋白的核酸的3步pcr方案的图。
图10是表达hiv-1囊膜蛋白的非感染性粒子的抗hiv-1抗体加强免疫效果。示出了使用表达sfenv-f的f缺失型仙台病毒载体的感染性粒子(sev18+sfenvf/df)和非感染性粒子(sev18+sfenvf/df/nvp)进行的小鼠(balb/c)的免疫诱导实验的结果。对于envf,使用了利用来自bg505株的胞外结构域的bg505envf和利用来自ad8eo株的胞外结构域的ad8eoenvf。作为阴性对照,pbs组(g1)进行了4次pbs接种。对sev/sev-bg505组(g2)进行了4次表达bg505envf的感染性粒子(sev18+sfbg505envf/df)接种,对sev/nvp-bg505组(g3)进行了1次表达bg505envf的染性粒子(sev18+sfbg505envf/df)接种,然后,进行了3次表达bg505envf的非感染性粒子(sev18+sfbg505envf/df/nvp)接种。另外,为了对在加强接种中使用不同的抗原所带来的抗体交叉性扩大效果进行研究,在进行了2次表达bg505envf的感染性粒子(sev18+sfbg505envf/df)接种之后,作为sev/sev-ad8eo组(g4)进行了2次表达ad8eoenvf的感染性粒子(sev18+sfad8eoenvf/df)接种,或者作为sev/nvp-ad8eo组(g5)分别进行了1次表达bg505envf的非感染性粒子(sev18+sfbg505envf/df/nvp)接种及表达ad8eoenvf的非感染性粒子(sev18+sfad8eoenvf/df/nvp)接种。在利用elisa进行的抗bg505gp120抗体效价测定中,对于od450值的平均值及终点滴度而言,sev/nvp-bg505组(g3)显示出与sev/sev-bg505组(g2)同等或更高的值,表达sfenvf的非感染性粒子(nvp)显示出与表达sfenvf的感染性粒子(sev)相比为同等以上的抗体加强接种能力。另外,在sev/sev-ad8eo组(g4)及sev/nvp-ad8eo组(g5)这两组中,对于od450值的平均值及终点滴度而言,sev/nvp-bg505组(g3)及sev/sev-bg505组(g2)显示出同等或更高的值,通过表达ad8eoenvf的感染性粒子及非感染性粒子的加强接种,显示出能够有效地诱导对bg505gp120应答的抗体。
图11是表达hiv-1囊膜蛋白的非感染性粒子的抗hiv-1抗体加强免疫效果(2)。为了使用图10中示出的小鼠实验中采血得到的样品对表达ad8eoenvf的感染性粒子或非感染性粒子的加强免疫接种的抗体的交叉性扩大效果进行研究,使用与ad8eo同样属于hiv-1亚型b的balgp120蛋白进行了相同的抗gp120抗体elisa。其结果是,对于终点滴度而言,在sev/sev-ad8eo组(g4)中显示出高值,在sev/nvp-ad8eo组(g5)中也显示出与sev/sev-ad8eo组(g4)同等的值。另外,对bg505终点滴度与bal终点滴度之比的值进行了分析,结果是,sev/sev-ad8eo组(g4)、sev/nvp-ad8eo组(g5)显示出比sev/nvp-bg505组(g3)及sev/sev-bg505组(g2)更高的值,特别是sev/nvp-ad8eo组(g5)显示出很高的值。
具体实施方式
以下,对本发明的实施方式进行详细说明。
在本发明中,“疫苗”是指用于引起对抗原的免疫反应的组合物,例如,是指用于传染病、感染症等的预防或治疗而使用的组合物。疫苗包含抗原、或者能够表达抗原,由此能够诱导对抗原的免疫应答。为了病原微生物的感染、传播及流行的预防或治疗,本发明的副粘病毒非感染性粒子可以制剂成包含抗原的疫苗。该疫苗能够以希望的方式使用。
“抗原”是包含1个或1个以上的表位(抗体或免疫细胞进行识别的抗原的一部分)的分子,是指刺激宿主的免疫系统,可以诱导抗原特异性免疫应答的分子。免疫应答可以是体液性免疫应答和/或细胞性免疫应答。可以3个~数个左右的氨基酸形成1个表位,通常,蛋白质中的1个表位包含约7~约15个氨基酸,例如,至少包含8、9、10、12、或14个氨基酸。需要说明的是,在本发明中,表位不仅使由一级结构形成的表位,还包含依赖于蛋白质的立体结构的表位。另外,抗原也称为免疫原。
本发明的“非感染性病毒粒子”是指不具有感染性的病毒粒子。具体而言,是指不具有通常的病毒粒子所具有的、通过接触细胞表面而将粒子内的核酸导入细胞内的能力的病毒粒子。非感染性病毒粒子可以是实质上不具有1种或1种以上的感染所需要的病毒蛋白质的粒子。实质上不具有是指为野生型病毒粒子所具有的蛋白质水平的1/50以下,优选为1/100以下、1/200以下、1/500以下、1/1000以下、1/2000以下,优选为1/5000以下。另外,病毒粒子是指通过与病毒的粒子形成机制相同的作用而形成的粒子。本发明的非感染性病毒粒子是被囊膜(来自细胞膜的生物体膜)包覆的粒子。例如,副粘病毒的非感染性病毒粒子可以包含副粘病毒的基因组rna。该病毒基因组rna可以缺失了至少一个囊膜基因。另外,该病毒基因组rna可以与副粘病毒蛋白质形成复合体(核糖核蛋白;rnp)。该rnp例如为副粘病毒的基因组rna与n、p、l蛋白的复合体。n、p、l蛋白例如可以由该病毒基因组编码。本发明的“非感染性病毒粒子”例如是使缺失至少一个囊膜基因的病毒载体复制增殖而不供给该缺失囊膜蛋白时所产生的粒子。
在本发明中,“病毒载体”是通过具有来自于该病毒的基因组核酸、并将导入基因整合至该核酸,从而可以在导入细胞后使该基因表达的载体。副粘病毒载体是染色体非整合型病毒载体,载体可在细胞质中表达,因此,不存在导入基因被整合至宿主的染色体(来自于核的染色体)的危险性。因此,安全性高,而且能够从感染细胞中除去载体。在本发明中,副粘病毒载体包含具有通过导入细胞来表达搭载的基因的能力的复合体,所述复合体除了感染性病毒粒子以外,还包含病毒核心、病毒基因组与病毒蛋白质的复合体、或非感染性病毒粒子等。例如,在副粘病毒中,由副粘病毒基因组和与其结合的副粘病毒蛋白质(np、p及l蛋白)形成的核糖核蛋白(病毒的核心部分)可以通过导入细胞而在细胞内表达导入基因(wo00/70055)。对细胞的导入可以使用适当的转染试剂等来进行。在本发明中,这样的核糖核蛋白(rnp)也包含于副粘病毒载体中。在本发明中,副粘病毒载体优选为上述的rnp被来自细胞膜的生物体膜所包覆的粒子。
在本发明中,“异种病原体的抗原蛋白”是指包含来自于病原体的抗原的蛋白质,所述病原体与来自于本发明的非感染性粒子的副粘病毒的来源不同。这样的病原体可以是与来自于本发明的非感染性粒子的副粘病毒的来源不同的致病性副粘病毒,或者是不同种、即除副粘病毒以外的生物(病毒也包含在生物中)。另外,病原体是指,能够至少暂时性地损害宿主的健康状态的生物(包括病毒),优选为微生物,进一步优选为病毒,例如具有囊膜的病毒(囊膜病毒)。宿主没有特别限制,优选为哺乳动物,进一步优选为人。
在本发明中,“在病毒粒子表面表达某蛋白质”是指,在该粒子表面表达了该蛋白质,具体而言,是指在该粒子表面保持了该蛋白质。在从细胞中形成该粒子时,在该细胞中,表达该蛋白质并存在于细胞膜,病毒粒子从该细胞膜出芽,由此可以获得在病毒表面表达该蛋白质的病毒粒子。该病毒粒子可以不具有表达该蛋白质的能力,但优选具有表达该蛋白质的能力。
在本发明中,“副粘病毒的至少1种囊膜蛋白从病毒粒子表面缺失”是指,该副粘病毒的野生型病毒粒子在粒子表面保持的至少1种囊膜蛋白不存在于粒子表面。如上所述,这样的病毒粒子可以通过在细胞中表达缺失至少一个囊膜基因的病毒而不供给该缺失囊膜蛋白来生产。这样生产的病毒粒子在病毒粒子表面缺失了副粘病毒的至少1种囊膜蛋白,在该粒子中保持了缺失编码该囊膜蛋白的基因的病毒基因组。作为该囊膜蛋白,可以列举例如f和/或hn蛋白。
在本发明中,副粘病毒是指属于副粘病毒科(paramyxoviridae)的病毒或其衍生物。副粘病毒科是基因组中具有非节段负链rna的单分子负链病毒(mononegavirales)组之一,包括副粘病毒亚科(paramyxovirinae)(包括呼吸道病毒属(respirovirus,也称为副粘病毒属)、腮腺炎病毒(rubulavirus)属、以及麻疹病毒(morbillivirus)属)及肺炎病毒亚科(pneumovirinae)(包括肺炎病毒属及偏肺病毒属)。作为副粘病毒科病毒中包含的病毒,具体可以列举:仙台病毒(sendaivirus)、新城疫病毒(newcastlediseasevirus)、流行性腮腺炎病毒(mumpsvirus)、麻疹病毒(measlesvirus)、rs病毒(respiratorysyncytialvirus)、牛疫病毒(rinderpestvirus)、瘟热病毒(distempervirus)、猴副流感病毒(sv5)、人副流感病毒1、2、3型等。更具体可以包括例如:sendaivirus(sev)、humanparainfluenzavirus-1(hpiv-1)、humanparainfluenzavirus-3(hpiv-3)、phocinedistempervirus(pdv)、caninedistempervirus(cdv)、dolphinmolbillivirus(dmv)、peste-des-petits-ruminantsvirus(pdpr)、measlesvirus(mev)、rinderpestvirus(rpv)、hendravirus(hendra)、nipahvirus(nipah)、humanparainfluenzavirus-2(hpiv-2)、simianparainfluenzavirus5(sv5)、humanparainfluenzavirus-4a(hpiv-4a)、humanparainfluenzavirus-4b(hpiv-4b)、mumpsvirus(mumps)、以及newcastlediseasevirus(ndv)等。作为弹状病毒,包括弹状病毒科(rhabdoviridae)的水疱性口炎病毒(vesicularstomatitisvirus)、狂犬病毒(rabiesvirus)等。
需要说明的是,副粘病毒的基因组rna是负链,蛋白质的氨基酸序列由具有基因组rna的互补序列的反基因组编码。在本发明中,为了方便,有时将基因组和反基因组均称为基因组。
本发明的病毒优选为属于副粘病毒亚科(包括呼吸道病毒属、腮腺炎病毒属及麻疹病毒属)的病毒或其衍生物,更优选为属于呼吸道病毒属(genusrespirovirus)(也称为副粘病毒属(paramyxovirus))的病毒或其衍生物。衍生物中包括以不损害病毒的基因导入能力的方式修饰了病毒基因的病毒、以及进行了化学修饰的病毒等。作为能够适用于本发明的呼吸道病毒属病毒,例如包括:人副流感病毒1型(hpiv-1)、人副流感病毒3型(hpiv-3)、牛副流感病毒3型(bpiv-3)、仙台病毒(sendaivirus;也称为小鼠副流感病毒1型)、麻疹病毒、猴副流感病毒(sv5)、以及猴副流感病毒10型(spiv-10)等。在本发明中,副粘病毒最优选为仙台病毒。
副粘病毒通常在囊膜的内部包含由rna和蛋白质形成的复合体(核蛋白;rnp)。rnp中含有的rna是作为负链rna病毒的基因组的(-)链(负链)的单链rna,该单链rna与np蛋白、p蛋白及l蛋白结合而形成rnp。该rnp中含有的rna成为用于转录和复制病毒基因组的模板(lamb,r.a.,andd.kolakofsky,1996,paramyxoviridae:thevirusesandtheirreplication.pp.1177-1204.infieldsvirology,3rdedn.fields,b.n.,d.m.knipe,andp.m.howleyetal.(ed.),ravenpress,newyork,n.y.)。
副粘病毒的“np、p、m、f、hn及l基因”分别是指编码核衣壳、磷蛋白、基质蛋白、融合蛋白、血凝素-神经氨酸酶及大分子蛋白的基因。核衣壳(np)蛋白与基因组rna结合,是对基因组rna具有模板活性而言不可缺少的蛋白质。通常,np基因有时也表述为“n基因”。磷(p)蛋白是作为rna聚合酶的小亚基的磷酸化蛋白。基质(m)蛋白起到从内侧保持病毒粒子结构的功能。融合(f)蛋白是与侵入宿主细胞相关的膜融合蛋白,血凝素-神经氨酸酶(hn)蛋白质是与和宿主细胞的结合相关的蛋白质。大分子(l)蛋白是rna聚合酶的大亚基。上述各基因具有各自的转录控制单元,从各基因转录单独的mrna,转录蛋白质。从p基因开始,除了p蛋白以外,翻译利用不同的orf翻译的非结构蛋白质(c)、以及通过读取p蛋白mrna过程中的rna编辑而制备的蛋白质(v)。例如,属于副粘病毒亚科的各病毒中的各基因通常按照从基因组的前端(3’)开始编码的顺序表示如下。
呼吸道病毒属np/c/vmfhn-l
腮腺炎病毒属np/vmfhn(sh)l
麻疹病毒属np/c/vmfh-l
例如,对于仙台病毒的各基因的碱基序列的数据库收录号而言,关于n基因,参照m29343、m30202、m30203、m30204、m51331、m55565、m69046、x17218,关于p基因,参照m30202、m30203、m30204、m55565、m69046、x00583、x17007、x17008,关于m基因,参照d11446、k02742、m30202、m30203、m30204、m69046、u31956、x00584、x53056,关于f基因,参照d00152、d11446、d17334、d17335、m30202、m30203、m30204、m69046、x00152、x02131,关于hn基因,参照d26475、m12397、m30202、m30203、m30204、m69046、x00586、x02808、x56131,关于l基因,参照d00053、m30202、m30203、m30204、m69040、x00587、x58886。另外,在示例出编码其它病毒的病毒基因时,关于n基因,可以示例出cdv、af014953;dmv、x75961;hpiv-1、d01070;hpiv-2、m55320;hpiv-3、d10025;mapuera、x85128;mumps、d86172;mev、k01711;ndv、af064091;pdpr、x74443;pdv、x75717;rpv、x68311;sev、x00087;sv5、m81442;及tupaia、af079780;关于p基因,可以示例出cdv、x51869;dmv、z47758;hpiv-l、m74081;hpiv-3、x04721;hpiv-4a、m55975;hpiv-4b、m55976;mumps、d86173;mev、m89920;ndv、m20302;pdv、x75960;rpv、x68311;sev、m30202;sv5、af052755;及tupaia、af079780;关于c基因,可以示例出cdv、af014953;dmv、z47758;hpiv-1、m74081;hpiv-3、d00047;mev、abo16162;rpv、x68311;sev、ab005796;及tupaia、af079780,关于m基因,可以示例出cdv、m12669;dmvz30087;hpiv-1、s38067;hpiv-2、m62734;hpiv-3、d00130;hpiv-4a、d10241;hpiv-4b、d10242;mumps、d86171;mev、ab012948;ndv、af089819;pdpr、z47977;pdv、x75717;rpv、m34018;sev、u31956;及sv5、m32248,关于f基因,可以示例出cdv、m21849;dmv、aj224704;hpn-1、m22347;hpiv-2、m60182;hpiv-3、x05303、hpiv-4a、d49821;hpiv-4b、d49822;mumps、d86169;mev、ab003178;ndv、af048763;pdpr、z37017;pdv、aj224706;rpv、m21514;sev、d17334;及sv5、ab021962,关于hn(h或g)基因,可以示例出cdv、af112189;dmv、aj224705;hpiv-1、u709498;hpiv-2.d000865;hpiv-3、ab012132;hpiv-4a、m34033;hpiv-4b、ab006954;mumps、x99040;mev、k01711;ndv、af204872;pdpr、x74443;pdv、z36979;rpv、af132934;sev、u06433;及sv-5、s76876,关于l基因,可以示例出cdv、af014953;dmv、aj608288;hpiv-1、af117818;hpiv-2、x57559;hpiv-3、ab012132;mumps、ab040874;mev、k01711;ndv、ay049766;pdpr、aj849636;pdv、y09630;rpv、z30698;及sv-5、d13868。但是,各病毒已知多种毒株,根据毒株的不同,也存在包含除上述示例以外的序列的基因。具有来自这些任意基因的病毒基因的仙台病毒载体作为用于产生本发明的非感染性粒子的病毒载体是有用的。例如,本发明的仙台病毒载体、以及感染性及非感染性粒子可以包含与上述任意病毒基因的编码序列具有90%以上、优选具有95%以上、96%以上、97%以上、98%以上或99%以上的同一性的碱基序列。另外,本发明的仙台病毒载体、以及感染性及非感染性粒子例如可以包含编码与上述任意病毒基因的编码序列所编码的氨基酸序列具有90%以上、优选具有95%以上、96%以上、97%以上、98%以上或99%以上的同一性的氨基酸序列的碱基序列。另外,本发明的仙台病毒载体、以及感染性及非感染性粒子例如可以包含编码上述任意病毒基因的编码序列所编码的氨基酸序列中10个以内、优选为9个以内、8个以内、7个以内、6个以内、5个以内、4个以内、3个以内、2个以内或1个氨基酸发生了取代、插入、缺失和/或添加而成的氨基酸序列的碱基序列。
需要说明的是,本说明书中记载的碱基序列及氨基酸序列等参照了数据库收录号的序列参照例如本申请的申请日及优先权日的序列,可以确定为本申请的申请日及优先权日的任一时刻的序列,优选确定为本申请的申请日的序列。各时刻的序列可以通过参照数据库的修订历史来确定。
本发明中使用的副粘病毒可以是衍生物,衍生物中包括以不损害病毒的基因导入能力的方式修饰了病毒基因的病毒、以及进行了化学修饰的病毒等。
另外,副粘病毒可以来自于天然毒株、野生毒株、突变毒株、实验室传代毒株、以及人工构建的毒株等。例如,仙台病毒可以举出z毒株,但并不限定于此(medicaljournalofosakauniversityvol.6,no.1,march1955p1-15)。即,该病毒只要能够制造作为目标的非感染性病毒粒子即可,可以是具有与从自然中分离的病毒相同的结构的病毒,也可以是通过基因重组进行了人工修饰的病毒。例如,可以是野生型病毒所具有的任意基因发生了突变、缺失的病毒。例如,可以优选使用编码病毒的囊膜蛋白或外壳蛋白质中的至少1种基因具有缺失或抑制其表达的终止密码子突变等突变的病毒。这样的不表达囊膜蛋白的病毒例如是可以在感染细胞中复制基因组、但无法形成感染性病毒粒子的病毒。这样的传播能力缺失型的病毒适于非感染性病毒粒子的制造。例如,可以使用将f或hn中任一囊膜蛋白(突刺蛋白)的基因、或者f及hn基因不编码至基因组中的病毒(wo00/70055及wo00/70070;li,h.-o.etal.,j.virol.74(14)6564-6569(2000))。如果至少将基因组复制所需要的蛋白质(例如n、p及l蛋白)编码至基因组rna,病毒就可以在感染细胞中对基因组进行扩增。在制造囊膜蛋白缺失型且具有感染性的病毒粒子中,例如,在病毒产生细胞中外源性地供给缺失的基因产物或可以与其互补的蛋白质(wo00/70055及wo00/70070;li,h.-o.etal.,j.virol.74(14)6564-6569(2000))。另一方面,可以通过完全不补充缺失的病毒蛋白质来回收非感染性病毒粒子(wo00/70070)。
另外,在本发明的病毒的生产中,优选使用搭载突变型的病毒蛋白质基因的病毒。例如,在病毒的结构蛋白质(np,m)、rna合成酶(p,l)中,已知包括减毒化突变、温度敏感性突变的多种突变。在本发明中,可以根据目的优选使用具有这些突变蛋白质基因的副粘病毒。在本发明中,可以优选使用减弱了细胞毒性的病毒。细胞毒性例如可以通过对从细胞释放出的乳酸脱氢酶(ldh)进行定量来测定。对于细胞毒性的弱化程度而言,例如,以moi(感染复数)3感染来自人的hela细胞(atccccl-2)或来自猴的cv-1细胞(atccccl70)并培养了3天的培养液中的ldh释放量比野生型显著降低,例如,可以使用降低了20%以上、25%以上、30%以上、35%以上、40%以上或50%以上的病毒。另外,使细胞毒性降低的突变中也包括温度敏感性突变。温度敏感性突变是指,与低温(30℃~36℃、例如30℃~32℃)相比,在病毒宿主的通常温度(例如37℃~38℃)下活性显著降低的突变。这样的具有温度敏感性突变的蛋白质可以在允许温度(低温)下制备病毒,因此是便利的。在本发明中,对于具有有用的温度敏感性突变的病毒而言,例如,与在培养细胞中32℃下进行感染的情况相比,在37℃下进行感染时,增殖速度或基因表达水平至少为1/2以下,优选为1/3以下,更优选为1/5以下,更优选为1/10以下,更优选为1/20以下。
本发明所用的病毒在其基因组中除了病毒蛋白质基因以外,还可以编码控制病毒性质的外源基因、调节因子。例如,为了调整病毒蛋白质的表达,可以编码degron序列、mirna的靶序列。
另外,本发明中使用的副粘病毒只要不妨害非感染性病毒粒子的制造、且在粒子上表达抗原基因的表达产物即可,可以是野生型。本发明中优选使用的副粘病毒的至少1种囊膜基因发生了缺失或突变。这样的病毒包括:至少1种囊膜基因缺失的病毒、至少1种囊膜基因突变了的病毒、至少1种囊膜基因突变且至少1种囊膜基因缺失的病毒。突变或缺失的至少1种囊膜基因优选为编码囊膜构成蛋白质的基因,可以列举例如f基因和/或hn基因。例如,可以优选使用f基因缺失或编码f基因功能丧失型的突变f蛋白的病毒。另外,也可以使用hn基因缺失、或编码hn基因功能丧失型的突变hn蛋白的病毒。另外,例如,在本发明中可以优选使用缺失f基因、且进一步缺失hn基因、或hn基因进一步具有突变的副粘病毒。另外,例如,在本发明中可以优选使用缺失f基因、且进一步缺失hn基因的副粘病毒。这样的突变型的病毒可以按照公知的方法制备。另外,本发明的副粘病毒优选具有m基因。
本发明的非感染性病毒粒子在表面表达抗原分子(即,在表面保持抗原分子)。抗原分子是在给药该非感染性病毒粒子时在人及动物中引起对该抗原的免疫反应的分子,可以列举来自于病原体的结构蛋白质或病原体的增殖所必需的病毒蛋白质。在病原体中,为了阻止病原病毒的感染,优选使用在病毒粒子表面表达的囊膜蛋白作为抗原。作为具有囊膜的病毒,除了上述的副粘病毒科的各病毒以外,还包括被分类为单分子负链病毒的埃博拉病毒等丝状病毒科(filoviridae)、狂犬病毒等弹状病毒科(rhabdoviridae)、布尼亚病毒科(bunyaviridae)、拉沙病毒等沙粒病毒科(arenaviridae),进一步包括分别属于具有节段负链rna作为基因组的正粘病毒科(orthomyxoviridae)、具有正链rna作为基因组的黄病毒科(flaviviridae)、披膜病毒科(togaviridae)、逆转录病毒科(retroviridae)、冠状病毒科(coronaviridae)、以及具有双链dna作为基因组的乙型肝炎病毒等嗜肝dna病毒科(hepadnaviridae)、疱疹病毒科(herpesviridae)、天然痘病毒等痘病毒科(poxviridae)的病毒。作为病原体,特别可以举出hiv及htlv等t细胞感染性的病毒。hiv-1和htlv-1均是属于逆转录病毒科的囊膜病毒。
这些囊膜病毒通过该粒子表面的囊膜蛋白识别作为靶标的细胞,进行感染。因此可以认为,诱导与粒子表面的囊膜蛋白结合而阻止病毒的细胞感染的抗体的疫苗对于阻止感染是有效的。即,本发明的副粘病毒非感染性粒子包含在粒子表面表达致病性病毒的囊膜蛋白的一部分或全部作为抗原蛋白的粒子。这里,囊膜蛋白的一部分只要显示出免疫原性即可,其长度没有限制,如上所述,可以适当使用包含1个或1个以上的表位、能够刺激宿主的免疫系统诱导抗原特异性免疫应答的部分,通常,至少包含约7个~约15个氨基酸,例如包含8、9、10、12或14个氨基酸。这样的抗原蛋白优选包含该囊膜蛋白的胞外结构域(细胞外结构域)的一部分或全部。更优选本发明的副粘病毒非感染性粒子包含致病性病毒的囊膜蛋白的胞外结构域的全部氨基酸序列中至少20%以上、优选50%以上、60%以上、70%以上、80%以上、90%以上或全部的序列。通过在粒子表面表达作为靶标的病毒的囊膜蛋白抗原,可以生产对阻止感染有效的疫苗。抗原蛋白可以是天然的蛋白质、其片段、或者包含该片段的融合蛋白等。融合蛋白例如为该片段与其它病毒(例如副粘病毒)的囊膜蛋白(可以是一部分,也可以是全部)的融合蛋白。
但是,病毒的囊膜蛋白有可能难以在异种病毒粒子表面表达。发明人等为了解决该问题,制备将抗原囊膜分子提呈至细胞外的部分与来自本发明非感染性粒子的副粘病毒囊膜分子的细胞内部分融合而成的基因,并将其搭载于病毒基因组。可以确认到根据由此制备的融合基因表达的融合蛋白被高效地整合至非感染性病毒粒子上。作为本发明的抗原蛋白,可以优选使用在病毒粒子的外侧包含病原体的抗原片段、且在病毒粒子的内侧包含副粘病毒的囊膜蛋白的细胞质区域片段的融合蛋白。
例如,作为在本发明副粘病毒非感染性粒子的粒子表面表达了的异种病原体的抗原蛋白,可以优选使用在粒子的膜的外侧包含异种病原体的抗原、且在粒子的膜的内侧包含该副粘病毒的囊膜蛋白的粒子内部分的融合蛋白。在抗原蛋白为致病性病毒的囊膜蛋白的情况下,可以使用该囊膜蛋白的胞外结构域(在细胞中表达时的细胞外区域)作为抗原部分。作为副粘病毒的囊膜蛋白的粒子内部分,可以使用在细胞中表达该囊膜蛋白时的细胞质区域。融合蛋白所使用的胞外结构域、细胞质区域分别可以不是全长,可以是部分片段。融合蛋白的跨膜区域可以来自任何一者,优选为副粘病毒蛋白质的跨膜区域,更优选使用与上述的细胞质区域相同的囊膜蛋白的跨膜区域。
逆转录病毒的囊膜基因编码了作为i型跨膜蛋白的囊膜蛋白前体。该前体在高尔基体经过糖链修饰等修饰后,通过氨基末端的信号肽转运至细胞表面,由蛋白酶进行加工,分割成细胞外部分(su)和跨膜部分(tm)这2个亚基。su通过与tm的细胞外部分相互作用而在细胞膜上形成复合体,进而,通过使该复合体形成三聚体,成为具有活性的囊膜蛋白。可以认为,该三聚体通过tm的细胞质侧与作为逆转录病毒粒子的支架蛋白的ma蛋白相互作用,由此在病毒粒子出芽时被整合至病毒粒子中。
在本发明非感染性粒子的粒子表面表达的异种病原体的抗原蛋白如上述的逆转录病毒的囊膜蛋白那样来自于i型跨膜蛋白的情况下,待融合的副粘病毒的囊膜蛋白也优选选择i型跨膜蛋白,在异种病原体的抗原蛋白来自于ii型跨膜蛋白的情况下,待融合的副粘病毒的囊膜蛋白也优选选择ii型跨膜蛋白。例如,在选择逆转录病毒的囊膜蛋白作为抗原蛋白的情况下,优选使其胞外结构域与例如副粘病毒的f蛋白的细胞内区域(可有包含跨膜部分(tm))融合。需要说明的是,在使用逆转录病毒的囊膜蛋白作为抗原表达融合蛋白的情况下,为了易于形成三聚体,优选至少包含逆转录病毒的囊膜蛋白的胞外结构域的c末端,更优选包含包括胞外结构域c末端的胞外结构域的50个氨基酸以上、优选为60个氨基酸以上、70个氨基酸以上、80个氨基酸以上、90个氨基酸以上、100个氨基酸以上、120个氨基酸以上、150个氨基酸以上、200个氨基酸以上或250个氨基酸以上。另外,优选包含逆转录病毒的囊膜蛋白的tm区域的n末端,更优选包含包括tm区域n末端的tm区域侧的50个氨基酸以上、优选为60个氨基酸以上、70个氨基酸以上、80个氨基酸以上、90个氨基酸以上、100个氨基酸以上或120个氨基酸以上。
另外,优选包含位于逆转录病毒的囊膜蛋白的胞外结构域与tm之间的蛋白酶切断部位,该蛋白质优选在该切断部位被切断。
编码抗原蛋白的基因可以插入副粘病毒基因组的希望位置。在副粘病毒的情况下,越接近基因组的3’末端,越可期待表达水平提高,因此,例如可以在位于3’末端的前导序列与位于其5’侧的最初的副粘病毒蛋白质(通常为n蛋白)的基因之间插入编码抗原蛋白的碱基序列。或者,可以为最初的副粘病毒蛋白质(通常为n蛋白)与第2个副粘病毒蛋白质(通常为p蛋白)的基因之间、第2个与第3个(通常为p与m之间)等。
对于htlv-1的囊膜基因而言,在本说明书的实施例中使用的从htlv-1感染患者的血细胞得到的分离株(国立传染病研究所)的情况下,由1467个碱基的编码序列构成,编码了由488个氨基酸形成的囊膜蛋白前体(gp63)。该前体在利用蛋白酶进行加工后被分割成细胞外部分(gp43,su,氨基酸1-322)和跨膜部分(gp21,tm,氨基酸323-488)。在本说明书的实施例中,制成将与跨越蛋白酶切断部位的gp63的氨基酸1-442(称为“gp63ecto”)相当的碱基序列和仙台病毒f蛋白的跨膜部分的基因进行融合而成的基因(称为“gp63ectof”)(图1a),将其插入位于与在f缺失型仙台病毒基因组的最上游(3’侧)编码的仙台病毒蛋白质(通常为n蛋白)的n末端对应的部位的上游(3’侧)的插入部位(18+位)(图1c)。
融合基因gp63ectof的制备具体通过以下方式进行:首先,通过以搭载了htlv-1的前病毒序列的质粒(pcxsn-gp63efoldo、国立传染病研究所)作为模板的pcr法制成编码gp63ecto(序列号:10)的基因片段,所述htlv-1的前病毒序列是使用pcr法由htlv-1感染者的血细胞dna扩增而得到的。与此不同地,以编码仙台病毒序列的质粒作为模板,通过pcr法制成了与仙台病毒f蛋白的跨膜部分以后(也包含细胞质区域)(accessionno.aab06281.1的氨基酸496-565;序列号:11)相当的基因片段。此时,gp63ecto基因扩增用的下游侧引物和仙台病毒f蛋白的跨膜部分的扩增用的上游引物设计为跨过作为目标的融合基因的边界部分、且具有相互互补的部分。接着,将制成的两个基因片段混合,再次进行pcr,由此,制成了由gp63ecto与仙台病毒f蛋白的氨基酸496-565形成的融合基因gp63ectof(序列号:12及13)。此时,在包含融合基因的片段的上游和下流导入了用于容易对仙台病毒载体进行插入的noti识别序列。
作为包含htlv-1的囊膜抗原蛋白的融合蛋白的优选方式,可以举出例如,htlv-1的囊膜蛋白片段与在其c末端侧包含副粘病毒f蛋白的细胞跨膜区域及细胞内区域的融合蛋白,所述htlv-1的囊膜蛋白片段包含htlv-1的囊膜蛋白(成熟型)的细胞外区域、以及从tm区域的n末端侧起至少50个氨基酸以上(优选为60个氨基酸以上、70个氨基酸以上、80个氨基酸以上、90个氨基酸以上、100个氨基酸以上或120个氨基酸以上)。需要说明的是,在融合蛋白的n末端可以添加副粘病毒囊膜蛋白的信号序列。作为信号肽,可以举出例如仙台病毒的信号肽(序列号15),但并不限定于此。另外,融合蛋白的各边界部分可以适当插入接头、间隔物(例如,由1个或多个氨基酸构成的序列)。优选为包含序列号10的第1-322位、优选为第1-442位的氨基酸序列、或与该序列相同的区域的序列、且在其c末端侧包含序列号11的氨基酸序列或与该序列相同的区域的序列的蛋白质,可以举出例如,包含序列号13中记载的氨基酸序列的融合蛋白。
这里,相同的区域是指在不同株的病毒的氨基酸序列中相对应的区域。病毒通常富于多样性,根据分离株不同,有时囊膜蛋白的氨基酸序列不同。本发明包括希望的毒株的病毒,以上所示的序列仅是示例。对于具有不同序列的病毒株而言,可以使用上述的相同的区域的序列等来实施本发明。相同的区域例如可以通过使用电脑程序进行氨基酸序列的比对来鉴定。
示例出优选的融合蛋白,但并不限定于此,可以举出例如,包含与序列号13的氨基酸序列具有60%以上、70%以上、80%以上、优选为85%以上、90%以上、95%以上、97%以上、98%以上或99%以上的同一性的氨基酸序列的蛋白质,其具有在细胞膜上表达的功能。序列的同一性例如可以使用blastp程序(altschul,s.f.etal.,j.mol.biol.215:403-410,1990)来确定。例如,可以在ncbi(nationalcenterforbiothchnologyinformation)的blast的网页使用默认参数进行检索(altschuls.f.etal.,naturegenet.3:266-272,1993;madden,t.l.etal.,meth.enzymol.266:131-141,1996;altschuls.f.etal.,nucleicacidsres.25:3389-3402,1997;zhangj.&maddent.l.,genomeres.7:649-656,1997)。例如,可以利用进行2个序列比较的blast2sequences程序(tatianaaetal.,femsmicrobiollett.174:247-250,1999)进行2个序列的比对,确定序列的同一性。将空位与错配同样处理,例如,计算相对于分泌后的成熟型蛋白质的氨基酸序列总体的同一性的值。
在hiv-1的情况下,本发明的实施例中使用的bg505株(wuetal.j.virol.80(2),835-844(2006))的囊膜蛋白前体gp160(accessionno.aba61516.1)由860个氨基酸构成。该前体在利用蛋白酶进行加工后,被分割成细胞外部分(gp120,su,氨基酸1-508)和跨膜部分(gp41,tm,氨基酸509-860)。在实施例中,制备了将与除信号肽(氨基酸1-29)以外的gp160的氨基酸30-680(序列号14)相当的碱基序列和仙台病毒f蛋白的跨膜部分(accessionno.aab06281.1的氨基酸496-565、也包含细胞质区域的一部分、序列号12)的基因进行融合而成的基因。此时,通过由2个氨基酸残基(as)形成的接头将仙台病毒的信号肽(accessionno.aab06281.1的氨基酸1-26、序列号15)同时添加于n末端(图1b)。制成的融合基因(称为“sfenvf”、序列号16)插入了f缺失型仙台病毒载体基因组的n末端的插入部位(18+位)(图1c)。
sfenvf融合基因的制备具体可以通过以下方式进行:首先,以编码hiv-1bg505株的env基因的质粒作为模板,通过pcr法制成与gp160的氨基酸30-680相当的基因片段,与此不同地,以编码仙台病毒序列的质粒作为模板,通过pcr法制成与仙台病毒f蛋白的跨膜部分相当的基因片段。此时,gp160基因扩增用的下流侧引物和仙台病毒f蛋白的跨膜部分的扩增用的上游引物设计为跨过作为目标的融合基因的边界部分、且具有相互互补的部分。接着,将制成的两个基因片段混合,再次进行pcr,由此,制成了由gp160的氨基酸30-680和仙台病毒f蛋白的氨基酸496-565形成的融合基因。此时,通过将包含仙台病毒的信号肽和与接头相当的序列的引物用于上游用的引物,在融合基因中添加了仙台病毒的信号肽。另外,同时在包含融合基因的片段的上游和下游导入了用于容易对仙台病毒载体进行插入的noti识别序列。
另外,也可以使用ad8eo株(shingai,m.etal.,2012,procnatlacadsciu.s.a.109(48):19769-19774)的囊膜蛋白前体gp160(accessionno.km082921.1)。该前体在利用蛋白酶进行加工后,被分割成细胞外部分(gp120,su,氨基酸1-504)和跨膜部分(gp41,tm,氨基酸505~850)。在实施例中,制备了将与除信号肽(氨基酸1-31)以外的gp160的氨基酸32~677(序列号:28)相当的碱基序列和仙台病毒f蛋白的跨膜部分(accessionno.aab06281.1的氨基酸496-565、也包含细胞质区域的一部分、序列号12)的基因进行融合而成的基因。此时,通过由2个氨基酸残基(as)形成的接头将仙台病毒的信号肽(accessionno.aab06281.1的氨基酸1-26、序列号15)同时添加于n末端。制成的融合基因(称为“sfad8eoenvf”、氨基酸序列为序列号29)插入了f缺失型仙台病毒载体基因组的n末端的插入部位(18+位)。
作为包含hiv-1的囊膜抗原蛋白的融合蛋白的优选方式,与上述的htlv-1的情况相同,可以举出例如,hiv-1的囊膜蛋白片段与在其c末端侧包含副粘病毒f蛋白的细胞跨膜区域及细胞内区域的融合蛋白,所述hiv-1的囊膜蛋白片段包含hiv-1的囊膜蛋白(成熟型)的细胞外区域、以及从tm区域的n末端侧起至少50个氨基酸以上(优选为60个氨基酸以上、70个氨基酸以上、80个氨基酸以上、90个氨基酸以上、100个氨基酸以上、120个氨基酸以上、200个氨基酸以上、300个氨基酸以上、400个氨基酸以上、500个氨基酸以上或600个氨基酸以上)。需要说明的是,在融合蛋白的n末端可以添加副粘病毒囊膜蛋白的信号序列。作为信号肽,可以举出例如仙台病毒的信号肽(序列号15),但并不限定于此。另外,融合蛋白的各边界部分可以适当插入接头、间隔物(例如,由1个或多个氨基酸构成的序列)。优选为包含序列号14的第1-479位、优选为第1-651位的氨基酸序列、或与该序列相同的区域的序列、且在其c末端侧包含序列号11的氨基酸序列或与该序列相同的区域的序列的蛋白质,可以举出例如,包含序列号17的第29-749位的氨基酸序列的融合蛋白。相同的区域的序列如上所述,本领域技术人员可以容易地确定。
例如,举出hiv-1的ad8eo株作为例子,优选为包含序列号28的第1-473位、优选为第1-646位的氨基酸序列、或与该序列相同的区域的序列、且在其c末端侧包含序列号29的氨基酸序列或与该序列相同的区域的序列的蛋白质,可以举出例如,包含序列号29的第31-746位的氨基酸序列的融合蛋白。相同的区域的序列如上所述,本领域技术人员可以容易地确定。
hiv病毒的囊膜蛋白的多样性高,根据分离株不同,有时氨基酸序列、蛋白质的尺寸不同,本发明包括希望的毒株,但并不限定于以上所示的序列。对于具有不同序列的毒株而言,可以使用上述的相同的区域的序列等来实施本发明。
示例出对于hiv-1囊膜蛋白的优选融合蛋白,但并不限定于此,可以举出例如,包含与序列号17或29的氨基酸序列具有60%以上、70%以上、80%以上、优选为85%以上、90%以上或95%以上、97%以上、98%以上或99%以上的同一性的氨基酸序列的蛋白质,其具有在细胞膜上表达的功能。序列的同一性可以与上述同样地使用例如blastp程序来确定。
融合基因gp63ectof或者sfenvf或sfad8eoenvf对f缺失型仙台病毒载体基因组的插入、以及病毒载体的扩增和回收使用公知的方法来进行(国际公开公报wo97/16539;国际公开公报wo97/16538;国际公开公报wo00/70070;国际公开公报wo01/18223;国际公开公报wo2005/071092;hasan,mketal.jgenvirol78:2813-2820,1997;katoaetal.emboj16:578-587,1997;yudetal.genescells2:457-466,1997;katoaetal.,genescells1;569-579,1996;tokusumitetal.virusres86:33-38,2002;lihoetal.,jvirol74:6564-6569,2000)。本发明的病毒载体、病毒粒子也可以与此同样地获得。
在优选的方式中,与感染性粒子相比,本发明的非感染性粒子的粒子中含有的病原体抗原蛋白的量有所增加。即,本发明提供本发明的非感染性粒子,与感染性粒子相比,其是粒子中含有的该抗原蛋白质量有所增加的粒子。这里,粒子中含有的病原体抗原蛋白包含在粒子的膜表面表达了的物质。另外,与感染性粒子相比,优选本发明的非感染性粒子的位于粒子表面的病原体抗原蛋白的量有所增加。比较的感染性粒子可以优选使用具有与本发明的非感染性粒子相同的基因组的病毒粒子、或者具有搭载了对其基因组赋予感染性的囊膜蛋白基因的基因组的病毒粒子。例如,在基因组上的囊膜蛋白基因缺失的非感染性粒子的情况下,可以将除了该囊膜蛋白基因未缺失以外具有相同基因组序列的病毒粒子作为比较对象。与感染性粒子相比,本发明的非感染性粒子的病原体抗原蛋白的量例如为1.2倍以上,优选为1.5倍以上、1.8倍以上、2倍以上、2.5倍以上、3倍以上、4倍以上、5倍以上、6倍以上、7倍以上或8倍以上。病原体抗原蛋白质量的比较例如可以通过单位粒子、粒子的单位重量、或单位粒子中含有的核酸量来进行比较,优选以平均每1个粒子的病原体抗原蛋白质量进行比较。病原体抗原蛋白质量可以通过例如elisa、蛋白质印迹法等公知的方法来测定。
另外,本发明涉及至少一个囊膜蛋白基因从基因组中缺失的副粘病毒载体,其缺失至少一个囊膜蛋白基因、且搭载异种病原体的抗原蛋白基因。该病毒载体优选为在导入细胞中具有基因组复制能力及粒子形成能力的载体,且在基因组上搭载了n、p、l基因。另外,该病毒载体优选在基因组上搭载了m基因。该病毒载体对于制造本发明的非感染性病毒粒子是有用的,而且可以将病毒载体本身作为疫苗使用。在该情况下,该病毒载体优选在病毒粒子表面表达了该异种病原体的抗原蛋白。即,在病毒粒子表面保持有该异种病原体的抗原蛋白。
特别地,本发明首次成功地提供了在病毒粒子表面表达来自于htlv的囊膜抗原蛋白的副粘病毒载体。本发明的表达htlv囊膜抗原蛋白的副粘病毒载体在粒子中包含有高水平的htlv囊膜抗原蛋白,无论是感染性病毒粒子,还是非感染性病毒粒子,均能够高效地诱导免疫反应。因此,在病毒粒子表面保持htlv囊膜抗原蛋白的本发明的感染性病毒载体及非感染性病毒粒子作为用于预防和/或治疗htlv感染或感染导致的疾病的疫苗是有用的。
基因组中缺失的囊膜蛋白基因、以及异种病原体的抗原蛋白直接适用于上述的非感染性病毒粒子的相关记载。例如,可以缺失f基因和/或hn基因,优选缺失至少缺失了f基因。另外,可以保有m基因。异种病原体的抗原蛋白可以是天然的蛋白质、其片段、或者包含该片段的融合蛋白等。异种病原体的抗原蛋白如上所述,优选为融合蛋白,其是膜蛋白质,在粒子的膜的外侧包含异种病原体的抗原、且在粒子的膜的内侧包含该副粘病毒的囊膜蛋白的粒子内部分。例如,优选为包含致病性病毒的囊膜蛋白的胞外结构域、和副粘病毒的囊膜蛋白的跨膜区域及细胞质区域的融合蛋白。胞外结构域、细胞质区域可以不是全长,可以是部分片段(例如,包含全长的30%以上、40%以上、50%以上、60%以上、70%以上、80%以上、90%以上或95%以上)。
为了由副粘病毒载体制造感染性粒子,可以在导入了病毒载体的细胞中供给病毒载体的基因组缺失的囊膜蛋白。该囊膜蛋白在病毒载体生产细胞中可以暂时性表达,也可以经常性表达。为了经常性表达,可以将编码该囊膜蛋白的基因导入细胞的染色体。为了暂时性表达,可以利用表达质粒载体、其它希望的载体导入编码该囊膜蛋白的基因,或者利用cre-loxp等系统使已整合至细胞的染色体中的该囊膜蛋白基因在特定的时刻表达。另外,为了制造非感染性粒子,将病毒载体导入不表达在病毒载体的基因组中缺失的囊膜蛋白的细胞。
另外,本发明涉及包含本发明的副粘病毒载体的组合物。该组合物例如为包含本发明的副粘病毒载体及希望的担载体的组合物。另外,本发明涉及包含本发明的非感染性粒子的组合物。该组合物例如为包含非感染性粒子及希望的担载体的组合物。作为担载体,可以是药学上能够允许的希望的担载体,可以列举例如:灭菌水、生理盐水、磷酸缓冲生理盐水(pbs)、缓冲液、培养液等可以使本发明的副粘病毒载体或非感染性粒子悬浮的希望的溶液等。另外,本发明涉及包含本发明的副粘病毒载体或非感染性粒子的疫苗制剂。本发明的疫苗制剂可以高效地诱导对病原体抗原蛋白的免疫应答,因此,作为用于对该病原体进行预防及治疗的疫苗是特别有用的。本发明的疫苗制剂例如可以制备成包含本发明的副粘病毒载体或非感染性粒子、以及希望的担载体的组合物。另外,可以进一步含有佐剂。
本发明的疫苗制剂的接种方式没有特别限制,例如,可以单次接种、多次接种使用。在多次接种中,可以对本发明的疫苗进行多次接种,或者也可以与其它类型的疫苗组合使用。例如,可以在初次免疫接种中,使用具有在接种后的细胞中产生感染性病毒粒子的能力的病毒载体作为疫苗制剂进行接种,在加强免疫接种中,接种包含本发明的非感染性粒子的疫苗制剂。由于非感染性粒子不产生感染性粒子,因此,安全性高,特别适于进行多次(例如,2次或2次以上、3次或3次以上、4次或4次以上、或者5次或5次以上)的加强免疫接种。
另外,本发明的疫苗制剂显示出对于扩大在进行了疫苗接种的个体中产生的抗体的交叉性也是有用的。例如,在使用本发明的疫苗制剂进行加强免疫接种的情况下,可以使用包含与初次免疫接种中使用的疫苗制剂所含有的抗原不同的抗原的疫苗制剂。例如,即使是相同的病原体的抗原,也可以使用与初次免疫接种中使用的抗原不同的蛋白质作为抗原,或者即使是相同的蛋白质,也可以使用与初次免疫接种中使用的抗原不同的部分作为抗原,或者可以使用与初次免疫接种中使用的抗原所属的病原体不同的病原体的蛋白质作为抗原。特别是即使是同种的病原体,也可以通过将与初次免疫接种中使用的疫苗制剂的来源病原体不同的株用于本发明的加强免疫接种,从而显著提高对病原体的交叉性(参照实施例10)。具体而言,例如在使用囊膜病毒的env蛋白质作为抗原的情况下,可以通过将使用非感染性粒子制造的本发明的疫苗制剂用于加强免疫接种,从而引起交叉性高的免疫反应,所述非感染性粒子包含与初次免疫接种中使用的env蛋白质的来源病毒株不同的株的env蛋白质作为抗原。
在将本发明的副粘病毒载体、非感染性粒子、包含该副粘病毒载体或非感染性粒子的疫苗、或者包含该副粘病毒载体或非感染性粒子的组合物等对动物给药时,其给药量可以根据疾病、患者的体重、年龄、性别、症状、给药目的、给药组合物的形态、给药方法等而适当确定。可以适当选择给药途径,可以列举例如:鼻腔给药、腹腔给药、肌肉给药、对肿瘤部位的局部给药等,但并不限定于此。另外,给药量可以根据对象动物、给药部位、给药次数等而适当调整。可以列举例如:1ng/kg~1000mg/kg、5ng/kg~800mg/kg、10ng/kg~500mg/kg、0.1mg/kg~400mg/kg、0.2mg/kg~300mg/kg、0.5mg/kg~200mg/kg、或1mg/kg~100mg/kg,但并不限定于此。另外,可以列举例如:以1×104~1×1015ciu/kg、1×105~1×1014ciu/kg、1×106~1×1013ciu/kg、1×107~1×1012ciu/kg、1×108~5×1011ciu/kg、1×109~5×1011ciu/kg、或1×1010~1×1011ciu/kg给药,以及以1×106~1×1017particles/kg、1×107~1×1016particles/kg、1×108~1×1015particles/kg、1×109~1×1014particles/kg、1×1010~1×1013particles/kg、1×1011~5×1012particles/kg、或5×1011~5×1012particles/kg给药,但并不限定于此。
包含本发明的载体的组合物的给药对象优选为哺乳动物(包括人及非人哺乳类)。具体包括:人、猴等非人灵长类、小鼠、大鼠等啮齿类、兔、山羊、绵羊、猪、牛、犬、猫等其它所有的哺乳动物。
实施例
[实施例1]搭载htlv-1囊膜蛋白的f缺失型仙台病毒(sev18+gp63ectof/δf、sev18+gp63ecto/δf)的构建
1)搭载gp63ectof基因的f缺失型仙台病毒制备用的质粒(psev18+gp63ectof/δf)的构建
gp63ecto基因片段的制备通过以plasmid(质粒)(phtlv-1、国立传染病研究所)为模板的pcr来进行,所述plasmid(质粒)搭载了使用pcr法从htlv-1感染者的血细胞dna扩增得到的htlv-1的前病毒序列。使用引物not1_gp63ecto_n(5’-atatgcggccgcgacgccaccatgggcaagttcctggccaccc-3’(序列号1))及引物gp63ectof_c(5’-cgtaatcacagtctctcttgagttagcttctctggcccactggc-3’(序列号2)),利用kod-plus-ver.2在94℃2分钟、使(98℃10秒钟、55℃30秒钟、68℃1.5分钟)的循环进行30个循环、68℃5分钟、4℃∞的条件下进行pcr,使用qiaquickpcrpurificationkit对扩增后的片段(约1.3kbp)进行了纯化。
f基因片段的制备通过以搭载于psev18+(wo00/070070;hasan,m.k.etal.,1997,j.generalvirology78:2813-2820;需要说明的是,“psev18+”也称为“psev18+b(+)”)的仙台病毒基因组cdna上的f基因作为模板的pcr来进行。使用引物gp63ectof_n(5’-gccagtgggccagagaagctaactcaagagagactgtgattacg-3’(序列号3))及引物sfenvf_eis_not1_c(5’-ttagcggccgcgatgaactttcaccctaagtttttcttactacggtcatcttttctcagccattgc-3’(序列号4)),利用kod-plus-ver.2在94℃2分钟、使(98℃10秒钟、55℃30秒钟、68℃1.5分钟)的循环进行30个循环、68℃5分钟、4℃∞的条件下进行pcr,使用qiaquickpcrpurificationkit对扩增后的f基因片段(约0.3kbp)进行了纯化。
gp63ectof基因片段的构建通过将利用上述的pcr制备的gp63ecto基因片段及f基因片段混合而作为模板的pcr来进行。使用引物not1_gp63ecto_n及引物sfenvf_eis_not1_c,利用kod-plus-ver.2在94℃2分钟、使(98℃10秒钟、55℃30秒钟、68℃1.5分钟)的循环进行30个循环、68℃2分钟、4℃∞的条件下进行pcr,使用qiaquickpcrpurificationkit对扩增后的gp63ectof基因片段(约1.6kbp)进行了纯化。该片段编码在gp63的胞外结构域(包含su和tm的一部分)的c端侧融合了sevf蛋白的tm区域及细胞质区域的融合蛋白。
接着,将noti处理后的上述gp63ectof片段(在两端具有noti位点)连接于在f缺失型仙台病毒基因组的np基因的上游具有搭载基因插入部位(noti切断部位)的psev18+/δf质粒(wo00/070070)的noti切断部位,在大肠杆菌中转化后进行克隆,通过测序选择碱基序列正确的克隆,得到了psev18+gp63ectof/δf质粒。需要说明的是,“δf”也表示为“df”。
2)搭载gp63ecto基因的f缺失型仙台病毒制备用的质粒(psev18+gp63ecto/δf)的构建
编码未与sevf蛋白的c末端融合的蛋白质的gp63ecto基因片段的制备通过以搭载于plasmid(质粒)(phtlv-1)的htlv-1的前病毒(seiki,m.etal.proc.natl.acad.sci.u.s.a.80(12),3618-3622(1983))作为模板的pcr来进行。使用引物not1_gp63ecto_n(序列号1)及引物gp63ecto_eis_not1_c(5’-atatgcggccgcgatgaactttcaccctaagtttttcttactacggtcaagcttctctggcccactggc-3’(序列号5)),利用kod-plus-ver.2在94℃2分钟、使(98℃10秒钟、55℃30秒钟、68℃1.5分钟)的循环进行30个循环、68℃5分钟、4℃∞的条件下进行pcr,使用qiaquickpcrpurificationkit对扩增后的gp63ecto片段(约1.3kbp)进行了纯化。
接着,将noti处理后的上述gp63ecto片段(在两端具有noti位点)连接于psev18+/δf质粒(wo00/070070)的noti切断部位,在大肠杆菌中转化后进行克隆,通过测序选择碱基序列正确的克隆,得到了psev18+gp63ectoδf质粒。
3)搭载gp63ectof基因的f缺失型仙台病毒(sev18+gp63ectof/δf)及搭载gp63ecto基因的f缺失型仙台病毒(sev18+gp63ecto/δf)的制备(再构建)
在转染的前一天将每1个孔5×105个细胞的293t/17细胞接种于6孔板,在37℃、5%co2条件下进行了培养。在该293t/17细胞中混合pcaggs-np(0.5μg)、pcaggs-p4c(-)(0.5μg)、pcaggs-l(tdk)(2μg)、pcaggs-t7(0.5μg)、pcaggs-f5r(0.5μg)(参照wo2005/071085)、以及上述制备的搭载gp63ectof基因的sev载体制备用质粒(psev18+gp63ectof/δf)(5.0μg)或搭载gp63ecto基因的sev载体制备用质粒(psev18+gp63ectof/δf)(5.0μg),使用transit-lt1(mirus)对上述的293t/17细胞进行了转染。在37℃、5%co2的条件下培养了2天后,用胰蛋白酶-edta将进行了转染的293t/17细胞从孔中剥离,在包含胰蛋白酶(2.5μg/ml)、青霉素、链霉素的mem培养基(以下,称为try/ps/mem)中进行悬浮后,接种于在其它孔中准备的表达仙台病毒f蛋白的辅助细胞llc-mk2/f/ad(li,h.-o.etal.,j.virology74.6564-6569(2000),wo00/70070)上,每3~4天进行培养基更换,并且继续进行培养。通过使用培养上清的一部分进行红细胞凝集反应,对培养上清中的病毒量进行监控,在获得了足够的红细胞凝集反应后,回收培养上清。使用qiaampviralrnaminikit从回收的培养上清中提取rna,通过以该rna作为模板的rt-pcr对搭载的基因(gp63ectof或gp63ecto)区域进行扩增,通过测序确认了得到的rt-pcr产物为正确的碱基序列。将包含回收的sev18+gp63ectof/δf病毒或sev18+gp63ecto/δf病毒的培养上清在液氮中快速冷冻后,在-80℃下保存。
4)搭载gp63ectof基因的f缺失型仙台病毒(sev18+gp63ectof/δf)及搭载gp63ecto基因的f缺失型仙台病毒(sev18+gp63ecto/δf)的扩增
使用12个t225细胞培养瓶在37℃、5%co2的条件下将辅助细胞llc-mk2/f/ad培养至半汇合,使用上述制备的包含sev18+gp63ectof/δf病毒或sev18+gp63ecto/δf病毒的培养上清以moi5.0感染了1小时。在感染后去除培养上清,添加每个细胞培养瓶30ml的包含重组胰蛋白酶(5.33mrpu/mltrypleselect、gibco)和庆大霉素的mem培养基(以下,称为try/ge/mem),在32℃、5%co2条件下进行培养。通过适当地采集一部分培养上清进行红细胞凝集分析来确认病毒生产的情况,在获得了足够的红细胞凝集反应后,将回收的培养上清作为sev18+gp63ectof/δf病毒及sev18+gp63ecto/δf病毒的感染性粒子的溶液。
[实施例2]搭载htlv-1囊膜蛋白的f缺失型仙台病毒非感染性粒子(sev18+gp63ectof/δfnvp)的制备
使用12个t225细胞培养瓶在37℃、5%co2的条件下将llc-mk2细胞培养至半汇合,使用上述制备的包含sev18+gp63ectof/δf病毒或sev18+gp63ecto/δf病毒的培养上清以moi5.0感染了1小时。在感染后去除培养上清,添加每个细胞培养瓶30ml的try/ge/mem培养基,在32℃、5%co2条件下进行培养。通过适当地采集一部分培养上清进行红细胞凝集分析来确认病毒生产的情况,在获得了足够的红细胞凝集反应后,将回收的培养上清作为非感染性粒子sev18+gp63ectof/δf/nvp及sev18+gp63ecto/δf/nvp的溶液。
[实施例3]搭载hiv-1囊膜蛋白的f缺失型仙台病毒的构建
1)搭载sfenvf基因的sev载体制备用的质粒(psev18+sfenvf/tsδf)的构建
sfenv的制备通过以搭载了hiv-1bg505株的env基因的质粒(wo2016/069518)作为模板的pcr来进行。使用引物sfenv_n1(5’-caacatcactactggttgttctcaccacattggtctcgtgtcaggctagcgcagagaatttgtgggtaacag-3’(序列号6))及引物env_f_c(5’-cacagtctctcttgagttcttaatataccagagcc-3’(序列号7)),利用kod-plus-ver.2在94℃2分钟、使(98℃10秒钟、55℃30秒钟、68℃2分钟)的循环进行30个循环、68℃5分钟、4℃∞的条件下进行pcr,使用qiaquickpcrpurificationkit对扩增后的片段(约2kbp)进行了纯化。
f基因片段的制备通过以搭载于psev18+的仙台病毒基因组cdna上的f基因作为模板的pcr来进行。使用引物envf_n(5’-ggctctggtatattaagaactcaagagagactgtg-3’(序列号8))及引物sfenvf_eis_not1_c(序列号4)),利用kod-plus-ver.2在94℃2分钟、使(98℃10秒钟、55℃30秒钟、68℃2分钟)的循环进行30个循环、68℃5分钟、4℃∞的条件下进行pcr,使用qiaquickpcrpurificationkit对扩增后的f基因片段(约0.3kbp)进行了纯化。
接着,sfenvf基因片段的构建通过将利用上述的pcr制备的sfenv基因片段及f基因片段混合而作为模板的pcr来进行。使用引物sf_n2(5’-taagcggccgccaaggttcacttatgacagcatatatccagagatcacagtgcatctcaacatcactactggttg-3’(序列号9))及引物sfenvf_eis_not1_c(序列号4),利用kod-plus-ver.2在94℃2分钟、使(98℃10秒钟、55℃30秒钟、68℃2.5分钟)的循环进行30个循环、68℃5分钟、4℃∞的条件下进行pcr,使用qiaquickpcrpurificationkit对扩增后的sfenvf基因片段(约2.5kbp)进行了纯化。该片段编码在hiv-1囊膜蛋白的胞外结构域(包含su和tm的一部分)的c端侧融合了sevf蛋白的tm区域及细胞质区域的融合蛋白。
接着,对纯化后的sfenvf片段(在两端具有noti位点)进行noti处理,连接于上述的psev18+/δf质粒的noti切断部位,在大肠杆菌中转化后进行克隆,通过测序选择碱基序列正确的克隆,得到了psev18+sfenvf/δf质粒。
2)搭载sfenvf基因的sev载体(sev18+sfenvf/δf)的制备(再构建)
在转染的前一天将每1个孔5×105个细胞的293t/17细胞接种于6孔板,在37℃、5%co2条件下进行了培养。在该293t/17细胞中混合pcaggs-np(0.5μg)、pcaggs-p4c(-)(0.5μg)、pcaggs-l(tdk)(2μg)、pcaggs-t7(0.5μg)、pcaggs-f5r(0.5μg)(参照wo2005/071085)、以及上述制备的搭载sfenvf基因的sev载体制备用质粒(psev18+sfenvf/δf)(5.0μg),使用transit-lt1(mirus)对上述的293t/17细胞进行了转染。在37℃、5%co2的条件下培养了2天后,用胰蛋白酶-edta将进行了转染的293t/17细胞从孔中剥离,在try/ps/mem培养基中进行悬浮后,接种于在其它孔中准备的辅助细胞llc-mk2/f/ad(li,h.-o.etal.,j.virology74.6564-6569(2000),wo00/70070)上,每3~4天进行培养基更换,并且继续进行培养。通过使用培养上清的一部分进行红细胞凝集反应,对培养上清中的病毒量进行监控,在获得了足够的红细胞凝集反应后,回收培养上清。使用qiaampviralrnaminikit从回收的培养上清中提取rna,通过以该rna作为模板的rt-pcr对搭载的基因(sfenvf或sfenv)区域进行扩增,通过测序确认了得到的rt-pcr产物为正确的碱基序列。将包含回收的sev18+sfenvf/δf病毒的培养上清在液氮中快速冷冻后,在-80℃下保存。
3)搭载sfenvf基因的f缺失型仙台病毒(sev18+sfenvf/δf)的扩增
使用12个t225细胞培养瓶在37℃、5%co2的条件下将辅助细胞llc-mk2/f/ad培养至半汇合,使用上述制备的包含sev18+sfenvf/δf病毒的培养上清以moi5.0感染了1小时。在感染后去除培养上清,添加每个细胞培养瓶30ml的try/ge/mem培养基,在32℃、5%co2条件下进行培养。通过适当地采集一部分培养上清进行红细胞凝集分析来确认病毒生产的情况,在获得了足够的红细胞凝集反应后,将回收的培养上清作为sev18+sfenvf/δf病毒的感染性粒子的溶液。
[实施例4]搭载hiv-1囊膜蛋白的f缺失型仙台病毒非感染性粒子的制备
使用12个t225细胞培养瓶在37℃、5%co2的条件下将llc-mk2细胞培养至半汇合,使用上述制备的包含sev18+sfenvf/δf病毒的培养上清以moi5.0感染了1小时。在感染后去除培养上清,添加每个细胞培养瓶30ml的try/ge/mem培养基,在32℃、5%co2条件下进行培养。通过适当地采集一部分培养上清进行红细胞凝集分析来确认载体生产的情况,在获得了足够的红细胞凝集反应后,将回收的培养上清作为非感染性粒子sev18+sfenvf/δf/nvp的溶液。
[实施例5]利用蛋白质印迹法进行的搭载htlv-1囊膜蛋白的f缺失型仙台病毒载体的感染性粒子和非感染性粒子的分析
使用蛋白质印迹法(wb)对搭载htlv-1囊膜蛋白的f缺失型仙台病毒载体的感染性粒子(sev18+gp63ectof/df)和非感染性粒子(sev18+gp63ectof/df/nvp)进行分析。用丙烯酰胺凝胶(5-20%wako)对各检体15μl(图2)或以总蛋白质质量计1μg(图3)进行电泳(40ma,80min),然后,使用电印迹法(60v,2hr)转印至尼龙膜。将膜在5%skimmilk/0.05%tween/tbst中于4℃下进行封闭过夜后,使由0.05%tween/tbst稀释至2000倍的一级抗体(抗htlv-1gp46抗体、abcamab9086)在室温下反应1小时,在清洗后,使由0.05%tween/tbst稀释至2000倍的二级抗体(hrp标记抗小鼠ig抗体、biosourcecat#:ami4704)在室温下反应1小时。在0.05%tween/tbst中清洗(5min×3次)后,使用eclprime(ge)进行检测(图2,图3)。与感染性粒子(sev18+gp63ectof/df)相比,非感染性粒子(sev18+gp63ectof/df/nvp)上的gp63ectof蛋白的量显著升高。
[实施例6]利用蛋白质印迹法进行的搭载hiv-1囊膜蛋白的f缺失型仙台病毒载体的感染性粒子和非感染性粒子的分析
使用蛋白质印迹法(wb)对搭载hiv-1囊膜蛋白的f缺失型仙台病毒载体的感染性粒子(sev18+sfenvf/df)和非感染性粒子(sev18+sfenvf/δf/nvp)进行了分析。用丙烯酰胺凝胶(12.5%wako)对各检体进行电泳(30ma,80min)后,使用电印迹法(60v,2hr)转印至尼龙膜。将膜在5%skimmilk/0.05%tween/tbst中于4℃下进行封闭过夜后,使由0.05%tween/tbst稀释至2000倍的一级抗体(图4系列a:抗hiv-1gp120抗体(aaltocat#:d7324)、图4系列b:抗仙台病毒抗体(株式会社爱迪药业))在室温下反应1小时,在清洗后,使由0.05%tween/tbst稀释的二级抗体(图4a:hrp标记抗绵羊ig抗体(invitrogencat#:618620)稀释10,000倍、图4b:hrp标记抗兔ig抗体(biosourcecat#:ali4404)稀释1,000倍)在室温下反应1小时。在0.05%tween/tbst中清洗(5min×3次)后,使用eclprime(ge)进行检测(图4)。与感染性粒子(sev18+sfenvf/df)相比,非感染性粒子(sev18+sfenvf/δf/nvp)上的sfenvf蛋白的量显著升高。
[实施例7]表达htlv-1囊膜蛋白的非感染性粒子的加强免疫效果
使用表达htlv-1env的gp63的胞外结构域与仙台病毒f蛋白的细胞质结构域的融合蛋白gp63ectof的f基因缺失型仙台病毒载体的感染性粒子(sev18+gp63ectof/df)和非感染性粒子(sev18+gp63ectof/df/nvp)进行了小鼠(balb/c)的免疫诱导实验。对于第1组(n=6、se组),仅进行了1次感染性粒子(sev18+gp63ectof/df)接种(week0),对于第2组(n=6、se/vlp群),在进行了1次感染性粒子(sev18+gp63ectof/df)接种(week0)后,进行了2次非感染性粒子(sev18+gp63ectof/df/nvp)接种(weeks4&5)。在感染性粒子(sev18+gp63ectof/df)接种中,经鼻腔接种了2.4×107ciu(0.02ml),在非感染性粒子(sev18+gp63ectof/df/nvp)接种中,肌肉内接种了1.1×1010particles(0.1ml)。使用初次接种(sev18+gp63ectof/df)后第8周进行安乐死时采集的血液,通过westernblot(wb)及elisa测定了抗htlvenv结合抗体效价。
在利用elisa进行抗体效价测定时,将htlv-1gp46蛋白(abcam,100ng/0.05ml/well)固定于96孔板(corningcostar#3690)的各孔中,用3%bsa/pbs进行封闭后,加入小鼠血浆,在进行过氧化物酶标记抗小鼠igg抗体反应、使用了tmb底物的显色反应之后,用读板仪测定了吸光度(od450)。其结果是,以使用了稀释1,000倍的血浆的数据(去除背景后的od450测定值的各组的平均值)计,第2组(0.256)显示出第1组(0.066)的3.9倍的值(图5)。
在利用wb进行的抗体效价测定中,使用problothtlv-1试剂盒(fujirebio#204450)按照其实验方案(使用生物素标记抗小鼠igg抗体)对htlv-1envgp46结合抗体进行了检测。其结果是,对于wb的检测极限稀释滴度(各组几何平均值)而言,与第1组(7.6×101)相比,第2组(6.5×102)显示出高值(8.5倍)(图6)。
[实施例8]表达hiv-1囊膜蛋白的非感染性粒子的加强免疫效果
使用表达hiv-1(bg505)env的gp160的胞外结构域与仙台病毒f蛋白的细胞质结构域的融合蛋白sfenv-f的f缺失型仙台病毒载体的感染性粒子(sev18+sfenvf/df)和非感染性粒子(sev18+sfenvf/df/nvp)进行了小鼠(balb/c)的免疫诱导实验。对于第1组(n=4、se组),仅进行了2次感染性粒子(sev18+sfenvf/df)接种(weeks0&1),对于第2组(n=4[初始为n=5,但因week1的体重减轻而去除了1只]、se/vlp组),在进行了2次感染性粒子(sev18+sfenvf/df)接种(weeks0&1)后,进行了2次非感染性粒子(sev18+sfenvf/df/nvp)接种(weeks4&5)。对于第3组(n=5、se/vlp/vlp组),在进行了2次感染性粒子(sev18+sfenvf/df)接种(weeks0&1)后,进行了4次非感染性粒子(sev18+sfenvf/df/nvp)接种(weeks4,5,8&9)。在感染性粒子(sev18+sfenvf/df)接种中,经鼻腔接种了5.0×107ciu(0.02ml),在非感染性粒子(sev18+sfenvf/df/nvp)接种中,肌肉内接种了2.0×109particles(0.1ml)。使用初次感染性粒子(sev18+sfenvf/df)接种后第8周(第1组、第2组)或第12周(第3组)在进行安乐死时采集的血液,通过elisa测定了抗hiv-1envgp120结合抗体效价。
在抗体效价测定中,将hiv-1bg505gp120蛋白(50ng/0.05ml/well)固定于96孔板(corningcostar#3690)的各孔中,用3%bsa/pbs进行封闭后,加入小鼠血浆,在进行过氧化物酶标记抗小鼠igg抗体反应、使用了tmb底物的显色反应之后,用读板仪测定了吸光度(od450)。其结果是,以使用了稀释12,500倍的血浆的数据(去除背景后的od450测定值的各组的平均值)计,第2组(0.475)显示出第1组(0.157)的3.0倍的值,第3组(1.242)显示出第1组的8.0倍的值(图7)。
[实施例9]表达htlv-1囊膜蛋白的非感染性粒子的抗htlv抗体加强免疫效果
使用表达htlv-1env的gp63的胞外结构域与仙台病毒f蛋白的细胞质结构域的融合蛋白gp63ectof的f基因缺失型仙台病毒载体的感染性粒子(sev18+gp63ectof/df)和非感染性粒子(sev18+gp63ectof/df/nvp)进行了小鼠(balb/c)的免疫诱导实验。对于第1组(n=6、sev/sev组),进行了4次感染性粒子(sev18+gp63ectof/df)接种(week0,4,8&9),对于第2组(n=6、sev/nvp组),进行了1次感染性粒子(sev18+gp63ectof/df)接种(week0)及3次非感染性粒子(sev18+gp63ectof/df/nvp)接种(weeks4,8&9)。另外,作为阴性对照,对于第3组(n=4、pbs组),进行了4次pbs接种(week0,4,8&9)。在感染性粒子(sev18+gp63ectof/df)接种中,肌肉内接种了5.0×107ciu(0.05ml),在非感染性粒子(sev18+gp63ectof/df/nvp)接种中,肌肉内接种了5.0×109particles(0.05ml)。使用初次接种后第11周在进行安乐死时采集的血液,通过elisa测定了抗htlvenv结合抗体效价。
在利用elisa进行的抗体效价测定中,将htlv-1gp46蛋白(abcam,200ng/0.05ml/well)固定于96孔板(corningcostar#3690)的各孔中,用3%bsa/pbs进行封闭后,加入小鼠血浆,在进行过氧化物酶标记抗小鼠igg抗体反应、使用了tmb底物的显色反应之后,用读板仪测定了吸光度(od450)。其结果是,在使用了稀释8,000倍的血浆的数据(od450测定值的平均)中,第1、2组均显示出很高的值,特别是第2组(sev/nvp组)与对照组相比显示出显著高的值。另外,在终点滴度(od450值超过背景的最大稀释倍率)的比较中,第2组(sev/nvp组)比第1组(sev/sev组)显示出显著高的值(图8)。根据以上的结果表明,在不具有感染性这一点考虑安全性高的表达gp63ectof的非感染性粒子(nvp)接种中,比表达gp63ectof的感染性粒子(sev)接种显示出具有更高的抗htlv-1env抗体加强免疫能力。
[实施例10]搭载hiv-1ad8-eo株囊膜蛋白的f缺失型仙台病毒的构建
1)搭载来自于ad8eo株的env的胞外结构域sfad8eoenvf基因的sev载体制备用质粒(psev18+sfad8eoenvf/tsδf)的构建
来自于ad8eo株(hiv-1亚型b)的env的胞外结构域sfad8eoenv的制备通过以搭载了hiv-1ad8eo株的env基因的质粒(shingai,m.etal.,2012,procnatlacadsciu.s.a.109(48):19769-19774)、hiv-1bg505株的sfenvf、或各pcr的产物作为模板的pcr,按照图9所示的3步pcr来进行。作为第一步,以ad8eo株env基因作为模板,使用引物sf_ad8-eo_n(5’-ggctagcgcagagaatttgtgggtcacag-3’(序列号18))及引物ad8-eo_a450g_c(5’-tattgaaagagcagttctttatttctcctc-3’(序列号19))的组合(1)、引物ad8-eo_a450g_n(5’-gaggagaaataaagaactgctctttcaata-3’(序列号20))及引物ad8-eo_a831g_c(5’-ctgtactattatgttctttgtattgtctg-3’(序列号21))的组合(2)、引物ad8-eo_a831g_n(5’-cagacaatacaaagaacataatagtacag-3’(序列号22))及引物ad8-eo_a1506g_c(5’-ctgtactattatgttctttgtattgtctg-3’(序列号21))的组合(3)、引物ad8-eo_a1506g_n(5’-cagacaatacaaagaacataatagtacag-3’(序列号22))及引物f_c(5’-ctctcttgagttctttatataccacagcc-3’(序列号23))的组合(4),另外,以hiv-1bg505株的sfenvf作为模板,使用引物not1_sf_n(5’-atatgcggccgcgacgccaccatgacagcatatatccagag-3’(序列号24))及引物sf_ad8-eo_c(5’-cccacaaattctctgcgctagcctgacacg-3’(序列号25))组合(5)、引物f_n(5’-tataaagaactcaagagagactgtgattac-3’(序列号26))及引物eis-noti-3r(5’-ctgcggccgcgatgaactttcaccctaagtttttc-3’(序列号27))的组合(6),利用kod-plus-ver.2在94℃2分钟、使(98℃10秒钟、55℃30秒钟、68℃2分钟)的循环进行30个循环、68℃5分钟、4℃∞的条件下进行pcr,使用qiaquickpcrpurificationkit对扩增后的片段(分别为(1)约0.4kbp、(2)约0.4kbp、(3)约0.7kbp、(4)约0.54kbp、(5)约0.13kbp、(6)约0.26kbp)进行了纯化。作为第二步,以(1)及(5)作为模板,使用引物not1_sf_n(5’-atatgcggccgcgacgccaccatgacagcatatatccagag-3’(序列号:24))及引物ad8-eo_a450g_c(5’-tattgaaagagcagttctttatttctcctc-3’(序列号:19))的组合(7),以(2)及(3)作为模板,使用引物ad8-eo_a450g_n(5’-gaggagaaataaagaactgctctttcaata-3’(序列号:20))及引物ad8-eo_a1506g_c(5’-ctgtactattatgttctttgtattgtctg-3’(序列号:21))的组合(8),以(4)及(6)作为模板,使用引物ad8-eo_a1506g_n(5’-cagacaatacaaagaacataatagtacag-3’(序列号:22))及引物eis-noti-3r(5’-ctgcggccgcgatgaactttcaccctaagtttttc-3’(序列号:27))的组合(9),利用kod-plus-ver.2在94℃2分钟、使(98℃10秒钟、55℃30秒钟、68℃2分30秒)的循环进行30个循环、68℃5分钟、4℃∞的条件下进行pcr,使用qiaquickpcrpurificationkit对扩增后的片段(分别为(7)约0.5kbp、(8)约1.1kbp、(9)约0.7kbp)进行了纯化。作为第三步,以(7)、(8)及(9)作为模板,使用引物not1_sf_n(5’-atatgcggccgcgacgccaccatgacagcatatatccagag-3’(序列号:24))及引物eis-noti-3r(5’-ctgcggccgcgatgaactttcaccctaagtttttc-3’(序列号:27))的组合(10),利用kod-plus-ver.2在94℃2分钟、使(98℃10秒钟、55℃30秒钟、68℃2分30秒)的循环进行40个循环、68℃5分钟、4℃∞的条件下进行pcr,对扩增后的片段((10)约2.3kbp)使用qiaquickpcrpurificationkit,纯化了sfad8eoenvf基因片段。
该sfad8eoenvf基因片段编码在hiv-1ad8-eo株囊膜蛋白的胞外结构域(包含su和tm的一部分)的c端侧融合了sevf蛋白的tm区域及细胞质区域的融合蛋白。
接着,对纯化后的sfad8eoenvf片段(在两端具有noti位点)进行noti处理,连接于上述的psev18+/δf质粒的noti切断部位,在大肠杆菌中转化后进行克隆,通过测序选择碱基序列正确的克隆,得到了psev18+sfad8eoenvf/δf质粒。
2)搭载sfad8eoenvf基因的sev载体(sev18+sfad8eoenvf/δf)的制备(再构建)
在转染的前一天将每1个孔5×105个细胞的293t/17细胞接种于6孔板,在37℃、5%co2条件下进行了培养。在该293t/17细胞中混合pcaggs-np(0.5μg)、pcaggs-p4c(-)(0.5μg)、pcaggs-l(tdk)(2μg)、pcaggs-t7(0.5μg)、pcaggs-f5r(0.5μg)(参照wo2005/071085)、以及上述制备的搭载sfenvf基因的sev载体制备用质粒(psev18+sfad8eoenvf/δf)(5.0μg),使用transit-lt1(mirus)对上述的293t/17细胞进行了转染。在37℃、5%co2的条件下培养了2天后,用胰蛋白酶-edta将进行了转染的293t/17细胞从孔中剥离,在try/ps/mem培养基中进行悬浮后,接种于在其它孔中准备的辅助细胞llc-mk2/f/ad(li,h.-o.etal.,j.virology74.6564-6569(2000),wo00/70070)上,每3~4天进行培养基更换,并且继续进行培养。通过使用培养上清的一部分进行红细胞凝集反应,对培养上清中的病毒量进行监控,在获得了足够的红细胞凝集反应后,回收培养上清。使用qiaampviralrnaminikit从回收的培养上清中提取rna,通过以该rna作为模板的rt-pcr对搭载的基因(sfad8eoenvf)区域进行扩增,通过测序确认了得到的rt-pcr产物为正确的碱基序列。将包含回收的sev18+sfad8eoenvf/δf病毒的培养上清在液氮中快速冷冻后,在-80℃下保存。
3)搭载sfad8eoenvf基因的f缺失型仙台病毒(sev18+sfad8eoenvf/δf)的扩增
使用12个t225细胞培养瓶在37℃、5%co2的条件下将辅助细胞llc-mk2/f/ad培养至半汇合,使用上述制备的包含sev18+sfad8eoenvf/δf病毒的培养上清以moi5.0感染了1小时。在感染后去除培养上清,添加每个细胞培养瓶30ml的try/ge/mem培养基,在32℃、5%co2条件下进行培养。通过适当地采集一部分培养上清进行红细胞凝集分析来确认病毒生产的情况,在获得了足够的红细胞凝集反应后,将回收的培养上清作为sev18+sfad8eoenvf/δf病毒的感染性粒子的溶液。
[实施例11]搭载hiv-1ad8-eo株囊膜蛋白的f缺失型仙台病毒非感染性粒子的制备
使用12个t225细胞培养瓶在37℃、5%co2的条件下将llc-mk2细胞培养至半汇合,使用上述制备的包含sev18+sfad8eoenvf/δf病毒的培养上清以moi5.0感染了1小时。在感染后去除培养上清,添加每个细胞培养瓶30ml的try/ge/mem培养基,在32℃、5%co2条件下进行培养。通过适当地采集一部分培养上清进行红细胞凝集分析来确认载体生产的情况,在获得了足够的红细胞凝集反应后,将回收的培养上清作为非感染性粒子sev18+sfad8eoenvf/δf/nvp的溶液。
[实施例12]表达hiv-1囊膜蛋白的非感染性粒子的抗hiv-1抗体加强免疫效果
使用表达hiv-1env的gp160的胞外结构域与仙台病毒f蛋白的细胞质结构域的融合蛋白sfenv-f的f缺失型仙台病毒载体的感染性粒子(sev18+sfenvf/df)和非感染性粒子(sev18+sfenvf/df/nvp)进行了小鼠(balb/c)的免疫诱导实验。对于envf,使用了利用来自于bg505株(hiv-1亚型a)的胞外结构域得到的蛋白质(bg505envf)和利用来自于ad8eo株(hiv-1亚型b)的胞外结构域得到的蛋白质(ad8eoenvf)。第1组(n=4、pbs组)作为阴性对照,进行了4次pbs接种(week0,4,8&9)。对于第2组(n=6、sev/sev-bg505组),进行了4次表达bg505envf的感染性粒子(sev18+sfbg505envf/df)接种的(week0,4,8&9),对于第3组(n=6、sev/nvp-bg505组),在进行了1次表达bg505envf的感染性粒子(sev18+sfbg505envf/df)接种(weeks0)后,进行了3次表达bg505envf的非感染性粒子(sev18+sfbg505envf/df/nvp)接种(weeks4,8&9)。进而,为了对使用不同的抗原进行加强免疫所带来的抗体的交叉性扩大效果进行研究,对于第4组,在进行了2次表达bg505envf的感染性粒子(sev18+sfbg505envf/df)接种的(week0&4)后,进行了2次表达ad8eoenvf的感染性粒子(sev18+sfad8eoenvf/df)接种(week8&9),对于第5组,在进行了1次表达bg505envf的感染性粒子(sev18+sfbg505envf/df)接种(weeks0)及1次表达bg505envf的非感染性粒子(sev18+sfbg505envf/df/nvp)接种(weeks4)后,进行了2次表达ad8eoenvf的非感染性粒子(sev18+sfad8eoenvf/df/nvp)接种(weeks8&9)。在感染性粒子(sev18+sfbg505envf/df或sev18+sfad8eoenvf/df)接种中,肌肉内接种了5.0×107ciu(0.05ml),在非感染性粒子(sev18+sfbg505envf/df/nvp或sev18+sfad8eoenvf/df/nvp)接种中,肌肉内接种了5.0×109particles(0.05ml)。使用初次接种使用11周进行安乐死时采集的血液,通过elisa测定了抗hiv-1env(bg505gp120及balgp120)结合抗体效价。
在抗体效价测定中,将hiv-1bg505gp120蛋白(50ng/0.05ml/well)固定于96孔板(corningcostar#3690)的各孔中,用3%bsa/pbs进行封闭后,加入小鼠血浆,在进行过氧化物酶标记抗小鼠igg抗体反应、使用了tmb底物的显色反应之后,用读板仪测定了吸光度(od450)。抗bg505gp120抗体elisa的结果是,对于od450值的平均值及终点滴度而言,第3组(sev/nvp-bg505组)显示出与第2组(sev/sev-bg505组)同等或更高的值,表达sfenvf的非感染性粒子(nvp)显示出表达sfenvf的感染性粒子(sev)的同等以上的抗体加强免疫能力(图10)。
为了对表达ad8eoenvf的非感染性粒子的加强免疫接种所带来的抗体的交叉性扩大效果进行研究,使用与ad8eo同样属于hiv-1亚型b的balgp120蛋白,进行了相同的抗gp120抗体elisa。其结果是,对于终点滴度而言,用表达ad8eoenvf的感染性粒子进行了加强免疫的第4组(sev/sev-ad8eo组)显示出高值,用表达ad8eoenvf的非感染性粒子进行了加强免疫的第5组(sev/nvp-ad8eo组)显示出与第4组同等的值。另外,对bg505终点滴度与bal终点滴度之比的值进行了分析,结果是,第4、5组比用bg505envf表达粒子进行了加强免疫的第2、3组显示出更高的值,特别是第5组显示出高值(图11)。根据以上的结果表明,通过使用了来自不同株的抗原的表达sfenvf的非感染性粒子的加强免疫接种,能够有效地诱导交叉性高的抗体。
虽然对本发明的优选方式进行了详细说明,但对于本领域技术人员而言,这些方式可以进行变更是显而易见的。因此,本发明包括能够以本说明书中详细记载以外的方法、方式进行实施的方案。即,本发明包括与附带的“权利要求书”的技术思想或其本质部分相同的范围所包含的所有变更。
包括这里所述的专利及专利申请说明书在内的全部出版物中记载的内容通过在此进行引用,从而以与其全部内容公开的相同程度引入本说明书。
工业实用性
与现有的感染性粒子相比,本发明的非感染性粒子保持了高安全性、并且以更高的水平保持了抗原蛋白。可以认为,本发明的非感染性粒子所具有的这样的特征印证了作为对于以病毒为代表的病原体等的疫苗的有利性,在传染病的预防、治疗中是极其有用的。
序列表
<110>国立传染病研究所长代表日本国
株式会社爱迪药业
<120>使用了非感染性副粘病毒粒子的传染病疫苗
<130>d4-a1601p
<150>jp2016-224475
<151>2016-11-17
<160>29
<170>patentinversion3.5
<210>1
<211>43
<212>dna
<213>人工序列
<220>
<223>人工合成的引物序列
<400>1
atatgcggccgcgacgccaccatgggcaagttcctggccaccc43
<210>2
<211>44
<212>dna
<213>人工序列
<220>
<223>人工合成的引物序列
<400>2
cgtaatcacagtctctcttgagttagcttctctggcccactggc44
<210>3
<211>44
<212>dna
<213>人工序列
<220>
<223>人工合成的引物序列
<400>3
gccagtgggccagagaagctaactcaagagagactgtgattacg44
<210>4
<211>66
<212>dna
<213>人工序列
<220>
<223>人工合成的引物序列
<400>4
ttagcggccgcgatgaactttcaccctaagtttttcttactacggtcatcttttctcagc60
cattgc66
<210>5
<211>69
<212>dna
<213>人工序列
<220>
<223>人工合成的引物序列
<400>5
atatgcggccgcgatgaactttcaccctaagtttttcttactacggtcaagcttctctgg60
cccactggc69
<210>6
<211>72
<212>dna
<213>人工序列
<220>
<223>人工合成的引物序列
<400>6
caacatcactactggttgttctcaccacattggtctcgtgtcaggctagcgcagagaatt60
tgtgggtaacag72
<210>7
<211>35
<212>dna
<213>人工序列
<220>
<223>人工合成的引物序列
<400>7
cacagtctctcttgagttcttaatataccagagcc35
<210>8
<211>35
<212>dna
<213>人工序列
<220>
<223>人工合成的引物序列
<400>8
ggctctggtatattaagaactcaagagagactgtg35
<210>9
<211>75
<212>dna
<213>人工序列
<220>
<223>人工合成的引物序列
<400>9
taagcggccgccaaggttcacttatgacagcatatatccagagatcacagtgcatctcaa60
catcactactggttg75
<210>10
<211>442
<212>prt
<213>人t细胞白血病病毒1型(humant-cellleukemiavirustype1)
<400>10
metglylyspheleualathrleuileleuphepheglnphecyspro
151015
leuilepheglyasptyrserprosercyscysthrleuthrilegly
202530
valsersertyrhisserlysprocysasnproalaglnprovalcys
354045
sertrpthrleuaspleuleualaleuseralaaspglnalaleugln
505560
proprocysproasnleuvalsertyrsersertyrhisalathrtyr
65707580
serleutyrleupheprohistrpthrlyslysproasnargasngly
859095
glyglytyrtyrseralasertyrseraspprocysserleulyscys
100105110
protyrleuglycysglnsertrpthrcysprotyrthrglyalaval
115120125
serserprotyrtrplyspheglnhisaspvalasnphethrglnglu
130135140
valserargleuasnileasnleuhispheserlyscysglyphepro
145150155160
pheserleuleuvalaspalaproglytyraspproiletrppheleu
165170175
asnthrgluproserglnleuproprothralaproproleuleupro
180185190
hisserasnleuasphisileleugluproserileprotrplysser
195200205
lysleuleuthrleuvalglnleuthrleuglnserthrasntyrthr
210215220
cysilevalcysileaspargalaserleuserthrtrphisvalleu
225230235240
tyrserproasnvalservalproserserserserthrproleuleu
245250255
tyrproserleualaleuproalaprohisleuthrleupropheasn
260265270
trpthrhiscyspheaspproglnileglnalailevalserserpro
275280285
cyshisasnserleuileleupropropheserleuserprovalpro
290295300
thrleuglyserargserargargalavalprovalalavaltrpleu
305310315320
valseralaleualametglyalaglyvalalaglyglyilethrgly
325330335
sermetserleualaserglylysserleuleuhisgluvalasplys
340345350
aspileserglnleuthrglnalailevallysasnhislysasnleu
355360365
leulysilealaglntyralaalaglnasnargargglyleuaspleu
370375380
leuphetrpgluglnglyglyleucyslysalaleuglngluglncys
385390395400
argpheproasnilethrasnserhisvalproileleuglngluarg
405410415
proproleugluasnargvalleuthrglytrpglyleuasntrpasp
420425430
leuglyleuserglntrpalaarggluala
435440
<210>11
<211>70
<212>prt
<213>仙台病毒(sendaivirus)
<400>11
asnserarggluthrvalilethrileilevalvalmetvalvalile
151015
leuvalvalileilevalileileilevalleutyrargleuargarg
202530
sermetleumetglyasnproaspaspargileproargaspthrtyr
354045
thrleugluprolysilearghismettyrthrasnglyglypheasp
505560
alametalaglulysarg
6570
<210>12
<211>1605
<212>dna
<213>人工序列
<220>
<223>编码gp63ectof的核苷酸序列
<400>12
atatgcggccgcgacgccaccatgggcaagttcctggccaccctgatcctgttcttccag60
ttctgccccctgatcttcggcgactacagccccagctgctgcaccctgaccatcggcgtg120
tccagctaccacagcaagccctgcaaccccgcccagcccgtgtgcagctggacactggat180
ctgctggccctgagcgccgaccaggccctgcagcctccttgccccaacctggtgtcctac240
agcagctaccacgccacctacagcctgtacctgttcccccactggaccaagaagcccaac300
cggaacggcggaggctactacagcgcctcctacagcgacccctgctccctgaagtgcccc360
tacctgggctgccagagctggacctgcccttacacaggcgccgtgtccagcccctactgg420
aagttccagcacgacgtgaacttcacccaagaagtgtcccggctgaacatcaacctgcac480
ttcagcaagtgcggcttccccttctccctgctggtggacgcccctggctacgaccctatc540
tggttcctgaacaccgagcccagccagctgccccctactgctcctcctctgctgccccac600
tccaacctggaccatatcctggaacccagcatcccctggaagtccaagctgctgacactg660
gtgcagctgaccctgcagagcaccaactacacctgtatcgtgtgcatcgaccgggccagc720
ctgagcacctggcacgtgctgtacagccccaacgtgtccgtgcccagcagcagctccacc780
cccctgctgtaccctagtctggccctgcctgccccccacctgacactgcccttcaactgg840
acccactgcttcgacccccagatccaggccatcgtgtctagcccctgccacaacagcctg900
atcctgccccccttcagcctgtcccctgtgcccaccctgggctccagatctagaagggcc960
gtgcccgtggccgtgtggctggtgtctgctctggctatgggagccggcgtggccggtggc1020
atcacaggcagcatgagcctggcctccggcaagagcctgctgcacgaggtggacaaggac1080
atcagccagctgacccaggccattgtgaagaaccacaagaacctgctgaagatcgcccag1140
tacgccgcccagaacagacggggcctggacctgctgttttgggagcagggcggcctgtgc1200
aaagccctgcaagaacagtgccggttccccaacatcaccaacagccacgtgcccatcctg1260
caagaaagaccccccctggaaaaccgggtgctgaccggctggggcctgaactgggatctg1320
ggcctgagccagtgggccagagaagctaactcaagagagactgtgattacgatcatagta1380
gttatggtcgtaatattggtggtcattatagtgatcatcatcgtgctttatagactcaga1440
aggtcaatgctaatgggtaatccagatgaccgtataccgagggacacatacacattagag1500
ccgaagatcagacatatgtacacaaacggtgggtttgatgcaatggctgagaaaagatga1560
ccgtagtaagaaaaacttagggtgaaagttcatcgcggccgctaa1605
<210>13
<211>512
<212>prt
<213>人工序列
<220>
<223>gp63ectof的氨基酸序列
<400>13
metglylyspheleualathrleuileleuphepheglnphecyspro
151015
leuilepheglyasptyrserprosercyscysthrleuthrilegly
202530
valsersertyrhisserlysprocysasnproalaglnprovalcys
354045
sertrpthrleuaspleuleualaleuseralaaspglnalaleugln
505560
proprocysproasnleuvalsertyrsersertyrhisalathrtyr
65707580
serleutyrleupheprohistrpthrlyslysproasnargasngly
859095
glyglytyrtyrseralasertyrseraspprocysserleulyscys
100105110
protyrleuglycysglnsertrpthrcysprotyrthrglyalaval
115120125
serserprotyrtrplyspheglnhisaspvalasnphethrglnglu
130135140
valserargleuasnileasnleuhispheserlyscysglyphepro
145150155160
pheserleuleuvalaspalaproglytyraspproiletrppheleu
165170175
asnthrgluproserglnleuproprothralaproproleuleupro
180185190
hisserasnleuasphisileleugluproserileprotrplysser
195200205
lysleuleuthrleuvalglnleuthrleuglnserthrasntyrthr
210215220
cysilevalcysileaspargalaserleuserthrtrphisvalleu
225230235240
tyrserproasnvalservalproserserserserthrproleuleu
245250255
tyrproserleualaleuproalaprohisleuthrleupropheasn
260265270
trpthrhiscyspheaspproglnileglnalailevalserserpro
275280285
cyshisasnserleuileleupropropheserleuserprovalpro
290295300
thrleuglyserargserargargalavalprovalalavaltrpleu
305310315320
valseralaleualametglyalaglyvalalaglyglyilethrgly
325330335
sermetserleualaserglylysserleuleuhisgluvalasplys
340345350
aspileserglnleuthrglnalailevallysasnhislysasnleu
355360365
leulysilealaglntyralaalaglnasnargargglyleuaspleu
370375380
leuphetrpgluglnglyglyleucyslysalaleuglngluglncys
385390395400
argpheproasnilethrasnserhisvalproileleuglngluarg
405410415
proproleugluasnargvalleuthrglytrpglyleuasntrpasp
420425430
leuglyleuserglntrpalaargglualaasnserarggluthrval
435440445
ilethrileilevalvalmetvalvalileleuvalvalileileval
450455460
ileileilevalleutyrargleuargargsermetleumetglyasn
465470475480
proaspaspargileproargaspthrtyrthrleugluprolysile
485490495
arghismettyrthrasnglyglypheaspalametalaglulysarg
500505510
<210>14
<211>651
<212>prt
<213>人类免疫缺陷病毒1型(humanimmunodeficiencyvirustype1)
<400>14
alagluasnleutrpvalthrvaltyrtyrglyvalprovaltrplys
151015
aspalagluthrthrleuphecysalaseraspalalysalatyrglu
202530
thrglulyshisasnvaltrpalathrhisalacysvalprothrasp
354045
proasnproglngluilehisleugluasnvalthrgluglupheasn
505560
mettrplysasnasnmetvalgluglnmethisthraspileileser
65707580
leutrpaspglnserleulysprocysvallysleuthrproleucys
859095
valthrleuglncysthrasnvalthrasnasnilethraspaspmet
100105110
argglygluleulysasncysserpheasnmetthrthrgluleuarg
115120125
asplyslysglnlysvaltyrserleuphetyrargleuaspvalval
130135140
glnileasngluasnglnglyasnargserasnasnserasnlysglu
145150155160
tyrargleuileasncysasnthrseralailethrglnalacyspro
165170175
lysvalserphegluproileproilehistyrcysalaproalagly
180185190
phealaileleulyscyslysasplyslyspheasnglythrglypro
195200205
cysproservalserthrvalglncysthrhisglyilelysproval
210215220
valserthrglnleuleuleuasnglyserleualagluglugluval
225230235240
metileargsergluasnilethrasnasnalalysasnileleuval
245250255
glnpheasnthrprovalglnileasncysthrargproasnasnasn
260265270
thrarglysserileargileglyproglyglnalaphetyralathr
275280285
glyaspileileglyaspileargglnalahiscysthrvalserlys
290295300
alathrtrpasngluthrleuglylysvalvallysglnleuarglys
305310315320
hispheglyasnasnthrileileargphealaasnserserglygly
325330335
aspleugluvalthrthrhisserpheasncysglyglygluphephe
340345350
tyrcysasnthrserglyleupheasnserthrtrpileserasnthr
355360365
servalglnglyserasnserthrglyserasnaspserilethrleu
370375380
procysargilelysglnileileasnmettrpglnargileglygln
385390395400
alamettyralaproproileglnglyvalileargcysvalserasn
405410415
ilethrglyleuileleuthrargaspglyglyserthrasnserthr
420425430
thrgluthrpheargproglyglyglyaspmetargaspasntrparg
435440445
sergluleutyrlystyrlysvalvallysilegluproleuglyval
450455460
alaprothrargalalysargargvalvalglyargglulysargala
465470475480
valglyileglyalavalpheleuglypheleuglyalaalaglyser
485490495
thrmetglyalaalasermetthrleuthrvalglnalaargasnleu
500505510
leuserglyilevalglnglnglnserasnleuleuargalaileglu
515520525
alaglnglnhisleuleulysleuthrvaltrpglyilelysglnleu
530535540
glnalaargvalleualavalgluargtyrleuargaspglnglnleu
545550555560
leuglyiletrpglycysserglylysleuilecysthrthrasnval
565570575
protrpasnsersertrpserasnargasnleusergluiletrpasp
580585590
asnmetthrtrpleuglntrpasplysgluileserasntyrthrgln
595600605
ileiletyrglyleuleuglugluserglnasnglnglnglulysasn
610615620
gluglnaspleuleualaleuasplystrpalaserleutrpasntrp
625630635640
pheaspileserasntrpleutrptyrilelys
645650
<210>15
<211>26
<212>prt
<213>仙台病毒(sendaivirus)
<400>15
metthralatyrileglnargserglncysileserthrserleuleu
151015
valvalleuthrthrleuvalsercysgln
2025
<210>16
<211>2318
<212>dna
<213>人工序列
<220>
<223>编码sfenvf的核苷酸序列
<400>16
taagcggccgccaaggttcacttatgacagcatatatccagagatcacagtgcatctcaa60
catcactactggttgttctcaccacattggtctcgtgtcaggctagcgcagagaatttgt120
gggtaacagtctactatggagtccctgtatggaaggatgcagagacaacattgttctgtg180
ctagtgacgcaaaggcttacgagacggagaagcacaatgtgtgggcaactcacgcatgtg240
tcccaaccgatccaaatcctcaagagattcatctagagaatgtgactgaagaattcaata300
tgtggaagaataatatggtagagcaaatgcatacagatatcattagtttatgggaccagt360
cacttaaaccctgcgttaaattgacgcctctatgtgtgacacttcaatgtactaatgtta420
caaacaacataacagatgatatgagaggagaactgaagaactgtagtttcaacatgacga480
cagagttgcgtgacaagaaacagaaagtgtattcactattctatcggttggatgtagtac540
agataaatgagaatcaaggaaacaggtccaacaactctaacaaagagtacagacttatta600
attgcaataccagtgctatcacgcaagcctgcccaaaggtttcatttgaaccaataccta660
ttcattattgtgcacctgctggattcgccatcctcaaatgtaaagacaagaagttcaatg720
gaacaggaccctgcccatcagtttcaaccgttcagtgcacccacggaatcaagcctgtag780
ttagtactcaattattgttaaatgggagcttagctgaagaagaagttatgattagatcag840
agaatattaccaataatgcgaagaacatcttggttcaattcaatactccagtccagatca900
attgcacaaggcctaataataataccagaaagagtataagaattgggccaggacaggcat960
tctatgcaacaggagatataatcggagacattcgacaagcgcactgcactgtttctaagg1020
ccacttggaatgaaacattgggtaaagttgtaaagcaacttcggaagcatttcggaaata1080
acacaattattagatttgcgaactcatctggaggggatctggaagtgacaacacactctt1140
tcaattgcggtggcgagttcttctattgtaatacaagtggattatttaactctacttgga1200
tttcaaatacctcagtccaaggatctaattcaacagggtctaacgattctataacattac1260
cttgccgtataaagcaaattattaatatgtggcaaagaatcgggcaagcgatgtatgctc1320
cacctattcaaggcgtgattcgttgcgtttcaaacataacagggttgatcctgaccaggg1380
atggaggctctaccaattccaccaccgagaccttccgtcccggtggcggagatatgcggg1440
ataactggagatcagagctctataagtataaggttgtgaagattgaacctcttggagttg1500
cccctacaagagcaaagagaagggtggttggccgagagaagagagcagttggcatcggtg1560
ctgtctttctcggatttcttggagcagctggatccactatgggagcagcatcaatgacac1620
taacagtgcaggctagaaatttgcttagcggaatcgttcagcagcagagcaatttactaa1680
gagcaattgaagcacagcaacatctcttaaagttgacggtgtggggcattaaacaactac1740
aagcgagagtgcttgccgtcgaaagatatttgcgagaccaacagctattgggtatttggg1800
gttgttctgggaaattaatttgcacaacaaatgttccatggaactcctcctggagtaata1860
ggaatttaagtgagatatgggacaacatgacatggttgcagtgggacaaggaaatctcaa1920
attatacacagataatctatggattattagaagagtctcagaatcagcaagagaagaatg1980
aacaggatttgcttgcattggataagtgggcttctctatggaactggttcgatattagta2040
attggctctggtatattaagaactcaagagagactgtgattacgatcatagtagttatgg2100
tcgtaatattggtggtcattatagtgatcatcatcgtgctttatagactcagaaggtcaa2160
tgctaatgggtaatccagatgaccgtataccgagggacacatacacattagagccgaaga2220
tcagacatatgtacacaaacggtgggtttgatgcaatggctgagaaaagatgaccgtagt2280
aagaaaaacttagggtgaaagttcatcgcggccgctaa2318
<210>17
<211>749
<212>prt
<213>人工序列
<220>
<223>sfenvf的氨基酸序列
<400>17
metthralatyrileglnargserglncysileserthrserleuleu
151015
valvalleuthrthrleuvalsercysglnalaseralagluasnleu
202530
trpvalthrvaltyrtyrglyvalprovaltrplysaspalagluthr
354045
thrleuphecysalaseraspalalysalatyrgluthrglulyshis
505560
asnvaltrpalathrhisalacysvalprothraspproasnprogln
65707580
gluilehisleugluasnvalthrgluglupheasnmettrplysasn
859095
asnmetvalgluglnmethisthraspileileserleutrpaspgln
100105110
serleulysprocysvallysleuthrproleucysvalthrleugln
115120125
cysthrasnvalthrasnasnilethraspaspmetargglygluleu
130135140
lysasncysserpheasnmetthrthrgluleuargasplyslysgln
145150155160
lysvaltyrserleuphetyrargleuaspvalvalglnileasnglu
165170175
asnglnglyasnargserasnasnserasnlysglutyrargleuile
180185190
asncysasnthrseralailethrglnalacysprolysvalserphe
195200205
gluproileproilehistyrcysalaproalaglyphealaileleu
210215220
lyscyslysasplyslyspheasnglythrglyprocysproserval
225230235240
serthrvalglncysthrhisglyilelysprovalvalserthrgln
245250255
leuleuleuasnglyserleualagluglugluvalmetileargser
260265270
gluasnilethrasnasnalalysasnileleuvalglnpheasnthr
275280285
provalglnileasncysthrargproasnasnasnthrarglysser
290295300
ileargileglyproglyglnalaphetyralathrglyaspileile
305310315320
glyaspileargglnalahiscysthrvalserlysalathrtrpasn
325330335
gluthrleuglylysvalvallysglnleuarglyshispheglyasn
340345350
asnthrileileargphealaasnserserglyglyaspleugluval
355360365
thrthrhisserpheasncysglyglygluphephetyrcysasnthr
370375380
serglyleupheasnserthrtrpileserasnthrservalglngly
385390395400
serasnserthrglyserasnaspserilethrleuprocysargile
405410415
lysglnileileasnmettrpglnargileglyglnalamettyrala
420425430
proproileglnglyvalileargcysvalserasnilethrglyleu
435440445
ileleuthrargaspglyglyserthrasnserthrthrgluthrphe
450455460
argproglyglyglyaspmetargaspasntrpargsergluleutyr
465470475480
lystyrlysvalvallysilegluproleuglyvalalaprothrarg
485490495
alalysargargvalvalglyargglulysargalavalglyilegly
500505510
alavalpheleuglypheleuglyalaalaglyserthrmetglyala
515520525
alasermetthrleuthrvalglnalaargasnleuleuserglyile
530535540
valglnglnglnserasnleuleuargalaileglualaglnglnhis
545550555560
leuleulysleuthrvaltrpglyilelysglnleuglnalaargval
565570575
leualavalgluargtyrleuargaspglnglnleuleuglyiletrp
580585590
glycysserglylysleuilecysthrthrasnvalprotrpasnser
595600605
sertrpserasnargasnleusergluiletrpaspasnmetthrtrp
610615620
leuglntrpasplysgluileserasntyrthrglnileiletyrgly
625630635640
leuleuglugluserglnasnglnglnglulysasngluglnaspleu
645650655
leualaleuasplystrpalaserleutrpasntrppheaspileser
660665670
asntrpleutrptyrilelysasnserarggluthrvalilethrile
675680685
ilevalvalmetvalvalileleuvalvalileilevalileileile
690695700
valleutyrargleuargargsermetleumetglyasnproaspasp
705710715720
argileproargaspthrtyrthrleugluprolysilearghismet
725730735
tyrthrasnglyglypheaspalametalaglulysarg
740745
<210>18
<211>29
<212>dna
<213>人工序列
<220>
<223>人工合成的引物序列
<400>18
ggctagcgcagagaatttgtgggtcacag29
<210>19
<211>30
<212>dna
<213>人工序列
<220>
<223>人工合成的引物序列
<400>19
tattgaaagagcagttctttatttctcctc30
<210>20
<211>30
<212>dna
<213>人工序列
<220>
<223>人工合成的引物序列
<400>20
gaggagaaataaagaactgctctttcaata30
<210>21
<211>29
<212>dna
<213>人工序列
<220>
<223>人工合成的引物序列
<400>21
ctgtactattatgttctttgtattgtctg29
<210>22
<211>29
<212>dna
<213>人工序列
<220>
<223>人工合成的引物序列
<400>22
cagacaatacaaagaacataatagtacag29
<210>23
<211>29
<212>dna
<213>人工序列
<220>
<223>人工合成的引物序列
<400>23
ctctcttgagttctttatataccacagcc29
<210>24
<211>41
<212>dna
<213>人工序列
<220>
<223>人工合成的引物序列
<400>24
atatgcggccgcgacgccaccatgacagcatatatccagag41
<210>25
<211>30
<212>dna
<213>人工序列
<220>
<223>人工合成的引物序列
<400>25
cccacaaattctctgcgctagcctgacacg30
<210>26
<211>30
<212>dna
<213>人工序列
<220>
<223>人工合成的引物序列
<400>26
tataaagaactcaagagagactgtgattac30
<210>27
<211>35
<212>dna
<213>人工序列
<220>
<223>人工合成的引物序列
<400>27
ctgcggccgcgatgaactttcaccctaagtttttc35
<210>28
<211>646
<212>prt
<213>猴-人免疫缺陷病毒(simian-humanimmunodeficiencyvirus)
<400>28
asnleutrpvalthrvaltyrtyrglyvalprovaltrplysgluala
151015
thrthrthrleuphecysalaseraspalalysalatyraspthrglu
202530
valhisasnvaltrpalathrhisalacysvalprothraspproasn
354045
proglngluvalvalleugluasnvalthrgluasnpheasnmettrp
505560
lysasnasnmetvalgluglnmethisgluaspileileserleutrp
65707580
aspglnserleulysprocysvallysleuthrproleucysvalthr
859095
leuasncysthrasptrpglyasnvalthrasnileasnserserser
100105110
gluglumetargglygluilelysasncysserpheasnilethrthr
115120125
serileargasplysvallysgluasptyralaleuphetyrargleu
130135140
aspvalvalproileaspasnaspasnthrsertyrargleuileser
145150155160
cysasnthrserthrilethrglnalacysprolysvalserpheglu
165170175
proileproilehistyrcysthrproalaglyphealaileleulys
180185190
cyslysasplyslyspheasnglythrglyprocyslysasnvalser
195200205
thrvalglncysthrhisglyileargprovalvalserthrglnleu
210215220
leuleuasnglyserleualagluglugluvalvalileargserser
225230235240
asnphethraspasnthrlysasnileilevalglnleulysgluser
245250255
valgluileasncysthrargproasnasnasnthrarglysserile
260265270
hisileglyproglyargalaphetyrthrthrglyaspileilegly
275280285
aspileargglnalahiscysasnileserargthrlystrpasnasn
290295300
thrleuasnglnilealathrlysleulysgluglnpheglyasnasn
305310315320
lysthrilevalpheasnglnserserglyglyaspprogluileval
325330335
methisserpheasncysglyglygluphephetyrcysasnserthr
340345350
glnleupheasnserthrtrpasnpheasnglythrtrpasnleuthr
355360365
glnserasnglythraspthrilethrleuprocysargilelysgln
370375380
ileileasnmettrpglngluvalglylysalamettyralapropro
385390395400
ileargglyglnileargcysserserasnilethrglyleuileleu
405410415
thrargaspglyglyasnhisasnasnaspthrgluthrpheargpro
420425430
glyglyglyaspmetargaspasntrpargsergluleutyrlystyr
435440445
lysvalvallysilegluproleuglyvalalaprothrlysalalys
450455460
argargvalvalglnargglulysargalavalglyalaileglyala
465470475480
metpheleuglypheleuglyalaalaglyserthrmetglyalaala
485490495
serilethrleuthrvalglnalaargleuleuleuserglyileval
500505510
glnglnglnasnasnleuleulysalaileglualaglnglnhisleu
515520525
leuglnleuthrvaltrpglyilelysglnleuglnalaargvalleu
530535540
alavalgluargtyrleuargaspglnglnleuleuglyiletrpgly
545550555560
cysserglylysleuilecysthrthralavalprotrpasnalaser
565570575
trpserasnlysthrleuaspmetiletrpasnasnmetthrtrpmet
580585590
glutrpgluarggluileaspasntyrthrglyleuiletyrthrleu
595600605
ileglugluserglnasnglnglnglulysasngluglngluleuleu
610615620
gluleuasplystrpalaserleutrpasntrppheaspilethrasn
625630635640
trpleutrptyrilelys
645
<210>29
<211>746
<212>prt
<213>人工序列
<220>
<223>sfad8eoenvf的氨基酸序列
<400>29
metthralatyrileglnargserglncysileserthrserleuleu
151015
valvalleuthrthrleuvalsercysglnalaseralagluasnleu
202530
trpvalthrvaltyrtyrglyvalprovaltrplysglualathrthr
354045
thrleuphecysalaseraspalalysalatyraspthrgluvalhis
505560
asnvaltrpalathrhisalacysvalprothraspproasnprogln
65707580
gluvalvalleugluasnvalthrgluasnpheasnmettrplysasn
859095
asnmetvalgluglnmethisgluaspileileserleutrpaspgln
100105110
serleulysprocysvallysleuthrproleucysvalthrleuasn
115120125
cysthrasptrpglyasnvalthrasnileasnsersersergluglu
130135140
metargglygluilelysasncysserpheasnilethrthrserile
145150155160
argasplysvallysgluasptyralaleuphetyrargleuaspval
165170175
valproileaspasnaspasnthrsertyrargleuilesercysasn
180185190
thrserthrilethrglnalacysprolysvalserphegluproile
195200205
proilehistyrcysthrproalaglyphealaileleulyscyslys
210215220
asplyslyspheasnglythrglyprocyslysasnvalserthrval
225230235240
glncysthrhisglyileargprovalvalserthrglnleuleuleu
245250255
asnglyserleualagluglugluvalvalileargserserasnphe
260265270
thraspasnthrlysasnileilevalglnleulysgluservalglu
275280285
ileasncysthrargproasnasnasnthrarglysserilehisile
290295300
glyproglyargalaphetyrthrthrglyaspileileglyaspile
305310315320
argglnalahiscysasnileserargthrlystrpasnasnthrleu
325330335
asnglnilealathrlysleulysgluglnpheglyasnasnlysthr
340345350
ilevalpheasnglnserserglyglyaspprogluilevalmethis
355360365
serpheasncysglyglygluphephetyrcysasnserthrglnleu
370375380
pheasnserthrtrpasnpheasnglythrtrpasnleuthrglnser
385390395400
asnglythraspthrilethrleuprocysargilelysglnileile
405410415
asnmettrpglngluvalglylysalamettyralaproproilearg
420425430
glyglnileargcysserserasnilethrglyleuileleuthrarg
435440445
aspglyglyasnhisasnasnaspthrgluthrpheargproglygly
450455460
glyaspmetargaspasntrpargsergluleutyrlystyrlysval
465470475480
vallysilegluproleuglyvalalaprothrlysalalysargarg
485490495
valvalglnargglulysargalavalglyalaileglyalametphe
500505510
leuglypheleuglyalaalaglyserthrmetglyalaalaserile
515520525
thrleuthrvalglnalaargleuleuleuserglyilevalglngln
530535540
glnasnasnleuleulysalaileglualaglnglnhisleuleugln
545550555560
leuthrvaltrpglyilelysglnleuglnalaargvalleualaval
565570575
gluargtyrleuargaspglnglnleuleuglyiletrpglycysser
580585590
glylysleuilecysthrthralavalprotrpasnalasertrpser
595600605
asnlysthrleuaspmetiletrpasnasnmetthrtrpmetglutrp
610615620
gluarggluileaspasntyrthrglyleuiletyrthrleuileglu
625630635640
gluserglnasnglnglnglulysasngluglngluleuleugluleu
645650655
asplystrpalaserleutrpasntrppheaspilethrasntrpleu
660665670
trptyrilelysasnserarggluthrvalilethrileilevalval
675680685
metvalvalileleuvalvalileilevalileileilevalleutyr
690695700
argleuargargsermetleumetglyasnproaspaspargilepro
705710715720
argaspthrtyrthrleugluprolysilearghismettyrthrasn
725730735
glyglypheaspalametalaglulysarg
740745
- 还没有人留言评论。精彩留言会获得点赞!
- 腹泻相关病毒多重基因检测体系及其试剂盒和应用的制造方法与工艺
- 基于POCKIT Micro荧光PCR平台的禽流感病毒H7亚型检测试剂及应用的制造方法与工艺
- 一种流行性乙型脑炎的重组酶常温扩增核酸(RT‑RPA)试纸条检测试剂盒及应用的制造方法与工艺
- 一种通用型巢氏PCR检测伪狂犬病毒的方法与流程
- 一种仔猪大肠杆菌血清型鉴定及其毒力因子检测方法与流程
- 犬瘟热病毒敏感细胞系SLAM‑MDCK及其构建方法和应用与流程
- 一种基因VII型新城疫弱病毒株的制造方法与工艺
- 一种利用植物维生素C合成途径构建生产维生素C大肠杆菌菌株的方法与流程
- 一种RHDV的亚单位疫苗的制造方法与工艺
- 一种SD大鼠感染人附红细胞体模型的构建方法与流程