肿瘤坏死因子α诱导蛋白8样分子1在制备治疗脂肪肝及相关疾病药物中的应用的制作方法
本发明属于基因的功能与应用领域,具体涉及一种肿瘤坏死因子α诱导蛋白8 样分子1(tumor necrosis factor alpha induced protein 8like 1,TIPE1)基因在脂肪肝及相关疾病中的功能及应用,具体是在制备预防、缓解和/或治疗脂肪肝及相关疾病的药物中的应用。
背景技术:
随着现代人生活方式以及生活环境的改变,肥胖、脂质异常及糖尿病等代谢性疾病已经成为全球性的重大疾病,严重威胁公众的健康及生活质量。非酒精性脂肪肝病(Non-alcoholic fatty liver disease,NAFLD)为一种无过量饮酒史,以肝细胞脂肪堆积及变性为病理特征的代谢性疾病,其发病因素包括肥胖、Ⅱ型糖尿病、血脂异常及代谢综合征等1-3。NAFLD是最为常见的慢性肝脏疾病,根据全球大范围统计,NAFLD的发病率大约为25%,其中10-20%的患者最终发展为非酒精性脂肪性肝炎(Non-alcoholic steatohepatitis,NASH),而约三分之一的NASH 患者逐步演化为肝硬化,甚至肝癌4,5。此外,伴随着NAFLD及NASH的出现,机体也会产生一系列的代谢紊乱综合征,如血脂代谢异常,糖尿病等。然而,目前尚无有效的药物及治疗手段攻克这一临床难题,鉴于此,寻找有效的预防措施及治疗手段势在必行。
肿瘤坏死因子α诱导蛋白8(tumor necrosis factor alpha induced protein 8, TIPE)家族类基因近几年被鉴定确认,包括TIPE、TIPE1、TIPE2、TIPE3,已有研究表明TIPE家族分子主要在肿瘤发生发展及免疫调控机制中发挥重要作用6-9。 TIPE1是其中最晚被发现的基因,至今关于它的研究较少。TIPE1广泛表达于多种组织,研究报道TIPE1在肝癌组织中表达下调且与肿瘤恶性分级呈负相关,其通过抑制p65及JNK信号通路活性进而促进细胞凋亡10。关于TIPE1在肝脏脂肪累积及变性中的研究尚未见报道。
参考文献
[1]Reccia I,Kumar J,Akladios C,Virdis F,Pai M,Habib N,et al. Non-alcoholic fatty liver disease:A sign of systemic disease.Metabolism 2017 Jul;72:94-108.
[2]Machado MV,Diehl AM.Pathogenesis of Nonalcoholic Steatohepatitis. Gastroenterology 2016Jun;150(8):1769-1777.
[3]Mota M,Banini BA,Cazanave SC,Sanyal AJ.Molecular mechanisms of lipotoxicity and glucotoxicity in nonalcoholic fatty liver disease.Metabolism 2016Aug;65(8):1049-1061.
[4]Dyson J,Jaques B,Chattopadyhay D,Lochan R,Graham J,Das D,et al. Hepatocellular cancer:the impact of obesity,type 2diabetes and a multidisciplinary team.J Hepatol 2014Jan;60(1):110-117.
[5]Gaggini M,Morelli M,Buzzigoli E,DeFronzo RA,Bugianesi E, Gastaldelli A.Non-alcoholic fatty liver disease(NAFLD)and its connection with insulin resistance,dyslipidemia,atherosclerosis and coronary heart disease. Nutrients 2013May 10;5(5):1544-1560.
[6]Freundt EC,Bidere N,Lenardo MJ.A different TIPE of immune homeostasis.Cell 2008May 02;133(3):401-402.
[7]Lou Y,Liu S.The TIPE(TNFAIP8)family in inflammation,immunity, and cancer.Mol Immunol 2011Oct;49(1-2):4-7.
[8]Moniz LS,Vanhaesebroeck B.A new TIPE of phosphoinositide regulator in cancer.Cancer cell 2014Oct 13;26(4):443-444.
[9]Goldsmith JR,Chen YH.Regulation of inflammation and tumorigenesis by the TIPE family of phospholipid transfer proteins.Cell Mol Immunol 2017 Jun;14(6):482-487.
[10]Zhang Z,Liang X,Gao L,Ma H,Liu X,Pan Y,et al.TIPE1induces apoptosis by negatively regulating Rac1activation in hepatocellular carcinoma cells.Oncogene 2014;34(20):2566-2574.
技术实现要素:
为解决上述现有技术的缺陷和不足,本发明的目的在于提供一种TIPE1基因的表达与脂肪肝及相关疾病之间的相互关系,提供一个用于治疗脂肪肝及相关疾病的靶基因TIPE1的新用途,进而把TIPE1基因应用于脂肪肝及相关疾病的治疗。
本发明通过以下技术方案实现:
本发明第一方面,提供肿瘤坏死因子α诱导蛋白8样分子1在制备保护肝脏的药物中的应用。
优选地,所述药物具有抑制肝脏脂质堆积的功能。
本发明第二方面,提供肿瘤坏死因子α诱导蛋白8样分子1在制备预防、缓解和/或治疗脂肪肝及相关疾病药物中的应用。
本发明涉及的肿瘤坏死因子α诱导蛋白8样分子1在制备预防、缓解和/或治疗脂肪肝及相关疾病药物中的应用,所述的药物的活性成分是肿瘤坏死因子α诱导蛋白8样分子1。
本发明涉及的肿瘤坏死因子α诱导蛋白8样分子1在制备预防、缓解和/或治疗脂肪肝及相关疾病药物中的应用,具体的是肿瘤坏死因子α诱导蛋白8样分子1作为药物靶点筛选预防、缓解和/或治疗脂肪肝及相关疾病的药物,所述药物是提高肿瘤坏死因子α诱导蛋白8样分子1表达量的试剂。
优选地,提高肿瘤坏死因子α诱导蛋白8样分子1表达量的试剂,给药方式为直接裸DNA注射法、脂质体包裹DNA直接注射法、金包被DNA基因枪轰击法、繁殖缺陷细菌携带质粒DNA法、复制缺陷腺病毒携带目的DNA法、PEG 修饰蛋白药物注射法、脂质体包裹蛋白静脉注射法,或蛋白微球制剂皮下注射法。
所述的肿瘤坏死因子α诱导蛋白8样分子1或TIPE1,包括基因或蛋白。所述的TIPE1基因在对象体内经转录翻译为肿瘤坏死因子α诱导蛋白8样分子1 蛋白产物。
所述脂肪肝及相关疾病包括但不限于:胰岛素抵抗、代谢综合征、肥胖、糖尿病、高血糖、高血脂症、单纯性肝脏脂肪变性、非酒精性脂肪性肝炎,肝纤维化、肝硬化、肝癌等。
本发明通过试验确定了肿瘤坏死因子α诱导蛋白8样分子1的表达与脂肪肝及相关疾病之间的关系:
本发明以人正常肝脏L02细胞系及TIPE1过表达的L02细胞系为研究对象,通过棕榈酸酯(PA)及油酸(OA)刺激诱导肝脏细胞脂质堆积模型进而研究TIPE1 基因的功能。研究发现,TIPE1过表达能够显著改善肝脏细胞内脂质堆积,说明TIPE1能够保护肝脏细胞免受脂肪样变性,TIPE1在肝脏脂质代谢性疾病中起着保护作用。
本发明相对于现有技术具有如下的优点及效果:
(1)本发明发现TIPE1基因的新功能,即TIPE1基因具有能够抑制脂肪肝及相关疾病的作用。
(2)基于TIPE1在保护脂肪肝及相关疾病中的作用,其可以用于制备预防、缓解和/或治疗脂肪肝及相关疾病的药物。由于TIPE1是机体内源性蛋白质,因此作为药物的安全性很高。
附图说明
图1为L02细胞株TIPE1蛋白表达量Western Blot检测结果。
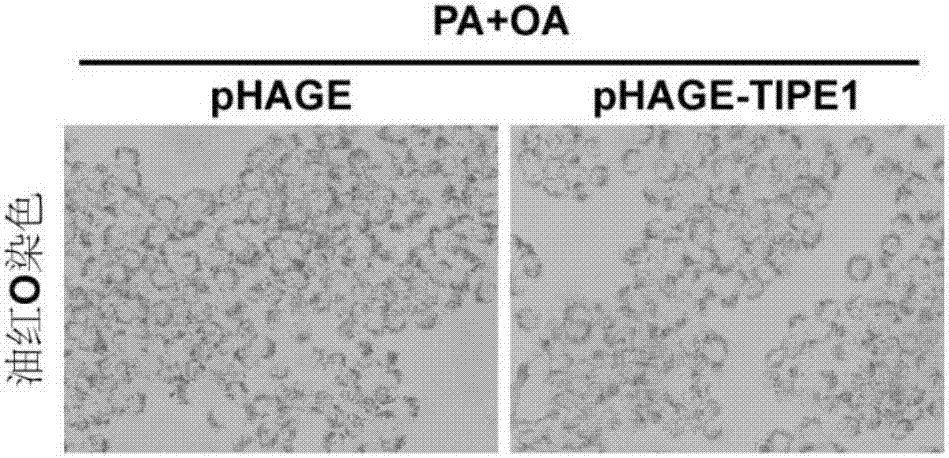
图2为L02细胞经PA+OA(0.4mM+0.8mM)刺激后油红O染色结果(×400)。
具体实施方式
通过以下详细说明结合附图可以进一步理解本发明的特点和优点。所提供的实施例仅是对本发明方法的说明,而不以任何方式限制本发明揭示的其余内容。
本发明中的实验所涉及的试剂在国内外市场购买,或按照说明书中的配方自行配制;未做特殊说明的实验方法都是采用本领域已知的常规方法。
细胞培养
人肝脏细胞系L02购自中国科学院细胞库(目录号GNHu6),人胚肾HEK293T 细胞购自美国菌种保藏中心(American type culture collection,ATCC)。上述细胞均采用DMEM高糖培养基(含10%FBS,1%青霉素-链霉素)置于5%CO2的 37℃恒温细胞专用培养箱培养,实验用细胞培养时间不超过三个月,每三个月进行一次支原体检测。细胞冻存采用含10%DMSO的FBS冻存。
TIPE1过表达质粒构建
1)PCR扩增TIPE1基因,引物为:
正向:5’-CGCGGATCCATGGACACCTTCAGCACCAA-3’,
反向:5’-ACGCGTCGACTCAGAGGCTGCCCTCGTCCA-3’;
2)PCR产物进行琼脂糖凝胶电泳,随后使用DNA凝胶回收试剂盒(天根) 进行DNA片段的回收;
3)将所得DNA产物和限制性核酸酶内切BamHI和SalI(Thermo)、buffer orGreen buffer、ddH2O混合均匀(50μl体系),置于37℃条件下反应。使用AxyPrepTMPCR Clean-Up Kit(Axygen) 回收酶切产物;
4)使用PCR一步定向克隆试剂盒(Novoprotein)按照试剂盒说明书进行重组反应;
5)制作大肠杆菌感受态细胞,将上述连接产物进行转化实验,涂板,置于 37℃培养箱,过夜培养;
6)从37℃培养箱中取出过夜培养的平板,挑克隆摇菌,并检测菌落PCR阳性克隆;
7)将PCR鉴定为阳性的菌液吸取5-10μl接种至5ml LB(含抗性)培养基中,在220rpm,37℃摇床中过夜培养;
8)取出过夜培养的菌液,对已经混浊的菌液进行质粒提取(天根质粒DNA 小提试剂盒);
9)提取后的质粒可直接用于构建慢病毒包装。
慢病毒载体构建和包装
1)前一天开始在6孔板中培养HEK293T细胞,使每孔细胞预计在铺板后第二天的细胞汇聚度为50%以上。
2)在200μlI Reduced Serum Medium中加入转染试剂(PEI Max,或Lipofectamine 2000),轻轻混匀,简短离心(DNA(μg):转染试剂(μl)=1:0.5 ~1:5);
3)在200μl Opti-MEMR○I Reduced Serum Medium中加入目的基因质粒1μg、包装质粒(慢病毒常用pMD2.G(Addgene,12259)0.5μg和psPAX2(Addgene, 12260)0.75μg,轻轻混匀,简短离心;
4)将2)和3)体系轻轻混匀,简短离心,室温孵育20min;
5)将混合体系滴加到培养HEK293T细胞的6孔板中,轻轻混匀;
6)转染6h后,换新鲜培养基;
7)转染后48-72h收获含病毒的上清,3000rpm离心10min,去除沉淀,并用0.45μm的滤膜过滤;
8)过滤后的病毒可立即用于感染或-80℃贮存。
细胞感染
(1)L02细胞铺板:每种病毒感染两个孔,并留出一孔作为空白对照,以便后期筛选细胞用。
(2)第一次感染:将病毒液与待感染的L02细胞(和普通转染密度一致) 培养基混合,混合比率取决于病毒滴度和细胞承受能力(本次每孔使用500μl 病毒液+2ml完全培养基),并随后加入2.5μl聚凝胺(8mg/mL),使其终浓度为8μg/ml。
(3)感染后最快2h即可换液终止感染,若细胞承受力强,最长可持续感染24h。
(4)第二次感染:感染24h后,再感染一次。
加药筛选细胞
第一次感染48h后,在六孔板中(包括空白孔)加入含有嘌呤霉素的完全培养基(终浓度为1μg/ml),待空白孔细胞完全死亡,将六孔板中细胞传代至 T25培养瓶,一般空白细胞在24~48h后全部死亡。待细胞长满后,收取一部分细胞做Western blot验证过表达,并冻存部分细胞。
Western blot分析
1)制胶
根据目的蛋白大小选择需要的分离胶浓度,一般8%-10%的分离胶可满足大部分实验需求。
2)蛋白提取
细胞用适量RIPA(50mM Tris-HCl PH7.4,150mM NaCl,1%Triton X-100or NP-40,1%Sodium deoxycholate,0.1%SDS,1mM EDTA,使用前加蛋白酶或磷酸酶抑制剂)冰上裂解10-30min;4℃,12000g离心10min,上清即为总蛋白;采用BCAProtein Assay Kit进行蛋白定量,取30-50μg总蛋白进行Western blot 分析。
3)上样及电泳
保证上样量及上样体积一致,恒压电泳,上层胶采用80-90V,下层胶采用 100V。
4)转膜
配制转膜液,提前预冷;PVDF膜使用前用甲醇浸泡1-2min;转膜,胶在负极侧,膜在正极侧,海绵、滤纸提前浸泡。转膜电压设为250V,电流设为0.2A,转移1.5h。
5)封闭
5%脱脂奶粉(in TBST)于震荡摇床室温封闭1h。
6)一抗孵育
封闭结束后用TBST洗涤蛋白膜3次,每次5min,加一抗(TIPE1,AVIVA system,ARP52919_P050),4℃孵育过夜。
7)二抗孵育(抗兔二抗来源,购自北京博奥龙免疫技术有限公司,抗兔二抗货号为BF03008/BF03008X)
一抗孵育后膜用TBST洗3遍,每次5min,加一定比例二抗(in TBST)室温孵育1h。
8)显影。
孵育后用TBST洗涤3次,每次5min。利用Bio-Rad Chemi Doc XRS+凝胶成像系统检测目的条带。
油红O染色
1)细胞固定:细胞用PBS洗涤2-3次,去除死细胞,加入300μl 4%多聚甲醛固定20min;
2)加入1×PBS洗涤2次后,加入60%异丙醇漂洗10s,弃去异丙醇,晾干;
3)每孔加入500μl油红O染色1min;
4)加入PBS洗涤2-3次,去除背景的红色,在显微镜下观察,拍照。
实施例1TIPE1过表达对肝细胞脂肪堆积的影响
构建过表达TIPE1的慢病毒表达载体,转染HEK-293T细胞,包装慢病毒,感染L02细胞构建过表达TIPE1的稳定细胞株(pHAGE-TIPE1),同时过表达空载体作为对照组(pHAGE组),通过Western blot检测稳定细胞株是否高表达TIPE1;表达成功的L02细胞种板,分为4组,即pHAGE对照组,pHAGE-TIPE1对照组, pHAGE实验组,pHAGE-TIPE1实验组。待细胞贴壁后,实验组加入棕榈酸酯(PA,终浓度0.4mM)和油酸(OA,0.8mM)刺激,同时对照组加入同等量的BSA, 16h后进行油红O染色。
Western blot检测结果如图1所示,感染过表达TIPE1慢病毒的L02细胞株中,TIPE1的蛋白表达量显著高于空载对照组,说明过表达TIPE1的L02稳定细胞株构建成功。油红O染色结果如图2所示,BSA处理细胞时,pHAGE对照组, pHAGE-TIPE1对照组细胞均无明显着色,而当加入PA+OA刺激后,与对照组相比,pHAGE实验组和pHAGE-TIPE1实验组被油红O染色的细胞数目及着色程度显著增多。但pHAGE-TIPE1实验组与pHAGE实验组相比较,pHAGE-TIPE1实验组中被油红O染色的细胞数目及着色程度显著减弱,说明TIPE1过表达能够抑制 PA和OA刺激导致的肝细胞脂质沉积。
上述结果表明TIPE1过表达能够抑制PA和OA刺激导致的肝细胞脂质沉积, TIPE1在脂肪肝及其相关疾病的病理过程中起着保护作用。
上述实施例为本发明较佳的实施方式,但本发明的实施方式并不受上述实施例的限制,其他的任何未背离本发明的精神实质与原理下所作的改变、修饰、替代、组合、简化,均应为等效的置换方式,都包含在本发明的保护范围之内。
序列表
<110> 武汉大学
<120> 肿瘤坏死因子α诱导蛋白8样分子1在制备治疗脂肪肝及相关疾病药物中的应用
<160> 2
<170> SIPOSequenceListing 1.0
<210> 1
<211> 29
<212> DNA
<213> 人工序列(Artificial Sequence)
<400> 1
cgcggatcca tggacacctt cagcaccaa 29
<210> 2
<211> 30
<212> DNA
<213> 人工序列(Artificial Sequence)
<400> 2
acgcgtcgac tcagaggctg ccctcgtcca 30
- 还没有人留言评论。精彩留言会获得点赞!