抗坏血酸与二甲双胍的复合制剂用于制备化疗药物的应用的制作方法
本发明属于生物医药技术领域,更具体地,涉及一种基于抗坏血酸及二甲双胍的联合给药方案,用于实体肿瘤化疗的杀伤及其应用。
背景技术:
肿瘤的化学疗法是当前癌症治疗的主要方法之一。传统化疗药物不仅容易出现耐药性,且由于选择性差,常常导致达不到预期的疗效,甚至出现严重的异质性反应,例如骨髓抑制、心脏毒性、胃肠道反应等等,令患者苦不堪言,严重影响患者的生活质量及依从性。另一方面,虽然基础科研不断发现新型的前体化合物,但真正能用于临床的新药近年来却寥寥无几。而药物重定位研究,即所谓的“老药新用”,通过对已经上市的药物进行二次挖掘,获得老药的新用途,已成为当下非常有希望的研究方法。已经上市的药物往往因为充分的毒理安全性,进行“新用”将相比其他前体化合物更容易掌握患者的不良反应。这不仅可以极大缩短新药上市的时间,且更节省研发所需要的人力、财力成本,市场更容易推广,经济价值可观。
技术实现要素:
针对现有技术的以上缺陷或改进需求,本发明解决了现有化疗药物对肿瘤细胞的抑制作用不强,价格昂贵,且由于选择性差使正常细胞受损的技术问题。
本发明提供了抗坏血酸与二甲双胍的复合制剂用于制备化疗药物的应用。
优选地,所述抗坏血酸与二甲双胍的质量比为(1.76~3.52):(1.66~6.62)。
优选地,所述复合制剂的应用液中抗坏血酸的浓度为10mmol/L~20mmol/L,二甲双胍的浓度为10mmol/L~40mmol/L。
优选地,所述抗坏血酸用于提高肿瘤细胞内过氧化氢的水平。
优选地,所述二甲双胍用于阻断肿瘤细胞过氧化氢清除通路。
优选地,所述应用的给药方式为静脉注射。
优选地,所述肿瘤细胞为肝癌肿瘤细胞、结肠癌肿瘤细胞、肺腺癌肿瘤细胞或胰腺癌肿瘤细胞。
本发明相对于现有技术,具有以下有益效果:
(1)由于抗坏血酸和二甲双胍两种药本身的不良反应较少,抗坏血酸联合二甲双胍用药,不仅可以提高对多种肿瘤细胞的客观杀灭作用,同时减小对正常组织细胞的副作用,使用安全,对正常细胞影响显著小于肿瘤细胞,降低了严重不良反应的发生率,提高诊疗的依从性以及安全性。
(2)本发明联合抗坏血酸及二甲双胍作为化疗药物,实现了对肿瘤细胞的高效杀伤,提升了化疗效果。本发明的化疗药物不仅对肿瘤细胞的抑制作用更强,且选择性较强,即正常细胞受损小,同时由于两种药物价格便宜,能极大降低患者就医成本,提供了一种更加安全有效的化疗药物,具有较强的推广价值。
(3)细胞应对氧化损伤及氧化应激时,Nrf/ARE通路往往处于活化的状态,Nrf2作为一类转录因子,对下游抗氧化蛋白、酶系具有直接的调控作用。细胞清除过氧化氢主要通过过氧化氢酶(CAT)、谷胱甘肽过氧化物酶、硫氧还蛋白互作蛋白等,其中过氧化氢酶因其表达量高、组织分布广泛,是清除过氧化氢的最主要的酶。CAT的转录主要通过FOXO3a转录因子进行,药理剂量的抗坏血酸会提高肿瘤细胞内过氧化氢的水平,细胞内过氧化氢的持续性升高,会诱导肿瘤细胞的死亡。肿瘤细胞胞内活性氧(含过氧化氢)的水平显著高于正常组织细胞,而肿瘤细胞清除过氧化氢的能力小于正常细胞;另一方面二甲双胍通过增加胰岛素与胰岛素受体的结合,使胰岛素对血糖的清除作用增强,因二甲双胍其对胰岛素受体的增敏作用,会同时偶联对肿瘤细胞生长因子受体的阻断作用,使肿瘤细胞发生凋亡。二甲双胍对肿瘤细胞不仅对抗氧化通路Nrf2/ARE具有一定阻断作用,且可以通过抑制FOXO3a的活化,达到降低胞内CAT活性的作用。
(4)本发明所制成的复合制剂,一方面可以提高肿瘤细胞胞内过氧化氢的水平,另一方面因复合制剂中所含有的二甲双胍,通过抑制FOXO3a转录因子的活化,达到抑制CAT活性的目的,使得胞内过氧化氢清除能力进一步下降。二甲双胍在联合抗坏血酸后,CAT进一步被抑制,且对肿瘤细胞的抑制率进一步增高,而正常细胞系的影响并没有肿瘤细胞系大,因而本复合制剂具有较强的选择性。过氧化氢持续滞留于细胞内,过氧化氢不仅可以激活肿瘤细胞死亡通路,还可以与亚铁离子发生FENTON反应,生成羟自由基,羟自由基是最活泼的生物活性氧属,会对生物大分子产生不可逆的毁灭性打击,正常细胞因铁代谢不如肿瘤细胞旺盛,且清除过氧化氢的效率能力又强,发生FENTON反应的几率远远低于肿瘤细胞,所以直接破坏肿瘤细胞内生物大分子,诱导肿瘤细胞凋亡,以此达到协同作用。通过使用本发明的药物,进一步提升肿瘤细胞内的活性氧水平且抑制过氧化氢的清除,更容易让肿瘤细胞达到死亡阈值,即早于正常细胞发生凋亡。
(5)本发明所用联合制剂可选择性抑制人肝癌细胞系HepG2、人肝癌细胞系SMMC7721增殖、人肺腺癌细胞A549、胰腺癌细胞BxPC-3,同时对人正常肝细胞L-02、人视网膜上皮细胞hRPE、支气管上皮细胞16HBE的增殖抑制率显著低于肿瘤细胞系,经过氧化氢酶活力测定发现,复合化疗药物诱导肿瘤细胞酶活力显著低于正常细胞系,经胞内总过氧化氢测定发现,该发明所述的药物组合可以显著升高肿瘤细胞胞内过氧化氢水平,升高幅度显著高于正常细胞。
(6)本发明采用的抗坏血酸与二甲双胍,生产技术成熟,使用广泛,市场容易推广,价格低廉,具有非常重要的实际应用价值。
附图说明
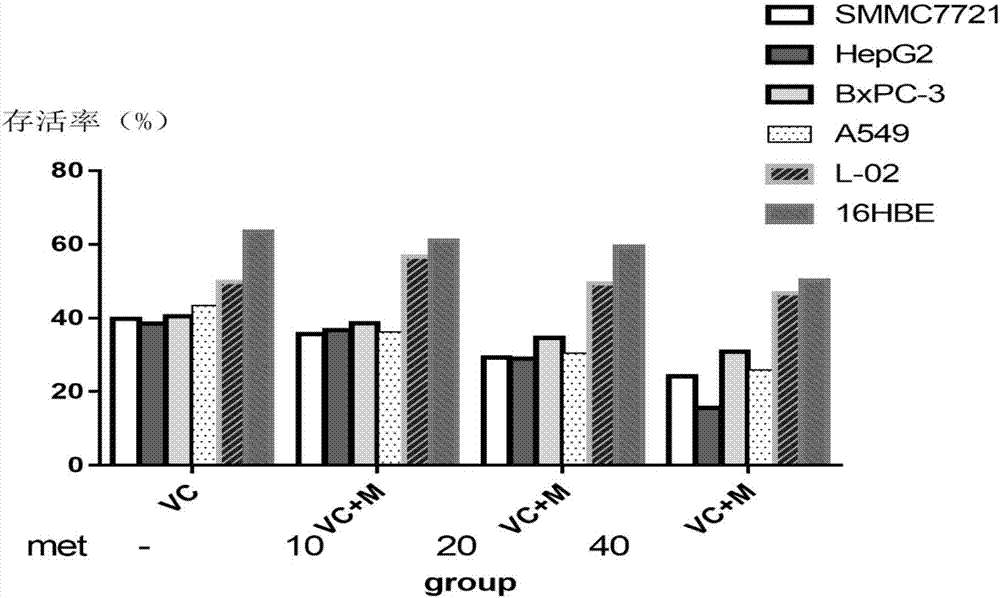
图1是二甲双胍对HepG2、SMMC7721、BxPC-3、A549和L-02、16HBE细胞增殖的影响图。
图2是二甲双胍联合20mM抗坏血酸对HepG2、SMMC7721、BxPC-3、A549和L-02、16HBE增殖的影响图。
图3是HepG2细胞与L-02细胞不同给药方案下的细胞总集落形成数。
图4是HepG2细胞与L-02细胞胞内过氧化氢酶活力变化的幅度。
图5是HepG2细胞与L-02细胞胞内过氧化氢提升的幅度。
图6是HepG2细胞胞内FOXO3a蛋白表达水平。
具体实施方式
为了使本发明的目的、技术方案及优点更加清楚明白,以下结合附图及实施例,对本发明进行进一步详细说明。应当理解,此处所描述的具体实施例仅仅用以解释本发明,并不用于限定本发明。此外,下面所描述的本发明各个实施方式中所涉及到的技术特征只要彼此之间未构成冲突就可以相互组合。
实施例1
如图1、图2、表1、表2所示,本实施例1是将不做任何处理的组作为对照组,二甲双胍为10mM的条件下,不同给药方案的细胞存活率。首先将二甲双胍配制成1mol/L的储备液,加药前,根据需要,用含5%胎牛血清的DMEM培养液稀释到10mM,确保双蒸水所占体积不超过0.5%。抗坏血酸在各体系中的浓度分别为10mM和20mM。
在细胞处理方面,取对数生长期的细胞,以5×103个/孔种于96孔板,每孔培养液总体积为100μl,待细胞生长24h后,分别给予不同药物处理方案。将细胞培养24h,24h后利用磺酰罗丹明B(SRB法)检测细胞存活率。结果见图1、2。其中横轴代表不同的分组,Metformin表示二甲双胍系列浓度,VC表示单独使用10或20mM的抗坏血酸,Met+VC表示两种药物按上述配比联用;纵轴即为存活率。对两种肝癌细胞系HepG2、SMMC7721细胞、人胰腺癌细胞BxPC-3、人肺腺癌A549、人胚胎肝细胞L02细胞、人支气管上皮细胞16HBE,与对照组相比,各处理组的抑制率均显著升高(p<0.05)。单独使用二甲双胍的情况下,该药物对在该剂量下,不难发现,L02细胞存活率显著高于HepG2组(p<0.05),其中,HepG2与L02的平均增殖率分别为75.26±2.59、86.63±3.72,这显示单独使用二甲双胍时,即使在实验剂量为10mM的低剂量情况下,仍对肿瘤细胞的杀伤作用大于正常细胞,但对细胞的抑制作用过低,不具备药理价值。而在联合抗坏血酸时,即联合10mM、20mM的VC时,对各细胞存活率的具体结果见表1、2。随着维生素C的加入,二甲双胍的选择性杀灭作用增强,即在此条件下,不仅人胚胎肝细胞L-02的存活率显著高于两种肝癌细胞系,且两者对药物的差异非常明显,同时,对多种肿瘤细胞均具有抑制作用。
表1 二甲双胍的浓度为10mM与抗坏血酸浓度为20mM联合用药对各细胞存活率影响
表2 二甲双胍的浓度为10mM与抗坏血酸浓度为10mM联合用药对各细胞存活率影响
实施例2
如图2、3、4、5所示,本实施例2是将不做任何处理的组作为对照组,将20mM的二甲双胍加入培养体系中,细胞处理、检测方法、分组、图例同实施例1。利用SRB法检测两种细胞系的存活率。由于VC在20mM时,对肿瘤细胞的抑制率较高,且正常细胞系与肿瘤细胞系在抗坏血酸浓度下,细胞存活率差异较大,而VC剂量为10mM时,上述趋势仍存在,但肿瘤细胞系存活率仍高于50%,故选择20mMVC作为本实施例所用VC浓度,即为最优配比的VC浓度。图1中,单独添加20mM的二甲双胍对多种细胞的抑制率均较实施例1中显著升高。人胚胎肝细胞L-02的存活率虽然较之实施例1中有所下降,但存活率仍高于50%,且其存活率仍显著高于其他几种肝癌细胞系,正常细胞系与肿瘤细胞系间存活率的差异较大。而联合相同剂量的维生素C后,正常细胞系存活率较单独使用二甲双胍,存活率有所下降,但仍高于肿瘤细胞,结果见表3。我们同时实施了集落形成实验,更全面考察了20mM浓度下二甲双胍对各细胞系的存活率的影响,结果仍显示了相同趋势,具体见图3,其中,Met表示二甲双胍,剂量浓度为20mM;VC表示抗坏血酸,浓度为20mM;VC+Met表示20mM抗坏血酸联合20Mm二甲双胍;纵坐标表示细胞集落数。各分组细胞按不同给药方案预先处理24h后,按100个/皿接种6孔板中,设置三个平行组,每3d换液一次,15d后观察细胞集落数。从图3中可以看出,对照组中,因HepG2为肝癌细胞系,其增殖能力强于正常细胞系,故15d后,细胞形成的集落数高于L-02细胞;而抗坏血酸组,则出现正常细胞系的集落数高于肿瘤细胞系,这表明抗坏血酸单独使用具有一定的选择性,而加入二甲双胍制成复合制剂后,仍能发现正常细胞系在15d后的集落数高于肿瘤细胞系,且肿瘤细胞系形成的集落数低于抗坏血酸组,这表明,复合制剂的抗癌效果优于单独抗坏血酸组。
表3 二甲双胍为20mM联合抗坏血酸的浓度为20mM联合用药对各细胞存活率影响
肿瘤细胞对过氧化氢的清除能力弱于正常细胞,利用这一特性,进一步增加其胞内过氧化氢含量,使其达到“死亡阈值”。过氧化氢酶活力检测采用过氧化氢酶活力检测试剂盒,同时采用BCA比色法得到各组蛋白浓度,以酶活力/蛋白浓度作为检测结果。如图4所示,通过检测胞内过氧化氢酶活力的方法,与无处理组作对比,在单独添加抗坏血酸的作用下,两种细胞胞内酶活力相比,正常细胞系(图4中的L-02及hRPE)中hRPE显著高于两种肿瘤细胞,在加入二甲双胍形成复合制剂的情况下,肿瘤细胞的胞内CAT酶活力有所下降,且肿瘤细胞(HepG2、BxPC-3)的胞内CAT酶活力降幅较大,与正常细胞系相比差异更为明显。对细胞胞内过氧化氢的检测方法同过氧化氢酶活力的检测方法,通过改良fenton反应比色法检测胞内过氧化氢大小,以相比对照组增加幅度作为纵坐标。从图5中可以看出,HepG2细胞胞内的过氧化氢增幅显著高于正常肝细胞,这提示本发明采用的疗法能通过抑制胞内过氧化氢酶活力,使得肿瘤细胞胞内过氧化氢进一步蓄积,而该疗法对正常细胞CAT影响并不大,故使其产生选择性死亡机制。进一步通过Western Blot方法检测HepG2细胞内总FOXO3a蛋白表达水平发现(具体结果见图6),VC及二甲双胍单用组使细胞胞内总FOXO3a表达水平相比对照组略有增高,但VC联合二甲双胍组(图6中以VC+Met表示),FOXO3a表达水平降幅明显,所以本发明采用的联合制剂对该蛋白具有抑制作用,由于FOXO3a直接调控CAT的合成,结合酶活力检测的结果,可以发现本发明所用的联合制剂不仅能抑制CAT的表达,降低CAT的含量,同时还能抑制CAT的酶活力,抑制肿瘤细胞对胞内过氧化氢的清除,达到抑制肿瘤细胞增殖的作用。
实施例3
如图1所示,本实施例3的细胞处理方法同实施例1、2,是将不做任何处理的组作为对照组,将40mM的二甲双胍加入培养体系中,利用SRB法检测两种细胞系的存活率。如图1所示,单独使用40mM的二甲双胍的情况下各细胞的存活率,正常细胞的存活率高于癌症细胞;如图2所示,二甲双胍和抗坏血酸复合制剂对正常细胞和肿瘤细胞的存活的影响,如图可见,L-02的存活率仍高于另外几种肿瘤细胞系,这显示该剂量浓度下复合制剂的具有较强的抑制作用。
本领域的技术人员容易理解,以上所述仅为本发明的较佳实施例而已,并不用以限制本发明,凡在本发明的精神和原则之内所作的任何修改、等同替换和改进等,均应包含在本发明的保护范围之内。
- 还没有人留言评论。精彩留言会获得点赞!