一种乏氧响应聚合物纳米粒及其应用的制作方法
本发明属于纳米材料制备和生物医学领域,具体涉及一种乏氧响应聚合物纳米粒,及其在制备抗肿瘤药物中的应用。
(二)
背景技术:
癌症是目前全球发病和死亡的主要原因之一,是严重危害人类生命健康、制约社会经济发展的一类主要疾病。利用化学抗癌药物破坏和抑制肿瘤细胞生长的化学治疗,因其高效性及药物针对性,是大部分癌症治疗不可缺少的选择。但是,化学治疗常因化学药物较小分子尺寸、低水溶性而存在某些局限性,如较低的生物利用度、较快血或肾清除速率、非特异选择性、低的肿瘤富集率、严重耐药性、对正常组织副作用等。
纳米技术的发展为生命医学提供了非常丰富的选择和极具创意与高效解决方案。多种纳米载药体系被开发用于高效递送化学治疗药物,可达到提高药物溶解度和稳定性、延长药物半衰期、提高治疗指数及降低免疫原性等目的。
光动力治疗是以光源、光敏剂(ps)、氧气三者相互作用为基础的光敏化治疗方式;激光照射治疗部位时,胞内光敏分子受到激发,发生光敏化作用,产生具有强氧化活性的单线态氧(1o2),破坏胞内的dna、脂类、蛋白质等生物活性物质,诱导细胞凋亡。其优势在于其非侵入性和相对低的毒副作用:创伤很小、选择性好、毒性低微,对不同细胞类型的癌组织都有效,可重复治疗。然而,大多数小分子光敏剂表现出强疏水性质、低水溶性和较低肿瘤靶向性质。另外,光动力学治疗过程快速耗尽组织氧和扰乱肿瘤血流而导致组织缺氧,降低局部肿瘤组织活性氧物质的产生。这影响光动力治疗效果,限制了在癌症治疗中的临床应用。因此,改善光敏剂的肿瘤递送、利用及缓解光动力引起肿瘤乏氧将可有效提高肿瘤治疗效果,具有较强的科学意义与临床转化价值。
(三)
技术实现要素:
本发明的目的在于提供一种乏氧响应聚合物纳米粒及其应用。
本发明利用聚合物纳米药物负载光敏剂,提高了光敏剂在肿瘤部位的富集能力,光照实现光动力治疗;在肿瘤乏氧环境和光动力治疗后引起的乏氧条件下,肿瘤细胞内高表达的还原酶还原降解纳米聚合物链,释放抗癌药物实现化学治疗。通过光动力治疗和化学治疗的联合治疗作用,提高肿瘤治疗效果。
为实现上述目的,本发明采用如下技术方案:
一种乏氧响应聚合物纳米粒,以4,4-偶氮二苯胺和对苯二甲醛为单体先交联形成共轭聚合物链,并通过非共价作用负载光敏剂和化疗药物,再通过纳米沉淀法形成所述乏氧响应聚合物纳米粒;所述纳米粒粒径为20~500nm。
所述化疗药物为:喜树碱、阿霉素、紫杉醇、表柔比星、顺铂、卡铂、多西他赛、依托泊苷、柔红霉素、博来霉素、长春碱、甲氨蝶呤吉西他滨、他莫昔芬中的一种或多种。
所述化光敏剂为下列之一:二氢卟吩e6(ce6)、锌酞菁、铝酞菁、血卟啉、竹红菌素、苯丙卟啉、替莫泊芬、他拉泊芬、红紫素。
所述纳米粒由如下合成方法制备:
(1)将4,4-偶氮二苯胺和对苯二甲醛按1:0.1~100摩尔比(优选1:1)溶解于n,n-二甲基甲酰胺(dmf)溶液中,加入乙酸引发聚合,反应5~120分钟;
(2)往步骤(1)中加入化疗药物,继续反应1~60分钟后,将反应液滴加至含有表面活性剂的水溶液中,超声1~60分钟后,继续搅拌1~60分钟,所述化疗药物与4,4-偶氮二苯胺用量之比为1~100mg:1mmol(优选为40mg:1mmol);
(3)往步骤(2)中的溶液滴加光敏剂溶液,继续搅拌10~120分钟,将反应溶液用1000-6000rpm离心5~30分钟,收集上层溶液,除去大尺寸颗粒;所述光敏剂与4,4-偶氮二苯胺用量之比为1~100mg:1mmol(优选为40mg:1mmol);
(4)将收集的上层溶液用20000~40000rpm离心,收集下层沉淀,并水洗多次,之后重分散于水溶液中,即得所述乏氧响应聚合物纳米粒,于0~8℃避光保存。
步骤(2)所述的表面活性剂为:聚乙烯吡咯烷酮、聚丙烯酸、聚乙二醇、透明质酸、聚乙烯亚胺、葡聚糖、壳聚糖、岩藻糖、白蛋白、明胶、脂质体中的一种或多种。
本发明还涉及所述的纳米粒在制备抗肿瘤药物中的应用。
具体的,所述药物用于肿瘤的光动力治疗或化学治疗。光动力治疗过程可以增强聚合物纳米药物在肿瘤细胞的释放及增强治疗效果。
所述药物通过响应乏氧微环境的还原酶而降解,释放化疗药物。
本发明的有益效果主要体现在:
(1)本发明中乏氧响应聚合物纳米粒的合成步骤简单温和、低能耗;
(2)本发明中乏氧响应聚合物纳米粒通过静电作用、疏水作用或π-π作用非共价高效吸附化疗药物和光敏剂,避免了共价修饰过程对药物分子结构的破坏;
(3)本发明中乏氧响应聚合物纳米粒可响应细胞乏氧微环境的还原酶而降解,实现响应型高效药物释放;
(4)本发明中乏氧响应聚合物纳米粒具有光动力治疗能力,光动力治疗消耗氧,增强肿瘤细胞乏氧,可以进一步提高聚合物降解,通过响应型的聚合物实现化学治疗和光动力治疗的协同治疗效果,增强对肿瘤的联合杀伤能力。
(四)附图说明
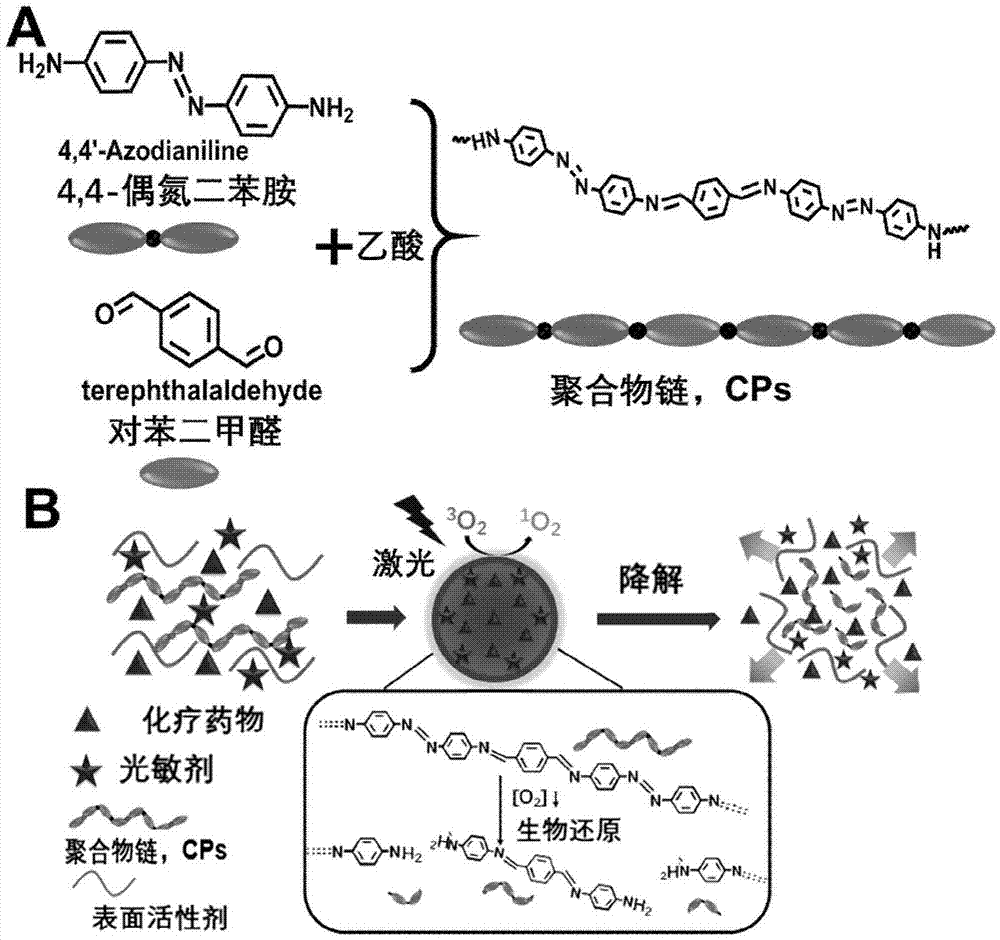
图1为聚合物纳米药物合成示意图。(a)响应聚合物链的合成示意图;(b)聚合物纳米药物的合成及响应示意图。
图2为聚合物纳米药物的表征图。(a)透射电镜图;(b)粒径分布图;(c)聚合物纳米药物及相应参照物的紫外可吸收光谱图;(d)聚合物纳米药物和聚合物纳米颗粒以cpt激发波长激发的荧光图;(e)聚合物纳米药物和聚合物纳米颗粒以ce6激发波长激发的荧光图;(f)聚合物纳米药物的体外活性氧响应能力测试,以abda为探针,380nm处的归一化变化图。
图3为聚合物纳米药物响应还原酶模拟降解的表征图。(a)聚合物纳米药物在连二亚硫酸钠(na2s2o4)处理前后的透射电镜图;(b)聚合物纳米药物在连二亚硫酸钠(na2s2o4)处理前后以cpt激发波长激发的荧光图。
图4(a)为聚合物纳米药物运载光敏剂和化疗药物进细胞的荧光成像图;(b)为聚合物纳米药物及参照物在细胞内产生活性氧的荧光成像图;(c)为聚合物纳米药物及参照物用于细胞光照及未光照条件治疗后的活死染色荧光成像图。
图5为聚合物纳米药物及参照物用于细胞光照及未光照条件治疗后细胞活力定量检测结果。
图6为聚合物纳米药物在光照条件光动力治疗过程产生细胞乏氧的细胞成像图。
图7为聚合物纳米药物在光动力治疗产生乏氧条件的协同治疗细胞活力定量检测结果。
(五)具体实施方式
下面结合具体实施例对本发明进行进一步描述,但本发明的保护范围并不仅限于此:
实施例1:
聚合物纳米药物的合成:称取4.2mg4,4-偶氮二苯胺(4,4’-azodianiline,0.02mmol)和2.7mg对苯二甲醛(terephthalaldehyde,0.02mmol)溶于4mln,n-二甲基甲酰胺(dmf)溶液中,再加入0.2ml冰醋酸(98%)引发聚合反应5分钟。将400μl2mg/ml的cpt(喜树碱,cpt,作为本实施例中的化疗药物)加入聚合物溶液中,混匀,继续反应5分钟。搅拌条件下,将上述混合溶液滴加至20ml1mg/ml聚乙烯吡咯烷酮(pvp,分子量40k)的水溶液中,滴加完毕后超声反应5分钟后,继续搅拌反应10分钟后,滴加入400μl2mg/ml二氢卟吩e6(ce6,作为本实施例中的光敏剂)的dmf溶液,继续反应30分钟。将反应后溶液于6000rpm离心5分钟,去沉淀后,将上层溶液于25000rpm条件离心30分钟,收集下层沉淀,超声分散,水洗离心3次以除去未反应物质,最后,产物重分散于3ml的水溶液中,即为cps-cpt-ce6nps,置于四度冰箱避光保存。长期保存时,将聚合物纳米药物通过冷冻干燥法干燥后,避光冷冻保存。
另外,参照上述方法,合成了分别或同时未负载药物和光敏剂的聚合物纳米颗粒作为参照样品用于比较研究,分别记为cpsnps(未负载药物和光敏剂)、cps-cptnps(未负载光敏剂)、cps-ce6nps(未负载药物)。聚合物纳米药物的合成示意图如图1所示,图1a为聚合物形成示意图,图1b为聚合物纳米药物形成及响应降解药物释放示意图。
实施例2:
对实施例1中合成的聚合物纳米药物进行相关的理化性质表征以证明成功合成聚合物纳米药物。通过透射电镜(tem)、粒径测试仪(dls)、紫外-可见分光光度计(uv-vis)、荧光光谱仪等测试表征。另外,验证聚合物纳米药物在670nm激光照射下产生活性氧的能力进行考察,以9,10-蒽基-双(亚甲基)二丙二酸(abda)为活性氧指示剂,聚合物纳米药物与abda混合后,激光照射不同时间,测试380nm处的吸收值变化,归一化处理,与未光照射样品进行比较,证明聚合物纳米药物的活性氧产生能力。考察纳米聚合物药物响应还原酶的能力,选择连二亚硫酸钠(na2s2o4)为还原酶模拟物,通过测试还原前后电镜变化和聚合物纳米药物中cpt荧光变化。
具体测试结果如下:
(1)对合成的聚合物纳米药物进行表征,结果如图2所示,其中,图2a为透射电镜图,可见合成的聚合物纳米药物尺寸约100nm;图2b为聚合物纳米药物的粒径分布图,尺寸分布集中,说明合成较为均匀;图2c为聚合物纳米药物及其参照样品的吸收光谱图,从图中可见成功将化疗药物cpt和光敏剂ce6成功负载;图2d和图2e分别为测试聚合物纳米药物中cpt和ce6的荧光,有包裹药物和光敏剂时,分别出现cpt在440nm处的荧光峰和ce6在650nm处的荧光峰,证明了成功将化疗药物和光敏剂包裹进聚合物纳米药物。
(2)活性氧产生结果如图2f所示,abda在有聚合物纳米药物且光照,380nm处吸收随光照时间延长而降低,而未光照组被没有明显变化,说明聚合物纳米药物可以在光照条件下产生活性氧。
(3)聚合物物纳米药物响应还原酶降解结果如图3a所示,在有连二亚硫酸钠(na2s2o4)存在时,聚合物纳米颗粒明显降解;同时测试降解前后cpt的荧光变化,如图3b所示,降解后cpt荧光明显增强;以上结果证明了聚合物纳米药物可以被还原降解,说明具有响应还原酶降解的能力。
实施例3:
以宫颈癌细胞(hela细胞)为模型,利用共聚焦荧光显微镜测试聚合物纳米药物在细胞层面运载药物和光敏剂的能力;结合活性氧荧光指示剂2',7'-二氯荧光黄双乙酸盐(dcfh-da)考察聚合物纳米药物在细胞内产生活性氧的能力;结合活死双染荧光指示剂(钙黄绿素-碘化丙啶calcein-am-pi)考察聚合物纳米药物在光照和无光照条件下的治疗效果。利用细胞活力定量检测试剂盒(cck-8试剂盒),定量测试聚合物纳米药物在在光照和无光照条件下的治疗效果。
具体测试结果如下:
(1)聚合物纳米药物与hela细胞共孵育4小时后,利用共聚焦荧光显微镜分别检测ce6和cpt的荧光,结果如图4a所示,出现了ce6和cpt的荧光图像,证明了聚合物纳米药物可成功将光敏剂和化疗药物递送进细胞。
(2)聚合物纳米药物及相应的参照物与hela细胞共孵育4小时后,洗去纳米材料后,加入荧光指示剂dcfh-da孵育20分钟,然后再对细胞进行670nm光照,另外一组未光照组作为对比,之后用荧光共聚焦显微镜检测,结果如图4b所示,在含有ce6的纳米材料组(cps-ce6nps和cps-cpt-ce6nps)出现了dcfh明显的荧光,证明含有ce6的纳米材料可以在光照下产生活性氧,所以聚合物纳米药物可用于细胞光动力治疗。
(3)聚合物纳米药物及相应的参照物与hela细胞共孵育4小时后,洗去纳米材料后,然后再对细胞进行670nm光照,另外一组未光照组作为对比,12小时,用活死双染荧光指示剂对细胞进行染色20分钟,之后用荧光共聚焦显微镜检测,结果如图4c所示,在未光照时,纳米材料对细胞的杀伤作用较低;光照时,含有ce6的纳米材料组(cps-ce6nps和cps-cpt-ce6nps)相对于未含有ce6组(空白、cpsnps和cps-cptnps),显著提高对癌细胞的杀伤能力,说明聚合物纳米药物具有良好的光动力治疗效果;另外,cps-cpt-ce6nps相比于cps-ce6nps也有一定提高,这是由于光照时产生乏氧加快化疗药物释放,增强了聚合物纳米药物的光动力治疗效果。
(4)hela细胞培养于96孔板,与聚合物纳米药物及相应的参照共孵育4小时后,洗去纳米材料后,然后再对细胞进行670nm光照,另外一组未光照组作为对比,12小时,按照细胞活力定量检测试剂盒操作方法操作,检测结果如图5所示,在未光照时,纳米材料对细胞的杀伤作用较低;光照时,含有ce6的纳米材料组(cps-ce6nps和cps-cpt-ce6nps)相对于未含有ce6组(空白、cpsnps和cps-cptnps),显著提高对癌细胞的杀伤能力。另外,相比于cps-ce6nps,cps-cpt-ce6nps提高细胞杀伤,因光照时产生乏氧加快化疗药物释放,增强聚合物纳米药物的光动力治疗效果。
实施例4:
以宫颈癌细胞(hela细胞)为模型,利用共聚焦荧光显微镜测试聚合物纳米药物的光动力治疗过程可以造成细胞乏氧及响应还原酶降解的药物释放提高光动力治疗效果。选择hypoxia/oxidativestressdetectionkit试剂盒(enzolifesciences公司产品)中的hypoxia(red)dye通过共聚焦荧光显微镜检测,该探针在细胞乏氧时,被细胞内的还原酶还原,荧光恢复。另外,96孔板培养细胞加入纳米材料孵育4小时后,pbs洗2次后,加入新鲜培养液,在上层盖一层无毒性的油(hypoxia/oxidativestressdetectionkit试剂盒配套),670nm激光光照10分钟,后继续孵育12小时,之后用细胞活力定量检测试剂盒测试治疗后的细胞活力。
具体测试结果如下:
(1)聚合物纳米药物及相应的参照物(包括乏氧引发剂dfo)与hela细胞共孵育4小时后,洗去材料后,加入hypoxia(red)dye检测探针,670nm激光光照10分钟,之后通过共聚焦荧光显微镜检测。结果如图6所示,只有在纳米材料含有ce6(cps-ce6nps)且光照时,细胞才产生探针的荧光,该结果与阳性参照(dfo处理)结果一致,证明了聚合物纳米材料在光照条件的光动力治疗过程可以加剧细胞乏氧。
(2)hela细胞培养于96孔板,加入不同纳米材料孵育4小时后,pbs洗2次后,加入新鲜培养液,在上层盖一层无毒性的油,670nm激光光照10分钟,后继续孵育12小时,之后用细胞活力定量检测试剂盒测试治疗后的细胞活力。结果如图7所示,cps-cpt-ce6nps组显示出最高的肿瘤细胞杀伤能力(89.6%),明显高于cps-ce6nps组的59.3%,同时对比在常氧条件时的相应治疗组(与图5中相应组进行比较),也具有明显提高。
结果证明,所合成的聚合物纳米药物可以响应肿瘤内乏氧微环境同时释放负载的化疗药物,进而补充和提高光动力治疗的效果,达到协同治疗。
- 还没有人留言评论。精彩留言会获得点赞!