一种叶酸修饰的壳聚糖纳米颗粒及其制备和应用的制作方法
本发明属于复合纳米材料及其制备和应用领域,特别涉及一种叶酸修饰的壳聚糖纳米颗粒及其制备和应用。
背景技术
壳聚糖作为一种天然的阳离子多糖,来源广泛并且价格比较便宜、没有毒害,具有良好的生物相容性和生物可降解性等优点,可广泛应用于医药、食品还有化工等领域。但是壳聚糖也存在很多的不足,壳聚糖分子间存在氢键使得壳聚糖结晶度高,因此它不溶于一般的有机溶剂,从而大大限制了壳聚糖的应用。所以壳聚糖的改性研究应运而生,并取得了许多进展。目前,伴随着可控/活性自由基聚合在合成结构明确、分子量可控高分子方面的发展,壳聚糖的可控接枝改性也取得了十分不错的成绩。在壳聚糖分子中键合、亲水性的或具有某种特殊功能的合成高分子,可以改善壳聚糖的某些性能,提高壳聚糖的应用范围。另外,cs也被认为是具有ph敏感性质的天然聚合物。壳聚糖的接枝聚合物不仅具有壳聚糖的特点,而且具有合成聚合物的优点。由于其在药物递送系统开发中的潜力已经广泛应用于制药工业。
乳腺癌是威胁女性健康最常见的危险之一,为了提高乳腺癌临床治疗的疗效,纳米制剂一直是研究的焦点,以提高ptx在抗肿瘤药物治疗领域的溶解度和靶向效率。然而对于癌症治疗,纳米颗粒对肿瘤的特异性需要进一步改进,现有技术已经使用与肿瘤细胞表面上的特定生物标志物结合的生物靶向部分的例子,这些主动靶向策略能够识别并且特异性结合修饰纳米颗粒的表面的靶分子,增强纳米颗粒被运输到肿瘤细胞的能力。
叶酸受体(fr)在一些实体肿瘤细胞表面呈现高表达状态,如卵巢癌,肾母细胞瘤,宫颈癌,肺癌等。然而,在正常组织细胞中表达量很低甚至不表达,叶酸修饰的生物材料具有主动靶向于肿瘤组织与细胞的潜能。叶酸修饰的纳米颗粒可以通过其受体介导的细胞内吞作用的方式进入细胞。
技术实现要素:
本发明所要解决的技术问题是提供一种叶酸修饰的壳聚糖纳米颗粒及其制备和应用,克服了现有复合纳米材料的细胞选择代谢性能差等的缺陷,该方法操作简单、反应条件温和,且所得产物fa-cs-g-pnipam的分子量分散宽度低,壳聚糖聚合物纳米颗粒粒径在200nm左右能最大程度到达乳腺癌被特定组织或细胞选择性代谢。
本发明的一种叶酸修饰的壳聚糖纳米颗粒的制备方法,步骤包括:
(1)将叶酸fa、edc、nhs加入溶剂中,搅拌,得到混合溶液;
(2)混合溶液加入到壳聚糖温敏嵌段共聚物cs-g-pnipam的水溶液中,搅拌,透析,冷冻干燥,即得叶酸修饰的壳聚糖纳米颗粒。
上述制备方法的优选方式如下:
所述步骤(1)中叶酸、edc、nhs的摩尔比为1:1:1。
所述步骤(1)中搅拌为:室温条件下搅拌22~26h。
所述步骤(2)中混合溶液、cs-g-pnipam的水溶液的体积比为1:1。
所述步骤(2)中cs-g-pnipam由以下方法制备:将乙酰化壳聚糖溶于溶剂中,加入链转移剂、催化剂、脱水剂,室温搅拌,提纯,冻干,得到壳聚糖的raft试剂;将壳聚糖的raft试剂溶于溶剂中,氮气保护下,加入n-异丙基丙烯酰胺nipam和引发剂,油浴反应,提纯,即得。
所述乙酰化壳聚糖具体为:壳聚糖cs溶解于1%醋酸溶液中,加入甲醇搅拌至澄清,再滴加入乙酸酐溶液,室温搅拌反应,10%naoh析出沉淀,经过滤、烘干得到乙酰化壳聚糖。
所述溶剂为二甲基甲酰胺dmf,链转移剂为2-(十二烷基三硫代碳酸酯基)-2-甲基丙酸ddact,催化剂为4-(n,n-二甲基氨基)吡啶dmap,脱水剂为二环己基碳二亚胺dcc,引发剂为偶氮二异丁腈aibn。
步骤(2)中叶酸fa与cs-g-pnipam的质量比为1:1~2。
所述步骤(2)中搅拌为:避光条件下搅拌22~26h。
所述步骤(2)中透析为采用mwco=3500的透析袋;冷冻干燥时间为2-4天。
本发明的一种制备的叶酸修饰的壳聚糖纳米颗粒。
所述的纳米颗粒粒径为100~150nm。
本发明的一种叶酸修饰的壳聚糖纳米颗粒的应用,如在乳腺癌细胞的靶向治疗。
有益效果
(1)本发明采用壳聚糖具有良好的ph敏感性。
(2)制备方法操作简单、实验条件温和;
(3)本发明中壳聚糖聚合物纳米颗粒粒径在100nm左右,低于300纳米这由于epr效应适合于肿瘤靶向;
(4)本发明反应所得产物分子量分散宽度低,pdi<0.45,适合静脉注射给药;
(5)叶酸(fa)具有肿瘤靶向性,将fa连在壳聚糖表面,得到具有肿瘤主动靶向效果的纳米颗粒(fa-cs-g-pnipam),通过edc-nhs技术将肿瘤靶向fa缀合到纳米颗粒的表面,经过fa修饰后的壳聚糖接枝聚合物在乳腺癌细胞的靶向治疗中具有良好的研究前景。
附图说明
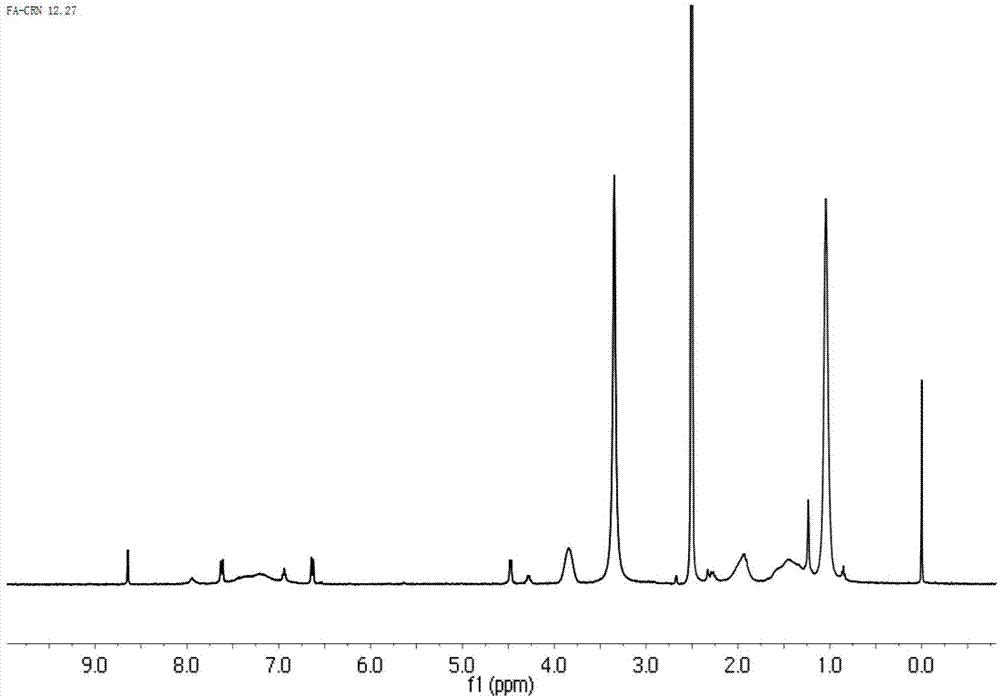
图1为本发明实施例1中得到的fa-cs-g-pnipam的核磁共振氢谱(h1nmr)。
图2为本发明实施例1中得到的fa-cs-g-pnipam(ftir)。
图3为fa-cs-g-nipam在25℃水溶液中的(dls)。
图4为实施例3中fa-cs-g-pnipam/dox在不同ph环境下的药物释放曲线。
图5为实施例4中fa-cs-g-pnipam/dox、cs-g-pnipam/dox对mcf-7及huvec细胞的激光共聚焦显微镜结果。
具体实施方式
下面结合具体实施例,进一步阐述本发明。应理解,这些实施例仅用于说明本发明而不用于限制本发明的范围。此外应理解,在阅读了本发明讲授的内容之后,本领域技术人员可以对本发明作各种改动或修改,这些等价形式同样落于本申请所附权利要求书所限定的范围。
实施例1
(1)cs-g-pnipam的合成:将5g壳聚糖cs溶解于250ml1%醋酸溶液中,搅拌使其完全溶解,缓慢加入250ml甲醇搅拌至澄清,再滴加入1ml乙酸酐溶液,室温搅拌反应3.5h,加入10%naoh溶液析出溶液中的壳聚糖,经过滤、烘干得到乙酰化壳聚糖,研磨成细细的粉末备用。将0.298g得到的乙酰化壳聚糖溶于5mldmf中搅拌溶解,加入0.370gddact、0.015gdmap、0.205gdcc,室温搅拌反应48h,倒入冰水,冰水浴过夜,用mwco=3500的透析袋透析三天,然后冻干得到壳聚糖的raft试剂。将0.047g得到的壳聚糖raft试剂溶于5mldmf中,在氮气氛下磁力搅拌4.5h使其完全溶解,加入0.0016gaibn作为引发剂、0.5gnipam氮气保护下60℃油浴反应24h,加入50ml乙醚沉淀3次,纯化后得到壳聚糖温敏嵌段共聚物cs-g-nipam。
(2)按1:1:1的摩尔比将叶酸、edc和nhs加入到30mldmso中,在室温条件下搅拌,直至溶质完全溶解得到的混合溶液缓慢加入到30ml含有30mgcs-g-pnipam的水溶液中,在室温下避光条件搅拌24h,透析袋透析冻干。
对本实施例得到的壳聚糖温敏嵌段共聚物叶酸修饰的壳聚糖纳米粒进行核磁共振氢谱(h1nmr)测试,结果如图1所示,可以看到在δ=1.00ppm处出现了pnipam主链上的氢、叔丁基上甲基以及ddact上氢的峰,δ=3.90ppm是pnipam上次甲基上氢的峰,pnipam的特征峰在0.82-2.10ppm和7.80ppm处都出现了,除了壳聚糖和pnipam的特征峰,fa的特征共振在7.15-8.64ppm处检测到,表明fa是成功接种到壳聚糖上。这些结果表明fa-cs--g-pnipam已经成功合成。
红外(ftir)测试结果如图2所示,cs-g-pnipam在1457cm-1处出现了特征吸收峰,这说明该聚合物中存在着(-ch3)基团,在1645cm-1处出现的特征峰是-o=c-的伸缩振动产生的,这些特征峰都显示存在pnipam,这些结果进一步证明了cs-g-pnipam的成功合成。另外fa-cs-g-pnipam共聚物分别在1610cm-1,1516cm-1和1099cm-1处出现对应于苯环伸缩振动,n-h伸缩振动和coo-伸展振动,
图3为fa-cs-g-nipam在25℃水溶液中的(dls),可以看到两亲性fa-cs-g-pnipam共聚物可以在水相中自组装成纳米颗粒,fa-cs-g-pnipam的粒径为125.5nm,具有窄的尺寸分布。
实施例2
(1)cs-g-pnipam的合成:将5g壳聚糖cs溶解于250ml1%醋酸溶液中,搅拌使其完全溶解,缓慢加入250ml甲醇搅拌至澄清,再滴加入1ml乙酸酐溶液,室温搅拌反应3.5h,加入10%naoh溶液析出溶液中的壳聚糖,经过滤、烘干得到乙酰化壳聚糖,研磨成细细的粉末备用。将0.298g得到的乙酰化壳聚糖溶于5mldmf中搅拌溶解,加入0.370gddact、0.015gdmap、0.205gdcc,室温搅拌反应48h,倒入冰水,冰水浴过夜,用mwco=3500的透析袋透析三天,然后冻干得到壳聚糖的raft试剂。将0.047g得到的壳聚糖raft试剂溶于5mldmf中,在氮气氛下磁力搅拌4.5h使其完全溶解,加入0.0032gaibn作为引发剂、1gnipam氮气保护下60℃油浴反应24h,加入50ml乙醚沉淀3次,纯化后得到壳聚糖温敏嵌段共聚物cs-g-nipam。
(2)按照1:1:1的摩尔比,将叶酸、edc和nhs加入到15ml无水dmso中,在室温条件下搅拌,直至溶质完全溶解,得到混合溶液。将上述混合溶液缓慢加入到含有15mgcs-g-pnipam水溶液中,在室温、避光条件下搅拌16h,得到fa-cs-g-pnipam水溶液,透析冻干。
实施例3
以dox为模式药物,制备载药复合材料fa-cs-g-pnipam/dox,fa-cs-g-pnipam溶于水中,加入阿霉素dox,搅拌反应,透析,冷冻干燥,得到叶酸修饰的壳聚糖纳米载药复合材料fa-cs-g-pnipam/dox;其中dox与fa-cs-g-pnipam的质量比为1:2~5并在不同ph条件下进行药物释放试验:
称取2mg载药复合物fa-cs-g-pnipam/dox于纯水中充分溶解,分别放入两个透析袋(mw=3500)中,并放置在溶出仪,分别补加20ml的pbs溶液(ph=7.4)及醋酸溶液(ph=5.0),溶出仪温度设为37℃,转速90转/分,分别于2h、4h、6h、8h、10h、12h、24h、36h、48h、60h、72h取出1ml透析液,并回补1ml相应的pbs缓冲溶液和醋酸缓冲溶液。对收集的透析液进行紫外检测,吸收波长设为480nm,收集数据并计算药物释放情况。
dox在两种ph环境下的释放曲线如图4所示,可知在72h后,dox在ph=5.0的醋酸缓释液中约释放46%;而在ph=7.4的pbs环境中仅释放26%,两者释放存在显著差异。由于肿瘤组织较正常组织细胞相比其ph要低,故该载药复合材料的释放正好符合这一特性,表明该载药复合材料是一种可以用于肿瘤治疗的ph敏感型材料。
实施例4
对实施例3制得的载药复合材料fa-cs-g-pnipam/dox进行靶向性验证试验:
在24孔细胞培养板中放入盖玻片,并种入mcf-7细胞,每孔细胞密度大约为30,000个,并补足每孔1ml的培养液,在5%co2,的条件下于培养箱中培养24h。第二天倒掉旧培养基,加入含5μmdox的fa-cs-g-pnipam/dox的100μl的pbs溶液,并补足900μl新鲜培养基,孵育2h。吸去含材料的培养液,并用pbs冲洗,加1ml2.5%的戊二醛固定15min。吸去戊二醛,并用pbs冲洗,加1mldapi染色15min。吸去dapi,并用pbs冲洗,将盖玻片取出,滴一滴荧光封闭剂,置于载玻片上,进行激光共聚焦显微镜检测。为了对材料靶向性进行检测,选取非靶向细胞huvec细胞,操作过程与mcf-7相同。
cs-g-pnipam/dox、fa-cs-g-pnipam/dox对huvec及mcf-7细胞的激光共聚焦显微镜结果如图5所示,可以发现,经过材料孵化后的mcf-7细胞的fitc荧光强度均比huvec细胞高,说明材料对乳腺癌癌细胞均有一定的靶向性。
- 还没有人留言评论。精彩留言会获得点赞!