一种共价有机框架材料的抗肿瘤应用的制作方法
本发明涉及肿瘤治疗技术领域,具体涉及一种共价有机框架材料的抗肿瘤应用,尤其涉及一种共价有机框架材料在制备治疗肿瘤药物、光动力治疗的药剂和光热治疗的药剂中的一种或多种的应用、药物或药剂、共价有机框架材料分散液。
背景技术:
肿瘤(tumour)是指机体在各种致瘤因子作用下,局部组织细胞增生所形成的新生物(neogrowth),因为这种新生物多呈占位性块状突起,也称赘生物(neoplasm)。根据新生物的细胞特性及对机体的危害性程度,又将肿瘤分为良性肿瘤和恶性肿瘤两大类,而癌症即为恶性肿瘤的总称。癌症的种类有很多,严重威胁人类的健康,其性质类型各异、累及的组织和器官不同、病期不同、对各种治疗的反应也不同,因此大部分需要进行综合治疗,根据患者的身体状况、肿瘤的病理类型、侵犯范围等情况,综合采用手术、化疗、放疗、免疫治疗、中医中药治疗、介入治疗、微波治疗等手段,以期较大幅度地提高治愈率,并改善患者的生活质量。而现阶段最常用的化疗与放疗在杀死肿瘤细胞的同时也对正常细胞与组织造成损伤。
光疗做为新兴的疗法,主要包括光动力治疗与光热治疗,其借助光敏剂药物与激光的配合使用实现肿瘤高效的局部治疗,减小毒副作用。利用光源辐射肿瘤部位的光敏剂,产生活性氧(ros)自由基或释放热量,从而破坏核酸或蛋白质等生物大分子,以及破坏肿瘤血管,导致肿瘤细胞的凋亡或坏死。大部分光敏剂分子难溶于水,容易聚集导致产生ros的能力下降,而且不能直接实现其静脉注射。因此通过构建纳米形式的光敏剂非常必要,解决光敏剂难溶于水而不能直接静脉注射,以及聚集导致ros产生能力下降的问题。
异质结是两种不同的半导体相接触所形成的界面区域。按照两种材料的导电类型不同,异质结可分为同型异质结(p-p结或n-n结)和异型异质(p-n或p-n)结等。通常两种半导体有相似的晶体结构、相近的原子间距和热膨胀系数。异质结类型材料在光催化,光电,光检测等领域具有广泛的应用,其能够实现电荷的有效分离,延长载流子的寿命,从而实现其功能。
共价有机框架材料(cofs)作为新兴的材料引起了广泛的关注,目前在分离,环境污染治理,质子传导,催化,药物传递,光电等领域得到初步的应用。通过单体设计与匹配组合能够实现共价有机框架材料自身的功能化,同时cofs具有许多优异的性能,例如较大的比表面积以及有序的孔道,有利于实现水与氧气等小分子的传输以及与cofs活性位点的接触。将卟啉单体引入cofs结构中,通过构造异质结类型的cofs结构,实现有效的电荷分离与传输,从而延长电子或空穴的寿命,有利于ros的产生,提高光动力治疗的效果。
因而,如何能够找到一种异质结类型的纳米材料,解决上述光动力治疗和光热治疗中光敏剂存在的问题,已成为诸多具有前瞻性的研究人员广为关注的焦点之一。
技术实现要素:
有鉴于此,本发明要解决的技术问题在于提供一种共价有机框架材料的应用、药物或药剂、共价有机框架材料分散液,尤其是该共价有机框架材料在制备治疗肿瘤药物、光动力治疗的药剂和光热治疗的药剂中的一种或多种的应用。本发明将共价有机框架材料用于光热治疗和光动力治疗中,不仅可以直接静脉注射,而且由于光激发形态的重组,光照后能够释放热量,实现肿瘤的光热治疗,还能在单波长下实现光动力治疗与光热治疗的协同治疗。
本发明提供了一种共价有机框架材料在制备治疗肿瘤药物、光动力治疗的药剂和光热治疗的药剂中的一种或多种的应用;
所述共价有机框架材料具有如式(i)所示的结构:
优选的,所述光动力治疗为光动力治疗肿瘤;
所述光热治疗为光热治疗肿瘤;
所述肿瘤包括宫颈癌、肺癌、肝癌、膀胱癌、乳腺癌、结直肠癌、食管癌、头颈部鳞癌、肾癌、前列腺癌和卵巢癌中的一种或多种。
本发明还提供了一种药物或药剂,所述药物包括共价有机框架材料和药学上可接受的辅料;
所述药剂包括共价有机框架材料和制剂学上可接受的辅料;
所述共价有机框架材料具有如式(i)所示的结构:
优选的,所述药物的剂型包括口服制剂、注射剂、栓剂、吸入剂或可直接应用于肿瘤的剂型;
所述药剂的剂型包括口服制剂、注射剂、栓剂、吸入剂或可直接应用于光动力治疗和/或光热治疗的剂型;
所述药剂包括光敏剂;
所述共价有机框架材料的剂量为0.05~500mg/kg。
优选的,所述药物的剂型包括胶囊、微囊、片剂、颗粒剂、丸剂、分散粉末、液体制剂、煎膏剂、悬浮剂、糖浆剂、凝胶剂、气雾剂、贴剂、脂质体、口服液、静脉注射液或肌肉注射液;
所述药物中,所述共价有机框架材料的质量含量为1%~100%;
所述药剂的剂型包括胶囊、微囊、片剂、颗粒剂、丸剂、分散粉末、液体制剂、煎膏剂、悬浮剂、糖浆剂、凝胶剂、气雾剂、贴剂、脂质体、口服液、静脉注射液或肌肉注射液;
所述药剂中,所述共价有机框架材料的质量含量为1%~100%。
本发明提供了一种共价有机框架材料分散液,包括共价有机框架纳米材料和溶剂;
所述共价有机框架纳米材料具有如式(i)所示的结构:
优选的,所述共价有机框架纳米材料包括纳米片;
所述共价有机框架纳米材料的平均粒径为50~500nm;
所述溶剂包括pbs、dmem和纯水中的一种或多种;
所述分散液的浓度为0.001~50mg/ml。
优选的,所述溶剂中还包括水和/或血清;
所述水与所述共价有机框架纳米材料的质量比为1:(0.005~50);
所述血清与所述共价有机框架纳米材料的质量比为1:(0.005~50)。
优选的,所述共价有机框架材料由给体2,3,6,7,10,11-六羟基三苯与受体5,15-双(4-硼苯基)卟啉在无水无氧条件下,在有机溶剂中经反应后得到;
所述反应温度为80~150℃;
所述反应时间为2~5天。
优选的,所述共价有机框架材料分散液由共价有机框架纳米材料和溶剂,经过超声分散后得到;
所述超声的功率为200~500w;
所述超声的时间为2~10h。
本发明提供了一种共价有机框架材料在制备治疗肿瘤药物、光动力治疗的药剂和光热治疗的药剂中的一种或多种的应用;所述共价有机框架材料具有如式(i)所示的结构。与现有技术相比,本发明针对现有的大多光敏剂分子难溶于水,容易聚集导致产生ros的能力下降,而且不能直接实现其静脉注射的问题。
本发明创造性的将具有式(i)结构的共价有机框架材料用于治疗肿瘤药物、光动力治疗的药剂和光热治疗的药剂中。本发明提供的共价有机框架材料通过硼酯键构成,在一定时间范围内,提供了生物降解性,能够从体内排除。而且该共价有机框架材料由给体与受体构成,形成给受体异质结类型共价有机框架材料,实现了电荷的有效分离,同时纳米片提供的π-π堆积能够实现电荷的有效转运,延长了载流子的寿命。产生的电子能够与氧气作用,产生o2·–;空穴能够与水分子作用,产生·oh,两者都能促进肿瘤细胞的凋亡或坏死;共价有机框架材料的孔道有利于氧气与水分子的传输,大的比表面积有利于小分子吸附在纳米片的表面,增加小分子与电子或空穴的接触,从而增强产生ros的能力,同时孔道结构有利于产生ros的扩散,增强杀伤细胞的能力。
本发明提供的共价有机框架材料,在光激发后能够释放热量,从而实现肿瘤的光热治疗,而且可以在单波长下实现光动力与光热的协同治疗,从而实现强有力的杀伤细胞。本发明提供的共价有机框架材料,其能制备稳定的分散液,所以能直接实现静脉注射。共价有机框架材料通过epr效应,提高体内实验中纳米片的富集,同时其具有光声成像的能力,能够确定共价有机框架材料的最佳富集时间,从而实现成像指导下的肿瘤治疗。
实验结果表明,本发明将该有机框架材料用于hela细胞的光动力和光热治疗中,能够显著的抑制hela肿瘤的生长。
附图说明
图1为本发明实施例1制备的异质型结构共价纳米片的粒径分布与电位图;
图2为本发明实施例1制备的异质型结构共价纳米片的电镜照片;
图3为本发明实施例制备的共价有机纳米片的材料水平的光动力评价;
图4为本发明实施例制备的共价有机纳米片的材料水平的光热评价;
图5为本发明实施例制备的共价有机纳米片对hela细胞的毒性评价;
图6为本发明实施例制备的共价有机纳米片对hela细胞的治疗评价;
图7为本发明实施例制备的共价有机纳米片在肿瘤部位富集后的光声信号评价;
图8为本发明实施例制备的共价有机纳米片经静脉注射再经光疗后以及对照组肿瘤体积的变化图;
图9为本发明提供的治疗组以及对照组离体肿瘤的变化图。
具体实施方式
为了进一步理解本发明,下面结合实施例对本发明优选实施方案进行描述,但是应当理解,这些描述只是为了进一步说明本发明的特征和优点,而不是对发明权利要求的限制。本领域技术人员可以借鉴本文内容,适当改进工艺参数实现。特别需要指出的是,所有类似的替换和改动对本领域技术人员来说是显而易见的,它们都被视为包括在本发明。本发明的方法及应用已经通过较佳实施例进行了描述,相关人员明显能在不脱离本发明内容、精神和范围内对本文所述的方法和应用进行改动或适当变更与组合,来实现和应用本发明技术。
本发明所有原料,对其来源没有特别限制,在市场上购买的或按照本领域技术人员熟知的常规方法制备的即可。
本发明所有原料,对其纯度没有特别限制,本发明优选采用分析纯或满足医药纯度标准。
本发明所有原料,其牌号和简称均属于本领域常规牌号和简称,每个牌号和简称在其相关用途的领域内均是清楚明确的,本领域技术人员根据牌号、简称以及相应的用途,能够从市售中购买得到或常规方法制备得到。
本发明提供了一种共价有机框架材料在制备治疗肿瘤药物、光动力治疗的药剂和光热治疗的药剂中的一种或多种的应用;
所述共价有机框架材料具有如式(i)所示的结构:
本发明所述制备治疗肿瘤药物、光动力治疗的药剂和光热治疗的药剂中的一种或多种,更优选为制备治疗肿瘤药物、光动力治疗的药剂或光热治疗的药剂,或者为光动力治疗和光热治疗的药剂。
本发明对所述光动力治疗的具体应用方向没有特别限制,以本领域技术人员熟知的光动力治疗的常规应用方向即可,本领域技术人员可以根据实际情况、效果数据以及具体病因进行选择和调整,本发明所述光动力治疗优选为光动力治疗肿瘤。本发明对所述光热治疗的具体应用方向没有特别限制,以本领域技术人员熟知的光热治疗的常规应用方向即可,本领域技术人员可以根据实际情况、效果数据以及具体病因进行选择和调整,本发明所述光热治疗优选为光热治疗肿瘤。
本发明对所述肿瘤的种类没有特别限制,以本领域技术人员熟知的常规肿瘤的种类即可,本领域技术人员可以根据实际情况、效果数据以及具体病因进行选择和调整,本发明所述肿瘤可以包括宫颈癌、肺癌、肝癌、膀胱癌、乳腺癌、结直肠癌、食管癌、头颈部鳞癌、肾癌、前列腺癌和卵巢癌中的一种或多种,也可以为宫颈癌、肺癌、肝癌、膀胱癌、乳腺癌、结直肠癌、食管癌、头颈部鳞癌、肾癌、前列腺癌或卵巢癌,具体可以为宫颈癌。
本发明对所述具有如式(i)所示的结构的共价有机框架材料的来源没有特别限制,以本领域技术人员熟知的常规来源即可,可以采用常规的方法制备,也可以市售购买即可,本领域技术人员可以根据实际情况进行选择和调整。本发明所述共价有机框架材料的结构表述没有特别限制,其符合本领域的常规表述方式,本领域技术人员基于基础常识能够唯一准确的理解其具体含义和结构。
本发明提供了一种药物或药剂,所述药物包括共价有机框架材料和药学上可接受的辅料;
所述药剂包括共价有机框架材料和制剂学上可接受的辅料;
所述共价有机框架材料具有如式(i)所示的结构。
本发明对所述药物或药剂中共价有机框架材料的优选方案和具体选择,与前述应用中的优选方案和具体选择基本一致,在此不再一一赘述。
本发明提供了一种药物,所述药物包括共价有机框架材料和药学上可接受的辅料;所述共价有机框架材料具有如式(i)所示的结构。
本发明提供了一种药剂,所述药剂包括共价有机框架材料和制剂学上可接受的辅料;所述共价有机框架材料具有如式(i)所示的结构。
本发明对所述药剂的种类没有特别限制,以本领域技术人员熟知的用于光动力治疗和/或光热治疗的药剂即可,本领域技术人员可以根据应用情况、应用需求或产品性能要求进行调整,本发明所述药剂优选为光敏剂。
本发明对所述药物的剂型没有特别限制,以本领域技术人员熟知的此类药物的常规剂型即可,本领域技术人员可以根据应用情况、应用需求或产品性能要求进行调整,本发明所述药物的剂型优选包括口服制剂、注射剂、栓剂、吸入剂或可直接应用于肿瘤的剂型,具体可以为胶囊、微囊、片剂、颗粒剂、丸剂、分散粉末、液体制剂、煎膏剂、悬浮剂、糖浆剂、凝胶剂、气雾剂、贴剂、脂质体、口服液、静脉注射液或肌肉注射液。
本发明对所述药物中,共价有机框架材料的含量没有特别限制,以本领域技术人员熟知的此类药物的常规含量即可,本领域技术人员可以根据应用情况、应用需求或产品性能要求进行调整,本发明所述药物中,所述共价有机框架材料的质量含量优选为1%~100%,更优选为10%~90%,更优选为20%~80%,更优选为30%~70%,更优选为40%~60%。
本发明对所述药剂的剂型没有特别限制,以本领域技术人员熟知的此类药物的常规剂型即可,本领域技术人员可以根据应用情况、应用需求或产品性能要求进行调整,本发明所述药剂的剂型优选包括口服制剂、注射剂、栓剂、吸入剂或可直接应用于肿瘤的剂型,具体可以为胶囊、微囊、片剂、颗粒剂、丸剂、分散粉末、液体制剂、煎膏剂、悬浮剂、糖浆剂、凝胶剂、气雾剂、贴剂、脂质体、口服液、静脉注射液或肌肉注射液。
本发明对所述药剂中,共价有机框架材料的含量没有特别限制,以本领域技术人员熟知的此类药剂的常规含量即可,本领域技术人员可以根据应用情况、应用需求或产品性能要求进行调整,本发明所述药剂中,所述共价有机框架材料的质量含量优选为1%~100%,更优选为10%~90%,更优选为20%~80%,更优选为30%~70%,更优选为40%~60%。
本发明对所述药物或药剂中,共价有机框架材料的剂量没有特别限制,以本领域技术人员熟知的此类药物的常规剂量即可,本领域技术人员可以根据应用情况、应用需求或产品性能要求进行调整,本发明所述共价有机框架材料的剂量优选为0.05~500mg/kg,更优选为0.1~300mg/kg,更优选为0.5~200mg/kg,更优选为1~100mg/kg,更优选为2~50mg/kg,具体可以为2.5~10mg/kg。
本发明还提供了一种共价有机框架材料分散液,包括共价有机框架纳米材料和溶剂;
所述共价有机框架纳米材料具有如式(i)所示的结构。
本发明对所述分散液中共价有机框架材料的优选方案和具体选择,与前述药物或药剂中的优选方案和具体选择基本一致,在此不再一一赘述。
本发明对所述共价有机框架纳米材料具体形态没有特别限制,以本领域技术人员熟知的此类材料的常规形态即可,本领域技术人员可以根据应用情况、应用需求或产品性能要求进行调整,本发明为更好的达到其药用效果,所述共价有机框架纳米材料特别优选为纳米片。
本发明对所述共价有机框架纳米材料纳米片的参数没有特别限制,以本领域技术人员熟知的此类材料的常规参数即可,本领域技术人员可以根据应用情况、应用需求或产品性能要求进行调整,本发明所述共价有机框架纳米材料的平均粒径优选为50~500nm,更优选为100~500nm,更优选为200~400nm,更优选为250~350nm,具体可以为50~500nm。本发明所述纳米片的厚度优选为20~30nm,更优选为22~28nm,更优选为24~26nm,具体可以为25nm。
本发明对所述溶剂具体选择没有特别限制,以本领域技术人员熟知的此类材料的常用溶剂即可,本领域技术人员可以根据应用情况、应用需求或产品性能要求进行调整,本发明所述溶剂优选包括pbs、dmem和纯水中的一种或多种,更优选为pbs、dmem或纯水。
本发明对所述分散液浓度没有特别限制,以本领域技术人员熟知的此类材料分散液的常规浓度即可,本领域技术人员可以根据应用情况、应用需求或产品性能要求进行调整,本发明所述分散液的浓度优选为0.001~50mg/ml,更优选为0.005~25mg/ml,更优选为0.01~10mg/ml,更优选为0.05~1mg/ml。
本发明为保证最终产品的性能,所述溶剂中优选还包括水和/或血清,更优选为水和血清。本发明所述水与所述共价有机框架纳米材料的质量比优选为1:(0.005~50),更优选为1:(0.05~10),更优选为1:(0.1~1),具体可以为1:(0.005~5)。本发明所述血清与所述共价有机框架纳米材料的质量比优选为1:(0.005~50),更优选为1:(0.05~10),更优选为1:(0.1~1),具体可以为1:(0.005~5)。
本发明对所述具有如式(i)所示的结构的共价有机框架材料的来源没有特别限制,以本领域技术人员熟知的常规来源即可,可以采用常规的方法制备,也可以市售购买即可,本领域技术人员可以根据实际情况进行选择和调整,本发明为保证最终产品的性能,完整和优化技术方案,所述共价有机框架材料具体由以下步骤制备:
由给体2,3,6,7,10,11-六羟基三苯与受体5,15-双(4-硼苯基)卟啉(5,15-bis(4-boronophenyl)porphyrin)在无水无氧条件下,在有机溶剂中经反应后得到。
本发明对所述原料的比例没有特别限制,以本领域技术人员熟知的常规比例即可,本领域技术人员可以根据制备情况、产品需求或产品性能要求进行选择和调整,本发明所述2,3,6,7,10,11-六羟基三苯与受体5,15-双(4-硼苯基)卟啉的摩尔比优选为2:3。
本发明对所述有机溶剂的选择没有特别限制,以本领域技术人员熟知的此类反应的常用有机溶剂即可,本领域技术人员可以根据制备情况、产品需求或产品性能要求进行选择和调整,本发明所述有机溶剂优选为乙腈和均三甲苯,具体可以为乙腈和均三甲苯(7:3)。
本发明对所述反应的条件没有特别限制,以本领域技术人员熟知的此类反应的常规条件即可,本领域技术人员可以根据制备情况、产品需求或产品性能要求进行选择和调整,本发明所述反应的温度优选为80~150℃,更优选为90~140℃,更优选为100~130℃。本发明所述反应的时间优选为2~5天,更优选为2.5~4.5天,更优选为3~4天。
本发明为进一步提高产品的性质,优化制备路径,所述反应后优选还包括后处理步骤,具体可以为洗涤和/或分离。本发明所述后处理步骤具体优选为:
反应后得到的固体产物,用甲苯洗涤直至液体无色。真空条件下加热去除溶剂,温度优选为80~120℃(更优选为90~110℃),时间优选为12~48h(更优选为24~36h)。
本发明对所述共价有机框架材料分散液的制备过程没有特别限制,以本领域技术人员熟知的分散液的常规制备过程即可,本领域技术人员可以根据实际情况进行选择和调整,本发明为保证最终产品的性能,完整和优化技术方案,所述共价有机框架材料分散液具体优选由以下步骤制备:
由共价有机框架纳米材料和溶剂,经过超声分散后得到。
本发明对所述超声分散的过程参数没有特别限制,以本领域技术人员熟知的超声分散的常规参数即可,本领域技术人员可以根据实际情况进行选择和调整,本发明所述超声的功率优选为200~500w,更优选为250~450w,更优选为300~400w。本发明所述超声的时间优选为2~10h,更优选为3~9h,更优选为5~7h。
本发明为进一步细化技术方案,完整制备过程,保证最终产品的性能参数,上述分散液的制备过程具体可以为以下步骤:
在无水无氧条件下,给体(2,3,6,7,10,11-六羟基三苯,2当量)与受体(5,15-bis(4-boronophenyl)porphyrin,3当量)在乙腈/均三甲苯(7:3)中反应,反应温度80~150℃,反应时间为2~5天,得到固体产物。
再用甲苯洗涤直至液体无色。真空条件下加热去除溶剂,得到固体粉末。温度选择为80~120℃,时间选择为12~48h。
(2)将得到的固态粉末(3~6mg)加入水,pbs,血清(6ml)中超声分散,超声功率为200~500w,超声时间为2~10h,得到具有纳米尺寸的共价有机纳米片分散液(0.5~1mg/ml)。
本发明所述步骤提供了一种共价有机框架材料在制备治疗肿瘤药物、光动力治疗的药剂和光热治疗的药剂中的一种或多种的应用、药物或药剂、共价有机框架材料分散液。本发明将具有式(i)结构的共价有机框架纳米片应用于治疗肿瘤药物、光动力治疗的药剂和光热治疗的药剂中,研究结果表明,该纳米片通过硼酯键构成,在一定时间范围内,提供了生物降解性,能够从体内排除,具有安全性;该纳米片由给体与受体构成,形成给受体异质结类型纳米片,实现了电荷的有效分离,同时纳米片提供的π-π堆积能够实现电荷的有效转运,延长了载流子的寿命。产生的电子能够与氧气作用,产生o2·–;空穴能够与水分子作用,产生·oh,两者都能促进肿瘤细胞的凋亡或坏死。而且纳米片的孔道有利于氧气与水分子的传输,大的比表面积有利于小分子吸附在纳米片的表面,增加小分子与电子或空穴的接触,从而增强产生ros的能力,同时孔道结构有利于产生ros的扩散,增强杀伤细胞的能力。同时,本发明研究还表明,光激发纳米片后能够释放热量,从而实现肿瘤的光热治疗,还可以在单波长下实现光动力与光热的协同治疗,从而实现强有力的杀伤细胞。本发明提供的共价有机框架材料,其能制备稳定的分散液,所以能直接实现静脉注射。共价有机框架材料通过epr效应,提高体内实验中纳米片的富集,同时其具有光声成像的能力,能够确定共价有机框架材料的最佳富集时间,从而实现成像指导下的肿瘤治疗。
本发明首先合成卟啉单体(5,15-bis(4-boronophenyl)porphyrin),随后卟啉单体与商业化试剂2,3,6,7,10,11-六羟基三苯通过溶剂热法制备出共价有机框架材料(tp-por),tp-por在超声的条件下制备出具有分散性能的共价有机纳米片,其具有优异的光动力治疗与光热治疗功能,同时具有生物降解性,表明具有异质型结构的共价有机框架材料是一种新型、高效的光疗试剂,作为抗肿瘤的光疗药物具有良好应用前景。本发明提供的制备方法在制备纳米片时,无需加入有机溶剂,同时不需要加入peg等大分子修饰,只需超声即可制备出纳米片,操作简便,实验条件温和,效率高。本发明提供的共价有机框架材料,溶于水,能制备稳定的分散液,所以能直接实现静脉注射。
实验结果表明,本发明将该有机框架材料用于hela细胞的光动力和光热治疗中,能够显著的抑制hela肿瘤的生长。
为了进一步说明本发明,以下结合实施例对本发明提供的一种共价有机框架材料的应用、药物或药剂、共价有机框架材料分散液进行详细描述,但是应当理解,这些实施例是在以本发明技术方案为前提下进行实施,给出了详细的实施方式和具体的操作过程,只是为进一步说明本发明的特征和优点,而不是对本发明权利要求的限制,本发明的保护范围也不限于下述的实施例。
实施例1
具有异质型结构的共价有机框架材料的制备
(1)在无水无氧条件下,给体(2,3,6,7,10,11-六羟基三苯,2当量)与受体(5,15-bis(4-boronophenyl)porphyrin,3当量)在乙腈/均三甲苯(7:3)中反应,反应温度80~150℃,反应时间为2~-5天,得到固体产物用甲苯洗涤直至液体无色。真空条件下加热去除溶剂,温度选择为80~120℃,时间选择为12~48h。
(2)将得到的固态粉末(3~6mg)加入水,pbs,血清(6ml)中超声分散,得到具有纳米尺寸的共价有机纳米片分散液(0.5~1mg/ml)。
实施例2
对本发明实施例制备的共价有机框架材料共价纳米片进行表征。
材料粒径与电位测定
制备pbs分散的共价有机纳米片分散液(0.1mg/ml),随后测定粒径与电位。
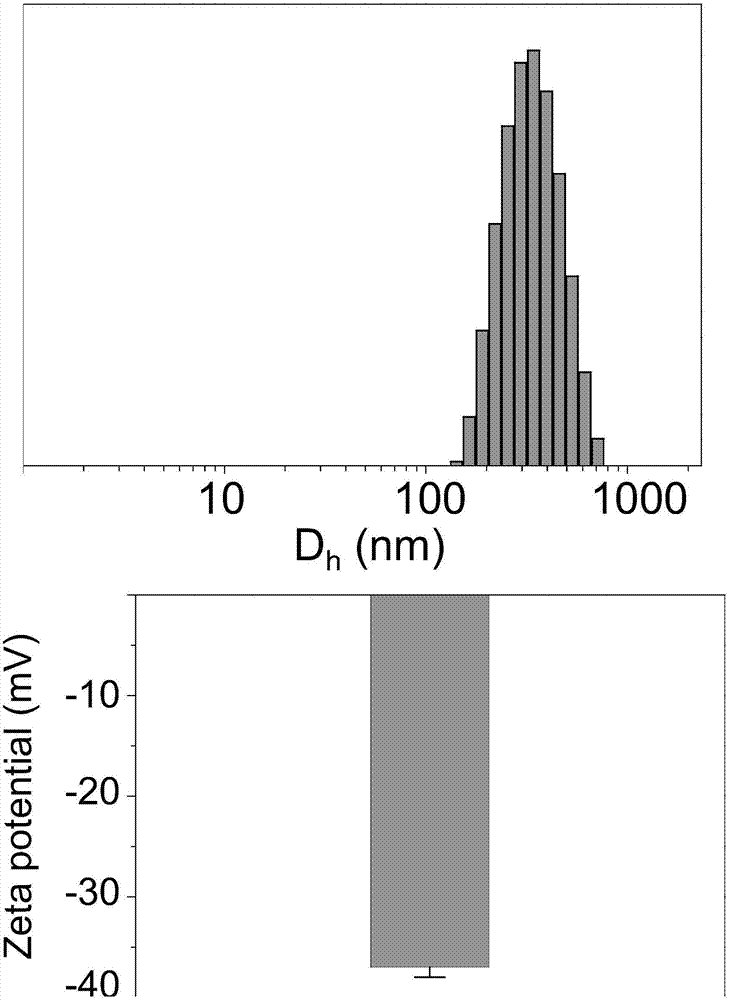
参见图1,图1为本发明实施例1制备的异质型结构共价纳米片的粒径分布与电位图。
如图1所示,异质型结构共价纳米片的粒径为350nm左右,电位为-37mv,其有利于实现纳米片的静脉注射。
参见图2,图2为本发明实施例1制备的异质型结构共价纳米片的电镜照片。
实施例3
对本发明实施例制备的共价有机框架材料共价纳米片材料进行光动力性能评价。
利用1,3-二苯基异苯并呋喃(dpbf)检测ros的产生,dpbf(50μl,1mm)
加入到共价有机纳米片分散液(3ml,0.1mg/ml)中,利用激光(1wcm-2,635nm)辐射混合溶液,紫外吸收监控dpbf吸收的变化。
参见图3,图3为本发明实施例制备的共价有机纳米片的材料水平的光动力评价。即在光照条件下,dpbf吸收强度随照射时间变化的曲线图。
由图3可知,其证明ros的产生。
实施例4
对本发明实施例制备的共价有机框架材料共价纳米片材料进行光热性能评价。
为了评价共价有机纳米片分散液的光热性能,其在不同浓度(0.05~0.2mg/ml)条件下被激光辐射(635nm,1wcm-2,5min),20s间隔记录温度变化。pbs做为对照实验。
参见图4,图4为本发明实施例制备的共价有机纳米片的材料水平的光热评价。即在不同材料浓度与光照条件下,温度随时间变化的曲线图。
由图4可知,证明了材料的光热性能。
实施例5
体外细胞暗毒性评价
hela细胞以每孔1000接种到96孔板中,37℃条件下培养24h,随后加入一系列浓度的纳米片分散液(10~200μg/ml),培养24h后,通过cck-8测定其细胞毒性。
参见图5,图5为本发明实施例制备的共价有机纳米片对hela细胞的毒性评价。即在不同材料浓度件下的细胞存活率的曲线图。
由图5可知,纳米片对细胞无明显的毒性,表面其优异的生物相容性。
实施例6
体外细胞光毒性评价
hela细胞以每孔1000接种到96孔板中,37℃条件下培养24h,随后加入一系列浓度的纳米片分散液(1.25~20μg/ml),培养6h后,激光(635nm,1wcm-2)辐射5min。进一步培养24h,随后通过cck-8测定其细胞毒性。
参见图6,图6为本发明实施例制备的共价有机纳米片对hela细胞的治疗评价。即在不同材料浓度与光照条件下的细胞存活率曲线图。
由图6可知,本发明提供的纳米片具有优异的光疗性能。
实施例7
体内光声成像
选用4-6周的balb/c裸鼠,皮下注射100μl的hela细胞(1×106)悬浮液,当肿瘤大约100mm3时开始实验。静脉注射纳米片的pbs分散液(200μl,0.5mg/ml),随后利用光声成像系统(itheramostinvision128)监控不同时间点(0,8,12,24h)纳米片在肿瘤部位的富集,实现成像指导的光疗。
参见图7,图7为本发明实施例制备的共价有机纳米片在肿瘤部位富集后的光声信号评价。即材料随时间变化在肿瘤部位富集曲线图。
由图7可知,本发明提供的纳米片在12h后可实现肿瘤的最大富集。
实施例8
体内光疗实验
选用上述动物模型,30只老鼠分为六组,(1)pbs非照射;(2)pbs照射;(3)纳米片(5mgkg-1)非照射;(4)纳米片(5mgkg-1)加1mm冰冷的载玻片加照射;(5)纳米片(5mgkg-1)加抗坏血酸加照射;(6)纳米片(5mgkg-1)照射。注射纳米片12h进行照射(635nm,1wcm-2for5min)。通过冰冷的载玻片降低温度,抑制光热。通过抗坏血酸注射瘤内抑制光动力,从而区分肿瘤的光动力与光热治疗,验证光疗的协同作用。
参见图8,图8为本发明实施例制备的共价有机纳米片经静脉注射再经光疗后以及对照组肿瘤体积的变化图。
参见图9,图9为本发明提供的治疗组以及对照组离体肿瘤的变化图。
其中,静脉注射纳米制备的纳米片经光疗后,体积变化如图8所示,结果表明具有异质型结构的纳米片能够很好的实现肿瘤的光疗。如图9所示,通过观察老鼠肿瘤的离体照片,更进一步证明肿瘤的治疗效果。
以上对本发明提供的一种共价有机框架材料在制备治疗肿瘤药物、光动力治疗的药剂和光热治疗的药剂中的一种或多种的应用、药物或药剂、共价有机框架材料分散液进行了详细的介绍,本文中应用了具体个例对本发明的原理及实施方式进行了阐述,以上实施例的说明只是用于帮助理解本发明的方法及其核心思想,包括最佳方式,并且也使得本领域的任何技术人员都能够实践本发明,包括制造和使用任何装置或系统,和实施任何结合的方法。应当指出,对于本技术领域的普通技术人员来说,在不脱离本发明原理的前提下,还可以对本发明进行若干改进和修饰,这些改进和修饰也落入本发明权利要求的保护范围内。本发明专利保护的范围通过权利要求来限定,并可包括本领域技术人员能够想到的其他实施例。如果这些其他实施例具有不是不同于权利要求文字表述的结构要素,或者如果它们包括与权利要求的文字表述无实质差异的等同结构要素,那么这些其他实施例也应包含在权利要求的范围内。
- 还没有人留言评论。精彩留言会获得点赞!