一种索拉菲尼固体脂质纳米粒及其制备方法与应用与流程
本发明涉及生物医药
技术领域:
,尤其涉及一种索拉菲尼脂质纳米粒及其制备方法与应用。
背景技术:
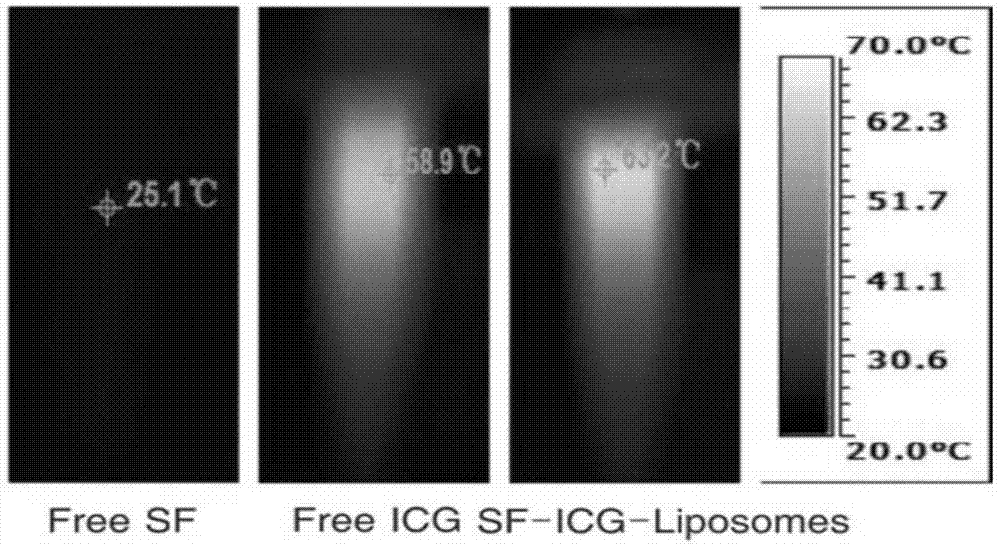
截止到2017年以前,索拉菲尼是临床上唯一一种通过美国食品药品管理局认证的用来延长晚期细胞性肝癌患者寿命的药物,索拉菲尼作为一种联芳结构的多蛋白激酶抑制剂,一方面可以靶向作用于ras的下游raf/serine(丝氨酸)/threonine(苏氨酸)激酶中的raf家族中raf1和braf两种亚型,ras是丝裂原活化蛋白激酶(mitogen-activatedproteinkinase)信号通路上调控raf/mek/erk通路活性的关键分子,这些激酶磷酸化后最终可以通过上调一系列与细胞增殖相关的基因促进细胞增殖,索拉菲尼可以通过靶向raf家族中的两种亚型来抑制肿瘤细胞的增殖;另一个方面索拉菲尼还可以作用于血管内皮生长因子受体2(vascularendothelialgrowthfactorreceptor2,vegfr-2)、血管内皮生长因子受体3(vascularendothelialgrowthfactorreceptor3,vegfr-3)和血小板源性生长因子受体β(platelet-derivedgrowthfactor,pdgfr-β)抑制肿瘤新生血管的生成。索拉菲尼作为晚期细胞性肝癌患者们的首要选择,患者们在接受索拉菲尼治疗的同时不得不同时面对索拉菲尼自身的缺陷,第一,索拉菲尼的溶解性极差,在水中的溶解度不超过10μg/ml,这极大的影响了患者服用索拉菲尼的用药效率。第二,索拉菲尼的细胞毒性很大,接受索拉菲尼治疗的患者都要忍受包括腹泻、痢疾、体重减少、高血压、厌食、变声、恶心呕吐等副作用对患者身体的伤害。第三,索拉菲尼作为一种小分子靶向药物,肿瘤细胞极易对其产生强烈的耐药性,这也就导致了患者接受索拉菲尼治疗后肿瘤的体积并不会显著减少,并且只能将患者的平均寿命对比安慰剂治疗延长三个月。索拉菲尼尽管存在如此多的缺点,可是到目前为止,在临床上仍然找不到一种可以替代索拉菲尼的药物用来系统的治疗和延长晚期肝细胞癌症患者的寿命,与此同时,临床上也没有提出任何一种如何改善索拉菲尼缺点的办法。因此,怎样改善以索拉菲尼的毒性,增强索拉菲尼的溶解性和治疗效果仍然是当前迫在眉睫需要解决的问题。技术实现要素:本发明的目的在于克服现有技术中的不足,提供了一种索拉菲尼脂质纳米粒及其制备方法,该索拉菲尼脂质纳米粒将索拉菲尼和吲哚箐绿共同装载到一个磷脂膜纳米载体中,这样既可以改善索拉菲尼的毒性和溶解性,又能够增强吲哚箐绿的耐光性和肿瘤聚集的性能。基于脂质体独特的磷脂双分子层囊泡结构,它可以同时将水溶性吲哚箐绿和脂溶性索拉菲尼分别的封装在双分子层内部和脂质双分子层中间,脂质体可以在将水溶性的icg装载入脂质体囊泡中的同时将疏水性小分子药物索拉菲尼装入到磷脂双分子层疏水区域中。本发明是这样实现的:本发明的目的之一在于提供一种索拉菲尼脂质纳米粒,由核和外壳构成,所述的外壳为磷脂薄膜,所述的核为索拉菲尼和吲哚箐绿,其中所述脂溶性索拉菲尼封装在所述磷脂双分子层中间,所述亲水性吲哚箐绿位于所述磷脂双分子层形成的脂质体囊泡中。本发明的目的之二在于提供一种索拉菲尼脂质纳米粒的制备方法,具体包括如下步骤:步骤1、称取索拉菲尼与磷脂,加入有机溶剂溶解,得到有机相后去除有机溶剂,得到内含索拉菲尼的磷脂薄膜;步骤2、称取吲哚箐绿,溶解于去离子水中得到水相;步骤3、将步骤2所得的水相加入到步骤1所得的磷脂薄膜中,搅拌混匀后经过滤,即得该索拉菲尼脂质纳米粒。本发明的目的之三在于提供所述索拉菲尼脂质纳米粒在制备治疗肝癌药物中的应用。利用脂质体将索拉菲尼同吲哚箐绿共同装载进去进行晚期细胞性肝癌的治疗:本发明的索拉菲尼-吲哚箐绿-脂质体可以显著的减小索拉菲尼的细胞毒性。且与索拉菲尼单独疗法比,可以显著减少肝癌肿瘤体积大小。本发明具有的有益效果是:1、本发明提供的一种索拉菲尼脂质纳米粒,脂质体独特的磷脂双分子层囊泡结构,它可以同时将水溶性的icg装载入脂质体囊泡中的同时将疏水性小分子药物索拉菲尼装入到磷脂双分子层疏水区域中,本发明索拉菲尼和吲哚箐绿共同装载在一个磷脂纳米载体中,这样既可以改善索拉菲尼的毒性和溶解性,又能够增强吲哚箐绿的耐光性和肿瘤聚集的性能,具体地:(1)光热治疗,是一种将光能通过特殊的染料分子转换成热能的新型肿瘤治疗手段,可以协同索拉菲尼一起对晚期细胞性肝癌进行治疗减少肿瘤体积,吲哚箐绿(icg)是唯一通过欧洲药品管理局和美国食品药品监督局的两亲性荧光染料。当受到近红外激光照射时,icg分子吸收荧光能量到达高振动能级的激发态,然后通过钝化作用将能量以热量的形式释放出去,产生局部高温杀死肿瘤细胞。鉴于索拉菲尼在治疗晚期细胞性肝癌过程中,无法有效地减小肿瘤体积的大小,本发明选用光热治疗这种无痛无副作用的新兴治疗手段协同索拉菲尼一同治疗晚期细胞性肝癌,光热治疗与传统的手术、化疗或放疗治疗手段相比,具有副作用低,针对性强等许多优点。(2)鉴于索拉菲尼的溶解性差,细胞毒性高,吲哚箐绿的学习循环性差等等一系列缺点,我们有必要选择一种药物递送系统同时转载水溶性的吲哚箐绿和脂溶性的索拉菲尼,使之同时聚集在肿瘤细胞,我们选择脂质体递送系统的优点在于:①脂质体是已经通过fda的药物递送系统,我们不需要考虑其毒性与代谢的性质,可以马上用于临床治疗;②脂质体可以同时装载脂溶性的水溶性的药物,通过控制合成的脂质体粒径可以通过epr效应使脂质体被动靶向到肿瘤区域。2、本发明提供的一种索拉菲尼脂质纳米粒的制备方法,先将脂溶性的索拉非尼与磷脂,在有机溶剂溶解作用下得到内含索拉菲尼的磷脂薄膜,再将亲水性的吲哚箐绿加入到磷脂双分子层形成的脂质体囊泡中从而完美解决现有技术的缺陷。3、本发明提供的索拉菲尼脂质纳米粒可以显著的减小索拉菲尼的细胞毒性。且与索拉菲尼单独疗法相比,可以显著减少肝癌肿瘤体积大小;索拉菲尼脂质纳米粒不仅可以改善icg在周围环境中的稳定性,而且可以防止icg与血浆蛋白结合,从而改善血液循环时间。附图说明图1为本发明实验例1提供的索拉菲尼脂质纳米粒的透射电镜(tem)图;图2为本发明实验例1提供的索拉菲尼脂质纳米粒的直径和多分散指数(pdi)图;图3为本发明实验例1提供的索拉菲尼脂质纳米粒的特征性光谱图;图4为本发明实验例1提供的索拉菲尼脂质纳米粒吸光度和荧光强度图,其中4(a)图为吸光度图;4(b)图为荧光强度图;图5为本发明实施例提供的不同浓度条件下索拉菲尼的包封率示意图;图6为本发明实验例2提供的近红外(808nm,2w/cm2)辐照下游离sf、游离icg和sils的温升特性;图7为本发明实验例2提供的热像图;图8中(a)为5次激光照射下游离icg和sf-icg-liposomes的温度变化图;(b)为sf-icg-liposomes经激光照射(808nm,2w/cm2,5min)以及不经过激光照射时的sf释放谱;图9中(a)为不同剂量sf和icg与hep3b孵育后(pbs组,吲哚箐绿组,索拉菲尼组和本发明的索拉菲尼-吲哚箐绿-脂质体组)细胞活力的测定;(b)为激光照射前后细胞活力的测定图;图10为本发明探究小鼠肿瘤体积大小示意图;图11为hep3b荷瘤小鼠不同时间点游离icg和sf-icg-脂质体的体内荧光图像;图12为12h注射后的肿瘤裸鼠图,游离icg组和sils组;图13为游离icg组和sils组肿瘤裸鼠的血液循环曲线图;图14为不同注射时间点照射后的温度变化图;图15为近红外激光照射hep3b荷瘤小鼠红外热图。具体实施方式实施例1一、索拉菲尼脂质纳米粒(简称sils)的制备1、将二棕榈酸磷脂酰胆碱dppc、胆固醇和dspe-peg2000混合制备成磷脂。2、称取索拉菲尼(sf)与磷脂,加入甲醇与氯仿(体积比2:1)震荡溶解,得到有机相通过旋转蒸发仪旋蒸去除有机相,得到内含索拉菲尼的磷脂薄膜。3、称取吲哚箐绿(icg),加入到注射水中,溶解后得到水相。4、保持温度60℃,将水相加入到磷脂薄膜中,用磁力搅拌器以320转/分钟搅拌混合液,持续4h。将制备的脂质体超声20min,以450nm滤膜挤出一次,再以脂质体挤出器经200nm,100nm滤膜反复挤出5次后,置于4℃保存。同时制备空白脂质体(除不含索拉菲尼和吲哚箐绿外,其余同上)和sf-脂质体(除不含吲哚箐绿外,其余同上)作为对照。二、组分配比的探索为了探索索拉菲尼、吲哚箐绿、磷脂的较适合的重量比,采用高效液相色谱法(hplc)考察了脂质体包封sf的包封率(ee)。本申请人测量不同重量比下的高效液相色谱图,并在265nm处用高效液相色谱法测定sf浓度,并与sf标准曲线进行比较,用以下方程计算了sf包封率(ee%):ee%=(载药/包封剂)×100。所有实验一式三份,数据报告为三个独立实验的脑膜±标准差(sd)。如图5a所示,sf:dppc的最佳质量比为1:30。如图5b所示,胆固醇:二棕榈酸磷脂酰胆碱dppc=1:1-8;优选地,胆固醇:二棕榈酸磷脂酰胆碱dppc=1:8;如图5c所示,表明各组分的重量比为,索拉菲尼:吲哚箐绿:磷脂=1:1-8:20。优选地,索拉菲尼:吲哚箐绿:磷脂=1:2:20;需要说明这里选用dspe-peg2000:二棕榈酸磷脂酰胆碱dppc=1:10,加入dspe-peg2000是为了增加体内的长循环时间。本发明经高效液相色谱实验证实,本发明索拉菲尼-吲哚箐绿-脂质体可以显著提升索拉菲尼在水相中的溶解度。实验例1索拉菲尼脂质纳米粒性能检测1、采用透射电子显微镜负染法观察sils的形态。如图1所示,为该索拉菲尼脂质纳米粒(简称sils)的透射电镜图;透射电子显微镜(tem)图显示了清晰的典型球形脂质形状,进一步证实了sils在水中是稳定的,对囊泡的聚集和融合有一定的抑制作用。2、用zetasizernano系列纳米仪器有限公司进一步测定了sils的颗粒尺寸、多面指数(pdi)和zeta电位。如图2所示,为该索拉菲尼脂质纳米粒的直径和多分散指数(pdi)图;并汇总如下表1。表1样品大小(nm)pdizeta电位sils143.4±3.90.123±0.008-12.4±2.3粒度分布表明,sils适合于epr光热效应的靶向药物的传递。测得的zeta电位表明sils制剂对囊泡聚集和融合具有良好的稳定性。3、用紫外-可见分光度计(uv-vis分光度计,1800pc,mapada,中国)记录特征性光谱图,如图3所示。与空白脂质体和sf-脂质体(sf-liposomes)相比,sils(图中为sf-icg-liposomes)的紫外-可见吸收光谱呈现两个特征吸收峰,一个峰位于265nm处,这是sf的特征;在780nm处的第二个峰,这是icg的特征,表明这两种化合物在sils中成功地进行了包覆。4、为了比较sils与游离icg的稳定性,在4周内测定了sil制剂的吸光度和荧光强度,如图4。对于相同浓度的icg和sils(icg封装在sils中),游离icg的吸光度(初始强度的12%,如图4a)和荧光强度(仅为原始荧光强度的3%,如图4b)下降。sils包膜4周后保留初始吸光度的78%和初始荧光强度的71%;吸收强度下降越少,证明药物随时间泄露的越少,则表明越稳定,因此说明sils(icg封装在sils中)稳定性好。现有文献知游离的icg聚集在水溶液中形成二聚体和低聚物,浓度超过3.9mg/ml,导致荧光自猝灭。本研究通过在脂质体中包封icg,解决了sf的溶解度差的问题,同时提高了icg的稳定性。实验例2索拉菲尼脂质纳米粒光热效应1、为了阐明sils(60μg/mlicg)的光热效应,我们分析了近红外(808nm,2w/cm2)辐照下游离sf、游离icg和sils的温升特性,如图6所示。2、热像图(图7)显示sils和游离icg的最高温度分别为65.5℃和58.9℃。sils相对于游离icg的最高温度升高可能是由于脂质体提高了icg的稳定性和吸光度。因此,包裹icg比游离icg更有效地使得温度升高。3、我们还探讨了sils和游离icg(60μg/mlicg)的光稳定性。首先,sils和游离icg在808nm近红外激光(2.0w/cm2)下照射3分钟,然后冷却至室温。不经近红外激光照射10min。在5个周期中,sils组典型的温度为40.8,38.7,36.9,33.4和28.7;游离icg的温度为37.3,35.1,31.7,24.6(图8a)更高的温度表明sils(icg包封脂质体)比游离icg具有更高的光稳定性。我们通过观察激光照射下和不受激光照射时sils之间的明显温度变化(图8b),可视化了近红外诱导sils的sf释放(图8b),证明了热疗能控制sf在sils中的释放,降低sf的药物毒性。实验例3细胞实验1、将肝癌细胞系hep3b传入96孔板,每孔3000个细胞,分为四组,分别为pbs组,吲哚箐绿组,索拉菲尼组合索拉菲尼-吲哚箐绿-脂质体组,每组分为6个副孔,对应6个不同的浓度,培养24h后吸掉培养基,加入用dmem稀释的10%的cck8检测试剂,37℃孵箱孵育1h后检测450nm处的吸光度值,利用所得数据绘制细胞存活率曲线。由图9a可知,sils比游离sf具有更低的细胞毒性和更高的细胞存活率,特别是在高sf浓度时。表明sils可以通过脂质体包裹降低sf的细胞毒性。因此,本发明的索拉菲尼-吲哚箐绿-脂质体可以显著的减小索拉菲尼的细胞毒性。2、此外,为了保证sils适合在近红外激光照射下进行治疗,我们研究了nir激光照射下细胞存活率的变化。如图9b所示,在808nm(2.0w/cm2,10min)的光照射下,sils激光照射后hep3b细胞的存活率明显低于sils不经激光照射的hep3b细胞。这表明激光照射组的治疗效果优于不受激光照射的治疗组。实验例4体外实验1、采用balb/c裸鼠作为肿瘤模型,选择接种hep3b细胞1x106分散于100μl生理盐水中皮下注射接种,每日观察肿瘤生长情况,当肿瘤长至100mm3,将异种移植的小鼠分为四组,分别为pbs组,索拉菲尼组,索拉菲尼-吲哚箐绿脂质体加光照与不加光照组,其中光照组在尾静脉注射本发明脂质体药物12h后采用808nm激光照射10min(2.0w/cm2)。每天记录小老鼠的体重与肿瘤体积。绘制肿瘤体积曲线,由图10可知,本发明的索拉菲尼-吲哚箐绿-脂质体对比与索拉菲尼单独疗法可以显著减少肿瘤体积大小。2、活体近红外荧光图像及光热研究鉴于脂质体能提高游离icg的稳定性和靶向性,对sils(5mg/kgsf和10mgicg)对hep3b荷瘤小鼠的近红外成像进行了评价。如图11所示,我们探索了不同时间点的荧光图像。注射后24h,游离icg组荧光信号逐渐减少。sils的荧光强度明显高于游离icg组;且与游离icg比较,sils能在肿瘤部位积聚。肉眼观察发现,注射后12小时sils小鼠的肿瘤部位比游离icg小鼠的肿瘤部位更绿(图12),这说明sils不仅可以改善icg在周围环境中的稳定性,而且可以防止icg与血浆蛋白结合,从而改善血液循环时间;此外,与游离icg相比,药代动力学数据显示,sils的血液循环时间较好,如图13所示;我们还探究了sils在体内的局部加热温度(图14)不同注射时间点照射后的温度变化。为此,将sils、游离icg和pbs溶液静脉注射于hep3b荷瘤小鼠体内,于注射后8h在808nm(2.0w/cm2,5min)激光照射检测其温度变化及热像图。从热像图(图15)中可知sils,比pbs和游离icg组,有更高的肿瘤表面温度。这个结果证明了sils的光热疗特性:产生局部高温杀死肿瘤细胞。以上所述仅为本发明的较佳实施例而已,并不用以限制本发明,凡在本发明的精神和原则之内,所作的任何修改、等同替换、改进等,均应包含在本发明的保护范围之内。当前第1页12
相关技术
网友询问留言
已有0条留言
- 还没有人留言评论。精彩留言会获得点赞!
1