化合物dCTB在制备治疗癌性疼痛的药物中的应用的制作方法
本发明属于化学医药领域,具体涉及化合物dctb在制备治疗癌性疼痛的药物中的应用。
背景技术:
疼痛在正常生理情况下是机体对伤害性刺激的一种预警机制,使得机体离开危险环境从而避免受到更大的伤害,而癌性疼痛广泛存在于癌症患者中,70%癌症中晚期患者伴随中度至重度的慢性疼痛,并且在疼痛中结束生命。癌性疼痛不仅给患者带来巨大的身体痛苦和精神折磨,严重影响患者的癌症治疗和生存质量,同时会给患者家庭,社会带来沉重的经济负担。
癌性疼痛是一种严重顽固且难治的慢性疼痛,其发生发展过程包含了神经病理性疼痛和炎性疼痛两种复杂的机制,且具有与其他类型疼痛不同的病理特点,主要表现为中重度的自发性疼痛,同时伴随着一系列对外界刺激的异常痛觉,如触诱发痛,机械、热、冷觉痛敏等,疼痛视觉模拟评分(vas)在8-10分。然而,生命科学与医学领域对于癌性疼痛具体的细胞和分子机制仍然不清楚,没有发现具有明确作用的靶点药物,导致癌性疼痛的临床治疗缺乏针对性。
cn101636391b公开了一种用于神经病理性疼痛的预防剂和/或治疗剂,其使用2-[(取代茚-7-基氧基)甲基]吗啉或其可药用的盐作为有效成分。该发明有益于提供一种优异的用于神经病理性疼痛的预防剂和/或治疗剂,特别有益于提供一种用于下列疼痛的预防剂和/或治疗剂:异常性疼痛、痛觉过敏、感觉过敏、自发痛、癌性疼痛、三叉神经痛、幻肢痛、带状疱疹后疼痛、纤维肌痛综合征、腰及下肢疼痛、丘脑痛、非典型性面痛、伴随脊髓损伤的疼痛、伴随多发性硬化症的疼痛。
cn102204978a公开了一种协同治疗癌性疼痛的药物组合物及其制剂。其全部原料均为中草药,其中陈皮,枳壳,川扑理气,白花蛇舌草,熟大黄,葛根,金钱草,茵陈清热祛湿,茜草,赤芍和丹参祛瘀,当归,白芍和甘草补益的治疗方式,解决痰浊影响气的正常运行,造成气的功能失调,引起气滞出现癌性疼痛的问题。本发明的药物组合物为一种能够有效终止癌性疼痛,且无明显毒副作用,具有镇痛作用的天然中草药的药物组合物。
cn108379263a公开了一种治疗癌性疼痛的药物组合物,所述药物组合物包括以下活性成分:地西泮、氨基比林、安替比林、巴比妥。地西泮、氨基比林、安替比林、巴比妥按一定的配比联合使用时,协同增效,对于治疗癌性疼痛方面有显著的止痛效果,具有用药剂量少、药物的毒副作用低、患者的依从性高的优点,能提高癌性患者的生活质量,降低治疗成本。该药物组合物经过多例病例临床使用者证实,疗效确切,一次给药,镇痛作用可以持续或超过24小时,最长可达到36小时,且无明显的不良反应。
但是目前,针对癌性疼痛的治疗策略还很少,因此,开发一种对治疗癌性疼痛具有针对性,且疗效显著的药物是十分有意义的。
技术实现要素:
针对现有技术的不足,本发明的目的在于提供化合物dctb在制备治疗癌性疼痛的药物中的应用。
为达到此发明目的,本发明采用以下技术方案:
本发明提供了化合物dctb在制备治疗癌性疼痛的药物中的应用。
所述化合物dctb的化学名称为4-(4-(3,4-二氯苯基)-1,2,5-噻二唑-3-基)-1-丁醇醚。
所述化合物dctb的合成路线如下所示:
现有技术公开了化合物dctb具有抗肿瘤作用,但本发明首次发现了dctb具有缓解癌性疼痛的作用,能够应用于制备治疗癌性疼痛的药物。dctb是通过抑制脊髓背角yap和taz的表达和聚集来实现上述功能的,其中,yap为yes激酶相关蛋白,taz为转录联合激活因子。肿瘤压迫或者浸润导致的神经损伤,促使yap或taz在脊髓背角的表达和聚集,引起中枢敏化,产生疼痛。yap或taz在癌性疼痛的发生和发展过程中发挥类似于“开关”的作用,含量增加会导致疼痛,降低会缓解疼痛。因此,化合物dctb在制备治疗癌性疼痛的药物中具有很大的潜力,且在治疗过程中具有针对性,疗效显著。
优选地,所述癌性疼痛包括由肿瘤压迫或肿瘤浸润导致的中重度疼痛,所述中重度疼痛的表现形式包括触诱发痛、痛觉过敏或自发性疼痛。
在本发明中,所述药物的剂型包括片剂、散剂、颗粒剂、胶囊剂、注射剂、喷雾剂、膜剂、栓剂、滴鼻剂或滴丸剂。
在本发明中,所述药物的给药途径包括静脉注射、腹腔注射、肌肉注射、皮下注射、口服给药、舌下给药、鼻腔给药或经皮给药。
优选地,所述dctb为负载于药用载体上的dctb。
优选地,所述药用载体包括脂质体、胶束、树枝状大分子、微球或微囊。
化合物dctb可以负载于常用药用载体上作为治疗癌性疼痛的药物,实现更好的生物相容性、生物安全性和药效。
优选地,所述dctb为药物组合物中含有的dctb。
相对于现有技术,本发明具有以下有益效果:
本发明提供了化合物dctb的新应用,所述新应用为化合物dctb在制备治疗癌性疼痛的药物中的应用,dctb通过抑制脊髓背角的yap和taz两种蛋白的表达和聚集来实现治疗癌性疼痛的功能,且在治疗过程中具有很强的针对性,疗效显著,副作用小,耐受性低,为研究癌性疼痛的治疗策略提供了理论依据,为制备新的治疗癌性疼痛的药物提供了一个嵌入点。
附图说明
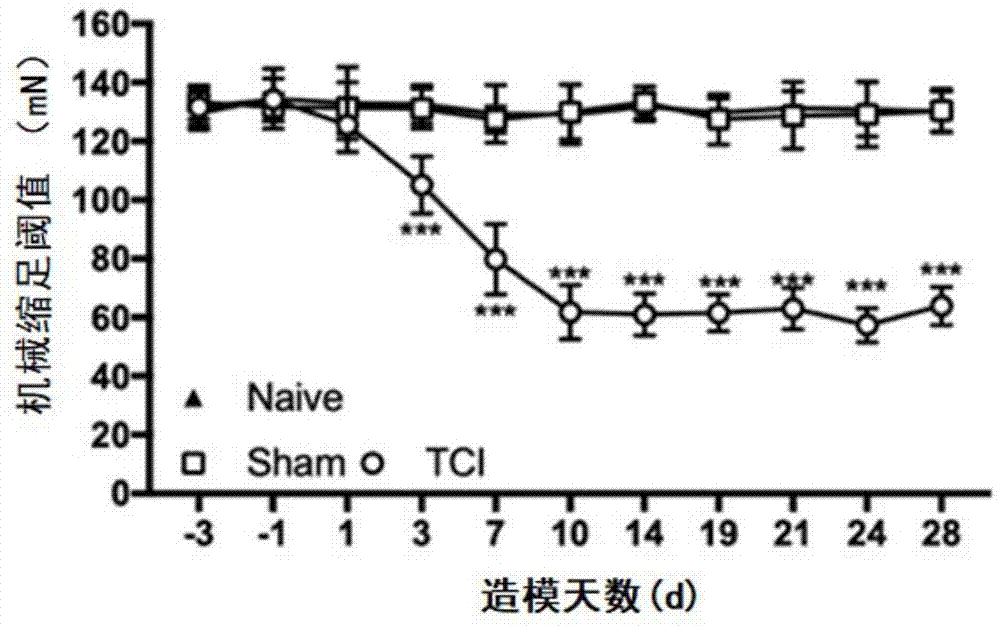
图1是实施例1大鼠的机械痛敏检测结果统计图;
图2是实施例1大鼠的热痛敏检测结果统计图;
图3是实施例2中yap和taz表达量变化结果统计图;
图4是实施例2中yap和taz的免疫蛋白印迹图;
图5是实施例3大鼠的机械痛敏检测结果统计图;
图6是实施例3大鼠的热痛敏检测结果统计图;
图7是实施例4中yap的表达量变化结果统计图;
图8是实施例4中taz的表达量变化结果统计图;
图9是实施例4中yap和taz的免疫蛋白印迹图;
图10是实施例5大鼠的机械痛敏检测结果统计图;
图11是实施例5大鼠的热痛敏检测结果统计图。
具体实施方式
下面通过具体实施方式来进一步说明本发明的技术方案。本领域技术人员应该明了,所述实施例仅仅是帮助理解本发明,不应视为对本发明的具体限制。
以下实施例选用的大鼠为sd(spraguedawley,斯普拉格-道利)大鼠。
以下实施例涉及的组别包括:tci组(即胫骨骨髓腔接种肿瘤细胞组,接种后大鼠会出现机械痛觉和热痛觉过敏)、sham组(即假手术组,大鼠胫骨骨髓腔接种已经灭活的肿瘤细胞)、naive组(即空白对照组,指大鼠不做任何处理)、sham+dctb组(即假手术组给予化合物dctb的治疗)、tci+dctb组(即接种肿瘤细胞组给予化合物dctb的治疗)。
以下实施例涉及tci模型和sham模型的制作,其制作方法具体如下:向sd大鼠腹腔注射107个肝癌walker256细胞,14天后取荷瘤鼠腹水,并1000rpm离心5min,弃上清,然后用无菌的pbs缓冲液漂洗(1000rpm×5min)2-3遍,最后用pbs缓冲液重悬肿瘤细胞浓度至1×105个/μl,置于冰盒内备用。另取调整好浓度的细胞在沸水中水浴10min,作为灭活细胞。向sd大鼠腹腔注射戊巴比妥钠(50mg/kg)麻醉后,取仰卧位固定。在左侧胫骨中上1/3处,用75%乙醇消毒,沿胫骨长轴切开皮肤,切口约1cm,分离肌肉,暴露胫骨骨面。用1ml注射器的针头在骨面上钻一小孔,然后用20μl的微量注射器经小孔进入胫骨骨髓腔,缓慢注入5μl肿瘤细胞,建立tci模型;而向sham模型大鼠注入等体积的灭活细胞。注射完毕后留针约30s,然后拔出微量注射器。针孔处用无菌骨蜡封闭,在伤口处涂抹适量青霉素粉,然后缝合。整个手术过程均按照无菌要求进行。即成功建立tci模型和sham模型。
以下实施例涉及机械痛敏和热痛敏的检测,机械痛敏和热痛敏可以分别反映出大鼠对机械刺激和热刺激的敏感程度,其值越低,代表大鼠对机械刺激和热刺激的敏感程度越强,其检测方法具体如下:机械痛敏使用金属纤维丝刺激大鼠手术侧足底皮肤,记录大鼠缩脚反射时的压力;热痛敏使用热源刺激大鼠手术侧足底皮肤,记录大鼠缩脚反射的时间。
实施例1
机械痛敏和热痛敏的检测试验(1)
随机将60只雄性大鼠分为tci组、sham组和naive组,每组20只,预饲7天。分别在造模前3天、1天、造模后1天、3天、7天、10天、14天、19天、21天、24天和28天时检测每组大鼠的机械痛敏和热痛敏,其中tci组和sham组的造模方法如上所示,机械痛敏和热痛敏的检测方法如上所示。
试验结果如图1和图2所示,大鼠在进行tci造模后,tci组机械痛敏和热痛敏均出现下降,naive组和sham组无变化,说明大鼠在接种肿瘤细胞后,会出现较为明显的癌性疼痛,且痛阈值随着时间逐渐降低。
实施例2
免疫蛋白印迹法检测大鼠脊髓背角yap和taz的表达(1)
使用实施例1中完成检测的大鼠进行如下试验:分别在造模后1天、3天、7天、14天和21天时将大鼠脱颈处死,取出大鼠l4-l5对应的脊髓片段(即脊髓的第四个和第五个腰节片段),用免疫蛋白印迹法检测脊髓背角yap和taz的表达情况。
试验结果如图3和图4所示,tci组大鼠脊髓背角的yap和taz含量在造模后1天、3天、7天、14天和21天时均有显著增加,而sham组大鼠脊髓背角的yap和taz含量没有变化,说明大鼠在接种肿瘤细胞后,其脊髓背角的yap和taz含量会显著增加,接种灭活的肿瘤细胞不会导致大鼠脊髓背角的yap和taz含量增加。
实施例3
机械痛敏和热痛敏的检测试验(2)
随机将40只雄性大鼠分为tci组、sham组、tci+dctb组和sham+dctb组,每组10只,预饲7天。分别在造模前3天、1天、造模后1天、3天、7天、10天、14天、19天、21天、24天和28天时检测每组大鼠的机械痛敏和热痛敏。其中tci组和sham组的造模方法与实施例1相同,在造模后第1天向tci+dctb组和sham+dctb组大鼠鞘内注射化合物dctb(每只大鼠给予1.6mg溶解在20μl人工脑脊液的dctb),连续给药3天。机械痛敏和热痛敏的检测方法与实施例1相同。
试验结果如图5和图6所示,大鼠在进行tci造模后,tci组大鼠机械痛敏和热痛敏均出现下降,sham组大鼠无变化,而在造模早期鞘内注射化合物dctb可以显著抑制tci组大鼠机械痛敏和热痛敏的下降,说明化合物dctb能够显著抑制癌性疼痛发生和发展。
实施例4
免疫蛋白印迹法检测大鼠脊髓背角yap和taz的表达(2)
使用实施例3中完成检测的大鼠进行如下试验:在造模后第4天将大鼠脱颈处死,取出大鼠l4-l5对应的脊髓片段(即脊髓的第四个和第五个腰节片段),用免疫蛋白印迹法检测脊髓背角yap和taz的表达情况。
试验结果如图7、图8和图9所示,tci组大鼠脊髓背角的yap和taz含量在造模后第4天时均有显著增加,sham组大鼠脊髓背角的yap和taz含量没有变化,而鞘内注射化合物dctb后,能使tci+dctb组大鼠脊髓背角的yap和taz含量相对于tci组显著降低,说明化合物dctb能够有效降低yap和taz的表达,从而达到抑制癌性疼痛发生和发展的效果。
实施例5
机械痛敏和热痛敏的检测试验(3)
随机将40只雄性大鼠分为tci组、sham组、tci+dctb组和sham+dctb组,每组10只,预饲7天。分别在造模前3天、1天、造模后1天、3天、7天、10天、14天、19天、21天、24天和28天时检测每组大鼠的机械痛敏和热痛敏。其中tci组和sham组的造模方法与实施例1相同,在造模后第10天向tci+dctb组和sham+dctb组大鼠鞘内注射化合物dctb(每只大鼠给予1.6mg溶解在20μl人工脑脊液的dctb),连续给药3天。机械痛敏和热痛敏的检测方法与实施例1相同。
试验结果如图10和图11所示,大鼠在进行tci造模后,tci组大鼠机械痛敏和热痛敏均出现下降,sham组大鼠无变化,而在造模中晚期鞘内注射化合物dctb可以显著逆转tci组大鼠机械痛敏和热痛敏的下降,说明化合物dctb能够显著抑制癌性疼痛的发展。
申请人声明,本发明通过上述实施例来说明本发明的化合物dctb在制备治疗癌性疼痛的药物中的应用,但本发明并不局限于上述实施例,即不意味着本发明必须依赖上述实施例才能实施。所属技术领域的技术人员应该明了,对本发明的任何改进,对本发明产品各原料的等效替换及辅助成分的添加、具体方式的选择等,均落在本发明的保护范围和公开范围之内。
以上详细描述了本发明的优选实施方式,但是,本发明并不限于上述实施方式中的具体细节,在本发明的技术构思范围内,可以对本发明的技术方案进行多种简单变型,这些简单变型均属于本发明的保护范围。
另外需要说明的是,在上述具体实施方式中所描述的各个具体技术特征,在不矛盾的情况下,可以通过任何合适的方式进行组合,为了避免不必要的重复,本发明对各种可能的组合方式不再另行说明。
- 还没有人留言评论。精彩留言会获得点赞!