用于制造佐剂的新型方法与流程
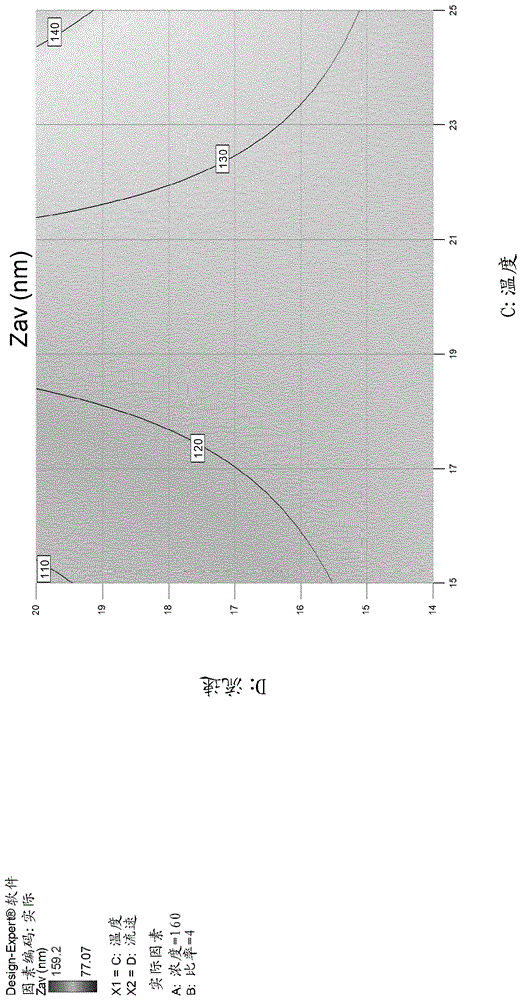
本发明涉及用于使用微流体装置制造包含皂苷的佐剂的方法和相关方面。发明背景在疫苗中包括佐剂以改善体液和细胞免疫应答,特别是在低免疫原性亚单位疫苗的情况下。与病原体的自然感染类似,佐剂依赖于先天性免疫系统的活化以促进持久的适应性免疫。由于多种先天性免疫途径的同时活化是自然感染的特征,佐剂可以组合多种免疫刺激剂以促进对疫苗接种的适应性免疫应答。佐剂系统01(as01)是基于脂质体的佐剂,其含有两种免疫刺激剂,3-o-脱酰基-4'-单磷酰脂质a(3d-mpl)和qs-21(garcon和vanmechelen,2011;didierlaurent等人,2017)。tlr4激动剂3d-mpl是来自明尼苏达沙门氏菌(salmonellaminnesota)的脂多糖的无毒衍生物。qs-21是从南美树皂树(quillajasaponaria)molina的树皮提取的天然皂苷分子(kensil等人,1991;ragupathi等人,2011)。在最近开发的疟疾疫苗rts,s(mosquirixtm)和带状疱疹(herpeszoster)hz/su疫苗(shingrixtm)中,以及针对病原体诸如人免疫缺陷病毒和结核分枝杆菌(mycobacteriumtuberculosis)开发的多种候选疫苗中包括as01。在这些候选疫苗的临床前和临床评估期间,始终观察到抗原特异性抗体和cd4+t细胞免疫。as01一致地产生针对疫苗接种的细胞免疫应答的能力使其与通常主要促进对疫苗接种的体液应答的其他佐剂分开(black等人,2015;garcon和vanmechelen,2011)。同时,as01佐剂化的疫苗在易感群体诸如婴儿(用rts,s)和老年人(用hz/su)中有效地促进对疫苗接种的免疫原性。as01注射导致动物模型中先天性免疫的快速和瞬时活化。免疫后,嗜中性粒细胞和单核细胞被迅速募集至引流淋巴结(dln)。此外,as01诱导mhcii高树突细胞(dc)的募集和活化,这是t细胞活化所必需的(didierlaurenta.m.等人,2014)。一些数据也可用于as01的组分的作用机制。3d-mpl经由tlr4信号传导,刺激nf-κb转录活性和细胞因子产生,并直接活化人和小鼠两者中的抗原呈递细胞(apc)(debecker等人,2000;ismaili等人,2002;martin等人,2003;mata-haro等人,2007)。qs-21促进小鼠中的高抗原特异性抗体应答和cd8+t-细胞应答(kensil和kammer,1998;newman等人,1992;soltysik等人,1995)和人类中的抗原特异性抗体应答(livingston等人,1994)。由于其物理特性,认为qs-21可能在体内充当危险信号(lambrecht等人,2009;li等人,2008)。尽管已显示qs-21活化asc-nlrp3炎性体和随后的il-1β/il-18释放(marty-roix,r.等人,2016),但参与皂苷的佐剂作用的确切分子途径尚未清楚地定义。已显示3d-mpl和qs-21在诱导免疫应答中协同起作用。此外,已显示提供两种免疫刺激剂的方式是影响诱导的应答的质量的重要因素,其中as01中的脂质体呈递提供比基于as02的水包油乳剂更高的功效。(dendouga等人2012)。us2010202928和us2015115488描述了使用微流体的脂质体的制备。wo2013/192310公开了通过受控的微涡旋大规模生产纳米颗粒的方法。所述方法据称可用于制备聚合物或非聚合物颗粒和杂合颗粒。kim等人nanoletters201212(7):3587-3591也公开了通过受控的微涡旋(microvortice)大规模生产纳米颗粒的方法。hood等人small20151143:5790-5799描述了用于使用微流体生产脂质体的方法。仍然需要新的制造方法,其使得能够以商业上可行的规模安全、方便和成本有效地生产脂质体佐剂,同时维持由常规制造方法产生的免疫学性能。发明概述现已令人惊讶地发现,微流体装置可用于制造包含皂苷的脂质体佐剂,同时维持与常规制造方法相当的免疫学性能。因此,提供了使用微流体装置制造包含皂苷的脂质体佐剂的方法,其包括以下步骤:(a)在所述装置中混合包含溶剂、磷脂酰胆碱脂质和固醇的第一溶液以及包含水和皂苷的第二溶液;和(b)除去溶剂。还提供了使用微流体装置制造包含皂苷的脂质体佐剂的方法,其包括以下步骤:(a)在所述装置中混合包含溶剂、磷脂酰胆碱脂质和固醇的第一溶液以及包含水的第二溶液;(b)添加皂苷;和(c)除去溶剂。进一步提供了使用微流体装置制造包含皂苷的脂质体佐剂的方法,其包括以下步骤:(a)在所述装置中混合包含溶剂、磷脂酰胆碱脂质和固醇的第一溶液以及包含水的第二溶液;(b)除去溶剂;和(c)添加皂苷。本发明还提供了制造用于使用微流体装置制备包含皂苷的脂质体佐剂的脂质体浓缩物的方法,其包括在所述装置中混合包含溶剂、磷脂酰胆碱脂质和固醇的第一溶液以及包含水和皂苷的第二溶液的步骤。还提供了制造用于使用微流体装置制备包含皂苷的脂质体佐剂的脂质体浓缩物的方法,其包括以下步骤:(a)在所述装置中混合包含溶剂、磷脂酰胆碱脂质和固醇的第一溶液以及包含水的第二溶液;和(b)添加皂苷。进一步提供了用于制备脂质体佐剂的脂质体浓缩物,所述脂质体浓缩物包含水、溶剂、磷脂酰胆碱脂质、皂苷和胆固醇。因此,提供了使用微流体装置制造包含皂苷的脂质体佐剂的方法,其包括以下步骤:(a)在所述装置中混合包含溶剂、dopc和固醇的第一溶液以及包含水和皂苷的第二溶液;和(b)除去溶剂。还提供了使用微流体装置制造包含皂苷的脂质体佐剂的方法,其包括以下步骤:(a)在所述装置中混合包含溶剂、dopc和固醇的第一溶液以及包含水的第二溶液;(b)添加皂苷;和(c)除去溶剂。进一步提供了使用微流体装置制造包含皂苷的脂质体佐剂的方法,其包括以下步骤:(a)在所述装置中混合包含溶剂、dopc和固醇的第一溶液以及包含水的第二溶液;(b)除去溶剂;和(c)添加皂苷。本发明还提供了制造用于使用微流体装置制备包含皂苷的脂质体佐剂的脂质体浓缩物的方法,其包括在所述装置中混合包含溶剂、dopc和固醇的第一溶液以及包含水和皂苷的第二溶液的步骤。还提供了制造用于使用微流体装置制备包含皂苷的脂质体佐剂的脂质体浓缩物的方法,其包括以下步骤:(a)在所述装置中混合包含溶剂、dopc和固醇的第一溶液以及包含水的第二溶液;和(b)添加皂苷。进一步提供了用于制备脂质体佐剂的脂质体浓缩物,所述脂质体浓缩物包含水、溶剂、dopc、皂苷和胆固醇。本发明另外提供了包含溶剂和100-170mg/ml脂质的溶液,其中所述溶剂包含70-90%v/v乙醇和10-30%v/v异丙醇。此类溶液可用于制造脂质体、诸如脂质体佐剂。附图简述图1:单混合室微流体芯片的示意图图2:八个混合室微流体芯片图3:液体分配歧管(一至十六个)图4:具有分配和收集歧管的两个八个混合室微流体芯片的操作排列图5:储备物制备方法对脂质体大小分布的影响图6:储备物稳定性对浓度和温度的依赖性图7:溶剂组成和温度对脂质体大小的影响图8:实施例4操作条件和组织排列的详情图9:实施例4测试条件的视觉概述图10:实施例4的结果图11:zav和pdi之间的关系图12:在100mg/mldopc和比率5(1:4有机相:水相)下的大小预测图13:在130mg/mldopc和比率5(1:4有机相:水相)下的大小预测图14:在160mg/mldopc和比率5(1:4有机相:水相)下的大小预测图15:在100mg/mldopc和比率4(1:3有机相:水相)下的大小预测图16:在100mg/mldopc和比率6(1:5有机相:水相)下的大小预测图17:在130mg/mldopc和比率6(1:5有机相:水相)下的大小预测图18:在130mg/mldopc和比率4(1:3有机相:水相)下的大小预测图19:在160mg/mldopc和比率4(1:3有机相:水相)下的大小预测图20:在160mg/mldopc和比率6(1:5有机相:水相)下的大小预测图21:在130mg/mldopc和比率5(1:4有机相:水相)下的证实条件图22:ge-特异性igg滴度图23:ge-特异性cd4+t细胞的百分比图24:微流体产生的脂质体大小和储存后的pdi稳定性图25:商业规模多室方法的示意图图26:初始歧管设计的示意图图27:初始歧管的测试设置的照片图28:初始歧管在200ml/min下观察到的流速变化图29:初始歧管在50ml/min下观察到的流速变化图30:比较流速分布的预测值和测量值的图表图31:改进的歧管设计的示意图图32:通过改进的歧管单元1(‘b1’)的每个通道的流速与平均值的变化图33:通过改进的歧管单元2(‘b2’)的每个通道的流速与平均值的变化图34:通过改进的歧管单元3(‘a2’)的每个通道的流速与平均值的变化图35:16个混合室和单个混合室脂质体之间的大小分布比较图36:微流体和薄膜脂质体佐剂之间的ge-特异性igg滴度比较图37:微流体和薄膜脂质体佐剂之间的ge-特异性cd4+t细胞比较图38:微流体和薄膜脂质体佐剂之间的ge-特异性igg滴度gmr比较图39:微流体和薄膜脂质体佐剂之间的ge-特异性cd4+t细胞gmr比较图40:16个混合室和单个混合室脂质体(具有皂苷(qs21)和tlr4激动剂(3d-mpl))之间的大小分布比较序列标识符的描述seqidno.1:rts多肽序列seqidno.2:结核分枝杆菌h37rv菌株rv1196多肽序列seqidno.3:结核分枝杆菌h37rv菌株rv0125多肽序列seqidno.4:m72融合多肽序列seqidno.5:m72-2his融合多肽序列seqidno.6:水痘带状疱疹病毒截短的ge多肽序列seqidno.7:构象约束的rsvpref抗原多肽序列seqidno.8:hivtv1gp120多肽序列seqidno.9:hiv1086.cgp120多肽序列。详述本发明提供了使用微流体装置制造包含皂苷的脂质体佐剂的方法,其包括以下步骤:(a)在所述装置中混合包含溶剂、磷脂酰胆碱脂质和固醇的第一溶液以及包含水和皂苷的第二溶液;和(b)除去溶剂。还提供了使用微流体装置制造包含皂苷的脂质体佐剂的方法,其包括以下步骤:(a)在所述装置中混合包含溶剂、磷脂酰胆碱脂质和固醇的第一溶液以及包含水的第二溶液;(b)添加皂苷;和(c)除去溶剂。进一步提供了使用微流体装置制造包含皂苷的脂质体佐剂的方法,其包括以下步骤:(a)在所述装置中混合包含溶剂、磷脂酰胆碱脂质和固醇的第一溶液以及包含水的第二溶液;(b)除去溶剂;和(c)添加皂苷。本发明还提供了制造用于使用微流体装置制备包含皂苷的脂质体佐剂的脂质体浓缩物的方法,其包括在所述装置中混合包含溶剂、磷脂酰胆碱脂质和固醇的第一溶液以及包含水和皂苷的第二溶液的步骤。还提供了制造用于使用微流体装置制备包含皂苷的脂质体佐剂的脂质体浓缩物的方法,其包括以下步骤:(a)在所述装置中混合包含溶剂、磷脂酰胆碱脂质和固醇的第一溶液以及包含水的第二溶液;和(b)添加皂苷。进一步提供了用于制备脂质体佐剂的脂质体浓缩物,所述脂质体浓缩物包含水、溶剂、磷脂酰胆碱脂质、皂苷和胆固醇。本发明还提供了使用微流体装置制造包含皂苷的脂质体佐剂的方法,其包括以下步骤:(a)在所述装置中混合包含溶剂、dopc和固醇的第一溶液以及包含水和皂苷的第二溶液;和(b)除去溶剂。还提供了使用微流体装置制造包含皂苷的脂质体佐剂的方法,其包括以下步骤:(a)在所述装置中混合包含溶剂、dopc和固醇的第一溶液以及包含水的第二溶液;(b)添加皂苷;和(c)除去溶剂。进一步提供了使用微流体装置制造包含皂苷的脂质体佐剂的方法,其包括以下步骤:(a)在所述装置中混合包含溶剂、dopc和固醇的第一溶液以及包含水的第二溶液;(b)除去溶剂;和(c)添加皂苷。本发明还提供了制造用于使用微流体装置制备包含皂苷的脂质体佐剂的脂质体浓缩物的方法,其包括在所述装置中混合包含溶剂、dopc和固醇的第一溶液以及包含水和皂苷的第二溶液的步骤。还提供了制造用于使用微流体装置制备包含皂苷的脂质体佐剂的脂质体浓缩物的方法,其包括以下步骤:(a)在所述装置中混合包含溶剂、dopc和固醇的第一溶液以及包含水的第二溶液;和(b)添加皂苷。进一步提供了用于制备脂质体佐剂的脂质体浓缩物,所述脂质体浓缩物包含水、溶剂、dopc、皂苷和胆固醇。本发明另外提供了包含溶剂和100-170mg/ml脂质的溶液,其中所述溶剂包含70-90%v/v乙醇和10-30%v/v异丙醇。本发明另外提供了包含溶剂和100-170mg/ml脂质的溶液,其中所述溶剂包含70-90%v/v乙醇和10-30%v/v异丙醇。此类溶液可用于制造脂质体、诸如脂质体佐剂。微流体装置微流体装置是一种流体处理设备,其中通常至少一个方面具有亚毫米规模的尺寸,并且通常通过被动方式(即通过流体流的接触并且在混合室内没有移动部件)进行混合。所述微流体装置将包括混合室,在所述混合室内混合第一溶液和第二溶液。所述混合室将通常具有25.6mm2或更小、诸如12.8mm2或更小、合适地6.4mm2或更小、特别是3.2mm2或更小且尤其是1.6mm2或更小的横截面积。所述混合室将通常具有0.1mm2或更大、合适地0.2mm2或更大、特别是0.3mm2或更大且尤其是0.4mm2或更大的横截面积。在一些实施方案中,所述混合室将具有0.2-3.2mm2、诸如0.4-1.6mm2、特别是0.6-1.2mm2且尤其是0.7-1.0mm2(例如0.8mm2)的横截面积。所述混合室的横截面可以是任何形状,尽管通常是对称的。所述横截面可以是基本上矩形的(诸如正方形)。所述横截面本质上可以是延长的,其中较大的尺寸是垂直尺寸的至少两倍,诸如至少三倍或至少四倍。所述较大的尺寸可以是垂直尺寸的不大于十倍,诸如不大于八倍或不大于六倍。所述较大的尺寸将通常是垂直尺寸的2至10倍,诸如3至8倍,特别是4至6倍,尤其是5倍。矩形横截面可以具有1-8mm、诸如1-4mm、例如1.4-3.2mm、特别是1.6-2.4mm、尤其是1.8-2.2mm(例如2mm)的长边。矩形横截面可以具有0.1to4mm、例如0.1to2mm、任选地0.1-1.2mm、诸如0.1-0.8mm、特别是0.2-0.6mm、尤其是0.3-0.5mm(例如0.4mm)的短边。所述微流体装置将具有至混合室的用于递送第一溶液的至少一个入口(诸如一个入口)。所述装置可以具有至混合室的用于递送第一溶液的多个入口,诸如两个入口。合适地,所述微流体装置将具有至混合室的用于递送第一溶液的五个或更少个入口,例如四个或更少个。所述微流体装置将具有至混合室的用于递送第二溶液的至少一个入口。所述装置可以具有至混合室的用于递送第二溶液的多个入口,诸如两个入口。合适地,所述微流体装置将具有至混合室的用于递送第二溶液的五个或更少个入口,例如四个或更少个。为了促进充分的混合,对于具有较大横截面积的混合室,可以增加第一溶液和第二溶液的入口的数目。所述入口的横截面可以是任何形状,尽管通常是对称的。所述横截面可以是矩形的(诸如正方形)。每个入口将通常具有1.28mm2或更小、合适地0.64mm2或更小、特别是0.32mm2或更小且尤其是0.16mm2或更小的横截面积。每个入口将通常具有0.01mm2或更大、合适地0.02mm2或更大、特别是0.03mm2或更大且尤其是0.04mm2或更大的横截面积。在一些实施方案中,每个入口将具有0.02-0.32mm2、诸如0.04-0.16mm2、特别是0.06-0.12mm2且尤其是0.07-0.10mm2(例如0.8mm2)的横截面积。所有入口的总横截面积将合适地是所述混合室的横截面积的小于70%,诸如小于60%且特别是小于50%。方便地,所述入口可以跨越所述混合室的一侧的全长。每个入口的形状和大小可以独立地变化。然而,通常第一溶液的入口将在形状和大小上相同,且第二溶液的入口将在形状和大小上相同。方便地,所有入口在形状和大小上都相同。每个入口可以是所述混合室的宽度的2-20%,例如5-15%,诸如8-12%,特别是10%。一种特殊的入口设计形状为矩形,0.2mm宽,且横跨所述混合室的另一侧的全长(例如0.4mm高)。所述入口将通常被定位,使得第一溶液和第二溶液流入混合室的方向基本上平行于(例如,在15度内,诸如在10度内,特别是在5度内),诸如平行于,流过所述混合室的总体方向。所述微流体装置将具有来自所述混合室的至少一个出口,用于回收混合材料。所述装置可以具有来自所述混合室的多个出口,用于回收混合材料,诸如两个或三个出口,随后将其组合。合适地,所述装置将具有来自所述混合室的单个出口,用于回收混合材料。所述出口的横截面可以是任何形状,尽管通常是对称的。所述横截面可以是矩形的(诸如正方形),通常具有0.2-1mm2、诸如0.3-0.6mm2、例如0.4-0.5mm2的面积。在其他实例中,所述出口可以具有圆形横截面(例如,具有0.5-1mm、诸如0.6-0.8mm、例如0.75mm的直径)。所有出口的总横截面积将合适地是所述混合室的横截面积的小于70%,诸如小于60%且特别是小于50%。所述混合室应当具有足够长度,以允许到液体到达出口时混合基本上完成。通常,所述室将长度为1-10cm,诸如1.5-5cm,特别是1.8-4cm,尤其是2-3cm,例如2.5cm。在一个实施方案中,所述装置包括混合室,其横截面为矩形,具有0.2-3.2mm2(例如0.6-1.0mm2)的横截面积,1.4-3.2mm(例如1.6-2.4mm)的长边,0.1-1.2mm(例如0.32-0.48mm)的短边,用于第一溶液的入口和用于第二溶液的两个入口(所述入口对称地设置在混合室的近端),1.5-5cm(例如2-3cm)的混合室长度,和位于混合室的远端的出口。合适地,所述入口宽度为0.16-0.24mm,且跨越所述混合室的另一侧的全长。所述微流体装置可以由任何合适的材料(即耐受第一溶液和第二溶液中使用的组分且可经受制造的材料)形成。合适的材料包括硅和玻璃。不锈钢是另一种合适的材料。可以通过蚀刻从此类材料制备装置,例如可以通过深度反应性离子蚀刻(drie或等离子体蚀刻)来制备硅装置,并且可以通过湿蚀刻(hf蚀刻)来制备玻璃装置。所选材料可以进行表面处理以改进表面的特征。为了达到作为可管控的时间段(例如240分钟或更短,特别是120分钟或更短)的批量运行持续时间,系统必需达到足够的生产率水平。另外,为了通过减少启动和关闭效应的影响来帮助批次间一致性,运行时间必需具有足够的长度(例如,至少30分钟,特别是至少60分钟)。微流体装置按比例放大为了促进以工业规模(例如每分钟至少0.5g磷脂酰胆碱脂质、诸如每分钟至少1g,尤其是每分钟至少2g且特别是每分钟至少4g的规模,诸如每分钟至少0.5gdopc、诸如每分钟至少1g、尤其是每分钟至少2g且特别是每分钟至少4g的规模)产生脂质体佐剂,可以使用大型混合室或可以平行操作多个混合室。例如,2个或更多个混合室,尤其是4个或更多个,特别是8个或更多个,诸如16个或更多个(例如16个)。平行操作的多个混合室可以是128个或更少个,诸如64个或更少个,尤其是32个或更少个。因此,在一些实施方案中,所述多个混合室是2-128个,诸如4-64个,例如8-32个。在一些情况下,来自多个混合室的每个混合室可以独立地操作,其中第一溶液和第二溶液通过独立的泵提供给混合室(即,每个泵不同时向任何其他混合室提供溶液)。可以将第一溶液和/或第二溶液储存于独立的容器(即,不同时向多于一个混合室提供第一溶液和/或第二溶液的容器)中,或者可以将第一溶液和/或第二溶液储存于用于多于一个混合室(诸如所有混合室)的容器中。来自每个混合室的混合材料可以单独地回收和储存/处理,任选地在随后的阶段组合,或者可以在进一步处理和/或储存之前组合(例如来自所有混合室)。方便地,多个混合室中的所有混合室由相同的泵供应,并且在进一步处理和/或储存之前收集来自所有混合室的混合材料。合适地,所有混合室和所有混合室内的流体流是基本上相同的,使得从每个混合室获得的材料是基本上相同的。期望地,在每个混合室中测量的流速与期望的流速相比变化小于5%。最佳地,配置混合室、入口和出口、第一溶液、第二溶液的供应以及多个混合室的混合材料的收集,使得在操作中它们基本上相同地进行。来自多个混合室的每个混合室可以被配置为单独的芯片,或者为了方便起见,可以在单个芯片中组合多个混合室(例如,含有8个混合室)。可以平行使用多个此类芯片以提供多个室(例如,两个芯片,其各自含有8个混合室,以提供总共16个待平行操作的混合室)。合适地,多个混合室能够以50-2000ml/min、诸如100-1000ml/min、特别是200-500ml/min的总速率产生混合材料。本文所述的微流体装置是本发明的一个方面。第一溶液第一溶液(‘有机’相)包含溶剂、磷脂酰胆碱脂质和固醇。合适地,所述第一溶液包含溶剂、dopc和固醇。所述溶剂应当溶解磷脂酰胆碱脂质(诸如dopc)、固醇和存在的任何其他组分,以提供作为单相的第一溶液。此外,所述溶剂应当与水溶液可混溶,使得所述第一溶液和第二溶液的混合产生包含脂质体的悬浮液的单一液相。所述溶剂将是有机溶剂或包含至少一种有机溶剂的单相混合物。所述溶剂可以包含短链有机醇,诸如乙醇和/或异丙醇。合适地,所述溶剂将包含乙醇,诸如浓度为70-90%v/v,更合适地75-85%v/v,或78-82%v/v。合适地,所述溶剂将包含异丙醇,诸如浓度为10-30%v/v,更合适地15-25%v/v,或18-22%v/v。合适地,所述溶剂将基本上由以下组成:浓度为70-90%v/v的乙醇和浓度为10-30%v/v的异丙醇,诸如浓度为75-85%v/v的乙醇和浓度为15-25%v/v的异丙醇,特别是浓度为78-82%v/v的乙醇和浓度为18-22%v/v的异丙醇,尤其是浓度为80%v/v的乙醇和浓度为20%v/v的异丙醇。在较高乙醇浓度(诸如高于90%v/v乙醇)下,溶剂的溶解能力受限制(其最终限制系统容量)。在较低乙醇浓度(诸如低于70%v/v乙醇)下,该方法可能对操作参数(诸如温度)更敏感。如所提及,第一溶液将包含磷脂酰胆碱脂质。磷脂酰胆碱脂质将含有具有12-20个碳原子、任选地具有一个双键的非支链的酰基链,特别感兴趣的是拥有具有14-18个碳原子、任选地具有一个双键的酰基链的那些。通常,脂质分子中的两个酰基链各自是相同的。感兴趣的特定磷脂酰胆碱脂质包括:饱和磷脂酰胆碱脂质-二月桂酰基磷脂酰胆碱(dlpc)、二肉豆蔻酰基磷脂酰胆碱(dmpc)、二棕榈酰基磷脂酰胆碱(dppc)、二硬脂酰基磷脂酰胆碱(dspc)和二花生四烯酰基磷脂酰胆碱(dapc);和不饱和磷脂酰胆碱脂质二棕榈油酰基磷脂酰胆碱和二油酰基磷脂酰胆碱(dopc);及其混合物。合适地,磷脂酰胆碱脂质基本上从其他脂质纯化。通常,磷脂酰胆碱脂质是至少80%纯的,诸如至少90%纯的,特别是至少95%纯的,尤其是98%纯的,例如至少99%或甚至至少99.8%纯的。因此,本发明提供了包含溶剂和100-170mg/ml脂质的溶液,其中所述溶剂包含70-90%v/v乙醇和10-30%v/v异丙醇。合适地,所述脂质是磷脂酰胆碱脂质,因此合适地,提供的溶液是第一溶液。如所提及,所述第一溶液合适地包含dopc(二油酰基磷脂酰胆碱)。合适地,dopc基本上从其他酰基链类型和其他头基类型两者的其他脂质纯化。通常,dopc是至少90%纯的,诸如至少95%纯的,特别是至少98%纯的,尤其是99%纯的,例如至少99.8%纯的。合适地,所述第一溶液包含100-170mg/mldopc,诸如100-160mg/mldopc,特别是120-160mg/ml。所述第一溶液可以包含120-150mg/mldopc,诸如120-140mg/mldopc。尤其是,所述第一溶液可以包含约130mg/mldopc(例如125-135mg/mldopc,特别是130mg/mldopc)。所述固醇将通常是胆固醇。胆固醇在merckindex,第13版,第381页中公开为在动物脂肪中发现的天然固醇。胆固醇具有式(c27h46o),并且也被称为(3β)-胆甾-5-烯-3-醇。合适地,所述第一溶液包含20-50mg/ml固醇(例如胆固醇),诸如25-40mg/ml,特别是约32.5mg/ml(例如30-35mg/ml,尤其是32.5mg/ml)。合适地,所述第一溶液的干重是100-250mg/ml,诸如140-220mg/ml,特别是150-220mg/ml。因此,本发明提供了包含溶剂和100-170mg/ml脂质的溶液,其中所述溶剂包含70-90%v/v乙醇和10-30%v/v异丙醇。合适地,所述脂质是dopc,因此合适地,提供的溶液是第一溶液。用于本发明中的脂质通常是成膜脂质。成膜脂质包含各种各样的结构,包括磷脂(例如磷脂酰胆碱、磷脂酰乙醇胺、磷脂酰甘油、磷脂酰肌醇和磷脂酰丝氨酸)、神经酰胺和鞘磷脂。成膜脂质通常具有极性头基(其在膜中朝向水相对齐)和一个或多个(例如两个)疏水性尾基(其在膜中缔合以形成疏水核)。所述疏水性尾基通常将呈酰基酯的形式,其长度(例如8至26个碳原子)和其不饱和度(例如一个、两个或三个双键)两者均可以变化。用于本发明中的脂质可以是天然或合成来源的,并且可以是单一纯组分(例如,基于重量计,90%纯的,特别是95%纯的,且合适地99%纯的),单类脂质组分(例如,磷脂酰胆碱的混合物,或可替代地,具有保守的酰基链类型的脂质的混合物)或可以是许多不同脂质类型的混合物。在本发明的一个实施方案中,所述脂质是单一纯组分。纯脂质通常是合成或半合成来源的。用于本发明中的纯脂质的实例包括磷脂酰胆碱(例如,dlpc、dmpc、dppc、dspc和dopc;尤其是dlpc、dmpc、dppc和dopc;特别是dopc)和磷脂酰甘油(例如dppg),合适地磷脂酰胆碱。纯脂质的使用由于其限定的组成是期望的,然而,它们通常更昂贵。在本发明的一个实施方案中,所述脂质是组分的混合物。用于本发明中的脂质的混合物可以是天然来源的,通过本领域技术人员已知的手段通过提取和纯化获得。天然来源的脂质混合物通常比纯合成脂质显著便宜。天然来源的脂质包括从鸡蛋或大豆提取的脂质,所述提取物将通常含有具有酰基链长度、不饱和度和头基类型的混合物的脂质。通常可以预期植物来源的脂质提取物表明比动物来源的那些更高水平的不饱和度。应当注意的是,由于来源的变化,脂质提取物的组成可以在批次间变化。在本发明的一个实施方案中,所述脂质是一种脂质提取物,其含有至少50重量%、特别是至少75重量%且合适地至少90重量%的单一头基类型的磷脂(例如磷脂酰胆碱)。在本发明的第二个实施方案中,特定脂质提取物由于它们相对便宜的成本可以是优选的。在本发明的第三个实施方案中,所述脂质是具有保守的酰基链长度(例如至少50重量%、特别是至少75重量%且合适地至少90重量%)、例如长度为12个(例如月桂基)、14个(例如肉豆蔻基)、16(例如棕榈基)或18个(例如硬脂基或油酰基)碳原子的脂质混合物。合适地,用于本发明中的脂质提取物将包含至少50重量%磷脂(例如,磷脂酰胆碱和磷脂酰乙醇胺),特别是至少55重量%磷脂,尤其是至少60重量%磷脂(诸如75重量%或90重量%)。脂质混合物也可以通过纯脂质的组合或通过一种脂质提取物与其他脂质提取物或与纯脂质的组合来制备。脂质(例如,dopc)与固醇的比率通常为3:1至5:1w/w,诸如3.5:1至4.5:1w/w。在一些实施方案中,所述第一溶液基本上由溶剂和100-160mg/ml脂质和30-40mg/ml胆固醇组成,其中所述溶剂包含70-90%v/v乙醇和10-30%v/v异丙醇。期望地,所述脂质是磷脂酰胆碱。合适地,所述脂质是dopc。为了制备包含tlr4激动剂的脂质体佐剂,所述第一溶液中可以任选地包括tlr4激动剂。所述第一溶液可以含有1-25mg/ml的tlr4激动剂,诸如2-16mg/ml,特别是3-12mg/ml,且尤其是4-10mg/ml(例如约6.5,诸如5.5-7.5mg/ml,特别是6.5mg/ml)。本发明还提供了用于制备包含溶剂、脂质、胆固醇和tlr4激动剂的溶液的方法,所述方法包括以下步骤:(i)制备tlr4激动剂在至少一部分溶剂中的悬浮液;(ii)合并悬浮的tlr4激动剂与磷脂酰胆碱脂质和胆固醇;(iii)添加另外的溶剂;(iv)混合。本发明还提供了用于制备包含溶剂、脂质、胆固醇和tlr4激动剂的溶液的方法,所述方法包括以下步骤:(i)制备tlr4激动剂在至少一部分溶剂中的悬浮液;(ii)合并悬浮的tlr4激动剂与dopc和胆固醇;(iii)添加另外的溶剂;(iv)混合。合适地,所述混合在30-50℃、特别是35-45℃、诸如40℃的温度下进行。合适地,所述溶剂的至少一部分是所述溶剂的至少25%,特别是至少35%,且尤其是至少45%。合适地,所述至少一部分是所述溶剂的90%或更少,诸如80%或更少,特别是70%或更少,且尤其是60%或更少。在一些实例中,所述至少一部分是所述溶剂的35-70%,诸如45-60%。合适地,所述另外的溶剂是任何剩余的溶剂,尽管其可以是剩余的溶剂的一部分,后来添加额外的溶剂。因此,本发明还提供了用于制备包含溶剂、脂质、胆固醇和tlr4激动剂的溶液的方法,所述方法包括以下步骤:(i)制备tlr4激动剂在至少一部分溶剂中的悬浮液;(ii)合并悬浮的tlr4激动剂与磷脂酰胆碱脂质和胆固醇;(iii)添加另外的溶剂;(iv)混合;(v)添加额外的溶剂。合适地,所述另外的溶剂是任何剩余的溶剂,尽管其可以是剩余的溶剂的一部分,后来添加额外的溶剂。因此,本发明还提供了用于制备包含溶剂、脂质、胆固醇和tlr4激动剂的溶液的方法,所述方法包括以下步骤:(i)制备tlr4激动剂在至少一部分溶剂中的悬浮液;(ii)合并悬浮的tlr4激动剂与dopc和胆固醇;(iii)添加另外的溶剂;(iv)混合;(v)添加额外的溶剂。所述额外的溶剂可以是所述溶剂的0-30%,诸如0-20%。由上述方法中的任一种产生的溶液随后可以过滤以除去任何颗粒物质,然后用于微流体装置中。所述方法的其他特征可以如针对第一溶液所述,例如,所述溶液包含100-160mg/ml脂质和30-40mg/ml胆固醇,其中所述溶剂包含70-90%v/v乙醇和10-30%v/v异丙醇。期望地,所述脂质是磷脂酰胆碱。合适地,所述脂质是dopc。合适地,所述溶液包含4-10mg/mltlr4激动剂,尤其是3d-mpl。合适地,本发明提供了基本上由100-160mg/ml脂质和30-40mg/ml胆固醇组成的溶液,且其中所述溶剂包含70-90%v/v乙醇和10-30%v/v异丙醇。期望地,所述脂质是磷脂酰胆碱,更合适地,所述脂质是dopc。合适地,所述溶液包含4-10mg/mltlr4激动剂,尤其是3d-mpl。第二溶液所述第二溶液(“水相”)包含水,且在一些方法中可以包含皂苷。所述第二溶液充当反溶剂,在与所述第一溶液混合后引起导致脂质体的形成。组分从第一溶液沉淀越快,通常获得的脂质体越小。所述第二溶液将基本上是水性的,并且将包含至少90%v/v水,诸如至少95%水,特别是至少98%水,且尤其是100%水。当存在于所述第二溶液中时,合适地,皂苷以0.05-25mg/ml、诸如0.2-10mg/ml、特别是0.5-5mg/ml且尤其是0.8-3mg/ml(例如约1.625mg/ml,诸如1.2-2mg/ml,特别是1.625mg/ml)的浓度存在。当所述第二溶液中不存在皂苷时,合适地,所述第二溶液基本上由水组成(诸如由水组成)。当所述第二溶液中存在皂苷时,合适地,所述第二溶液基本上由水和皂苷组成(诸如由水和皂苷组成),例如所述第二溶液可以通过注射用水中的皂苷(例如qs-21)。所述第二溶液的离子强度将合适地是150nm或更低,诸如100nm或更低,尤其是80nm或更低,特别是60nm或更低,例如40nm或更低。电导率可以是水溶液的离子强度的方便替代物。所述第二溶液的电导率将合适地是12ms/cm或更低,例如10ms/cm或更低,8ms/cm或更低,6ms/cm或更低,或4ms/cm或更低。合适地,所述第二溶液基本上由水性皂苷组成。微流体操作最佳操作条件将取决于所述装置的精确配置和所述产物的期望特征。合适地,进入所述混合室的总流速是15-30ml/min/mm2混合室横截面,诸如16-28ml/min/mm2,特别是17.5-25ml/min/mm2,且尤其是19-21(例如20ml/min/mm2)。合适地,所述第一溶液和第二溶液的流速比率将在1:2至1:6的范围内,诸如1:3至1:5,特别是1:3.5至1:4.5,且尤其是1:4。混合材料中的溶剂的高水平可能影响脂质体的稳定性,因此期望地避免导致高溶剂浓度的流速比率–50%的溶剂浓度由1:1的比率导致,33%的溶剂浓度由1:2的比率导致,25%的溶剂浓度由比率1:3导致,20%的溶剂浓度由比率1:4导致,且16%的溶剂浓度由比率1:5导致。所述第一溶液的低流速降低系统生产率。由于与含有超过某些阈值(例如50l)的组合物的溶剂的处理和使用相关的安全方案,导致混合材料的相对大体积的流速比率是不太期望的。合适地,所述第一溶液进入所述混合室的总流速在2-7.5ml/min/mm2混合室横截面的范围内,诸如2.5-7ml/min/mm2,特别是3-6.5ml/min/mm2,且尤其是3.5-6(例如5)ml/min/mm2。合适地,所述第二溶液进入所述混合室的总流速在11-25ml/min/mm2混合室横截面的范围内,诸如12-20ml/min/mm2,特别是14-18ml/min/mm2,且尤其是15-17(例如16)ml/min/mm2。所述第一溶液和第二溶液将通常在10-30℃的范围内、诸如15-25℃、尤其是18-22℃、特别是20℃)的温度下提供,并且可以在相同或不同的温度下,合适地在相同温度下且特别是在20℃下进行。所述混合室可以维持在10-30℃的范围内、诸如15-25℃、尤其是18-22℃、特别是20℃的温度下。根据所述装置和环境条件的设计,可能仅必需主动控制所述第一溶液和第二溶液的温度,而不必主动控制混合室温度。所述第一溶液和第二溶液的混合可以是适度放热的。较低操作温度导致形成较小的脂质体。所述微流体装置可以在受控温度环境内操作,例如其中温度维持在10-30℃的范围中,诸如15-25℃,尤其是约20℃(诸如18-22℃,尤其是20℃)。无需控制所述系统的工作压力。合适地,所述混合室内的最大雷诺数是2100,尤其是1800,诸如1500,特别是1000,例如500。所述混合室内的最大雷诺数合适地在25至1500的范围内,更合适地在50至500之间,尤其是75至300,且特别是100至200。用于计算雷诺数的方法是本领域技术人员已知的,并在本文的实施例中举例说明。脂质体在所述第一溶液和第二溶液混合后,将形成脂质体。术语‘脂质体’是本领域中是众所周知的,并且定义一般类别的囊泡,其包含围绕水性空间的一个或多个脂质双层。因此,脂质体由一个或多个脂质和/或磷脂双层组成,并且可以在其结构中含有其他分子,诸如蛋白或碳水化合物。因为存在脂质相和水相两者,脂质体可以包封或捕获水溶性材料、脂溶性材料和/或两亲性化合物。脂质体大小可以从30nm至几μm变化,这取决于磷脂组成和用于其制备的方法。本发明的脂质体含有磷脂酰胆碱脂质,或基本上由磷脂酰胆碱脂质和固醇(如果适用的话具有皂苷和tlr4激动剂)组成。合适地,本发明的脂质体含有dopc,或基本上由dopc和固醇(如果适用的话具有皂苷和tlr4激动剂)组成。在本发明中,脂质体大小将在50nm至200nm的范围内,特别是60nm至180nm,诸如70-165nm。最佳地,脂质体应当是稳定的并且具有~100nm的直径以允许通过过滤方便地灭菌。脂质体的结构完整性可以通过方法诸如测量脂质体的大小(z-平均直径,zav)和多分散性的动态光散射(dls),或通过用于分析脂质体结构的电子显微镜来评价。合适地,平均粒径在95和120nm之间,和/或,多分散性(pdi)指数不大于0.35,尤其是不大于0.3,诸如不大于0.25。在一个实施方案中,平均粒径在95和120nm之间,和/或,多分散性(pdi)指数不大于0.2。在一些情况下,溶剂和某些额外组分的存在可以影响脂质体大小。因此,在除去溶剂和并入任何额外组分之后,合适地测量脂质体大小。除去溶剂回收的混合材料将在水和溶剂中包含脂质体。此类材料是用于制备脂质体佐剂的脂质体浓缩物,所述脂质体浓缩物包含水、溶剂、磷脂酰胆碱脂质、皂苷和胆固醇,诸如包含水、溶剂、dopc、皂苷和胆固醇。回收的材料可以储存用于后来使用,或者可以进一步处理以除去所述溶剂的一些或全部。为了促进脂质体在佐剂中的使用,期望除去基本上所有的有机溶剂(例如,留下至少98%w/w水,诸如至少99%水,特别是至少99.5%水,尤其是至少99.9%水,诸如至少99.99%)。合适地,残余有机溶剂的水平等于每人剂量小于150ug,诸如每人剂量小于100ug,诸如每人剂量小于50ug,且特别是每人剂量小于20ug(例如每人剂量10ug或更少)。期望地,所述残余有机溶剂的水平符合国际协调委员会关于人用药物的技术要求的残余溶剂指南q3c(r6)。可以通过多种方法来进行溶剂除去,所述方法可以单独或组合使用。合适的方法包括超滤和透析,特别是渗滤。可以通过透析进行所述溶剂的至少一部分、诸如所述溶剂的基本上全部的除去。透析是使用半渗透性密闭容器,所述半渗透性密闭容器是选择性渗透的,使得当将回收的材料引入半渗透性密闭容器时,所述溶剂将穿过容器的半渗透性部分,并且将保留脂质体(还有皂苷和tlr4激动剂,如果存在的话)。例如,所使用的半渗透性密闭容器可以包括单个半渗透膜,并且可以通过将包含回收的材料的半渗透性密闭容器浸入交换介质中并允许通过膜分离的液体通过扩散达到平衡而实现溶剂除去。透析可以以分批或连续操作模式进行。例如,透析可以用分批替换交换介质来重复多次,以达到期望水平的溶剂除去。透析也可以在连续过程中,其中回收的材料和/或交换介质连续地经历替换。可以在本发明方法中使用的示例性透析膜包括7kda膜。可以通过超滤进行所述溶剂的至少一部分、诸如所述溶剂的基本上全部的除去。超滤是使用包括通过半渗透性膜隔开的第一隔室和第二隔室的密闭容器。可以将回收的材料置于密闭容器的第一隔室中,然后可以对其施加相对于第二隔室的正压,使得迫使液体穿过密闭容器的半渗透性部分。渗滤是超滤的一种形式,其中通过将交换介质添加至容器的第一隔室,可以将剩余液体的至少一部分替换为交换介质。因此,随着超滤进行,剩余的液体将趋向于交换介质的组成。渗滤可以以各种方式进行-连续的(也称为恒定体积),其中交换介质以与膜上的液体过滤相当的速率添加;不连续的,其中剩余液体的体积变化,并且交换介质以不连续的方式(例如,通过初始稀释和随后浓缩至原始体积,或通过初始浓缩并随后稀释至原始体积等)添加。最佳操作模式可以取决于许多因素,包括:1)初始样品体积、浓度和粘度,2)所需的最终样品浓度,3)样品在各种浓度下的稳定性,4)渗滤所需的缓冲液的体积,5)总处理时间,6)可用的储库大小,7)经济性。示例性渗滤膜包括hydrosart30kd。在溶剂除去期间使用的交换介质不必对应于最终脂质体佐剂的介质,为了方便起见,交换介质合适地是期望的最终脂质体佐剂介质或其浓缩物,例如,磷酸盐缓冲盐水或所期望的另一种缓冲组合物。在某些方法中,可以在除去溶剂之前将皂苷添加至回收的混合材料中。在其他方法中,可以在除去溶剂之后添加皂苷。皂苷用于本发明中的合适的皂苷是quila及其衍生物。quila是分离自南美树皂树(quillajasaponaria)molina的一种皂苷制备物,并且首次由dalsgaard等人于1974描述为具有佐剂活性(“saponinadjuvants”,archiv.fürdiegesamtevirusforschung,vol.44,springerverlag,berlin,p.243-254)。quila的纯化级分已通过hplc分离,其保留佐剂活性,而没有与quila相关的毒性(参见例如ep0362278)。一般感兴趣的级分包括qs7、qs17、qs18和qs-21,例如qs7和qs-21(也称为qa7和qa21)。qs-21是尤其感兴趣的皂苷。在本发明的某些实施方案中,皂苷是皂树(quillajasaponaria)molinaquila的衍生物,合适地是quila的免疫活性级分,诸如qs7、qs17、qs18或qs-21,尤其是qs-21。通常,皂苷,诸如quila且尤其是qs-21,是至少90%纯的,诸如至少95%纯的,特别是至少98%纯的,尤其是99%纯的。本发明的有利特征在于在反应原性较低的组合物中呈现皂苷,其中其被外源固醇、诸如胆固醇猝灭。在其中混合第一和第二溶液之后添加皂苷的方法中,皂苷的量将通常等于如果较早添加将使用的量。tlr4激动剂tlr4激动剂的合适实例是脂多糖,合适地脂质a的无毒衍生物,特别是单磷酰脂质a,且更特别是3-脱-o-酰化的单磷酰脂质a(3d-mpl)。3d-mpl由glaxosmithklinebiologicalsn.a.以名称“mpl”销售,并且在整个文件中称为3d-mpl。参见,例如,美国专利号4,436,727;4,877,611;4,866,034和4,912,094。3d-mpl可以根据gb2220211a中描述的方法生产。化学上,其为3-脱酰基单磷酰脂质a与4、5或6个酰化链的混合物。在本发明的上下文中,小颗粒3d-mpl可用于制备水性佐剂组合物。小颗粒3d-mpl具有的粒径使得其可以无菌过滤通过0.22μm过滤器。此类制备物描述于wo94/21292中。合适地,粉末状3d-mpl用于制备用于本发明中的水性佐剂组合物。可以使用的其他tlr4激动剂是烷基氨基葡糖苷磷酸酯(agp),诸如wo98/50399或美国专利号6,303,347中描述的那些(还描述了用于制备agp的方法)。一些agp是tlr4激动剂,且一些是tlr4拮抗剂。可用于本发明中的其他tlr4激动剂包括吡喃葡糖基脂质佐剂(gla),诸如描述于wo2008/153541或wo2009/143457,或文献文章colerrn等人(2011)developmentandcharacterizationofsyntheticglucopyranosyllipidadjuvantsystemasavaccineadjuvant.plosone6(1):e16333.doi:10.1371/journal.pone.0016333和ariasma等人(2012)glucopyranosyllipidadjuvant(gla),asynthetictlr4agonist,promotespotentsystemicandmucosalresponsestointranasalimmunizationwithhivgp140.plosone7(7):e41144.doi:10.1371/journal.pone.0041144。wo2008/153541或wo2009/143457通过引用并入本文,用于定义可用于本发明中的tlr4激动剂的目的。通常,tlr4激动剂,诸如脂多糖且尤其是3d-mpl,是至少90%纯的,诸如至少95%纯的,特别是至少98%纯的,尤其是99%纯的。在某些方法中,可以在除去溶剂之前将tlr4激动剂添加至回收的混合材料中。在其他方法中,可以在除去溶剂之后添加tlr4激动剂(在此类情况下,tlr4的量通常将等于如果较早添加将使用的量)。因此,提供了使用微流体装置制造包含皂苷和tlr4激动剂的脂质体佐剂的方法,其包括以下步骤:(a)在所述装置中混合包含溶剂、磷脂酰胆碱脂质、固醇和tlr4激动剂的第一溶液以及包含水和皂苷的第二溶液;和(b)除去溶剂。还提供了使用微流体装置制造包含皂苷和tlr4激动剂的脂质体佐剂的方法,其包括以下步骤:(a)在所述装置中混合包含溶剂、磷脂酰胆碱脂质和固醇的第一溶液以及包含水的第二溶液;(b)添加皂苷;(c)添加tlr4激动剂;和(d)除去溶剂;其中步骤(b)和(c)可以呈任一顺序,或者可以在单个步骤中进行。进一步提供了使用微流体装置制造包含皂苷和tlr4激动剂的脂质体佐剂的方法,其包括以下步骤:(a)在所述装置中混合包含溶剂、磷脂酰胆碱脂质和固醇的第一溶液以及包含水的第二溶液;(b)除去溶剂;(c)添加皂苷;和(d)添加tlr4激动剂;其中步骤(c)和(d)可以呈任一顺序,或者可以在单个步骤中进行。另外,提供了使用微流体装置制造包含皂苷和tlr4激动剂的脂质体佐剂的方法,其包括以下步骤:(a)在所述装置中混合包含溶剂、磷脂酰胆碱脂质和固醇的第一溶液以及包含水的第二溶液;(b)添加皂苷;(c)除去溶剂;和(d)添加tlr4激动剂。进一步提供了使用微流体装置制造包含皂苷和tlr4激动剂的脂质体佐剂的方法,其包括以下步骤:(a)在所述装置中混合包含溶剂、磷脂酰胆碱脂质和固醇的第一溶液以及包含水的第二溶液;(b)添加tlr4激动剂;(c)除去溶剂;和(d)添加皂苷。还提供了制造用于使用微流体装置制备包含皂苷和tlr4激动剂的脂质体佐剂的脂质体浓缩物的方法,其包括在所述装置中混合包含溶剂、磷脂酰胆碱脂质、固醇和tlr4激动剂的第一溶液以及包含水和皂苷的第二溶液的步骤。还提供了制造用于使用微流体装置制备包含皂苷和tlr4激动剂的脂质体佐剂的脂质体浓缩物的方法,其包括以下步骤:(a)在所述装置中混合包含溶剂、磷脂酰胆碱脂质和固醇的第一溶液以及包含水的第二溶液;(b)添加皂苷;和(c)添加tlr4激动剂;其中步骤(b)和(c)可以呈任一顺序,或者可以在单个步骤中进行。还提供了使用微流体装置制造包含皂苷和tlr4激动剂的脂质体佐剂的方法,其包括以下步骤:(a)在所述装置中混合包含溶剂、dopc、固醇和tlr4激动剂的第一溶液以及包含水和皂苷的第二溶液;和(b)除去溶剂。还提供了使用微流体装置制造包含皂苷和tlr4激动剂的脂质体佐剂的方法,其包括以下步骤:(a)在所述装置中混合包含溶剂、dopc和固醇的第一溶液以及包含水的第二溶液;(b)添加皂苷;(c)添加tlr4激动剂;和(d)除去溶剂;其中步骤(b)和(c)可以呈任一顺序,或者可以在单个步骤中进行。进一步提供了使用微流体装置制造包含皂苷和tlr4激动剂的脂质体佐剂的方法,其包括以下步骤:(a)在所述装置中混合包含溶剂、dopc和固醇的第一溶液以及包含水的第二溶液;(b)除去溶剂;(c)添加皂苷;和(d)添加tlr4激动剂;其中步骤(c)和(d)可以呈任一顺序,或者可以在单个步骤中进行。另外提供了使用微流体装置制造包含皂苷和tlr4激动剂的脂质体佐剂的方法,其包括以下步骤:(a)在所述装置中混合包含溶剂、dopc和固醇的第一溶液以及包含水的第二溶液;(b)添加皂苷;(c)除去溶剂;和(d)添加tlr4激动剂。进一步提供了使用微流体装置制造包含皂苷和tlr4激动剂的脂质体佐剂的方法,其包括以下步骤:(a)在所述装置中混合包含溶剂、dopc和固醇的第一溶液以及包含水的第二溶液;(b)添加tlr4激动剂;(c)除去溶剂;和(d)添加皂苷。还提供了制造用于使用微流体装置制备包含皂苷和tlr4激动剂的脂质体佐剂的脂质体浓缩物的方法,其包括在所述装置中混合包含溶剂、dopc、固醇和tlr4激动剂的第一溶液以及包含水和皂苷的第二溶液的步骤。还提供了制造用于使用微流体装置制备包含皂苷和tlr4激动剂的脂质体佐剂的脂质体浓缩物的方法,其包括以下步骤:(a)在所述装置中混合包含溶剂、dopc和固醇的第一溶液以及包含水的第二溶液;(b)添加皂苷;和(c)添加tlr4激动剂;其中步骤(b)和(c)可以呈任一顺序,或者可以在单个步骤中进行。如本文所用的术语‘在单个步骤中进行’意欲同期或同时进行。通过根据本文描述的任何方法混合第一溶液和第二溶液可获得(诸如通过其获得)的含有脂质体的溶液形成本发明的一个进一步方面。另外的赋形剂由所请求保护的方法产生的脂质体佐剂可以进一步修饰。例如,可以将其稀释以达到如期望用于后来使用的组分和/或添加的额外组分的特定浓度。此类步骤可以在所述方法的多个阶段进行:在除去溶剂之前,在除去溶剂期间(例如通过交换介质的方式)或在除去溶剂之后。在一个进一步实施方案中,将缓冲剂添加至组合物中。鉴于组合物的组分和用于施用于受试者的必要适合性,调节液体制备物的ph。合适地,液体混合物的ph为至少4,至少5,至少5.5,至少5.8,至少6。液体混合物的ph可以为小于9,小于8,小于7.5或小于7。在其他实施方案中,液体混合物的ph为4至9,5至8,诸如5.5至8。因此,ph将合适地为6-9,例如6.5-8.5。在一个特别优选的实施方案中,ph为5.8至6.4。适当的缓冲液可以选自乙酸盐、柠檬酸盐、组氨酸、马来酸盐、磷酸盐、琥珀酸盐、酒石酸盐和tris。在一个实施方案中,所述缓冲剂是磷酸盐缓冲剂,诸如na/na2po4、na/k2po4或k/k2po4。所述缓冲剂可以以至少6mm、至少10mm或至少40mm的量存在于液体混合物中。所述缓冲剂可以以小于100mm、小于60mm或小于40mm的量存在于液体混合物中。众所周知的是,对于胃肠外施用,溶液应当具有药学上可接受的重量摩尔渗透压浓度,以避免细胞变形或裂解。药学上可接受的重量摩尔渗透压浓度将通常意味着溶液将具有近似等渗或轻度高渗的重量摩尔渗透压浓度。合适地,本发明的组合物当重构时将具有250至750mosm/kg范围内的重量摩尔渗透压浓度,例如,重量摩尔渗透压浓度可以在250至550mosm/kg的范围内,诸如280至500mosm/kg的范围内。在一个特别优选的实施方案中,重量摩尔渗透压浓度可以在280至310mosm/kg的范围内。可以根据本领域中已知的技术,诸如通过使用商业上获得的渗压计,例如从advancedinstrumentsinc.(usa)可获得的advancedtmmodel2020测量重量摩尔渗透压浓度。“等渗剂”是生理上可耐受的并赋予制剂合适涨度以防止跨越与制剂接触的细胞膜的水的净流动的化合物。在一些实施方案中,用于组合物中的等渗剂是盐(或盐的混合物),方便地,所述盐是氯化钠,合适地,浓度为近似150nm。然而,在其他实施方案中,所述组合物包含非离子等渗剂,并且组合物中的氯化钠的浓度小于100mm,诸如小于80mm,例如小于50mm,诸如小于40mm,小于30mm,且特别是小于20mm。组合物中的离子强度可以小于100mm,诸如小于80mm,例如小于50mm,诸如小于40mm或小于30mm。在一个具体实施方案中,所述非离子等渗剂是多元醇,诸如蔗糖和/或山梨糖醇。山梨糖醇的浓度可以是例如约3%至约15%(w/v),诸如约4%至约10%(w/v)。包含免疫活性皂苷级分和tlr4激动剂的佐剂(其中等渗剂是盐或多元醇)已描述于wo2012/080369中。合适地,本发明中使用的组合物具有0.05ml至1ml,诸如0.1至0.5ml的人剂量体积,尤其是约0.5ml或0.7ml的剂量体积。所用组合物的体积可以取决于递送途径和位置,其中通过皮内途径给予较小剂量。单位剂量容器可以含有过量,以允许在施用单位剂量期间适当地操纵材料。皂苷,诸如qs-21,可以以每个人剂量1至100μg的量使用。qs-21可以以约50µg的水平使用。合适范围的实例是40-60μg,合适地45-55μg或49-51μg,诸如50μg。在一个进一步实施方案中,人剂量包含约25μg的水平的qs-21。较低范围的实例包括20-30μg,合适地22-28μg或24-26μg,诸如25μg。意欲用于儿童的人剂量与意欲用于成人的那些相比可能减少(例如减少50%)。tlr4激动剂,诸如脂多糖,诸如3d-mpl,可以以每个人剂量1至100μg的量使用。3d-mpl可以以约50µg的水平使用。合适范围的实例是40-60μg,合适地45-55μg或49-51μg,诸如50μg。在一个进一步实施方案中,人剂量包含约25μg的水平的3d-mpl。较低范围的实例包括20-30μg,合适地22-28μg或24-26μg,诸如25μg。意欲用于儿童的人剂量与意欲用于成人的那些相比可能减少(例如减少50%)。当佐剂中存在tlr4激动剂和皂苷两者时,则tlr4激动剂与皂苷的重量比合适地为1:5至5:1,合适地1:1。例如,在3d-mpl以50μg或25μg的量存在的情况下,则合适地qs-21也可以以每人剂量50μg或25μg的量存在。皂苷:dopc的比率将通常为约1:50至1:10(w/w),合适地1:25至1:15(w/w),且优选地1:22至1:18(w/w),诸如1:20(w/w)。抗原根据本发明的方法制备的脂质体佐剂可以与免疫原或抗原结合使用。在一些实施方案中,提供了编码免疫原或抗原的多核苷酸。脂质体佐剂可以与免疫原分开施用,或者抗原可以在制造期间或同期与免疫原或抗原组合,作为用于组合施用的免疫原性组合物。因此,提供了用于制备包含免疫原或抗原或编码所述免疫原或抗原的多核苷酸的免疫原性组合物的方法,所述方法包括以下步骤:(i)根据本文所述的方法制备脂质体佐剂;(ii)混合所述脂质体佐剂与免疫原或抗原或编码所述免疫原或抗原的多核苷酸。还提供了根据本文所述的方法制备的脂质体佐剂在制造药物中的用途。合适地,所述药物包含免疫原或抗原,或编码所述免疫原或抗原的多核苷酸。进一步提供了根据本文所述的方法制备的脂质体佐剂,其用作药物。合适地,所述药物包含免疫原或抗原,或编码所述免疫原或抗原的多核苷酸。术语免疫原意指能够激发免疫应答的多肽。合适地,所述免疫原是包含至少一个b或t细胞表位的抗原。激发的免疫应答可以是抗原特异性b细胞应答,其产生中和抗体。激发的免疫应答可以是抗原特异性t细胞应答,其可以是全身性应答和/或局部应答。抗原特异性t细胞应答可以包含cd4+t细胞应答,诸如涉及表达多种细胞因子(例如ifnγ、tnfα和/或il2)的cd4+t细胞的应答。可替代地或额外地,所述抗原特异性t细胞应答包含cd8+t细胞应答,诸如涉及表达多种细胞因子(例如ifnγ、tnfα和/或il2)的cd8+t细胞的应答。所述抗原可以源自(诸如获得自)感染人和非人脊椎动物的人或非人病原体,包括例如细菌、真菌、寄生微生物或多细胞寄生虫,或癌细胞或肿瘤细胞。在一个实施方案中,所述抗原是重组蛋白,诸如重组原核蛋白。在一个实施方案中,所述抗原源自疟原虫属(诸如恶性疟原虫(plasmodiumfalciparum)),分枝杆菌属(诸如结核分枝杆菌(mycobacteriumtuberculosis)(tb)),水痘带状疱疹病毒(vzv),人呼吸道合胞病毒,人免疫缺陷病毒(hiv),莫拉氏菌属(诸如卡他莫拉氏菌(moraxellacatarrhalis))或不可分型的流感嗜血杆菌(haemophilusinfluenzae)(nthi)。所述抗原可以包含源自引起疟疾的寄生虫(诸如恶性疟原虫(plasmodiumfalciparum)或间日疟原虫(plasmodiumvivax))的制备物,或由其组成。在一个实施方案中,所述抗原可以是恶性疟原虫环子孢子(cs)蛋白或其变体。cs蛋白的合适变体可以是这样的变体,其中cs蛋白的部分呈具有来自乙型肝炎的表面抗原s(hbsag)的杂合蛋白的形式。cs变体抗原可以例如呈包含cs蛋白的基本上所有c-末端部分、cs蛋白免疫显性区的四个或更多个串联重复和hbsag的杂合蛋白的形式。所述杂合蛋白可以包含含有至少160个氨基酸并且与cs蛋白的c-末端部分基本上同源、但缺乏疏水性锚定序列的序列。cs蛋白可缺乏来自c末端的最后12个氨基酸。进一步,其可含有4个或更多个,例如10个或更多个asn-ala-asn-pro四肽(nanp)重复基序。用于本发明中的杂合蛋白可以是这样的蛋白,其包含经由线性接头连接至hbsag的n-末端的同框融合的源自株系nf54的基本上对应于恶性疟原虫克隆3d7的氨基酸207-395的恶性疟原虫的cs蛋白的一部分。所述接头可以包含来自hbsag的pres2的一部分。适合用于本发明中的cs构建体概述于wo93/10152,其在美国被授予为美国专利号5,928,902和6,169,171,其两者通过引用并入,用于描述用于本发明中的合适蛋白的目的。用于本发明中的特定杂合蛋白是称为rts的杂合蛋白(seqidno.1,也描述于wo2015/150568、wo93/10152(其中其表示为rts*)和wo98/05355,其由以下组成:-甲硫氨酸残基-三个氨基酸残基,metalapro-一段189个氨基酸,其代表恶性疟原虫株系3d7的cs蛋白的氨基酸207至395-甘氨酸残基-四个氨基酸残基,provaithrasn,其代表乙型肝炎病毒(adw血清型)pres2蛋白的四个羧基末端残基,和-一段226个氨基酸,其由核苷酸1653至2330编码,并指定乙型肝炎病毒(adw血清型)的s蛋白。rts可以呈rts,s混合颗粒的形式。rts,s颗粒包含两种多肽rts和s,其可以同时合成并自发形成复合微粒结构(rts,s)。所述抗原可以包含源自分枝杆菌属、诸如牛分枝杆菌(mycobacteriumbovis)或结核分枝杆菌(mycobacteriumtuberculosis)、尤其是结核分枝杆菌的制备物,或由其组成。结核病领域中感兴趣的抗原包括rv1196和rv0125。rv1196(例如在dillon等人infectionandimmunity199967(6):2941-2950中以名称mtb39a描述)是高度保守的,其在h37rv、c、haarlem、cdc1551、94-m4241a、98-r604inh-rif-em、kzn605、kzn1435、kzn4207、kznr506菌株间具有100%序列同一性,f11菌株具有单点突变q30k(大多数其他临床分离物与h37rv具有超过90%的同一性)。rv0125(例如,在skeiky等人infectionandimmunity199967(8):3998-4007中通过名称mtb32a描述)也是高度保守的,其在许多菌株间具有100%序列同一性。全长rv0125包括被切割以提供成熟蛋白的n-末端信号序列。在一个实施方案中,所述抗原源自rv1196,诸如包含,诸如由以下组成:与seqidno:2具有至少70%同一性,诸如至少80%,尤其是至少90%,特别是至少95%,例如至少98%,诸如至少99%同一性的序列。典型的rv1196相关抗原将包含(诸如由其组成)具有少量缺失、插入和/或取代的seqidno:2的衍生物。实例是具有在0-5个位置的最多达5个残基的缺失,在0-5个位置的最多达5个残基的插入和最多达20个残基的取代的那些。rv1196的其他衍生物是包含(诸如由其组成)seqidno:2的片段的那些,所述片段长度为至少200个氨基酸,诸如长度为至少250个氨基酸,尤其是长度为至少300个氨基酸,特别是长度为至少350个氨基酸。在一个实施方案中,所述抗原源自rv0125,诸如包含(诸如由其组成)与seqidno:3具有至少70%同一性,诸如至少80%,尤其是至少90%,特别是至少95%,例如至少98%,诸如至少99%同一性的序列。典型的rv0125相关抗原将包含(诸如由其组成)具有少量缺失、插入和/或取代的seqidno:3的衍生物。实例是具有在0-5个位置的最多达5个残基的缺失,在0-5个位置的最多达5个残基的插入和最多达20个残基的取代的那些。rv0125的其他衍生物是包含(诸如由其组成)seqidno:3的片段的那些,所述片段长度为至少150个氨基酸,诸如长度为至少200个氨基酸,尤其是长度为至少250个氨基酸,特别是长度为至少300个氨基酸。rv0125的具体衍生物是包含(诸如由其组成)seqidno:3的片段(其对应于seqidno:3的残基1-195)的那些。rv0125的另外的免疫原性衍生物是包含(诸如由其组成)seqidno:3的片段(其对应于seqidno:3的残基192-323)的那些。特别优选的rv0125相关抗原是seqidno:3的衍生物,其中催化三联体的至少一个(例如一个、两个或甚至全部三个)已被取代或缺失,使得蛋白酶活性已降低且更容易产生蛋白-催化性丝氨酸残基可被缺失或取代(例如被丙氨酸取代)和/或催化性组氨酸残基可被缺失或取代和/或取代的,催化性天冬氨酸残基可被缺失或取代。特别感兴趣的是seqidno:3的衍生物,其中催化性丝氨酸残基已被取代(例如被丙氨酸取代)。还感兴趣的是rv0125相关抗原,其包含(诸如由其组成)与seqidno:3具有至少70%同一性,诸如至少80%,尤其是至少90%,特别是至少95%,例如至少98%,诸如至少99%同一性的序列,且其中催化三联体的至少一个已被取代或缺失,或者包含(诸如由其组成)seqidno:3的片段的那些,所述片段长度为至少150个氨基酸,诸如长度为至少200个氨基酸,尤其是长度为至少250个氨基酸,特别是长度为至少300个氨基酸,且其中催化三联体的至少一个已被取代或缺失。rv0125的另外的免疫原性衍生物是包含(诸如由其组成)seqidno:3的片段(其对应于seqidno:3的残基192-323)的那些,其中催化三联体的至少一个(例如一个、两个或甚至全部三个)已被取代或缺失。rv0125的具体免疫原性衍生物是包含(诸如由其组成)seqidno:3的片段(其对应于seqidno:3的残基1-195)的那些,其中催化性丝氨酸残基(seqidno:3的位置176)已被取代(例如被丙氨酸取代)。合适地,所述抗原将包含这样的序列,诸如由其组成:所述序列与seqidno.4具有至少70%同一性,诸如至少80%,尤其是至少90%,特别是至少95%,诸如至少98%,例如至少99%同一性。典型的m72相关抗原将包含(诸如由其组成)具有小量缺失、插入和/或取代的seqidno:4的衍生物。实例是具有在0-5个位置的最多达5个残基的缺失、在0-5个位置的最多达5个残基的插入和最多达20个残基的取代的那些。m72的其他衍生物是包含(诸如由其组成)seqidno:4的片段的那些,所述片段长度为至少450个氨基酸,诸如长度为至少500个氨基酸,诸如长度为至少550个氨基酸,诸如长度为至少600个氨基酸,诸如长度为至少650个氨基酸或长度为至少700个氨基酸。由于m72是从两个单独抗原rv0125和rv1196衍生的融合蛋白,至少450个残基的任何片段将包含多个来自全长序列的表位(skeiky等人j.immunol.2004172:7618-7628;skeikyinfect.immun.199967(8):3998-4007;dilloninfect.immun.199967(6):2941-2950)。m72相关抗原将包含(诸如由其组成)与seqidno.4具有至少70%同一性、诸如至少80%、尤其是至少90%、特别是至少95%、诸如至少98%、例如至少99%同一性的序列。典型的m72相关抗原将包含(或由其组成)具有少量缺失、插入和/或取代的seqidno:4的衍生物。实例是具有在0-5个位置的最多达5个残基的缺失,在0-5个位置的最多达5个残基的插入和最多达20个残基的取代。在具体实施方案中,m72相关抗原将包含seqidno.4的残基2-723,例如包含(或由其组成)seqidno.4或包含(或由其组成)seqidno.5。可根据本发明采用的一种另外的抗原是结核抗原rv1753及其变体,诸如wo2010010180中所述,例如选自wo2010010180的seqidno:1和2-7、尤其是seqidno:1的rv1753序列。结核病领域中另一种目标抗原是rv2386及其变体,诸如wo2010010179中所述,例如选自wo2010010179的seqidno:1和2-7、尤其是seqidno:1的rv2386序列。结核病领域中的其他目标抗原包括rv3616及其变体,诸如wo2011092253中所述,例如选自wo2011092253的seqidno:1和2-7的天然rv3616序列或修饰的rv3616序列,诸如选自wo2011092253的seqidno:161-169、179和180、尤其是seqidno:167的那些。额外的目标抗原是hbha,诸如wo97044463、wo03044048和wo2010149657中所述。前述专利申请wo2010010180、wo2010010179、wo2011092253、wo97044463、wo03044048和wo2010149657通过引用以其整体并入本文,用于定义可用于本发明中的抗原的目的。其他目标抗原是包含以下(或由以下组成)的那些:rv1174,也称为dpv,诸如wo2010010177的seqidno8中所述;rv1793,也称为mti或mtb9.9,诸如wo2010010177的seqidno10中所述;rv2087,也称为msl或mtb9.8,诸如wo2010010177的seqidno9中所述;rv3616,也称为htcc1或mtb40,诸如wo2010010177的seqidno1和2-7或wo2011092253的seqidno161-169、179或180中所述;和/或rv3874,也称为cfp10或tb38.1,诸如wo2010010177的seqidno9中所述;或免疫原性部分(诸如来自其的至少20、50、75或100个残基)或其变体(诸如与其具有至少70%、80%、90%或95%同一性)。(wo2010010177和wo2011092253通过引用以其整体并入本文,用于定义可用于本发明中的抗原的目的)。结核抗原最适合以多肽的形式使用,但可以可替代地以编码所述多肽的多核苷酸的形式提供。可根据本发明采用的一种另外的抗原源自水痘带状疱疹病毒(vzv)。用于本发明中的vzv抗原可以是任何合适的vzv抗原或其免疫原性衍生物,合适地是纯化的vzv抗原。在一个实施方案中,所述vzv抗原是vzv糖蛋白ge(也称为gp1)或其免疫原性衍生物。野生型或全长ge蛋白由623个氨基酸组成,所述623个氨基酸包含信号肽、所述蛋白的主要部分、疏水锚定区域(残基546-558)和c-末端尾巴。在一个方面,使用gec-末端截短体(也被称作截短的ge或ge截短体),其中所述截短在羧基末端除去总氨基酸残基的4-20%。在一个进一步方面,所述截短的ge缺乏羧基末端锚定区域(合适地是野生型序列的近似氨基酸547-623)。在一个进一步方面,ge是具有seqidno.6的序列的截短的ge。在ep0405867和其中的参考文献中描述了ge抗原,其无锚衍生物(其也是免疫原性衍生物)及其生产[也参见vafaia.,antibodybindingsitesontruncatedformsofvaricalla-zostervirusgpi(ge)glycoprotein,vaccine199412:1265-9]。ep192902也描述了ge及其生产。haumont等人virusresearch(1996)vol40,p199-204(通过引用完整地并入本文)也描述了截短的ge。在wo2006/094756中描述了适合用于根据本发明的用途的佐剂化的vzvge组合物,即与佐剂组合的羧基末端截短的vzvge,所述佐剂包含qs-21、3d-mpl和脂质体(进一步含有胆固醇)。leroux-roelsi.等人(j.infect.dis.2012,206:1280-1290)报道了评估佐剂化的vzv截短的ge亚单位疫苗的i/ii期临床试验。所述抗原可以包含源自人呼吸道合胞病毒(rsv)的制备物或由其组成。在某些有利的实施方案中,多肽抗原是来自rsv的f蛋白多肽抗原。在的背景下构象约束的f多肽抗原尤其适合作为多肽抗原组分。先前已描述了呈融合前(pref)和融合后(postf)构象的构象约束的f蛋白。此类构象约束的f蛋白通常包含工程改造的rsvf蛋白胞外域。f蛋白胞外域多肽是rsvf蛋白的一部分,其包括rsvf蛋白的细胞外结构域的全部或部分,并且缺乏功能性(例如,通过缺失或取代)跨膜结构域,其可以表达,例如,在细胞培养物中以可溶性(不附着于膜)的形式表达。在融合前构象中构象约束的示例性f蛋白抗原在本领域已经描述并且详细公开于例如美国专利号8,563002(wo2009079796);美国公开专利申请号us2012/0093847(wo2010/149745);us2011/0305727(wo2011/008974);us2014/0141037、wo2012/158613和wo2014/160463,其各自通过引用并入本文,用于举例说明融合前f多肽(和核酸)及其产生方法的目的。通常,所述抗原呈多肽的三聚体的形式。提供融合前构象中的f蛋白的实例的额外出版物包括:mclellan等人,science,vol.340:1113-1117;mclellan等人,science,vol342:592-598,和rigter等人,plosone,vol.8:e71072,其各自也可以在本文公开的免疫原性组合的背景中使用。例如,在融合前构象中稳定的f蛋白多肽通常包括f蛋白(例如,可溶性f蛋白多肽)的胞外域,其包含至少一个稳定f蛋白的融合前构象的修饰。例如,所述修饰可以选自三聚化结构域的添加(通常至c末端),弗林蛋白酶切割位点中的一个或多个的缺失(在氨基酸~105-109和~133-136),pep27结构域的缺失,疏水结构域(例如,hra和/或hrb)中的亲水性氨基酸的取代或添加。在一个实施方案中,构象约束的pref抗原包含rsvf蛋白多肽的f2结构域(例如氨基酸1-105)和f1结构域(例如氨基酸137-516),其没有间插的弗林蛋白酶切割位点,其中所述多肽进一步包含位于f1结构域的c-末端的异源三聚化结构域。任选地,pref抗原还包含改变糖基化(例如,增加糖基化)的修饰,诸如在对应于rsvf蛋白的氨基酸~500-502的位置处取代一个或多个氨基酸。当存在寡聚化序列时,其优选为三聚化序列。合适的寡聚化序列是本领域中众所周知的,并且包括,例如,酵母gcn4亮氨酸拉链蛋白的卷曲螺旋,来自噬菌体t4fibritin(“折叠子”)的三聚化序列,和流感ha的三聚体结构域。另外或可替代地,在融合前构象中构象约束的f多肽可以包括至少两个引入的半胱氨酸残基,其彼此非常接近并形成稳定融合前rsvf多肽的二硫键。例如,两个半胱氨酸可以在彼此的约10å之内。例如,半胱氨酸可以在位置165和296或在位置155和290处引入。示例性pref抗原由seqidno:7代表。所述抗原可以包含源自hiv的制备物或由其组成。所述抗原可以是hiv蛋白,诸如hiv包膜蛋白。例如,所述抗原可以是hiv包膜gp120多肽或其免疫原性片段。一种合适的抗原是公开申请wo2008/107370的seqidno:8的hiv进化枝bgp120多肽(或该多肽的免疫原性片段)。wo2008/107370的seqidno:8通过引用并入本申请中。合适的抗原还包括包含公开申请wo2015/036061的seqidno:1的v1v2区域的多肽,或seqidno:1的v1v2区域的免疫原性衍生物或片段。此外,包含wo2015/036061的seqidno:5的v1v2区域的多肽或seqidno:5的v1v2区域的免疫原性衍生物或片段可以用作合适的抗原。wo2015/036061的seqidno:1和seqidno:5通过引用并入。在另一个实施方案中,所述抗原可以包含两种或更多种不同的hiv包膜gp120多肽抗原(或这些多肽的免疫原性片段)。合适的抗原包括hiv进化枝cgp120多肽抗原,包括tv1gp120(seqidno:8)和1086.cgp120(seqidno:9)。其他合适的hiv抗原包括nef、gag和polhiv蛋白及其免疫原性片段。所述组合物可以包含不可分型的流感嗜血杆菌抗原,其例如选自:fimbrin蛋白[(us5766608-ohiostateresearchfoundation)]和包含来自其的肽的融合体[例如,lb1(f)肽融合体;us5843464(osu)或wo99/64067];omp26[wo97/01638(cortecs)];p6[ep281673(stateuniversityofnewyork)];tbpa和/或tbpb;hia;hsf;hin47;hif;hmw1;hmw2;hmw3;hmw4;hap;d15(wo94/12641);蛋白d(ep594610);p2;和p5(wo94/26304);蛋白e(wo07/084053)和/或pila(wo05/063802)。所述组合物可以包含卡他莫拉氏菌蛋白抗原,其例如选自:omp106[wo97/41731(antex)&wo96/34960(pmc)];omp21;lbpa和/或lbpb[wo98/55606(pmc)];tbpa和/或tbpb[wo97/13785&wo97/32980(pmc)];copb[helminenme,等人(1993)infect.immun.61:2003-2010];uspa1和/或uspa2[wo93/03761(universityoftexas)];ompcd;hasr(pct/ep99/03824);pilq(pct/ep99/03823);omp85(pct/ep00/01468);lipo06(gb9917977.2);lipo10(gb9918208.1);lipo11(gb9918302.2);lipo18(gb9918038.2);p6(pct/ep99/03038);d15(pct/ep99/03822);ompla1(pct/ep99/06781);hly3(pct/ep99/03257);和ompe。在一个实施方案中,所述组合物可以包含不可分型的流感嗜血杆菌(nthi)蛋白抗原和/或卡他莫拉氏菌蛋白抗原。所述组合物可以包含来自流感嗜血杆菌的蛋白d(pd)。蛋白d可以如wo91/18926中所述。所述组合物可以进一步包含来自流感嗜血杆菌的蛋白e(pe)和/或pilina(pila)。蛋白e和pilina可以如wo2012/139225中所述。蛋白e和pilina可以作为融合蛋白呈现;例如,如wo2012/139225中所述的lvl735。例如,所述组合物可以包含三种nthi抗原(pd、pe和pila,其中最后两种组合为pepila融合蛋白)。所述组合物可以进一步包含来自卡他莫拉氏菌的uspa2。uspa2可以如wo2015125118中所述,例如wo2015125118中描述的mc-009((m)(uspa231-564)(hh))。例如,所述组合物可以包含三种nthi抗原(pd、pe和pila,其中最后两种组合为pepila融合蛋白)和一种卡他莫拉氏菌抗原(uspa2)。可以提供多种抗原。例如,可以提供多种抗原以强化激发的免疫应答(例如以确保强烈的保护),可以提供多种抗原以拓宽免疫应答(例如以确保针对一系列病原体菌株或在大部分受试者群体中的保护)或可以提供多种抗原以目前激发针对许多病症的免疫应答(由此简化施用方案)。在提供多种抗原的情况下,这些可以是不同的蛋白,或者可以呈一种或多种融合蛋白的形式。抗原可以以每个人剂量0.1至100μg的量提供。本发明可以应用于治疗或预防与一种或多种上述抗原相关的疾病或病症。在一个实施方案中,所述疾病或病症选自疟疾、结核病、copd、hiv和疱疹。脂质体佐剂可以与免疫原或抗原分开施用,或者可以在制造期间或同期)与免疫原或抗原组合,作为用于组合施用的免疫原性组合物。灭菌尤其对于肠胃外施用,组合物应当是无菌的。灭菌可以通过各种方法进行,尽管灭菌通过过滤无菌级过滤器可以方便地进行。灭菌可以在制备佐剂或免疫原性组合物期间进行多次,但通常至少在制造结束时进行。“无菌级过滤器”意指在大于或等于1x107/cm2的有效过滤面积的攻击水平下被微生物攻击后产生无菌流出物的过滤器。为了本发明的目的,无菌级过滤器对于本发明领域的技术人员是众所周知的,无菌级过滤器具有0.15至0.25μm、合适地0.18-0.22um、诸如0.2或0.22um的孔径。无菌级过滤器的膜可以由技术人员已知的任何合适的材料(例如但不限于乙酸纤维素、聚醚砜(pes)、聚偏二氟乙烯(pvdf)、聚四氟乙烯(ptfe))制成。在本发明的一个具体实施方案中,本发明的滤膜中的一个或多个或全部包含聚醚砜(pes),尤其是亲水性聚醚砜。在本发明的一个具体实施方案中,本文所述的方法中使用的过滤器是双层过滤器,尤其是具有孔径大于最终过滤器的孔径的内置式预过滤器的无菌过滤器。在一个实施方案中,灭菌过滤器是双层过滤器,其中预过滤器膜层具有0.3至0.5nm、诸如0.35或0.45nm的孔径。根据进一步实施方案,过滤器包含不对称的过滤膜,诸如不对称的亲水性pes过滤膜。或者,所述灭菌过滤层可以由pvdf(例如与不对称亲水性pes预过滤膜层组合)制成。鉴于预期的医疗用途,材料应当是药物级的(诸如肠胃外级的)。就整数而言,术语'基本上'意指功能相当的,使得如果整数的基本性质不变,则可以容忍偏差。例如,就特定值而言,术语'基本'将通常意指在规定值的正负10%之内的值。本申请中所有参考文献(包括专利申请和授权专利)的教导通过引用完全并入本文。定义为“包含”某些要素的组合物或方法或过程应理解为涵盖(分别)由那些要素组成的组合物、方法或过程。如本文所用,‘基本上由......组成’意指可以存在额外的组分,条件是它们不改变总体特性或功能。将通过参考以下非限制性实施例进一步描述本发明:实施例。通用实验详情单个混合室微流体装置及一般操作装置图1举例说明在单个芯片上具有一个混合室的示例性微流体装置的设计。所述装置包括长度为2.5cm且具有2mmx0.4mm的延长横截面的混合室。所述混合室具有一个位于中心的用于提供第一溶液的入口和两个用于提供第二溶液的入口。每个入口为0.2mm宽,并且跨越所述混合室的另一侧的全长。单个出口位于所述混合室的远端。操作为了进行微流体实验,将cetoninemesysmi-压力注射器泵、cetoni玻璃注射器和含有所述装置的micronit芯片固定器置于温度受控的区域(sartoriuscertomat)中。在任何实验运行之前,将所述系统清洁并使其稳定在设定温度下。产物收集和溶剂除去将收集的浓缩的脂质体分为2部分:第一部分用磷酸盐缓冲盐水(pbs)ph6.1稀释以达到2mg/mldopc的最终浓度,并在0.22um聚醚砜(pes)膜上过滤。对该样品进行组成测试(dopc、胆固醇、3d-mpl、qs-21)。第二部分用磷酸盐缓冲盐水ph6.1透析(装置7000mwcothermoslide-a-lyser)以除去有机溶剂。使用的方案为:2x15min,2x30min和过夜(每个时间点1lpbsph6.1缓冲液)。然后将保留物稀释以达到2mg/mldopc,并在0.22umpes膜上过滤。对该样品进行大小测量。通过气相色谱法对该样品测试残余乙醇。多混合室微流体装置及一般操作装置图2举例说明在单个芯片上具有八个混合室的示例性多混合室微流体装置的设计。所述装置包括长度为2.5cm且具有2mmx0.4mm的延长横截面的八个混合室。每个混合室具有一个位于中心的用于提供第一溶液的入口和两个用于提供第二溶液的入口。每个入口为0.2mm宽,并且跨越所述混合室的另一侧的全长。单个出口位于所述混合室各自的远端。图3举例说明歧管设计,其可以与多混合室微流体芯片组合使用,以将第一溶液或第二溶液供应至十六个混合室的入口,或者从十六个混合室的出口收集混合材料。图4是示例性多混合室微流体装置的示意图,所述装置具有基于图2中显示的样式的两个芯片(占据两个中央支架)的总共十六个混合室,以及供应十六个室的第一溶液入口的分配歧管(左下支架),供应十六个室的第二溶液入口的分配歧管(左上支架)和合并来自十六个室的出口的收集歧管(右支架)。操作可以以类似于单个装置的方式来操作多混合室装置。例如,可以制备有机储备液(例如4.9l),其在80:20乙醇/ipa中含有dopc130mg/ml、胆固醇32.5mg/ml和3d-mpl6.5mg/ml。水相(例如19.7l)可以由在注射用水中稀释的1.625mg/ml的qs-21构成。合适的泵,诸如用于有机相的串联的isco500d和用于水相的串联的1000d,可以以连续流使用,以通过歧管供应液相,将该流分成16个流,其进入平行排列的16个混合室。在混合室的末端,可以使用另一个歧管来将含有浓缩脂质体的混合材料收集至一个容器中。渗滤可用于从混合材料除去有机溶剂,并用合适的缓冲液(诸如pbsph6.1缓冲液)替换注射用水。用合适的缓冲液(例如pbsph6.1)进一步稀释允许根据期望的组分浓度获得最终组合物。然后可以进行无菌过滤。分析方法-大小测量大小测量利用dls原理与malvernzetasizer仪器。将样品稀释于相应的缓冲液(通常为pbsph6.1)中用于测量。-3d-mpl含量使用与荧光检测偶联的hplc来定量3d-mpl组分。在c18柱上实现分离。从在脂质体基质(dopc,胆固醇)中重构的氨基葡萄糖hcl和磷酸氨基葡萄糖6的等摩尔混合物制备标准品。样品和标准品在强还原条件下用酸衍生。-qs-21含量使用与uv检测偶联的hplc来定量qs-21组分。在c18柱上实现分离。用在dmso中稀释为25至75ug/ml的qs-21参考制备标准品将样品稀释于dsmo中用于分析。-dopc-chol含量使用2种方法:第一种方法(个别标准)使用与uv检测器偶联的u-hplc。在c18柱上实现分离。用在ipa/chcl3中稀释的dopc/chol制备标准品(用于储备液),并在相同的缓冲液中稀释,对于dopc为0至700ug/ml,且对于胆固醇为0至175ug/ml。将样品稀释于ipa/chcl3中。第二种方法(相对于先前表征的佐剂组合物)使用与uv检测器偶联的hplc。在c18柱上实现分离。使用先前表征的佐剂组合物制备标准品,通过经典方法制备,在甲醇中稀释,对于dopc为0至500ug/ml,且对于胆固醇为0至125ug/ml将样品稀释于甲醇中。-溶剂残余物使用与顶空注入器和fid(火焰电离检测器)偶联的气相色谱的方法。在cpwax52-cbagilent柱上实现分离。对于每种特定的有机溶剂(在这种情况下为ipa和乙醇),标准品被制备为2至160ug/ml。loq为2ug/ml稀释样品,以便在标准品范围内。实施例1:第一溶液制备方法和组成的研究实施例1a–溶剂组成方法为了研究溶剂组成对脂质体产生的影响,以各种乙醇/异丙醇比率制备dopc、胆固醇和3d-mpl的溶液。将dopc、胆固醇和3d-mpl各自单独地在55℃下溶解(dopc为60体积%,胆固醇为20%,3d-mpl为20%)15分钟。然后将3d-mpl溶液添加至dopc溶液中,并将该混合物添加至胆固醇溶液中,并再进一步混合15分钟,以提供具有150mg/mldopc的最终组合物(20:5:1重量比dopc:胆固醇:3d-mpl)。单室微流体装置以14ml/min的总流速、20(19:1)(1:19有机相:水相)的流速比、使用注射用水作为水相用储备溶液和室温下的环境进行操作。结果表1–溶剂组成对脂质体大小的影响乙醇:ipa比率脂质体大小(nm)100:0-80:2012470:3013960:4015450:50174结论纯乙醇不能以目标浓度溶解组分。尽管纯异丙醇能够以目标浓度溶解组分,但在类似实验中产生的脂质体(160mg/ml)非常大,其中直径为203nm。乙醇和ipa的混合物,尤其是90:10至70:30范围内的乙醇和ipa的混合物,提供良好的溶解容量与低粘度。实施例1b–溶液制备方法评估组分添加的顺序,其比较两种以下方法:1.将dopc、胆固醇和3d-mpl各自单独地在55℃下溶解(体积分别为60%、20%、20%)于80:20乙醇:ipa中15分钟。然后将3d-mpl溶液添加至dopc溶液中,并再进一步混合15分钟。然后将3d-mpl/dopc混合物添加至胆固醇溶液中,并再进一步混合1小时,以提供具有120mg/mldopc(20:5:1重量比dopc:胆固醇:3d-mpl)的最终组合物。2.将3d-mpl用50%的溶剂(80:20乙醇:ipa)悬浮,且然后添加至dopc和胆固醇粉末中。然后用溶剂的剩余部分调节体积,并将混合物加热至40℃持续15分钟,以提供具有120mg/mldopc(20:5:1重量比dopc:胆固醇:3d-mpl)的最终组合物。方法1要求将混合物在55℃下保持1小时,用于完全溶解组分。然而,如果不在轻微搅拌下保持几分钟,则可以观察到相分离。为了避免这种情况,需要连续搅拌,直到溶解完成。方法2允许在更少时间(15分钟)后完全溶解,并且如果不搅拌,则没有观察到相分离。单混合室微流体装置以18ml/min的总流速、20(1:19有机相:水相)的流速比且在15-25℃的温度下使用通过两种方法制备的储备第一溶液进行操作。第二溶液(水溶液)是注射用水中的qs-21。结果结果显示于图5中。结论方法1对温度更敏感,而方法2允许在15-25℃范围内用95-120nm的大小规格内的脂质体样品进行温度不太敏感的微流体操作。实施例1c–溶液浓度限值评估dopc、胆固醇和3d-mpl浓度对储备物稳定性和溶解度的影响。遵循方法2以40、60、80、100、120、140、160和200mg/ml(20:5:1重量比dopc:胆固醇:3d-mpl)的dopc浓度制备dopc、胆固醇和3d-mpl于乙醇/ipa80:20中的储备溶液。首先在t0(30℃)下进行测量,然后将样品在25℃下储存一小时,进行分析,且然后在20℃下储存一小时,进行分析,且然后在15℃下储存一小时并进行分析。结果结果显示于图6中。通过nephelostar的浊度测量揭示低于100mg/ml的浓度逐步形成并具有更高的浊度。类似地,200mg/ml逐步形成并具有更高的浊度。结论100和160mg/ml之间的浓度在15℃和30℃之间的温度下是稳定的。当在该浓度范围内混合于乙醇/ipa中时,脂质(dopc)、固醇(胆固醇)和tlr4激动剂(3d-mpl)之间的特异性相互作用可以解释这些令人惊讶的结果。实施例2:溶剂组成和温度对脂质体大小的影响的研究方法遵循方法2在乙醇:ipa中以80:20;70:30和60:40的比率以120mg/ml的dopc浓度(20:5:1重量比dopc:胆固醇:3d-mpl)制备dopc、胆固醇和3d-mpl的储备溶液,并与1.5mg/ml的水性qs-21储备物一起使用。微流体过程在15℃、20℃和25℃的温度下以18ml/min的总流速和5的流速比(1:4有机相:水相)运行。在该实验中,在透析之前测量脂质体大小。结果结果显示于图7中。结论温度部分驱动组分(dopc、胆固醇和3d-mpl)的溶解度。在40℃下制备的储备物可以冷却至15℃而不沉淀。然而,在较低温度下的操作诱导更快的沉淀,且由此产生较小的脂质体。脂质体大小受第一溶液的组成、不同温度的影响,其中比率60:40变化最大,其中比率60:40>70:30>80:20。该实验还将80:20比率的选择证实为对温度的敏感性最低。实施例4:微流体运行条件的详细分析及其对脂质体大小的影响基于先前确定的一般限制,构建doe(实验的设计)中央复合材料,以确定在大小(zav)方面的过程响应,并检测温度、总流速、流速比和储备物浓度之间的任何交叉相互作用。方法表2–研究的条件的概述在图8中提供了测试条件的表格,且在图9中提供了测试条件的视觉概述。经四天进行实验。如先前所述,根据方法2制备第一溶液。短暂地称重dopc(脂质体),随后称重胆固醇(sigma)。在分开小瓶中,称量3d-mpl(gskhamilton)。将50%的有机相(80%乙醇(merck)和20%异丙醇)添加至3d-mpl中。然后将悬浮的mpl添加至dopc/胆固醇粉末中,并在40℃下在混合下放置。在溶解三种组分(澄清溶液)之后,将有机储备物在40℃下再放置15分钟。然后调节体积以提供目标浓度(20:5:1重量比dopc:胆固醇:3d-mpl)。对于第二溶液,将qs-21浓缩的液体物料(bulk)在注射用水中稀释以达到所需的最终浓度。使用sas9.2和designexpert9基于响应表面估计的面居中的中央复合设计(face-canteredcentralcompositedesignforresponsesurfaceestimation)用6个中心点和24个模型点进行统计分析。雷诺数根据以下方程计算:。例如在以下条件下:有机相水相密度0.829g/cm³,在22.4°c1.002g/cm³,在21.7°c粘度3.345cp,在19.8°c1.09cp,在20°c流速3.2ml/min12.8ml/min工作t°20°c20°c基于流体的平均密度和粘度(按其比例):密度:(12.8x1.002+3.2x0.829)/16=0.9674g/cm³粘度:(12.8x1.09+3.2x3.345)/16=1.541cp,如果1pa=1kg.m-1.s-2且1cp=1mpa.s,则粘度=1.541g.m-1.s-1=0.01541g.cm-1.s-1混合室尺寸为:2000um(w)x400um(h)。2q=2x16=32ml/min=0.53cm³/sw+h=400um(高度)+2000um(宽)=2400um=0.24cm方程内的所有内容:(0.9674x0.53)/(0.01541x0.24)=138.6可以对所有流速和流速比采用等效方法。结果图10提供了实验的结果。-pdi的建模表3呈现zav和pdi的标准偏差(sd)和方差系数(cv)。表3–doe的中心点的重复性的分析zavpdisd重复性1.170.01sd中等精度5.530.03cv重复性1.05%4.24%cv中等精度4.97%16.89%没有可靠的pdi的预测模型可以拟合在数据上,但与zav显著相关(0.75的相关系数)。zav<110nm,在0.95的情况下得到pdi<0.2。zav和pdi之间的关系在图11中举例说明。-zav的建模观察到研究的不同因素的一些显著影响,以及浓度和温度以及温度和流速的明显的共同影响。adjr²=0.80predr²0.73其他影响被认为不重要(p-值>5%)。表4-研究参数和交叉效应的p-值因素p-值浓度(a)0.008308流速比(b)0.000998温度(c)<0.0001流速(d)0.957301浓度和温度(ac)0.008791温度和流速(cd)0.000151比率的平方(b^2)<0.0001图12至20呈现使用创建的模型在不同固定因子下的zav响应的预测。-模型的证实如图21中所示,进行八次证实性运行以测试模型的能力(所有运行均在130mg/mldopc且流速比为5(1:4有机相:水相)。获得的结果与模型良好一致,其中所有结果均落在90-110nm的预期范围内。表5–证实结果结论为了在温度、运行时间和收获体积方面优化该过程,1:4(有机相:水相)的比率与约130mg/ml的dopc浓度、14至17ml/min的流速以及16至25℃的温度对于获得95-120nm(即约100nm)的区域中的脂质体看起来最好。特定参数是在80:20乙醇:ipa中的130mg/mldopc,流速比1:4(有机相:水相),总流速16ml/min和温度20℃。表3呈现zav和pdi的标准偏差(sd)和cv。其显示非常低的cv,代表良好的可重复性。实施例5:适应性免疫应答方法-佐剂制备使用先前描述的单混合室设备制备脂质体。在18ml/min的总流速和5的流速比(1:4有机相:水相)的条件下将包含80/20乙醇/ipa中的dopc(120mg/ml)、胆固醇(30mg/ml)和3d-mpl(6mg/ml)的有机相与含有注射用水中qs-21(1.5mg/ml)的水相混合。将有机相维持在20℃。将水相维持在15℃。通过透析除去溶剂,并将所得浓缩物稀释以提供最终的佐剂制剂。-疫苗接种向6-8周龄-雌性c57b16小鼠(22只/组)用以微流体产生的具有3d-mpl和qs-21的脂质体配制的ge抗原注射两次,间隔14天。5只小鼠的对照组接受仅含缓冲液的ge。将最终的佐剂制剂稀释并根据需要与ge混合以提供疫苗接种混合物。评估两个剂量的佐剂(每只动物0.4和0.1ug的3d-mpl和qs-21两者分别对应于典型的50ug人剂量(hd)的1/125和1/500)。每只动物接受5ug的ge。注射体积为20ul。第二次免疫后7天(第21天),收集脾脏和血清,并分别分析t细胞和b细胞应答。-ics(细胞内细胞因子染色)将脾脏收集在rpmi培养基中并使用陶瓷组织研磨机(均质化器)使用两次上下冲程进行解离。将均质化的样品转移至50ml聚丙烯管中。通过过滤通过100um尼龙细胞过滤器来除去纤维材料。然后将细胞洗涤,计数并以每ml107个细胞重悬浮。ics是允许基于细胞因子产生定量抗原特异性t淋巴细胞的技术。将淋巴细胞在体外在蛋白转运抑制剂(布雷菲德菌素a)存在的情况下用肽ge或培养基再次刺激过夜(o.n)。然后这些细胞通过使用荧光抗体(细胞外染色:cd4、cd8,细胞内染色:tnfα、ifnγ和il2)的常规免疫荧光程序进行处理。结果表示为减去每只小鼠的介质条件后cd4细胞群体内的细胞因子阳性细胞的频率。对显示至少两种细胞因子(il2、ifn-α或tnf-α)表达的群体进行统计分析。-elisa通过elisa测量抗-ge总igg。将96孔板在4℃下用抗原包被过夜。然后洗涤板并用饱和缓冲液在37℃下饱和1小时。之后,添加100μl稀释的小鼠血清或标准品或对照,并在37℃下孵育1小时30分钟。洗涤之后,将板在37℃下与100µl抗小鼠igg-生物素化一起孵育1小时。洗涤之后,将板与100ul链霉抗生物素蛋白-pod缀合物在37℃下孵育30分钟。洗涤之后,每孔添加100μltmb,并将板在室温下避光保持15分钟。为了停止反应,每孔添加100μl的h2so40.4n。通过elisa读板器在450/630nm的波长下读取吸光度。使用softmax-pro软件计算结果。结果脂质体具有95.5nm的直径,0.184的pdi。最终的佐剂制剂具有2.2mg/ml的dopc含量,0.58mg/ml的胆固醇含量,119ug/ml的qs-21含量,和90ug/ml的3d-mpl含量。elisa结果显示于图22中,且ics结果显示于图23中。结论微流体产生的与tlr4激动剂和皂苷结合的脂质体能够将对示例性抗原的细胞和抗体应答佐剂化。实施例6:微流体脂质体的稳定性使用先前描述的单混合室设备制备脂质体。在16ml/min的总流速和5的流速比(1:4有机相:水相)的条件下将包含80/20乙醇/ipa中的dopc(130mg/ml)、胆固醇(32.5mg/ml)和3d-mpl(6.5mg/ml)的有机相与含有注射用水中qs-21(1.625mg/ml)的水相混合。将有机相维持在20℃。将水相维持在20℃。通过透析除去溶剂,并无菌过滤材料。结果显示于图24中,表明使用微流体产生的脂质体在4℃下储存2个月后基本上不变。实施例7:方法的按比例放大本实施例的目的是测试方法的按比例放大,以便使用微流体方法产生商业规模批次的佐剂。在适合于一个工作日的生产周期中制备单批320l的佐剂(图25)。使用的混合室的数目为16。歧管评估为了将有机相和水相分配至16个混合室中,分配歧管应当理想地提供均匀的流量分配。实际的限制意味着完美的分配是不可能的,但必须避免过度变化。流量的过度变化可以导致最终产物的不均匀性,并且可能导致产物落在目标规格之外。根据流量分配的变化,计算最终产物中的组分含量的理论估计值。表6显示,低于5%的变化基本上不影响保持在目标规格范围内的最终产物中的组分含量。在高于6%变化的情况下,3d-mpl的含量接近于可接受的上限,并且随着变化百分比的进一步增加而超过该边界。表6-随着流速的变化的最终产物中预期组分含量应用于歧管测试的程序初始歧管设计的入口(图26)连接至填充有水的isco泵。在歧管的16个出口中的每个出口处,连接20cm的etfe(乙烯四氟乙烯)管(1/16”,0.04”id),并置于50mlfalcontm管中(图27)。实验前称重每个falcontm管。然后用水填充管(入口和出口)和歧管以消除气泡。系统以~200ml/min总流速运行2分钟。2分钟时段之后,称重每个falcontm管,以计算递送的确切水量。计算流量变化的%:通道x(1至16)的重量除以测量的平均重量。初始歧管用水以200ml/min进行测试,并且还用乙醇和异丙醇的混合物以50ml/min进行测试。结果(图28和图29)显示通道间的变化:在高总流速(~200ml/min)下,一个高于5%的可接受的变化限值(通道1),但其他接近于该限值(通道2、3、4、9、10、11和12)。对于最低流速(~50ml/min),变化低于5%,但显示相同的总体趋势。遵循那些结果,进行cfd(计算流体动力学)分析,以预测沿着歧管的每个区段的流量分配。分析显示,最初弯头诱导随后分支中的流速差异。这些差异沿着最终分支仍然存在。将预测的变化针对观察到的实验值(来自200ml/min测试)作图,并显示相同的总体趋势(图30)。用cfd分析证实第一歧管的其不能以期望的均匀性分配的实验发现。遵循这些结果,cfd被用作支持改进的第二代歧管的设计的工具(图31)。研究导致除去最初弯头,缩短第一通道长度,增加第二和第三通道的长度。在这些情况下,速度概况更恒定,并且几乎完全除去循环区域。改进的歧管的测试第二歧管用相似的程序进行测试(12.8ml/min/通道=204.8总流速),并在三个歧管(指定为b1、b2和a2)中的每个上重现三次。图32-34显示获得的实验结果。在所有情况下,单独通道的变化均低于5%的期望限值,在许多情况下,测量的流速的变化与平均值相比小于2%。脂质体产生使用改进的歧管,进行实验,以证实可以以商业规模产生与用单个混合室产生的那些具有相同概况的脂质体。对于实验,串联使用isco1000d和500d泵。由于运行时间有限,每个泵仅使用一个汽缸。泵加热套连接至水浴(julabof33),每个泵一个水浴。使用认证的探针监测温度的控制。将两个改进的歧管在入口处连接至每个泵,并连接至2个各自含有8个混合室的微芯片,以平行提供总共16个混合室。使用的管是etfe1/160.04”id,长度为29.5cm。在每个混合室的出口处连接29.5cm的etfe管(1/160.02”id)。不直接控制原型的温度,但将设备置于受控的温度区域中(在20℃),并在任何实验之前使其适应环境。将泵冲洗两次并排空,然后用适当的有机相(溶解于80/20乙醇/异丙醇中的130mg/ml的dopc,32.5mg/ml的胆固醇)和水相(注射用水)填充。然后在连接至分配歧管之前,将泵引发以消除系统中的空气。对于有机相,流速设置为51.2ml/min,且对于水相,流速设置为204.8ml/min。当引发系统并清除空气时,将来自每个室的前2ml丢弃,且然后将每个室的出口收获在16个单独的容器中(运行时间<30秒)。合并来自每个通道的500ul产物,并在ph6.1的pbs中稀释130倍之后进行dls测量。在多室原型上进行运行之后,将来自泵的管与多室原型断开,并连接至一个混合室。使流速适应于有机相3.2ml/min和水相12.8ml/min。当系统稳定(无空气)时,将离开混合室的前2ml丢弃,且收获随后的~2ml)。大小测量值使用malvernzsnano系列仪器计算(图35),并且与用“一个”混合室产生的脂质体相比,显示16混合室的合并物的趋势相同。大小和多分散性也是等效的(表7)。结果首次显示在适用于工业规模产生中的含有16个混合室(和相关联的歧管)的原型与一个混合室之间的脂质体产生(dopc-胆固醇)的等效性。表7-多室和单室脂质体的dls结果zav(nm)pdi单个混合室1410.2216个混合室的合并物1430.23实施例8:相对于通过薄膜方法产生的脂质体的适应性免疫应答方法-佐剂制备使用先前描述的单混合室设备制备三批脂质体。在16ml/min的总流速和5的流速比(1:4有机相:水相)的条件下将包含80/20乙醇/ipa中的dopc(130mg/ml)、胆固醇(32.5mg/ml)和3d-mpl(6.5mg/ml)的有机相与含有注射用水中qs-21(1.625mg/ml)的水相混合。将温度维持在20℃。使用hydrosart30kda膜和六倍体积的置换缓冲液通过渗滤除去溶剂。渗滤时间为近似40分钟。随后使用在0.22umpes膜上的无菌过滤对材料进行无菌过滤。所得脂质体佐剂浓缩物可以根据需要稀释以提供最终的佐剂制剂。-疫苗接种向6-8周龄-雌性c57b16小鼠(每组6只,总共186只动物)用具有3d-mpl和qs-21的脂质体制剂中的ge抗原注射两次,间隔14天。阴性对照组在相同时间表上仅接受ge与缓冲液。通过稀释佐剂浓缩物并根据需要与ge混合来制备最终的疫苗接种混合物。评估五个剂量的佐剂(每只动物每次注射0.05、0.1、0.2、0.4和1ug的3d-mpl和qs-21两者,其分别对应于典型的50ug人剂量(hd)的1/1000、1/500、1/250、1/125和1/50,基于预期的免疫刺激剂含量)。每只动物每次注射接受5ug的ge。注射体积为20ul。将三批微流体脂质体佐剂与通过薄膜方法产生的三批脂质体佐剂进行比较。由于空间限制,该实验以两部分进行(即,每组6只小鼠中的3只小鼠在每个部分中接受治疗,其中将结果组合)。第二次免疫后7天(第21天),收集脾脏和血清,并分别分析t细胞和b细胞应答。使用实施例5中提供的方法进行ics和elisa。结果微流体批次表征表8-微流体批次的dls表征表9-微流体批次组成(稀释浓缩物之后)表10-薄膜批次表征elisa结果显示于图36中,且ics结果显示于图37中。使用模型来计算且然后从数据检索实验部分(实验1vs实验2)和批次(批次1、批次2或批次3)的效果。然后对于两种方法分别将线性模型拟合在这些数据上。方法之间相关的预测几何平均值呈现于图38和图39(分别为elisa和ics)中。结论微流体产生的与tlr4激动剂和皂苷结合的脂质体能够以与薄膜产生的脂质体通常相当的方式将对示例性抗原的细胞和抗体应答佐剂化。实施例9:相对于通过薄膜方法产生的脂质体的适应性免疫应答遵循实施例7中描述的成功按比例放大,使用16通道微流体装置来制备一批包括皂苷(qs21)和tlr4(3d-mpl)免疫刺激剂的脂质体材料。在16ml/min的总流速(每个室)和5的流速比(1:4有机相:水相)的条件下将包含80/20乙醇/ipa中的dopc(130mg/ml)、胆固醇(32.5mg/ml)和3d-mpl(6.5mg/ml)的有机相与含有注射用水中qs-21(1.625mg/ml)的水相混合。将温度维持在20℃。最初的单室基准运行使用单室进行(丢弃前2ml)。随后,系统用所有16个室平行运行,并单独收集来自每个室出口的材料(丢弃来自每个室的前2ml)。制备16个室的合并物。第三次运行在用于基准条件的相同单混合室中进行(未置于培养箱中),再次丢弃前2ml。在微流体过程后(不除去溶剂),通过dls进行大小测量。表11-多室和单室脂质体的dls结果zav(nm)pdi单个混合室基准1050.2116个混合室的合并物1030.20单个混合室1060.21在三次运行中获得的大小的比较(图40)显示相当的概况,证实了本申请中阐述的方法的稳健性和可扩展性质。在整个说明书和随后的权利要求书中,除非上下文另有要求,否则词语‘包含(comprise)’以及变型诸如‘包含(comprises)’和‘包含(comprising)’将被理解为暗示包括所述的整数或步骤或整数或步骤的组,但不排除任何其他整数或步骤或整数的组或步骤的组。本说明书和权利要求书构成其一部分的申请可以用作关于任何后续申请的优先权的基础。这种后续申请的权利要求可以针对本文所述的任何特征或特征的组合。实施方案被设想为在适合于环境的情况下可与彼此独立、完全组合以形成本发明的另外的实施方案。它们可以采取产品、组合物、方法或用途权利要求的形式,并且可以通过实例而非限制的方式包括所附权利要求。本说明书中引用的所有公开(包括但不限于专利和专利申请)都通过引用并入本文,如同每个单独的公开被特定并单独地提到如同完整记载地通过引用并入本文。参考文献ariasma等人(2012)glucopyranosyllipidadjuvant(gla),asynthetictlr4agonist,promotespotentsystemicandmucosalresponsestointranasalimmunizationwithhivgp140.plosone7(7):e41144.doi:10.1371/journal.pone.0041144black,s.,e.degregorio,和r.rappuoli.2015.developingvaccinesforanagingpopulation.sciencetranslationalmedicine.7:281ps288colerrn等人(2011)developmentandcharacterizationofsyntheticglucopyranosyllipidadjuvantsystemasavaccineadjuvant.plosone6(1):e16333.doi:10.1371/journal.pone.0016333dalsgaard等人in1974(“saponinadjuvants”,archiv.fürdiegesamtevirusforschung,vol.44,springerverlag,berlin,p243-254)debecker,g.,v.moulin,b.pajak,c.bruck,m.francotte,c.thiriart,j.urbain,和m.moser.2000.theadjuvantmonophosphoryllipidaincreasesthefunctionofantigen-presentingcells.internationalimmunology.12:807-815.dendouga,n.,m.fochesato,l.lockman,s.mossman,和s.l.giannini.2012.cell-mediatedimmuneresponsestoavaricella-zostervirusglycoproteinevaccineusingbothatlragonistandqs-21inmice.vaccine.30:3126-3135.didierlaurenta.m.,collignonc.,bourguignonp.,wouterss.,fierensk.,fochesatom.,dendougan.,langletc.,malissenb.,lambrechtb.n.,garconn.,vanmechelenm.,和s.morel.2014enhancementofadaptiveimmunitybythehumanvaccineadjuvantas01dependsonactivateddendriticcellsjournalofimmunology193(4):1920-1930.didierlaurent等人,2017adjuvantsystemas01:helpingtoovercomethechallengesofmodernvaccinesexpertreiewsofvaccines16(1):55-63dillon等人infectionandimmunity199967(6):2941-2950enhancementofadaptiveimmunitybythehumanvaccineadjuvantas01dependsonactivateddendriticcells.thejournalofimmunology.193garcon,n.,和m.vanmechelen.2011.recentclinicalexperiencewithvaccinesusingmpl-andqs-21-containingadjuvantsystems.expertreviewofvaccines.10:471-486fochesato,m.,dendougan.和boxusm.2016humvaccinimmunother12(8):2092-2095haumontm.,jacqueta.,massaerm.,deleersnyderv.,mazzup.,bollena.和jacobsp1996purification,characterizationandimmunogenicityofrecombinantvaricella-zostervirusglycoproteingesecretedbychinesehamsterovarycellsvirusres199640(2):199-204helminenme,等人(1993)infect.immun.61:2003-2010hood,r.r.;devoe,d.l.2015highthroughputcontinuousflowproductionofnanoscaleliposomesbymicrofluidicverticalflowfocusing.smalljournal.11,no.43,5790–5799ismaili,j.,j.rennesson,e.aksoy,j.vekemans,b.vincart,z.amraoui,f.vanlaethem,m.goldman,和p.m.dubois.2002.monophosphoryllipidaactivatesbothhumandendriticcellsandtcells.journalofimmunology.168:926-932.kensil,c.r.,u.patel,m.lennick,和d.marciani.1991.separationandcharacterizationofsaponinswithadjuvantactivityfromquillajasaponariamolinacortex.journalofimmunology.146:431-437.kensil,c.r.,和r.kammer.1998.qs-21:awater-solubletriterpeneglycosideadjuvant.expertopiniononinvestigationaldrugs.7:1475-1482.kimyt等人2012massproductionandsizecontroloflipid-polymerhybridnanoparticlesthroughcontrolledmicrovortices.nanoletters12(7):3587-3591lambrecht,b.n.,m.kool,m.a.willart,和h.hammad.2009.mechanismofactionofclinicallyapprovedadjuvants.currentopinioninimmunology.21:23-29.leroux-roelsi.等人j.infect.dis.2012,206:1280-1290li,h.,s.b.willingham,j.p.ting,和f.re.2008.cuttingedge:inflammasomeactivationbyalumandalum'sadjuvanteffectaremediatedbynlrp3.journalofimmunology.181:17-21.livingston,p.o.,s.adluri,f.helling,t.j.yao,c.r.kensil,m.j.newman,和d.marciani.1994.phase1trialofimmunologicaladjuvantqs-21withagm2ganglioside-keyholelimpethaemocyaninconjugatevaccineinpatientswithmalignantmelanoma.vaccine.12:1275-1280.ragupathi,g.,j.r.gardner,p.o.livingston,和d.y.gin.2011.naturalandsyntheticsaponinadjuvantqs-21forvaccinesagainstcancer.expertreviewofvaccines.10:463-470martin,m.,s.m.michalek,和j.katz.2003.roleofinnateimmunefactorsintheadjuvantactivityofmonophosphoryllipida.infectionandimmunity.71:2498-2507.marty-roix,r.等人identificationofqs-21asaninflammasome-activatingmolecularcomponentofsaponinadjuvants.j.biol.chem.291,1123–36(2016)mata-haro,v.,c.cekic,m.martin,p.m.chilton,c.r.casella,和t.c.mitchell.2007.thevaccineadjuvantmonophosphoryllipidaasatrif-biasedagonistoftlr4.science.316:1628-1632.mclellan等人,science,vol.340:1113-1117.mclellan等人,science,vol342:592-598newman,m.j.,j.y.wu,b.h.gardner,k.j.munroe,d.leombruno,j.recchia,c.r.kensil,和r.t.coughlin.1992.saponinadjuvantinductionofovalbumin-specificcd8+cytotoxictlymphocyteresponses.journalofimmunology.148:2357-2362.rigter等人,plosone,vol.8:e71072skeiky等人infectionandimmunity199967(8):3998-4007skeiky等人j.immunol.2004172:7618-7628soltysik,s.,j.y.wu,j.recchia,d.a.wheeler,m.j.newman,r.t.coughlin,和c.r.kensil.1995.structure/functionstudiesofqs-21adjuvant:assessmentoftriterpenealdehydeandglucuronicacidrolesinadjuvantfunction.vaccine.13:1403-1410.vafaia.,antibodybindingsitesontruncatedformsofvaricella-zostervirusgpi(ge)glycoprotein,vaccine199412:1265-9当前第1页12
相关技术
网友询问留言
已有0条留言
- 还没有人留言评论。精彩留言会获得点赞!
1