双重减毒肝晚期疟原虫及相关组合物和方法与流程
相关申请的交叉引用本申请要求于2017年1月25日提交的美国临时申请第62/450258号的权益,该申请通过引用整体并入本文。发明领域本公开涉及基因修饰的疟原虫生物体及相关组合物和方法。在一个方面,本公开涉及双重减毒疟原虫,所述双重减毒疟原虫的lisp2和plasmei2基因的功能被破坏,并且由于这种减毒而不能完成肝期发育。所述减毒疟原虫对于刺激脊椎动物宿主免疫系统的方法和组合物是有用的,并因此表现为疫苗。在另一方面,本公开涉及基因修饰,所述基因修饰驱动基因修饰的疟原虫生物体中的血液和配子体抗原的表达以增强由此赋予的免疫原性保护。关于序列表的声明与本申请相关的序列表以文本格式提供以代替纸质拷贝,其通过引用在此并入本说明书中。包含序列表的文本文件的名称是65267_st25.txt。文本文件为37kb;于2018年1月24日创建;并且与说明书的提交一起经由efs-web提交。政府许可权利声明本发明是在美国国立卫生研究院(nationalinstitutesofhealth)授予的1r01ai125706-01的政府支持下完成的。政府拥有本发明的某些权利。
背景技术:
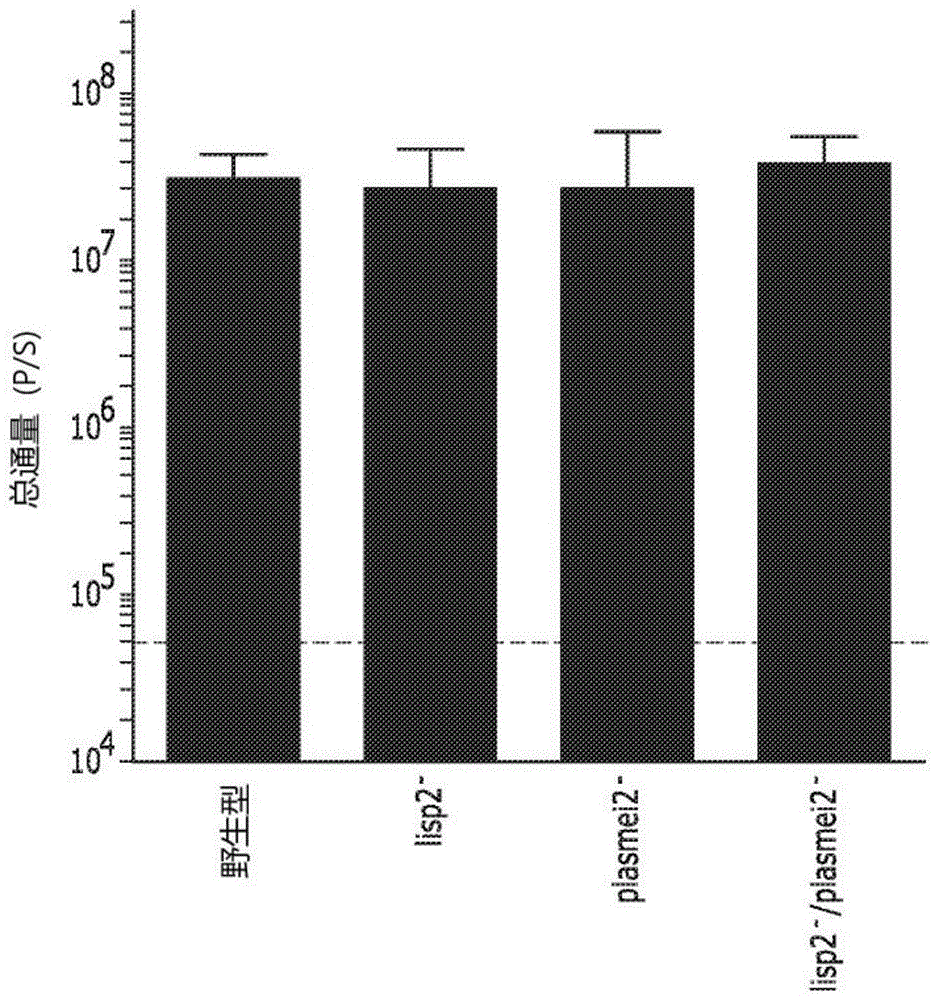
:疟疾对人类健康有极大的影响,每年造成数十万人死亡,并且在疟疾流行地区,尤其是在撒哈拉以南的非洲地区,成为各国社会和经济发展的主要障碍。疟原虫属寄生物是疟疾的主要病原体,其通过感染的阿诺菲力滋蚊(anophelesmosquito)的唾液传播给脊椎动物宿主。在传播之后,处于子孢子期的疟原虫寄生物快速通过血液流到肝脏。感染肝细胞的子孢子在受感染的肝细胞内生长和复制,产生数万个红内期(bloodstage)-感染性裂殖子。裂殖子感染红细胞,在那里它们经历进一步发育和复制,然后它们引起红细胞的破裂,向血液中释放出一波新的裂殖子。大部分新的裂殖子继续通过更多红细胞重复复制周期。这种感染和红细胞破裂的循环表现为与疟疾相关的潜在严重症状,诸如发烧、寒颤、虚弱、不适和脾肿大。少数循环的裂殖子最终发育为雄性或雌性配子体,所述雄性或雌性配子体保留在体内循环中,直到被新的蚊子在血餐中摄入。假设新的蚊子是相容的(即,另一只阿诺菲力滋蚊),配子体开始发育成胚子并融合形成二倍体受精卵。受精卵发育为能动的动合子形式,其穿过蚊子的中肠壁并形成卵囊。卵囊经历多轮分裂最终产生感染性子孢子,其可被注入下一个脊椎动物宿主中,由此重复生命周期。疟原虫感染的肝期对疟疾预防性干预而言是有吸引力的目标,因为其是无症状的并且在有症状的红内期感染之前。数十年前,发现经辐射的疟原虫子孢子(“辐射减毒子孢子”或ras)在用作实验时可在啮齿目动物和人类中都提供无菌保护性免疫。这是令人惊讶的,因为疟疾的自然感染不会在世界上的流行地区引起无菌保护性免疫。不幸的是,生产一致批次ras的复杂性以及ras制剂的可变免疫原性使得这种方法成为开发有用疫苗组合物的挑战性方法。近年来,已证明在啮齿目动物模型中用基因减毒疟原虫(gap)疫苗接种之后可实现无菌保护性免疫。最初的gap通过缺失与卵囊子孢子相比在感染性子孢子中上调的基因来制备。这种缺失在子孢子期不影响gap的活力,但导致在肝期发育的早期停滞。这些gap表现出强大的免疫原性特性,但有时也显示出不完全减毒,允许肝期至红内期的生命周期进展(也称为“突破”),导致活性感染。已开发了下一代gap以尝试提供肝期寄生物,所述肝期寄生物遵循肝脏内的生长、发育和复制而仅在进入红内期之前停滞。认为这种“肝晚期停滞”的寄生物与肝早期停滞的寄生物相比是更强的免疫原,因为它们可为免疫系统呈递更大和更宽范围的寄生物抗原。这可归因于其在宿主肝细胞内的数量更多、尺寸更大和发育更高级。确实,在啮齿目动物疟疾模型中,已经显示约氏疟原虫(plasmodiumyoelii)的肝晚期停滞的gap与肝早期停滞的gap或ras相比提供了对子孢子攻击的优异保护。此外,还显示这些gap提供了对直接的红内期攻击的跨阶段保护,表明存在也有红内期形式特征的肝晚期gap。然而,鉴定导致在发育的肝晚期完全减毒的人类疟疾(恶性疟原虫(p.falciparum))中缺失的靶基因,一直是具有挑战性的。尽管产生可用于刺激脊椎动物免疫系统以应对随后的攻击的减毒疟原虫寄生物的技术已经取得进展,仍有需要鉴定基于特定基因的修饰,所述基于特定基因的修饰能同时提供完全减毒(即,在血液中的多轮扩增之前完全停止生命周期发展)和允许肝期寄生物的健康和延长的发育以提供更多的抗原,以提供针对后续寄生物攻击的更完全的免疫性。本公开解决了这些和相关需要。附图说明通过参考以下详细描述并结合附图,本发明的前述方面和许多附带优点将变得更容易理解,因此将更好地理解本发明的上述方面和许多附带优点,其中:图1a-1c说明了约氏疟原虫(p.yoelii)lisp2-、plasmei2-和lisp2-/plasmei2-gap在肝期发育晚期停滞。图1a示出了将四组远交sw小鼠(每组5只)用50,000子孢子进行静脉内攻击。作为对照,小鼠用表现为野生型的表达荧光素酶的1971cl1寄生物攻击。在43小时时通过评估荧光素酶活性来体内测量肝期负荷。通过未配对的双尾t-检验测定,四个系(lines)之间的通量没有统计学差异。短划线表示背景通量。图1b示出了来自具有指定基因修饰的寄生物的寄生物纳虫空泡膜(parasiteparasitophorousvacuolemembrane)的显微照片。收获来自寄生物感染的小鼠的肝脏,用pbs灌注,并在子孢子感染之后43小时时在4%多聚甲醛中固定。从固定的肝脏切割切片(50μm),并使用一抗进行ifa以使寄生物纳虫空泡膜(pvm)标记物hep17发绿色荧光(标记为"hep17"的示例性信号),通过bip使内质网发红色荧光(标记为"bip"的示例性信号),和通过dapi使dna发蓝色荧光(标记为"dapi"的示例性信号)。显示了标记物的代表性染色。比例尺:10μm。图1c图示了肝期的尺寸。在进行ifa之后,计算大致肝期尺寸(基于寄生物最大周长处的面积,使用pvm标记物hep17作为参考)的测量结果以进行比较。在每个时间点评估至少20个寄生物。当通过未配对的双尾t-检验测定时,四个寄生物系之间的面积没有统计学差异。结果表明所有寄生物以相似的速度发育,因此所有gap均为晚期停滞的。图2a和2b说明了晚期停滞的约氏疟原虫gap保持和保护免受致死性红内期攻击。图2a示出了用50,000约氏疟原虫野生型(实心条形柱)、fabb/f-(空心条形柱)或lisp2-/plasmei2-(点状条形柱)子孢子接种的多组c57bl/6小鼠(n≥6)。于接种后24小时、44小时、72小时和96小时时(x-轴)使用体内生物发光成像检测肝期发育(总通量,y-轴)。基于未配对的双尾t-检验(其中p<0.006),高亮显示(*)显著差异。nd;由于转变到红内期而未测定。背景荧光描绘为水平虚线。图2b示出了用50,000静脉内子孢子(约氏疟原虫fabb/f-,4只小鼠[正方形],以及约氏疟原虫lisp2-/plasmei2-,10只小鼠[三角形])和作为对照的未感染的唾液腺提取物(首次实验8只小鼠[圆形])相隔1个月免疫两次,并用10,000致死性ym约氏疟原虫感染的红细胞静脉内攻击。跟踪寄生物血症,直到清除。当寄生物血症超过65%时,处死所有首次实验小鼠以避免痛苦。图3a-3f说明了约氏疟原虫lisp2-/plasmei2-gap免疫促进了对多个生命周期阶段的体液应答。图3a示出了elisa,其用于测量识别环子孢子蛋白(csp)的抗体的水平。将来自5只假免疫小鼠(三角形)和5只gap免疫小鼠(圆形)的血清进行连续稀释,并测定抗体滴度。x-轴示出了稀释度,且y-轴为检测后的od读数。图3b-3f是多个疟原虫生命周期阶段的显微照片。使用ifa测定针对来自gap-免疫小鼠的寄生物的igg抗体活性。将来自5只混合(pooled)小鼠的血清以1:200稀释用于ifa,用荧光第二抗体检测结合抗体。图3b:来自gap-免疫小鼠的血清(左图),而非来自首次实验小鼠(右图)的血清,识别子孢子表面(以箭头指示,左上图)。在下图中示出了子孢子的微分干涉相衬图。图3c-3e:来自gap-免疫血清的肝期ifa(标记为“红色”)示出了在发育24小时(图3c)时与csp的交叉反应性(标记为“绿色”),在发育34小时(图3d)和44小时(图3e)时的弱内部反应性(标记为“红色”),其中寄生物用bip的抗体进行可视化(标记为“红色”)。图3f:gap-免疫血清识别了红内期裂殖子内部(标记为“红色”),且裂殖子表面用msp1的抗体进行可视化(标记为“绿色”)。在图3b-3f中,dna被标记为“蓝色”。图3a和图3f中的比例尺:5μm,图3b-3e中的比例尺:10μm。图4a-4d说明了约氏疟原虫lisp2-/plasmei2-gap免疫诱导了长期的肝脏-特异性cd8t细胞免疫性。将sw小鼠免疫三次,在6周之后通过蚊咬攻击(表2),随后在40天之后通过静脉注射7,000个表达荧光素酶的约氏疟原虫子孢子再次攻击。图4a:在感染后42小时时通过生物发光成像评估寄生物肝脏负荷。图4b-4d。处死小鼠,并灌注其肝脏以分离肝脏非实质细胞和通过流式细胞术分型。显示肝脏淋巴细胞总数(图4b)、cd8tem(通过cd8+、cd62l-、klrg1+种群测量)(图4c)和抗原处理过的cd8+cxcr6+t细胞总数(通过cd8+、cd44hi、cxcr6+测量)(图4d)与被攻击的首次实验对照相当。通过mann-whitneyu检验进行统计学比较,其中*为p<0.05,**为p<0.01。图5a和5b图解说明了用于crispr/cas9-介导的疟原虫转基因的质粒。先前产生用于约氏疟原虫转基因的约氏疟原虫crispr/cas9质粒(pyc;图5a)在这里用于产生用于恶性疟原虫转基因的多种形式的恶性疟原虫crispr/cas9质粒(pfc;图5b)。为此,可将啮齿目动物疟疾-特异性序列置换为恶性疟原虫(p.falciparum)序列。ef1α或hsp70启动子驱动药物选择性标记物(hdhfr或bsd)和cas9核酸内切酶的表达。蛋白质的双重表达用2a跳跃肽(2askippeptide)实现。在pyc质粒(图5a)中,dhfr/ts3utr稳定rna,在pfc(图5b)中,这利用hsp703utr来实现。u6rna启动子驱动基因特异性指导rna的表达,所述基因特异性指导rna无缝连接到cas9募集rna序列(crrna)。多克隆位点(mcs)允许基因敲除所需同源区域的克隆。图6a-6c说明了使用质粒pfc敲除恶性疟原虫(plasmodiumfalciparum)abcc2以证明pfc产生该物种的敲除株系的功效。图6a说明了质粒pfcabcc2,其被转染到恶性疟原虫nf54中以诱导abcc2ko。图6b示意性说明了在用wr99210进行药物选择之后,从被转染的寄生物中移除abbc2基因,这可归因于靶向的cas9引发的双链断裂和随后与pfcabcc2ko质粒中所含的5utr/3utr元件的重组。通过pcr使用引物对p1/p2和p3/p4评估克隆寄生物的基因缺失。图6c说明了来自3种恶性疟原虫abcc2–克隆(cl1-3)和野生型(wt)的扩增dna的dna凝胶电泳。结果显示了在全部克隆中均有基因缺失,这可归因于p1/p2产物的长度减少和p3/p4产物的缺乏。图7a-7c说明了基因减毒恶性疟原虫的产生,其是使用crispr/cas9技术生成的plasmei2-敲除。图7a示意性说明了相对于plasmei2基因的退火位点,其用于在应用针对plasmei2基因敲除的crispr/cas9之前和之后检测靶基因的存在。图7b说明了来自野生型恶性疟原虫(即,无基因修饰)的plasmei2基因区域的扩增。图7c说明了来自于受plasmei2基因crispr/cas9缺失影响的恶性疟原虫的plasmei2基因的任何区域均缺乏扩增。图8是人寄生物恶性疟原虫发育的人源化鼠模型的示意图。将恶性疟原虫的子孢子接种到frghuhep小鼠,随后对其施用人红细胞。允许恶性疟原虫的感染进行足够的时间以使肝期转变到红内期。随后评估血液样品的恶性疟原虫的红内期发育。图9是一系列野生型和plasmei2-ko恶性疟原虫的显微照片,显示了在人肝脏嵌合的frghuhep小鼠的肝脏中,在子孢子注射之后6天,在肝晚期裂体生殖(schizogon)时的发育。对来自野生型和plasmei2-ko恶性疟原虫中的每一种进行染色使得环子孢子蛋白(csp)(表示为“绿色”)、bip以显示内质网(表示为“红色”),且dapi以显示dna(表示为“蓝色")。发明详述本公开涉及完全减毒和发育到肝晚期的减毒疟原虫。特别是,所述减毒疟原虫的lisp2和plasmei2基因的功能被破坏。所公开的双重减毒疟原虫可用于刺激脊椎动物宿主免疫系统的方法和组合物。本公开是基于发明人表征了多个突变对于疟原虫寄生物发育的影响的工作。发明人发现约氏疟原虫中两种基因缺失的特定组合导致寄生物的完全减毒,但仅在明显正常肝期形式的发育之后。完全减毒的发现是令人惊奇的,这是因为先前对每种基因缺失本身的表征已得到了不完美或不完全的肝晚期停滞。缺失的两个基因靶plasmei2和肝特异性蛋白2(lisp2)参与不同的生物过程。先前使用gap技术的实验显示,仅仅对各自导致不完全减毒的缺失进行组合有可能在一定程度上改善减毒,但是不会必然实现生命周期进展的完全停止。考虑到每种基因在不相关过程中的明显参与,这尤其如此。完全减毒,尤其是在健康发育之后,是确保任何可施用组合物安全性的关键特征,因为其确保了没有会导致临床症状的异常传播或生命周期进展。为实现完全减毒,发明人研究了不同的敲除表型。发明人惊奇地发现,缺乏plasmei2和lisp2的双敲除寄生物实现了在肝期期间明显健康的发育进展,但在红内期发育(即,裂殖子)之前发育完全停止的难以解释的组合。双敲除寄生物在所检验的所有小鼠品系中均完全减毒,在肝期发育的晚期停滞,并且提供免受子孢子和红内期攻击的保护。此外,成功地产生了plasmei2基因敲除的恶性疟原虫,其还表现出晚期停滞,并且在人源化小鼠模型中没有检测到向红内期的转变。这些发现提供了对以下概念的证明:与现有减毒寄生物相比,肝晚期停滞的恶性疟原虫gap的产生实现优异的保护。根据前述内容,在一个方面,本公开提供了经基因修饰以破坏plasmei2基因功能和lisp2基因功能的活疟原虫生物体。如本文所用的,术语“疟原虫生物体(plasmodiumorganism)”或“寄生物”是指属于疟原虫属的任何寄生物。在一些实施方式中,疟原虫生物体可感染人类宿主,诸如,例如,恶性疟原虫、间日疟原虫(p.vivax)、卵形疟原虫(p.ovale)、三日疟原虫(p.malariae)和诺氏疟原虫(p.knowlesi)。在一些实施方式中,疟原虫生物体是恶性疟原虫。在一些实施方式中,疟原虫生物体是间日疟原虫或卵形疟原虫。在其它实施方式中,疟原虫生物体可感染其它脊椎动物宿主,诸如非人灵长目动物和啮齿目动物。这些疟原虫生物体的实例包括约氏疟原虫、伯氏疟原虫(p.berghei)、夏氏疟原虫(p.chabaudi)、文氏疟原虫(p.vinckei)和食蟹猴疟原虫(p.cynomolgi)。术语“活”是指疟原虫生物体中的持续代谢活性。在一些实施方式中,“活”表示疟原虫生物体能够最终至少建立初步感染,例如,在肝细胞中(培养或体内的)。考虑到基因减毒,疟原虫生物体可处于可实行的任何相关发育阶段。因此,例如,除了肝细胞内(肝)阶段之外,疟原虫生物体还可处于蚊内发育阶段和感染性子孢子期。如本文所用的,术语“基因修饰的”是指对疟原虫生物体基因组的修饰,所述修饰导致与野生型基因组序列的限定的差异。基因修饰是通过人为操纵强加的,例如,通过基因工程。具体地,基因修饰导致plasmei2和lisp2基因的功能破坏。术语“破坏”基因功能,具体地,“破坏plasmei2基因功能和lisp2基因功能”,表示干涉基因功能从而抑制、失活、减弱或阻断该基因功能。干涉或破坏可例如通过以一定方式和/或程度改变基因序列以使得翻译的蛋白(如果有的话)不再执行其野生型功能。在一些实施方式中,如下文中所述,这可通过使修饰的寄生物不能发展到肝晚期和/或向红内期转变来实现。基因改变可包括在初始基因序列中引入一个或多个添加、取代或缺失。与野生型蛋白相比,所得的序列可导致功能性活性位点的移除或改变,或者导致正常蛋白折叠的改变以提供不同的二级结构(并因此丧失活性位点)。在一些实施方式中,基因改变是去除基因的一部分(包括全部)。在一些实施方式中,添加或缺失导致所翻译的蛋白质的至少部分导致功能的丧失或减弱。或者,可通过如下方式干扰基因:影响转录或翻译速率以导致较低水平的蛋白产物,从而降低疟原虫生物体内聚集蛋白的活性水平。这可通过改变基因中或周围的启动子或其他调控序列来实现。基因修饰允许产生疟原虫生物体的克隆种群,其具有与野生型相同的遗传限定修饰。因此,本公开提供了各自具有如本文所公开的基因修饰的疟原虫生物体的克隆种群。在一些实施方式中,所述疟原虫生物体缺少功能性plasmei2基因或缺少功能性lisp2基因,如上所述的。在一些实施方式中,所述疟原虫生物体缺少功能性plasmei2基因和缺少功能性lisp2基因。如本文所用的,术语“缺少功能性基因”表示生物体在其基因组中缺少编码在野生型生物体中定义的功能性蛋白的遗传材料。如本文所述,野生型plasmei2-编码的蛋白质包含rna结合结构域(rbd),其与mei2(减数分裂抑制2(meiosisinhibited2))中的rbd之一具有同源性,其最初描述于裂殖酵母schizosaccharomycespombe中。编码的蛋白仅在肝期寄生物的细胞质颗粒中表达,显示在rna稳态中的作用。约氏疟原虫plasmei2基因的说明性序列在本文中如seqidno:1所示。直系同源的恶性疟原虫plasmei2基因的说明性序列在本文中如seqidno:9所示。考虑到在天然存在的直系同源物中潜在的中性序列变异或变异,在一些实施方式中,功能性plasmei2基因被定义为包含与seqidno:1或seqidno:9所示序列具有至少90%、91%、92%、93%、94%、95%、96%、97%、98%和99%序列同一性的核酸序列。功能性plasmei2基因的缺少可通过可证明的在发育肝晚期的发育停滞来证明,如下文中所述的。特别是与缺少功能性lisp2基因相结合时,这种发育停滞可以是完全的(即,完全减毒且无肝期突破)。如本文所述,野生型肝脏-特异性蛋白2(lisp2)-编码的蛋白在伯氏疟原虫的肝中期到晚期纳虫空泡膜(pvm)上表达,且lisp2基因的缺失被证明导致肝晚期停滞,并且不完全减毒。约氏疟原虫lisp2基因的说明性序列在本文中如seqidno:5所示。直系同源的恶性疟原虫lisp2基因的说明性序列在本文中如seqidno:13所示。考虑到在天然存在的直系同源物中潜在的中性序列变异或变异,在一些实施方式中,功能性lisp2基因被定义为包含与seqidno:5或seqidno:13所示序列具有至少90%、91%、92%、93%、94%、95%、96%、97%、98%和99%序列同一性的核酸序列。功能性lisp2基因的缺少可通过可证明的在发育肝晚期的发育停滞来证明,如下文中所述的。特别是与缺少功能性plasmei2基因相结合时,这种发育停滞可以是完全的(即,完全减毒且无肝期突破)。如本文所述,plasmei2和lisp2基因功能破坏的疟原虫生物体表现为完全减毒,即,生命周期发育完全停滞,使得没有任何超出停滞状态的发育后代进展(“突破”)到下一个发育阶段。因此,在一些实施方式中,所述疟原虫生物体不发育到能够感染哺乳动物中间宿主中的红细胞的裂殖子阶段。在一些实施方式中,哺乳动物中间宿主体内的疟原虫生物体的生命周期发育停滞于肝晚期。哺乳动物宿主可以为已知易受疟原虫寄生物感染的任何哺乳动物物种。在一些实施方式中,哺乳动物宿主是人。在一些实施方式中,哺乳动物宿主是非人灵长目动物。在一些实施方式中,哺乳动物宿主是啮齿目动物,诸如大鼠、小鼠或豚鼠。基因修饰可使用任何用于基因工程的合适技术进行。例如,如在下文中更详细描述地,plasmei2基因功能和lisp2基因功能均通过使用crispr/cas9基因编辑技术使各个基因缺失来破坏(参见,例如,zhangc,etal.2014.efficienteditingofmalariaparasitegenomeusingthecrispr/cas9system.mbio5:e01414-01414;wagnerjc,etal.2014.efficientcrispr-cas9-mediatedgenomeeditinginplasmodiumfalciparum.natmethods11:915-918;andghorbalm,etal.2014.genomeeditinginthehumanmalariaparasiteplasmodiumfalciparumusingthecrispr-cas9system.natbiotechnol32:819-821;其各自通过引用整体并入本文)。基因破坏(geneticdisruption)还可通过抑制因子的过表达来实现。这样的因子可通过反向遗传方法插入到假基因中,即,在生命周期期间的任何时间点均对寄生物存活不是必需的基因。抑制因子不应赋予寄生物毒性,而是用于破坏plasmei2基因功能或lisp2基因功能。应用基因重组以对靶标plasmei2和/或lisp2基因应用功能性敲除的其他方法是公知的。例如,参见wo2005/063991和u.s.8168166,其各自通过引用整体并入本文,它们公开了例如从疟原虫基因组去除靶基因座的同源置换策略。反义技术也已成功用于破坏疟原虫基因功能。例如,针对恶性疟原虫拓扑异构酶ii基因的不同区域的外源递送硫代磷酸酯反义寡核苷酸导致寄生物生长的序列-特异性抑制(参见,例如,noonpakdee,w.,etal.,inhibitionofplasmodiumfalciparumproliferationinvitrobyantisenseoligodeoxynucleotidesagainstmalarialtopoisomeraseii,biochembiophysrescommun.302(4):659-64(2003),其通过引用整体并入本文)。类似地,用反义构建物转染恶性疟原虫clag9基因,所述clag9基因已显示对通过靶向基因破坏发生的细胞粘附而言是必需的,与未转染对照寄生物相比,导致细胞粘附的15-倍降低(参见,例如,gardiner,d.l.,etal.,inhibitionofplasmodiumfalciparumclag9genefunctionbyantisenserna,molbiochemparasitol.110(1):33-41(2000),其通过引用整体并入本文)。这种方法可容易地被修改用于特异性应用到靶plasmei2和/或lisp2靶基因。能用于破坏基因功能的另一项示例性技术是使用短干扰rna分子(sirna)的rna干扰(rnai)以在基因中产生表型突变。rnai已被用作研究和/或验证在不同生物体(包括植物、果蝇、蚊子、小鼠和疟原虫)中的基因功能的方法。例如,在疟原虫中,rnai被用于证明来自恶性疟原虫的ppi丝氨酸/苏氨酸蛋白磷酸蛋白酶(pfpp1)的重要作用(kumaretal.characterizationandexpressionofappiserine/threonineproteinphosphatase(pfpp1)fromthemalariaparasite,plasmodiumfalciparum:demonstrationofitsessentialroleusingrnainterference.malar.j.1(1):5(2002))。rnai还被用于通过降低编码二氢乳清酸脱氢酶的基因的表达水平(mcrobert&mcconkey.rnainterference(rnai)inhibitsgrowthofplasmodiumfalciparum.mol.biochem.parasitol.119(2):273-8(2002))和通过阻断半胱氨酸蛋白酶基因的表达(malotraetal.,double-strandedrna-mediatedgenesilencingofcysteineproteases(falcipain-1and-2)ofplasmodiumfalciparum.mol.microbiol.45(5):1245-54(2002))来抑制恶性疟原虫的生长。在小鼠疟疾模型中,rnai已被用于抑制体内循环的伯氏疟原虫寄生物中的基因表达(mohmmedetal.,invivosilencinginplasmodiumberghei-amousemalariamodel.biochem.biophys.res.commun.309(3):506-11(2003))。这些研究已证明了使用rnai作为有效工具以破坏疟原虫生物体的基因功能。在一些实施方式中,疟原虫生物体还可被进一步增强以展示其他抗原,其功能是为宿主免疫系统提供其他刺激。在一个实施方式中,疟原虫生物体包含至少一种编码红内期或配子体相关抗原的转基因。本公开的这一要素在下文中更详细描述。在另一相关方面中,本公开提供了一种包含本文所述的活疟原虫生物体的免疫原性组合物。所述免疫原性组合物可为,例如,被构造用于施用给哺乳动物宿主(例如,人)的疫苗组合物。其中plasmei2基因功能和/或lisp2基因功能已被破坏的工程化疟原虫生物体通常在有性阶段(sexualstage)细胞培养物中生长,并在蚊子载体中扩增。在一些实施方式中,扩增的子孢子可被收获以用于免疫原性组合物中(参见,例如,al-olayan,e.m.,etal.,completedevelopmentofmosquitophasesofthemalariaparasiteinvitro.science295:677-679(2002))。先前已描述了用于生产适合作为疫苗施用的减毒无菌子孢子的方法,以及用于子孢子的冷冻保存的方法(参见,例如,chulay,j.d.,etal.malariatransmittedtohumansbymosquitoesinfectedfromculturedplasmodiumfalciparum.am.j.trop.med.hyg.35(1):66-8(1986)(jan);u.s.patentno.7,229,627,其各自通过引用整体并入本文)。通过将减毒活疟原虫生物体悬浮在可药用载体中来生产主题疫苗组合物。或者,疫苗组合物可通过已被用于扩增减毒子孢子的感染性蚊子的叮咬来施用。合适的可药用载体包括无菌水或无菌生理盐溶液,特别是磷酸盐缓冲盐水(pbs),如本领域所熟知的。在一些实施方式中,组合物中的基因减毒的疟原虫生物体是具有相同或显著相似(允许约<1%的基因组中的微小基因变化)的基因组的克隆种群,更具体而言,包含相同的基因修饰以破坏plasmei2基因功能和/或lisp2基因功能。在一些实施方式中,免疫原性组合物(例如,疫苗组合物)包含如上所述的基因修饰的疟原虫生物体,其还表达至少一种编码红内期或配子体相关抗原的转基因,如下文中更详细描述的。根据本公开的疫苗可通过感染性蚊子叮咬以及肠胃外施用来施用,例如,皮内、皮下、透皮、表皮、通过粘膜、进入粘膜下组织、肌内、腹膜内和静脉内施用。施用本发明的活减毒子孢子的合适方法描述于2003年11月20日提交的pct/us03/37498以及2005年10月6日公布的美国专利公开第2005/0220822号中,两者均通过引用并入本文。可使用单次接种或者两次或更多次的一系列接种来实现所需水平的保护。因此,第一引发剂量的疫苗之后可进行随后的加强剂量。接种次数可在1年内1至6次剂量范围内,在随后几年可使用额外的加强剂量。根据经验选择剂量以在宿主中实现所需的免疫应答。“免疫应答”表示获得性和增强性程度的保护性免疫,优选针对后续暴露于野生型疟原虫子孢子的完全保护或无菌保护。每次接种中基因减毒疟原虫子孢子(诸如恶性疟原虫基因减毒子孢子)的合适剂量可介于约1,000至约10,000,000子孢子之间,诸如介于约1,000至1,000,000子孢子之间,介于5,000至500,000子孢子之间,介于10,000至250,000子孢子之间,或介于100,000至150,000子孢子之间。在本发明的一些实施方式中,每次接种对人类受试者施用至少约1,000基因减毒子孢子的剂量。在本发明的一些实施方式中,对人类受试者施用介于约1,000至500,000基因减毒子孢子之间的剂量。在本发明的一些实施方式中,对人类受试者施用介于约10,000和250,000基因减毒子孢子之间的剂量。因此,在一个相关方面,本公开还提供了一种诱导受试者针对一种或多种疟原虫抗原的免疫应答的方法。所述方法包括对受试者施用活疟原虫生物体或包含活疟原虫生物体的组合物,其中所述活疟原虫生物体经基因修饰以破坏plasmei2基因功能和lisp2基因功能,如上所述的。在优选实施方式中,受试者的接种提供了针对后续暴露于疟原虫寄生物的至少一定程度的保护性免疫。通常认为,根据本发明的方法用一种疟原虫物种的基因减毒疟原虫子孢子接种受试者将诱导针对相同物种的野生型疟原虫寄生物的攻击的保护性免疫。然而,已显示用一种疟原虫物种的子孢子免疫能够针对另一种疟原虫攻击进行保护,因此以此方式引起跨物种保护也在本发明范围内。在一个实施方式中,施用给受试者的活疟原虫生物体是感染性子孢子期的疟原虫。免疫原性(例如,疫苗)组合物的示例性剂量和施用方法如上文所述。在所述方法的一些实施方式中,所述受试者是人,并且所述活疟原虫是恶性疟原虫、间日疟原虫、卵形疟原虫、三日疟原虫或诺氏疟原虫。在更具体的实施方式中,所述活疟原虫是恶性疟原虫。在其它实施方式中,受试者是啮齿目动物,并且所述活疟原虫是约氏疟原虫、伯氏疟原虫、夏氏疟原虫或文氏疟原虫。在一个具体实施方式中,所述啮齿目动物是小鼠,并且活疟原虫是约氏疟原虫。在一些实施方式中,所述施用步骤导致受试者肝细胞的感染。在一些实施方式中,免疫应答改善或防止因后续的野生型疟原虫攻击所致的感染。因此,在一些实施方式中,在暴露于野生型恶性疟原虫之后,所公开的方法赋予了足以减少至少60%的受试者(例如,人)的疟疾症状的保护性免疫,诸如,例如至少60%、至少70%、至少80%、至少90%、至少95%或至少99%的受试者(部分保护性免疫)。在一些实施方式中,在暴露于野生型疟原虫之后,所公开的方法赋予了足以在至少60%的受试者(例如,人)中预防疟疾的保护性免疫,诸如,例如至少60%、至少70%、至少80%、至少90%、至少95%或至少99%的受试者(完全保护性免疫)。在一些实施方式中,50-100%的受试者(例如,人),诸如95%的受试者被完全或至少部分保护免受野生型疟原虫寄生物(例如,恶性疟原虫寄生物)的攻击至少10个月。在另一方面,本公开提供了基因减毒疟原虫寄生物(gap),其还包含至少一种编码红内期或配子体相关抗原的转基因。通过提供一种或多种红内期或配子体相关抗原的表达,任何gap或相关组合物将具有额外的免疫原性和提供针对红内期寄生物(无性和有性)的额外保护。因此,即使gap在发育到红内期之前即完全停滞,其也仍能够针对红内期寄生物的特征抗原刺激免疫细胞。这提供了针对红内期寄生物的进一步保护并降低了临床症状及配子体抗原中感染传播的风险。术语“基因减毒”表示gap具有基因修饰,该修饰导致通过肝发育期的进展减少,从而导致临床症状或寄生物负荷的较低表现和/或无表现。基因减毒可以是基因修饰,该基因修饰导致生命周期的肝期期间健康功能所需的一种或多种基因的破坏。例如,该基因修饰将包含导致plasmei2和/或lisp2基因的功能破坏的一种或多种修饰,如上所述的。然而,本公开的这一方面不限于plasmei2和/或lisp2基因的破坏,还可应用于其他gap等。例如,gap可包含一种或多种以下基因功能的破坏:p52、p36、sap1、fabb/f。这样的gap在例如美国专利第8168166号中更详细描述,其通过引用整体并入本文。编码的红内期或配子体抗原可以是与具有刺激免疫应答能力的无性红内期或有性红内期(配子体)相关的任何抗原。适合用于本方面的红内期和配子体抗原的代表性和非限制性实例包括:裂殖体逸出抗原-1(sea-1)(raj,d.k.,etal.,antibodiestopfsea-1blockparasiteegressfromrbcsandprotectagainstmalariainfection.science344(6186):871877(2014)),网织红细胞-结合家族同系物5(rh5)(tran,t.m.,etal.,naturallyacquiredantibodiesspecificforplasmodiumfalciparumreticulocyte-bindingproteinhomologue5inhibitparasitegrowthandpredictprotectionfrommalaria.jinfectdis209(5):789-798(2014);和douglas,a.d.,etal.,apfrh5-basedvaccineisefficaciousagainstheterologousstrainblood-stageplasmodiumfalciparuminfectioninaotusmonkeys.cellhostmicrobe17(1):130-139(2015)),以及配子体抗原恶性疟原虫红内期抗原s25(talaat,k.r.,etal.,safetyandimmunogenicityofpfs25-epa/alhydrogel(r),atransmissionblockingvaccineagainstplasmodiumfalciparum:anopenlabelstudyinmalarianaiveadults.plosone11(10):e0163144(2016))和红内期抗原pfs48/45(singh,s.k.,etal.,aplasmodiumfalciparum48/45singleepitoper0.6csubunitproteinelicitshighlevelsoftransmissionblockingantibodies."vaccine33(16):1981-1986(2015)或其任何免疫原性部分。转基因通常在合适启动子的控制下,所述启动子导致工程化疟原虫的子孢子或肝发育期期间转基因的转录。这样的启动子可为组成型启动子或在子孢子和/或肝期期间提高表达的启动子。示例性的启动子包括用于子孢子期的环子孢子蛋白(csp)(engelmann,s.,etal.,transgenicplasmodiumbergheisporozoitesexpressingbeta-galactosidaseforquantificationofsporozoitetransmission.molbiochemparasitol146(1):30-37(2006))和血小板反应蛋白相关粘附蛋白(trap)(kaiser,k.,etal.,differentialtranscriptomeprofilingidentifiesplasmodiumgenesencodingpre-erythrocyticstage-specificproteins.molmicrobiol51(5):1221-1232(2004)),用于肝期的lisp2(deniz,m.,etal.,invivoandinvitrocharacterizationofaplasmodiumliverstage-specificpromoter.plosone10(4):e0123473(2015);用于组成型启动子的延长因子1α(vaughan,a.m.,etal.,atransgenicplasmodiumfalciparumnf54strainthatexpressesgfp-luciferasethroughouttheparasitelifecycle.molbiochemparasitol186(2):143-147(2012))。可在gap中以本领域中已确立的任何合适方法实施转基因。例如,如下文中更详细描述的,crispr/cas9基因编辑系统已被成功应用在疟原虫物种中,并且可用于以合适的启动子表达转基因从而有利于红内期或配子体阶段抗原的转基因表达。或者,可使用更多已确立的方法进行转基因表达。在一些实施方式中,编码的红内期或配子体相关抗原被构造为在疟原虫生物体表面上表达或由疟原虫生物体分泌。取决于野生型抗原序列,这可通过移除初始信号序列并代之以导致在肝期分泌或表面表达的信号序列来实现。认为这种合理设计的转基因允许在肝期驻留期间重组蛋白的正确折叠以及在子孢子表面之外或在pv/pvm界面处的表达。或者,可将合适的基序附加到蛋白质抗原的n-末端上,因为该方法已用于验证肝期发育期间的蛋白输出(montagna,g.n.,etal.,antigenexportduringliverinfectionofthemalariaparasiteaugmentsprotectiveimmunity.mbio5(4):e01321-01314(2014))。应意识到对于本方面所设想的许多gap已经能内源性地编码适合用于本公开这一方面的许多红内期抗原。在大多数情况中通常将不会表达这种抗原,因为许多gap通过设计减毒在达到允许这种表达的合适红内期之前停滞发育。因此,在另一方面,本公开提供了一种基因减毒的疟原虫寄生物(gap),其进一步包含至少一种转基因,所述至少一种转基因具有对编码红内期或配子体相关抗原的内源基因的内源启动子序列的修饰,使得红内期或配子体相关抗原在子孢子和/或肝期发育早期表达。合适的强子孢子和肝期启动子将驱动子孢子和肝期表达。这可通过例如将编码红内期或配子体相关抗原的内源基因的启动子替换为组成型启动子或以另外方式促进子孢子和/或肝发育期中表达的启动子。示例性的靶基因、启动子序列和实施基因修饰的方法是已知的,并且在本文中另外描述。优选地,基因的这种转基因表达基本上不抑制在蚊子中培养的疟原虫提供感染性子孢子的能力。这可使用惯常方法容易地测定。在另一方面中,本公开提供了一种制备如本文所述的基因修饰的疟原虫生物体的方法和/或一种包含如本文所述的活疟原虫生物体的免疫原性组合物。所述方法包括在疟原虫生物体(例如,野生型或其他实验室株系)中实施一种或多种基因修饰以破坏plasmei2和/或lisp2的基因功能。通常,在生命周期发育的红内期(例如,裂殖子)中实施基因改变。在一些实施方式中,包含基因修饰(例如,全部或部分基因缺失)的质粒被转染到红内期的靶疟原虫生物体中。示例性的质粒如本文所述,并且可包含其他元件,诸如耐药基因以用作用于插入的可选择标记物。质粒通常包含同源臂以驱动关注基因的缺失。质粒可根据本领域中公开的技术生成,诸如使用crispr/cas9,随后双交叉同源重组(参见,例如,zhangc,etal.2014.efficienteditingofmalariaparasitegenomeusingthecrispr/cas9system.mbio5:e01414-01414;wagnerjc,etal.2014.efficientcrispr-cas9-mediatedgenomeeditinginplasmodiumfalciparum.natmethods11:915-918;andghorbalm,etal.2014.genomeeditinginthehumanmalariaparasiteplasmodiumfalciparumusingthecrispr-cas9system.natbiotechnol32:819-821;它们各自通过引用整体并入本文)。选择已成功摄取质粒的寄生物用合适的药物分离已经历基因缺失的寄生物种群。一旦获得寄生物种群,就可以通过有限稀释进行克隆。参见,例如,jansecj,etal.2006.high-efficiencytransfectionanddrugselectionofgeneticallytransformedbloodstagesoftherodentmalariaparasiteplasmodiumberghei.natprotoc1:346-356;其通过引用整体并入本文。通过pcr进行的任选基因分型可用于确认已经历基因缺失的克隆。此外,选择基因敲除寄生物的克隆可用于生命周期的表型分析。经修饰的疟原虫的生命周期可被允许在体外培养物或在可相容蚊子宿主中进展。例如,无性寄生物被转化为配子体,并且将成熟配子喂给合适的蚊子宿主(例如,对于恶性疟原虫寄生物,为斯氏按蚊),并且监控卵囊发育和唾液腺子孢子成熟。在一些实施方式中,当存在多个改变时,例如,在独立基因座处改变,诸如plasmei2和/或lisp2基因,可使用以上技术同时或连续地实施改变。例如,可在具有第一改变的初始克隆寄生物上实施以上技术以进行第二改变。蚊子体内的感染性子孢子可提供最终组合物,其可通过以下方式施用:使蚊子直接以受试者为食以接受组合物。或者,可从蚊子唾液腺提取子孢子、清洗并制备以注射给接受组合物的受试者。通常应注意,除非明确指出仅指择一性的或替代选项是互斥的,在权利要求中使用的术语“或”是用于表示“和/或”,尽管本公开支持仅指代选择性以及“和/或”的定义。根据长期专利法,除非特别说明,术语“一/一个/一种(a/an)”当在权利要求书或说明书中与术语“包括/包含/含有/具有”联合使用时,其指代一或多(一个或多个/一种或多种)。除非上下文明确要求,否则在整个说明书和权利要求中,“包括”、“包含”等词语应以包容性意义解释,而不是排他性或穷举性意义,诸如,意为“包括但不限于”。使用单数或复数的单词时还分别包括复数和单数。另外,当在本申请中使用时,词语“此处/这里/本文”、“上方”和“下方”以及类似含义的词语应当指代本申请作为整体而不是指本申请的任何特定部分。诸如“约”和“近似”之类的词语意味着围绕所述值的微小变化,通常在标准误差范围内,诸如在所述值的10%或5%之内。公开了可用于与所公开的方法和组合物联合以及准备用于所公开的方法和组合物的材料、组合物和组分。应理解当公开了这些材料的组合、子集、组等时,可具体设想多种单独和共同组合中的每个,尽管对这些化合物的各个和每个单个组合以及排列的具体引用可能没有被明确公开。这一概念适用于本公开的所有方面,包括但不限于所述方法中的步骤。因此,任何前述实施方式的特定元件可组合或替代用于其他实施方式中的元件。例如,如果存在可实施的多种其他步骤,应理解这些其他步骤中的每个可与所公开的方法的任何特定方法步骤或方法步骤组合一起实施,并且每个这种组合或组合的子集被具体考虑并且应当被认为是公开的。另外,应理解本文所述的实施方式可使用任何合适的材料实施,诸如本文中其他地方所述的那些或本领域中已知的那些。本文中引用的出版物或其所引用的主题在此通过引用整体并入。示例性技术说明下文中描述了令人惊奇的发现,即,疟原虫中lisp2和plasmei2基因的双重破坏允许寄生物生命周期完全停滞于肝期发育的末期。尽管每一基因操纵本身导致部分生命周期停滞,这些特定基因操纵的特定组合协同地实现了生命周期进展的完全停止,阻止了任何进入红内期的发育。这防止了严重的疾病症状以及任何潜在的通过蚊子载体的传播。作为额外的益处,完全停滞发生在肝期发育的极晚期,允许针对宿主免疫系统的更完整和更长时间的典型肝期抗原表达(representation)以对未来的野生型感染提供更全面的免疫应答。介绍针对恶性疟原虫疟疾的有效疫苗对于根除尝试可能是必不可少的,但利用选择寄生物抗原的亚单位疫苗开发迄今仍仅显示适度成功。相比之下,使用通过蚊子叮咬递送的辐射-减毒子孢子(ras)进行免疫的人类形成性试验针对完全感染性子孢子的攻击提供了近乎完全的保护(称为可控人疟疾感染(controlledhumanmalariainfection),chmi)。近年来,通过静脉内(iv)注射施用小瓶装的冷冻保存ras,其赋予了针对chmi的强有力的保护,证实了这种形式的疫苗接种的安全性和功效。辐射导致子孢子中的dna损伤,使其保留感染性,但在感染肝细胞时导致dna复制阻断,因此在滋养子/早期裂殖子阶段发生寄生物的发育停滞。这导致感染肝细胞中的寄生物死亡或者寄生物与感染细胞均死亡。减毒子孢子是复杂免疫原,包含数千种独特的寄生物蛋白,其中许多是针对子孢子的潜在抗体靶以及针对早期感染肝细胞的t细胞靶。因此,ras刺激多重适应性免疫应答,赋予红细胞前免疫对抗感染,从而阻止了红内期感染的发作。然而,如果活寄生物免疫原能够进一步发育通过肝裂殖期并因此显著增加其生物质,以及进一步使其抗原库(antigenrepertoire)多样化,则其应引起比ras更广泛和更强力的免疫应答。实际上,这已经通过全寄生物疫苗接种的替代方法在人类中显示,其中用完全感染性子孢子对用红内期抗疟氯喹进行预防性治疗的受试者进行免疫。在该免疫中,肝期发育是正常的,但从肝脏中释放出来并感染红细胞的红细胞外(exoerythrocytic)裂殖子被氯喹杀死。这种全寄生物免疫方法引起针对chmi的无菌保护,但令人震惊地是,与ras相比需要比其低约60-倍的累计寄生物量。然而,在免疫期间连续施用抗疟疾药物很可能被视为不可实施的疫苗接种方法。疟原虫寄生物的靶向基因缺失技术允许以更精确和可控的方式来产生确定和可重现的减毒寄生物批次。啮齿目动物疟疾基因减毒寄生物(gap)的初始研究集中于在感染性子孢子中上调(uis)的基因的缺失。从寄生物基因组缺失多个uis基因不会影响子孢子活力,而是导致寄生物在肝脏中的早期发育停滞,这些gap是强有力的免疫原,保护免疫小鼠免受子孢子攻击。在先前的临床研究中产生了肝早期停滞的恶性疟原虫的三敲除gap,并且没有显示出突破到红内期感染的证据,在最近的临床研究中,当通过约200只感染的蚊子叮咬施用给志愿者时,没有显示突破。在肝期发育早期停滞的其它恶性疟原虫gap包括恶性疟原虫b9-/sap1-和恶性疟原虫abccc2-,但这些gap尚未在人类中测试。肝早期停滞的gap基因敲除候选物的鉴定依赖于唾液腺子孢子的转录谱,其揭示了建立肝期感染所必须的基因,但不一定是控制肝期发育和成熟的基因。为鉴定后者,进行了啮齿目动物疟疾肝期蛋白质组和转录组的研究以及它们与其它生命周期的比较,并且揭示了肝期发育所必需的新型潜在gap基因候选物。这些包括编码参与ii型脂肪酸合成途径(fasii)(一种原核生物来源的顶质体定位途径)的酶的基因子集。实际上,在约氏疟原虫和伯氏疟原虫中fasii基因的缺失证明了在肝晚期停滞之前近乎完全的通过裂殖的肝期发育进展。约氏疟原虫fasii敲除是完全减毒的,但伯氏疟原虫敲除显示了到红内期感染的有限突破。与肝早期停滞的约氏疟原虫gap和约氏疟原虫ras相比,用缺乏fasii的约氏疟原虫子孢子免疫小鼠导致更有效的免疫应答和优异保护。重要地是,免疫的小鼠在真皮内免疫之后受到保护,并且还被保护免受致死性红内期攻击,因此显示出跨生命周期阶段的保护。总之,这些数据表明,肝晚期停滞的gap将是人类中优异的免疫原,并且安全的肝晚期停滞恶性疟原虫gap将显示为理想的活减毒疫苗株系。然而,产生肝晚期停滞的恶性疟原虫gap的努力遭遇阻碍,因为fasii中涉及的基因的缺失意外地导致蚊子体内的恶性疟原虫孢子的完全缺陷,阻碍了其产生。在进一步努力创造新的肝晚期停滞的gap时,我们和其他人针对啮齿目动物疟疾寄生物中的肝晚期发育停滞的表型继续筛选肝期表达基因的基因缺失。两种被鉴定出导致肝晚期停滞的独立基因缺失包括约氏疟原虫中的plasmei2(dankwada,etal.2016.aplasmodiumyoeliimei2-likernabindingproteinisessentialforcompletionofliverstageschizogony.infectimmun84:1336-1345,其通过引用整体并入本文)和伯氏疟原虫中的肝特异性蛋白2(lisp2)(annourat,etal.2014.twoplasmodium6-cysfamily-relatedproteinshavedistinctandcriticalrolesinliver-stagedevelopment.fasebj28:2158-2170;kumarh,etal.2016.protectiveefficacyandsafetyofliverstageattenuatedmalariaparasites.scirep6:26824;andoritoy,etal.2013.liver-specificprotein2:aplasmodiumproteinexportedtothehepatocytecytoplasmandrequiredformerozoiteformation.molmicrobiol87:66-79;其各自通过引用整体并入本文)。我们在这里检测了plasmei2和lisp2的双缺失是否能够协同产生安全的、完全减毒的gap。我们的研究令人惊奇地显示,约氏疟原虫plasmei2-/lisp2-构成了合成致死性基因缺失组合,其使寄生物完全减毒,同时保持了肝晚期停滞的表型。用约氏疟原虫plasmei2-/lisp2-免疫小鼠引起了强有力的t细胞和抗体应答,并且提供给了针对子孢子攻击的完全保护以及针对红内期攻击的跨阶段保护。结果约氏疟原虫plasmei2-和约氏疟原虫lisp2-显示肝期发育的不完全减毒约氏疟原虫plasmei2包含与mei2(减数分裂抑制2)中的rbd之一具有同源性的rna结合结构域(rbp),最初描述于裂殖酵母粟酒裂殖酵母(schizosaccharomycespombe)中(egelr,etal.1990.sexualdifferentiationinfissionyeast.trendsgenet6:369-373;其通过引用整体并入本文)。plasmei2在肝期寄生物的细胞质颗粒中表达,暗示了在rna稳态中的作用。我们先前已示出了plasmei2在约氏疟原虫17xnl中的缺失在高敏感性balb/cbyj小鼠中在50,000plasmei2-子孢子的静脉内攻击剂量下导致肝晚期停滞和没有突破到红内期感染的证据。为确定较高剂量是否能导致突破,我们在此以200,000或500,000plasmei2-子孢子在30只balb/cbyj小鼠群中针对每种剂量实施了静脉内攻击,并且确实观察到偶有突破到红内期感染(对于200,000为3/30,并且对于500,000为4/30,表1)。这一发现显示,约氏疟原虫plasmei2-在高剂量攻击的高敏感性小鼠中是极度但非完全减毒的。我们接下来认为,假设每个独特基因功能的缺乏能在其对肝期发育的不利作用方面起协同作用,则同时缺失两个各自在肝晚期导致不完全减毒的肝期-表达的基因能够通过产生合成致死表型来实现完全减毒。因此我们考虑了其它基因候选物并选择研究lisp2,因为其在肝中期至晚期纳虫空泡膜上表达,并且伯氏疟原虫lisp2的缺失导致不完全的肝晚期生长停滞。我们首先通过使用最近描述的crispr/cas9技术来缺失基因以检测约氏疟原虫lisp2-是否在肝晚期发育期间停滞(zhangc,etal.2014.efficienteditingofmalariaparasitegenomeusingthecrispr/cas9system.mbio5:e01414-01414;其通过引用整体并入本文),其允许寄生物基因组的有效编辑。这一系统的优点是转基因寄生物不携带药物敏感性标记物,因此容易地经受进一步的基因操纵。因此使用pyc质粒(zhangc,etal.2014.mbio5:e01414-01414;其通过引用整体并入本文)来靶向lisp2以在无标记物的约氏疟原虫17xnl寄生物中缺失,所述寄生物结构性地表达了名为1971cl1的gfp-荧光素酶融合(linjw,etal.2011.anovel'geneinsertion/markerout'(gimo)methodfortransgeneexpressionandgenecomplementationinrodentmalariaparasites.plosone6:e29289;其通过引用整体并入本文)。这允许使用体内成像系统(ivis)非侵入性分析小鼠的肝期发育和在相同动物中分析后续到红内期感染的转变。将来自两次单独转染的两种约氏疟原虫lisp2-克隆用于研究,并且除了肝期发育期间之外,都没有在寄生物生命周期的任何阶段显示缺陷(数据未示出)。为确定约氏疟原虫lisp2-是否在肝期发育期间停滞,将balb/cj小鼠组用1,000无标记物的、表达gfp-荧光素酶的1971cl1亲本寄生物(下文中称为野生型)或1,000lisp2-子孢子进行静脉内攻击,并测定达到红内期开放(bloodstagepatency)的时间。所有野生型-感染的小鼠在攻击后第三天达到红内期开放,而七只约氏疟原虫lisp2--感染的小鼠中的两只没有达到开放,并且其余小鼠显示显著延迟开放,在感染后5到7天达到开放(表1)。当用10,000lisp2-子孢子攻击小鼠时,所有小鼠在第4到6天达到红内期开放(表1),证明了约氏疟原虫lisp2-的不完全减毒。表1:balb/c小鼠中基因敲除约氏疟原虫红细胞前期(pre-erythrocyticstage)的减毒a从感染的斯氏按蚊分离唾液腺子孢子,并且用列出数量的子孢子对小鼠进行静脉内攻击。b显示了开放小鼠(patentmice)的数量和攻击小鼠的数量。通过giemsa染色薄血涂片(giemsa-stainedthinbloodsmear)进行红内期开放寄生物血症的检测。如果小鼠保持红内期阴性达21天,则认为减毒是完全的。c如果小鼠达到红内期开放,则在圆括号内表明小鼠的数量以及小鼠达到开放的日期。d无标记物的、表达gfp-荧光素酶的1971cl1寄生物在生命周期的所有方面均具有野生型表型(包括子孢子感染性),并且用于产生所有的基因敲除。约氏疟原虫lisp2-/plasmei2-gap表现出完全的肝晚期发育停滞接下来,我们通过在药物敏感性约氏疟原虫lisp2-寄生物中缺失plasmei2来产生约氏疟原虫lisp2-/plasmei2-基因缺失寄生物。对来自单独转染的两种约氏疟原虫lisp2-/plasmei2-寄生物克隆进行表型分析,对于单基因缺失寄生物,在无性红内期复制、有性期和蚊期(mosquitostage)发育以及蚊子唾液腺的子孢子感染期间没有明显的寄生物生命周期损坏(数据未示出)。我们随后比较了lisp2-/plasmei2-双基因缺失寄生物与lisp2-和plasmei2-单基因缺失寄生物以及野生型寄生物的肝期发育。用每个株系的50,000子孢子对swisswebster(sw)组小鼠进行静脉内攻击,并基于43小时时的荧光素酶活性测量肝期发育进展。基于荧光素酶表达的寄生物发育在单和双基因敲除寄生物株系和野生型寄生物中是不可区分的(图1a),表明所有三种gap均发育到肝晚期发育。为进一步评估肝期发育的表型,在肝期发育43小时时通过间接免疫荧光实验(ifa)使用识别pvm蛋白hep17和内质网蛋白bip的抗体将寄生物可视化(图1b)。肝期的gap发育到裂殖晚期,并且在hep17的表达形式方面显示与野生型相似(图1b)。然而,plasmei2-肝期显示了dna分离(segregation)表型和异常bip表达,并且在lisp2-/plasmei2-肝期中也观察到了该表型(图1b)。为量化基因敲除寄生物株系的肝期生长,在43小时时测定与野生型相比的肝期大小(图1c),在所分析的所有株系之间没有看到显著区别。因此,约氏疟原虫lisp2-/plasmei2-gap保持了单基因缺失寄生物的肝晚期停滞表型,并且表型上类似于plasmei2-单敲除。为确定lisp2-/plasmei2-gap是否存留在肝脏中,我们测量了在c57bl/6小鼠中子孢子接种之后lisp2-/plasmei2-gap随时间的肝期荧光素酶活性。作为对照,我们比较了lisp2-/plasmei2-gap与在表达gfp-荧光素酶的1971cl1亲本寄生物和野生型中产生的肝晚期停滞的gap。在子孢子接种后24小时和44小时时所有三种寄生物都显示相似的荧光素酶活性(图2a),此后没有测量野生型肝期活性,因为在约48小时时发生了肝期-至-红内期转变。在72小时时,lisp2-/plasmei2-gap和gap荧光素酶活性在背景水平下随着lisp2-/plasmei2gap活性降低而显著降低,但是gap荧光素酶活性仍显著高于背景。这表示gap比lisp2-/plasmei2-gap存留更久。在96小时时,两种gap均具有与背景相当的荧光素酶活性。为证实这一发现,在肝期发育44小时和60小时时,我们使用ifa来评估肝期发育。在44小时时,肝期lisp2-/plasmei2-gap和gap寄生物仍然存在,但在60小时时,仅检测到gap(数据未示出)。由于我们观察到在plasmei2-寄生物中的单基因敲除之间的突破感染的最低频率,我们接下来测定相当的高剂量lisp2-/plasmei2-gap是否会导致突破感染。因此,对于每个剂量的高敏感性balb/cbyj小鼠群,我们用200,000或500,000lisp2-/plasmei2-子孢子进行静脉内攻击。在这里,我们没有观察到任何到红内期感染的突破(对于200,000为0/29,对于500,000为0/26,表1)。这一发现表明,约氏疟原虫lisp2-/plasmei2-基因敲除组合构成合成致死表型,其中两个亚致死单基因缺失协同作用以导致完全渗透的致死表型。因此,lisp2-/plasmei2-gap在肝晚期是完全减毒的。约氏疟原虫lisp2-/plasmei2-gap针对红细胞前期和红细胞内期(erythrocyticstage)攻击提供保护为研究红细胞前期保护,将balb/cj小鼠组以2-3个月的间隔用10,000约氏疟原虫lisp2-/plasmei2-gap子孢子静脉内免疫两次,随后在加强后30天用10,000野生型子孢子静脉内攻击(表2)。保护的读数是在子孢子攻击后3天起到21天通过薄血涂片显微镜检测时不存在可检出的红内期寄生物血症。所有免疫的小鼠均被完全保护免受野生型子孢子攻击,并且在测试的小鼠亚组中,所有小鼠在首次攻击之后30天均被保护免受再次攻击(表2)。数据证明约氏疟原虫lisp2-/plasmei2-gap提供了完全的红细胞前期保护,从而预防了红内期寄生物血症发作。表2:约氏疟原虫gap保护免受子孢子攻击.a从感染的斯氏按蚊分离约氏疟原虫gap唾液腺子孢子,并且用所列出数量的子孢子对小鼠进行静脉内免疫。在圆括号中表明在初次免疫之后进行加强时的天数。b用所列出数量的野生型子孢子或用所列出数量的感染蚊子叮咬对小鼠进行静脉内攻击。在圆括号中表明在最后加强之后进行攻击时的天数。c表明了开放小鼠的数量和被攻击小鼠的数量。基于giemsa染色薄血涂片,如果小鼠在攻击后保持红内期阴性达21天,则认为保护是完全的。d用所列出数量的野生型子孢子攻击小鼠。在圆括号中表明在攻击后进行再次攻击时的天数。e用相当量的来自未感染蚊子的唾液腺提取物免疫对照小鼠。f进行再次攻击的对照小鼠为单独的群。我们接下来使用远交sw小鼠进行免疫,其与近交小鼠相比天生更难以通过全约氏疟原虫子孢子免疫进行保护。我们比较了lisp2-/plasmei2-gap与肝晚期-停滞的gap,小鼠中红细胞前期保护的现行金标准(currentgoldstandard)。将小鼠组用每种gap的50,000子孢子间隔1个月静脉内-免疫三次,随后在最后免疫之后30天通过用约氏疟原虫野生型-感染的蚊子叮咬1次来攻击。10只lisp2-/plasmei2--免疫小鼠中的9只得到保护,并且10只fabb/f-免疫小鼠全部得到保护(表2),表明两种gap均针对天然途径的子孢子攻击提供了保护。为进一步测试保护的持久性,我们在首次蚊咬攻击之后5个月再次攻击了一个亚组的免疫sw小鼠。通过用携带野生型约氏疟原虫子孢子的15只蚊子叮咬再次攻击小鼠,并且通过显微镜监测寄生物血症的发展21天。所有首次实验对照(5/5)在感染后第4天之前变为红内期阳性,而仅1/4约氏疟原虫lisp2-/plasmei2--免疫小鼠在第6天变为阳性,并且仅1/4-免疫小鼠在第7天为阳性(表2)。总体来看,这些数据证明了用肝晚期停滞的gap对远交sw小鼠进行免疫诱导了长期免疫应答,其提供了针对子孢子攻击的强有力的无菌保护。先前的工作已显示,用约氏疟原虫fabb/f-免疫的c57bl/6小鼠被保护免受直接的红内期攻击,而诸如用辐射的子孢子进行的肝早期停滞寄生物免疫不能针对红内期攻击进行保护。这表示肝晚期-停滞的寄生物表达与红内期共享的保护性抗原。由于约氏疟原虫lisp2-/plasmei2-也在肝期发育的晚期停滞,我们测试了用50,000约氏疟原虫lisp2-/plasmei2-子孢子或约氏疟原虫子孢子间隔一个月免疫的c57bl/6小鼠组是否能被保护免受10,000致死性约氏疟原虫ym红内期寄生物的静脉内攻击。首次实验小鼠不能控制红内期感染。相反,约氏疟原虫lisp2-/plasmei2-和约氏疟原虫免疫小鼠均被保护免受攻击,并且在清除红内期寄生物感染之前显示低的初始寄生物血症(图2b)。这一结果证明了约氏疟原虫lisp2-/plasmei2-子孢子免疫产生跨阶段的保护。约氏疟原虫lisp2-/plasmei2-gap免疫产生寄生物特异性抗体和t细胞应答gap免疫之后的红细胞前期保护的机理研究显示了抗体-介导的靶向子孢子的应答以及cd8t细胞-介导的靶向肝期寄生物的应答的重要性。大多数啮齿目动物疟疾研究在近交balb/c和c57bl/6小鼠中进行。远交小鼠较少被研究,但我们在这里显示了在约氏疟原虫lisp2-/plasmei2-gap免疫之后针对远交sw小鼠中蚊咬攻击的保护(表2)。由于知晓天然攻击途径可能允许保护性抗体阻断从叮咬位置到肝脏的子孢子行程,我们进一步研究了sw小鼠中的红细胞前期抗体应答。环子孢子蛋白(csp)是免疫显性的子孢子抗原,并且csp的抗体是保护性的。使用elisa读数,我们测定了如前免疫的5只sw小鼠组对全长约氏疟原虫csp的血清反应性(参见,例如,keitanygj,etal.2014.immunizationofmicewithlive-attenuatedlateliverstage-arrestingplasmodiumyoeliiparasitesgeneratesprotectiveantibodyresponsestopreerythrocyticstagesofmalaria.infectimmun82:5143-5153;其通过引用整体并入本文)(表2)。gap-免疫小鼠显示了高水平的csp反应性,而假免疫小鼠显示基线活性(图3a)。这证明了gap-免疫小鼠对csp产生了强有力的体液应答,表明在gap-免疫之后抗体在红细胞前期免疫应答中的重要性。血清还用于ifa以显示与子孢子表面结合的抗体(图3b),与cspelisa的结果一致。为确定血清是否还能识别肝期和红内期寄生物,在肝期发育24小时(图3c)、34小时(图3d)和44小时(图3e)时对来自感染小鼠的肝切片进行ifa。在肝期发育早期24小时时,血清反应性显示了类似于csp的肝期圆周模式定位。在肝期发育晚期,血清识别寄生物外围(表面和/或纳虫空泡)而且还识别内部结构,表明对肝晚期裂殖子也产生体液应答(图3d和3e)。在这些ifa中,使用bip的抗体来定位寄生物的内质网,并且一些与bip的共-定位是明显的。重要的是,免疫血清还识别无性红内期裂殖子(图3f),并且基于与裂殖子表面蛋白1(msp1)的稀疏共定位,识别模式主要是细胞内部的。因此,用肝晚期停滞的gap对远交sw小鼠进行免疫引起了识别多个寄生物阶段的有效体液应答。许多研究显示,用gap和ras免疫均引起了起重要作用的保护性cd8t细胞和cd8t细胞亚组,其包含cd8效应型记忆t细胞(tem)以及经由趋化因子受体cxcr6归巢于肝脏的cd8t细胞。为研究在约氏疟原虫lisp2-/plasmei2-gap免疫之后cd8t细胞募集到肝脏,通过7,000约氏疟原虫gfp-荧光素酶子孢子的静脉内注射对sw小鼠的亚组进行再次攻击,在攻击后42小时使用生物荧光成像分析其肝期负荷。相比于对照首次实验小鼠,免疫小鼠具有显著降低的肝期负荷,即89+/-6.9%(图4a),表明免疫应答在消除肝期寄生物中的功效。然后,在测量寄生物肝脏负荷后立即处死小鼠,灌注其肝脏以通过流式细胞术得到其肝脏-驻留的cd8t细胞的表型。与被攻击的首次实验对照相比,免疫小鼠肝脏包含显著更多的总淋巴细胞(图4b)。重要的是,免疫小鼠的肝脏具有增加的cd8tem(增加5.7-倍)(图4c),已知这对产生针对感染肝细胞的快速应答很重要。此外,我们还观察到肝脏中经历过抗原的cd44hicxcr6+cd8t细胞的数量增加(增加5.2-倍)(图4d),表明这些肝脏驻留cd8t细胞在对感染的肝细胞产生有效细胞应答中的显著性。这些数据证明,远交sw小鼠的lisp2-/plasmei2-gap免疫诱导了延长的、肝脏-驻留的记忆cd8t细胞应答,这很可能在提供强有力的无菌保护中是重要的。讨论减毒的红细胞前期恶性疟原虫疟疾寄生物产生保护人类受试者免受感染性子孢子攻击的免疫应答。其临床试验受到对于啮齿目动物疟原虫约氏疟原虫和伯氏疟原虫的减毒红细胞前期的广泛研究的启发并在此基础上建立。首先通过辐射子孢子实现减毒,但是近来通过精确基因缺失可实现基因减毒。尽管由于随机dna损伤,子孢子辐射导致肝期寄生物在广泛dna复制之前的不可控的早期停滞,但基因减毒具有设计潜力,并且取决于基因缺失,可在其发育期间的任何一点停滞肝期寄生物。虽然第一代gap通过控制早期阶段的肝细胞感染的基因座的基因缺失来构建,从而导致肝早期停滞,但啮齿目动物疟原虫中编码脂肪酸生物合成(fasii)的基因的缺失导致肝发育晚期停滞。这种不同的肝期生长停滞表型允许比较肝晚期-停滞的减毒啮齿目动物疟疾gap与肝早期停滞的啮齿目动物疟疾ras和gap的免疫原性和功效。这些研究显示,肝晚期停滞的gap不仅能在近交和远交小鼠中提供针对同源子孢子攻击的优异保护,而且还能保护小鼠免受异源啮齿目动物疟疾子孢子攻击和致死性红内期攻击。增强的保护可能是由保护性cd8t细胞应答和抗体应答的抗原靶标的多样性所介导的,证明免疫系统的两个臂在这种前所未有的保护中的重要性。这些发现为开发肝晚期停滞的恶性疟原虫gap作为优化的活-减毒疫苗提供了具有说服力的基本原理。不幸的是,恶性疟原虫中的fasii基因缺失阻止了子孢子形成,因此不能生产这样的疫苗。我们继续我们关于导致肝晚期停滞表型的基因缺失的研究,并且尝试组合将共同导致完全减毒gap的基因缺失。在这里,我们显示了通过缺失lisp2/plasmei2产生的新型约氏疟原虫gap,其是合成致死性的,并且将寄生物完全停滞于肝发育晚期。尽管单独缺失任一种基因不足以完全停滞肝期发育,导致突破红内期感染,两种基因的同时缺失导致完全的生长停滞和寄生物的死亡。通常在合成致死性中,单基因缺失对于表型没有显著影响,但情况并非总是如此。在我们的研究中,plasmei2缺失具有明显的表型,并且仅在一个敏感性balb/cbyj小鼠的小亚组中显示肝期-至-红内期突破,然而lisp2缺失则没那么有害,甚至相对少量的1000静脉内子孢子在敏感性较低的balb/cj小鼠中导致开放。将与强减毒表型相关的基因缺失与具有弱减毒表型的基因缺失组合将导致完全减毒看上去是违反直觉的。然而,在基因功能的双重丧失中观察到这种协同作用。然而,lisp2和plasmei2基因缺失–前者在肝期纳虫空泡中发挥作用(oritoy,etal.2013.molmicrobiol87:66-79;其通过引用整体并入本文),后者在rna稳态中发挥作用(dankwada,etal.2016.aplasmodiumyoeliimei2-likernabindingproteinisessentialforcompletionofliverstageschizogony.infectimmun84:1336-1345;其通过引用整体并入本文)–之间的导致对寄生物发育的如此严重和有害影响的精确相互作用仍有待确定。在疟原虫中,基因-基因相互作用的了解很少,特别是在肝期寄生物中。这一领域的研究可有助于发现进一步的基因-基因相互作用,其可能会干扰gap创建的目的。无论如何,其证实了使用crispr/cas9技术在疟原虫中的成功基因缺失(zhangc,etal.2014.efficienteditingofmalariaparasitegenomeusingthecrispr/cas9system.mbio5:e01414-01414;wagnerjc,etal.2014.efficientcrispr-cas9-mediatedgenomeeditinginplasmodiumfalciparum.natmethods11:915-918;andghorbalm,etal.2014.genomeeditinginthehumanmalariaparasiteplasmodiumfalciparumusingthecrispr-cas9system.natbiotechnol32:819-821;每一篇通过引用整体并入本文),因此,多基因座减毒的肝晚期停滞gap的产生是可实现的。我们发现,lisp2-/plasmei2-可完全保护免受子孢子攻击,并且还提供针对致死性红内期攻击的跨阶段保护。lisp2-/plasmei2-疫苗接种所产生的免疫应答的广度和持续时间对于保护的广度可能是重要的。lisp2-/plasmei2-gap免疫引发了识别子孢子表面和csp的抗体,已知这对于针对子孢子感染的体液保护是重要的。免疫血清还识别了肝期发育的24-、34-和44小时时的寄生物以及红内期寄生物。尽管不清楚肝期寄生物的抗体识别是否在保护中起作用,但是红内期寄生物的抗体识别是肝晚期停滞的gap所提供的跨阶段保护的重要组成部分,如同先前对于约氏疟原虫gap所显示的。实际上,约氏疟原虫lisp2-/plasmei2-与约氏疟原虫一样可针对致死性红内期攻击提供保护。这表明跨阶段保护的诱导是肝晚期停滞的gap的普遍特征,并且似乎不取决于导致减毒的特定基因敲除。减毒寄生物免疫接种所引起的无菌免疫力严重依赖于靶向肝期感染的肝细胞的cd8t细胞。近来,已显示出了cd8tem细胞之外,肝脏-驻留的cd8t细胞也在保护中起重要作用。我们观察到约氏疟原虫lisp2-/plasmei2-gap免疫导致已经历抗原的cd8tem细胞和肝脏-驻留的cd8t细胞的显著增加。这些cd8t细胞无疑在提供强有力的无菌保护方面具有重要作用,尤其是针对静脉内子孢子攻击。这种攻击模式很大程度上绕过了体液保护,所述体液保护在蚊咬感染后防止子孢子离开皮肤方面起重要作用。与肝早期停滞的寄生物相比,在肝晚期停滞gap中观察到的保护性免疫应答的提高的幅度和广度提供了优势。具有临床意义的是,实现保护所需的子孢子的免疫剂量较少。因此,可减少每次免疫的子孢子量和/或可减少免疫总次数而不会导致丧失针对感染的无菌保护。此外,免疫应答赋予了针对异源攻击的保护,并且甚至可显示跨物种保护,正如用肝晚期停滞的约氏疟原虫gap免疫时所证明的,其针对伯氏疟原虫攻击提供保护。最后,约氏疟原虫lisp2-/plasmei2-免疫保护免受致死性异源红内期攻击的证明提出了如下希望:即使针对红细胞前期感染的无菌保护减少,跨阶段保护也能阻止爆发性红内期复制,因此减轻疟疾疾病。最终,肝晚期-停滞的恶性疟原虫lisp2-/plasmei2-有待生成,并且两种基因在疟原虫之间显示高度保守,因此可以寻求这种有希望的gap用于人免疫接种。材料和方法实验动物来自harlan(indianapolis,in)的六至八周龄雌性sw小鼠用于寄生物生命周期维持和转基因寄生物的产生。来自harlan的六至八周龄雌性balb/cann小鼠用于评估间接免疫荧光测定(ifa)。来自jackson实验室(barharbor,me)的六至八周龄雌性c57bl/6、balb/cj和balb/cbyj小鼠用于评估寄生物的减毒和用作实验疫苗的能力。为产生子孢子,将约氏疟原虫亲本和转基因寄生物在sw小鼠和斯氏按蚊之间循环。将感染的蚊子保持在24℃和70%湿度的糖水上。本研究严格按照美国国立卫生研究院实验动物护理和使用指南中的建议进行。传染病研究中心有olaw动物福利保证(animalwelfareassurance)(a3640-01)。该协议得到了传染病研究机构动物护理和使用委员会中心(thecenterforinfectiousdiseaseresearchinstitutionalanimalcareandusecommittee)的批准。约氏疟原虫(p.yoelii)lisp2-、lisp2-/plasmei2-和fabb/f-的产生用于产生和分析寄生物的寡核苷酸引物在表3中详述。基于先前报道的crispr/cas9策略使用质粒pyc实现约氏疟原虫lisp2的缺失(zhangc,etal.2014.mbio5:e01414-01414,其通过引用整体并入本文)。简言之,在包含靶向关注基因的指导rna的cas9所介导的双链dna断裂后,使用双交换同源重组来缺失lisp2。将开放阅读框的上游和下游的互补区连接到质粒pyc中,20个核苷酸的指导rna序列也是如此(zhangc,etal.2014.mbio5:e01414-01414,其通过引用整体并入本文),导致质粒pyc_lisp2的产生。5'-侧翼和3'-侧翼互补区的序列在本文中分别如seqidno:6和7所示,指导序列在本文中如seqidno:8所示。将pyc质粒转染到约氏疟原虫系1971cl1的红内期裂殖体(schizonts)中(linjw,etal.2011.plosone6:e29289;其通过引用整体并入本文),一种表现为野生型的无标记寄生物并且在延长因子1α启动子的控制下在整个生命周期中表达绿色荧光蛋白(gfp)-荧光素酶融合物。这导致了约氏疟原虫lisp2-的产生。来自两次单独转染的两个独立的敲除克隆最初在整个生命周期中进行表型分析。为产生约氏疟原虫(p.yoelii)lisp2-/plasmei2-,将原本用于产生约氏疟原虫plasmei2-的质粒pl0034_plasmei2(dankwada,etal.2016.infectimmun84:1336-1345;通过引用整体并入本文)转染到无标记约氏疟原虫lisp2-寄生物中,分离来自单独转染的两个克隆用于进一步分析。在pl0034_plasmei2质粒中,5'-侧翼和3'-侧翼互补区的序列在本文中分别如seqidno:2和3所示,指导序列在本文中如seqidno:4所示。为实现fabb/f的缺失,使用用于产生约氏疟原虫plasmei2-的gimo技术,并将pl0034_fabb/f质粒转染到表达荧光素酶的约氏疟原虫品系1971cl1的红内期裂殖体中(linjw,etal.2011.plosone6:e29289;其通过引用整体并入本文)。表3:用于产生和分析寄生物的寡核苷酸引物序列**用于创建和分析plasmei2-敲除的寡核苷酸引物先前在dankwada,etal.2016.aplasmodiumyoeliimei2-likernabindingproteinisessentialforcompletionofliverstageschizogony.infectimmun84:1336-1345中公布;其通过引用整体并入本文。在转染全部寄生物并静脉注射到sw小鼠中之后,使用标准技术将乙胺嘧啶用于阳性选择和下游克隆重组寄生物(jansecj,etal.2006.high-efficiencytransfectionanddrugselectionofgeneticallytransformedbloodstagesoftherodentmalariaparasiteplasmodiumberghei.natprotoc1:346-356;通过引用整体并入本文)。使用我们已在多个场景上使用的方法通过pcr确定转基因[最近的例子参见lindnerse,etal.2014.enzymesinvolvedinplastid-targetedphosphatidicacidsynthesisareessentialforplasmodiumyoeliiliver-stagedevelopment.molmicrobiol91:679-693;通过引用整体并入本文]。免疫荧光分析肝期.向balb/cann小鼠静脉内注射约3×105子孢子,并在感染后的几个时间点从安乐死的小鼠收获肝脏。用1×pbs灌注肝脏,在1×pbs中的4%v/v多聚甲醛(pfa)中固定,并使用vibratome装置(tedpella,redding,ca)将肝叶切割成50μm切片。对于ifa,将切片在含有3%v/vh2o2和0.25%v/vtritonx-100的1×tbs中于室温透化30分钟。然后将切片在含有5%w/v干乳(tbs-m)的1×tbs中封闭至少1小时,并与一抗一起在tbs-m于4℃下温育过夜。在1×tbs中清洗后,以与上述相似的方式于室温将荧光二抗加入到tbs-m中2小时。进一步清洗后,将切片在0.06%w/vkmno4中温育2分钟以淬灭背景荧光。然后用1×tbs清洗切片,并于室温用1×tbs中的1μg/ml4,6-二脒基-2-苯基吲哚(dapi)染色5-10分钟以观察dna,并用fluoroguard抗褪色试剂固定(bio-rad,hercules,ca)。子孢子.从感染蚊子中提取唾液腺子孢子,在1×pbs中清洗一次,并在1×pbs中的4%v/v多聚甲醛(pfa)中固定,并使其在12孔显微镜载玻片上干燥。将子孢子透化并用1%pbs中的3%bsa和0.25%tritonx-100封闭,在1×pbs中清洗三次,并用来自五只模拟免疫小鼠和五只gap免疫小鼠的1:200稀释的混合血清温育。一小时后,用1×pbs将子孢子清洗三次,并于室温以与上述类似的方式将荧光二抗添加到1×pbs中1小时。子孢子在1×pbs中用4μg/mldapi染色以显现dna,用1×pbs清洗一次并用fluoroguard抗褪色试剂固定(bio-rad,hercules,ca)。红内期.使用先前描述的方法处理感染的红细胞以用于ifa(tonkincj,etal.2004.localizationoforganellarproteinsinplasmodiumfalciparumusinganovelsetoftransfectionvectorsandanewimmunofluorescencefixationmethod.molbiochemparasitol137:13-21;通过引用整体并入本文)。最初(并且在所有步骤之间)将红细胞于室温在微量离心机中以2000g颗粒化1分钟。将细胞在1×pbs中清洗两次,于室温在1×pbs+4%v/vpfa+0.0075%v/v戊二醛中固定30分钟,并在1×pbs+0.2%v/vtritonx-100中于室温透化10分钟。将1×pbs+3%w/v牛血清白蛋白(bsa)(封闭溶液)在4℃应用过夜。将一抗在封闭溶液中稀释,并于室温以上下颠倒旋转温育1小时。用1×pbs清洗两次后,将荧光二抗在封闭溶液中稀释,并与细胞一起温育30分钟,于室温进行上下颠倒旋转并避光。然后于室温用1×pbs中的dapi将核酸染色5-10分钟。用1×pbs清洗细胞三次,并用fluoroguard抗褪色试剂固定(bio-rad,hercules,ca)。使用荧光倒置显微镜(eclipsete2000-e;nikon)分析所有制剂,并使用olympus1×70deltavision反卷积显微镜获取图像。约氏疟原虫肝期的表型分析在ifa之后,通过测量寄生物在最大周长处的面积来测量肝期大小。还用体内成像系统(ivis)来测量肝期发育,因为在本研究中使用的寄生物表达荧光素酶并因此是生物发光的。使用如前所述的ivisluminaii动物成像仪(caliperlifesciences,usa)通过全身成像使动物中的荧光素酶活性可视化(franke-fayardb,etal.2006.real-timeinvivoimagingoftransgenicbioluminescentbloodstagesofrodentmalariaparasitesinmice.natprotoc1:476-485;mwakingwea,etal.2009.noninvasivereal-timemonitoringofliver-stagedevelopmentofbioluminescentplasmodiumparasites.jinfectdis200:1470-1478;andploemenih,etal.2009.visualisationandquantitativeanalysisoftherodentmalarialiverstagebyrealtimeimaging.plosone4:e7881;各自通过引用整体并入本文)。在使用异氟烷麻醉系统(xgi-8,caliperlifesciences,usa)麻醉之前,向小鼠腹膜内注射100μlredijectd-荧光素(perkinelmer)。在注射d-荧光素后5至10分钟内进行测量。以10cm视场(fov)、中等像素组合因子(mediumbinningfactor)和1至5分钟的曝光时间获得生物发光成像。通过使用软件的关注区域(roi)设置测量发光信号强度来进行生物发光的定量分析。将roi置于整个动物周围,并将roi测量值表示为总通量(光子/秒)。子孢子接种和攻击在感染性血餐后14至18天,从感染的斯氏按蚊的唾液腺中分离出子孢子,并静脉注射到受体小鼠的尾静脉中。为评估减毒,将子孢子注射到高敏感性balb/cbyj小鼠中(kaushanskya,etal.2015.susceptibilitytoplasmodiumyoeliipreerythrocyticinfectioninbalb/csubstrainsisdeterminedatthepointofhepatocyteinvasion.infectimmun83:39-47;其通过引用整体并入本文)。通过giemsa染色薄血涂片评估肝期到红内期的转变(红内期开放),在接种后第3天开始并在第21天结束,此时阴性涂片归因于完全减毒。对于免疫,用约氏疟原虫子孢子初次接种和加强c57bl/6、balb/cj和sw小鼠,随后用约氏疟原虫xnl子孢子或约氏疟原虫xnl感染的蚊子叮咬来进行静脉内攻击。通过giemsa染色薄血涂片评估到红内期开放的突破,在攻击后第3天开始并在第21天结束,此时,阴性涂片归因于完全保护。仅用蚊子唾液腺提取物免疫的小鼠用作对照。红内期攻击将约氏疟原虫ym感染的血液的冷冻储血(frozenbloodstocks)腹膜内注射到c57bl/6小鼠中并使其发育2-4天,直至通过giemsa染色的薄涂片测定的寄生物血症达到最大1%。通过心脏穿刺将这些小鼠最终放血,并将血液于pbs中稀释至含有10,000个感染的红细胞/200μl。然后将感染红细胞以200μl/小鼠的体积静脉内注射到免疫的受体小鼠中。在感染后第3天开始通过giemsa染色的薄涂片监测寄生物血症。当寄生物血症达到60%或变得垂死时,对小鼠实施安乐死。elisa如前所述进行抗-约氏疟原虫cspelisa(sackbk,etal.2015.mechanismsofstage-transcendingprotectionfollowingimmunizationofmicewithlateliverstage-arrestinggeneticallyattenuatedmalariaparasites.plospathog11:e1004855;其通过引用整体并入本文)。简言之,用1μg/ml全长约氏疟原虫csp包被高结合的96孔板。于室温封闭1小时后,将来自免疫小鼠和首次实验小鼠的血清样品以指定的稀释度于室温添加2小时。清洗后,然后于室温以1:5000稀释度加入hrp缀合的抗小鼠igg二抗1小时。使用sigmafastopd将板显影12分钟并且在450nm的波长下读取光密度。肝脏淋巴细胞分析为分析肝脏淋巴细胞,如前所述分离肝脏非实质细胞(millerjl,etal.2014.interferon-mediatedinnateimmuneresponsesagainstmalariaparasiteliverstages.cellrep7:436-447;其通过引用整体并入本文)。简言之,用氯胺酮/甲苯噻嗪麻醉小鼠,随后用如下材料灌注肝脏:含有5mmhepes和0.5mmedta的7.5mlhbss,随后是在含有5mmhepes的hbss中的7.5ml的0.5mg/ml胶原酶。随后通过使用40%碘克沙醇的梯度分离从肝匀浆中分离非实质细胞。随后对每个肝脏的总淋巴细胞进行计数,并且将在50μlpbs/1%fbs中的高达8x106肝脏淋巴细胞用如下的抗-小鼠抗体在冰上染色1小时:cd8alexafluor488;cd44percp-cy5.5;cd127brilliantviolet421;cd62lbrilliantviolet605;b220brilliantviolet785;cd3apc;cd4apc-cy7;cxcr6pe;klrg1pe-cy7。随后清洗细胞,并在bdlsrii上使用flowjo分析软件运行。通过基于fsc/ssc将关注细胞类型表示为淋巴细胞百分比并将该数字乘以从每个肝脏计数的淋巴细胞数量来计算细胞总数。以下描述了利用crispr/cas9系统以类似于约氏疟原虫减毒的方式对人类疟疾寄生物恶性疟原虫进行基因减毒的示例性方法,如上所述的。该质粒可用于在人寄生物中产生直系同源lisp2和plasmei2基因的双重敲除以证明完全的肝晚期减毒,以及产生适合临床前研究及人类施用的免疫调节组合物。如上文更详细描述的,单独的约氏疟原虫lisp2-和约氏疟原虫plasmei2-gap在balb/cbyj小鼠中不是完全减毒的,证明了仅敲除lisp2和plasmei2都不会导致完全减毒的晚期停滞gap。简言之,开发了双敲除的约氏疟原虫plasmei2-/lisp2-gap,并且令人惊讶地被证明为在肝晚期是完全停滞的。为此,以最近应用于约氏疟原虫的方式采用crispr/cas9技术作为有效的基因敲除策略(zhang,c.,etal.,efficienteditingofmalariaparasitegenomeusingthecrispr/cas9system.mbio5(4):e01414-01414(2014),其全部内容通过引用并入本文)。该策略的优点在于药物选择标记未加入到转基因寄生物的基因组中,允许连续的基因组操纵。用于操纵的单个质粒pyc(用于约氏疟原虫crispr/cas9编辑的质粒)携带所有必需的操作序列,并具有用于下述目的的克隆位点:(i)用于插入驱动基因组中特定双链断裂的特异性指导rna,和(ii)用于在切割位点处插入重组所必需的dna序列(图5a和5b)。使用pyc质粒平台敲除plasmei2,然后敲除lisp2。如上所述,即使在敏感性balb/cbyj小鼠中,约氏疟原虫plasmei2-/lisp2-双敲除gap也是完全减毒的,这是一种有希望的结果,证明了用这种缺失组合产生寄生物的固有能力。为了确保约氏疟原虫plasmei2-/lisp2-在发育过程中仍为晚期停滞的,在发育43小时(接近肝期发育结束的时间点,所述肝期发育在约52小时达到峰值)时对肝期进行分析,并且通过生物发光(图1a)和通过测量(图1b)显示,与此时间点的单敲除和野生型寄生物相比,双敲除肝期在晚期停滞并且具有相似的大小。这表明双敲除仍然在发育晚期停滞。此外,不仅用约氏疟原虫plasmei2-/lisp2-免疫小鼠提供了对子孢子攻击的完全保护,它还保护小鼠免受红内期攻击(图2b),类似于约氏疟原虫gap(butler,n.s.,etal.,superiorantimalarialimmunityaftervaccinationwithlateliverstage-arrestinggeneticallyattenuatedparasites.cellhostmicrobe9(6):451-462(2011)),证明约氏疟原虫plasmei2-/lisp2-gap与约氏疟原虫gap一样有效。恶性疟原虫gap的产生通常依赖于阳性/阴性选择机制来实现基因敲除(crabb,b.s.,etal.,transfectionofthehumanmalariaparasiteplasmodiumfalciparum.methodsmolbiol270:263-276)(2004),这个过程在克隆寄生物准备好进行表型评估之前可能花费好几个月。这在一定程度上阻碍了恶性疟原虫基因敲除的产生。然而,crispr/cas9基因组编辑技术也适用于通过两个独立的组进行恶性疟原虫基因组编辑(ghorbal,m.,etal.,genomeeditinginthehumanmalariaparasiteplasmodiumfalciparumusingthecrispr-cas9system.natbiotechnol32(8):819-821(2014);wagner,j.c.,etal.,efficientcrisprcas9-mediatedgenomeeditinginplasmodiumfalciparum.natmethods11(9):915-918(2014))。设计用于恶性疟原虫的两种系统都导致实现用于表型测试的克隆寄生物所花费的时间显著减少,但两者都依赖于两种独立质粒的转染和双重药物选择。由于转染效率非常低,这可能阻碍重组寄生物的产生。为克服该障碍,操纵上述pyc质粒以产生pfc质粒(用于恶性疟原虫crispr/cas9编辑的质粒)(图5a和5b)。为此,系统地去除啮齿动物疟疾调节序列并用恶性疟原虫序列代替。具体地,对于pfc_lisp2,5'-侧翼和3'-侧翼互补区的序列在本文中分别如seqidno:14和15所示,并且指导序列在本文中如seqidno:16所示。对于pfc_plasmei2,5'-侧翼和3'-侧翼互补区的序列在本文中分别如seqidno:10和11所示,指导序列在本文中如seqidno:12所示。当然,应当理解,基于对野生型恶性疟原虫序列(分别为seqidno:9和13)的知识,可以使用不同或至少变异的侧翼和指导序列来功能性地缺失或敲除plasmei2和lisp2基因。此外,创建了pfc的替代版本,其中药物选择标记/cas9表达由ef1α启动子或hsp70启动子驱动,药物选择标记是hdhfr的突变形式,其对wr99210或bsd具有抗性,其对杀稻瘟素具有抗性(图5b)。作为对照,测试了含有ef1α/hdhfr的pfc在产生abcc2的基因敲除中的用途,其最近显示在恶性疟原虫中具有减毒的肝期表型(rijpma,s.r.,etal.,multidrugabctransportersareessentialforhepaticdevelopmentofplasmodiumsporozoites.cellmicrobiol(2015)。在质粒转染后,在选择的一个月内回收抗药寄生物,并且亲本种群的初次克隆导致回收6种克隆,基于pcr分析,这些克隆都是敲除的(图6a,6c)。这证明了单质粒平台(即,pfc)成功应用于恶性疟原虫基因组内靶标的有效crispr/cas9编辑。pfc平台可用于指导crispr/cas9编辑方法以缺失约氏疟原虫plasmei2基因(恶性疟原虫基因的示例性序列在本文中如seqidno:9所示)和lisp2基因(该基因的示例性序列在本文中如seqidno:13所示)的恶性疟原虫直系同源物以产生恶性疟原虫plasmei2-/lisp2-gap。如上所述,缺失是由含有靶向plasmei2和lisp2基因的指导rna的cas9介导的双链dna断裂后的双交换同源重组产生的。该方法使用如上所述的质粒,例如pfc_lisp2和pfc_plasmei2,根据如在gorbal,m.,etal.,genomeeditinginthehumanmalariaparasiteplasmodiumfalciparumusingthecrisper-ca9system.nat.biotech.32(8):819821(2014)(其全部内容通过引用并入本文)中更详细描述的一般方法,以分别靶向每个基因。简言之,恶性疟原虫无性红内期寄生物在适当培养基中的人红细胞中培养。可任选地通过山梨糖醇处理和/或nycodenz富集来促进同步培养。如先前建立的,可通过将环状体阶段寄生物或裂殖体阶段进行电穿孔来转染寄生物。选择转染的克隆并使用pcr验证敲除。一旦验证了单敲除,则根据相同的方案对第二个目标重复该过程以实现双敲除。已经验证的恶性疟原虫lisp2-/plasmei2-克隆被选择用于继续生命周期。在体外培养所选克隆的配子体细胞,然后在斯氏按蚊体内产生唾液腺子孢子。发育生命周期状态是敲除对表型影响的观察。对于初始哺乳动物期的具体评估,可将恶性疟原虫lisp2-/plasmei2-子孢子施用给人肝脏-嵌合小鼠模型,其支持人恶性疟原虫的强有力发育和传播至感染的红内期。该模型允许对gap减毒的可靠的临床前测试。参见vaughan,a.m.,etal.,completeplasmodiumfalciparumliver-stagedevelopmentinliver-chimericmice.jclininvest122:3618-3628(2012),其通过引用整体并入本文。考虑到在约氏疟原虫lisp2-/plasmei2-寄生物中观察到完整的晚期减毒和优异的免疫原性,预期恶性疟原虫lisp2-/plasmei2-株系在两种动物模型和人类受试者中也分别显示出相似的完全晚期减毒和免疫原性特性。如上所述,可产生被证实在肝期发育晚期具有完全减毒的gap。通过生命周期发育进入肝晚期允许抗原表达的进展,在减毒之前提供来自红细胞前期(即子孢子和肝期)的丰富的多种野生型抗原。肝晚期减毒的明显优势还在于转基因寄生物也开始表现出随后红内期的特征性抗原,即使完全中止向这些阶段的完全转变也是如此。这提供了跨发育阶段的额外保护,并提供额外的免疫刺激层和针对现有和随后的野生型感染的保护。总体而言,更多数量和更大广度的抗原暴露导致更强和更有力的免疫应答,所述免疫应答能够保护免受子孢子和红内期的攻击。预计恶性疟原虫gap可作为安全有效的免疫原,在人类宿主中引发保护性免疫,以防止未来的感染和疟疾症状。以下描述了上述crispr/cas9策略的示例性实施方式,以实现人疟疾寄生物恶性疟原虫中plasmei2基因的完全敲除。如上所述产生编码用于从恶性疟原虫敲除plasmei2基因的必需序列的质粒(参见关于pfc_plasmei2和图5b的讨论)。转染寄生物,并在一个月温育后针对诱导的抗药性进行选择。使用图7a中示意性说明的标记物的各种组合,通过pcr评估所选寄生物的plasmei2基因座的存在。如图7b和7c所示,野生型对照显示内源plasmei2基因座的扩增,而使用相同的引物对,pfc_plasmei2转染的寄生物未显示完整基因座的扩增。左侧两个泳道证明,与退火到plasmei2基因座本身的引物的反应不会导致扩增,而右侧泳道证明使用退火至侧翼位点的引物的反应仅具有截短的扩增。为评估plasmei2-敲除的恶性疟原虫的发育,将子孢子接种到frghuhep小鼠中,然后输注人红细胞。参见图8。frghuhep是人-肝脏嵌合模型,其允许人疟疾(例如恶性疟原虫)在肝期发育。后来输注人红细胞支持体内从肝脏感染到红内期感染的寄生物转变,并且不需要灵长类宿主完成恶性疟原虫的生命周期。在足以允许发育到晚期裂体生殖(schizogony)的时间(约6天)之后获得肝细胞,并且对环子孢子蛋白(csp)进行染色。还将内质网和dna染色用于对照。从图9中可以看出,plasmei2-恶性疟原虫中的csp染色缺乏csp的确定组织,其是野生型肝期寄生物中健康裂体生殖的特征。这包括细胞外膜形成(cytomereformation)的开始(寄生物质膜的多次内陷),其发生在肝期发育结束时释放的红细胞外裂殖子形成之前。在图9中,基于csp染色,在野生型肝期寄生物中细胞外膜形成是明显的,但在plasmei2-肝期寄生物中没有细胞外膜形成。为测试由恶性疟原虫plasmei2-导致的肝期至红内期转变的潜力或程度,从感染的frghuhep/hurbc小鼠中提取血细胞,并在体外和体内测定中评估红内期寄生物的存在。如表4中所示,无论是qpcr还是培养物分析均未在感染恶性疟原虫plasmei2-子孢子的frghuhep/hurbc小鼠中检测到任何红内期寄生物。相反,这些测定方法中的每一种都能够在感染野生型恶性疟原虫子孢子的frghuhep/hurbc小鼠中检测到红内期寄生物。表4:检测通过蚊咬接种用恶性疟原虫plasmei2-感染的frghuhep/hurbc小鼠中肝期至红内期的转变。分别使用qrtpcr和培养物分析进行体外和体内实验。小鼠接种qrtpcr结果体外培养结果野生型#1检出检出野生型#2检出检出野生型#3检出检出plasmei2-#1未检出未检出plasmei2-#2未检出未检出plasmei2-#3未检出未检出这些数据表明,用于基因敲除的crispr/cas9方法可在人类疟疾寄生虫恶性疟原虫中实施以实现表现出完全的肝晚期发育停滞的活的基因减毒的恶性疟原虫。因此,该方法可以具体实施例如以实现基因减毒恶性疟原虫,所述基因减毒恶性疟原虫是plasmei2-和/或lisp2-的以用于保护性和/或改善性疫苗组合物的目的。以下是增强抗疟疾组合物(例如gap和相关制剂)以提供针对红内期寄生物的额外保护,从而进一步降低临床症状或感染传播风险的示例性方法的描述。介绍考虑到呈递红内期抗原所赋予的额外益处,可通过添加或增强红内期和/或配子期抗原来进一步增强任何现有的基于gap的免疫原性组合物。通过gap的红内期抗原的额外转基因表达将改善对无性和有性红内期的免疫,并且,针对有性红内期,能添加阻断传播的免疫元件。尽管以下描述提供了进一步修饰上述lisp2-/plasmei2-疟原虫寄生物("晚期gap")以产生额外的红内期或配子体抗原的示例性方法,应当理解,这样的修饰可应用于其它基于疟原虫的免疫原组合物,所述组合物也将受益于额外的红内期抗原表达。这种其它组合物可包括如上文中更详细描述的其它已知的基于全疟原虫(包括gap)的组合物(例如,为p52-、p36-和/或sap1-的疟原虫,它们都是"早期gap"的实例)和/或,例如在美国公开第20110033502、20080032388、20060121060、20070009556、20050233435号中所述的那些,每一篇通过引用整体并入本文。该计划的目标是产生还表达红内期(bs)和/或配子体(gam)抗原的gpa,例如,约氏疟原虫(gap(py)bs/gam)和/或恶性疟原虫(gap(pf)bs/gam)。gap(py)bs/gam简言之,如上所述地将包含约氏疟原虫(p.yoelii)裂殖体逸出抗原-1(pysea-1)作为红内期抗原和/或pys25作为配子体抗原和/或pys48/45作为配子体抗原的表达盒引入gap中。约氏疟原虫sea-1是恶性疟原虫sea-1(pysea-1)的同源物,其对来自感染的rbc的寄生物流出是必要的。针对约氏疟原虫sea-1的抗体减少了体外寄生物复制,并且用重组伯氏疟原虫sea-1(“pysea-1”与pysea-1具有47%相似性和34%氨基酸同一性)对小鼠进行疫苗接种显著减少了伯氏疟原虫感染的动物中的寄生物血症。配子体抗原pys25和pys48/45(pfs25和pfs48/45的直系同源物)是主要的传播阻断疫苗候选物。为产生转基因表达红内期和/或配子体抗原的gap疟原虫,采用基于敲入crispr/cas9的策略,所述策略使用双交换同源重组。用于敲入的质粒包含用于红内期抗原约氏疟原虫sea-1、配子体抗原pys25和/或pys48/45的表达盒以及用于简易检测由转基因寄生虫表达的重组蛋白的c-末端表位标签。环子孢子蛋白(csp)信号序列或pexel基序指导寄生物胞质溶胶之外的抗原表达。重组蛋白表达将由子孢子或肝期启动子驱动,例如,sap1启动子。如下所述地,可容易地将替代启动子插入到敲入质粒中以驱动差异性重组蛋白表达。如所指出的,在一种策略中,表位标记的嵌合蛋白(或者单独地每种蛋白)置于子孢子或肝期启动子和3'utr的控制下。例如,sap1启动子将允许转基因的子孢子/肝早期特异性基因表达。或者,可以使用更强的子孢子和肝早期特异性启动子(例如csp启动子)或组成型活性启动子(例如ef1α启动子)来确保转基因的最佳表达。在整个肝发育期表达的其他示例性组成型启动子或启动子包括uis4和fabb/f启动子。还可以去除天然信号序列和跨膜序列并改善重组表达。这被认为允许重组蛋白的正确折叠并且在肝期驻留期间在子孢子表面之外或pv/pvm界面处表达。作为备选,csppexel基序可以另外附加到蛋白质抗原的n-末端,因为该方法已经用于证明肝期发育期间的蛋白质输出。可用固定的子孢子的免疫荧光测定(ifa)和子孢子裂解物的western印迹来验证转基因表达,使用表位标签的抗体(ab)或针对重组蛋白产生的ab。为得到结合至pysea-1和pys25/pys48/45的抗体,将在hek293哺乳动物细胞表达平台中表达蛋白质。使用ajuplex佐剂用蛋白质抗原免疫小鼠以产生更高滴度的抗原-特异性多克隆ab作为阳性抗-bs/gam抗体的来源。抗体滴度可以通过标准elisa确认,其中来自用无关hivenv蛋白免疫的小鼠的血清作为阴性对照。为证实gap(py)bs/gam引发转基因产品-特异性抗体,将使用1x105gap(py)bs/gam子孢子免疫balb/cj小鼠(总共三次免疫,间隔两个月)。用相应的gap进行免疫可用作阴性对照。在最后免疫之后一个月,收集小鼠血清。随后使用纯化的抗体进行a)针对pysea-1和/或pys25/pys48/45重组蛋白、gap(py)bs/gam子孢子和作为阳性对照的混合红内期裂解物以及作为阴性对照的gap子孢子裂解物的western印迹和elisa分析,和b)红内期(对于pysea-1)和配子体(对于pys25/pys48/45)的ifa分析。gap产生的抗体可用作阴性对照。可将所有gap(py)bs/gam–引发的应答与通过用各种重组蛋白免疫所引起的应答进行比较。可如下文所详细描述地进一步评价gap(py)bs/gam对红内期和配子体的功能保护性免疫增强的详细检验。gap(pf)bs/gam还可产生gap以传基因表达恶性疟原虫的红内期和配子体抗原,类似于上文所述方法,包括指定的启动子。恶性疟原虫rh5最近已成为红内期疫苗接种的优选候选物,并且是恶性疟原虫裂殖子中存在的pfrh侵入配体的成员。pfrh5位于棒状体内,并且在rbc侵入之前分泌到裂殖子表面。pfrh5与pfripr(pfrh5-相互作用蛋白)相互作用,并且研究已揭示了二者均都通过与gpi锚定的富含半胱氨酸的保护性抗原(cyrpa)的相互作用而与裂殖子表面连接。pfrh5–pfripr–cyrpa复合物能使pfrh5结合其rbc表面受体基础免疫球蛋白(basigin)。已显示pfrh5ab滴度与对症状性疟疾的保护强烈相关,并且最近在非人灵长类动物中的rh5疫苗实验显示了针对红内期感染的显著保护。为此研究的目的,如果gap来自不同的疟原虫物种,可对pfrh5进行密码子优化表达。对于配子体,可使用pfs25或pfs48/45。可通过western和ifa分析来评价gap(pf)bs/gam的转基因蛋白表达(如上文中针对gap(py)bs/gam所述的)。可通过elisa使用重组蛋白来证实gap(pf)bs/gam在免疫之后诱导对恶性疟原虫抗原的抗体应答的能力(如上文中针对gap(py)bs/gam所述的),功能性分析在下文中更详细描述。红内期和/或配子体抗原转基因表达的评价如上所述,肝晚期减毒的gap产生针对由cd4/cd8t-细胞和抗体应答介导的红内期攻击的跨阶段保护,所述抗体应答针对也存在于红内期的肝晚期抗原。可评估工程化以重组表达额外的红内期或配子体抗原的任何gap的表达以及其是否导致改善的红内期免疫应答和传播阻断(例如,多阶段保护性免疫)。为确定gapbs/gam提供增强的跨阶段保护的能力,可进行一系列剂量递减的静脉内-免疫以深入了解新型gapbs/gam的保护能力。可通过减少免疫剂量和静脉内免疫次数来测定gapbs/gam(以及作为对照的没有抗原敲入表达的gap)提供完全、部分和不完全保护的剂量。对于每个剂量,可进行功效研究以确定针对红内期的保护以及抑制传播到蚊子的能力,如下所详述的。在下文中描述说明性方法:子孢子:对于子孢子静脉内攻击,表达gfp-荧光素酶的疟原虫寄生物将被用于允许使用生物发光成像体内评估肝期负荷随后通过血涂片跟踪开放性。这允许在不同gap之间比较它们的提供保护免受感染性子孢子攻击的能力。红内期:为确定针对红内期的保护,可通过静脉注射10,000致死疟原虫感染的rbc(irbc)攻击小鼠。监控寄生物血症以得到免疫对峰值寄生物血症以及清除/存活的时间的作用。作为比较,应注意用晚期停滞的约氏疟原虫fabb/f-gap进行的免疫引发了免疫应答,所述免疫应答既限制了峰值寄生物血症又比假免疫的小鼠更早地清除了寄生物,但是早期停滞的p52-/p36-/sap1-gap则不能提供类似的保护。有性传播阶段:通过腹膜内注射疟原虫gfp-luc接种首次实验balb/cj小鼠并在明显出现强健的雄性配子体外显(exflagellation)时允许配子体血症达到约1%来评价gapbs/gam的阻断传播的活性。此时,在静脉内注射(被动传递)用gapbs/gam子孢子免疫的小鼠的血清后1小时,允许~100只饥饿的斯氏按蚊从所述感染的小鼠获得血餐。对照小鼠将接受用相应的gap子孢子免疫的血清。一组小鼠还将接受来自用如上所述的佐剂中的pys25蛋白免疫的小鼠的血清。将完全吸血的蚊子保持10天,随后通过测量荧光素酶活性来评估卵囊发育,其之前已显示对于确定卵囊负荷是准确的。如果抗体与配子体结合并阻止传播,荧光素酶活性将显著降低。此外,以其在免疫后产生能够阻断寄生物红内期生长和传播的抗体的能力来评估gap(pf)bs/gam的功能。考虑到恶性疟原虫红内期寄生物不能感染啮齿目动物rbc,使用良好建立的和标准化的体外恶性疟原虫红内期生长抑制试验(gia)和体内恶性疟原虫传播阻断试验(tba)来检测对恶性疟原虫抗原的抗体应答。对于恶性疟原虫tba,将来自用gap(pf)bs/gam免疫的小鼠的血清添加到恶性疟原虫配子体培养物中,随后进行标准恶性疟原虫膜-饲试验,其中允许斯氏按蚊进食以获取富含配子体的血餐。表达荧光素酶的恶性疟原虫(p.falciparum)株系允许通过生物发光常规分析血清对蚊子中卵囊发育程度的影响。对于gia和tba,比较gap(pf)bs/gam免疫血清与对照恶性疟原虫感染,其中配子体培养物与用早期停滞gap免疫的小鼠所产生的血清混合。此外,用在佐剂中的重组pfs25和pfs48/45免疫的小鼠的血清被用作阳性对照,并且用无关hivenv蛋白类似免疫的小鼠的血清用作阴性对照。与gia的结果结合,这些实验允许测定是否存在gapbs/gam的gia和tba。预计gapbs/gam能够诱导bs/gam-特异性细胞和体液免疫应答。本文所述的最初选择的抗原在先前的体内和体外实验中作为保护性靶标已被证明是成功的,这增强了向gap(诸如本文其他地方所述的那些)中添加这样的红内期和/或配子体抗原将提供增强的跨阶段保护的信心。预计这些数据将证实红内期和/或配子体抗原的添加可改善疫苗,诸如基于gap的那些。尽管已说明和描述了本发明的优选实施方式,但将意识到可在背离本发明的精神和范围的情况下在其中进行多种变化。序列表<110>a·m·沃恩;s·h·i·卡佩;d·a·丹克瓦<120>双重减毒肝晚期疟原虫及相关组合物和方法<130>sbri-1-65267<140>tbd<141>2018-01-24<150>62/450,258<151>2017-01-25<160>23<170>patentinversion3.5<210>1<211>1446<212>dna<213>约氏疟原虫(plasmodiumyoelii)<400>1atgaatatgaatttgaaaaatataaacttagaagacgaaaaaataaataaaagagtgagt60aataaaagaatagtgcatataaaaaatacatatatatctccatatgttctttataataaa120aaggggaatagtaataatcaattggataaattaaataaaatatttactagtgaaaataat180tgtagattttcaaaagaatattataattatgttaaagatggtgatatatgtaatagtgga240gaaaaatatcctgaatgttgttccccaaatgttaagcaaaacaatagcccaaattatgac300caatgtaataatgaaaaaaaaatattaaaatatggcttgttgaatgaacaaaatatgaaa360tttttaaaaaaaaaaaaagaagaagattttgaattaaatacaatatctactatgatacat420atttattctgattatgaaagtgataaagacaatgaaacgataacaaatgaatataatgat480ttaatagattgtataaaaaaaataaatatttctaataataaatgtgttattaataatgat540aaaaaaatagaggatactttattaagtccttatgaacagtatagaaaatgtagttatcag600acaattgggcataaagaaaattatagtaacaaaaataatgaaaaaaatagtgacaaaaat660aatgaaaaaaatagtgacaaaaataatgaaaaaaatagtgacaacaatagcgataataat720aatgataacaatagcgacaataataataacagaaatagcgataataataatagtgatgat780aatggagaaaaatgtgtgcaaagattaaataattttatatctattccttcagtatcaaac840aaaagttgcatagaacatgtacatgttcagaatgatcatatggatactgtgtattatgat900aattttatttgtaataaagaaaatcgtgataataatgaaaatgatactatatataaatgt960gaagaatctataccacttggaacaatattaaatattcataatttagatagtaataataat1020aatggtctaacaacagttatgttaagaaatataccaaataaatatacacaaaatatgtta1080atggatgttatgaatgagcattttaaaggtttatatgattttttttatttaccaattgat1140tttcgtaacaaatgtaatgttggttatgcatttattaattttatacatcctcattatgct1200gaactatttattaaattttttaataattataaattaaatgcatttaaaagtaataaaata1260tgcactgttacatggggaagggtacaaggattaaaagctaatattgaacattacagaaat1320tctgcaattatgactatatctgtgcctcaatataagcctatactttttcaaaatggaata1380tctgtttcatggcctgaatcggatggtcccttaccagctataaaacttcgatcacataaa1440tattag1446<210>2<211>989<212>dna<213>约氏疟原虫(plasmodiumyoelii)<400>2ctacctgtaatggaaatatcgacataaagagaggaagaaaagatatgagatatatagaaa60gattttatttataattttttttttataaacattataaatttaaactggacatattttcac120caattatttaatcacatatgtcataacaccatactatagaaaatatatgtaatacatatt180tcgtataaatttattaaaattttattattaaaaatgtttttttatttgttgtgaatttat240ataatacaaaaatggggtattccccatattctttttgtttttattcattttttttttgtt300tattatatttgctattttaataaatacctctttctatatatgcatatgatcgtgtgtaca360catgcatatatttggtatgtatattcatgtgccttttttgaagagcatttttaatattga420ctttagttttattattgttgtaactattatacataacaaataaaaaaacatttaatttaa480gaatatataattcataaaaaaaattttgttcatatattcatatttggttgtttttttttt540ttttttccaatagtatggtatttttcattatacaacttaactacattttctattctgtta600tattacattactctcattaatagtgtaacattaacaacgtaaaattctgaatacatggtt660tttcttctaaaaaggtaaatatagaatatgtatgctttatatatattttaatgtcaaaaa720aaaataaaaataatgctatatttttaatatattttttaatcattttatacgttttatttt780aataattctgtgatataatttggctacatttaattaccttgccggtcagaaaaaaaaaca840taaaaatatgcatgtacataaaaaatataatcattacacacaaaaaatatatatatacat900acatataaagagaaaataagacttaaaataattctgacgtatgaatatagaaatagaaaa960gttgtaaatataaataaggacggacaaaa989<210>3<211>985<212>dna<213>约氏疟原虫(plasmodiumyoelii)<400>3tattgtttataaaattatagaattttacaactatgctaatttattttatatacatataca60tatacatagaaaaattatattattatgtttgacttcccaaaaaaaaaacacattaatatt120tcatattatcttatttgcctgatcatatatatatacactcatttataatattttagtttt180aaacgtttattccatatatctaaaattattactattgccaatgcgaaaacaggctatatg240tttcccttttattacatgtttgaatttgtgtattattattgttattcacataataataaa300tgtgaaatgatgacccgagttgtgaaggtgatatcctatattatgtatgttcatatgtat360gcgtgttcatatgtatgcgtgttcatatgtatgcgtgttcatatgtatgcgtgttcatat420gtatgcgtgttcatatgtatgtgtgttcatgtatatgcttgttcatatgtatgtgtgtgt480gtgaatgacgagcggtatttatattacaggtacataaatttgcacacatattgataatta540tattttccctgtacattttatttccctctttttaatatattactttatataacatgtatg600tgagtgcttataaataaaattgtgtaaaattcgttggtaacttattattacaactgttgt660tattttgcttatttattactatttatttttttagccttaaactggtgcctctttgatatg720ttctcttgtatatgtccacgagttattttggaaatcatttttgtgagcatatataatgca780actacataaatatgtgtgcatgatttaacaaactattttatatttacttccttcacaaca840tgtttaacatattttttaaatacatttttatatataaatattgatacatacacaacaaaa900tacaaaaaatactacattagtagctaattataaattagtgatatttaatagatcgagttg960tatatataatgcttacatttgttaa985<210>4<211>20<212>dna<213>约氏疟原虫(plasmodiumyoelii)<400>4ggtaagggaccatccgattc20<210>5<211>9927<212>dna<213>约氏疟原虫(plasmodiumyoelii)<400>5atgaaagatcatataaaaaatgtatgctttcggaaaactctactcatttcactactactt60attatattaaaatacacaaaatatgattatttagaaaaagaaaatggtggaaaacaaaaa120tacaacagcaatatatcgtcgccaagtttactaagaacatattttggtgtatatgtcaat180agaaaaaataaggatgtaaaggcattgaagaaattgttaaaaaatgttacgatttctaat240aattacctttgcatggtgaaaaaggtggacataaatgtttacaataaaatatgtggtaat300aagataaataaaattatattgaacaacgaaagaaaatatgagaaaaatgatttaaaaaaa360aagtgcattactactgaatcttcatcgtgcacatttgatgaagaaaaaaaaaggaaaaaa420ttattcacagattatgaaaaaataaatttatataaaaatagtaacccccttgaggatatt480gacacaaatggaaatacaattaaaggctttctttttgaattatttgatataattgaaaaa540attaagaaaattgtaatagatgcatctaacaaaattatttccatgtgtctatttaataat600gataattacaaagaaaacttattcgacataaaaaataataaggattataataaattgcat660aattataattcttataaatattatgaaaatccaaatataaatacatacaacattaataaa720gagttgtatgtatataatgaggaatatgctcataaatatttatattcttttatagacatt780tcacctgataatttaaatgttgatttttataaaaaagaagttcaaggaggagatagaaat840atagtgcccgaaatttttaaaaataaaaatgtgtataatttatctaaggataaaaagtat900gatatccatgataagatgaatgatggaaataaatcgaattgtggggtttcaagtgacaaa960gccgaaaaatatatatttgacactgaaacaaatagaagcgtaaaacttaaaaaggaacaa1020tttttggaaaaaagtgaaaactggaatgaaagcaaaataaaccaatcaaacaaactgcat1080aaaaaaaataacgaagtgatatatagatcgataggaagaattttggcagaaccaatatat1140gaaaatttagttttaaatacagatagaaataaagaaaaagaaagagaacgagaaatagaa1200aggaaacaagaaagagaatgggaaaaggaaagagaaaaagatagaaatccaaatacaaat1260aaaaataaacctaatccgttggaagaaaaacttttgctgattattaaagaacagaaagga1320gatcctaaaagtgaaaattccgaacaaaatcaaggaattactgtattagaatttagtcgt1380acaccgtcaaaaaaaaaaaaaagatcatgcacaattttagctgaaaatgaatcagaaact1440tcgggcgaagataaagaaaaggataaaaaacaagataaagaatctaatacttctgacaat1500aacaatggtgatagtccagcctctccagccccaaatgattcaaattatgatagtccagct1560tcgccagctccaaatgatgtaccagaaggtaacattcaaagaccttctagattaatcgca1620gaaaaggaatctgaaaataagagtgaagataaaaaacaagataatgaatctaatacttct1680gataataacaatggtgatagtccagtttctccatctccaaatgatgtaccagaaggtaac1740attaaaagaccttctagattaattgcagaaaaagaatctgaaaacaatagtaaaaataag1800agtgaagacaaaaagcaaaataaagaaagtaatacttctgataataaaaatgaagactca1860aattatgataatcccgcttctccagccccaaatgattcaaattatgatagtccagcttct1920ccagccccaaatgatgtaccggaaggcaacattcaaagaccttctagactaattgcagaa1980aaagaatctgaaaataatagtgaaaataagagtgaagataaaaaacaagataaagaaact2040aatacttctgataataacaatggtgataattcatcttctccagtcccaaatgatgtacca2100gaaggtaacattcaaagaccttctagattaatcgcggaaaaagaatctgaaaataatagt2160aaaaataagagtgaagacaaaaagcaaaataaagaaagtaatacttctgataataaaaat2220gaagactcaaattatgataatcccgcttctccagccccaaatgattcaaattatgatagt2280ccagcttctccagccccaaatgatgtaccggaaggcaacattcaaagaccttctagacta2340attgcagaaaaagaatctgaaaataatagtgaaaataagagtgaagataaaaaacaagat2400aaagaaactaatacttctgataataacaatggtgataatccagcctctccagccccaaat2460gactcaaattatgatagtccagcttctccatctccaaatgatgtaccagaaggtaacatt2520aaaagaccttctagattaattgcagaaaaagaatctgaaaacaatagtgaaaataagagt2580gaagataaagaacaaaataaaaaacaagataaagaaactaatacttctgataataacaat2640ggtgataatccagcctctccagccccaaatgatgtaccagaaggtaacattcaaagacct2700tctagactaattgcagaaaaagaatctgaaaataatagtgaaaataagagtgaaaataaa2760gaaactaatacttctgataataaaaatggagactcaaattatgataaccccgcttcgcca2820gccccaaatgattcaaattatgataatccagcttctccagccccaaatgatgtaccagaa2880ggtaacattcaaagaccttctagattaatcgcggaaaaagaatctgaaaataatagtaaa2940aataagagtgaagacaaaaagcaaaataaagaaagtaatacttctaataataacaatgaa3000gactcaaattatgataaccccgcttcgccagccccaaatgattcaaattatgataatcca3060gcttctccagccccaaatgattcaaattatgatagtccagcttctccagccccaaatgat3120gtaccagaaggtaacattaaaagaccttctagattaatcgcggaaaaagaatctgaaaat3180aatagtaaaaataagagtgaagacaaaaagcaaaataaagaaactaatacttctgataat3240aacaatggtgactcaaattatgataatccatcttctccagccccaaatgatataccggaa3300ggcaacattaaaaggccttctagactaatcgcagaaaaggaatctgaaaataagagtgaa3360agcaatagtgaaaataagagtgaagataaaaaacaagataaagaatctaatacttctgac3420aataataatggtgatagaccagcttctccagccccaaatgattcaaattatgatagtcca3480gcttctccagccccaaatgattcaaattatgatagtccagcttctccagccccaaatgat3540gtaccagaaggtaacattaaaaggccttctagactaattgcagaaaatgaatctgaaaat3600aaagaaaatgaaaaaaaaaaaaaaataaaagtatataatacttctggtaataataatggt3660gatagtccagcttctccagccccaaatgatgtaccagaaggtaatattaaaagaccttct3720agactaatcgcagaaaaagaatctgaaaataatagtgaaaataagagtgaagataaaaaa3780caagataaagaaactaatacttctgataataacaatggtgatagtccagcttctccagcc3840ccaaatgatgtaccagaaggtaacattcaaaggccttctagactaatcgcagaaaaggaa3900tctgaaaataagagtgaaagcaatagtgaaaataagagtgaagataaaaaacaagataaa3960gaaactaatacttctgataataacaatggtgataatcccgcttctccagctccgaaggat4020gtaccagaagataaacctaaaaggcctactagattattcgcagaaaaagaatctgaaaac4080aatagtgaaaataagaatgaagataaaaaacaagataaagaaactaatacttctgataat4140aaaaatgacgactcaaattatgaaaatccagcttctccagctccgaaggatgtaccagaa4200gataaacctaaaaggcctactagattattcgcagaaaaagaatctgaaaacaatagtgaa4260aataaagaacaaaataaagaatctaatacttctgataacaacaatggtgataactccgct4320tcttcagtctcaattgatataccagaaggtaacattaaaatcccttctatattaatttca4380gaaagtgaatctgaaaataagagtaaaactaacggtgaagataaagaacaaaataaagaa4440tctaatacttctgataacaatggtgataactccgcttcttcagtctcaattgatatacca4500gaaggtaacattcaaagaccttctagattaattgcagaaaaagaatctgaaaataatagt4560gaacataatagtaaaaataagaatgaagataaaaaacaagataaagaaaccaatacttct4620aataataaaactgatgataatccagcttctccagctccaaatgatgtaccagaagataaa4680cctaaaaggcctactagattattcgcagaaaaggaatctgaaaacaataatgaaaataag4740aatgaagataaaaaacaaaataaagaatctaatacttctgataataaaaatgaagactca4800aattatgataaccccgcttcaccagccccaaatgattcaaattatgataatccagcttct4860ccagctccaaatgatgtaccagaaggtaacattaaaagaccttctagattaatcgcagaa4920aaagaatctgaaaataatagtgaaaataagaatgaatataaagaacaaaataaagaatat4980aatacttctgataacaacagtggtgatattcctgaatctccagtcccaaattatgtacca5040gaaggtaaatttaaaaagatttctagactaatcgcgaaaaaagaatctgaaaataatcgt5100gaaaataagagtgaagataaaaaacaagataaagaaaccaatacttctgataataaaaat5160gatgatagaccagctactccagttccaaatgatgtaccagaaggtaacattaaaaggcct5220tctagactaatcgcggaaaaagaaactgaaaataatggtgaaaataagagtgaagataaa5280aaacaagataaagaaactaatacttctgacaataaccatgatgatagaccagctactcca5340gccccaaatgatgtaccagaagctaacattaaaaggccttctagattaattgcagaaaaa5400gaatctgaaaataatagtgaaaataagagtgaaaataaagaaactaatacttctgataat5460aaaaatggagactcaaattatgataaccccgcttcgccagccccaaatgatgattcaaat5520tatgataatccagcttctccagccccaaatgatgtaccagaaggtaacattaaaagacct5580tctagattaatcgcagaaaaggaatctgaaaataatagtgaaaacaatagtgaaaataaa5640gaatctaatacttctgataacaacaatggtgatgactccgcttcttcagtctcaattgat5700ataccagaaggtaacattaaatggtattctagaccaaccgcagaaaaaaaatctgaaaat5760aatagtgaaaacaatagtaaaaataaagaatctaatacttctgataacaacaatggtgat5820gactccgcttcttcagtctcagttgatataccagaaggtaacattaaaagaccttctaga5880ttaatcgcggaaaaagaatctgaaaataatagtgaaaataaaaatgatgataaaaaacaa5940gataaagaaactaatacttctgataataaaaatgaagactcaaattatgataaccccgct6000tcaccagccccaaatgattcaaattatgataatccagcttctccagctccaaatgatata6060ccagaaggtaacattaaaaggccttctagattaattgcagaaaaagaatatgaaaataat6120agtgaaaataagaatgaatataaagaacaaaataaagaatataatacttctgataacaac6180agtggtgatattcctgaatctccagtcccaaattatgtaccagaaggtaaatttaaaagg6240ttttctagactaatcgcggaaaaagaatctgaaaataatagtgaaaataaaaatgatgat6300aaaaaacaagataaagaaactaatacttctgataacaacaatgaagtctcaaattatgat6360aatccagcttctccagccccaaatgattcaaattatgataatcccgcttctccagtctca6420gttgatataccagaaggtaacattaaaaggccttctagactaattgcagaaaaagaatct6480gaaaataataataaaaataagaatgaagataaaaaacatgataaagaaactaatacttct6540gataataaaaatgaagactcaaattatgataaccccgcttcaccagccccaaatgattca6600aattatgataatcccgcttctccagtctcagttgatataccagaaggtaacattaaaagg6660ccttctagactaattgcagaaaaagaatctgaaaataagaatgaagataaaaaacaagat6720aaaaaacaagataatgaaactaataattctgacaataaccatgatgatagaccagctact6780ccagccccaaacgatgtaccagaagataaacctaaaaggcctactagattattcgcagaa6840aaggaatctgaaaataatagtgaaaataagaatgaagataaaaaacaaaataaagaatct6900aatacttctgacaataaccatgatgatagaccagctactccagccccaaacgatgtacca6960gaagataaacctaaaaggcctactagattattcgcagaaaaggaatctgaaaataatagt7020gaaaataagaatgaagataaaaaacaaaataaagaatctaatacttctgataataaaaat7080gaagactcaaattatgataaccccgcttctccagccccaaatgatgattcaaattatgat7140aatcccgcttctccagctccaaatgatgtaccagaaggtaaatttaaaaggctttctaga7200ctaatcgcagaaaaagaatttgaaaataagagtgaaaaacatatttccggaaaaaataaa7260gcaaataaaagtacgtttgtagaaaatggacaaaaatggaacttggatgaagaaaggaaa7320agcatgttcgaaaagataaaaaagaaaaaacaaaaatacaaaaaaaaatattatgcttat7380gatatgattgaaaaaatggaatatttgagttcgctatcagatgatgaatattttacgaat7440gatggtgcccctaatcatgcacaaactagtagtgttctaggaaaatatttgaaacatcct7500aatacttataataaatatttagatattaatttatttttcgatgaaaaaccatatcaatat7560agaaaaggtaattattattttataaatccatttccatatagtattataaagatgaaaaaa7620aatgaaggattatctaattcagaaaaaataaaatatgatggtgtctattgttattctctc7680tcctttaataattattcttcattaacatatacaattgaaaactcattcagaaatgtaaaa7740ccaatagaagaaataataccaggcacattaacaggttttaaaagtgatgacggatatcaa7800aaaatgcttactccaatgtttgttgaacaggatatgttcttacattgtgcatttaagaat7860gaatatgatgaaatagaaaataaaatagcatcatttcctgttaaaatatttttaaaaaaa7920aatttaaacaaaacaaaagggtgttcttttcaaataaataaaaatggttcgatatataaa7980gaatatgcagaaagggaatcatttttaagtaaaaaagttatattgaatgatgaaagtacc8040agtaacgaatgtgatatcacagctacaaatgaaattattggttttcaatgtggaccccca8100tacaaatattataccaacgacagtaatacgagttatattgataagattttttttaatact8160gtgaataatgaagatataaaaattggtgaatattttaaagttgaacctgcacattgtttt8220gaagaagttaatgcaaatgaacatattgaagatattgccccaggtagtttccctttcccg8280aattttgaaatgataaatggaggtttaaaatcacatcatacaaggtatataaagttaaaa8340ataagagatccaaatgcaattatatcatgttattgcaactattataataatgggaaaata8400atttattcaggtataatgactataaatggtaaaaaaaaatataatgatcaatcatattcg8460gattatccacctcaagacattaataaaacaagcgataatgcaaaaggaactggtcacaaa8520acaattaattcaaataaaaaaagtaaaattgataatacggaaaattatgataatgactat8580aaatatttttttaatttcttgccatattataatccatatctcatgcaatataaaaagcag8640cctgaatacgttgtgaaaaatgatttcatatatgatagtaagtatagcgacacaaataat8700gatgaatttttaaaaaaaattaaaaataatttgtccgacttaaaactcactgataacaat8760gagtatattcatgatatggatgataatttaagatataaatacgataatagagattctaac8820gtgtacccaatcagtgaatatgatctagaaaatcattttgatagcgacgtgttgtcagat8880tcttatggacacacgtttaatgatgattatataagtccacatagtaactcatattatgaa8940gaaaatacgtataactcagatgacattttctctaattatgatgacgttaatattgaagct9000gaatatgaagaatttgaaccattgcaaaataatgtaacttttcaagataataaatcctat9060gaagataaatctcaatctattatagtaatcaataaatcaaaaaatgttaatctttatatt9120cccaaaaataaaataaaaaataaatcggaatatacaaaaaataatgaagatatagaagat9180aataaaaagaaagatgcgctccttaaatatttattattaacatacgaagaaacaccagat9240aaaaatgaaaaaatgaataaaaaattaaaattatttaaagaatatttcccgtcttcacca9300aaccataatatatttgtagaagaaaaagaaaatgataatacatcaaataaaataaaaagt9360atatttgataatcaagaaaaatcaatagaatcattaagtggggaacaaatcaatggtgaa9420atagaagtatctgaaaatgattctactttagatcataataaatcttataattacgataat9480acaaatagcaacaatcatgaaaataataatgctggtgtgaataatgctgatgtgaataat9540gatggtgtgaataatgatggtgtgaataatgctggtgtgaataatgctggtgagaataat9600gctggtgtgaataatgctggtgagaataatgctggtgtgaataatgctgatgataataat9660gctgatgataatattgatgacgatacaacaaattttattatggataaaattttacatgat9720ttgtttggacataatgaatacgatggcaataaagaagaaaatccaaaaaacaagaaaata9780tatcaaactaaaattaatacaatagaaaatgaagaagacgatgaagaagaggaagaggaa9840gaagaagatttaattgaaaaggatggagaattagagaaagaaggcattgttccaagaaga9900aaacaaaaaagagttaccaaaatttaa9927<210>6<211>1006<212>dna<213>约氏疟原虫(plasmodiumyoelii)<400>6ggtacatcgacattcaccacaaaatatttcgtagagttgcattatcatcaaaagggtata60aaattataaaatataacataaaatataacataatggtgaaactaaaaataacgaaattca120agttggttgaataaaataaaaacacaacataaaagatcaaggtattatttttttttaaat180attctttatgaaaaacgattagaacaatttaaaataatgtatattatgcttgtacaatat240agttaaaataaagcgaataacgatacgattattcaatatgcagattaataatatatatgc300atgtaaatgtgtatatatttcttcattgtcaaattgcttaggcatatgtagcatatatga360tttttgacgattctttaaaaatatacaactgtaattcctaataaattaatgcagttgtaa420tcgaaaaaaaggcatgtgctcccgtatcgatttaaccatttaggtattgatctatgatcg480atctacatgtgaagaaaatgtgcatttttaaaaacagtttcataatggtttatgaatttt540ttagatcatatattgtttaaacaaaaaataaaacaaatacctattgtttgatattcgata600aagtgtgcaaacaaatttgcatgtatgtattctattatcgttggttttttttacaccacc660ttttttttttatttataatgtttttcaccacaaagcaactatatatataaaacacactaa720aaatatataattaaattaaaaaatataataaagaaaataaaaagcatatgtattatacat780acatgtatattctcctgaatatgtatgttttcagttcagattaagaacaaaaaaatacag840ataattaagcatttatttgttacgtttatacatgtcaataccaaaaatatatatgtgcct900acacatgttacatataagtagatacatataaatatatcggagtaatatttttcttcttta960atttttcacttttattataatcattttacttttttacacataaaaa1006<210>7<211>963<212>dna<213>约氏疟原虫(plasmodiumyoelii)<400>7agaaaaacctaaaagaggtaatacccaaaaatatgcatataagaaaaagggcaaaccata60ttggaaatacatgatataaggaatgaaattcaaagtgaaaaagaataatgtactattaat120ttggaagtgttgaacgtgataacaaaagcaaaacaaaggagttaaatcaaaagaaaataa180gacggaaagtcagaaagaagtaataattcaaataagcataataatataaaatacctaaag240tttaactatataaataagtattcgaattaaatatcttataataatatatattttgttttc300tatactattataaataaaaatgtgagcatatatgtctttgtgtaattttatattcatatt360caaaccatttatgattattttactaaggttgtcctaatttaaattataattagaaaaaaa420ctagtatatatttgaatagaattttaattacatattataaaaaaaacataattttttatt480ataaaatacttcatttcattttattaacctacaagacattatttaacattaacttcctca540aaaaatgtaaaaaataaattaaaaaaattttcttattctattttatttatttttatgaga600tttgtgcaagaacaaagtattttattaaaattttaaaaaaaataaatacataaaattcaa660aaatttcataaatgtttttaaaagagaataaaaataagaagcataaatcatataatattt720attttggctgagtaatagactagattatttggtatctatgtataatttgatgatataaat780attgtaaaaggcaataatttaatttctcacattttaatgatgactaattatattgactaa840ttcatatgtattatgtttggttgcttagactattgtgatatcaagtctttccattttcac900taattatttgacattttttatttcatctaacgatattttgtagttttaatttgaagttat960ttc963<210>8<211>20<212>dna<213>约氏疟原虫(plasmodiumyoelii)<400>8catattgaagatattgcccc20<210>9<211>1284<212>dna<213>恶性疟原虫(plasmodiumfalciparum)<400>9atgcataagatagatgaaaagataaatatgaataatgtaaaaggcactagaattattcat60gtaaaaaatacatatatatctccatacatactacacaatataaacaataatgaaggccca120ttaaaaaatatagacaaaatattaaaagaagaaaaagataatataaatttaaagatcaat180aatgttaataataaggaaactaataatgataagcacacattaaaatattcaacattatgt240aatgatctaaatataatgcatacacaaaataaagaagaagaaattgaattaaatacaatt300tcaacggttatacacatgaattctgatgaagatagtgataaagataatgataccataata360aatgaaaacaacgatttgttaattgataatataaagaaatatcatgccgttaaagataat420cataataatattatttataatgataaatataatacaattaataataattcagtcattaat480gatgtatgtaattctattcattttaataataattcatatataactaactttaatttaaat540cataatttttctgtgtgtaatcgtactttaaataacacctgcacaagtcaggtaaatttg600agaaataatatgaacagcaataaaaaaactaatgataacaataaaaatctgaacaatgaa660attaataagaaaatcaataatgataatattataaacgaatttgataatattaataataag720aaaaataattatattgattgttccgtttacaaatgtgaggatgaaataccccttggtacc780atattaaatatccaagatttggatatacataatagaaataatatgaacaattgtaataat840aatattaataataagagtaagattcttacaacagttatgcttagaaatattccaaacaaa900tatacacaaaatatgttgatggatgttatgaatgaacattttaaaggtttatatgatttt960ttttatttaccaattgattttagaaataaatgtaatgttggatatgcttttattaatttc1020atacatccatattatgctgaattgtttatcaaattttttaataattataaactcaatgca1080tttaaaagtaacaaagtctgttctgttacttggggaagagtacaaggattaaaggcaaat1140attgagcattatagaaattcagcgattatgaccataccaataccacaatataaacctata1200ctttttcaaaatggtataactgtttcgtggcctgaatcagatgggcctttaccatccatc1260aaattaagatctcaaaaattttaa1284<210>10<211>1011<212>dna<213>恶性疟原虫(plasmodiumfalciparum)<400>10catttataataatacatacaattttgaattataggatttttttctttgatgtattatatg60tattaatattattatttttataaaatgaatattttaattattatattttaatttcattta120aagtattttaaaattattattataataaaaatattagatgcatcttgtgcttacatataa180catttgcatgtgtggaaatattctctttccataaaaagatacaacttctcttgtttttgt240tttatttattttgattattgagaaataatataagaatatttaaccaatgaattaaattaa300aaatggtattctttttaaaaatgaaaaaaaaaaaaaaaaaacgtcaatgtaagaacaaaa360aagtgacaaattcatttggtattttttatataatatattttttttaatttatttatttat420tcctttatatatatatatatatatatatatatatatatacatacatacatatatatataa480tttatatataatttatatatattatattaaatgatatgtttataagaaaaaataaaatta540tgtgaatattttaattgttataattgattataaattatttgtgtttttattttgtataat600tgtatgctccaacatttaatgtgtatgctaaatatcgatggaatattattaaatatataa660ttcttaaaaattgagattttacatatttttttttattcccgtttttaagctgtttcataa720aaaaaaaaaaaattcataaagatatgaaatccatatttttttaaatatttggaaaaagga780atataacatgtaattatataatatatatatatatatatatatatatataatttggactaa840tcatattgatataaaaaaatatttttataataaaaaataataaataaataaataatagag900gagagacataaccaaaaagtgttgtaaataatacattaatatatatatatatatagatat960atatatatttttttttttttttttttctccttttatcaaaatgcataagat1011<210>11<211>859<212>dna<213>恶性疟原虫(plasmodiumfalciparum)<400>11ttaaattcaaagatgtatatagacacaaaaaaaaaaaaaaaataataaaaaaataaaaat60atatatatatatttatatatttatgtatcattgtttaaaaaaattaacaaattaaccttc120ttatgtttttacaatttacatactgattatatatatatacgtgtataatttactattcat180cttatcttatatattatcttcttttatttatttatttatttatttgtttttttttttttt240tctttttctttttctttttctttttccgcattaaatataatgtatcaaaatgattatttt300aattatatgaaaataaaatatatctgttaaaaataataatgtgtaaaaaaaataaaactt360atttatatacatttatatgtgataattatatattattatgtatatatattaatttatttt420tattttattgattaaaatataatattaatgtttttatttgtatatgaatatatattgtca480atgctttatatatatttaaaatatatgaaggaattttattttttatattcttgtctatat540atatatatatatatatatatatatatgtatatatattttttatttcttaacaaattaaat600ctagtttctttattattatataactttatcaacatttaaaataaataaaataataatttg660tgaatatataattatcaaatgtttaattgcttttttatatcccttataaaaacatatttc720gaaaaatatacatatatatatatatatatatatatatatatatatatatatatatgtttg780aaccgttaagtaaataatatggatagtaatattctaatacttttatgaattccctcgtaa840ttttaataattgccacagc859<210>12<211>20<212>dna<213>恶性疟原虫(plasmodiumfalciparum)<400>12aaataacacctgcacaagtc20<210>13<211>5895<212>dna<213>恶性疟原虫(plasmodiumfalciparum)<400>13atggagaagggttctattttatcgtttattttcttttgttctgttgttatctttatacga60tttatcggatatttcttttgtaatcgttacatgacagaagaaccatataataatattttt120gagataataaaacctgagaatttatatagttctttattattattgtcaaatgaaaaggaa180aatgattttcctagttctacaaattgtaacggatatatgaaatgtatccccttttataat240aatgtttctgaaagatggaagagatataattttatacaactttatataattagaagtgca300ttaaatatacatgtgatgagtaaatataatatgttaaataaatataataaggaaacgaac360agattattaaaaagaaataataatgtagaaaatagaattaataatatatccaatcattat420ttatgttcaggttttaaaaaagaaaaccgtttattcttccttttgttttataaaacaatt480aagatgatgaagttatatataaggaatttgtttatgaaatatattaaaatttattataaa540acaaaacattttgagaagaatatagaaactaataaaaaagtggtttatgttgaaagggat600aatctttttgatattgaaaggaataatctttttgatattttatatatgttaaaaagaata660gatagttatgtaaagaatatatattcaattatttctaataatttcttgtatgttataaga720ataatatttttaccatttgaaaaaatctatttctctttaaaatcccttataatgataaaa780aaaatgaacatgtcttcttcttattattattattatgtaaatatgttttctttgtataaa840aagaattacaacaaatatgaagaaatttttattcatgagcaaagagtaatatatcctaat900gaatacttgaaaaatgaaatgttggataaatatagaagggttatacgaattctctcggga960cagcatgataatccttttatagattctcttttaataaaccctgagaaaattgaaaaagat1020gatttagatgtaaagcagaaaaaaaaaaaaataattgaagagctgaagaaaaaaaaggaa1080aatacaaacacaaatacaaatacaagtacaaatacaagtgcaaatacaaatacaagtaca1140aacacaagtgcaaacacaaatacaagtacaaaagaatctcacatattagatgaatcgaaa1200ctagaaaccttttacagagacgaattagacaaaatgggaaaagaagaaattgaaacatat1260ttcaaagggaatattgacaaaaaatcacttgatgaatttcataaaatattgctagaagag1320ttaaacaaaatggacaaagatgaattatatgaaatgtatagagaagagttaaataggatt1380gaacaagaaaaaattagaaatatgaataaagaagaaataaataaaacttacaaggacgaa1440ataaataatatgaatagtgatcaagttgataaaatacatagagaagaattagaaaaaatc1500gaaaaagaaaaaataaacaaaatggataaagatgaaatagataaaatatatagagaagaa1560ttagacaaaatggatcgagatgcaatttatagtatgtatatagaagatataagtaacaaa1620aatataaaagacttaattaaaaatgaaaaggaaacaaataaggataaaaacaaaaaaaaa1680gatatagatataaacaaaaagaaaaaaaaagatatagatatagatgtagacatagataaa1740gatatacataaagatcatgtagaagaattatacggagaagtaaaaaacaaacttagcaaa1800gaagaattagatagaatggacagagacgcattatatagagtatacctagaagaattagat1860agaatgaacagagacgaattatatagagtatacctagaagaattagaaaaaatagacaag1920gaagaaaaagaaaaaattcatagagaaaaattacacaaaattgaaaaagagaaaataaat1980aaaatggataaagatcaaatagataaaatatatgaagaagaattaaacaaaatggatagt2040gatgaaattcaacatgtaaggagagcaatattacaagatatacaaaaagaaaaaatacaa2100aatttagaactagaagaaatcgatagactttataaagaagaattagatagaatggataga2160gaagcaaggtatgaaatccccatgagaaatttaagcagaaatgaaaaagataatattata2220catagaaatattaaaaatgaatctaaccaaaaaaataagaaagaaaatgtaaatgtattt2280ataatacacgacaataatgatagtaataataataataataataataatagagatgtgaat2340aatttaaataataagcacacaaataataattataatgaaaatgtagaagttgaattagtt2400gtacgaaatttagacaaggataaaggagccaagatagaagatattatagactattttaac2460aaagaaattaaaaaagacaaaaatgttaatgtttccaatatagtgaattttttaaattca2520aaagtaggaaaagataacacaccaattcaacataagaaggaaaatcaagtagatgttgtc2580aggaaaaatattcagattattcaagaggataatataaaaaataaaggccaaaaggataac2640actgaaatgttagataataataaggaaataacaaatattgatataaaaaatgttgatgat2700ataaaaaatgttggagatataaaaagtgttggagatataaaaagtgttgatgatataaac2760aatgttgatggtataaaaaatgttgatggtataaaaaatgttgatggtataaaaaatgtt2820gatggtataaacaatgtgggagatataaacaatgctggagatacaaataatgctggagat2880ataaacaatgtgggcgatataaacaattctgtagatatatacaacgttgaacatatagac2940gaagcggagaaaaaaccaaatcttgataatccaaaaaagtttgactggacacaggtattt3000aaagacaaagtaacagaaaagataaaaaatgaagaaaaattcaacaactcaaaagaaaat3060atacaaaacgatataagagataaagaaattcataaggatgatagaatcaagggaattact3120tcacgagaaaagaatgctgaagaaataaataataatgaaaaaaaagacaagtttgtgtat3180gaattttatacatccaataagaaagaaaatatagataaagaagaagaaaataatatagat3240gataaaaatataaaaatagaaatagaacctaattatgaaatcaacaacaattttgaagaa3300gaaaataaaaatgaaataaatgttattatagataaggaagcaaaaaataatatggataaa3360gatgatagtaataataataataatatacaaaagaataatattataattaaggataataca3420aatgtaagtgaagaggttcatattactgaaagtagtaaagaaatagcagaattttttaat3480aatataattaagaatagtaatatcttagatatgtgttcaaaaatgaatgcttccgattct3540gagaagggatttatatgtataaatggtaataattatattataaaccctggtacgtatcat3600ataataaatataaaatatccagattataataatgttagaaaaaaatggtatgattcgatg3660gattgtatatctataaataacaaggatgaaaataataataataaagaacataattattac3720aataaaaatgatgatgatttatatttaaagaaatcggttgaagaatttattccaggattt3780ttgagcaatattaataaagtagatgatttagcgagaatatttactccatcctttattcaa3840aatgatatttttttaaattgtatttacaaatataggaatgattttgataagaataataat3900atttattcctttcctatgaagatatttttaagaaaaaattcaacgaaaataaaaggttgt3960tcttttcaaattgatgaagaccctttgttatataaagattatagtgaaaaagaatcattt4020ctaagtaataaaattattttaaataattcaaacagaaatacggaatgtgtactacatgca4080tcaaatgaaattgtcggatttcaatgtggtcctccatataaatcttatgataatatacaa4140tatagacatcttacaaacaaatcaaacgatatacaaaaaaatatatttggtatatatagt4200aataataatagttcatattctcatttatttaaaaatatttttaataatgaacataaatta4260tataacgtaggaggatattttcaaacagaaccaattaattgttttgaatttgtaaatgat4320aacataaatgtggaagatatattaccaggagcggttccatttcctagatttgatttgata4380catcatgatttagatgttaatcagaccagatatattttattaaatgagacgaaccaagat4440aaaacaatctcttgtacttgtaattattttacagaacctaatattgtttatacaggtaaa4500attattattaaagttgaagaagagaaaatatataaaaccaaaaaattacaaactgaattt4560aatgatattataaataataaaaaggaaatatatcacgaaaaaaaaatgaatcatataatt4620aaagaaaagaaagatgaagacgaaaatgatatgtcatttaataaaaattatgttaataat4680tataatgaaaattttaaaataaatgatataaataatttttacaatagaaataatcatccc4740aataataattatcacaacgattatcacaataatcattctagtaaaggaaaccacacaaac4800aaaatacatgatacatttcttaagaataaatacaatatctcttttaataatttaaaattt4860tataatattaaacatgaaaataaaaataatcaagacgttattaattatgaatataatgtt4920gatgattatcatgaggtgcaggatggtcaggacgaatcatttaaagaagaggaagatttt4980attgattttaaagaaaatataattaatgataataccaaccataacaataccgatcttgat5040gatgataaatataataaatatcataataataataataataataataataattcttctttc5100aagtcgatagaaagtaatcttgatcttcaaagaagcatattacaatctggggacacacaa5160caagtagttgtaattaataaatcgaaaaatgtaaatgtcctttttccagataaaaaaaaa5220aatcacacacacccaaatgaagagaagagaacatttcctaaatatatctctttagtatat5280aaagaaaaaaataaggacaatgaaaaaatagacaagaccttaacctttattaaggagttt5340taccctccattgcttagaggaggtaaagacagcgatccggaaaataaacaaactggtgtt5400gaaataaacaatggtgtggaaaaaaaaaatgacgtacaaataaaaaatgatgtggaaata5460aaaaatgatgtggaaataaaaaatgatgtagaaataaacgatgatgtcgaaataaaaaat5520gatgtggaaataaaaaatgatgtggaaataaaaaatgatgtagaaataaacgatgatgtc5580gaaataaacgatgatgttgaaataaacaatggtgtagaaataaacgatggagtagaaaat5640aaagataatatacatgagggtaataataatttagaaaatgattcttttaatgaagatact5700attgaagaaccctttgaaaatatttttgattttataaatgaagaaacaagttcaaatgaa5760aactcggaaataattcttgattcagcagattctataaaaagaaaattaggtcacaacttt5820ttagacataataagtgcagggaaatttaaaataagacataaagaaaaaaaaacaaaaaat5880aaaaaaaaaaaataa5895<210>14<211>925<212>dna<213>恶性疟原虫(plasmodiumfalciparum)<400>14aagggaaaaatgcgccacttaaatggtcttataaaaaaaaaaaaaaaaaaaaattctaaa60taccttacatatatatatatatatatatttatttatttatttatttatatatttatatat120ttatatgtgaaaaatattaaaaaaaaaataaagaaccacattgttttaatataattattt180tatgtgtcttttaatattattgcagtgggaataaattaataatatatatataatttttta240tttaaacataatgaaaagaatacattataagatggttaaaaaatgatcagctttcatcat300cgacgttatatataaatgtgtcgattgttctaatggtgatattaaaatgttcctatattt360ttttttttttttttttcgcctaatatttatcacgttagatccacacatatatacccaaaa420aaaaaaaaaagaataagaaaaaaaatgtgtgaatatatcgaagcaaacatgttgataaat480atacatgtatgtatgttactcatttgtctctttttcttttttgttacttttcgagtgtct540tgtagagtgggttgcatatatctacataggaaagaaaaaataaaaataaataaataaata600aataaatatatatatatatatatatatatatatatatattacgtatatttttttttattt660tttattcttacatgttttataaaatttgatagagccttatttattgtaaggatataattt720aaaaaaataaaaatttcttttttttatattaatcaagcattatatatatgaaatattgtt780cacatataataataataatatatatatatatatgtgtgtatatatatttatttacatgtt840taataaattttttatacactgaaaaaaaagtattatatatctaaatatctacatatttat900ttatttctaagtattggtattaaac925<210>15<211>850<212>dna<213>恶性疟原虫(plasmodiumfalciparum)<400>15caaccataacaataccgatcttgatgatgataaatataataaatatcataataataataa60taataataataataattcttctttcaagtcgatagaaagtaatcttgatcttcaaagaag120catattacaatctggggacacacaacaagtagttgtaattaataaatcgaaaaatgtaaa180tgtcctttttccagataaaaaaaaaaatcacacacacccaaatgaagagaagagaacatt240tcctaaatatatctctttagtatataaagaaaaaaataaggacaatgaaaaaatagacaa300gaccttaacctttattaaggagttttaccctccattgcttagaggaggtaaagacagcga360tccggaaaataaacaaactggtgttgaaataaacaatggtgtggaaaaaaaaaatgacgt420acaaataaaaaatgatgtggaaataaaaaatgatgtggaaataaaaaatgatgtagaaat480aaacgatgatgtcgaaataaaaaatgatgtggaaataaaaaatgatgtggaaataaaaaa540tgatgtagaaataaacgatgatgtcgaaataaacgatgatgttgaaataaacaatggtgt600agaaataaacgatggagtagaaaataaagataatatacatgagggtaataataatttaga660aaatgattcttttaatgaagatactattgaagaaccctttgaaaatatttttgattttat720aaatgaagaaacaagttcaaatgaaaactcggaaataattcttgattcagcagattctat780aaaaagaaaattaggtcacaactttttagacataataagtgcagggaaatttaaaataag840acataaagaa850<210>16<211>20<212>dna<213>恶性疟原虫(plasmodiumfalciparum)<400>16gaatgcttccgattctgaga20<210>17<211>24<212>dna<213>人工序列(artificialsequence)<220><223>合成的(synthetic)<400>17tattcatattgaagatattgcccc24<210>18<211>24<212>dna<213>人工序列(artificialsequence)<220><223>合成的(synthetic)<400>18aaacggggcaatatcttcaatatg24<210>19<211>39<212>dna<213>人工序列(artificialsequence)<220><223>合成的(synthetic)<400>19gaccatgattacgccaagcttggtacatcgacattcacc39<210>20<211>59<212>dna<213>人工序列(artificialsequence)<220><223>合成的(synthetic)<400>20cttttaggtttttctgggccctttttatgtgtaaaaaagtaaaatgattataataaaag59<210>21<211>47<212>dna<213>人工序列(artificialsequence)<220><223>合成的(synthetic)<400>21ttttttacacataaaaagggcccagaaaaacctaaaagaggtaatac47<210>22<211>58<212>dna<213>人工序列(artificialsequence)<220><223>合成的(synthetic)<400>22aaacttaaggaattaattcaagcttggaaataacttcaaattaaaactacaaaatatc58<210>23<211>24<212>dna<213>人工序列(artificialsequence)<220><223>合成的(synthetic)<400>23ttttttaacgatgtaacagtgttg24当前第1页12
相关技术
网友询问留言
已有0条留言
- 还没有人留言评论。精彩留言会获得点赞!
1