益生菌传递的鱼用哈维氏弧菌口服DNA疫苗的制备及应用的制作方法
本发明涉及生物技术领域中的原核生物基因工程表达,并利用鱼体肠道中分离出的益生菌作为口服传递载体,具体地涉及一种益生菌传递的鱼用哈维氏弧菌口服dna疫苗的制备及应用。
背景技术:
哈维氏弧菌(vibrioharveyi)是海水养殖业中最常见的病原菌之一,常引起鱼、虾、蟹、贝等多种水产经济动物疾病的发生,对海水养殖业造成了巨大的经济损失。哈维氏弧菌是一种革兰氏阴性、发光海洋条件致病细菌,当周围水体环境恶化,水生生动物免疫力低下时,哈维氏弧菌会迅速繁殖,导致其感染弧菌病。近年来,随着海水养殖规模、密度的急剧增加,哈维氏弧菌引起的养殖损失报道日益增多。当前,国内对水产动物细菌性疾病防治多通过大量使用抗生素来实现,从而造成抗生素的滥用和细菌耐药性增加。当务之急是寻找一种环境友好的哈维氏弧菌抗病方法。相对传统的药物防治,疫苗防治有着安全、高效、特异性强,以及保护时间长等诸多的优点,通过基因工程技术构建新型疫苗来防治弧菌病已成为细菌性疾病防治的最主要途径。
技术实现要素:
本发明要解决的技术问题是提供一种新型益生菌传递的哈维氏弧菌口服dna疫苗的制备及应用方法。所述的该口服疫苗接种方便,能刺激鱼体产生免疫,并对哈维氏弧菌产生很高的保护效应,且对环境无任何危害。
本发明是通过采用如下技术方案实现的:
一种益生菌传递的鱼用哈维氏弧菌口服dna疫苗的制备方法,所述方法包括如下步骤:1)tssj基因片段的克隆与纯化;2)tssj基因真核表达载体(pctssj)的构建;3)乳酸乳球菌f3传递重组dna疫苗pctssj/f3构建所述的步骤1)tssj基因片段的克隆与纯化以哈维氏弧菌gdh11385基因组dna为模板,通过pcr获得tssj基因;
所述的步骤2)tssj基因真核表达载体(pctssj)的构建,所述载体为pcn3;
所述的步骤3)乳酸乳球菌f3传递重组dna疫苗pctssj/f3构建:
①乳酸乳球菌f3感受态制备
将实验室前期分离的乳酸乳球菌f3接种至gm17培养液中,30℃、180rpm振荡过夜培养;按体积比2-3%的接种量转接溶液ⅰ中,30℃、180rpm振荡培养至od600约为0.4-0.9时,离心收集菌体;再用30ml溶液ⅱ洗涤细胞2次,离心去上清后用1ml溶液ⅱ悬浮细胞,获得感受态乳酸乳球菌f3;取40μl分装于1.5ml离心管中,-80℃保存备用;
感受态制备液配方:溶液ⅰ:50ml2×m17+1ml50%葡萄糖+34ml50%蔗糖+10ml10%甘氨酸+10mlddh2o;溶液ⅱ:34ml50%蔗糖+10ml甘油+56mlddh2o。
②pctssj质粒转入乳酸乳球菌f3
取1μlpctssj质粒与40μl乳酸乳球菌f3感受态细胞混合,冰浴10min,转入预冷的0.2cm电转杯中,电转化条件为:电压2400v、电阻200ω、电泳25μf;电击后加入sgm17培养液,冰上放置5min,将电转杯中的混合液转入1.5ml离心管中,30℃静置培养2-3h,离心去掉部分上清液,轻轻混匀菌体,将全部菌液涂布在含有amp和caco3的固体mrs培养基;30℃静置培养18-24h。
③乳酸乳球菌f3传递重组dna疫苗pctssj/f3的筛选与鉴定
挑取单菌落至含amp的mrs培养基中,30℃条件下,180rpm振荡过夜培养;提取重组益生菌质粒,取1μl作为模板,以上游引物cn-f1:5’-cttgcgtttctgataggcaccta-3’和下游引物cn-r1:5’-tgcgggcctcttcgctatt-3’,进行pcr检测,筛选获得益生菌传递重组dna疫苗。
进一步,步骤1)中所述的通过pcr获得tssj基因,其中tssj上游引物:5’-cccgggatggacccatattcagatttag-3’;tssj下游引物:5’-cccgggcttttacgaccaaagacagat-3’(下划线部分为酶切位点smaⅰ)。
进一步,步骤1)中所述的tssj基因序列为seqno.1。
本发明还提供一种将上述疫苗制备成口服疫苗的方法,所述方法具体步骤如下:
①将重组的乳酸乳球菌pctssj/f3至含amp的gm17培养液中,30℃、180rpm振荡过夜培养至od600在0.8左右;离心后用pbs重悬至浓度为108cfu/ml。
②取适量1.5%的食品级海藻酸钠溶液与重组的乳酸乳球菌pctssj/f3充分混合,将混合溶液缓慢滴加食品级液体石蜡(含乳化剂span-80和硬脂酸镁),使液体石蜡的终浓度为1.8%,1800r/min搅拌,待充分乳化后,将10%的cacl2溶液加入乳化好的海藻酸钠细菌混合物中,边加边均匀搅拌,逐步钙化形成微球。
③8000r/min离心5min收集沉淀,用pbs缓冲液洗涤3次后,再用相同缓冲液重悬。
④将微球悬液与鱼用饲料混合制备成含益生菌数目为1010/g的口服疫苗,在空调房中晾干,置于4℃保存备用。
在哈维氏弧菌高发前期,每天每条鱼口服疫苗的投喂量为0.1g,连续投喂三周,即可大大提高免疫鱼体抵抗哈维氏弧菌能力。
本发明与现有技术相比的有益效果:
本发明提供一种以布氏鲳鲹肠道益生菌--乳酸乳球菌为传递载体的新型水产口服dna疫苗,在哈维氏弧菌高发前期,每天每条鱼口服疫苗的投喂量为0.1g,连续投喂三周,即可大大提高免疫鱼体抵抗哈维氏弧菌能力。该疫苗生产成本低,免疫方法简单,适用于大规模生产。
附图说明
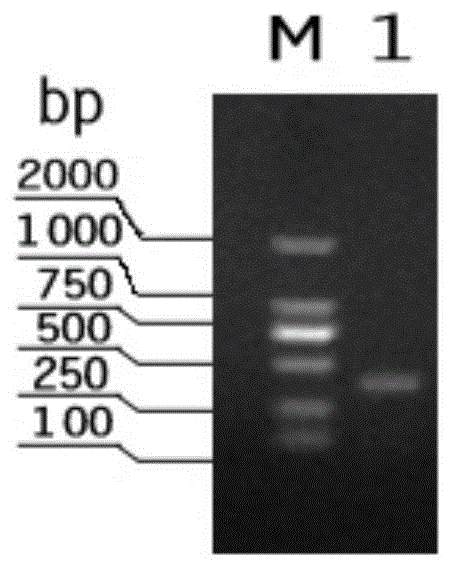
图1、tssj基因pcr产物琼脂糖电泳图谱;
图2、各实验组布氏鲳鲹呼吸爆发(nbt)a、超氧化物歧化酶(sod)b、溶菌酶(lzm)c和酸性磷酸酶(acp)d活性;
图3布氏鲳鲹elisa检测。
具体实施方式
下面通过实施例来对本发明的技术方案做进一步限定,但本发明的保护范围不受实施例任何形式上的限制。
实施例1
本实施例所用到乳酸乳球菌f3,是从健康野生布氏鲳鲹肠道中分离得到。分离方法为取布氏鲳鲹肠道组织,匀浆后涂布于乳酸菌分离固体培养基mrs,而后通过挑选单菌落获得。哈维氏弧菌gdh11385是本实验室从患病石斑鱼中分离得到;乳酸乳球菌f3和哈维氏弧菌gdh11385均可对外出售;其它试剂和培养基如无特别说明,均为从市场上购买的商品试剂。
一种益生菌传递的鱼用哈维氏弧菌口服dna疫苗的制备方法,所述方法包括如下步骤:
1)tssj基因片段的克隆与纯化
①以哈维氏弧菌gdh11385基因组dna为模板,通过pcr获得tssj基因;
其中tssj上游引物:5’-cccgggatggacccatattcagatttag-3’;tssj下游引物:5’-cccgggcttttacgaccaaagacagat-3’(下划线部分为酶切位点smaⅰ)。
pcr反应体系为:10×buffer2.5μl,taq酶0.2μl,dntps0.5μl,模板dna1μl,上下游引物各1μl,ddh2o18.8μl;反应条件:95℃预变性5min,95℃30s,60℃30s,72℃30s,共30个循环,最后72℃延伸10min;反应结束后,取5μl的pcr反应液与1μl的6×loadingbuffer混匀,进行1%琼脂糖凝胶电泳检测;
②将在琼脂糖凝胶上出现375bp的目的片段,如图1所示,采用胶回收试剂盒进行产物纯化,获得纯化的tssj基因片段,经测序,获得其核苷酸序列如下:
cccgggatggacccatattcagatttagaaataacagcaaatcacaatattaaccctgactccaatggtaggccatcccctgtagtcgtgtatgcttttgagttaacatcaaataccctttttgaaagtcaggattttttttctttttatgaagaaagtgaaaaagtcttaagccctgatttagtgaataaatatgaaatatcactaactccaggtcagaaagaaacatatcaggcaagtatgtctccaaagactgaatacttaggcattgtcgcagcgtttcgagatattgaaaattcaaattggcgacaagtcattgaagtggataagaccggttacaacacctatcaaattctgttagaagatctgtctttggtcgtaaaacccggg
③将纯化的tssj基因与peasy-t1simple克隆载体连接,转入至dh5α感受态细胞中,继而通过m13f/r为引物的pcr扩增和smaⅰ酶切鉴定,获得重组转化细菌pt1-tssj;
④用质粒提取试剂盒提取pt1-tssj重组质粒,而后对重组质粒进行smaⅰ酶切、纯化,获得两侧带smaⅰ酶切位点的tssj基因;酶切反应体系为:pt1-tssj重组质粒18μl,10×buffer5μl,smaⅰ内切酶2μl,ddh2o25μl;
2)tssj基因真核表达载体(pctssj)的构建
①用smaⅰ内切酶对真核表达质粒pcn3进行酶切,酶切体系与pt1-tssj重组质粒酶切体系相同,将酶切混合物放置于30℃水浴2h,而后加入1μlciap酶,37℃水浴2h,再通过琼脂糖凝胶电泳分离目的条带,最后胶回收获得目的条带;
②将酶切后回收的tssj片段和pcn3质粒在t4连接酶的作用下16℃连接16h,连接体系如下:酶切目的片段7.5μl,pcn3载体片段1μl,t4连接酶0.5μl,buffer1μl,然后将连接产物pctssj转化进入大肠杆菌dh5α感受态中;
③挑取单菌落至10μl的ddh2o中,充分混匀,取1μl作为模板,通过载体上的上游引物cn-f1:5’-cttgcgtttctgataggcaccta-3’,和目的片段的下游引物tssj-r:5’-cccgggcttttacgaccaaagacagat-3’,进行pcr检测,筛选pctssj重组转化大肠杆菌;
④将检测正确的菌落,取菌悬液加入5mllb培养基,37℃,振荡培养过夜,而后按照omega的质粒提取试剂盒提取质粒,获得真核表达质粒载体pctssj;
3)乳酸乳球菌f3传递重组dna疫苗pctssj/f3构建
①乳酸乳球菌f3感受态制备
将实验室前期分离的乳酸乳球菌f3接种至gm17培养液中,30℃、180rpm振荡过夜培养;按体积比2-3%的接种量转接溶液ⅰ中,30℃、180rpm振荡培养至od600约为0.4-0.9时,离心收集菌体;再用30ml溶液ⅱ洗涤细胞2次,离心去上清后用1ml溶液ⅱ悬浮细胞,获得感受态乳酸乳球菌f3;取40μl分装于1.5ml离心管中,-80℃保存备用;
感受态制备液配方:溶液ⅰ:50ml2×m17+1ml50%葡萄糖+34ml50%蔗糖+10ml10%甘氨酸+10mlddh2o;溶液ⅱ:34ml50%蔗糖+10ml甘油+56mlddh2o。所述的葡萄糖、蔗糖、甘氨酸的浓度为均为质量比。
其中,m17为商品化培养基,成份如下(大豆胨5g;蛋白胨2.5g;酪蛋白胨2.5g;酵母浸粉2.5g;牛肉粉5g;乳糖5g;抗坏血酸钠0.5g;β-甘油磷酸钠19g;mgso40.25g;琼脂12.75g;蒸馏水1000ml,ph7.0~7.4;121℃,15min灭菌)
②pctssj质粒转入乳酸乳球菌f3
取1μlpctssj质粒与40μl乳酸乳球菌f3感受态细胞混合,冰浴10min,转入预冷的0.2cm电转杯中,电转化条件为:电压2400v、电阻200ω、电泳25μf;电击后加入sgm17培养液,冰上放置5min,将电转杯中的混合液转入1.5ml离心管中,30℃静置培养2-3h,离心去掉部分上清液,轻轻混匀菌体,将全部菌液涂布在含有amp和caco3的固体mrs培养基;30℃静置培养18-24h。
③乳酸乳球菌f3传递重组dna疫苗pctssj/f3的筛选与鉴定
挑取单菌落至含amp的mrs培养基中,30℃条件下,180rpm振荡过夜培养;提取重组益生菌质粒,取1μl作为模板,以上游引物cn-f1:5’-cttgcgtttctgataggcaccta-3’和下游引物cn-r1:5’-tgcgggcctcttcgctatt-3’,进行pcr检测,筛选获得益生菌传递重组dna疫苗。
本发明还提供一种将上述疫苗制备成口服疫苗的方法,所述方法具体步骤如下:
①将重组的乳酸乳球菌pctssj/f3至含amp的gm17培养液中,30℃、180rpm振荡过夜培养至od600在0.8左右;离心后用pbs重悬至浓度为108cfu/ml。
②取适量1.5%的食品级海藻酸钠溶液与重组的乳酸乳球菌pctssj/f3充分混合,将混合溶液缓慢滴加食品级液体石蜡(含乳化剂span-80和硬脂酸镁),使液体石蜡的终浓度为1.8%,1800r/min搅拌,待充分乳化后,将10%的cacl2溶液加入乳化好的海藻酸钠细菌混合物中,边加边均匀搅拌,逐步钙化形成微球。
③8000r/min离心5min收集沉淀,用pbs缓冲液洗涤3次后,再用相同缓冲液重悬。
④将微球悬液与鱼用饲料混合制备成含益生菌数目为1010/g的口服疫苗,在空调房中晾干,置于4℃保存备用。
实施例2:重组乳酸乳球菌pctssj/f3口服疫苗对布氏鲳鲹免疫保护效应分析
(1)将重组乳酸乳球菌pctssj/f3和真核空载体重组乳酸球菌pcn3/f3分别接种至含amp的gm17培养液中,原始分离的乳酸乳球菌f3接种至gm17培养液中,分别于恒温摇床(30℃、180rpm)中过夜培养至浓度od600分别为0.72、0.74和0.85。
(2)离心后用pbs将各组菌重悬至浓度为108cfu/ml。取适量1.5%的食品级海藻酸钠溶液与各菌株充分混合,将混合溶液缓慢滴加食品级液体石蜡(含乳化剂span-80),至液体石蜡终浓度为1.8%,1800r/min搅拌,待充分乳化后,将10%的cacl2溶液加入乳化好的海藻酸钠细菌混合物中,边加边均匀搅拌,逐步钙化形成微球,此后8000r/min离心5min收集沉淀,用pbs缓冲液洗涤3次后,再用相同缓冲液重悬。
(3)将这些微球与布氏鲳鲹专用配合饲料混合制备成含菌数目为1010/g的口服疫苗,在空调房中晾干,置于4℃保存备用。
(4)在4月份哈维氏弧菌高发前期,用制备的重组乳酸乳球菌pctssj/f3口服疫苗、真核空载体重组乳酸球菌pcn3/f3、原始分离的乳酸乳球菌f3及商品饲料(对照组)免疫布氏鲳鲹幼鱼(约10g),每天每条鱼投喂量为0.1g,连续投喂3周,自第4周投喂正常配合饲料。
(5)在第4周、和8周分别随机取各组布氏鲳鲹90条鱼,各投喂组随机分成3个平行组,每组30条鱼。每条鱼注射100μl哈维氏弧菌gdh11385(1×108cfu/ml)进行攻毒,记录攻毒两周各实验组布氏鲳鲹的死亡情况,对病鱼进行病原分离,计算相对死亡保护率(rps)。
rps=[1-(%口服疫苗投喂组死亡率/%商品饲料投喂组死亡率)]×100
(6)经统计,投喂重组乳酸乳球菌pctssj/f3口服疫苗组、真核空载体重组乳酸球菌pcn3/f3组和原始分离的乳酸乳球菌f3组布氏鲳鲹第4周的相对保护效应分别是69.67%、51.29%和51.47%,第8周的相对保护效应分别是71.41%、50.00%和47.22%。结果表明重组乳酸乳球菌pctssj/f3口服疫苗能够显著提高布氏鲳鲹对哈维氏弧菌的抵抗力。
实施例3:重组乳酸乳球菌pctssj/f3口服疫苗对布氏鲳鲹免疫系统刺激效应分析
(1)非特异性免疫指标检测
①于投喂实验开始后1、2、3、4、6、8周分别取各投喂组布氏鲳鲹3条,取头肾,用南京建成试剂盒检测呼吸爆发(nbt)、超氧化物歧化酶(sod)和酸性磷酸酶(acp)活性。取布氏鲳鲹全血,制备血清后,测定溶菌酶(lzm)活性。
②如图2所示,各投喂组头肾rb、sod和acp活性结果表明,投喂重组乳酸乳球菌pctssj/f3口服疫苗组在前期显著引起机体免疫反应,随后恢复正常,血清lzm刺激反应相对滞后,在第4周与对照组差异显著,但同样随后恢复正常。
(2)酶联免疫吸附(elisa)检测
①于投喂实验开始后1、2、3、4、5、6、7、8周分别随机取对照组和投喂重组乳酸乳球菌pctssj/f3口服疫苗组布氏鲳鲹3条,取其全血,制备血清后,检测elisa活性。
②自第2周开始,投喂重组乳酸乳球菌pctssj/f3口服疫苗组elisa活性即显著高于对照组(图3)。
序列表
<110>海南大学
<120>益生菌传递的鱼用哈维氏弧菌口服dna疫苗的制备及应用
<160>5
<170>siposequencelisting1.0
<210>1
<211>390
<212>dna
<213>哈维氏弧菌gdh11385(vibrioharveyigdh11385)
<400>1
cccgggatggacccatattcagatttagaaataacagcaaatcacaatattaaccctgac60
tccaatggtaggccatcccctgtagtcgtgtatgcttttgagttaacatcaaataccctt120
tttgaaagtcaggattttttttctttttatgaagaaagtgaaaaagtcttaagccctgat180
ttagtgaataaatatgaaatatcactaactccaggtcagaaagaaacatatcaggcaagt240
atgtctccaaagactgaatacttaggcattgtcgcagcgtttcgagatattgaaaattca300
aattggcgacaagtcattgaagtggataagaccggttacaacacctatcaaattctgtta360
gaagatctgtctttggtcgtaaaacccggg390
<210>2
<211>28
<212>dna
<213>人工序列(artificialsequence)
<400>2
cccgggatggacccatattcagatttag28
<210>3
<211>27
<212>dna
<213>人工序列(artificialsequence)
<400>3
cccgggcttttacgaccaaagacagat27
<210>4
<211>23
<212>dna
<213>人工序列(artificialsequence)
<400>4
cttgcgtttctgataggcaccta23
<210>5
<211>27
<212>dna
<213>人工序列(artificialsequence)
<400>5
cccgggcttttacgaccaaagacagat27
- 还没有人留言评论。精彩留言会获得点赞!