检测创伤弧菌的RPA‑IAC引物及方法与流程
本发明涉及生物检测领域,特别涉及检测创伤弧菌的方法、引物及试剂盒。
背景技术:
创伤弧菌是一种带有荚膜的革兰氏阴性嗜盐弧菌,在海水养殖的牡蛎、虾和蟹等贝类、甲壳类水生动物中分布广泛,是流行程度、危害程度最高的食源性致病菌之一。人在生吃或未经充分加工的海产品,以及通过皮肤创口接触海水入血均可感染,并在短时间内出现败血症"蜂窝组织炎"出血性大疤,半数以上患者可因多脏器功能衰竭而死亡,因此创伤弧菌又被称为“海洋中的无声杀手”。
目前世界上大部分沿海国家都有创伤弧菌的致病报道,我国江浙、闽粤沿海以及台湾地区亦有较多的感染报道,更有数例因创伤弧菌感染引起的败血症患者,在3-4d内均出现腹腔内广泛性坏死、多器官功能衰竭而死亡的案例,是公众饮食健康的重大威胁之一,所以对创伤弧菌的检测在公共卫生上具有十分重要的意义。
目前,对创伤弧菌的检测仍主要依靠传统方法,即首先利用选择性培养基增菌,进而结合生化及血清学方法进行鉴定。传统方法检测结果准确,但是存在检测效率低、检测目标单一、灵敏度低且耗时长、操作繁琐等不足。为满足致病菌快速检测的要求,发展了酶联荧光免疫检测法(vidas-chl)、酶免疫法(eia)、聚合酶链式反应(pcr)、胶体金试纸条法、api生化鉴定试纸条法、环介导恒温扩增(lamp)技术和实时荧光pcr等方法。其中,vidas-chl法、eia法、胶体金试纸法和api法均存在特异性差、灵敏度低等缺陷,而没有得到广泛应用;lamp法,作为一种新兴的检测方法,尽管极大地提高了检测效率,又降低了检测成本,但是产生的假阳性率较高。pcr技术作为一种高度灵敏、快速简便的检测方法在诸多领域得到广泛应用,尤其在病原体检测方面取得了革命性的成果,成为核酸快速检测的一个金标准,并在此基础之上,又发展了dna探针技术、实时荧光pcr技术和pcr结合变性高效液相色谱(dhplc)技术等,而pcr引物的设计成为了制约该类检测方法成败的关键性因素,常规的pcr引物设计,不仅需要反复比对引物的特异性,而且需要优化引物的各项参数与反应条件,尤其是退火温度更是进行反复优化,以防止非特异性扩增,在这些条件的制约下选取的引物极易影响扩增的有效性和特异性。此外,荧光检测设备普遍售价偏高,也在一定程度上限制了这类检测方法的推广应用。
技术实现要素:
本发明要解决的技术问题是提供一种灵敏、准确、简便和快速的基于rpa-iac技术的检测创伤弧菌的方法,本发明还提供了用于该方法的特异性好、灵敏度高、检测时间短、不需要特殊的仪器和适用范围广的rpa引物及内标扩增序列和对应的检测试剂盒。
为了解决上述技术问题,本发明通过如下技术方案实现:
本发明第一方面提供了引物对和内标扩增序列,所述引物对包含seqidno:1所示的核苷酸序列和seqidno:2所示的核苷酸序列,所述内标扩增片段包含seqidno:3所示的核苷酸序列。
本发明第二方面提供了所述的引物对和内标扩增序列在制备检测或辅助检测创伤弧菌的产品中的应用;
在一优选例中,所述制备检测或辅助检测创伤弧菌的产品包括:制备检测或辅助检测生物样品是否感染创伤弧菌的产品,以及制备检测或辅助检测病原菌为或候选为创伤弧菌的产品。
本发明第三方面提供了一种试剂盒,包括所述的引物对和包含有所述的内标扩增序列的质粒。
在一优选例中,所述的试剂盒还包括rpa恒温扩增试剂。
在一优选例中,所述rpa恒温扩增试剂包括来自twistdx公司的rpa扩增试剂盒twistampbasickits所包含的试剂。
在一优选例中,还包括dna提取试剂。
在一优选例中,所述dna提取试剂包括来自天根生化科技有限公司的货号为dp432的动物基因组dna提取试剂盒所包含的试剂。
在一优选例中,所述dna提取试剂还包括来自天根生化科技有限公司货号为dp302的细菌基因组dna提取试剂盒所包含的试剂。
在一优选例中,还包括阳性对照和阴性对照。
本发明第四方面提供了所述的试剂盒在检测或辅助检测创伤弧菌,或制备检测或辅助检测创伤弧菌的产品中的应用。
在一优选例中,所述检测或辅助检测创伤弧菌包括:检测或辅助检测生物样品是否感染创伤弧菌,以及检测或辅助检测病原菌是否为或候选为创伤弧菌。
在一优选例中,所述制备检测或辅助检测创伤弧菌的产品包括:制备检测或辅助检测生物样品是否感染创伤弧菌的产品,以及制备检测或辅助检测病原菌为或候选为创伤弧菌的产品。
本发明第五方面提供了一种检测或辅助检测创伤弧菌的rpa-iac方法,包括使用所述的引物对和包含有所述的内标扩增序列的质粒或所述试剂盒的步骤。
在一优选例中,所述检测或辅助检测创伤弧菌包括:检测或辅助检测生物样品是否感染创伤弧菌,以及检测或辅助检测病原菌是否为或候选为创伤弧菌。
在一优选例中,所述的方法包括如下步骤:
1)rpa-iac扩增
以生物样品或病原菌含有的dna为模板与所述的引物对和包含有所述的内标扩增序列的质粒或所述试剂盒进行rpa扩增。
2)根据rpa-iac扩增的结果判断生物样品是否感染创伤弧菌,或病原菌是否为或候选为创伤弧菌。
任选的,在步骤1)之前还包括在生物样品或病原菌中提取dna的步骤。
在一优选例中,所述在生物样品或病原菌中提取dna是采用天根生化科技有限公司的货号为dp432的动物基因组dna提取试剂盒或天根生化科技有限公司货号为dp302的细菌基因组dna提取试剂盒进行。
在一优选例中,所述rpa-iac扩增的结果判断的标准为:
若所述rpa-iac扩增得到的扩增产物仅有大小为234bp的目标基因片段,或同时拥有大小分别为334bp、234bp的内标扩增片段和目标基因片段,则判定为生物样品感染创伤弧菌,或病原菌为或候选为创伤弧菌;若所述rpa扩增得到的扩增产物只有大小为334bp的内标扩增片段,未含有大小为234bp的目标基因片段,则判定为生物样品未感染创伤弧菌,或病原菌不为或候选不为创伤弧菌;若所述rpa扩增得到的扩增产物未含有大小为334bp的内标扩增片段,未含有大小为234bp的目标基因片段,判定为反应为假阴性,需要重新进行检测。
在一优选例中,所述rpa-iac扩增的反应体系如下:
含有冻干酶粉的0.2mltwistamp反应管
再水化缓冲液29.5μl
seqidno:1和seqidno:2所示的引物各2μl,引物的终浓度均为0.4μmol/l
包含有seqidno:3所示的内标扩增序列的质粒1.83×103copies
模板dna50ng
醋酸镁溶液2.5μl,浓度为280mmol/l
去离子水补足至50μl;
在一优选例中,所述rpa-iac扩增的反应条件如下:所述rpa-iac扩增的温度为37℃,时间为40min。
本发明第六方面提供了一种筛选创伤弧菌的系统,包括:
核酸提取装置,所述核酸提取装置用于提取所述生物样品或病原菌中的核酸样本;
rpa-iac扩增装置,所述rpa-iac扩增装置与所述核酸提取装置相连,适用于所述的引物对或所述试剂盒对所述核酸样本进行rpa-iac扩增;
判断装置,所述判断装置与所述rpa-iac扩增装置相连,以便基于rpa-iac扩增的结果,判断所述生物样品是否感染创伤弧菌,或病原菌是否为或候选为创伤弧菌。
在一优选例中,所述rpa-iac扩增的反应体系如下:
含有冻干酶粉的0.2mltwistamp反应管
再水化缓冲液29.5μl
seqidno:1和seqidno:2所示的引物各2μl,引物的终浓度均为0.4μmol/l
包含有seqidno:3所示的内标扩增序列的质粒,1.83×103copies
模板dna50ng
醋酸镁溶液2.5μl,浓度为280mmol/l
去离子水补足至50μl;
任选的,所述rpa-iac扩增的反应条件如下:所述rpa-iac扩增的温度为37℃,时间为40min。
本发明的生物样品为血液、细胞、组织等,或混杂了血液、细胞、组织等的食物等等;而病原菌则是一种纯菌种或至少二种以上的菌种的混合。
本发明涉及的“内标扩增片段”是添加到pcr反应体系中用以指示假阴性现象的一段人工构建dna序列或者是一段致病菌的保守基因序列。扩增内标作用的主要原理是:将扩增内标添加到pcr反应体系中,使之与目的基因进行共同扩增,如果在反应体系中存在一些抑制因素,则扩增内标和目的基因的扩增反应都将受到抑制,从而达到指示pcr反应假阴性的目的。
本发明的有益效果包括:
(1)本发明针对创伤弧菌设计特异性rpa-iac引物,建立了创伤弧菌rpa-iac检测方法,可对创伤弧菌进行定性检测。
(2)本发明的扩增内标序列与创伤弧菌基因组和人类基因组均非同源,可在确保目标序列扩增效率的同时有效规避检测假阴性和操作人员个体核酸干扰检测的发生;。
(3)本发明针对创伤弧菌仅设计了一对引物即可完成扩增,省去了复杂的引物设计过程;本发明的引物扩增只需要37℃下恒温反应即可,不需要特殊的热循环设备;反应时间仅需40min,检测时间短;不像lamp产物的弥散带,rpa-iac扩增产物根据引物设计位点具有特定大小的条带,其结果易于判断。
(4)本发明的rpa-iac扩增引物特异性好、灵敏度高且适用范围广。
(5)本发明建立的创伤弧菌rpa-iac检测方法,灵敏、准确、简便和快速,对进出口相关货物及产品检验检疫具有指导意义。
附图说明
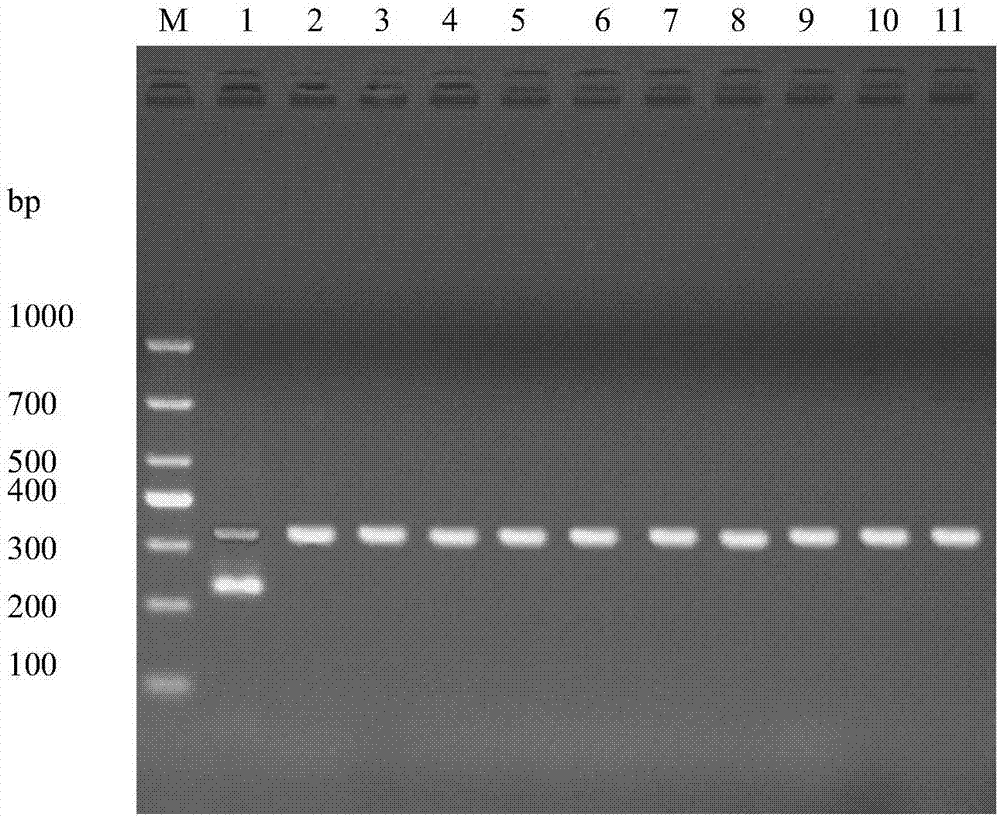
图1为本发明实施例4中rpa-iac引物对的特异性试验电泳检测结果。其中m为markerdl1000,1:创伤弧菌;2:拟态弧菌;3:副溶血弧菌;4:河流弧菌;5:溶藻弧菌;6:霍乱弧菌;7:哈维氏弧菌;8:沙门氏菌;9:大肠杆菌;10:金黄色葡萄球菌;11:单增李斯特菌。
图2为本发明实施例5中rpa-iac扩增的灵敏度试验电泳检测结果。其中m为markerdl1000,1-6:创伤弧菌模板量依次为100ng、10ng、1ng、0.1ng、0.01ng和0.001ng,扩增内标的用量均为1.83×103copies。
图3为本发明实施例5中rpa扩增的灵敏度试验电泳检测结果。其中m为markerdl1000,1-6:创伤弧菌模板量依次为100ng、10ng、1ng、0.1ng、0.01ng和0.001ng。
具体实施方式
除非特殊说明,本发明所用术语具有本发明所属领域中的一般含义。
下面参考具体实施例和附图,对本发明进行说明,需要说明的是,这些实施例仅仅是说明性的,而不能理解为对本发明的限制。实施例中未注明具体技术或条件的,均按照常规实验条件,如sambrook等分子克隆实验手册(sambrookj&russelldw,molecularcloning:alaboratorymanual,2001),或按照制造厂商说明书建议的条件。所用试剂或仪器未注明生产厂商者,均为可以通过市购获得的常规产品。
以下实施例中使用的副溶血弧菌、霍乱弧菌、溶藻弧菌、创伤弧菌、拟态弧菌、河流弧菌、哈维氏弧菌、大肠杆菌、金黄色葡萄球菌、沙门氏菌和单增李斯特菌均由汕头出入境检验检疫局提供。
实施例1
本实施例提供了rpa引物对和内标扩增序列及其应用。
rpa引物对的筛选方法为:针对创伤弧菌gryb基因(genbankid:cp012739.1),设计了多条rpa引物并进行了大量筛选,综合其特异性、灵敏度、引物与引物之间的作用,以及所使用的各引物与rpa扩增试剂盒的适配性,最终筛选出特异性好、重复性好且灵敏度高的如下可检测创伤弧菌的rpa引物对:
gryb-f:5′-gcttgaataccaccttcatacatgaagtgatc-3′(seqidno:1);
gryb-r:5′-tcatggtgtgcctgatgcaccgcttgctat-3′(seqidno:2);
内标扩增序列的设计和合成:为避免相近细菌的同源干扰和检测人员的个体核酸污染,经过综合分析考量,以高度保守的猪种属特异性基因β-actin的部分核酸序列为基础,两端分别连接引物序列gryb-f和gryb-r,形成如下所示序列大小为334bp的内标扩增序列:
gcttgaataccaccttcatacatgaagtgatcgttcgagaccttcaacaccccagccatgtacgtggccatccaggcggtgctgtccctgtacgcctctggccgcaccactggcatcgtgatggactccggagacggggtcacccacacggtgcccatctacgaggggtacgccctgccccacgccatcctgcgtctggacctggctggccgggacctgaccgactacctcatgaagatcctgacggagcggggctacagcttcaccaccacggccgagcgggagatcgtgcgggacatcaaggatagcaagcggtgcatcaggcacaccatga(seqidno:3)
上述seqidno:3中,大写序列为添加的gryb-f的原始序列和gryb-r的反向互补序列,小写序列272bp来源于genbank登录号为dq452569.1且标题为susscrofabetaactin(actb)gene,partialcds中489-760的一段序列,并经过理论和实践的同源性验证。
上述rpa-iac引物对和内标扩增序列的合成工作,均由上海生工生物技术有限公司完成。
在应用上,上述引物对和内标扩增序列可应用于制备检测或辅助检测创伤弧菌的产品,例如将内标扩增序列制备成含有此内标扩增序列的质粒,然后与引物对或其它结合起来成为检测或辅助检测创伤弧菌的产品,直接用来检测或辅助检测生物样品是否感染创伤弧菌。
实施例2
本实施例提供了一种试剂盒及其应用,所述试剂盒包括:
(1)seqidno:1、seqidno:2(均来自实施例1),以及含有如seqidno:3所示内标扩增序列的质粒;
(2)dna提取试剂;
(3)含冻干酶粉管;
(4)再水化缓冲液;
(5)醋酸镁溶液。
上述含冻干酶粉管、再水化缓冲液(rehydrationbuffer)和醋酸镁溶液(280mmol/l)为来自rpa扩增试剂盒twistampbasickits(twistdx公司,货号为tabas03kit)中的试剂。
所述dna提取试剂为来自货号为dp432的天根生化科技有限公司的动物基因组dna提取试剂盒中的试剂和来自货号为dp302的天根生化科技有限公司的细菌基因组dna提取试剂盒所包含的试剂。
所述含有如seqidno:3所示内标扩增序列的质粒的构建:将实施例1合成的内标扩增序列连接到通用载体puc57上,得到含有如seqidno:3所示内标扩增序列的阳性质粒。
上述内标扩增序列质粒的构建工作,采用常规t4噬菌体dna连接酶连接到通用载体puc57,并制备成阳性质粒冻干粉,在本发明中是由上海生工生物技术有限公司完成。按照拷贝数ncopies/μl=pcr片段的质量(g/μl)/(650g/mol×碱基数)×(6.02×1023)计算,将阳性质粒干粉稀释至1.83×103copies/μl
利用seqidno:1、seqidno:2和上述含有如seqidno:3所示内标扩增序列的质粒针对创伤弧菌进行rpa-iac扩增,得到的rpa-iac目标基因扩增产物和扩增内标产物的大小分别为234bp、334bp。
实验证明,上述dna提取试剂、含冻干酶粉管、再水化缓冲液、醋酸镁溶液,以及其与seqidno:1、seqidno:2和含有如seqidno:3所示内标扩增序列的质粒的联合使用,效果更加优越,具体表现在特异性强、重复性好、灵敏度高以及质控效果佳。
在应用上,上述试剂盒可应用于检测或辅助检测创伤弧菌上,例如检测或辅助检测生物样品是否感染创伤弧菌,或检测或辅助检测待测生物样品是否为或候选为创伤弧菌;还可以用来制备检测或辅助检测创伤弧菌的产品,例如制备检测或辅助检测生物样品是否感染创伤弧菌的产品,或制备检测或辅助检测病原菌为或候选为创伤弧菌的产品。
实施例3
本实施例提供了一种检测或辅助检测创伤弧菌的方法,例如检测或辅助检测生物样品是否感染创伤弧菌,或检测或辅助检测病原菌是否为或候选为创伤弧菌,该方法使用了实施例1的引物对或实施例2的试剂盒。
上述方法包括如下步骤:
步骤一:rpa-iac扩增
以生物样品或病原菌的dna为模板,添加实施例2中含有如seqidno:3所示内标扩增序列的质粒,采用seqidno:1和seqidno:2组成的引物对进行rpa-iac扩增,得到rpa-iac扩增产物,同时设置空白对照(模板为超纯水)。
rpa-iac扩增体系的配制方法如下:向含有冻干酶粉的0.2mltwistamp反应管中加入再水化缓冲液(rehydrationbuffer)29.5μl、上、下游引物(实施例1的gryb-f和gryb-r)各2μl(引物的终浓度均为0.4μmol/l),含有如seqidno:3所示内标扩增序列的质粒1μl(1.83×103copies),模板dna1ul(50ng),最后再加入醋酸镁溶液2.5μl(280mmol/l),用去离子水补足至50μl。
rpa-iac扩增反应条件:将上述rpa-iac扩增体系充分混匀,置于37℃的金属浴上反应40min,得到rpa-iac扩增产物。
步骤二:rpa-iac扩增产物的电泳检测
rpa-iac反应结束后,向上述扩增产物中加入50μl苯酚/氯仿(1:1)溶液,充分混匀后12000rpm离心2min,取5μl上清液于1.5%琼脂糖凝胶电泳,在凝胶成像系统上观察结果,并对rpa-iac扩增产物进行测序(在建立方法过程中均进行了测序验证,本文不再赘述)。
所述rpa-iac扩增的结果判断的标准为:
若所述rpa-iac扩增得到的扩增产物仅有大小为234bp的目标基因片段,或同时拥有大小分别为334bp、234bp的内标扩增片段和目标基因片段,则判定为含有创伤弧菌,提示所述生物样品感染创伤弧菌,或病原菌为或候选为创伤弧菌;若所述rpa-iac扩增得到的扩增产物只有大小为334bp的内标扩增片段,未含有大小为234bp的目标基因片段,则判定为不含有创伤弧菌,提示所述生物样品未感染创伤弧菌,或病原菌不为或候选不为创伤弧菌;若所述rpa-iac扩增得到的扩增产物未含有大小为334bp的内标扩增片段且未含有大小为234bp的目标基因片段,判定为反应假阴性,提示需要重新进行检测。
如果待测植株或待测病原菌还未提取dna,上述方法步骤(1)rpa-iac扩增之前还可以包括使用动物基因组dna提取试剂盒(购自天根生化科技有限公司,货号为dp432)或细菌基因组dna提取试剂盒(购自天根生化科技有限公司,货号为dp302)按照试剂盒说明书对生物样品或待测病原菌中的dna进行提取的步骤。
实施例4
本实施例对实施例1的引物对和内标扩增序列进行了有效性和特异性验证,所用的供试材料如下:副溶血弧菌、霍乱弧菌、溶藻弧菌、创伤弧菌、拟态弧菌、河流弧菌、哈维氏弧菌、大肠杆菌、金黄色葡萄球菌、沙门氏菌和单增李斯特菌,这些菌株为购买并经严格验证的标准菌株,均保存在汕头出入境检验检疫局检验检疫技术中心。
步骤一:基因组dna的提取
采用天根生化科技(北京)有限公司的货号为dp302的细菌基因组dna提取试剂盒按照试剂盒说明书分别提取溶藻弧菌、创伤弧菌、拟态弧菌、河流弧菌、哈维氏弧菌、大肠杆菌、金黄色葡萄球菌、沙门氏菌和单增李斯特菌的基因组dna。
步骤二:rpa-iac扩增
采用各种基因组dna模板:
组1以创伤弧菌的基因组dna混合物为模板(阳性对照)。
组2以拟态弧菌的基因组dna为模板。
组3以副溶血弧菌的基因组dna为模板。
组4以河流弧菌的基因组dna为模板。
组5以溶藻弧菌的基因组dna为模板。
组6以霍乱弧菌的基因组dna为模板。
组7以哈维氏弧菌的基因组dna为模板。
组8以沙门氏菌的基因组dna为模板。
组9以大肠杆菌的基因组dna为模板。
组10以金黄色葡萄球菌的基因组dna为模板
组11以单增李斯特菌的基因组dna为模板。
分别以组1-组11为模板,进行rpa-iac扩增,rpa-iac扩增的方法同实施例3的步骤一。
步骤三:rpa-iac扩增产物的电泳检测
rpa-iac扩增产物的电泳检测的方法同实施例3的步骤二。
结果分析:
结果如图1所示,组1-组11分别对应泳道1-11,泳道1显示在334bp和234bp处均有扩增条带,根据实施例3的判断标准,为阳性,即顺利检出创伤弧菌,其余泳道2-泳道11显示只有在334bp处有扩增条带,根据实施例3的判断标准,这就排除了假阴性可能性,进一步提高了结果的可靠性。综上,上述阳性判定和阴性判定结果均准确且所有组的扩增内标均成功扩增,由此证明本发明实施例1的引物对和内标扩增序列具有有效性、高特异性和良指示性;进一步的,本发明基于引物对和内标扩增序列及试剂盒建立的检测或辅助检测创伤弧菌的方法能够准确的对创伤弧菌进行检测。
实施例5
本实施例对实施例1的引物对和内标扩增序列进行了灵敏度验证,并与不添加扩增内标(即不添加实施例2中含有如seqidno:3所示内标扩增序列的质粒)进行比较,所用的供试材料如下:创伤弧菌,此菌株为购买并经严格验证的标准菌株,保存于汕头出入境检验检疫局检验检疫技术中心。
步骤一:基因组dna的提取
采用天根生化科技(北京)有限公司的货号为dp302的细菌基因组dna提取试剂盒按照试剂盒说明书分别提取创伤弧菌的基因组dna,并将得到的基因组dna进行10倍梯度稀释,制备得到不同浓度的创伤弧菌的基因组dna。
步骤二:rpa扩增和rpa-iac扩增
采用不同浓度的创伤弧菌的基因组dna作为模板:
组1:以100ng/μl的创伤弧菌基因组dna(1μl)为模板。
组2:以10ng/μl的创伤弧菌基因组dna(1μl)为模板。
组3:以1ng/μl的创伤弧菌基因组dna(1μl)为模板。
组4:以0.1ng/μl的创伤弧菌基因组dna(1μl)为模板。
组5:以0.01ng/μl的创伤弧菌基因组dna(1μl)为模板。
组6:以0.001ng/μl的创伤弧菌基因组dna(1μl)为模板。
分别以组1-组6为模板,分别进行rpa扩增及rpa-iac扩增,rpa-iac扩增的方法同实施例3的步骤一,rpa扩增与rpa-iac扩增的区别为扩增体系里不添加实施例2中含有如seqidno:3所示内标扩增序列的质粒。
步骤三:rpa扩增产物和rpa-iac扩增产物的电泳检测
二者扩增产物的电泳检测的方法同实施例3的步骤二。
结果分析:
rpa-iac扩增的结果如图2所示,组1-4均在234bp处有条带且组2-6在334bp处有条带,这说明组1-6的结果均有效且组5-组6无假阴性可能性,同时也说明本发明实施例1的引物对和内标扩增序列具有较高的灵敏度,可检测出样品中仅含有0.1ng的微量dna;rpa扩增的结果如图3所示,灵敏度结果同rpa-iac扩增。综上可知添加扩增内标并没有降低检测的灵敏度。
对比例1
实际上,在寻求到本发明的引物对之前,尝试了本发明的包含有内标扩增序列的质粒(来自实施例2)与非常多的引物对组合,在本对比例中只摘取其中之若干进行阐述,其余不予赘述,具体为:
利用实施例1的引物对以及用primerpremier5.0软件设计并选取其中排分靠前的引物对,用实施例3建立的检测或辅助检测创伤弧菌的方法对50份出口海产品进行了检测,同时参考食品卫生微生物学检验国家标准(标准号:gb4789.7-2013)中对这50份海产品进行了创伤弧菌的分离和系统生化鉴定,灵敏度试验的取样和模板浓度梯度设置均按照实施例5进行,检测结果如表2所示。
表2
结果显示:鉴于存在包含有内标扩增序列的质粒的情况下本发明引物对的检测结果与参考标准和已公开的检测方法的检测结果完全一致,这说明本发明引物对组合特异性强、灵敏度高且重复性很好,而采用引物设计软件随机选取的若干种引物的组合则或多或少的存在特异性不强、灵敏度不高、重复性不好以及干扰扩增内标等各种缺陷。
对比例2
本对比例提供了不同的试剂与本发明的引物对(来自实施例1)、包含有内标扩增序列的质粒(来自实施例1)组合在一起检测创伤弧菌时的检测结果对比。
各种试剂与本发明的引物对和包含有内标扩增序列的质粒组合:
组合1:本发明引物对和包含有内标扩增序列的质粒+某市售动物基因组dna提取试剂盒1+某市售rpa扩增试剂盒1
组合2:本发明引物对和包含有内标扩增序列的质粒+某市售动物基因组dna提取试剂盒2+某市售rpa扩增试剂盒2
组合3:本发明引物对和包含有内标扩增序列的质粒+某市售动物基因组dna提取试剂盒3+某市售rpa扩增试剂盒3
本发明组合:本发明引物对和包含有内标扩增序列的质粒+来自天根生化科技有限公司货号为dp432的动物基因组dna提取试剂盒所包含的试剂+来自twistdx公司的货号为tabas03kit的rpa扩增试剂盒twistampbasickits所包含的试剂。
利用上述本发明组合检测创伤弧菌时,其方法采用实施例3中的方法进行。灵敏度试验的取样和模板浓度梯度的设置均按照实施例5进行。
利用上述组合1、组合2和组合3检测创伤弧菌时,凡是用到市售试剂盒,均按照其试剂盒说明书进行操作进行,其余条件均同本发明组合。同时设标准已公开的对比方法(见对比例1)进行检测。
受检样品同对比例1中的50份出口海产品。
检测结果如表3所示。
表3
结果显示:本发明引物对、包含有内标扩增序列的质粒和各特定试剂的组合的检测结果与欧盟标准和已公开的检测方法的检测结果完全一致,这说明本发明引物对、内标扩增序列和各特定试剂的组合所组成的试剂盒具有特异性强、灵敏度高且重复性好的优势,而在存在内标扩增序列的情况下采用本发明引物对及与其它随机选取的若干试剂的组合则或多或少的存在特异性不强、灵敏度不高和重复性不好的各种缺陷。
虽然,上文中已经用一般性说明及具体实施方案对本发明作了详尽的描述,但在本发明基础上,可以对之作一些修改或改进,这对本领域技术人员而言是显而易见的。因此,在不偏离本发明精神的基础上所做的这些修改或改进,均属于本发明要求保护的范围。
sequencelisting
<110>广东出入境检验检疫局检验检疫技术中心;汕头出入境检验检疫局检验检疫技术中心
<120>检测创伤弧菌的rpa-iac引物及方法
<130>17cn
<160>3
<170>patentinversion3.3
<210>1
<211>32
<212>dna
<213>artificial
<220>
<223>seqidno:1
<400>1
gcttgaataccaccttcatacatgaagtgatc32
<210>2
<211>30
<212>dna
<213>artificial
<220>
<223>seqidno:2
<400>2
tcatggtgtgcctgatgcaccgcttgctat30
<210>3
<211>334
<212>dna
<213>artificial
<220>
<223>seqidno:3
<400>3
gcttgaataccaccttcatacatgaagtgatcgttcgagaccttcaacaccccagccatg60
tacgtggccatccaggcggtgctgtccctgtacgcctctggccgcaccactggcatcgtg120
atggactccggagacggggtcacccacacggtgcccatctacgaggggtacgccctgccc180
cacgccatcctgcgtctggacctggctggccgggacctgaccgactacctcatgaagatc240
ctgacggagcggggctacagcttcaccaccacggccgagcgggagatcgtgcgggacatc300
aaggatagcaagcggtgcatcaggcacaccatga334
- 还没有人留言评论。精彩留言会获得点赞!