丹参提取物在制备蛋白酪氨酸磷酸酶1B抑制剂及预防和/或治疗2型糖尿病药物中的应用的制作方法
本发明属于医药技术领域,具体涉及丹参提取物在制备蛋白酪氨酸磷酸酶1b抑制剂及预防和/或治疗2型糖尿病药物中的应用。
背景技术:
糖尿病是一种严重威胁人类健康的代谢性疾病,以高血糖为其主要生理特征,主要可分为1型糖尿病(t1dm)和2型糖尿病(t2dm)。其中,1型糖尿病是由于胰岛素缺乏所导致,约占糖尿病人群的5~10%,而t2dm则主要是由胰岛素抵抗引起,是最常见的类型,约占糖尿病人群的90%以上。且常伴随着多种严重的并发症,如尿毒症、肾衰竭、神经病变以及心血管疾病等。
近些年来,多种有效的治疗途径已被用于临床t2dm的治疗,一些重要的药物作用的生物学靶标:蛋白酪氨酸磷酸酶1b(proteintyrosinephosphatases1b,ptp1b)、胰高血糖素样肽-1(glucagon-likepeptide1,glp-1)、二肽基肽酶iv(dipeptidylpeptidase4,dpp-4)、α-葡萄糖苷酶(α-glucosidase,ag)等。常用的一些临床用药如二甲双胍、格列本脲、阿卡波糖、伏格列波糖等。其中一条重要而有效的治疗策略为ptp1b抑制剂的开发。ptp1b在胰岛素和瘦素信号通路中发挥着非常重要的负调控作用,它与蛋白酪氨酸激酶共同维持着体内酪氨酸蛋白磷酸化的平衡。研究发现,ptp1b是通过介导er应激引起的胰岛素抵抗,这是发展胰岛素抵抗过程中尤为重要的代谢途径。因此,ptp1b抑制剂的研究开发可能通过减轻甚至逆转肥胖症患者的高血糖症,对于t2dm的治疗有着重要的研究和临床意义。
天然产物一直以来都是寻找发现治疗各类型疾病药物先导化合物的重要源泉,并取得了丰硕的研究成果,如川芎嗪、长春西汀等心血管药物,鬼臼毒素、紫杉醇等抗肿瘤药物均直接或间接来源于天然产物。因此,基于中药或天然产物中寻找发现针对特定蛋白靶标的活性药物先导物,具有极其重要的研究意义和开发价值。丹参(salviamiltiorrhizabge.),一种传统中药材,为唇形科鼠尾草属植物,主要以其根用药,具有活血祛瘀、消肿止痛、镇静安神等多种药用功效。在临床上,丹参已被用于心脑血管类疾病的治疗已有数百年,尤其在动脉粥样硬化、高血脂症、冠心病以及脑血管疾病等治疗中发挥着非常重要的作用。
根据丹参中化学成分的结构特点,主要可以分为两种类型,即脂溶性成分和水溶性成分。其中的脂溶性成分是以丹参酮为主要代表的二萜醌类化合物,而水溶性成分主要为酚酸类化合物,二者均是丹参发挥良好药效的主要物质基础。近年来,在化学成分、药代动力学及药理学等方面研究较多的水溶性成分主要包括丹参素、丹酚酸a(salvianolicacida)、丹酚酸b(salvianolicacidb)和丹酚酸c(salvianolicacidc)、丹酚酸a甲酯、异丹酚酸c,其它丹酚酸类化合物还包括丹酚酸d、e、f、g、h、i、咖啡酸、紫草酸、迷迭香酸等化合物。
许多药理学实验研究表明,丹酚酸类成分通过多种生物学机制来发挥药理作用,如抗血栓形成、抑制血小板聚集、抑制细胞内源性胆固醇合成、防止动脉粥样硬化斑块形成且具有很强的抗氧化作用,它可以清除自由基、减少自由基对机体的损伤、抑制脂质过氧化反应,并且影响细胞内钙离子浓度及atp酶活性等作用。
丹参的化学成分及其生物学活性方面聚焦了很多研究成果。其中典型的水溶性成分丹酚酸c和丹酚酸a表现出潜在的α-葡萄糖苷酶抑制活性。然而,据文献检索,目前仍基本没有相关文献报道丹参中的化学成分与ptp1b之间的相互关系,这方面的研究仍然相对不足。因此,对于丹参中的大多数化学成分,包括其中的丹酚酸类化合物以及丹参酮类成分,均需要进一步深入探讨并阐明其与ptp1b相互作用时的结合规律,以进一步从传统中药丹参中发现具有潜在生物活性的新型ptp1b抑制剂,为临床t2dm的预防和治疗提供具有潜在成药性的药物先导物。
技术实现要素:
本发明的目的在于提供丹参提取物在制备蛋白酪氨酸磷酸酶1b抑制剂及预防和/或治疗2型糖尿病药物中的应用,丹酚酸c(salvianolicacidc)、丹酚酸a(salvianolicacida)、异丹酚酸c(iso-salvianolicacidc)、丹酚酸a甲酯(salvianolicacidamethylester)作为蛋白酪氨酸磷酸酶1b(ptp1b)抑制剂可预防和/或治疗2型糖尿病(t2dm)及其相关并发症。
本发明采取的技术方案为:
丹参提取物在制备蛋白酪氨酸磷酸酶1b抑制剂药物中的应用。
进一步地,所述丹参提取物为丹酚酸c、丹酚酸a、异丹酚酸c或丹酚酸a甲酯。
本发明还提供了所述丹参提取物作为蛋白酪氨酸磷酸酶1b抑制剂在制备预防和/或治疗2型糖尿病药物中的应用;所述丹参提取物是通过抑制蛋白酪氨酸磷酸酶1b的活性来预防和/或治疗2型糖尿病的。
进一步地,所述丹参提取物为丹酚酸c、丹酚酸a、异丹酚酸c或丹酚酸a甲酯。
本发明还提供了一种蛋白酪氨酸磷酸酶1b抑制剂,所述蛋白酪氨酸磷酸酶1b抑制剂是以丹酚酸c、丹酚酸a、异丹酚酸c或丹酚酸a甲酯中的一种或任意多种作为有效成分制备的药物。
进一步地,所述药物的剂型为片剂、注射剂、栓剂、气雾剂、缓释制剂、微囊、控释制剂、脂质体或纳米制剂。
本发明通过分子、细胞和动物水平的评价方法,首次提供了丹参提取物丹酚酸c、丹酚酸a、异丹酚酸c或丹酚酸a甲酯可显著抑制蛋白酪氨酸磷酸酶1b的活性,进而提高葡萄糖摄取率,降低血浆中葡萄糖水平,可预防和/或治疗2型糖尿病。丹酚酸c、丹酚酸a、异丹酚酸c或丹酚酸a甲酯及其药物上可接受的成盐化产物可与药用常见辅料和载体结合,制备成t2dm药物的组合物,从而达到预防或治疗的效果。同时,上述药物可根据实际的需要选择合适的剂型,如片剂、注射剂、栓剂、气雾剂、缓释制剂、微囊、控释制剂、脂质体、纳米制剂等。
经体外酶动力学实验证明,丹酚酸c、丹酚酸a、异丹酚酸c或丹酚酸a甲酯均可以可逆性抑制蛋白酪氨酸磷酸酶1b(ptp1b),且ic50值分别为6.04±0.07μm、12.19±0.22μm、17.58±0.18μm、24.13±0.54μm。
荧光猝灭实验表明:丹酚酸c、丹酚酸a、异丹酚酸c或丹酚酸a甲酯可以与ptp1b结合并发生相互作用,且显著猝灭其内置基团荧光,内置基团主要为芳香氨酸残基phe、tyr、trp。
细胞模型实验表明:通过胰岛素诱导的胰岛素抵抗性hepg2细胞模型中,丹酚酸c、丹酚酸a、异丹酚酸c或丹酚酸a甲酯在待测浓度下均表现出显著性且浓度依赖性地提高葡萄糖摄取率。
动物模型实验表明:在链脲佐菌素(stz)诱导的大鼠糖尿病模型中,丹酚酸c、丹酚酸a、异丹酚酸c或丹酚酸a甲酯均可显著降低血浆中葡萄糖水平。
附图说明
图1为丹酚酸c(a)、丹酚酸a(b)、异丹酚酸c(c)或丹酚酸a甲酯(d)的化学结构式;
图2为丹酚酸c(sac)、丹酚酸a(saa)、异丹酚酸c(isac)或丹酚酸a甲酯(saam)和阳性对照药熊果酸(ua)对ptp1b的抑制活性曲线;
图3为丹酚酸c(a、b)和丹酚酸a(c、d)对ptp1b的抑制动力学lineweaver-burkplots评价;
图4为丹酚酸c(a)和丹酚酸a(b)对ptp1b的抑制可逆性评价;
图5为丹酚酸c(a)和丹酚酸a(b)对ptp1b的荧光猝灭效应;
图6为丹酚酸c(sac)、丹酚酸a(saa)、异丹酚酸c(isac)或丹酚酸a甲酯(saam)在胰岛素抵抗的hepg2细胞模型上葡萄糖摄取效应评价(###p<0.001vs2nbdg,*p<0.01,**p<0.05vsinsulin-2nbdg);
图7为丹酚酸c(sac)、丹酚酸a(saa)、异丹酚酸c(isac)或丹酚酸a甲酯(saam)对糖尿病大鼠的降糖作用评价(*p<0.01,**p<0.05vscontrol);
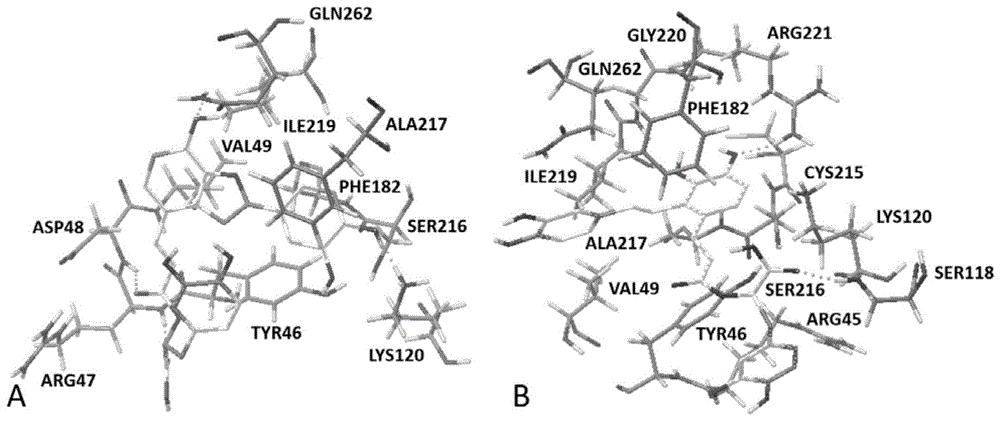
图8为丹酚酸c(a)、丹酚酸a(b)与ptp1b(pdbid:2qbq)的分子对接结果。
具体实施方式
下面通过具体实施例对本发明作进一步详细描述,但本发明的实施方式不限于此。
实施例1化合物丹酚酸c、丹酚酸a、异丹酚酸c或丹酚酸a甲酯对ptp1b的抑制活性评价
采用体外酶学实验对化合物丹酚酸c、丹酚酸a、异丹酚酸c或丹酚酸a甲酯进行ptp1b抑制活性评价。
1.1试剂与标准溶液的配制
(1)75mm磷酸缓冲液(pb,ph7.4):称取kh2po40.0956g,k2hpo40.6946g,edta1.862mg,用超纯水溶解并稀释至50ml。每次实验前新鲜配制,用于溶解稀释样品和其它试剂;
(2)ptp1b溶液:精密称取适量的ptp1b,用75mm的pb溶液溶解并配制为10u/ml的ptp1b工作液,用移液器吹匀酶溶液,置于冰上保存,待用;
(3)底物配制:精密称取适量4-nitrophenyl-phosphate(p-npp),加入75mmpb溶液溶解,配制成浓度为25mm的底物工作液,涡旋混匀1min,每次实验前新鲜配制;
(4)供试药物配制:精密称取待测药物适量,用dmso溶解配制为10mm的储备液,于-20℃避光保存。实验前用pb稀释至不同所需浓度(0~200μm),dmso含量小于0.1%。
1.2实验步骤
(1)在96孔板上加入不同浓度的待测样品溶液100μl,再加入0.1u/mlptp1b溶液50μl,并以相同体积的pb作为空白对照组,用已知的ptp1b抑制剂熊果酸(ursolicacid,ua)作为阳性对照组,每组平行设置3个复孔。将酶体系置于酶标仪上37℃孵育10min,于波长405nm处读数一次,并记录吸光度值。
(2)随后,向酶体系中加入50μl的底物p-npp(0.5mm)以启动酶反应,将微孔板置于酶标仪上37℃继续孵育30min,于波长405nm处读数一次,并记录吸光度值。
(3)待测化合物的ptp1b抑制活性根据如下公式计算:
抑制率(%)=[(c30–c0)–(s30–s0)]/(c30–c0)×100,
其中,c0和s0分别表示空白对照组和待测样品组在0min的吸光度值,c30和s30分别表示空白对照组和待测样品组在30min的吸光度值。
(4)数据处理:使用msexcel2013分析处理数据,并用graphpadprism6.0.2计算得到半数抑制浓度(ic50),ic50代表在所述实验条件下,ptp1b的活性被抑制50%时所需待测化合物的浓度。
1.3实验结果
应用体外酶学实验对化合物丹酚酸c、丹酚酸a、异丹酚酸c或丹酚酸a甲酯进行ptp1b抑制活性评价,其测定结果如图2所示。其中,阳性对照药熊果酸(ua)对ptp1b的抑制活性ic50值为10.11±0.12μm。化合物丹酚酸c(sac)、丹酚酸a(saa)、异丹酚酸c(isac)或丹酚酸a甲酯(saam)均表现出较好的ptp1b抑制活性,其ic50值分别为6.04±0.07μm、12.19±0.22μm、17.58±0.18μm和24.13±0.54μm。四者对ptp1b的抑制活性均表现出明显的浓度依赖性,随着待测物浓度的不断增加,其酶抑制活性也不断增大。
实施例2化合物丹酚酸c和丹酚酸a对ptp1b的抑制动力学测定
采用体外酶动力学实验判定化合物丹酚酸c和丹酚酸a对ptp1b抑制活性类型。
1.1试剂与标准溶液的配制
(1)75mm磷酸缓冲液(pb,ph7.4):称取kh2po40.0956g,k2hpo40.6946g,edta1.862mg,用超纯水溶解并稀释至50ml。每次实验前新鲜配制,用于溶解稀释样品和其它试剂;
(2)ptp1b溶液:精密称取适量的ptp1b,用75mm的pb溶液溶解并配制为10u/ml的ptp1b工作液,用移液器吹匀酶溶液,置于冰上保存,待用;
(3)底物配制:精密称取适量4-nitrophenyl-phosphate(p-npp),加入75mmpb溶液溶解,配制成浓度为25mm的底物工作液,涡旋混匀1min,每次实验前新鲜配制;
(4)供试药物配制:精密称取待测药物适量,用dmso溶解配制为10mm的储备液,于-20℃避光保存。实验前用pb稀释至不同所需浓度(0~200μm),dmso含量小于0.1%。
1.2实验步骤
(1)在96孔板上加入不同浓度的待测样品溶液100μl,再加入0.1u/ml的ptp1b溶液50μl,并以相同体积的pb作为空白对照组,每组平行设置3个复孔。将酶体系置于酶标仪上37℃孵育10min,于波长405nm处读数一次,并记录吸光度值。
(2)随后,向酶体系中加入50μl不同浓度的底物p-npp(0.05、0.1、0.15、0.2mm)以启动酶反应体系,于波长405nm处每隔30s读数一次共计7min,并记录吸光度值。
(3)数据处理:使用msexcel2013分析处理测定的实验数据以获得lineweaver-burkplots,酶反应体系的反应速率为δa/min。其中的竞争性抑制常数(ki,为抑制剂与ptp1b的结合平衡常数)和非竞争性抑制常数(kis,为抑制剂与ptp1b—底物复合物的结合平衡常数)均由lineweaver-burkplots二次计算获得。
1.3实验结果
酶动力学抑制类型评价实验测定结果如图3所示。由图3a可以看出,筛选得到的抑制剂丹酚酸c表现为混合竞争性抑制剂。表明它不仅可以和ptp1b结合,而且还可以与ptp1b—底物复合物结合。同时,根据图3b可以得知,丹酚酸c和ptp1b相互作用时的竞争性抑制常数ki为2.24μm,非竞争性抑制常数kis为8.97μm。由此可知,化合物丹酚酸c和ptp1b之间的结合亲和力要强于(约4倍)其与ptp1b—底物复合物之间的亲和力。由图3c可以看出,抑制剂丹酚酸a表现为竞争性抑制剂,它仅与ptp1b结合,且根据图3d可以得知,丹酚酸a和ptp1b相互作用时的竞争性抑制常数ki为22.79μm。
实施例3化合物丹酚酸c和丹酚酸a对ptp1b的抑制可逆性测定
1.1实验步骤
(1)在96孔板上加入不同浓度的待测样品溶液100μl,再加入不同浓度的(0.1~0.5u/ml)的ptp1b溶液50μl,并以相同体积的pb作为空白对照组,每组平行设置3个复孔。将酶体系置于酶标仪上37℃孵育10min,于波长405nm处读数一次,并记录吸光度值。
(2)随后,向酶体系中加入50μl的底物p-nitrophenylphosphate(p-npp)(0.5mm)以启动酶反应体系,于波长405nm处每隔30s读数一次共计10min,并记录吸光度值。
(3)数据处理:使用msexcel2013和graphpadprismv6.0综合分析处理测定获得的实验数据。
1.2实验结果
体外酶抑制可逆性评价实验结果表明,化合物丹酚酸c和丹酚酸a在不同酶液浓度下,随着待测物浓度的增加,所有曲线均相交通过原点位置,且曲线斜率呈现明显降低的趋势,这表明二者在抑制ptp1b酶时均表现出可逆性的抑制关系,其抑制可逆性如图4所示。
实施例4化合物丹酚酸c和丹酚酸a对ptp1b的荧光猝灭效应测定
1.1实验步骤
运用hitachif-7000(hitachi,japan)荧光分光光度计进行荧光猝灭实验测定,配备150w氙灯和1.0cm四面光滑的石英比色皿。具体设置参数为:荧光激发波长为280nm,发射波长为300到500nm,激发和发射狭缝宽度均为5nm,实验测试温度为室温。取浓度为0.1u/ml的ptp1b酶液3.5ml加入到比色皿中,再滴加受试化合物丹酚酸c或丹酚酸a,使其终浓度保持在0到20μm。待静置5min混合均匀后,测定其荧光值,如此往复进行测定多个待测物浓度下的荧光值。具体浓度点可参考:c(sac/sac)=0、2、3.98、5.96、7.94、9.9、11.86、13.81、15.75、17.68、19.61μm,从曲线a到k(a→k)。同时,设置缓冲液体系作为空白对照以在数据处理过程中扣除背景荧光值并校正。
1.2实验结果
荧光猝灭实验结果表明,随着化合物丹酚酸c和丹酚酸a浓度的不断增加,ptp1b的内置荧光值不断降低(a→k),表明二者均可以与ptp1b结合并发生相互作用,且显著猝灭ptp1b的内置基团荧光(主要为荧光发射团:芳香氨酸残基phe、tyr、trp),其荧光猝灭效应如图5所示。
实施例5化合物丹酚酸c、丹酚酸a、异丹酚酸c或丹酚酸a甲酯对胰岛素抵抗型hepg2(ir-hepg2)细胞进行葡萄糖摄取效应评价
1.1实验步骤
运用胰岛素抵抗(insulinresistance,ir)的hepg2细胞模型来考察化合物丹酚酸c、丹酚酸a、异丹酚酸c或丹酚酸a甲酯对葡萄糖摄取率的影响,以从细胞水平评价二者对ptp1b的抑制效应。使用荧光探针d-葡萄糖类似物2-[n-(7-nitrobenz-2-oxa-1,3-diazol-4-yl)amino]-2-deoxy-d-glucose(2-nbdg)作为葡萄糖示踪物。
使用gibco小牛血清、dmem培养基正常培养的hepg2分为空白对照组、模型组、阳性对照组、给药sac组、给药saa组。其中,空白对照组加入无血清培养基,模型组和给药组中均加入无血清培养基配置的胰岛素液(100nm),细胞正常培养12h,以建立胰岛素抵抗的hepg2细胞模型。实验设置6组平行孔,且重复三次。随后,用不同待测浓度含药的dmem培养基替换,并以rosigalitazone(1μm)作为阳性对照药,继续培养12h后,加入2-nbdg(40μm)继续培养30min,取上清,加入预冷的pbs洗涤细胞,并收集hepg2细胞。2-nbdg的荧光值用荧光分光光度计进行测定(激发波长λex=480nm,发射波长λem=528nm,室温测定)。
1.2实验结果
如图6所示,胰岛素诱导的hepg2细胞实验结果表明:与正常组相比,加入胰岛素诱导后,hepg2细胞摄糖能力显著性降低,说明造模成功并可用于后续实验数据测定和评价。与模型组相比,阳性对照药rosigalitazone能够显著性地提高胰岛素抵抗的hepg2细胞模型上葡萄糖的摄取。同时,化合物丹酚酸c和异丹酚酸c在浓度为2.5、5和10μm时也表现出显著性提高糖摄取率,且呈现出浓度依赖性的增加胰岛素刺激hepg2细胞中2-nbdg的摄取。丹酚酸a和丹酚酸a甲酯在三个待测浓度下(10、20和50μm)也表现出显著性且浓度依赖性地提高葡萄糖摄取率。
实施例6化合物丹酚酸c、丹酚酸a、异丹酚酸c或丹酚酸a甲酯对糖尿病大鼠的降糖作用评价
运用链脲佐菌素(streptozotocin,stz)诱导的糖尿病大鼠模型来考察化合物丹酚酸c和丹酚酸a对高浓度葡萄糖的降糖作用,以从整体动物水平评价二者的体内效应。
1.1实验步骤
sprague-dawley(sd)大鼠(160±20g)适应性饲养一周后,过夜禁食,链脲佐菌素(stz)溶解在柠檬酸盐缓冲液中,并按60mg/kg体重的剂量腹腔注射造模。48h后尾静脉取血使用血糖仪测定血糖浓度,其血糖水平在300-450mg/dl的大鼠被认定为是糖尿病大鼠,表示造模成功并用于后续实验评价。实验动物被分为三组,每组10只,分别为空白对照组、阳性对照组(二甲双胍,metformin)、给药sac组、saa组、isac组或saam组。药物给予剂量为100mg/kg体重的灌胃给药后,空白对照组给药同等剂量的生理盐水,分别于0、60、120、180、240、300min的时间点处取血测定其血糖水平。运用graphpadprismv6.0进行实验数据处理,以随着时间(min)的延长,血糖水平(mg/dl)的变化趋势作图。
1.2实验结果
如图7所示,动物实验结果表明:stz诱导的糖尿病大鼠其胰岛素严重匮乏,造成高血糖症(300-450mg/dl),远远超出正常水平。当给予阳性对照药二甲双胍后,随着时间的延长,能明显降低血糖水平。同样地,化合物丹酚酸c、丹酚酸a、异丹酚酸c或丹酚酸a甲酯均可显著降低血糖水平,表明二者均可用做调控胰岛素缺乏的糖尿病及其并发症的防治药物先导物。
实施例7化合物丹酚酸c和丹酚酸a与ptp1b相互作用分析
采用分子对接(moleculardocking)的方法探讨化合物丹酚酸c、丹酚酸a与ptp1b的相互作用方式
为了阐明化合物丹酚酸c和丹酚酸a与ptp1b可能存在的结合模式及相互作用位点,这里,我们采用分子对接的方法来探讨二者与ptp1b作用方式的分析。ptp1b(pdbcode:2qbq)由一条亚基构成,其中包含有两个个活性结构域:催化活性位点(cys215-arg221)和第二芳香结合位点(arg24、arg254、met258、gly259、gln262和gln266)。催化活性位点是产生催化作用的重要区域,残基cys215是催化中心。分析分子对接结果,我们根据其结合自由能和构象分析(bindingfreeenergy)确定,认为化合物与ptp1b结合自由能最低的对接构象为其优势构象,并对其作进一步分析。丹酚酸c、丹酚酸a和ptp1b分子对接结果如图8所示。由图可知,化合物丹酚酸c、丹酚酸a均结合于ptp1b的活性口袋处,且二者结构中大的共轭结构深入到结合口袋最里端的疏水区,从而发挥着对酶的良好抑制效应。同时,可以发现,丹酚酸c与氨基酸残基arg47、asp48、lys120、gln262之间形成了四个氢键相互作用。丹酚酸a与氨基酸残基ser118和arg221之间形成了两个氢键相互作用。其可观察到丹酚酸c和丹酚酸a结构中的芳香环与残基phe182和tyr46之间形成了face-to-face或者face-to-edge的pi-堆积作用。因此也可以看出,氢键的形成和疏水性相互作用等作用力的存在对于维系蛋白受体—配体复合物构象的稳定发挥着重要作用。
实施例8化合物丹酚酸a(saa)制剂的制备
(1)本发明的活性化合物saa的片剂
化合物saa2mg,淀粉88g,硬脂酸镁3g
制备工艺:取本发明的化合物saa过100目筛,加淀粉、硬脂酸镁混合均匀,制成颗粒,干燥,压片,即得。
(2)本发明的活性化合物saa的胶囊
化合物saa2mg,淀粉88g,硬脂酸镁3g
制备工艺:取本发明的化合物saa过100目筛,加淀粉、硬脂酸镁混合均匀,制成颗粒,干燥,装胶囊,即得。
(3)本发明的活性化合物saa的软胶囊
化合物saa10mg,大豆卵磷脂100g
制备工艺:取本发明的化合物saa,加大豆软磷脂,胶体磨混匀,抽真空,压制,即得软胶囊。
(4)本发明的活性化合物saa的冻干粉
化合物saa2g,亚硫酸钠4g,乙醇50ml,加水定容至1000ml;
制备工艺:取本发明的化合物saa分散在乙醇中,亚硫酸钠溶于水中,在超声或搅拌条件下将拿硫酸钠溶液逐渐加入,使成澄清透明溶液;补加水定容至足量;经0.22μm微孔滤膜过滤,冷冻干燥得到。
实施例9化合物丹酚酸c(sac)制剂的制备
(1)本发明的活性化合物sac的片剂
化合物sac2mg,淀粉88g,硬脂酸镁3g
制备工艺:取本发明的化合物sac过100目筛,加淀粉、硬脂酸镁混合均匀,制成颗粒,干燥,压片,即得。
(2)本发明的活性化合物sac的胶囊
化合物sac2mg,淀粉88g,硬脂酸镁3g
制备工艺:取本发明的化合物sac过100目筛,加淀粉、硬脂酸镁混合均匀,制成颗粒,干燥,装胶囊,即得。
(3)本发明的活性化合物sac的软胶囊
化合物sac10mg,大豆卵磷脂100g
制备工艺:取本发明的化合物sac,加大豆软磷脂,胶体磨混匀,抽真空,压制,即得软胶囊。
(4)本发明的活性化合物sac的冻干粉
化合物sac2g,亚硫酸钠4g,乙醇50ml,加水定容至1000ml;
制备工艺:取本发明的化合物sac分散在乙醇中,亚硫酸钠溶于水中,在超声或搅拌条件下将拿硫酸钠溶液逐渐加入,使成澄清透明溶液;补加水定容至足量;经0.22μm微孔滤膜过滤,冷冻干燥得到。
实施例10化合物异丹酚酸c(isac)制剂的制备
(1)本发明的活性化合物isac的片剂
化合物isac2mg,淀粉88g,硬脂酸镁3g
制备工艺:取本发明的化合物isac过100目筛,加淀粉、硬脂酸镁混合均匀,制成颗粒,干燥,压片,即得。
(2)本发明的活性化合物isac的胶囊
化合物isac2mg,淀粉88g,硬脂酸镁3g
制备工艺:取本发明的化合物isac过100目筛,加淀粉、硬脂酸镁混合均匀,制成颗粒,干燥,装胶囊,即得。
(3)本发明的活性化合物isac的软胶囊
化合物isac10mg,大豆卵磷脂100g
制备工艺:取本发明的化合物isac,加大豆软磷脂,胶体磨混匀,抽真空,压制,即得软胶囊。
(4)本发明的活性化合物isac的冻干粉
化合物isac2g,亚硫酸钠4g,乙醇50ml,加水定容至1000ml;
制备工艺:取本发明的化合物isac分散在乙醇中,亚硫酸钠溶于水中,在超声或搅拌条件下将拿硫酸钠溶液逐渐加入,使成澄清透明溶液;补加水定容至足量;经0.22μm微孔滤膜过滤,冷冻干燥得到。
实施例11化合物丹酚酸a甲酯(saam)制剂的制备
(1)本发明的活性化合物saam的片剂
化合物saam2mg,淀粉88g,硬脂酸镁3g
制备工艺:取本发明的化合物saam过100目筛,加淀粉、硬脂酸镁混合均匀,制成颗粒,干燥,压片,即得。
(2)本发明的活性化合物saam的胶囊
化合物saam2mg,淀粉88g,硬脂酸镁3g
制备工艺:取本发明的化合物saam过100目筛,加淀粉、硬脂酸镁混合均匀,制成颗粒,干燥,装胶囊,即得。
(3)本发明的活性化合物saam的软胶囊
化合物saam10mg,大豆卵磷脂100g
制备工艺:取本发明的化合物saam,加大豆软磷脂,胶体磨混匀,抽真空,压制,即得软胶囊。
(4)本发明的活性化合物saam的冻干粉
化合物saam2g,亚硫酸钠4g,乙醇50ml,加水定容至1000ml;
制备工艺:取本发明的化合物saam分散在乙醇中,亚硫酸钠溶于水中,在超声或搅拌条件下将拿硫酸钠溶液逐渐加入,使成澄清透明溶液;补加水定容至足量;经0.22μm微孔滤膜过滤,冷冻干燥得到。
上述参照实施例对丹参提取物在制备蛋白酪氨酸磷酸酶1b抑制剂及预防和/或治疗2型糖尿病药物中的应用进行的详细描述,是说明性的而不是限定性的,可按照所限定范围列举出若干个实施例,因此在不脱离本发明总体构思下的变化和修改,应属本发明的保护范围之内。
- 还没有人留言评论。精彩留言会获得点赞!