烟草抗肿瘤活性组分的提取方法及其应用与流程
本发明涉及烟草产品加工提取技术领域,具体涉及一种烟草抗肿瘤活性组分的提取方法及其应用。
背景技术:
烟草也称仙草,是一味传统的中药材,它的无机成分包括水、矿质元素;有机成分主要包括糖类、生物碱、杂环类、色素、酚类、萜类、有机酸类、脂质类、醇类、醛酮类等。其中,烟草中有机成分具有抗菌、抗病毒、抗肿瘤、抗氧化活性、清除体内自由基等多种功能。
目前,为了实现对烟草活性组分的提取,一般采用超临界提取、索氏提取、超声波提取方式。采用无水乙醇、正己烷、丙酮、乙酸乙酯、石油醚、二氯甲烷作为提取溶剂。其中低极性溶剂如石油醚、正己烷,中极性溶剂丙酮、二氯甲烷,这些溶剂多为易挥发、易燃、有毒溶剂,对工业生产设备、人员等要求高,且得到的烟草活性组分的含量少,这就大大限制了烟草活性组分的进一步研究和应用。
技术实现要素:
针对上述问题,本发明提供一种烟草抗肿瘤活性组分的提取方法及其应用,以提高烟草活性组分的提取量。
第一方面,本发明提供了一种烟草抗肿瘤活性组分的提取方法,该方法包括以下步骤:
(1)预处理:对烟草原料进行烘干处理,以及将烘干处理后的烟草原料进行超微粉碎处理,得到烟草超微粉;
(2)常温水提:在烟草超微粉中加入提取溶剂,在常温条件下进行提取操作;对提取操作后的烟草超微粉进行离心处理,并收集离心处理后的沉淀物;步骤(2)中的提取溶剂为纯化水;
(3)高温水提:在步骤(2)中收集的沉淀物中加入提取溶剂,在90-100℃的提取温度下进行浓缩提取操作;对浓缩提取操作后得到的浓缩提取液进行降温处理、离心处理,并收集离心处理后的沉淀物;步骤(3)中的提取溶剂为纯化水;
(4)甲醇提取:在步骤(3)中得到的沉淀物中加入提取溶剂,在0-4℃的提取温度下进行浸提提取操作,对浸渍提取物进行离心处理,并收集离心处理后的上清,将收集的上清进行旋转蒸发浓缩烘干处理,得到甲醇提取上清浓缩浸膏(tms);步骤(4)中的提取溶剂为85-100%的甲醇;
(5)丙酮提取:在步骤(4)中得到的沉淀物中加入提取溶剂,在0-4℃的提取温度下进行浸提提取操作,对浸渍提取物进行离心处理,并收集离心处理后的上清,将收集的上清进行旋转蒸发浓缩烘干/低温冷冻干燥处理,得到丙酮提取上清浓缩浸膏/丙酮提取上清冻干粉(tas);步骤(5)中的提取溶剂为85-100%的丙酮;
(6)色谱分离及组分活性筛选:
(a)取步骤(5)中得到的丙酮提取上清浓缩浸膏/丙酮提取上清冻干粉(tas)用60%甲醇-水溶液进行溶解,得到浓度为0.25g/ml样品,用制备液相进行分离,洗脱方式为:5%甲醇-水溶液等度洗脱,15%甲醇-水溶液等度洗脱,20%甲醇-水溶液等度洗脱,30%甲醇-水溶液等度洗脱,40%甲醇-水溶液等度洗脱,50%甲醇-水溶液等度洗脱,55%甲醇-水溶液等度洗脱,65%甲醇-水溶液等度洗脱,100%甲醇等度洗脱,检测波长为260nm,得到各组分经体外抗肿瘤活性筛选后,选取活性组分12进行旋蒸浓缩干燥;
(b)取活性组分12用无水乙醇进行溶解,得到浓度为0.25g/ml样品,用制备液相进行分离,洗脱方式为100%正己烷等度洗脱,85%正己烷-乙醇溶液等度洗脱,70%正己烷-乙醇溶液等度洗脱,60%正己烷-乙醇溶液等度洗脱,检测波长为260nm,得到各组分经体外抗肿瘤活性筛选后,选取活性组分ta-150-12-3进行旋蒸浓缩干燥;
(7)结构分析:取步骤(6)中得到活性组分ta-150-12-3进行质谱分析。色谱条件:5%-100%甲醇-水溶液10min;100%甲醇5min;质谱条件:正离子模式一级质谱;参比离子质荷比:121.050873和922.009798。
其中,步骤(1)中的中的超微粉碎处理是将烘干处理后的烟草原料,使用50-80目筛网的粉碎机进行粉碎处理,并对粉碎处理后的烟草原料,使用超微粉碎机进行粉碎处理,得到所述烟草超微粉。
其中,步骤(3)中的离心处理是指将降温处理后的所述浓缩提取液置于离心瓶中,离心温度为8-12℃,离心时间为0.5-1.5h,转速为3000-6000rpm/min。
其中,步骤(4)中加入提取溶剂的质量是沉淀物的质量的1.5-2.5倍。
其中,步骤(4)中的浸渍提取操作是指每隔0.5h搅拌一次,,提取时间为12-24h。
其中,步骤(4)中的浓缩烘干处理的温度为60-70℃。
其中,步骤(6)(a)中制备液相使用的色谱柱填料为直径10μm的c18,大小为150mm×250mm,洗脱方式为:5%甲醇-水溶液等度洗脱10min,15%甲醇-水溶液等度洗脱5min,20%甲醇-水溶液等度洗脱5min,30%甲醇-水溶液等度洗脱5min,40%甲醇-水溶液等度洗脱5min,50%甲醇-水溶液等度洗脱5min,55%甲醇-水溶液等度洗脱5min,65%甲醇-水溶液等度洗脱5min,100%甲醇等度洗脱12min,检测波长为260nm,上样量为200ml,流速为600ml/min。
其中,步骤(6)(b)中制备液相使用的色谱柱填料为直径10μm的硅胶,大小为150mm×250mm,洗脱方式为:洗脱方式为100%正己烷等度洗脱5min,85%正己烷-乙醇溶液等度洗脱15min,70%正己烷-乙醇溶液等度洗脱23min,60%正己烷-乙醇溶液等度洗脱12min,检测波长为260nm,上样量为80ml,流速为450ml/min。
其中,步骤(6)、(a)、(b)中体外抗肿瘤活性筛选是指进行抑制人肺癌a549细胞生长试验和抑制人肝癌hep-g2细胞生长试验。
第二方面,本发明提供了一种根据所述烟草活性组分在制备抗癌药物中的应用。
本发明具有如下的有益效果:
1、本发明通过对烟草原料进行预处理,并针对预处理后的烟草原料依次进行常温提取、高温提取、甲醇提取三次操作,且使用高极性溶剂纯化水、甲醇作为提取溶剂,通过采用不同提取溶剂不同提取条件,可以保证将烟草原料中的烟草活性组分实现充分提取,提高烟草活性组分的提取含量;
2、提取溶剂为水、乙醇等容积,成本低廉;
3、本发明对烟草原料经过特殊方法提取的提取物可作为抗肿瘤药物开发,具有广阔的应用前景。同时,本发明的烟草提取物的制备方法简单,适合工业化生产。
上述说明仅是本发明技术方案的概述,为了能够更清楚了解本发明的技术手段,并可依照说明书的内容予以实施,以下以本发明的较佳实施例。
附图说明
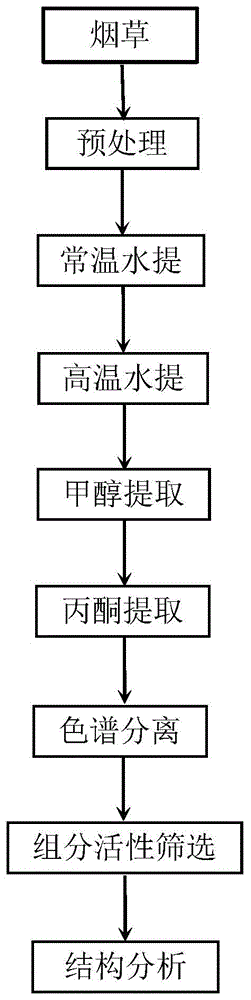
图1所示的是本发明实施例1得到的烟草活性组分的流程图;
图2所示的是本发明实施例1(6)(a)得到的烟草丙酮提取物色谱分离图;
图3所示的是本发明实施例1(6)(b)得到的烟草活性组分12色谱分离图;
图4所示的是本发明实施例1得到的烟草活性组分ta-150-12-3质谱检测离子图;
图5所示的是本发明实施例1得到的烟草活性组分ta-150-12-3对人肺肿瘤a549细胞生长抑制示意图;
图6所示的是本发明实施例1得到的烟草活性组分ta-150-12-3对人肝癌hep-g2细胞生长抑制示意图;
上述说明仅是本发明技术方案的概述,为了能够更清楚了解本发明的技术手段,并可依照说明书的内容予以实施,以下以本发明的较佳实施例。
具体实施方式
以下结合实施例对本发明作进一步具体描述。应该指出,以下具体说明都是例示性的,旨在对本发明提供进一步的说明。除非另有说明,本发明使用的所有科学和技术术语具有与本发明所属技术领域人员通常理解的相同含义。
本发明提供了一种烟草活性组分的提取方法,该提取方法请参考图1所示的流程图,该提取方法可以包括以下步骤:
实施例1:烟草抗肿瘤活性组分的提取
1、烟草抗肿瘤活性组分的提取步骤如下:
(1)预处理。
称取30kg烟草原料,放置在烘箱中进行烘干,烘干温度60℃,烘制时间4h,烘至烟草含水量小于5%取出;取烘干处理后的烟草原料,使用50目筛网的粉碎机粉碎后,并放入超微粉碎机中进行超微粉碎处理,得到烟草超微粉。
(2)常温水提。
称取30kg烟草超微粉加入到200l提取罐中,加入100kg纯化水,常温搅拌提取0.5h;搅拌提取结束后转移至离心瓶中,8℃离心0.5h,转速为4000rpm/min;收集离心处理后的沉淀物。
(3)高温水提。
称取步骤(2)中的沉淀物25kg,加入到100l浓缩提取罐中;加入60kg纯化水,打开浓缩提取罐加热开关;加热到90℃后,在90℃的温度下浓缩提取0.5h;向浓缩提取罐夹套中通入循环水,以对浓缩提取液进行降温处理,使其降温至室温;将浓缩提取液转移至离心瓶中进行离心处理,8℃离心0.5h,转速为4000rpm/min;并收集离心处理后的沉淀物。
(4)甲醇提取。
将步骤(3)中得到的沉淀物加入到不锈钢桶中,每桶10kg;每桶中加入15kg的甲醇,甲醇的质量分数为92%,在0℃的提取温度下浸渍提取操作;其中,提取时间为12h,每隔0.5h对桶内物质搅拌一次;将浸渍提取物置于离心瓶中,3℃离心1.5h,转速为4000rpm/min;收集离心处理后的上清,将收集的上清转移至50l旋蒸中60℃浓缩处理,在浓缩完成后转移至烘盘中,60℃烘制成浸膏,得到烟草甲醇提取物(tms)。
(5)丙酮提取。
将步骤(4)中得到的沉淀物中加入到不锈钢桶中,每桶10kg;每桶加入15kg丙酮,丙酮的质量分数为95%,在4℃的提取温度下进行浸提提取操作,其中,提取时间为12h,每隔0.5h对桶内物质搅拌一次;将浸渍提取物置于离心瓶中,3℃离心1.5h,转速为4000rpm/min;收集离心处理后的上清,将收集的上清转移至50l旋蒸中60℃浓缩处理,在浓缩完成后转移至烘盘中,60℃烘制成浸膏,得到烟草丙酮提取物(tas)。
(6)色谱分离及组分活性筛选。
(a)取步骤(5)中得到的丙酮提取上清浓缩浸膏(tas)用60%甲醇-水溶液进行溶解,得到浓度为0.25g/ml样品,用制备液相进行分离,洗脱方式为:5%甲醇-水溶液等度洗脱10min,15%甲醇-水溶液等度洗脱5min,20%甲醇-水溶液等度洗脱5min,30%甲醇-水溶液等度洗脱5min,40%甲醇-水溶液等度洗脱5min,50%甲醇-水溶液等度洗脱5min,55%甲醇-水溶液等度洗脱5min,65%甲醇-水溶液等度洗脱5min,100%甲醇等度洗脱12min,检测波长为260nm,上样量为200ml,流速为600ml/min,结果如图2所示,得到各组分经体外抗肿瘤活性筛选后,选取活性最强的组分旋蒸浓缩后真空干燥得到组分12做下一步分离纯化。
(b)取步骤(6)(a)中得到活性组分12用无水乙醇进行溶解,得到浓度为0.25g/ml样品,用制备液相进行分离,洗脱方式为:洗脱方式为100%正己烷等度洗脱5min,85%正己烷-乙醇溶液等度洗脱15min,70%正己烷-乙醇溶液等度洗脱23min,60%正己烷-乙醇溶液等度洗脱12min,检测波长为260nm,上样量为80ml,流速为450ml/min,结果如图3所示,得到各组分经体外抗肿瘤活性筛选后,得到本发明目的抗肿瘤活性组分ta-150-12-3。
(8)结构分析:取取步骤(6)(b)中得到活性组分ta-150-12-3进行质谱分析。色谱条件:5%-100%甲醇-水溶液10min;100%甲醇5min;质谱条件:正离子模式一级质谱;参比离子质荷比:121.050873和922.009798。其离子质谱图如图4所示,结果表明该组分可能为笨丙素类化合物。
实施例2:烟草活性组分抑制人肿瘤a549细胞生长的试验
空白对照孔:不加药物,加终浓度为1%的dmso;
实验孔:加实施例1步骤(6)(b)所得的抗肿瘤活性组分
细胞培养:
在5%co2,37℃,饱和湿度下,用rpmi1640(10%fbs+15%ps)培养基培养人肺肿瘤a549细胞,选取对数期生长的细胞作为实验细胞。细胞计数后用培养基稀释为约5.8万每毫升的细胞悬液。
细胞生长情况监测:
将细胞实时监测仪放入5%co2、37℃饱和湿度培养箱中。取8孔板,每孔加入150μlrpmi1640培养基,放入细胞实时监测仪中走基线,走完基线后取出八孔板,每孔加入稀好的a549细胞悬液345μl,至每孔细胞数约2×104个,静置30min,在倒置显微镜下观察细胞是否均匀。每孔加入5μl稀释好的药物(实施例1得到的烟草活性组分)至终浓度为50μg/ml,含1%dmso的培养基作为空白对照组,放入细胞实时监测仪中检测,检测完毕时拍照记录。实验结果如图5所示,结果表明:本发明提取得到的烟草抗肿瘤活性组分ta-150-12-3在50μg/ml时能达到基本抑制人肺癌细胞a549的生长。
实施例3:抑制人肝癌hep-g2细胞生长的试验
空白对照孔:不加药物,加终浓度为1%dmso;
实验孔:加实施例1步骤(6)(b)所得的抗肿瘤活性组分
细胞培养:
在5%co2,37℃,饱和湿度下,用dmem(10%fbs、1%ps)培养基培养人肺癌hep-g2细胞,选取对数期生长的细胞作为实验细胞。细胞计数后用培养基稀释为约5.8万每毫升的细胞悬液。
细胞生长情况监测:将细胞实时监测仪放入5%co2,37℃饱和湿度培养箱中。取八孔板,每孔加入150μldmem培养基,放入细胞实时监测仪中走基线,走完基线后取出八孔板,每孔加入稀释好的hep-g2细胞悬液345μl,至每孔细胞数约4×104个,静置30min,在倒置显微镜下观察细胞是否均匀。每孔加入5μl稀释好的药物(实施例1得到的烟草活性组分)至终浓度为50μg/ml,含1%dmso的培养基作为空白对照组,放入细胞实时监测仪中检测,检测完毕时拍照记录。实验结果如图6所示,上方线为空白对照孔、下方线为实验孔。结果表明:本发明提取得到的烟草抗肿瘤活性组分ta-150-12-3在50μg/ml时能达到基本抑制人肝癌细胞hep-g2的生长。
以上所述,仅为本发明的优选实施例,应当指出,对于本技术领域的普通技术人员来说,在不脱离本发明的核心技术的前提下,还可以做出改进和润饰,这些改进和润饰也应属于本发明的专利保护范围,与本发明的权利要求书相当的含义和范围内的任何改变,都应认为是包括在权利要求书范围内。
- 还没有人留言评论。精彩留言会获得点赞!