一种包含活性生物因子的脂质体及其制备方法与流程
本发明属于活性生物因子领域,特别涉及一种包含活性生物因子的脂质体及其制备方法。
背景技术:
成纤维细胞生长因子是一种重要的细胞因子,其具有多种生理功能,在生命活动中发挥重要作用。成纤维细胞生长因子家族目前已知包括23个成员,家族成员之间具有30-80%的同源性。目前研究对成纤维细胞生长因子的研究主要集中在fgf-1(a-fgf,酸性成纤维细胞生长因子)、fgf-2(b-fgf,碱性成纤维细胞生长因子)、fgf-13、fgf-21等。
fgf-2即碱性成纤维细胞生长因子最初由牛脑垂体和脑组织提取物中分离得到,能促进2t3细胞的分裂增殖,后续研究表明,fgf-2在体内分布广泛,从垂体、脑、下丘脑、视网膜、肾上腺、胸腺、黄体、肾、心脏、肝脏、胎盘中都能分离得到,并且在多种肿瘤组织中也有表达。人类fgf-2基因为单拷贝基因,定位于4号染色体的短臂上,全长大于40kb,在基因的5’端和3’端都有对基因转录起调控作用的非编码序列,其mrna长约6802bp,由于翻译起始位点不同而产生一种低mrfgf-2和4种高mrfgf-2。
fgf-2是一种多功能细胞因子,如其能够促进细胞有丝分裂、诱导新生血管生成、促进损伤血管内皮细胞修复、促进软组织损伤修复、促进软骨和骨组织损伤修复、促进神经组织修复和再生等。综上,成纤维细胞生长因子尤其是碱性成纤维细胞生长因子具有巨大的临床价值,可用于治疗或辅助治疗多种临床疾病。
成纤维细胞生长因子等外源性活性生物分子在体内半衰期较短,如fgf-2体内的半衰期仅为3-10min,全身或局部给药的效果不能满足临床应用需要。
现有的成纤维细胞生长因子给药技术主要集中在以下几个方面:肝素调控fgf释药技术,即肝素通过共价接枝的方法结合到不同的载体材料,形成肝素-聚合物复合物的新材料,进而包载fgf,或者游离的肝素通过非共价形式直接混入到载体材料中,从而影响药物fgf的释放过程;fgf微球与纳米球;fgf脂质体;fgf胶束;fgf水凝胶等。相对于脂质体,肝素调控fgf释药技术、fgf胶束、fgf水凝胶等给药技术存在制备步骤繁多、技术复杂、成本较高等缺点,而脂质体制备步骤简单、成本低廉,具有广阔的临床推广前景。
脂质体是由磷脂、胆固醇及其它两亲性物质制备而成,由双分子膜形成一层或多层空心的超微型球状载体剂型,其内部为水相的闭合囊泡,脂质体作为药物载体可以延缓药物在体内的释放。但目前的活性生物因子,例如成纤维细胞生长因子尤其是fgf-2的脂质体存在包封率不高、稳定性不佳等不足,存在进一步改进的需求。
技术实现要素:
为解决现有技术中活性生物因子的脂质体包封率不高、稳定性不佳以及生物学活性易降低的缺陷,本发明提供一种包含活性生物因子的脂质体及其制备方法。
具体地,本发明提供了一种包含活性生物因子的脂质体,制备所述脂质体的原料为卵磷脂、胆固醇、磷脂酰乙醇胺以及活性生物因子,优选所述磷脂酰乙醇胺为二油酰磷脂酰乙醇胺。
进一步地,所述卵磷脂为大豆卵磷脂、氢化大豆卵磷脂、蛋黄卵磷脂、二棕榈酰磷脂酰胆碱中的一种或多种,优选为大豆卵磷脂。
进一步地,所述活性生物因子为成纤维细胞生长因子、神经生长因子、表皮细胞生长因子、胰岛素,优选为成纤维细胞生长因子,更优选为fgf-2。
更进一步地,所述脂质体中卵磷脂、胆固醇、二油酰磷脂酰乙醇胺的比例为10-20:3-6:1-2(重量比);所述比例优选为20:5:1.5。
更进一步地,所述脂质体中卵磷脂、胆固醇、二油酰磷脂酰乙醇胺、活性生物因子的比例为10-20:3-6:1-2:0.1(重量比)。
本发明还提供一种脂质体的制备方法,具体即通过薄膜分散法制备脂质体。
进一步地,称取所需量的卵磷脂、胆固醇、二油酰磷脂酰乙醇胺、活性生物因子放入茄形瓶中,再加入氯仿使之完全溶解;利用旋转蒸发仪通过旋转蒸发抽去溶液中的氯仿,从而在茄形瓶瓶底以及内壁形成一层均匀的脂质薄膜;真空干燥器内放置过夜以彻底去除氯仿;加入10%蔗糖水溶液,在室温下水化30min形成半透明乳状液,室温挤出,过0.22μm微孔滤膜5-10次进行整粒,从而获得活性生物因子脂质体。
更进一步地,其中各原料中,卵磷脂、胆固醇、二油酰磷脂酰乙醇胺的比例为10-20:3-6:1-2(重量比);所述比例优选为20:5:1.5。
更进一步地,其中各原料中,卵磷脂、胆固醇、二油酰磷脂酰乙醇胺、活性生物因子的比例为10-20:3-6:1-2:0.1(重量比)。
最进一步地,其中各原料用量为:20mg大豆卵磷脂、5mg胆固醇、1.5mg二油酰磷脂酰乙醇胺、100μg活性生物因子。
有益效果
本发明的脂质体包封率高、稳定性佳,能够很好的保持活性生物因子的活性,适用于活性生物因子的长期保存;且制备方法鉴定,便于活性生物因子的产业化生产和应用。
附图说明
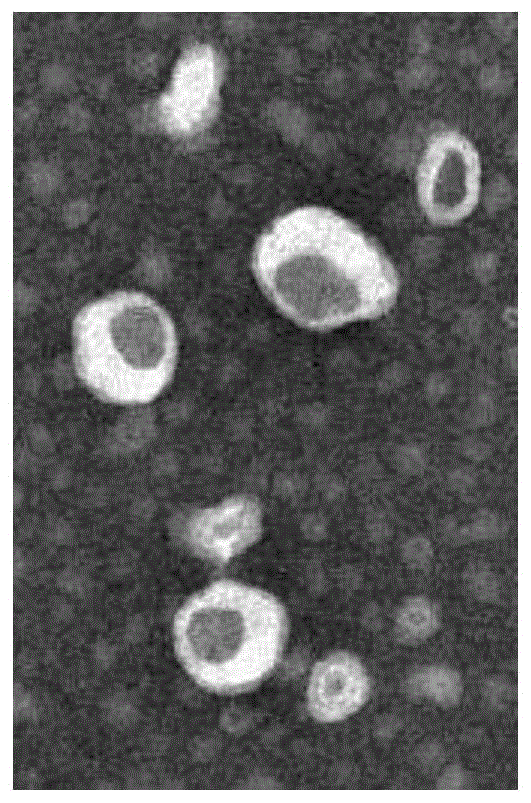
图1:本发明fgf-2脂质体的透射电镜照片。
具体实施方式
在下文中更详细地描述了本发明以有助于对本发明的理解。
应当理解的是,在说明书和权利要求书中使用的术语或词语不应当理解为具有在字典中限定的含义,而应理解为在以下原则的基础上具有与其在本发明上下文中的含义一致的含义:术语的概念可以适当地由发明人为了对本发明的最佳说明而限定。
下列实施例中未注明具体条件的实验方法,通常按照本领域常规实验方法,或按照制造厂商所建议的条件进行。
实施例1:薄膜分散法制备fgf-2脂质体
本发明出人意料地发现,在由大豆卵磷脂、胆固醇制备的脂质体中加入磷脂酰乙醇胺,尤其是加入二油酰磷脂酰乙醇胺能够大大提高脂质体对活性生物因子的包封率和降低脂质体的渗漏率,并且脂质体的稳定性也有显著提高。
进而,经前期预实验发现,将大豆卵磷脂、胆固醇和二油酰磷脂酰乙醇胺以10-20:3-6:1-2(重量比)的比例获得的脂质体形态好,稳定性以及包封率等参数也较佳,适于作为活性生物因子的载体。
因此,本实施例依据以上配比制备脂质体,具体步骤参数如下:
称取20mg大豆卵磷脂、5mg胆固醇、1.5mg二油酰磷脂酰乙醇胺、100μgfgf-2放入茄形瓶中,再加入氯仿使之完全溶解;利用旋转蒸发仪通过旋转蒸发抽去溶液中的氯仿,从而在茄形瓶瓶底以及内壁形成一层均匀的脂质薄膜;真空干燥器内放置过夜以彻底去除氯仿;加入10%蔗糖水溶液,在室温下水化30min形成半透明乳状液,室温挤出,过0.22μm微孔滤膜5-10次进行整粒,从而获得fgf-2脂质体。
所获得的脂质体的透射电镜照片如图1所示。
由上述方法制备的脂质体呈现较完整的类球形,以单室结构为主,平均粒径在100.0nm左右,主要分布在65.45-136.55nm之间,脂质体的ζ电位为-45.49mv,即ζ电位值绝对值在30-60mv之间,体系较稳定。
对比例1:
根据以下步骤制备fgf-2脂质体:称取20mg大豆卵磷脂、5mg胆固醇、100μgfgf-2放入茄形瓶中,再加入氯仿使之完全溶解;利用旋转蒸发仪通过旋转蒸发抽去溶液中的氯仿,从而在茄形瓶瓶底以及内壁形成一层均匀的脂质薄膜;真空干燥器内放置过夜以彻底去除氯仿;加入10%蔗糖水溶液,在室温下水化30min形成半透明乳状液,室温挤出,过0.22μm微孔滤膜5-10次进行整粒,从而获得fgf-2脂质体。
对比例2:
根据以下步骤制备fgf-2脂质体:称取20mg大豆卵磷脂、5mg胆固醇、2mg磷脂酰甘油、100μgfgf-2放入茄形瓶中,再加入氯仿使之完全溶解;利用旋转蒸发仪通过旋转蒸发抽去溶液中的氯仿,从而在茄形瓶瓶底以及内壁形成一层均匀的脂质薄膜;真空干燥器内放置过夜以彻底去除氯仿;加入10%蔗糖水溶液,在室温下水化30min形成半透明乳状液,室温挤出,过0.22μm微孔滤膜5-10次进行整粒,从而获得fgf-2脂质体。
试验例:
1、包封率的测定
取2ml的fgf-2脂质体置于10ml定量瓶中,用二甲亚砜定容,再以95%乙醇稀释10倍,摇匀,用hplc定量,包封率计算公式为:包封率(%)=(包封入脂质体中的fgf-2的量/fgf-2总量)×100%。
2、稳定性的测定
采用离心分光光度法测定物理稳定性参数ke,吸取fgf-2脂质体样品1ml,置于离心管中3500rpm/min离心10min,取离心前的脂质体及离心后的上清液各0.3ml,分别加入磷酸盐缓冲液(ph6.8)稀释至5.0ml,以磷酸盐缓冲液为空白,于波长500nm处测定其吸光度,脂质体离心前后测得的吸光度值分别为a0、a,计算稳定性参数ke值,ke=(a0-a)/a0×100%,ke值越小,说明脂质体越稳定。
3、渗漏率的测定
采用sephadexg-50分子排阻色谱法将fgf-2脂质体与游离的fgf-2分离开,再将载药脂质体混悬液分别置于4℃、25℃、37℃保存,间隔一定的时间用hplc方法测定药物渗漏率,渗漏率(%)=(放置前脂质体中的药物量-放置后脂质体中的药物量)/脂质体中药量×100%。
4、生物活性的测定
采用mtt法测定fgf-2脂质体的生物活性,用含0.5%血清的dmem培养液将fgf-2脂质体或fgf-2原液稀释至0.1mg/l,精密吸取100μl加入第1孔,依次4倍稀释,每个稀释度设3个复孔,fgf-2原液(标准品)初始剂量为100u,并设空白脂质体基质对照,在酶标仪上以630nm为参比波长,于波长570nm处测定a值,计算fgf-2脂质体的生物学活性。
结果如下:
首先,具体测定了在4℃保存条件下脂质体的包封率,测定三批样品,本发明实施例1与对比例1-2制备的fgf-2脂质体的包封率随时间的变化情况体现在表1中。
表1:4℃下保存的fgf-2脂质体包封率的变化情况
由表1的包封率结果可知,本发明实施例1制备的fgf-2脂质体获得了更好的包封率,且包封率在4℃低温长期存放时能够维持在较高水平,有利于fgf-2的保存。
其次,具体测定了在4℃保存条件下脂质体的稳定性,测定三批样品,本发明实施例1与对比例1-2制备的fgf-2脂质体的稳定性随时间的变化情况体现在表2中。
表2:4℃下保存的fgf-2脂质体稳定性的变化情况
由表2的稳定性结果可知,本发明实施例1制备的fgf-2脂质体在低温保存的情况下具有更好的稳定性,且在低温长期存放时也能够长期维持在较高水平,有利于fgf-2长期的保存。
测定了在4℃下保存一定时间的渗漏率和生物学活性,重复三次,结果如表3所示:
表3:4℃下保存的fgf-2脂质体渗漏率和生物学活性的变化情况
由表3的脂质体渗漏率和生物学活性变化结果可知,本发明实施例1制备的fgf-2脂质体在长时间低温保存的情况下具有更低的渗漏率以及更好的生物学活性,有利于fgf-2的长期保存。
综上,由上述试验例给出的实验数据可知,由卵磷脂、胆固醇、二油酰磷脂酰乙醇胺和活性生物因子制备的脂质体能够获得最佳的包封率、稳定性,并且能够维持活性生物因子的生物活性,利于活性生物因子的产业化应用。
以上所述仅是本发明的优选实施方式,应当指出:对于本技术领域的普通技术人员来说,在不脱离本发明原理的前提下,还可以做出若干改进和润饰,这些改进和润饰也应视为本发明的保护范围。
- 还没有人留言评论。精彩留言会获得点赞!