一种阿奇霉素干混悬剂及其制备方法与流程
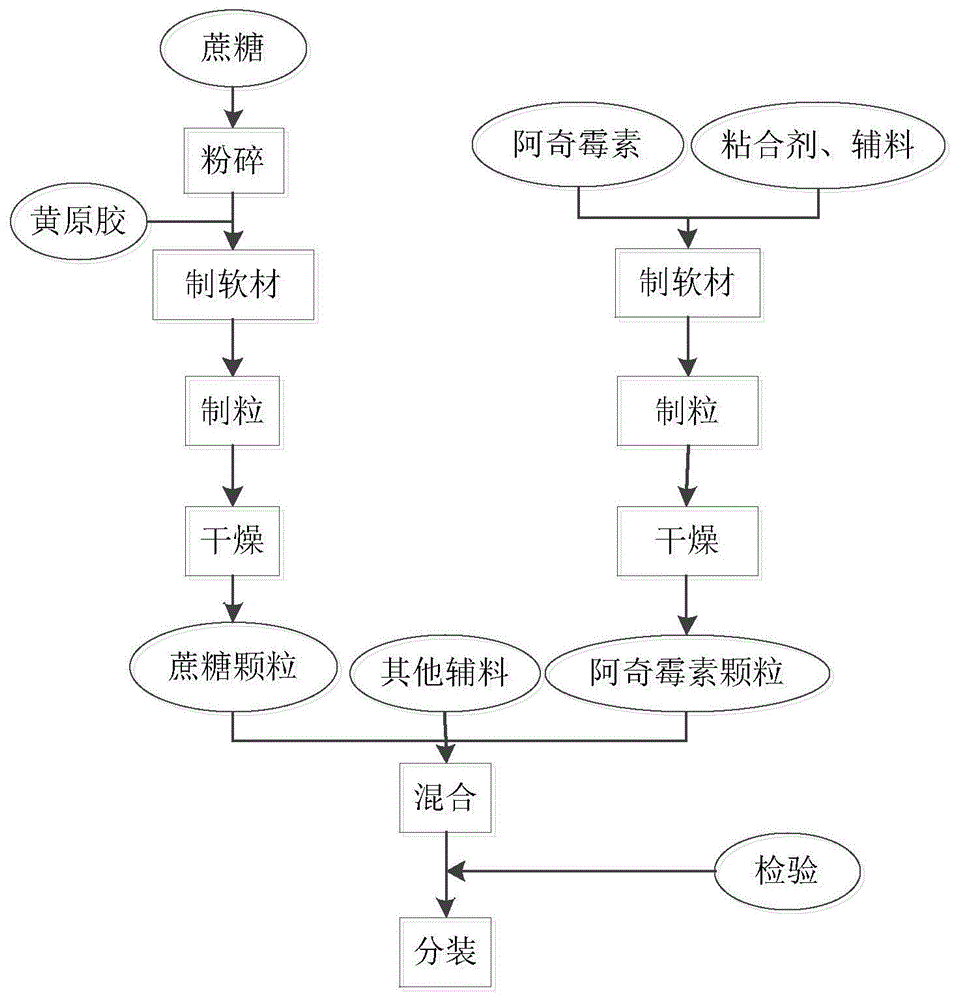
本发明涉及药物制剂领域,具体涉及一种阿奇霉素干混悬剂及其制备方法。
背景技术:
:阿奇霉素最先是由克罗地亚普利瓦公司研制合成,并率先在前南斯拉夫上市的。为了取得更大的经济效益,原研发公司将全球的生产和市场开发权进行了转让,由美国辉瑞公司和意大利sigma-tau公司授让进行全球开发。辉瑞公司在取得了全球开发权后,其获批的阿奇霉素商品名为希舒美。08年,希舒美在阿奇霉素的市场占有率达到30.78%。阿奇霉素于1980年被发现,1981年推出,属大环内酯类第二代抗生素,适用于敏感菌所致的呼吸道、皮肤软组织感染和衣原体所致的传播性疾病。阿奇霉素干混悬剂(pliva)的原辅料组成为阿奇霉素、蔗糖、无水磷酸三钠、羟丙纤维素、黄原胶、樱桃粉末香精、香蕉粉末香精、二氧化硅。专利ep1498141b1,阿奇霉素干混悬剂为原辅料混合直接分装所得。目前粉末混合直接分装得到得阿奇霉素干混悬剂很难达与nmpa公布的参比制剂(阿奇霉素干混悬剂pliva)体外溶出和体内行为一致。且阿奇霉素味极苦,粉末混合直接分装的产品很难掩盖其苦味,存在儿童用药的依从性差的问题。cn109875965a中公开了一种阿奇霉素干混悬剂,提到了将原料中的羟丙纤维素优化为高取代羟丙纤维素和低取代羟丙纤维素,同时,在制备时,先制备糖颗粒与阿奇霉素颗粒,然后将精制糖与二氧化硅预混,再加入阿奇霉素颗粒与无水磷酸三钠混合,再按递加法加入制好的糖颗粒、香精,可达到美国辉瑞公司的阿奇霉素干混悬剂的生物利用度,并大幅改善了口感,减轻了肠胃副反应。但其缺陷在于:在与参比制剂(阿奇霉素干混悬剂pliva)相比时,溶出度仍然没有达到理想的一致性,致使其在质量与疗效方面与参比制剂仍然有一些差距。技术实现要素:为了解决上述技术问题,本发明首先提出了一种阿奇霉素干混悬剂的制备方法,具体技术方案如下:一种阿奇霉素干混悬剂的制备方法,先制备阿奇霉素颗粒,再将所述阿奇霉素颗粒与其他辅料混合;其中,所述阿奇霉素颗粒的制备包括如下步骤:s1、将1~3%(优选为2%)处方量的羟丙纤维素制备成水溶液,得到粘合剂;s2、将阿奇霉素与剩余处方量的羟丙纤维素混合后,在搅拌下加入所述粘合剂制成阿奇霉素软材,干燥得到所述阿奇霉素颗粒。本发明发现,将部分羟丙纤维素制成粘合剂后,并按上述方式混合制粒,有利于调节阿奇霉素干混悬剂的溶出,当按1~3%(优选为2%)处方量的羟丙纤维素制备粘合剂时,可以大幅优化其在体外溶出和体内行为方面与参比制剂(阿奇霉素干混悬剂pliva)相比的一致性,提升药物质量与疗效。同时,有利于掩盖阿奇霉素本身存在的苦味,便于解决儿童用药的依从性问题。为了进一步提升药物性能,本发明对其他条件进一步进行了优化,得到如下技术方案:作为优选,所述粘合剂的质量浓度为1~3%,更优选为2%。作为优选,先制备蔗糖颗粒和阿奇霉素颗粒,再将所述蔗糖颗粒、阿奇霉素颗粒与其他辅料混合;其中,所述蔗糖颗粒的制备包括如下步骤:将蔗糖、黄原胶混合后,在搅拌下加入水制成蔗糖软材,干燥得到所述蔗糖颗粒。优选所述水的重量为所述蔗糖重量的2~4%,进一步优选为3%。上述方式可以改善原料的流动性,有利于其混合均匀,以进一步提升阿奇霉素干混悬剂的质量。作为优选,将所述阿奇霉素软材和/或所述蔗糖软材过24目筛之后,再进行干燥。作为优选,在45~65℃条件下干燥。作为优选,所述阿奇霉素颗粒和/或所述蔗糖颗粒的水分含量≤7%;优选≤5%。作为优选,在所述阿奇霉素颗粒和/或所述蔗糖颗粒的制备过程中,混合方式为高切高搅;优选混合时间为3~10min。在制备阿奇霉素颗粒时,混合时间进一步优选为7min;在制备蔗糖颗粒时,混合时间进一步优选为5min。作为优选,所述阿奇霉素干混悬剂的原料包括以下重量份组分:优选所述阿奇霉素干混悬剂的原料包括以下重量份组分:当按照上述原料配方制备时,不仅可以提升药物质量与疗效,也能进一步改善阿奇霉素干混悬剂的口味。作为优选,控制所述蔗糖的粒径≤60目,所述阿奇霉素的粒径≤100目,其他原料的粒径≤40目。当各原料粒径控制在上述范围内时,有利于进一步改善成品的均一性。如果原料本身就在上述范围内,则不需要进行预处理;如果大于上述范围,需要预先对其进行粉碎。作为优选,所述蔗糖颗粒、阿奇霉素颗粒与其他辅料在8~16rpm下混合;更优选为11~12rpm。优选混合时间为30~60min,更优选为40~50min。作为优选,将所述蔗糖颗粒、阿奇霉素颗粒先与无水磷酸三钠、二氧化硅混合8~12min(优选10min)后,再与剩余辅料混合。当将所述蔗糖颗粒、阿奇霉素颗粒直接与所有其他辅料混合时,容易发生分层现象,致使主药含量不均一,而上述优选的混合方式对解决该问题有较大影响,可以进一步提升阿奇霉素干混悬剂的质量与疗效。作为一种优选方案,所述阿奇霉素干混悬剂的制备方法包括如下步骤:(1)原料预处理:控制所述蔗糖≤60目,所述阿奇霉素≤100目,无水磷酸三钠、羟丙纤维素、黄原胶、香蕉粉末香精、樱桃粉末香精≤40目;(2)按下述配方称取原料:(3)蔗糖颗粒的制备:将蔗糖、黄原胶在高切高搅下混合3~10min后,在搅拌下加入水制成蔗糖软材,过24目筛,45~65℃干燥至颗粒水分≤7%,得到所述蔗糖颗粒;其中,所述水的重量为所述蔗糖重量的2~4%;(4)阿奇霉素颗粒的制备:s1、将1~3%处方量的羟丙纤维素制备成水溶液,得到粘合剂;s2、将阿奇霉素与剩余处方量的羟丙纤维素在高切高搅下混合3~10min后,在搅拌下加入所述粘合剂制成阿奇霉素软材,过24目筛,45~65℃干燥至颗粒水分≤7%,得到所述阿奇霉素颗粒;(5)总混:将蔗糖颗粒、阿奇霉素颗粒先与无水磷酸三钠、二氧化硅在8~16rpm下混合8~12min后,再与剩余辅料混合至总混合时长为30~60min。按照常规,在制得上述阿奇霉素干混悬剂后,还包括送检、分装的步骤,在此不做进一步限定。本领域技术人员可对上述优选方案进行组合,得到本发明较佳实施例,在此不做进一步限定。本发明进一步提供通过上述方法制得的阿奇霉素干混悬剂。本发明有益效果如下:本发明所制得的阿奇霉素干混悬剂与nmpa公布的参比制剂(阿奇霉素干混悬剂pliva)体外溶出和体内行为一致,也就是说,其与参比制剂相比在质量与疗效上具有很高的一致性。同时,通过该方法可以很好地掩盖阿奇霉素的苦味,解决了儿童用药的依从性问题。附图说明图1为实施例1中的阿奇霉素干混悬剂的工艺流程图;图2为不同样品在ph4.5介质中的溶出曲线对比图;图3为不同样品在ph6.0介质中的溶出曲线对比图;图4为不同样品在餐后的药代动力学数据;图5为不同样品在餐前的药代动力学数据。具体实施方式以下实施例用于说明本发明,但不用来限制本发明的范围。实施例1本实施例提供一种阿奇霉素干混悬剂的制备方法,包括如下步骤(工艺流程图见图1):1)蔗糖粉碎过60目,阿奇霉素粉碎过100目,无水磷酸三钠、羟丙纤维素、黄原胶、香精过40目备用。2)称取阿奇霉素10kg、蔗糖388kg、无水磷酸三钠1.5kg、羟丙纤维素1kg、黄原胶1kg、樱桃粉末香精1.5kg、香蕉粉末香精0.24kg、二氧化硅2kg。3)粘合剂制备:将20g羟丙纤维素加1000ml纯化水制备成水溶液,备用。4)蔗糖颗粒制备:388kg蔗糖粉、1kg黄原胶加入到高速湿法制粒机混合5min,加入11.6kg纯化水制成软材,过24目摇摆,60℃干燥2h,得到颗粒,水分为4.7%。5)阿奇霉素颗粒制备:将10kg阿奇霉素、0.98kg的羟丙纤维素加入到高速湿法制粒机混合7min后,搅拌下加入粘合剂制成软材,过24目摇摆,60℃干燥30min,得到颗粒,水分4.9%。6)总混:将得到的蔗糖颗粒、阿奇霉素颗粒、无水磷酸三钠、二氧化硅加入三维运动混合机,混合10min,再加入樱桃粉末香精1.5kg、香蕉粉末香精0.24kg混合45min;7)分装:分装,即得阿奇霉素干混悬剂,取样品记为样1。实施例2本实施例提供一种阿奇霉素干混悬剂的制备方法,包括如下步骤:1)蔗糖粉碎过60目,阿奇霉素粉碎过100目,无水磷酸三钠、羟丙纤维素、黄原胶、香精过40目备用。2)称取阿奇霉素10kg、蔗糖388kg、无水磷酸三钠1.5kg、羟丙纤维素1kg、黄原胶1kg、樱桃粉末香精1.5kg、香蕉粉末香精0.24kg、二氧化硅2kg。3)粘合剂制备:将30g羟丙纤维素加1000ml纯化水制备成水溶液,备用。4)蔗糖颗粒制备:388kg蔗糖粉、1kg黄原胶加入到高速湿法制粒机混合5min,加入11.6kg纯化水制成软材,过24目摇摆,60℃干燥2h,得到颗粒,水分为5.2%。5)阿奇霉素颗粒制备:将10kg阿奇霉素、0.97kg的羟丙纤维素加入到高速湿法制粒机混合7min后,搅拌下加入粘合剂制成软材,过24目摇摆,60℃干燥30min,得到颗粒,水分4.9%。6)总混:将得到的蔗糖颗粒、阿奇霉素颗粒、无水磷酸三钠、二氧化硅加入三维运动混合机,混合10min,再加入樱桃粉末香精1.5kg、香蕉粉末香精0.24kg混合45min;7)分装:分装,即得阿奇霉素干混悬剂,取样品记为样2。实施例3本实施例提供一种阿奇霉素干混悬剂的制备方法,包括如下步骤:1)蔗糖粉碎过60目,阿奇霉素粉碎过100目,无水磷酸三钠、羟丙纤维素、黄原胶、香精过40目备用。2)称取阿奇霉素10kg、蔗糖388kg、无水磷酸三钠1.5kg、羟丙纤维素1kg、黄原胶1kg、樱桃粉末香精1.5kg、香蕉粉末香精0.24kg、二氧化硅2kg。3)粘合剂制备:将20g羟丙纤维素加1000ml纯化水制备成水溶液,备用。4)蔗糖颗粒制备:388kg蔗糖粉、1kg黄原胶加入到高速湿法制粒机混合5min,加入13.5kg纯化水制成软材,过24目摇摆,60℃干燥2h,得到颗粒,水分为3.6%。5)阿奇霉素颗粒制备:将10kg阿奇霉素、0.98kg的羟丙纤维素加入到高速湿法制粒机混合7min后,搅拌下加入粘合剂制成软材,过24目摇摆,60℃干燥40min,得到颗粒,水分3.8%。6)总混:将得到的蔗糖颗粒、阿奇霉素颗粒、无水磷酸三钠、二氧化硅加入三维运动混合机,混合10min,再加入樱桃粉末香精1.5kg、香蕉粉末香精0.24kg混合40min;7)分装:分装,即得阿奇霉素干混悬剂,取样品记为样3。对比例1本对比例提供一种阿奇霉素干混悬剂的制备方法,包括如下步骤:1)蔗糖粉碎过60目,阿奇霉素粉碎过100目,无水磷酸三钠、羟丙纤维素、黄原胶、香精过40目备用。2)称取阿奇霉素10kg、蔗糖388kg、无水磷酸三钠1.5kg、羟丙纤维素1kg、黄原胶1kg、樱桃粉末香精1.5kg、香蕉粉末香精0.24kg、二氧化硅2kg。3)粘合剂制备:将240g羟丙纤维素加12l纯化水制备成水溶液,备用。4)阿奇霉素颗粒制备:将10kg阿奇霉素、0.76kg的羟丙纤维素、388kg蔗糖、黄原胶1kg、樱桃粉末香精1.5kg、香蕉粉末香精0.24kg加入到高速湿法制粒机混合7min后,搅拌下加入粘合剂制成软材,过24目摇摆,60℃干燥3h,得到颗粒,水分为5.1%。5)总混:将得到的颗粒、无水磷酸三钠1.5kg、二氧化硅2kg加入三维运动混合机,混合50min。6)分装:分装,即得阿奇霉素干混悬剂,取样品记为样4。对比例2本对比例提供一种阿奇霉素干混悬剂的具体制备过程:1)蔗糖粉碎过60目,阿奇霉素粉碎过100目,无水磷酸三钠、羟丙纤维素、黄原胶、香精过40目备用。2)称取阿奇霉素10kg、蔗糖388kg、无水磷酸三钠1.5kg、羟丙纤维素1kg、黄原胶1kg、樱桃粉末香精1.5kg、香蕉粉末香精0.24kg、二氧化硅2kg。3)阿奇霉素颗粒制备:阿奇霉素10kg、蔗糖388kg、无水磷酸三钠1.5kg、羟丙纤维素1kg、黄原胶1kg、樱桃粉末香精1.5kg、香蕉粉末香精0.24kg、二氧化硅2kg加入三维运动混合机,混合50min。4)分装:分装,即得阿奇霉素干混悬剂,取样品记为样5。对比例3本对比例进一步提供市售品1,购自辉瑞制药,批号890128。对比例4本对比例进一步提供采用
背景技术:
中cn109875965a中实施例1的方法制得的阿奇霉素干混悬剂,取样品记为样6。试验例1体外溶出行为对比本试验例根据溶出曲线相似性判定方法,评价实施例1~3、对比例1~4与参比制剂的相似性。相似因子f2=50·log{[1+(1/n)(rt-tt)2]-0.5·100}其中,rt为t时间参比样品测得平均溶出度;tt为t时间受试样品测得平均溶出度;n为取样时间点个数。具体的体外溶出行为测定方法如下:方法:桨法转速:50rpm介质:ph6.0磷酸盐缓冲液、ph4.5醋酸盐缓冲液,900ml温度:37.0℃取样时时间点:5、10、15、30、45、60min取样量:10ml(同时补充相同体积相同温度的溶出介质)供试品溶液配制:过滤,取续滤液进行hplc检测。参比制剂(pliva)、样1、样2、样3、样4、样5、样6、市售品1在ph4.5醋酸盐缓冲液中的平均累计溶出度见表1,溶出曲线见图2;在ph6.0磷酸盐缓冲液中的平均累计溶出度见表2,溶出曲线见图3:表1表2由表1~2、图2~3可知,样1、样2、样3、样4在ph4.5醋酸盐缓冲液中溶出曲线与参比制剂(pliva)相似,样1、样2、样3在ph6.0磷酸盐缓冲液中溶出曲线与参比制剂(pliva)相似。试验例2口味对比本试验例随机选取了10为志愿者,对实施例1、对比例1~4与参比制剂的口味进行评价,结果见下表3:表3人员pliva样1样4样5市售品1样61苦微甜微甜很苦很苦很苦2微苦微甜微甜较苦很苦很苦3较苦微苦微甜很苦较苦较苦4很苦微甜微苦较苦较苦很苦5较苦微甜微苦很苦很苦较苦6较苦微甜微苦较苦较苦很苦7较苦微甜苦很苦很苦很苦8很苦无味较苦很苦很苦很苦9很苦微甜很苦很苦很苦很苦10很苦微甜很苦很苦很苦很苦从10位不同人员对以上6种阿奇霉素干混悬剂在口味上的描述,可知本发明所述阿奇霉素干混悬剂的用药依从性较好。试验例3体内试验对比本试验例对参比制剂(pliva)、样1、样5进行体内试验,数据如表4~5、图4~5所示。具体试验方法如下:选择符合入选标准的健康成年受试者8人分别进行空腹单次给药和餐后单次给药试验,男性和女性均有,每个试验单一性别应不少于该试验受试者例数的1/3。给药后1.0,1.5,2.0,2.5,3.0,4.0,6.0,8.0,12.0,18.0,24.0,36.0,48.0h共13个时间点进行采血,检测血药浓度,并绘制血药浓度-时间曲线。n:参与试验的健康人数;c:血药浓度,ng/ml;t:时间,hr;auc:血药浓度曲线下面积,h*ng/ml。表4生物等效性(餐后)n=8药代动力学参数pliva样1样5cmax(ng/ml)486.3±103.6467.5±105.7569.8±101.3auc0-t(h*ng/ml)3929.1±693.53856.3±521.34268.8±794.6tmax(hr)2.6±0.42.6±0.52.4±0.8表5生物等效性(餐前)n=8药代动力学参数pliva样1样5cmax(ng/ml)586.3±97.6597.5±103.7610.8±110.3auc0-t(h*ng/ml)4529.1±733.14628.3±531.95269.9±789.9tmax(hr)2.5±0.32.4±0.52.2±0.4由结果可知,本发明所述阿奇霉素干混悬剂(样1)与参比制剂(阿奇霉素干混悬剂pliva)药代动力学参数更为接近,可判定二者生物学等效。综上,本发明所述阿奇霉素干混悬剂(样1)与nmpa公布的参比制剂(阿奇霉素干混悬剂pliva)体外溶出和体内行为一致,从而评价其质量与疗效一致性。且很好的掩盖了阿奇霉素的苦味,解决了儿童用药的依从性问题。虽然,上文中已经用一般性说明、具体实施方式及试验,对本发明作了详尽的描述,但在本发明基础上,可以对之作一些修改或改进,这对本领域技术人员而言是显而易见的。因此,在不偏离本发明精神的基础上所做的这些修改或改进,均属于本发明要求保护的范围。当前第1页12
相关技术
网友询问留言
已有0条留言
- 还没有人留言评论。精彩留言会获得点赞!
1