一种核酸药物复合物及其制备方法和应用与流程
本发明属于核酸纳米组装技术领域,涉及一种核酸药物复合物及其制备方法和应用。
背景技术:
近年来,随着核酸操控技术的不断发展,人们逐渐实现了对目标基因的有效编辑和沉默。核酸类基因治疗药物逐渐走上临床,在疾病的早期诊断和治疗方面表现出巨大的潜力,逐渐发展成为一种高效的疾病诊断和治疗手段。
然而,基因治疗同样也面临着一系列挑战,其中急需解决的是核酸类药物给药难的问题。现如今,临床上应用较多的基因治疗载体为病毒载体,但是病毒载体存在潜在的安全性问题,很大程度上增加了病人在基因治疗过程中的风险。除了病毒载体之外,非病毒载体如脂质体、阳离子聚合物和无机纳米颗粒等也被成功开发为传递核酸类药物的载体,但是,非病毒载体具有较高的免疫原性和细胞毒性,一定程度上限制了这类载体的应用。
cn103804473a公开了一种多肽及包含该多肽的核酸药物纳米粒,所述多肽包含带正电荷的第一片段和具有靶向功能的第二片段。利用该段多肽作为核酸药物传递载体,其第一片段通过静电作用与聚负电荷的核酸结合,形成复合物,第二片段则与肝癌细胞表面的受体结合,将核酸通过被动靶向及主动靶向而浓集于肝癌组织,大大提高了核酸药物的靶向性,减少核酸药物的使用剂量;利用本发明方法制备的多肽-核酸纳米粒稳定性好,用药安全性高,尺寸为20-300纳米,制备过程简单可控,容易规模化放大生产。但是,所述包含多肽的核酸药物纳米粒具有较高的免疫原性。
cn109288815a公开了一种可实现肿瘤靶向投递核酸药物的多级递送纳米粒子的制备方法和应用,多级递送纳米粒子被设计为核-壳结构,具有环境响应性的壳层赋予多级递送纳米粒子针对周围环境呈现不同表面特性的能力,允许多级递送纳米粒子克服多个生理屏障并将核酸药物高效送至肿瘤组织,向患有肿瘤的小鼠注射携带有荧光探针标记的质粒dna的多级递送纳米粒子实现了核酸药物在肿瘤组织中高效富集,表明利用多级递送纳米粒子完全可以实现肿瘤靶向递送核酸药物。但是,所述多级递送纳米粒子的壳层采用pei/pba作为环境响应性聚合物,具有一定的细胞毒性,且制备工艺复杂,无法实现大规模生产。
核酸一方面作为遗传信息的载体,另一方面也可通过碱基互补配对的方式组装形成具有特定尺寸和形貌的核酸纳米结构。随着核酸纳米技术的不断发展,具有良好生物相容性的核酸类纳米材料逐渐被应用于活体成像、生物检测和药物传递等各个生物医学研究领域。
因此,基于核酸类药物和核酸纳米载体之间非常高的结构同源性,开发一种高效的用于传递核酸类药物的核酸纳米载体,对于基因治疗类药物的研发具有重要的意义。
技术实现要素:
针对现有技术的不足及实际需求,本发明提供了一种核酸药物复合物及其制备方法和应用,所述核酸药物复合物具有核酸药物的靶向传递和可控释放功能,生物相容性好、安全性高,能够高效地传递核酸类药物,提高了基因治疗的效果。
为达此目的,本发明采用以下技术方案:
第一方面,本发明提供了一种核酸药物复合物,所述核酸药物复合物由支链结构、修饰在所述支链结构上的功能元件以及连接所述支链结构的桥联结构组成;
所述支链结构包括超分子和连接在所述超分子上的核酸支链;
所述功能元件通过主客体识别组装在所述支链结构的超分子上;
所述桥联结构包括核酸支链的互补链、二硫键和核酸药物;
所述桥联结构作为连接链将多个支链结构连接起来形成核酸药物复合物。
本发明中,通过合理的结构设计和序列设计,结合超分子体系的主客体识别功能,组装形成的核酸药物复合物可以实现核酸药物的靶向传递和可控释放,达到治疗疾病的目的。
同传统的非病毒载体如脂质体、阳离子聚合物和无机纳米颗粒相比,本发明的以超分子为核心的核酸药物复合物生物相容性好、安全性高,能够高效地传递核酸类药物,在疾病的早期诊断、遗传病治疗和肿瘤治疗等领域具有重要的应用价值。
根据本发明,核酸药物复合物中的超分子通过与配体分子形成主客体识别体系,使得核酸药物复合物可以装载靶向传递和可控释放等功能元件,提高了基因治疗的效果,所述超分子可以是任意的超分子结构,优选为环糊精,进一步优选为生物相容性好且被广泛应用于生物医学领域的β-环糊精。
优选地,所述核酸支链的核酸序列如seqidno:1~2所示;
seqidno:1:gagagagagagagagttttt;
seqidno:2:tttttgtgtgtgtgtgtgtg。
优选地,所述功能元件包括修饰有超分子配体的功能核酸和/或功能多肽。
优选地,所述超分子配体包括金刚烷。
本发明中,选择同β-环糊精进行主客体识别的金刚烷(ad)为配体分子,修饰在功能核酸和/或功能多肽上,有助于功能元件结合在以β-环糊精为核心的核酸药物复合物上。
优选地,所述功能性核酸包括核酸适配子muc1。
本发明向核酸药物复合物中引入核酸适配子muc1作为功能核酸,有利于实现核酸药物复合物的靶向传递。
优选地,所述核酸适配子muc1包括如seqidno:3所示的核酸序列;
seqidno:3:tttttgcagttgatcctttggataccctgg。
优选地,所述功能多肽包括内涵体逃逸肽。
本发明向核酸药物复合物中引入内涵体逃逸肽作为功能多肽,有利于实现核酸药物复合物的可控释放。
优选地,所述内涵体逃逸肽包括如seqidno:4所示的氨基酸序列;
seqidno:4:glfgaiagfiengwegmidgwyg。
优选地,所述桥联结构的核酸支链的互补链如seqidno:5~6所示;
seqidno:5:ctctctctctctctc;
seqidno:6:cacacacacacacac。
优选地,所述桥联结构的核酸药物包括靶基因的反义核酸。
本发明中,反义核酸通过末端修饰的二硫键引入到桥联结构中,有利于实现反义核酸类药物的可控释放,反义核酸的靶标可以是任意mrna,例如可以是如seqidno:7所示的靶向绿色荧光蛋白的mrna,优选地,所述反义核酸的靶标为与肿瘤发生发展相关的mrna,例如可以是如seqidno:8所示的靶向肿瘤相关基因plk1的mrna。
优选地,所述反义核酸如seqidno:7~8所示;
seqidno:7:gaccaggatgggcaccaccc;
seqidno:8:gcacttggcaaagccgccctt。
优选地,所述支链结构、功能元件和桥联结构的摩尔比为1:1:(1-7),例如可以是1:1:1、1:1:2、1:1:3、1:1:3.5、1:1:4、1:1:5、1:1:6或1:1:7。
第二方面,本发明提供了一种如第一方面所述的核酸药物复合物的制备方法,所述方法包括:
(1)构建支链结构:
(2)构建功能元件;
(3)支链结构、功能元件和桥联结构组装形成核酸药物复合物。
本发明中,核酸药物复合物的制备方法操作简单,重复性好,可以实现大规模生产。
根据本发明,利用有机合成策略,在超分子的特定官能团上偶联核酸支链,制备支链结构,优选地,步骤(1)所述构建支链结构包括以下步骤:
(1’)以β-环糊精为超分子核心,通过有机官能团化将β-环糊精的伯醇羟基转变为叠氮基团(β-cd-7n3);
(2’)将氨基修饰的核酸支链分别与含有炔基的dbco-nhs(二苯基环辛炔-活性酯)小分子反应,在核酸支链的末端修饰dbco官能团;
(3’)将末端修饰有dbco的核酸支链分别与含有叠氮基团的β-环糊精进行无铜点击反应,构建得到以β-环糊精为核心的支链结构。
优选地,步骤(3’)所述末端修饰有dbco的核酸支链与含有叠氮基团的β-环糊精的投料比为(7~14):1,例如可以是7:1、8:1、9:1、10:1、11:1、12:1、13:1或14:1。
优选地,步骤(2)所述构建功能元件包括将金刚烷成酰胺化交联在所述功能核酸上,和/或将金刚烷成酰胺化固相合成在所述功能多肽上。
优选地,步骤(3)所述支链结构、功能元件和桥联结构的摩尔比为1:1:(1~7),例如可以是1:1:1、1:1:2、1:1:3、1:1:3.5、1:1:4、1:1:5、1:1:6或1:1:7。
作为优选技术方案,本发明的核酸药物复合物中包括两种支链结构(分别在超分子上修饰seqidno:1或seqidno:2的支链核酸)和两种功能元件,摩尔比最优为支链结构i:支链结构ii:ad-muc1:ad-ha:桥联结构=1:1:1:1:7。
优选地,步骤(3)所述组装的条件为:35~40℃孵育5~10min,降温至0~4℃,孵育的温度例如可以是35℃、36℃、37℃、38℃、39℃或40℃,孵育的时间例如可以是5min、6min、7min、8min、9min或10min。
第三方面,本发明提供了一种如第一方面所述的核酸药物复合物在制备肿瘤治疗药物中的应用。
优选地,所述肿瘤包括乳腺癌、肝癌、卵巢癌、前列腺癌、非小细胞癌、头颈癌或非何金氏淋巴瘤中的任意一种。
与现有技术相比,本发明具有如下有益效果:
(1)本发明通过合理的结构设计和序列设计,结合超分子体系的主客体识别功能,制备的核酸药物复合物可以装载靶向传递和可控释放等功能元件,实现了核酸药物的靶向传递和可控释放,提高了基因治疗的效果;
(2)与传统的非病毒载体如脂质体、阳离子聚合物和无机纳米颗粒相比,本发明的以超分子为核心的核酸药物复合物生物相容性好、安全性高,能够高效地传递核酸类药物,在疾病的早期诊断、遗传病治疗和肿瘤治疗等领域具有重要的应用价值;
(3)本发明的核酸药物复合物的制备方法简便,重复性好,形成的核酸药物复合物具有确定的形貌和尺寸,可以实现大规模生产。
附图说明
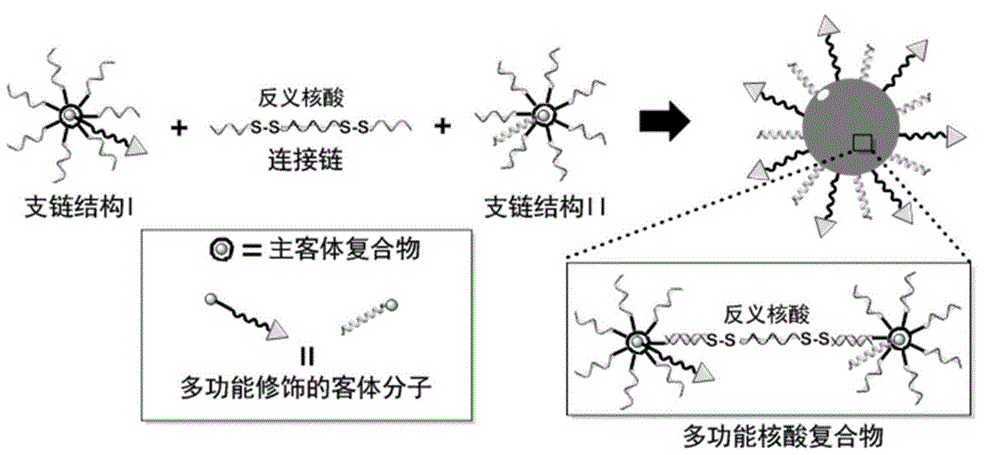
图1为核酸药物复合物的制备方法示意图;
图2为支链结构的凝胶电泳检测结果图;
图3为核酸药物复合物的凝胶电泳检测结果图;
图4为核酸药物复合物的原子力显微镜形貌表征图;
图5为核酸药物复合物对细胞内绿色荧光蛋白的沉默效果图;
图6为核酸药物复合物对肿瘤细胞的生长抑制效果图。
具体实施方式
为进一步阐述本发明所采取的技术手段及其效果,以下结合实施例和附图对本发明作进一步地说明。可以理解的是,此处所描述的具体实施方式仅仅用于解释本发明,而非对本发明的限定。
实施例中未注明具体技术或条件者,按照本领域内的文献所描述的技术或条件,或者按照产品说明书进行。所用试剂或仪器未注明生产厂商者,均为可通过正规渠道商购获得的常规产品。
实施例中采用的仪器和材料如下:
器材:梯度pcr仪(eppendorf,德国),小型高速离心机(eppendorf,德国),紫外-可见分光光度计(岛津,日本),荧光显微镜(leica,德国),全波长酶标仪(tecan,瑞士);
原料:核酸序列购自生工生物工程(上海)股份有限公司,多肽购自上海紫域生物科技有限公司,dbco-nhs有机小分子购自sigma-aldrich公司;
试剂:实验中使用的缓冲溶液1×pbs缓冲溶液(ph7.4)的组成为:136.9×10-3mol·l-1(8.00g·l-1)nacl,2.68×10-3mol·l-1(0.20g·l-1)kcl,9.75×10-3mol·l-1(1.56g·l-1)na2hpo4·h2o和1.47×10-3mol·l-1(0.20g·l-1)kh2po4,缓冲溶液的试剂均为分析纯,购自sigma-aldrich公司;细胞活力实验使用的试剂盒购自日本同仁化学;
细胞:人乳腺癌mcf7和mcf7-egfp细胞系购自中国协和医科大学基础医学研究所细胞中心;
培养基:dmem培养基(thermofisher,美国),添加10%胎牛血清(thermofisher,美国),细胞接种于100mm培养皿中,置于5%co2培养箱37℃培养,当细胞生长至融合度80%左右时传代。
实施例1核酸药物复合物的制备
图1为核酸药物复合物的制备方法示意图,具体步骤为:
(1)构建支链结构:
选择超分子体系中的β-环糊精(β-cd)为核心,通过有机官能团化将β-环糊精的伯醇羟基转变为叠氮基团(β-cd-7n3);
选择两条末端修饰氨基的核酸序列seqidno:1(f):gagagagagagagagttttt(3’端氨基修饰),seqidno:2(r):tttttgtgtgtgtgtgtgtg(5’端氨基修饰),分别同含有炔基的dbco-nhs小分子反应,在核酸支链的末端修饰dbco官能团;
将末端修饰有dbco的核酸支链(f-dbco和r-dbco)分别同β-cd-7n3进行无铜点击反应,其中dbco修饰的核酸支链与β-cd-7n3的摩尔比例为14:1,构建以β-环糊精为核心的支链核酸结构,并将其命名为支链结构i和支链结构ii;
(2)构建功能元件:
选择同β-环糊精进行主客体识别的金刚烷(ad)为配体分子,将nhs活化的羧酸化金刚烷(ad-nhs)同5’端氨基修饰的具有细胞靶向功能的核酸适配子muc1seqidno:3(tttttgcagttgatcctttggataccctgg)进行交联,构建金刚烷修饰的核酸适配子(ad-muc1);
通过多肽固相合成的方式在具有可控释放功能的内涵体逃逸肽seqidno:4(ha:glfgaiagfiengwegmidgwyg)的n端修饰金刚烷,构建金刚烷修饰的多肽(ad-ha);
(3)支链结构、功能元件和桥联结构组装形成核酸药物复合物:
桥联结构中的反义核酸序列靶向绿色荧光蛋白的mrna,具体为:
ctctctctctctctcs-sgaccaggatgggcaccacccs-scacacacacacacac(linker-egfp:靶向绿色荧光蛋白的mrna);
将步骤(1)得到的支链结构i和支链结构ii、步骤(2)中得到的金刚烷修饰的核酸适配子(ad-muc1)和内涵体逃逸肽(ad-ha),以及桥联结构(linker-egfp)以摩尔比为1:1:1:1:7在37℃下孵育5min后,逐渐缓慢降温至4℃,构建得到以β-环糊精为核心的核酸药物复合物。
图2为步骤(1)构建的支链结构的凝胶电泳检测结果图,其中泳道1为双链dnamarker,泳道2为支链结构i,泳道3为支链结构ii,说明支链结构成功构建。
图3为步骤(3)构建的核酸药物复合物的凝胶电泳检测结果图,其中泳道1为支链结构i,泳道2为支链结构i与桥联结构的组装体,泳道3为支链结构i和支链结构ii与桥联结构的组装体,泳道4为支链结构i和支链结构ii与桥联结构的组装体装载上金刚烷修饰的核酸适配子(ad-muc1)和内涵体逃逸肽(ad-ha)的核酸药物复合物。可以看出,核酸药物复合物能够很好地进入凝胶,并表现出相对于支链结构、支链结构与桥联结构的组装体更为滞后的电泳行为。
图4为构建的核酸药物复合物的原子力显微镜形貌表征图,核酸药物复合物具有良好的纳米颗粒的形貌,粒径为80±15nm。
实施例2核酸药物复合物对细胞内绿色荧光蛋白的沉默效果
稳定表达绿色荧光蛋白的人乳腺癌mcf7-egfp细胞接种于35mm培养皿中,置于5%co2培养箱37℃过夜培养;
将实施例1制备的核酸药物复合物加入到mcf7-egfp细胞培养基中(药物浓度:100nm),作为有靶向结构组,同时设置pbs对照组、单独的靶基因egfp的反义核酸组和未修饰有功能元件的核酸复合物组(无靶向结构组);
孵育72小时后,通过荧光显微镜观察绿色荧光蛋白的荧光强度。
结果如图5所示,单独的反义核酸基本不能进入细胞,未表现出明显的沉默效果;无靶向结构组能部分进入细胞,表现出对绿色荧光蛋白一定的沉默效果;有靶向结构组能充分地进入靶细胞,表现出非常明显的绿色荧光蛋白沉默效果。
实施例3
与实施例1相比,步骤(3)中采用的桥联结构的核酸序列为:
ctctctctctctctcs-sgcacttggcaaagccgccctts-scacacacacacacac(linker-plk1:靶向肿瘤相关基因plk1的mrna),其他条件与实施例1相同。
实施例4核酸药物复合物对肿瘤细胞的生长抑制效果
人乳腺癌mcf7细胞接种于100mm培养皿中,置于5%co2培养箱37℃过夜培养;
培养细胞至对数生长期,采用胰蛋白酶消化并收集细胞,调整细胞悬液浓度为5×104个/ml,接种于96孔板中,每孔100μl;
将96孔板置于co2培养箱中过夜培养,吸出培养液,将实施例3制备的核酸药物复合物混合到新的培养基中,加入到mcf7-egfp细胞中(药物浓度:100nm),作为有靶向结构组,同时设置pbs对照组、单独的靶基因plk1的反义核酸组和未修饰有功能元件的核酸复合物组(无靶向结构组);
孵育72小时后,弃掉培养基,加入细胞活力检测试剂,每孔100μl,继续孵育1小时;
用酶标仪检测每孔在450nm处的od值,根据od值计算出肿瘤细胞存活率,计算公式为:存活率%=实验组od值/对照组od值×100。
结果如图6所示,单独的反义核酸不能进入细胞,未表现出明显的肿瘤细胞抑制效果;无靶向结构组表现出一定的肿瘤细胞抑制能力(细胞存活率<80%);有靶向结构组表现出最强的肿瘤细胞抑制效果(细胞存活率<25%)。由此可知,经靶向修饰的超分子为核心的核酸药物复合物能够高效传递反义核酸序列,表现出显著的肿瘤抑制效果。
综上所述,本发明中以超分子为核心的支链结构能够快速并高效地装载反义核酸序列,形成具有一定形貌和尺寸的核酸药物复合物;所述核酸药物复合物通过主客体识别装载靶向传递和可控释放等功能元件,极大程度上提高基因治疗的效果;本发明只需通过简单的核酸序列设计,就能够实现具有不同靶标的反义核酸序列的引入,在疾病治疗药物的研究领域具有广阔的应用前景。
申请人声明,本发明通过上述实施例来说明本发明的详细方法,但本发明并不局限于上述详细方法,即不意味着本发明必须依赖上述详细方法才能实施。所属技术领域的技术人员应该明了,对本发明的任何改进,对本发明产品各原料的等效替换及辅助成分的添加、具体方式的选择等,均落在本发明的保护范围和公开范围之内。
sequencelisting
<110>国家纳米科学中心
<120>一种核酸药物复合物及其制备方法和应用
<130>20190916
<160>8
<170>patentinversion3.3
<210>1
<211>20
<212>dna
<213>人工合成
<400>1
gagagagagagagagttttt20
<210>2
<211>20
<212>dna
<213>人工合成
<400>2
tttttgtgtgtgtgtgtgtg20
<210>3
<211>30
<212>dna
<213>人工合成
<400>3
tttttgcagttgatcctttggataccctgg30
<210>4
<211>23
<212>prt
<213>人工合成
<400>4
glyleupheglyalailealaglypheilegluasnglytrpglugly
151015
metileaspglytrptyrgly
20
<210>5
<211>15
<212>dna
<213>人工合成
<400>5
ctctctctctctctc15
<210>6
<211>15
<212>dna
<213>人工合成
<400>6
cacacacacacacac15
<210>7
<211>20
<212>dna
<213>人工合成
<400>7
gaccaggatgggcaccaccc20
<210>8
<211>21
<212>dna
<213>人工合成
<400>8
gcacttggcaaagccgccctt21
- 还没有人留言评论。精彩留言会获得点赞!