茶多酚在作为免疫检查点抑制剂及制备用于抗肿瘤的药物中的应用的制作方法
本发明涉及生物医药技术领域,尤其是涉及一种茶多酚在作为免疫检查点抑制剂及制备用于抗肿瘤的药物中的应用。
背景技术:
恶性肿瘤已成为人类面临的最大威胁之一。如何实现对肿瘤的有效治疗成为世界性的难题。经过多年的不断探索,肿瘤免疫治疗终于取得了重要的研究成果,以pd-1/pd-l1抗体为代表的免疫检查点阻断治疗对多种肿瘤具有良好的疗效。cd8+t细胞活化会上调抑制性受体pd-1以控制免疫的过度活化而引起的自身免疫性疾病;而在肿瘤微环境中,肿瘤细胞及多种炎性细胞通过高表达pd-1配体pd-l1或者pd-l2,使t细胞耗竭,进而抑制t细胞的抗肿瘤杀伤功能,使得肿瘤实现免疫逃逸。
尽管pd-1/pd-l1抗体对多种肿瘤均有一定的效应,但整体的客观总反映率(orr)通常低于30%;另外25%的使用pd-1/pd-l1抗体的病人会产生获得性抵抗机制,对肿瘤免疫治疗产生抗性,影响肿瘤治疗及治愈。目前对于获得性抵抗机制的产生还没有很好的解释,对于具有获得性抵抗机制的病人的肿瘤发展也无有效药物。并且,以pd-1抗体为代表的免疫检查点治疗药物制备复杂、价格昂贵,成本较高。
有鉴于此,特提出本发明。
技术实现要素:
本发明的第一个目的在于提供茶多酚在作为免疫检查点抑制剂中的应用,以至少缓解现有技术中存在的技术问题之一。
本发明的第二个目的在于提供茶多酚在制备用于抗肿瘤的药物中的应用,以至少缓解现有技术中存在的技术问题之一。
本发明提供了茶多酚或其药学可接受的盐在作为免疫检查点抑制剂中的应用,所述免疫检查点包括程序性细胞死亡蛋白1(pd-1)、程序性死亡配体1(pd-l1)或程序性死亡配体2(pd-l2)中的一种或多种。
本发明提供了一种茶多酚或其药学可接受的盐,用于治疗和/或预防肿瘤。
本发明提供了一种药物组合物,用于治疗和/或预防肿瘤,药物组合物包括茶多酚或其药学可接受的盐和药学上可接受的辅料。
本发明提供了一种用于抑制免疫检查点在受试者中表达的方法,包括向受试者施用茶多酚或其药学可接受的盐、或本公开的的组合物。
在一种或多种实施方式中,免疫检查点包括pd-1、pd-l1或pd-l2中的一种或多种。
本发明提供了一种抑制第一细胞表达pd-1和/或第二细胞表达pd-l1和/或pd-l2的方法,包括:使第一细胞和/或第二细胞与茶多酚或其药学可接受的盐进行接触。
在一种或多种实施方式中,接触在体外进行。
在一种或多种实施方式中,接触在体内进行。
在一种或多种实施方式中,第一细胞为免疫细胞。
在一种或多种实施方式中,第二细胞为癌细胞或炎性细胞。
在一种或多种实施方式中,所述茶多酚包括儿茶素类、黄酮、黄酮醇类、花青素类、酚酸、缩酚酸类或聚合酚类中的一种或多种,优选为儿茶素类;
优选地,所述儿茶素包括表没食子儿茶素没食子酸酯、表没食子儿茶素、表儿茶素没食子酸酯或表儿茶素中的一种或多种;优选为表没食子儿茶素没食子酸酯;
优选地,所述表没食子儿茶素没食子酸酯包括纳米类表没食子儿茶素没食子酸酯。
进一步地,所述表没食子儿茶素没食子酸酯通过抑制stat1通路实现对免疫检查点pd-1、pd-l1和/或pd-l2的表达抑制。
另外,本发明还提供了上述的免疫检查点抑制剂在制备用于抗肿瘤的药物中的应用,所述免疫检查点抑制剂为茶多酚,所述免疫检查点包括pd-1、pd-l1或pd-l2中的一种或多种,所述茶多酚通过抑制免疫检查点的表达实现抗肿瘤。
进一步地,所述肿瘤包括黑色素瘤、乳腺癌肿瘤、膀胱癌肿瘤、头颈癌肿瘤、肺癌肿瘤、结肠癌肿瘤、直肠癌肿瘤、胃癌肿瘤、前列腺癌肿瘤、肝癌肿瘤、胰腺癌肿瘤、卵巢癌肿瘤或淋巴瘤。
进一步地,所述用于抗肿瘤的药物还包括药学上可接受的辅料。
进一步地,所述用于抗肿瘤的药物的剂型包括口服制剂或注射制剂;
优选地,所述口服制剂包括片剂、胶囊剂、颗粒剂、丸剂、糖浆剂、口服溶液剂、口服混悬剂或口服乳剂;
优选地,所述注射制剂包括注射液或粉针剂。
进一步地,所述用于抗肿瘤的药物的有效给药剂量为注射2-6mg/kg/天,优选为2-5mg/kg/天,更优选为3-4mg/kg/天;或
所述用于抗肿瘤的药物的有效给药剂量为口服5-40mg/kg/天,优选为10-35mg/kg/天,更优选为15-25mg/kg/天。
进一步地,所述茶多酚包括儿茶素类、黄酮、黄酮醇类、花青素类、酚酸、缩酚酸类或聚合酚类中的一种或多种,优选为儿茶素类;
优选地,所述儿茶素包括表没食子儿茶素没食子酸酯、表没食子儿茶素、表儿茶素没食子酸酯或表儿茶素中的一种或多种;优选为表没食子儿茶素没食子酸酯;
优选地,所述表没食子儿茶素没食子酸酯包括纳米类表没食子儿茶素没食子酸酯。
本发明的发明人根据大量实验验证茶多酚可作为免疫检查点pd-1、pd-l1和pd-l2的抑制剂,茶多酚可显著抑制免疫细胞及肿瘤细胞免疫检查点相关信号通路的表达,降低免疫细胞及肿瘤细胞细胞表面的免疫检查点受体和配体的表达,从而既可以提高免疫细胞的抗肿瘤能力,又可以从肿瘤内部解除产生肿瘤免疫抑制的免疫检查点配体的表达,阻止肿瘤免疫逃逸的发生。因此可以利用茶多酚制备针对免疫检查点的抗肿瘤免疫药物,或者抗肿瘤免疫辅助药物进行肿瘤治疗或预防。此外,茶多酚的制备相对简单、经济,因此本发明不仅可以更有效的解除肿瘤微环境中的免疫抑制,同时可以以更低廉的价格实现对肿瘤的治疗。
附图说明
为了更清楚地说明本发明具体实施方式或现有技术中的技术方案,下面将对具体实施方式或现有技术描述中所需要使用的附图作简单地介绍,显而易见地,下面描述中的附图是本发明的一些实施方式,对于本领域普通技术人员来讲,在不付出创造性劳动的前提下,还可以根据这些附图获得其他的附图。
图1a为本发明实施例1提供的使用10μmegcg处理ifnγ刺激的1205lu人黑色素瘤细胞24小时后,pd-l1的mrna的qpcr检测结果图;
图1b为本发明实施例1提供的使用10μmegcg处理ifnγ刺激的a375人黑色素瘤细胞24小时后,pd-l1的mrna的qpcr检测结果图;
图1c为本发明实施例1提供的使用10μmegcg处理ifnγ刺激的mcf7人乳腺癌细胞24小时后,pd-l1的mrna的qpcr检测结果图;
图1d为本发明实施例1提供的使用30μmegcg处理ifnγ刺激的mda-mb-231人乳腺癌细胞24小时后,pd-l1的mrna的qpcr检测结果图;
图2a为本发明实施例1提供的使用10μmegcg处理ifnγ刺激的1205lu人黑色素瘤细胞24小时后,pd-l2的mrna的qpcr检测结果图;
图2b为本发明实施例1提供的使用10μmegcg处理ifnγ刺激的a375人黑色素瘤细胞24小时后,pd-l2的mrna的qpcr检测结果图;
图2c为本发明实施例1提供的使用10μmegcg处理ifnγ刺激的mcf7人乳腺癌细胞24小时后,pd-l2的mrna的qpcr检测结果图;
图2d为本发明实施例1提供的使用30μmegcg处理ifnγ刺激的mda-mb-231人乳腺癌细胞24小时后,pd-l2的mrna的qpcr检测结果图;
图3a为本发明实施例1提供的使用10μmegcg处理ifnγ刺激的1205lu人黑色素瘤细胞24小时后,细胞表面pd-l1蛋白表达的流式细胞仪检测结果图;
图3b为本发明实施例1提供的使用10μmegcg处理ifnγ刺激的a375人黑色素瘤细胞24小时后,细胞表面pd-l1蛋白表达的流式细胞仪检测结果图;
图3c为本发明实施例1提供的使用10μmegcg处理ifnγ刺激的mcf7人乳腺癌细胞24小时后,细胞表面pd-l1蛋白表达的流式细胞仪检测结果图;
图3d为本发明实施例1提供的使用30μmegcg处理ifnγ刺激的mda-mb-231人乳腺癌细胞24小时后,细胞表面pd-l1蛋白表达的流式细胞仪检测结果图;
图4a为本发明实施例1提供的使用10μmegcg处理ifnγ刺激的1205lu人黑色素瘤细胞24小时后,细胞表面pd-l2蛋白表达的流式细胞仪检测结果图;
图4b为本发明实施例1提供的使用10μmegcg处理ifnγ刺激的a375人黑色素瘤细胞24小时后,细胞表面pd-l2蛋白表达的流式细胞仪检测结果图;
图4c为本发明实施例1提供的使用10μmegcg处理ifnγ刺激的mcf7人乳腺癌细胞24小时后,细胞表面pd-l2蛋白表达的流式细胞仪检测结果图;
图4d为本发明实施例1提供的使用30μmegcg处理ifnγ刺激的mda-mb-231人乳腺癌细胞24小时后,细胞表面pd-l2蛋白表达的流式细胞仪检测结果图;
图5a为本发明实施例1提供的使用10μmegcg处理ifnγ刺激的1205lu人黑色素瘤细胞24小时后,stat1的mrna的qpcr检测结果图;
图5b为本发明实施例1提供的使用10μmegcg处理ifnγ刺激的1205lu人黑色素瘤细胞24小时后,irf1的mrna的qpcr检测结果图;
图5c为本发明实施例1提供的使用10μmegcg处理ifnγ刺激的1205lu人黑色素瘤细胞24小时后,磷酸化stat1、stat1、irf1的蛋白表达的western-blot检测结果图;
图6a为本发明实施例1提供的使用30μmegcg处理cd3/cd28激活的t淋巴细胞24小时后,cd3+t细胞表面pd-1蛋白表达的流式细胞仪检测结果图;
图6b为本发明实施例1提供的使用30μmegcg处理cd3/cd28激活的t淋巴细胞24小时后,cd4+t细胞表面pd-1蛋白表达的流式细胞仪检测结果图;
图6c为本发明实施例1提供的使用30μmegcg处理cd3/cd28激活的t淋巴细胞24小时后,cd8+t细胞表面pd-1蛋白表达的流式细胞仪检测结果图;
图7a为本发明实施例1提供的使用30μmegcg处理cd3/cd28激活的t淋巴细胞24小时后,cd3+t细胞表面pd-1蛋白表达的流式细胞仪检测的平均荧光强度柱状统计结果图;
图7b为本发明实施例1提供的使用30μmegcg处理cd3/cd28激活的t淋巴细胞24小时后,cd4+t细胞表面pd-1蛋白表达的流式细胞仪检测的平均荧光强度柱状统计结果图;
图7c为本发明实施例1提供的使用30μmegcg处理cd3/cd28激活后t淋巴细胞24小时后,cd8+t细胞表面pd-1蛋白表达的流式细胞仪检测的平均荧光强度柱状统计结果图;
图8a为本发明实施例1提供的使用10μmegcg处理ifnγ刺激的b16f10小鼠黑色素瘤细胞24小时后,细胞表面pd-l1蛋白表达的流式细胞仪检测结果图;
图8b为本发明实施例1提供的使用10μmegcg处理ifnγ刺激的b16f10小鼠黑色素瘤细胞24小时后,细胞表面pd-l2蛋白表达的流式细胞仪检测结果图;
图8c为本发明实施例1提供的使用10μmegcg处理ifnγ刺激的b16f10小鼠黑色素瘤细胞24小时后,pd-l1的mrna的qpcr检测结果图;
图8d为本发明实施例1提供的使用10μmegcg处理ifnγ刺激的b16f10小鼠黑色素瘤细胞24小时后,pd-l2的mrna的qpcr检测结果图;
图9a为本发明实施例1提供的使用10μmegcg处理ifnγ刺激的b16f10与b16f10特异激活的c57bl6小鼠脾脏cd8+t细胞共孵育4小时后,培养基中ldh含量的检测结果图,其结果为t细胞对b16f10肿瘤细胞的特异杀伤;
图9b为本发明实施例1提供的使用1μmegcg处理的b16f10.cova.rfp细胞与特异激活的ot-1小鼠脾脏cd8+t细胞共孵育24小时后,肿瘤细胞caspase-3的激活情况检测结果图,其结果为t细胞对b16f10.cova.rfp肿瘤细胞的特异杀伤;
图10为本发明实施例1提供的腹腔注射egcg的c57bl6小鼠的b16f10黑色素瘤尺寸变化图;
图11a为本发明实施例1提供的egcg对c57bl6小鼠肿瘤组织中pd-l1转录水平的影响的结果图;
图11b为本发明实施例1提供的egcg对c57bl6小鼠肿瘤组织中pd-l2转录水平的影响的结果图;
图11c为本发明实施例1提供的egcg对c57bl6小鼠肿瘤组织中stat1转录水平的影响的结果图;
图11d为本发明实施例1提供的egcg对c57bl6小鼠肿瘤组织中irf1转录水平的影响的结果图;
图11e为本发明实施例1提供的egcg对c57bl6小鼠肿瘤组织中磷酸化stat1、stat1、irf1和pd-l1蛋白水平表达影响的结果图;
图12为本发明实施例1提供的负瘤c57bl6小鼠注射egcg后,其脾脏和近肿瘤淋巴结t细胞种群组成比例变化情况图。
图13为本发明实施例1提供的c57bl6小鼠皮下注射b16f10肿瘤后,各处理组中肿瘤尺寸变化曲线图。
具体实施方式
下面将结合实施例对本发明的技术方案进行清楚、完整地描述,显然,所描述的实施例是本发明一部分实施例,而不是全部的实施例。基于本发明中的实施例,本领域普通技术人员在没有做出创造性劳动前提下所获得的所有其他实施例,都属于本发明保护的范围。
需要说明的是:
本发明中,如果没有特别的说明,本文所提到的所有实施方式以及优选实施方法可以相互组合形成新的技术方案。
本发明中,如果没有特别的说明,本文所提到的所有技术特征以及优选特征可以相互组合形成新的技术方案。
本发明所公开的“范围”以下限和上限的形式,可以分别为一个或多个下限,和一个或多个上限。
本发明中,“优选地”和“优选的”是指在某些情况下可以提供某些益处的本发明的实施例。然而,在相同或其他情况下,其他实施例也可以是优选的。此外,一个或多个优选实施例的叙述并不意味着其他实施例是无用的,并且不旨在将其他实施例排除在本发明的范围之外。
除非另有说明,本文中所用的专业与科学术语与本领域熟练人员所熟悉的意义相同。此外,任何与所记载内容相似或均等的方法或材料也可应用于本发明中。
根据本发明的一个方面,提供了茶多酚在作为免疫检查点抑制剂中的应用,所述免疫检查点包括pd-1、pd-l1或pd-l2中的一种或多种。
茶多酚是指茶叶中一大类组成复杂、分子量及其结构差异很大的多酚类化合物及其衍生物的混合物,主要化学成分为儿茶素类(黄烷醇类)、黄酮及黄酮醇类、花青素类、酚酸及缩酚酸类、聚合酚类等化合物的复合体。
免疫检查点(immunecheckpoints)是大量分布在免疫体系中的调节性通路,对维持机体自身的耐受、免疫应答的时间和免疫应激的强弱起到关键的调节作用。免疫检查点在免疫激活后开始参与反应,作为减少炎症的自然抑制反馈环路发挥作用,保障并减少免疫反应对周围组织可能造成的免疫损伤,从而避免正常组织的附带受累。而肿瘤却可以利用免疫检查点通路作为免疫逃避的主要机制,特别是逃避可以识别肿瘤特异性抗原t细胞的免疫杀伤。
本发明的发明人根据大量实验验证茶多酚可作为免疫检查点的抑制剂,茶多酚可以显著抑制免疫细胞及肿瘤细胞免疫检查点相关信号通路的表达,降低免疫细胞及肿瘤细胞细胞表面的免疫检查点受体和配体的数量,既可以提高免疫细胞的抗肿瘤免疫杀伤,又可以从肿瘤内部解除产生肿瘤免疫抑制的免疫检查点配体的表达,阻止肿瘤免疫逃逸的发生。因此可以利用茶多酚制备针对免疫检查点的抗肿瘤免疫药物,或者抗肿瘤免疫辅助药物进行抗肿瘤免疫治疗。此外,茶多酚的制备相对简单、经济,因此本发明不仅可以更有效的解除肿瘤微环境中的免疫抑制,同时可以以更低廉的价格实现对肿瘤的治疗。
本发明中典型的茶多酚对免疫检查点的抑制可以通过阻断免疫检查点的表达通路来抑制免疫检查点的表达。
在一些优选的实施方式中,所述茶多酚包括儿儿茶素类、黄酮、黄酮醇类、花青素类、酚酸、缩酚酸类或聚合酚类中的一种或多种,优选为儿茶素类。
儿茶素在茶多酚中的含量最高,更易于提取,优选儿茶素作为免疫检查点抑制剂在抑制免疫检查点表达上的效率及作用更强,从而达到阻止肿瘤免疫逃逸的目的。
优选地,所述儿茶素包括egcg(表没食子儿茶素没食子酸酯)、egc(表没食子儿茶素)、ecg(表儿茶素没食子酸酯)和ec(表儿茶素)中的一种或多种;优选为egcg,是因为egcg的生物可利用度相对较高。
egcg可以抑制t细胞表面pd-1的表达,从而充分解除cd8+t细胞的免疫失活,进而激活抗肿瘤免疫反应,实现肿瘤的治疗。
优选地,所述egcg包括纳米类egcg。
纳米类egcg是指利用纳米技术,对egcg进行包裹或包装的所有纳米类药物。利用纳米药物的技术将egcg制备为纳米egcg,能够有效提高egcg的生物可利用性,增加egcg的肿瘤靶向,使egcg可以特意的在肿瘤部位有效富集及释放,进而增加egcg的肿瘤靶向和生物可利用性。
在一些优选的实施方式中,所述egcg通过抑制stat1通路实现免疫检查点的表达抑制。
其中,stat1通路为stat1-irf1通路,免疫检查点包括pd-1,pd-l1和pd-l2。
根据本发明的另一个方面,提供了上述的免疫检查点抑制剂在制备用于抗肿瘤的药物中的应用,所述免疫检查点抑制剂为茶多酚,所述免疫检查点包括pd-1、pd-l1和/或pd-l2中的一种或多种,所述茶多酚通过抑制免疫检查点的表达实现抗肿瘤。
在一些优选的实施方式中,所述肿瘤包括黑色素瘤、乳腺癌肿瘤、膀胱癌肿瘤、头颈癌肿瘤、肺癌肿瘤、结肠癌肿瘤、直肠癌肿瘤、胃癌肿瘤、前列腺癌肿瘤、肝癌肿瘤、胰腺癌肿瘤、卵巢癌肿瘤或淋巴瘤。
在一些优选的实施方式中,所述用于抗肿瘤的药物还包括药学上可接受的辅料。
药学上可接受的辅料是指生产药品和调配处方时,使用的赋形剂和附加剂,是指除活性成分外,在安全性方面已进行了合理的评估,并且包含在药物制剂中的物质。同一药用辅料可用于不同给药途径的药物制剂,且有不同的作用和用途。在本发明提供的药物中添加的药学上可接受的辅料,能够起到赋型、充当载体或提高稳定性的作用,此外,还具有增溶、助溶或缓控释等重要功能。
典型但非限制性的药学上可接受的辅料包括:溶剂、抛射剂、增溶剂、助溶剂、乳化剂、着色剂、黏合剂、崩解剂、填充剂、润滑剂、湿润剂、渗透压调节剂、稳定剂、助流剂、矫味剂、防腐剂、助悬剂、包衣材料、芳香剂、抗黏着剂、抗氧剂、螯合剂、渗透促进剂、ph调节剂、缓冲剂、增塑剂、表面活性剂、发泡剂、消泡剂、增稠剂、包合剂、保湿剂、吸收剂、稀释剂、絮凝剂与反絮凝剂、助滤剂或释放阻滞剂中的一种或多种。
在一些优选的实施方式中,药物的剂型包括口服制剂或注射制剂。
当口服用药时,上述药物可制成任意口服可接受的制剂形式,例如可以为,但不限于片剂、胶囊剂、颗粒剂、丸剂、糖浆剂、口服溶液剂、口服混悬剂或口服乳剂。
其中,片剂使用的载体一般包括乳糖和玉米淀粉,另外也可加入润滑剂如硬脂酸镁。胶囊剂使用的稀释剂一般包括乳糖和干燥玉米淀粉。口服混悬剂则通常是将活性成分与适宜的乳化剂和悬浮剂混合使用。
任选地,以上口服制剂形式中还可加入一些甜味剂、芳香剂或着色剂。
当以注射的形式给药时,上述药物可制成任意注射可接受的制剂形式,例如可以为,但不限于注射液或粉针剂。
其中,可使用的载体和溶剂包括水、林格氏溶液和等渗氯化钠溶液。另外,灭菌的非挥发油也可用作溶剂或悬浮介质,如单甘油酯或二甘油酯。
在一些优选的实施方式中,所述用于抗肿瘤的药物的有效给药剂量为静脉注射2-6mg/kg/天,例如可以为,但不限于2mg/kg/天、3mg/kg/天、4mg/kg/天、5mg/kg/天或6mg/kg/天。或,
所述用于抗肿瘤的药物的有效给药剂量为口服5-40mg/kg/天,例如可以为,但不限于5mg/kg/天、6.7mg/kg/天、10mg/kg/天、15mg/kg/天、20mg/kg/天、25mg/kg/天、30mg/kg/天、32.4mg/kg/天、35mg/kg/天或40mg/kg/天。
在一些优选的实施方式中,给药频率例如可以为,但不限于每天两次、每天一次、每两天一次、每周一次或每月一次给药。或者,可以以缓释制剂的形式给予本发明提供的药物,在这种情况下,需要较少的给药频率。
给药剂量和频率根据制剂在用药者体内的半衰期而不同,在治疗性应用中,有时需要以相对短的间隔给予相对高的剂量,直至疾病的进展被延缓或停止,并优选地直至个体表现出疾病症状的部分或完全改善,在此之后,可以给予患者预防方案。
优选的注射给药剂量为2-5mg/kg/天,更优选为3-4mg/kg/天;
优选的口服给药剂量为10-35mg/kg/天,更优选为15-25mg/kg/天。
典型但非限制性的治疗性给药为注射给药,预防性给药为口服给药。
当给药剂量在上述优选范围内时,作为免疫检查点抑制剂制备得到的药物更易抑制免疫检查点的表达,从而更好地达到阻止肿瘤的免疫逃逸反应的目的。
为了有助于更清楚的理解本发明的内容,现结合具体的实施例详细介绍如下。
如无特别说明,本发明实施例中使用的细胞、药品及试剂均来源为正规而易购渠道:
细胞均购买于美国atcc,细胞因子均购买于thermofisherscientific公司,egcg购买于enzolifescience公司,流式细胞仪为beckmancoulter公司,流式抗体购买于ebioscience公司,real-timepcr仪器为roche公司,反转录试剂盒及qpcr试剂为qiagen公司,wb抗体为cellsignalingtechnology公司,wb仪器为bio-radlaboratories公司。
实施例1egcg抑制免疫检查点受体表达
1205lu和a375人黑色素瘤细胞或mcf7和mda-mb-231人乳腺癌细胞被接种于六孔板中培养12小时后,处理组细胞中加入含有10ng/mlifnγ的培养基以刺激pd-l1和pd-l2的表达,2小时后,egcg处理组细胞中加入10或30μmegcg,之后共培养24小时后,收集细胞,进行rna提取和反转录,并利用real-timepcr检测pd-l1和pd-l2的mrna表达情况(gapdh为管家基因)。
结果如图1a、1b、1c、1d、图2a、2b、2c和2d所示。ifnγ刺激1205lu和a375人黑色素瘤细胞或mcf7和mda-mb-231人乳腺癌细胞24小时后,收集细胞并qpcr检测pd-l1或pd-l2的基因表达情况,发现其pd-l1或者pd-l2的表达升高。10μm-30μmegcg处理被刺激细胞24小时候后,pd-l1或者pd-l2的基因表达显著降低。**p<0.01,***p<0.001。
1205lu和a375人黑色素瘤细胞或mcf7和mda-mb-231人乳腺癌细胞被接种于六孔板中培养12小时后,处理组细胞中加入含有10ng/mlifnγ的培养基以刺激pd-l1和pd-l2的表达,2小时后egcg处理组细胞中加入10或30μmegcg,之后共培养24小时后,收集细胞,与流式细胞仪pd-l1和pd-l2抗体共孵育30分钟后,清洗细胞,用流式细胞仪检测肿瘤细胞表面蛋白表达水平。
结果如图3a、3b、3c、3d和图4a、4b、4c和4d所示,ifnγ刺激1205lu和a375人黑色素瘤细胞或mcf7和mda-mb-231人乳腺癌细胞24小时后,流式细胞仪检测细胞表面pd-l1或pd-l2的表达,发现其pd-l1或者pd-l2的表达显著升高。10μm-30μmegcg处理被刺激细胞24小时候后,pd-l1或者pd-l2的表达降低,其中,ifnγ刺激的mcf7和231细胞中的pd-l2的表达变化不明显,所以egcg处理后表面蛋白抑制也不明显。
1205lu肿瘤细胞被接种于六孔板中培养12小时,之后处理组细胞加入浓度为10ng/mlifnγ培养基,2小时后egcg处理组细胞加入10μmegcg,之后共培养24小时,收集细胞,进行rna提取及反转录,并利用real-timepcr检测stat1和irf1的mrna表达情况(gapdh为管家基因);进行蛋白提取,利用western-blot技术检测磷酸化和本底stat1蛋白表达以及irf-1蛋白表达情况。
结果如图5a、5b和5c所示,egcg处理能够显著抑制ifnγ刺激的1205lu人黑色素瘤细胞中stat1信号通路的mrna及磷酸化和本底蛋白的表达,也能够显著抑制ifnγ刺激的1205lu人黑色素瘤细胞中irf1信号通路的mrna及蛋白的表达。
利用ficoll-paque(ge公司)密度离心的方法,分离人血液中的淋巴细胞,并用cd3+pantcellsnegativeselection(macsmiltenyibiotec)的方法分离纯化cd3+t细胞。之后处理组t细胞用cd3/cd28磁珠(gibco公司)激活24小时后,去除激活磁珠,egcg组加入30μmegcg处理。24小时后,收集t细胞(无cd3/cd28激活组为control,cd3/cd28激活组为activated,激活后加入egcg处理的为activated+egcg),流式细胞仪抗体cd3+,cd4+,cd8+,pd-1与t细胞共孵育30分钟,清洗细胞后,上流式细胞仪检测各淋巴细胞组分细胞表面pd-1蛋白的表达变化。
结果如图6a、6b、6c、7a、7b和7c所示。人血液中分离的人cd3+t细胞,用cd3/cd28磁珠体外激活24小时后,cd3+,cd4+和cd8+t细胞细胞表面pd-1蛋白会有显著的增高;加入30μmegcg处理t细胞24小时后,收集细胞进行流式细胞仪检测并分别鉴定cd3+,cd4+和cd8+t细胞细胞表面pd-1蛋白表达水平,发现egcg可以显著抑制激活的cd3+,cd4+和cd8+t细胞表面的pd-1蛋白的表达水平。**p<0.01,***p<0.001,n=3。
在小鼠黑色素瘤模型中,egcg持续给药可以使肿瘤体积显著降低,pd-l1表达显著抑制,t细胞活化显著增强。
小鼠黑色素瘤细胞b16f10接种于六孔板中培养12小时,之后处理组细胞中加入含有5ng/mlifnγ的培养基,2小时后,egcg处理组细胞加入10或30μmegcg,之后共培养24小时,收集细胞,与流式细胞仪pd-l1和pd-l2抗体共孵育30分钟后,清洗细胞,并用流式细胞仪检测肿瘤细胞表面蛋白表达水平。
结果如图8a、8b、8c和8d所示,b16f10小鼠黑色素瘤细胞系被ifnγ刺激后给予egcg处理,之后收集细胞进行pd-l1和pd-l2的mrna检测(gapdh为管家基因),并用流式细胞仪检测细胞表面pd-l1和pd-l2蛋白,发现egcg可以显著抑制pd-l1的mrna和蛋白表达,但是pd-l2在小鼠b16f10细胞系中不表达;
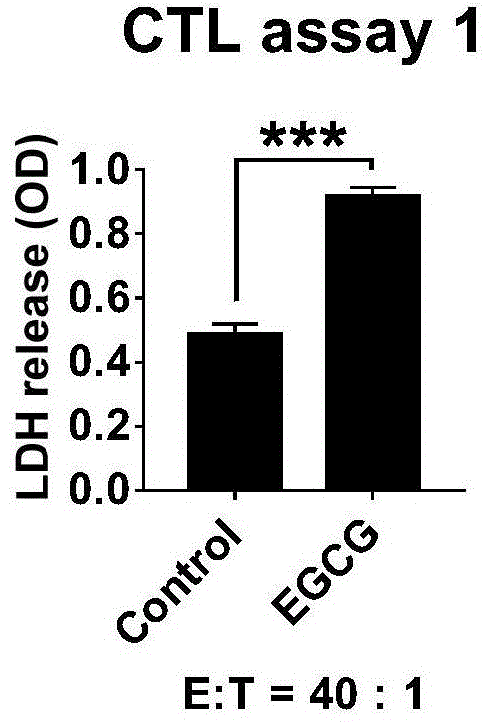
结果如图9a和图9b所示,细胞水平检测t细胞特异杀伤肿瘤的能力。
ctlassay1:对c57bl6小鼠皮下注射b16f10(105细胞),2周后提取小鼠脾脏细胞,并用灭活的b16f10处理脾脏细胞24小时,之后利用磁珠分选cd8+t细胞;小鼠黑色素瘤细胞b16f10接种于96孔板中培养12小时,之后加入含有5ng/mlifnγ的培养基,2小时后加入10μmegcg,之后共培养24小时,加入上步磁珠分选的cd8+t细胞,混合孵育4小时,并保证t细胞(e)与肿瘤细胞(t)比例为40∶1。4小时后,收集培养基上清,利用ldh试剂盒检测培养基上清中ldh含量,并以仅有肿瘤和仅有t细胞组中ldh含量为对照,计算处理组中ldh含量,其结果即为t细胞特异杀伤肿瘤细胞的情况(图9a)。
ctlassay2:分离6周龄的ot-1小鼠(可特异识别卵清蛋白)的脾脏细胞,并用2μg的sinfekl多肽处理72小时,pbs清洗脾细胞,并用20u/ml的il-2处理72小时,之后用磁珠negative分选cd8+t细胞。
b16f10.cova.rfp(卵清蛋白和红色荧光蛋白转染)接种于96孔板中,加入1μmegcg处理24小时,之后用培养基清洗细胞,并加入上步骤中处理的ot-1cd8+t细胞,使t细胞(e)与肿瘤细胞(t)比例为2∶1,之后加入incucytecaspase-3凋亡试剂(绿色荧光)。用essenbioscience公司的incucytezoom显微镜24小时内实时检测b16f10.cova.rfp细胞的凋亡。仅有t细胞,以及仅有b16f10细胞组为标准化数值对照组。凋亡结果以对照组数值为基础,进行标准化处理。结果如图9b显示,egcg处理组的b16f10.cova.rfp细胞凋亡比无egcg处理的对照组显著升高,表明egcg处理后t细胞杀伤肿瘤能力显著增强。
c57bl6小鼠皮下注射b16f10,并检测肿瘤大小,在肿瘤大小为50立方毫米左右时进行egcg腹腔注射,浓度1mg/只/天,在对照组肿瘤达到2000立方毫米时结束实验,并取肿瘤组织备用,并用流式细胞仪检测小鼠脾脏和近肿瘤淋巴结cd3+t细胞组分的变化。肿瘤生长情况如图10所示。
结果如图11a、11b、11c、11d和11e所示,对图10中所取肿瘤组织进行stat1、irf1、pd-l1和pd-l2的转录水平和蛋白水平的检测(beta-actin为管家基因),发现stat1、irf1、pd-l1基因与蛋白水平在egcg处理后有显著降低,磷酸化的stat1蛋白水平在egcg处理后也有显著降低,pd-l2无mrna与蛋白水平表达。
结果如图12所示,egcg处理后的c57bl6负瘤小鼠与对照组比较,其脾脏和近肿瘤淋巴结中的cd8+t细胞种群组成比例明显升高,证明egcg处理后小鼠的肿瘤免疫杀伤显著增强。
构建c57bl6皮下黑色素瘤荷瘤小鼠模型,肿瘤尺寸达到大约50mm3时,随机分为三组,每三天分别通过尾静脉注射生理盐水(control)、egcg水溶液(egcg)和负载egcg的纳米载体水分散液(nanoegcg),egcg组和nanoegcg组的egcg剂量为0.5mg/只。
结果如图13所示,c57bl6小鼠皮下b16f10肿瘤生长情况以体积(tumorsize)=长×宽×高表示,统计分析基于每组5只小鼠,并使用one-wayanova分析。结果证明纳米egcg(nanoegcg)其抑制肿瘤生长的效果比egcg更好。*代表egcg组和nanoegcg组分别与control组差异显著(p<0.05),#代表egcg组和nanoegcg组差异显著(p<0.05)。
最后应说明的是:以上各实施例仅用以说明本发明的技术方案,而非对其限制;尽管参照前述各实施例对本发明进行了详细的说明,本领域的普通技术人员应当理解:其依然可以对前述各实施例所记载的技术方案进行修改,或者对其中部分或者全部技术特征进行等同替换;而这些修改或者替换,并不使相应技术方案的本质脱离本发明各实施例技术方案的范围。
- 还没有人留言评论。精彩留言会获得点赞!
- SPNP‑I在制备Nav1.7通道工具试剂中的应用的制造方法与工艺
- SPNP‑I在制备Nav1.2通道工具试剂中的应用的制造方法与工艺
- SPNP‑IX在制备Nav1.3通道抑制剂中的应用的制造方法与工艺
- SPNP‑IX在制备Kv4.2通道工具试剂中的应用的制造方法与工艺
- SPNP‑IX在制备Kv4.3通道工具试剂中的应用的制造方法与工艺
- SPNP‑27在制备Nav1.5通道抑制剂中的应用的制造方法与工艺
- SPNP‑27在制备Nav1.3通道抑制剂中的应用的制造方法与工艺
- 一种多肽在制备Nav1.3钠通道工具试剂中的应用的制造方法与工艺
- SPKP‑XI在制备Kv4.2通道抑制剂中的应用的制造方法与工艺
- SGLT‑2糖尿病抑制剂及其中间体的制备方法与流程