包载过氧化氢酶且连接PD-L1抗体的脂质体在制备肿瘤治疗药物的应用的制作方法
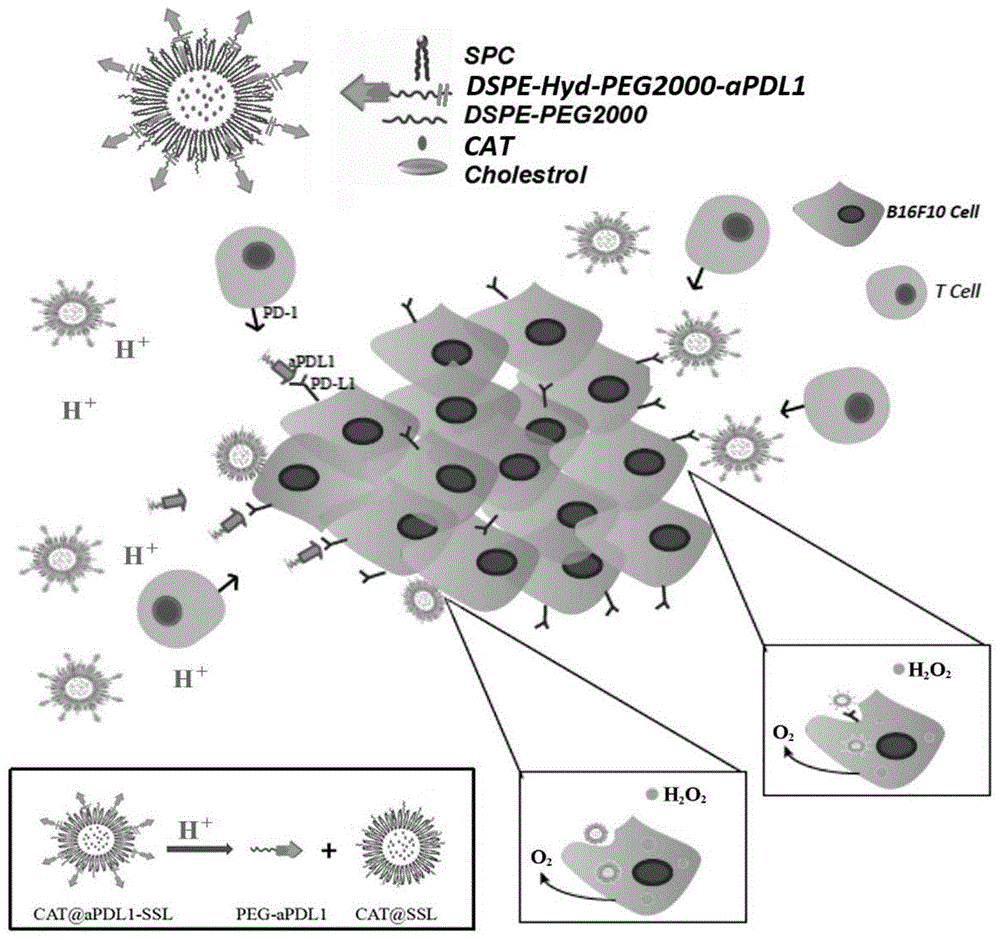
本发明涉及一种脂质体在制备肿瘤治疗药物的应用,属于免疫脂质体药物递送系统领域,特别涉及包载过氧化氢酶同时表面连接pd-l1抗体的免疫脂质体在制备肿瘤治疗药物的应用。
背景技术:
肿瘤细胞可以通过多种机制抑制免疫系统的功能从而逃避免疫系统的识别和杀伤。阻断肿瘤对免疫系统的抑制通常有两种途径,即阻断肿瘤抑制性的信号通路和改善肿瘤抑制性的微环境。免疫检查点蛋白介导的免疫抑制通路通过抑制t淋巴细胞的作用来抑制免疫系统对肿瘤细胞的识别就是一种代表性的免疫抑制机制。由于炎症和抗原的刺激,肿瘤细胞表面过表达抑制性受体,有助于免疫检查点抑制剂靶向结合。
相较于其他固体肿瘤而言,黑色素瘤有大量炎性细胞浸润,往往会表达更高水平的抑制性受体。与抑制性受体特异性结合的单克隆抗体(免疫检查点抑制剂),例如死亡受体1配体抗体(apdl1s)可以有效抑制黑色素瘤的生长。
过去5年中,fda批准了一些apdl1生物制剂(例如帕博利珠单抗和尼鲁单抗)来治疗黑色素瘤。研究表明,这些apdl1生物制剂可以有效抑制黑色素瘤生长,延长患者生存期。然而随着研究深入,发现这些免疫检查点抑制剂会造成自身免疫疾病以及炎性副作用等。这些副作用主要与apdl1体内分布靶向性较低有关。因此,改善apdl1体内分布的靶向性,促进其在肿瘤部位浓集,将有望提高其有效性降低毒副作用。
改善肿瘤低氧微环境可以促进t淋巴细胞对于肿瘤组织的浸润,增强apdl1的作用,抑制肿瘤生长。肿瘤组织具有抑制性的微环境,可以抑制t淋巴细胞激活同时促进浸润的t淋巴细胞凋亡,这也是肿瘤的自我保护机制。低氧是肿瘤抑制性微环境的重要组成部分。低氧微环境通过产生调节性的环状单磷酸腺苷(camp)并抑制t细胞受体信号通路,抑制t淋巴细胞的激活与浸润,影响apdl1的作用效果。过氧化氢酶(cat)可以有效分解肿瘤内源性过量的过氧化氢产生氧气,改善肿瘤低氧微环境,从而有望增强apdl1的作用效果。
因此,apdl1与过氧化氢酶联合给药,将有望产生协同增效的作用效果,增强肿瘤免疫治疗的效果。
脂质体是有效的药物递送载体,可以递送多种药物,增强药物稳定性,减少毒副作用,还可以增强药物在体内分布的靶向性。设计靶向配体修饰的,靶向特定位置的主动靶向脂质体,可以进一步增强药物的靶向性,增强治疗效果降低毒副作用。
目前,国内现有技术多是将包载过氧化氢酶的脂质体与游离apdl1组合使用,这样既增加了给药次数,给临床应用增加困难,同时也无法改善游离apdl1的靶向性,继而无法增加其有效性减少毒副作用。国内仍未报道脂质体与pd-l1、过氧化氢酶的结合运用,也未曾报道相应组合物质在制备肿瘤治疗药物的应用。
技术实现要素:
为了克服现有技术的不足,本发明目的是提供包载过氧化氢酶且连接pd-l1抗体的脂质体在制备肿瘤治疗药物的应用,其可以有效缓解肿瘤区域低氧同时阻断肿瘤抑制性信号通路(pd-1/pd-l1),对黑色素瘤有较好的治疗作用。
本发明设计的多功能免疫脂质体,将cat与apdl1有机结合,采用脂质体作为载体共同递送,能够有效解决现有问题,增强肿瘤免疫治疗的效果。
为了达到上述目的,本发明采用以下技术方案:
本发明提供包载过氧化氢酶且连接pd-l1抗体的脂质体在制备肿瘤治疗药物的应用。
进一步地,所述脂质体是一种以大豆磷脂,胆固醇为骨架的包载了过氧化氢酶并且表面连接有apdl1的多功能免疫脂质体。
更进一步地,所述脂质体通过薄膜分散/后插入法制备;所述过氧化氢酶包载在脂质体当中;所述apdl1是通过反应合成apdl1导向化合物,插入脂质体磷脂双分子层中;所述脂质体表面还连接有腙键。
更进一步地,所述脂质体为球形结构,粒径为118.2±1.763nm,多分散系数为0.223±0.007;过氧化氢酶的包封效率为30-36%。
进一步地,所述脂质体的制备方法包括以下步骤:
1)通过薄膜分散法制备包载过氧化氢酶的长循环脂质体,利用溶解有过氧化氢酶的pbs溶液进行水化的脂质薄膜;
2)通过薄膜分散/后插入法制备免疫脂质体:
原料导向化合物与apdl1混合,合成apdl1导向化合物;
将合成的apdl1导向化合物与包载过氧化氢酶的长循环脂质体混合搅拌,室温下孵育4h,即可得到免疫脂质体。
更进一步地,所述薄膜分散法包括以下步骤:
1.1)原料大豆磷脂、胆固醇、dspe-peg2000,溶解于氯仿中,摩尔比为100:50:8;
1.2)利用旋转蒸发仪将氯仿溶液悬干,去除掉氯仿溶液,得到脂质薄膜;
1.3)将脂质薄膜用磷酸缓冲液(pbs)水化;
1.4)通过200nm聚碳酸酯膜过滤后得到脂质体。
更进一步地,步骤1)中,所述制备包载过氧化氢酶的脂质体使用溶解有1.5mg/ml过氧化氢酶的pbs溶液。
更进一步地,步骤2)中,所述原料导向化合物与apdl1以摩尔比10:1的比例混合;原料导向化合物与apdl1通过抗体apdl1的氨基与原料导向化合物的琥珀酰亚胺基反应,合成apdl1导向化合物;将apdl1导向化合物与包载过氧化氢酶的脂质体以摩尔比1:100的比例混合搅拌。
更进一步地,步骤2)中,还包括多余的apdl1与过氧化氢酶通过透析法除去的步骤。
进一步地,所述肿瘤为黑色素瘤;
进一步地,所述脂质体通过以下任一种或一种以上机制实现:
a.与肿瘤细胞表面的pd-l1受体结合阻断pd-1/pd-l1信号通路;
b.改善肿瘤的低氧状态
c.通过受体介导主动靶向途径以及epr效应,靶向性地浓集于肿瘤组织;
d.促进cd8+t淋巴细胞对肿瘤组织的浸润和对肿瘤细胞杀伤,增强免疫治疗的效果;
e.apdl1和过氧化氢酶的组合产生协同治疗作用有效抑制了肿瘤生长。
与现有技术相比,本发明具有以下有益效果:
1)本发明所制备的脂质体表面连接有apdl1,与肿瘤细胞表面的pd-l1受体结合阻断pd-1/pd-l1信号通路,增强免疫治疗作用;
2)本发明所制备的脂质体当中包载了过氧化氢酶(cat),可以有效缓解肿瘤区域低氧状态;
3)本发明所制备的脂质体可以阻断pd-1/pdl1信号通路,同时将cat递送到肿瘤区域,缓解肿瘤低氧,具有最理想的靶向能力,apdl1s和cat的协同治疗作用,从而促进cd8+t淋巴细胞对肿瘤组织的浸润和对肿瘤细胞杀伤,增强免疫治疗的效果。
附图说明
图1为cat@apdl1-ssl的结构及作用机制图;
图2为实施例2中cat@apdl1-ssl的表征图;
图中:a为通过dls确定的cat@apdl1-ssl的粒径分布;b为通过tem观察的形态图像,比例尺:100nm;c为通过便携式溶解氧计检测到的h2o2溶液中o2的浓度;d为蛋白酶k处理(0.5mg/ml)后不同时间点的游离cat和cat@apdl1-ssls的相对酶活力。
图3为实施例2中通过clsm观察c6@ssls,c6@apdl1-ssls(ph7.4)和c6@apdl1-ssls(ph6.5)与荧光二抗的共定位结果图;
图4为实施例3中通过流式细胞仪检测在不同ph条件下不同制剂细胞摄取的直方图和平均值图;
图中:a、c为ph6.5;b、d为ph7.4;n=3,结果显示为平均值±标准误差;*p<0.05,**p<0.01;
图5为实施例4中dir,dir@ssls和dir@apdl1-ssls的靶向能力效果图;
图中:a为在静脉注射三种制剂的1、2、4、8、12和24小时后,荷瘤小鼠的活体成像结果(圆圈代表肿瘤面积);b为注射后24h,三组小鼠的主要器官和肿瘤组织的离体荧光图像;c为荧光效率的定量结果;n=3,结果显示为平均值±sd***p<0.001;
图6为实施例5中对照组(pbs),apdl1-ssl,cat@ssl和cat@apdl1-ssl对肿瘤缺氧状态的影响图;
图中:a为静脉注射四种不同制剂后,荷瘤小鼠肿瘤切片的免疫荧光图像,蓝色信号(较暗圆点)代表被dapi染色的细胞核,绿色信号(较亮)代表被低氧探针染色的缺氧区域;b为基于a中显示的图像,使用imagej软件分析阳性肿瘤缺氧区域的定量结果;n=3,结果为:平均值±标准误差,比例尺:100μm;
图7为实施例6中cd4+和cd8+t细胞在肿瘤组织中的浸润情况图;
图8为实施例7中体内抗肿瘤效果图;
图中:a为pbs,游离apdl1,ssl,apdl1-ssl,cat@ssl和cat@apdl1-ssl治疗后荷瘤小鼠的体重;b为每组小鼠的相对肿瘤体积;c为用上述制剂处理后的小鼠生存曲线;n=6,结果表示:均值±标准误差;
图9为实施例7中不同制剂的生物安全性评估图。
具体实施方式
本发明制备了一种多功能免疫脂质体(称为cat@apdl1-ssl,如图1所示)。这种免疫脂质体表面连接有apdl1并且包载了过氧化氢酶(cat),可以有效缓解肿瘤区域低氧同时阻断肿瘤抑制性信号通路(pd-1/pd-l1),对黑色素瘤有较好的治疗作用。cat包载在脂质体当中可以避免其被蛋白酶水解保持酶活性。cat@apdl1-ssl可以阻断pd-1/pdl1信号通路,同时将cat递送到肿瘤区域,缓解肿瘤低氧,从而促进cd8+t淋巴细胞对肿瘤组织的浸润和对肿瘤细胞杀伤,增强免疫治疗的效果。
如图1所示,多功能免疫脂质体(cat@apdl1-ssl)是一种以大豆磷脂(spc),胆固醇(cholestrol)为骨架的包载了过氧化氢酶并且表面连接有apdl1的免疫脂质体。
apdl1通过与原料导向化合物dspe-hyd-peg2000-nhs反应合成apdl1导向化合物dspe-hyd-peg2000-apdl1,插入脂质体磷脂双分子层中(dspe:1,2-二硬脂酰基-甘油-3-磷酸乙醇胺;peg:聚乙二醇;hyd:腙键)。该脂质体由于表面连接有腙键而具有ph敏感特性。在肿瘤酸性微环境中(ph6.5),腙键与过量的氢离子(h+)反应而断裂,释放apdl1。之后游离apdl1与肿瘤细胞表面的pd-l1受体结合阻断pd-1/pd-l1信号通路,增强免疫治疗作用。当大量h+因为与腙键反应而消耗后,肿瘤微环境ph有望升高,同时腙键不再断裂,apdl1-ssl将以整体形式与pd-l1受体结合(图1)。
体外摄取实验和体内分布实验表明,该多功能免疫脂质体具有较好的靶向能力,能够浓集于肿瘤组织中。并且该脂质体可以促进cd8+t淋巴细胞对于肿瘤组织的浸润,增强免疫治疗效果,显著延长小鼠生存期。
本发明制备的脂质体药物递送系统,将过氧化氢酶(cat)与apdl1-ssl结合,从肿瘤微环境和抑制性信号通路,两个方面抑制肿瘤生长,增强apdl1的免疫治疗作用。同时脂质体具有epr效应,可以增强apdl1和cat体内分布的靶向性。因此,免疫脂质体cat@apdl1-ssl在肿瘤免疫治疗方面具有广阔的研究前景。
现结合附图与具体实施例对本发明作进一步说明。
以下实施例数据采用平均值±sd值的方式表示。数据平均值采用组间t检验进行比较分析。p<0.05(*),p<0.01(**)和p<0.001(***)被认为具有统计学意义。
实施例1脂质体制备
普通长循环脂质体(ssl)是通过薄膜分散法制备的。
原料spc(大豆磷脂),胆固醇,dspe-peg2000,溶解于1ml氯仿中,摩尔比为100:50:8。之后利用旋转蒸发仪将氯仿溶液悬干,去除掉氯仿溶液,得到脂质薄膜。将脂质薄膜用2ml磷酸缓冲液(pbs)水化。最终ssl通过200nm聚碳酸酯膜过滤后得到。
多功能免疫脂质体(cat@apdl1-ssl)通过薄膜分散/后插入法制备。
首先,原料导向化合物dspe-hyd-peg2000-nhs与apdl1以摩尔比10:1的比例混合,通过抗体apdl1的氨基与原料导向化合物的琥珀酰亚胺基反应,合成apdl1导向化合物dspe-hyd-peg2000-apdl1。
cat@ssl制备是利用2ml溶解有3mgcat的pbs溶液进行水化,其他步骤与ssl一致。将dspe-hyd-peg2000-apdl1与cat@ssl以摩尔比1:100的比例混合搅拌,室温下孵育4h,即可得到免疫脂质体cat@apdl1-ssl。多余的apdl1与cat通过透析法除去。
表征用包载香豆素-6以及近红外荧光探针dir的脂质体也是通过薄膜分散/后插入法制备的。
实施例2表征
2.1脂质体的表征
通过动态光散射粒径仪(dls)(zetasizernanozs90;马尔文;英国)测量cat@apdl1-ssl的粒径和分散性。
脂质体溶液用2%磷钨酸染色后,利用透射电镜(tem)(jem-1400plus,日本电子,日本)观察粒子形态。
cat的包封率通过bca蛋白定量法测量。
游离cat和包载在脂质体中的cat的酶活性通过标准goth’s法测定。
首先,将0.5ml的h2o2溶液(30%水溶液)加入1.5ml的eppendorf(ep)管中,然后将1ml游离cat和1mlcat@apdl1-ssls添加到每个ep管中,并在37℃下与h2o2反应1分钟。随后,将0.5ml的钼酸铵(32.4mm)添加至反应溶液。钼酸铵与过量的h2o2溶液反应生成稳定的黄色报春花复合物后,终止反应。之后用紫外-可见分光光度计(lambda35;perkinelmer,沃尔瑟姆,美国)在400nm波长下检测吸光度,计算相对酶活力。在体系中加入蛋白酶k,来考察游离cat以及cat@ssl的稳定性。将游离cat以及cat@ssl与蛋白酶k混合,随后用标准goth’s法测定酶稳定性。便携式溶氧仪(jpbj-608,inesa,中国)通过测量不同时间点下,cat@apdl1-ssl分解h2o2产生的氧气量,来检测包载在脂质体中的cat的酶活力。
实验结果:
通过动态光散射仪(dls)测定(图2a)cat@apdl1-ssl的粒径为118.2±1.763nm,其多分散系数为0.223±0.007。cat@apdl1-ssls的粒径可能会通过高渗透和高截留(epr)效应来增强其在肿瘤组织中的蓄积。根据tem观察,cat@apdl1-ssls具有球形结构和良好的分散能力(图2b)。
使用标准bca蛋白测定法确定cat的包封效率(ee)为36%。
使用goth方法和便携式溶解氧计确定cat包封在脂质体中能够较好的保留cat的酶活力。cat@apdl1-ssls分解h2o2产生o2,溶液中的o2浓度从4.41mg/ml增加到31.08mg/ml,而与pbs相比,ssls对h2o2溶液中的o2浓度没有任何显着影响。这表明包载在脂质体中的cat具有分解h2o2产生o2的能力(图2c)。
由于体内存在蛋白酶,因此检测蛋白酶对游离cat和cat@apdl1-ssls的影响,以确定脂质体是否可以保护cat的酶活性。蛋白酶k消化试验表明,cat@apdl1-ssls在37℃下用蛋白酶k(0.5mg/ml)处理8小时(图2d)后,保留了原始酶活性的80.76%。但是,蛋白酶cat消化后,游离cat仅保持其初始酶活性的32.41%(图2d)。蛋白酶k消化实验表明,脂质体不仅递送cat,而且保护包载在脂质体内的cat的酶活性,并防止cat被蛋白酶消化而失活。
2.2免疫脂质体表面连接apdl1的表征
将包载荧光探针香豆素-6(c6)的免疫脂质体c6@apdl1-ssl与alexafluor647标记的山羊抗兔免疫球蛋白二抗(abcam,剑桥,英国)共孵育,来考察apdl1是否成功连接到脂质体表面。
将c6@apdl1-ssls(ph7.4)与二抗在室温下孵育2小时。孵育后,将混合物以14,000rpm离心15分钟,然后使用pbs洗涤两次。然后将沉淀物重悬于pbs中,并使用共聚焦激光扫描显微镜(clsm)(a1rsi;尼康,东京,日本)进行观察。
为了研究在低ph条件下脂质体表面上apdl1的活性,使用柠檬酸盐缓冲液(ph6.0)将溶液的ph调节至6.5,并如上所述重复后续步骤。
实验结果:
为了确证apdl1连接在脂质体表面上,采用薄膜分散法制备了包载亲脂性绿色荧光探针c6(coumarin-6)的脂质体。使用alexafluor647标记的二抗标记c6@apdl1-ssls表面的apdl1。由于与二抗共定位,c6@apdl1-ssls(ph7.4)组显示黄色荧光。而c6@ssl无黄色荧光。如图3所示,绿色信号(较亮光斑)代表c6@ssl,c6@apdl1-ssls(ph7.4)或c6@apdl1-ssls(ph6.5),红色信号(较暗光斑)代表alexafluor647标记的二抗;白色箭头指示共定位区域;比例尺:10μm。表明在c6@apdl1-ssl(ph7)脂质体表面存在apdl1。
此外,未观察到在ph6.5的条件下,c6@apdl1-ssls(ph6.5)与荧光二抗的共定位显,可能是由于免疫脂质体表面的腙键断裂所致。在ph6.5的溶液中,腙键与h+反应后,腙键断裂,并释放出apdl1远离脂质体,因此荧光二抗与脂质体无共定位现象(图3)。这些结果表明免疫脂质体具有ph敏感性特征。
实施例3体外细胞摄取实验
使用上述薄膜分散方法制备负载c6的脂质体c6@apdl1-ssl。
将b16-f10细胞以1×106细胞/孔的密度接种到六孔板中,并孵育过夜。然后除去培养基,并用pbs洗涤细胞3次。将pbs,游离c6,c6@apdl1-ssl,c6@apdl1-ssl和游离apdl1(ph7.4)加入板的每个孔中(c6,150ng/ml)并与b16-f10细胞在37℃和5%co2的条件下孵育2小时。2小时后,移去样品溶液,并将200μl胰蛋白酶和乙二胺四乙酸(edta)加入每个孔中以消化细胞。将消化后的细胞悬液,以1,000rpm离心5分钟,然后将沉淀物以1×106细胞/ml的密度重新悬浮在pbs中。
为了研究在低ph条件下脂质体的细胞摄取,使用柠檬酸盐缓冲液(ph6.0)将培养基调节至ph6.5,并如上所述重复后续步骤。
流式细胞仪(facscalibur;bdbiosciences,美国)用于检测脂质体的细胞摄取情况。使用flowjo10.0软件处理流式细胞仪结果。
实验结果:
通过流式细胞仪检测免疫脂质体的体外细胞摄取情况,以研究其特异性靶向能力。使用薄膜分散法,制备包载亲脂性绿色荧光探针香豆素-6(c6)的脂质体。结果表明,在ph6.5时,c6@ssls和c6@apdl1-ssls的细胞摄取无明显差异,添加游离apdl1后,c6@apdl1-ssls的摄取也没有受到抑制(图4a,c)。但是,在ph7.4时观察到差异,c6@apdl1-ssls的摄取显着高于c6@ssls,并且被游离apdl1抑制(图4b,d)。这可能是由于在ph6.5时免疫脂质体表面的ph敏感键断裂,释放了apdl1(图1)。
这些结果表明,免疫脂质体可在肿瘤微环境中消耗过量的h+,有望改善抑制性微环境。当apdl1在ph6.5下释放时,免疫脂质体通过类似于ssl的内吞途径摄取到b16-f10细胞中,游离apdl1则不抑制这种摄取。在ph7.4时,相比ssls,免疫脂质体的摄取显著增加,并且游离apdl1抑制了它们的摄取,说明此时免疫脂质体主要通过受体介导途径摄取进入细胞。该结果表明,apdl1成功地连接在免疫脂质体表面。
由于pd-l1受体在b16-f10细胞上的过表达,通过受体介导主动靶向途径以及epr效应,免疫脂质体有望靶向性地浓集于肿瘤组织,说明免疫脂质体是有前景的黑色素瘤免疫治疗的候选者。
实施例4体内分布考察
为了研究多功能免疫脂质体(cat@apdl1-ssl)的体内生物分布及其靶向能力,使用亲脂性荧光探针dir标记脂质体。
使用上述薄膜分散法制备负载dir的脂质体。向c57bl/6(6-8周龄,20g/b)小鼠的右侧腋下注射b16-f10细胞,密度为1×106。当肿瘤体积达到100mm3时,将荷瘤小鼠分为三个随机组。然后给他们静脉注射游离dir,dir@ssls或dir@apdl1-ssls(dir:150μg/kg)。
使用体内光学成像系统(ivisspectrum,xenogen,阿拉米达,美国)在脂质体注射后1、2、4、8、12和24h观察脂质体的生物分布。24小时后处死小鼠,并收集肿瘤和主要器官用于体外成像。使用livingimage4.3.1软件处理图像。
实验结果:
研究免疫脂质体的体内生物分布是很有必要的,因为生物分布会影响免疫脂质体的治疗效率和副作用。因此,本研究使用体内光学成像系统考察了免疫脂质体的生物分布。
dir,一种亲脂性荧光探针,被包载在脂质体中。为了说明免疫脂质体的靶向能力,将游离dir,dir@ssls或dir@apdl1-ssls静脉注射到荷瘤小鼠体内(apdl1:1mg/kg)。结果表明给药后,dir@apdl1-ssls逐渐积累在肿瘤组织中。24小时后,dir@apdl1-ssls在肿瘤区域发出最强的荧光信号。这表明免疫脂质体具有比游离dir和dir@ssls更好的肿瘤靶向能力(图5a)。
为了进一步测试体内免疫脂质体的靶向能力,将荷瘤小鼠在注射给药后24小时处死,并收集其主要器官和肿瘤组织进行观察(图5b)。dir@apdl1-ssls在肿瘤组织中表现出明显的蓄积,而游离dir和dir@ssls在肿瘤组织中没有表现出明显的蓄积。定量结果表明,在三个治疗组中,dir@apdl1-ssls在肿瘤组织中的荧光效率最高,比dir的荧光效率高8.5倍。dir@ssls的荧光效率较低,是游离dir的5倍(图5c)。体内分布表明,与游离药物和正常脂质体相比,免疫脂质体具有最理想的靶向能力,这可能是由于主动靶向和epr效应的结合所导致。理想的靶向能力表明免疫脂质体有望具有较好的免疫治疗效率,并且在体内引起的副作用较小。
还值得注意的是,与脂质体相比,游离dir在肝脏和脾脏中的分布较低,这可能是由于游离小分子的新陈代谢更快,并且脂质体表面的peg水化层使得脂质体具有长循环特性。这些发现进一步表明免疫脂质体在黑色素瘤的治疗方面具有广阔的前景。
实施例5肿瘤组织低氧情况评估
为了评估脂质体缓解肿瘤组织低氧的能力,将荷瘤c57bl/6小鼠静脉注射pbs,apdl1-ssl,cat@ssl或cat@apdl1-ssl(cat:2mg/kg;apdl1:1mg/公斤)。静脉注射后24小时,将盐酸哌莫硝唑(60g/20g)腹腔注射到每只小鼠中(hypoxyprobe-1plus试剂盒;hypoxyprobe,inc.,burlington,美国)。然后处死小鼠并收集肿瘤组织,用于免疫荧光染色。
使用clsm(nikon,a1r-si,日本)观察免疫荧光染色的结果。使用imagej软件分析肿瘤缺氧区域的半定量结果。
实验结果:
为了证明免疫脂质体对肿瘤缺氧状态的影响,本研究用哌莫硝唑(一种外源性缺氧染色探针31)进行免疫荧光染色后观察了肿瘤缺氧区域的面积变化。
将b16-f10荷瘤小鼠随机分为四组并静脉注射pbs,apdl1-ssl,cat@ssl或cat@apdl1-ssl(cat:2mg/kg,apdl1:1mg/kg)。给药后24小时,每组小鼠腹腔注射哌莫硝唑(30mg/kg)。然后在90分钟后处死小鼠以收集肿瘤组织进行冰冻切片,然后进行免疫荧光染色观察肿瘤的低氧状态。与pbs和apdl1-ssl对照相比,用cat@ssls和cat@apdl1-ssls处理后,低氧状态得以改善(图6a)。
此外,半定量结果显示,在用cat@ssl和cat@apdl1-ssl处理后,缺氧阳性面积分别显着减少至19.75%和10.19%(图6b)。
这些结果表明,包载cat的脂质体通过cat分解内源性的h2o2产生o2,有效缓解了肿瘤的缺氧。缺氧是肿瘤抑制性微环境的重要组成部分,对t细胞的活化具有负调节作用。在这里,有理由相信,包载cat的脂质体可通过缓解缺氧而增强免疫治疗的效果。此外,cat@apdl1-ssl比cat@ssl更有效地缓解了缺氧,这可能是由于cat@apdl1-ssls在体内能够靶向分布和选择性蓄积到肿瘤组织中,增加了肿瘤组织中的cat浓度。这些结果进一步表明,apdl1s和cat的组合有望显著增强黑色素瘤免疫治疗的效果。
实施例6t淋巴细胞浸润考察
为了评估t淋巴细胞在肿瘤组织中的浸润情况,使用上述方法制备了荷黑色素瘤的c57bl/6小鼠模型。当肿瘤体积达到100mm3时,将荷瘤小鼠随机分为五组,并随机静脉注射pbs,游离apdl1,ssl,apdl1-ssl或cat@apdl1-ssl(apdl1:1mg/kg)。静脉注射后24小时,处死小鼠并收集肿瘤用于免疫荧光染色。使用4',6-diamidino-2-phenylindole(dapi)(solarbio,中国)标记b16-f10细胞的细胞核,并使用cd4+和cd8+抗体(bioss,shanghai,china)标记t细胞。
使用clsm(nikon,a1r-si,japan)观察免疫荧光染色的结果。
实验结果:
t淋巴细胞对肿瘤组织的浸润是评估免疫脂质体治疗效果的重要指标,因此本研究对肿瘤组织中t淋巴细胞的浸润进行了考察。pbs,游离apdl1,ssls,apdl1-ssls或cat@apdl1-ssls(cat:2mg/kg;apdl1:1mg/kg)治疗后,观察到肿瘤组织中cd4+和cd8+t细胞的浸润情况。
如图7所示,蓝色信号(较暗)代表被dapi染色的细胞核。绿色信号代表被af488-cd4+抗体染色的cd4+t细胞,红色信号(较亮)代表被af647-cd8+抗体染色的cd8+t细胞。比例尺:50μm。对照pbs组的肿瘤组织几乎没有t细胞浸润,而cat@apdl1-ssls组的肿瘤组织中有大量cd8+t细胞浸润。特别地,与游离的apdl1组相比,apdl1-ssl治疗组小鼠肿瘤组织中有更多的cd8+t细胞浸润,这表明由于epr效应和主动靶向作用,脂质体表面的缀合改善了游离apdl1s的治疗作用。
此外,与apdl1-ssl组相比,cat@apdl1-ssl治疗组的肿瘤组织中有更多cd8+t细胞的浸润。这表明,cat@apdl1-ssls可能有效促进肿瘤组织中cd8+t细胞的浸润,这可能是由于apdl1s和cat的协同治疗作用所致。
综上,cat@apdl1-ssls可以有效促进cd8+t细胞对于肿瘤组织的浸润,有望增强对于黑色素瘤的免疫治疗。
实施例7体内抗肿瘤效果
为了评估免疫脂质体的抗肿瘤功效,将荷瘤小鼠随机分为六组(n=6),并每三天静脉注射pbs,游离apdl1,ssl,apdl1-ssl,cat@ssl或cat@apdl1-ssls(apdl1:1mg/kg)。
在治疗期间,记录小鼠的体重及其肿瘤的体积,以评估每种制剂的抗肿瘤效果。
通过以下公式计算肿瘤体积:v=长度×宽度2/2。
使用graphpadprism7.0软件分析荷瘤小鼠的存活曲线。
最后,为了评估体内使用脂质体的安全性,收集小鼠的主要器官进行苏木精和曙红(h&e)染色。
实验结果:
为了证明免疫脂质体体内的免疫治疗效率,每三天将对照组(pbs),游离apdl1,ssl,apdl1-ssl,cat@ssl或cat@apdl1-ssls静脉注射到荷瘤小鼠体内。每三天测量一次小鼠的体重和肿瘤体积。
研究结果表明,cat@apdl1-ssls具有较好的治疗效果(图8a,图8b,图8c)。apdl1,apdl1-ssl和cat@apdl1-ssl组中的小鼠体重略有增加,而其他组中的小鼠体重减少(图8a),这可能是由于肿瘤引起的全身症状所致。cat@apdl1-ssl组的肿瘤体积基本保持不变。但是,与原发灶相比,游离apdl1和apdl1-ssl治疗组的肿瘤体积分别增加了近9.25倍和3.69倍(图8b)。这些结果表明,脂质体作为纳米载体增强了apdl1的治疗效果,这可能是由于epr效应和主动靶向作用。apdl1和cat的组合产生协同治疗作用有效抑制了肿瘤生长。只有cat@apdl1-ssl组中的小鼠存活到实验结束(图8c),进一步证明cat@apdl1-ssls具有抗肿瘤功效,与本研究的其他结果一致。
最后,本研究通过h&e染色考察了免疫脂质体的生物安全性。用不同制剂治疗后,荷瘤小鼠的主要器官(包括心脏,肝脏,脾脏,肺和肾脏)的形态结构均未显示明显的病理异常(图9)。表明cat@apdl1-ssls具有良好的安全性,连续给药后不会产生全身毒性。
因此,这些结果表明,该研究中开发的免疫脂质体不仅具有优异的抗肿瘤功效,而且还具有很高的安全性,是有前景的免疫治疗药物递送系统。
实验结论:
为了克服游离apdl1的局限性并增强其免疫治疗效果,我们开发了称为cat@apdl1-ssls的多功能免疫脂质体,该脂质体表面含有apdl1修饰,脂质体内包载了cat。cat@apdl1-ssls的有效性已通过体内和体外的多种实验进行验证。
本研究中各种实验的结果表明,至少出于三个原因,多功能免疫脂质体有望成为黑色素瘤免疫治疗的候选药物。首先,免疫脂质体容易地制备并且具有较好的靶向能力,可以靶向性浓集于肿瘤组织中,从而降低了全身毒性,并增强了对于肿瘤治疗的有效性。第二,apdl1和cat具有协同效应,通过阻断pd-1/pd-l1抑制性信号通路同时缓解肿瘤缺氧,增强免疫治疗效果。第三,该多功能免疫脂质体,能够抑制黑素瘤的生长并显著延长荷瘤小鼠的生存期。
总之,在这项研究中开发和提出的多功能免疫脂质体(cat@apdl1-ssls)在黑色素瘤免疫治疗方面具有广阔的研究前景,并且可与其他癌症疗法(例如放疗和化学疗法)结合,进一步增强治疗效果。
本发明并不局限于上述实施方式,如果对本发明的各种改动或变型不脱离本发明的精神和范围,倘若这些改动和变型属于本发明的权利要求和等同技术范围之内,则本发明也意图包含这些改动和变动。
- 还没有人留言评论。精彩留言会获得点赞!