用于治疗癌症的免疫修饰粒子的制作方法
用于治疗癌症的免疫修饰粒子
发明领域
1.本公开总体上涉及使用免疫修饰粒子与诸如检查点调节剂、小分子或生物剂等癌症治疗剂的组合通过改变肿瘤微环境中的髓源性抑制细胞(mdsc)、肿瘤相关巨噬细胞(tam)、嗜中性粒细胞以及单核细胞来治疗癌症和增生性疾病的方法。
背景技术:
2.现在广泛认为独特髓源性细胞群是肿瘤微环境的一部分。这些细胞包括单核细胞、肿瘤相关巨噬细胞(tam)、髓源性抑制细胞(mdsc)以及树突细胞(kumar等,trends immunol.,37(3):208
‑
220(2016);richards等,cancer microenviron.,6(2):179
‑
91(2013))。大量工作表明,这些细胞是主动招募至肿瘤位点和转移位点的,在这些位点它们可根据来自局部环境的提示发生变化从而促成免疫抑制微环境(kumar等,trends immunol.,37(3):208
‑
220(2016);kitamura等,front immunol.,8:2004(2018);kitamura等,j exp med.,212(7):1043
‑
59(2015))。已证实这些细胞的免疫抑制活性促进肿瘤生长、增殖、血管生成、转移以及肿瘤免疫逃避。此外,肿瘤微环境(tme)中mdsc和tam的存在与不良疾病结果相关(gabrilovich等,nat rev immunol.,12(4):253
‑
68(2012);ouzounova等,nat comm.,8:14979(2017);marvel等j clin invest.,125(9):3356
‑
64(2015))。
3.除免疫细胞之外,肿瘤基质也在形成肿瘤微环境以及影响肿瘤生长和进展中起作用。肿瘤相关基质的细胞和分子组成,包括成纤维细胞、间充质基质细胞、脂肪细胞、内皮以及细胞外基质(ecm),已全部被证实促进肿瘤发生(valkenburg等,nat rev clin oncol.,15(6):366
‑
381(2018))。已证实组织驻留和骨髓间充质干细胞(msc)源性癌症相关成纤维细胞(caf)分泌生长因子以及改变抗肿瘤免疫反应并且促进肿瘤生长和转移的蛋白质(valkenburg等,nat rev clin oncol.,15(6):366
‑
381(2018);shiga等,cancers,7,2443
‑
2548(2015))。类似地,已报道ecm蛋白、间充质基质细胞、内皮细胞以及脂肪细胞阻抑抗肿瘤免疫性并且促进肿瘤进展(lu等,j cell biol.,196(4):395
‑
406(2012);kumar等,cancer cell 32(5):654
‑
668.e5(2017);quante等,cancer cell.,19,257
‑
272(2011);park等,endocr rev.,32(4):550
‑
70(2011);young等,cancer immunol immunother.,61(10):1609
‑
16(2012);hida等,int j mol sci.,19(5):1272(2018))。
4.虽然已在研发新颖抗癌治疗剂中取得重大进展,但归因于它们靶向肿瘤而不是靶向肿瘤微环境(tme)中抑制抗肿瘤免疫功能并且促进肿瘤进展的免疫抑制因子的事实,这些疗法的功效显示有限的前景。
5.通过免疫检查点受体(例如程序化细胞死亡蛋白1(pd
‑
1)和ctla
‑
4)和其配体(例如pd
‑
l1)的信号传导调控细胞毒性t细胞的活性,并且已显示在调节炎性免疫反应中发挥关键作用。重要地,已知许多肿瘤类型拦截pd
‑
1/pd
‑
l1和ctla
‑
4免疫检查点信号传导路径,以避开t细胞介导的抗肿瘤免疫反应。因此,使用如单克隆抗体等特定抑制剂靶向免疫检查点信号传导路径已在许多癌症中成为有吸引力的第一线治疗选择(alsaab等,front pharmacol 8:561(2017))。然而,已显示肿瘤微环境中髓源性抑制细胞(mdsc)和肿瘤相关
巨噬细胞(tam)的存在与肿瘤相关基质一起阻抑如抗pd1单克隆抗体等免疫检查点抑制剂的抗肿瘤功效(weber等,front immunol.,9:1310,(2018);highfill等,sci transl med.,6(237):237ra67(2014);zhao等,cancer immunol res.,6(12):1459
‑
1471(2016);wang等,nat commun.,9(1):3503(2018))。
6.免疫修饰粒子(imp)为具有免疫调节性质的带负电荷的纳米粒子(参见例如美国专利公布号us20150010631;us 20130323319)。
技术实现要素:
7.本公开提供了一种治疗癌症和增生性疾病的方法,所述方法包括施用不含能够抑制受试者中的单核细胞和其他吞噬细胞的抗原或其他生物活性剂的免疫修饰粒子与癌症疗法的组合。在不受理论约束的情况下,假定imp改变肿瘤微环境中的免疫抑制单核细胞源性细胞,这又将在向受试者施用时增强其他癌症疗法的功效。本文中表明,与使用癌症治疗剂(诸如免疫检查点抑制剂)的单一疗法相比,可靶向两种肿瘤细胞并且通过靶向mdsc、tam、嗜中性粒细胞、其他单核细胞源性细胞以及肿瘤相关基质克服免疫抑制肿瘤微环境的使用imp和癌症治疗剂的组合疗法也许能提供增强的治疗益处。
8.在各个实施方案中,本公开提供了一种治疗受试者的癌症的方法,所述方法包括向受试者施用带负电荷的粒子与癌症治疗剂的组合,其中所述粒子不含附着的肽或抗原部分或其他生物活性剂,并且其中所述施用改变肿瘤位点处的髓源性抑制细胞(mdsc)、肿瘤相关巨噬细胞(tam)、嗜中性粒细胞、单核细胞、树突细胞的群体和/或基质。
9.在各个实施方案中,本公开提供了一种治疗受试者的癌症的方法,所述方法包括向受试者施用带负电荷的粒子与癌症治疗剂的组合,其中所述粒子不含附着的肽或抗原部分或其他生物活性剂,并且其中所述施用改变肿瘤相关基质。
10.在各个实施方案中,本公开提供了一种治疗受试者的癌症的方法,所述方法包括向受试者施用带负电荷的粒子与癌症治疗剂的组合,其中所述粒子不含附着的肽或抗原部分或其他生物活性剂,并且其中所述施用改变基质结缔组织、成纤维细胞、内皮、脂肪组织、细胞外基质、外膜细胞、癌症干细胞、间充质干细胞和/或间充质基质细胞。
11.在各个实施方案中,本公开提供了一种治疗受试者的癌症的方法,所述方法包括向受试者施用带负电荷的粒子与癌症治疗剂的组合,其中所述粒子不含附着的肽或抗原部分或其他生物活性剂,并且其中所述施用使肿瘤尺寸减小和/或使肿瘤生长减少。在各个实施方案中,所述施用经由由肿瘤细胞直接摄入粒子诱导肿瘤细胞死亡、凋亡和/或坏死。
12.在各个实施方案中,本公开提供了一种治疗受试者的癌症的方法,所述方法包括向受试者施用带负电荷的粒子与癌症治疗剂的组合,其中所述粒子不含附着的肽或抗原部分或其他生物活性剂,并且其中所述施用调控抗肿瘤免疫反应。
13.在各个实施方案中,本公开提供了一种治疗受试者的癌症的方法,所述方法包括向受试者施用带负电荷的粒子与癌症治疗剂的组合,其中所述粒子不含附着的肽或抗原部分或其他生物活性剂,并且其中所述施用改变或调节肿瘤特异性免疫反应。
14.在各个实施方案中,本公开提供了一种治疗受试者的增生性疾病的方法,所述方法包括向受试者施用带负电荷的粒子与癌症治疗剂的组合,其中所述粒子不含附着的肽或抗原部分或其他生物活性剂,并且其中所述施用改变肿瘤位点处的髓源性抑制细胞
(mdsc)、肿瘤相关巨噬细胞(tam)、树突细胞、嗜中性粒细胞和/或单核细胞的群体。
15.在各个实施方案中,本公开提供了一种治疗受试者的增生性疾病的方法,所述方法包括向受试者施用带负电荷的粒子与癌症治疗剂的组合,其中所述粒子不含附着的肽或抗原部分或其他生物活性剂,并且其中所述施用改变肿瘤相关基质。
16.在各个实施方案中,本公开提供了一种治疗受试者的增生性疾病的方法,所述方法包括向受试者施用带负电荷的粒子与癌症治疗剂的组合,其中所述粒子不含附着的肽或抗原部分或其他生物活性剂,并且其中所述施用改变基质结缔组织、成纤维细胞、内皮、脂肪组织、细胞外基质、外膜细胞、间充质干细胞和/或间充质基质细胞。
17.在各个实施方案中,本公开提供了一种治疗受试者的增生性疾病的方法,所述方法包括向受试者施用带负电荷的粒子与癌症治疗剂的组合,其中所述粒子不含附着的肽或抗原部分或其他生物活性剂,并且其中所述施用使肿瘤尺寸减小和/或使肿瘤生长减少。
18.在各个实施方案中,本公开提供了一种治疗受试者的增生性疾病的方法,所述方法包括向受试者施用带负电荷的粒子与癌症治疗剂的组合,其中所述粒子不含附着的肽或抗原部分或其他生物活性剂,并且其中所述施用调控抗肿瘤免疫反应。
19.在各个实施方案中,本公开提供了一种治疗受试者的增生性疾病的方法,所述方法包括向受试者施用带负电荷的粒子与癌症治疗剂的组合,其中所述粒子不含附着的肽或抗原部分或其他生物活性剂,并且其中所述施用调控肿瘤特异性免疫反应。
20.在各个实施方案中,本公开提供了一种治疗受试者的癌症或增生性病症的方法,所述方法包括向受试者施用带负电荷的粒子与癌症治疗剂的组合,其中所述粒子不含附着的肽或抗原部分或其他生物活性剂,并且其中所述施用调控癌症干细胞。
21.在各个实施方案中,带负电荷的粒子为聚乙醇酸(pga)粒子、聚乳酸(pla)粒子、聚苯乙烯粒子、聚(乳酸
‑
共
‑
乙醇酸)(plga)粒子、金刚石粒子,或铁、锌、镉、金或银粒子,或它们的组合。
22.在一些实施方案中,带负电荷的粒子为聚(乳酸
‑
共
‑
乙醇酸)(plga)粒子。在各个实施方案中,粒子包含约50:50、约80:20至约100:0的聚乳酸:聚乙醇酸或约50:50、约80:20至约100:0的聚乙醇酸:聚乳酸。在各个实施方案中,粒子包含50:50的聚乳酸:聚乙醇酸。在各个实施方案中,粒子包含约99:1至约1:99的聚乳酸:聚乙醇酸,包括位于这些值之间的所有值和范围。
23.在各个实施方案中,粒子为表面官能化的。在各个实施方案中,通过羧化来实现表面官能化。在其他实施方案中,通过添加靶向剂来实现表面官能化。在一些实施方案中,所述靶向剂包含多肽、抗体、核酸、脂质、小分子、碳水化合物以及表面活性剂。在各个实施方案中,使表面官能化的纳米粒子优先靶向单核细胞、嗜中性粒细胞、巨噬细胞、树突细胞、t细胞、b细胞、nk细胞、nk t细胞、成纤维细胞、癌症相关成纤维细胞、内皮细胞、脂肪细胞、外膜细胞、内皮、脉管系统、淋巴管、肿瘤相关脉管系统、间充质基质细胞、间充质干细胞和/或细胞外基质。
24.在各个实施方案中,粒子具有介于
‑
100mv与
‑
1mv之间的ζ电位。在各个实施方案中,粒子具有介于
‑
80mv与
‑
30mv之间的ζ电位。在一些实施方案中,粒子的ζ电位为约
‑
100mv至约
‑
40mv、约
‑
75mv至约
‑
40mv、约
‑
70mv至约
‑
30mv、约
‑
60mv至约
‑
35mv或约
‑
50mv至约
‑
40mv。在各个实施方案中,ζ电位为约
‑
30mv、
‑
35mv、
‑
40mv、
‑
45mv、
‑
50mv、
‑
55mv、
‑
60mv、
‑
65mv、
‑
70mv、
‑
75mv、
‑
80mv、
‑
85mv、
‑
90mv、
‑
95mv或
‑
100mv,包括位于这些值之间的所有值和子范围。
25.在各个实施方案中,带负电荷的粒子的直径介于0.1μm至10μm之间。在各个实施方案中,粒子具有介于约0.2μm与约2μm之间;约0.3μm至约5μm之间;约0.5μm至约3μm之间;或约0.5μm至约1μm之间的平均直径。在一些实施方案中,粒子具有约100至1500nm、约200至2000nm、约100至10000nm、约300至1000nm、约400至800nm或约200至700nm的直径。在各个实施方案中,粒子具有约100nm、200nm、300nm、400nm、500nm、600nm、700nm、800nm、900nm、1000nm、1100nm、1200nm、1300nm、1400nm、1500nm或2000nm的平均直径,包括位于这些值之间的所有值和子范围。在一些实施方案中,带负电荷的粒子的直径介于400nm至800nm之间。
26.在各个实施方案中,受试者患有选自由以下组成的组的癌症:脑癌、皮肤癌、眼癌、乳腺癌、前列腺癌、胰腺癌、肺癌、食管癌、头颈癌、宫颈癌、肝癌、结肠癌、结肠直肠癌、直肠癌、骨癌、子宫癌、卵巢癌、膀胱癌、胃癌、口腔癌、甲状腺癌、肾癌、睾丸癌、白血病、淋巴瘤以及间皮瘤。具体实施方式中公开了所述方法所涵盖的其他癌症。
27.在各个实施方案中,癌症治疗剂为选自由以下组成的组的化学治疗剂:生长抑制剂、dna复制抑制剂、激酶抑制剂、信号传导级联反应抑制剂、血管生成抑制剂、代谢抑制剂、氨基酸合成抑制剂、致癌蛋白的选择性抑制剂、转移抑制剂、抗凋亡因子抑制剂、凋亡诱导剂、核苷信号传导抑制剂、酶抑制剂以及dna损伤剂。
28.在各个实施方案中,癌症治疗剂包含选自由以下组成的组的一种或多种生物剂:细胞因子、血管生成抑制剂、酶、免疫检查点调节剂以及单克隆抗体。
29.在各个实施方案中,细胞因子选自由以下组成的组:转化生长因子、肿瘤坏死因子、干扰素以及白介素。例示性细胞因子包括但不限于ifn
‑
α、ifn
‑
β、ifn
‑
γ、il
‑
1、il
‑
2、il
‑
4、il
‑
5、il
‑
6、il
‑
7、il
‑
10、il
‑
11、il
‑
12、il
‑
13、il
‑
15、il
‑
17、il
‑
18、il
‑
21、转化生长因子β超家族的成员(包括tgf
‑
β1、tgf
‑
β2以及tgf
‑
β3)、肿瘤坏死因子α、粒细胞集落刺激因子(g
‑
csf)以及粒细胞巨噬细胞集落刺激因子(gm
‑
csf)。
30.在各个实施方案中,单克隆抗体为单特异性、双特异性、三特异性或双特异性t细胞接合(bite)抗体。
31.在各个实施方案中,单克隆抗体为诱导抗肿瘤免疫反应的免疫细胞共刺激分子激动剂。例示性共刺激分子包括但不限于icos(可诱导t细胞共刺激剂)(cd278)、ox40(cd134)、41bb、gitr(糖皮质素诱导肿瘤坏死因子受体)、cd40以及cd27。
32.在各个实施方案中,免疫检查点调节剂靶向程序化细胞死亡蛋白1(pd
‑
1)、程序化细胞死亡蛋白配体
‑
1(pd
‑
l1)、细胞毒性t
‑
淋巴细胞相关蛋白4(ctla
‑
4)、t细胞免疫球蛋白和含粘蛋白结构域
‑
3(tim
‑
3)、淋巴细胞活化基因3(lag
‑
3)和/或tigit(具有ig和itim结构域的t细胞免疫受体)。在各个实施方案中,免疫检查点调节剂为选自由以下组成的组的抗体:伊匹单抗(ipilimumab)、曲美木单抗(tremelimumab)、派姆单抗(pembrolizumab)、纳武单抗(nivolumab)、阿特珠单抗(atezolizumab)、阿维单抗(avelumab)、赛米单抗(cemiplimab)以及德瓦鲁单抗(durvalumab)。
33.在各个实施方案中,可用于所述方法中的单克隆抗体选自包含以下的组:阿仑单抗(alemtuzumab)、贝伐单抗(bevacizumab)、本妥昔单抗(brentuximab)、西妥昔单抗(cetuximab)、地诺单抗(denosumab)、伊莫单抗(ibritumomab)、曲妥珠单抗
(trastuzumab)、帕尼单抗(panitumumab)、帕妥珠单抗(pertuzumab)以及利妥昔单抗(rituximab)。在各个实施方案中,可用于所述方法中的单克隆抗体靶向受体酪氨酸激酶、egfr、vegf、vegfr、pdgf、pdgfr、tgf
‑
β、tgf
‑
β
‑
lap、sirp
‑
α、cd47、cd39、cd73以及成纤维细胞活化蛋白(fap)。
34.在各个实施方案中,癌症治疗剂包含酶。在各个实施方案中,癌症治疗剂包含靶向t细胞、b细胞、apc、巨噬细胞、树突细胞、单核细胞、mdsc、tam、嗜中性粒细胞、其他单核细胞源性细胞、肿瘤相关基质、癌症干细胞、间充质干细胞、细胞外基质以及氨基酸的酶。在各个实施方案中,癌症治疗剂包含选自包含以下的组的酶:天冬酰胺酶、犬尿氨酸酶(kynurininase)、l
‑
精氨酸脱亚氨酶、l
‑
甲硫氨酸
‑
γ
‑
裂解酶、一种或多种氨基酸降解酶以及一种或多种核苷降解酶。
35.在各个实施方案中,癌症治疗剂包含选自由以下组成的组的一种或多种基于细胞的疗法:过继性细胞转移、肿瘤浸润性白细胞疗法、嵌合抗原受体t细胞疗法(car
‑
t)、nk细胞疗法以及干细胞疗法。
36.在各个实施方案中,基于细胞的疗法为自体患者源性细胞的过继转移。在各个实施方案中,基于细胞的疗法为异体供体源性细胞的过继转移。
37.在各个实施方案中,基于细胞的疗法为并非患者特有并且便于长期储存的通用供体源性或诱导多能干细胞源性细胞的转移。此类疗法也称为
‘
现成’疗法。
38.在各个实施方案中,癌症治疗剂为激素疗法。在各个实施方案中,癌症治疗剂包含一种或多种抗体
‑
药物缀合物。在各个实施方案中,癌症治疗剂包含一种或多种癌症疫苗。在各个实施方案中,癌症疫苗为蛋白质、多肽、核酸疫苗和/或树突细胞疫苗。
39.在各个实施方案中,癌症治疗剂为选自包含以下的组的免疫疗法:溶瘤病毒、细菌、溶瘤细菌或其他细菌组合物、卡介苗(bacillus calmette
‑
guerin,bcg)、微生物组调节剂和/或钟样受体(toll
‑
like receptor,tlr)激动剂。在各个实施方案中,tlr激动剂为tlr3、tlr4、tlr5、tlr7、tlr8、tlr9、tlr10、tlr11、tlr12和/或tlr13激动剂。在各个实施方案中,tlr激动剂源自于病毒、细菌和/或为合成制备的。在各个实施方案中,免疫疗法为sting路径调节剂。
40.在各个实施方案中,癌症治疗剂包含病毒或细菌载体。在各个实施方案中,病毒载体选自包含以下的组:腺病毒、腺相关病毒(aav)、单纯疱疹病毒、慢病毒、逆转录病毒、α病毒、黄病毒、棒状病毒、麻疹病毒、新城疫病毒(newcastle disease virus)、痘病毒、痘苗病毒、改良安卡拉病毒(modified ankara virus)、水疱性口炎病毒、小核糖核酸病毒、烟草花叶病毒、马铃薯x病毒、豇豆花叶病毒或黄瓜花叶病毒。在各个实施方案中,病毒为溶瘤病毒。在各个实施方案中,病毒为嵌合病毒、合成病毒、花叶病毒或假型病毒。
41.具体实施方式中阐述了预期用于所述方法中的其他癌症治疗剂。
42.在各个实施方案中,每周两次、每周一次、每两周一次、每三周一次、每4周一次、每两个月一次、每三个月一次、每6个月一次或每年一次地施用粒子和/或癌症治疗剂。
43.在各个实施方案中,静脉内、经口、经鼻、肌肉内、经眼、经皮或皮下施用粒子和/或癌症治疗剂。
44.在各个实施方案中,受试者为哺乳动物。在各个实施方案中,受试者为人。
45.在各个实施方案中,所述施用改善癌症或增生性病症的一种或多种症状。在各个
实施方案中,所述一种或多种症状选自由以下组成的组:受试者中的肿瘤尺寸或肿瘤负荷、肿瘤转移以及肿瘤中或肿瘤微环境中炎性细胞的水平。在各个实施方案中,所述施用使肿瘤尺寸或肿瘤负荷减小10%、20%、30%或更多。在各个实施方案中,所述施用改变肿瘤处的单核细胞、巨噬细胞、粒细胞、树突细胞和/或嗜中性粒细胞。
46.在各个实施方案中,将粒子配制在包含药学上可接受的载体、稀释剂或赋形剂的组合物中。在各个实施方案中,将癌症治疗剂配制在包含药学上可接受的载体、稀释剂或赋形剂的组合物中。在各个实施方案中,可将粒子和癌症治疗剂配制在同一组合物中或单独组合物中。
47.还涵盖一种包含本公开的任何前述粒子或癌症治疗剂组合物的组合物,或其用于制备用于治疗本文所描述的与炎症相关的病症以及癌症和/或增生性疾病中的任一者的药剂的用途。
48.应了解,本文所描述的各个特征或实施方案或组合为本发明的方面中的任一者的非限制性、说明性实例,并且因而意味着可与本文所描述的任何其他特征或实施方案或组合加以组合。举例来说,在用诸如“一个实施方案”、“一些实施方案”、“其他实施方案”、“特定例示性实施方案”和/或“另一实施方案”等措辞描述特征的情况下,这些类型的实施方案中的每一者为特征的非限制性实例,所述特征旨在与本文所描述的任何其他特征或特征组合加以组合,而不必列出每种可能的组合。此类特征或特征组合适用于本公开的方面中的任一者。在公开属于范围内的值的实例的情况下,将这些实例中的任一者考虑为可能的范围终点,此类终点之间的任何和所有数值均被涵盖,并且设想上终点和下终点的任何和所有组合。
附图说明
49.图1阐述了用于施用imp和检查点抑制剂抗pd
‑
1抗体的实例性处理时间表。
50.图2表明在llc细胞中与单一疗法处理相比imp加抗pd
‑
1组合疗法展现改善的肿瘤生长减少。
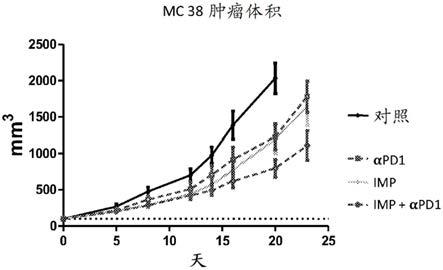
51.图3a至图3b示出了imp在单独施用或与抗pd1检查点抑制剂抗体组合施用时的抗肿瘤功效。为小鼠植入mc38肿瘤细胞并且在形成可触知的肿瘤之后用盐水对照、imp、抗pd1、或imp+抗pd1处理。(图3a)与对照处理相比,用imp处理抑制了肿瘤生长。imp功效类似于抗pd1处理。用imp+抗pd1处理展现协同作用,并且对肿瘤生长的抑制增强。(图3b)与对照处理相比,用imp处理使存活延长。imp存活功效优于抗pd1。用imp+抗pd1处理展现协同作用,并且与对照和相应单一疗法相比存活延长。
具体实施方式
52.imp带来有吸引力的特异性靶向循环中的免疫抑制单核细胞并且防止它们运输到肿瘤位点的可能性,在肿瘤位点处它们的免疫抑制活性促使肿瘤生长、增殖以及转移。相较于仅靶向肿瘤的单一疗法,imp疗法与其他抗癌治疗剂(如抗pd1单克隆抗体)对免疫抑制性肿瘤微环境的组合破坏/改变预期提供显著益处。
53.定义:
54.本文引用的各公布、专利申请、专利以及其他参考文献在不会与本公开不一致的
情况下以全文引用的方式并入本文中。
55.在此应注意,除非上下文另外明确指示,否则在用于本说明书和随附权利要求书中时,单数形式“一种”、“一个”以及“所述”包括复数参考物。
56.如本文所用的“粒子”是指任何非组织源性物质组合物,它可能为球形或球形样实体、珠粒或脂质体。术语“粒子”、术语“免疫修饰粒子”以及术语“珠粒”根据上下文可互换使用。另外,术语“粒子”可用于涵盖珠粒和球。
57.如本文所用的“表面官能化”是指向粒子的表面引入化学官能团。可通过疏水性单体与羧酸、磷酸酯、羟基、磺酸酯、膦酸酯以及胺或铵基团以及其他官能团的自由基共聚合来制备表面官能化的粒子。例如froimowicz等,curr org.chem 17:900
‑
912,2013中描述了制备表面官能化的纳米粒子的一般方法。
58.如本文所用的“可生物降解”是指粒子包含可例如因官能团与溶液中的水反应而经历降解的聚合物。如本文所用的术语“降解”是指通过分子量减小或通过疏水性基团转化为亲水性基团而变得可溶。可生物降解的粒子在体内不长时间存留,并且可控制完全降解的时间。可用于本发明中的生物相容性可生物降解聚合物包括己内酯、碳酸酯、酰胺、氨基酸、原酸酯、缩醛、氰基丙烯酸酯以及可降解氨基甲酸酯的聚合物或共聚物,以及这些物质与直链或分支链、取代或未取代的烷基、卤烷基、硫烷基、氨基烷基、烯基或芳族羟基羧酸或二羧酸的共聚物。此外,可将具有反应性侧链基团的生物学重要的氨基酸(诸如赖氨酸、精氨酸、天冬氨酸、谷氨酸、丝氨酸、苏氨酸、酪氨酸以及半胱氨酸)或其对映异构体与上述材料中的任一者一起包括在共聚物中,以提供用于缀合至抗原肽和蛋白质或缀合部分的反应性基团。适合于本发明的可生物降解材料包括金刚石、pla、pga、聚丙烯硫化物以及plga聚合物,以及金属,诸如铁(fe)、锌(zn)、镉(cd)、金或银。生物相容但不可生物降解的材料也可用于本文所描述的粒子中。举例来说,可采用丙烯酸酯、乙烯乙酸乙烯酯、酰基取代的乙酸纤维素、不可降解的氨基甲酸酯、苯乙烯、氯乙烯、氟乙烯、乙烯基咪唑、氯磺化烯烃、环氧乙烷、乙烯醇、(dupont,wilmington,del.)以及尼龙的不可生物降解的聚合物。
59.如本文所用的“带负电荷的粒子”是指已经过修饰以具有小于零的净表面电荷的粒子。
60.ζ电位为在固体表面与其液体介质之间的界面处所产生的电荷。“负ζ电位”是指粒子具有如以毫伏(mv)表示的粒子表面ζ电位,并且通过本领域中已知的仪器(例如nanobrook zetaplusζ电位分析仪或马尔文ζ电位测量仪(malvern zetasizer))进行测量来计算ζ电位。
[0061]“羧化的粒子”或“羧化的珠粒”或“羧化的球”包括已经过修饰或表面官能化以将一个或多个羧基添加至粒子表面的任何粒子。在一些实施方案中,羧基的添加例如通过与清道夫受体(诸如marco)相互作用使粒子从循环摄入吞噬细胞/单核细胞有所增强。可使用添加羧基的任何化合物,包括但不限于聚(乙烯
‑
马来酸酐)(pema)来实现粒子的羧化。
[0062]
如本文所用的术语“调控”或“改变”是指修改、调节或改变肿瘤位点处或肿瘤微环境中的免疫反应。修改或改变免疫反应的实例包括但不限于使肿瘤位点处或肿瘤微环境中的免疫抑制细胞数目减少或使其活性降低、使肿瘤位点处或肿瘤微环境中的免疫抑制免疫细胞浸润减少、使肿瘤位点或肿瘤微环境处的促炎性免疫细胞数目增加、使肿瘤位点或肿
瘤微环境处的促炎性免疫细胞浸润增加、使肿瘤位点或肿瘤微环境处的促炎性免疫细胞活性或功能增加、使肿瘤位点或肿瘤微环境处的抗肿瘤免疫细胞数目增加、使肿瘤位点处或肿瘤微环境中的抗肿瘤免疫细胞浸润增加、使肿瘤位点处或肿瘤微环境中免疫细胞的抗肿瘤活性或功能增加和/或杀死与免疫抑制相关的细胞。
[0063]
如本文所用的术语“肿瘤微环境”(tme)是指包围并且喂养肿瘤细胞的细胞、分子以及血管(国家癌症协会癌症术语辞典(national cancer institute dictionary of cancer terms))。肿瘤微环境包括免疫细胞(诸如骨髓源性炎性细胞、髓单核细胞、骨髓源性抑制细胞、肿瘤相关巨噬细胞、树突细胞以及淋巴细胞)、基质、成纤维细胞、信号传导分子以及细胞外基质(ecm)(joyce等,science 348:74
‑
80,2015)。
[0064]
如本文所用的“受试者”是指施用如本文所描述的粒子的人或非人动物,包括哺乳动物或灵长类动物。受试者可包括动物,诸如狗、猫、大鼠、小鼠、兔、马、猪、绵羊、牛以及人和其他灵长类动物。
[0065]
术语“治疗有效量”在本文中用于指示本公开的靶标特异性组合物有效改善或减轻所治疗的疾病或病症的一种或多种症状或迹象的量。
[0066]
术语“治疗(treat/treated/treating/treatment)”在相对于本文中的方法使用时是指暂时或永久地部分或完全消除、减轻、抑制或改善事件、疾病或疾患的一种或多种临床症状、表现或进展。此类治疗不需要为绝对的就可用。
[0067]
检查点调节剂
[0068]
程序化细胞死亡蛋白1(pd
‑
1)也称为分化簇279(cd279),是一种在活化t细胞、b细胞以及巨噬细胞上表达的细胞表面共抑制受体,并且是免疫检查点阻断的组分(shinohara等,genomics.,23(3):704,(1994);francisco等,immunol rev.,236:219,(2010))。pd
‑
1在与它的两个配体pd
‑
l1(也称为b7
‑
h1;cd274)和pd
‑
l2(b7
‑
dc;cd273)相互作用后限制t细胞的活性(postow等,j clin oncol.,33:9,(2015))。pd
‑
1与pd
‑
l1和pd
‑
l2相互作用使t细胞增殖、细胞因子产生有所减少,并且使细胞毒性活性降低(freeman gj等,j exp med.,192:1027
‑
34,(2000);brown ja等,j immunol.,170:1257
‑
66,(2003))。
[0069]
两种单克隆抗体已被美国食品和药物管理局(u.s.food and drug administration,fda)批准用于pd
‑
1免疫疗法的抑制。派姆单抗(merck sharp&dohme公司)被批准用于转移性黑素瘤,并且纳武单抗(bristol
‑
myers squibb)被批准用于转移性黑素瘤和转移性鳞状非小细胞肺癌(nsclc)。这些抗体中的两者均结合于pd
‑
1受体并且阻断它与它的配体pd
‑
l1和pd
‑
l2相互作用。在各个实施方案中,抗pd
‑
1抗体抑制或阻断pd
‑
1受体与它的配体pd
‑
l1和pd
‑
l2中的一者或两者的结合。
[0070]
美国专利号8,735,553;8,617,546;8,008,449;8,741,295;8,552,154;8,354,509;8,779,105;7,563,869;8,287,856;8,927,697;8,088,905;7,595,048;8,168,179;6,808,710;7,943,743;8,246,955;以及8,217,149中描述了pd
‑
1的其他抗体。
[0071]
还已证实pd
‑
l1的抑制剂有效抑制膀胱癌、头颈癌以及胃肠道癌中的实体肿瘤(herbst rs等,j clin oncol.,31:3000(2013);heery cr等,j clin oncol.,32:5s,3064(2014);powles t等,j clin oncol,32:5s,5011(2014);segal nh等,j clin oncol.,32:5s,3002(2014))。
[0072]
ctla
‑
4(细胞毒性t
‑
淋巴细胞相关蛋白4)(cd152)为在调控t细胞中组成性表达但
在活化之后仅在常规t细胞中上调的蛋白质受体。ctla
‑
4为t细胞信号传导和apc活化的ctla
‑
4/cd28:b7
‑
1/b7
‑
2共刺激路径的成员(grosso等,cancer immun.13:5,2013)并且通过结合于b7
‑
1或b7
‑
2从而减弱t细胞反应来充当t细胞活化的负调控剂。假设ctla
‑
4充当免疫检查点。对ctla
‑
4具特异性的抗体包括曲美木单抗和伊匹单抗所述抗体已被批准用于治疗黑素瘤。
[0073]
lag
‑
3(淋巴细胞活化基因3)(cd223)为在包括活化t细胞的许多免疫细胞上表达的细胞表面受体。lag
‑
3为cd8
+
t细胞的负调控剂并且它的缺乏与cd8
+
t细胞增殖增强相关(workman等j immunol174:688
‑
695(2005))。重要地,在临床前肿瘤模型与癌症患者样品中lag
‑
3与pd
‑
1在肿瘤浸润性淋巴细胞和耗竭t细胞上共表达,并且已显示促进肿瘤免疫逃避(andrews等,immunol rev.,276(1):80
‑
96(2017);le mercier等front immunol.,6:418(2015);woo等cancer res.,15;72(4):917
‑
27(2011);zhou等oncoimmunology 7(7):e1448332(2018))。lag
‑
3抑制在临床前模型中已显示作为治疗策略的前景(grosso等j clin invest.,117(11):3383
‑
92(2007);woo等cancer res.,15;72(4):917
‑
27(2011)),并且当前正在临床试验中针对许多癌症对使用单独或与其他检查点抑制剂抗体(诸如和)组合的单克隆抗体来抑制lag
‑
3进行评估。
[0074]
tim
‑
3(t细胞免疫球蛋白和含粘蛋白结构域3)为一种被发现在终末分化和活化t细胞上表达的跨膜蛋白,并且负责抑制t细胞反应以及诸如ifn
‑
γ等炎性细胞因子的表达。tim
‑
3与pd
‑
1在肿瘤浸润性淋巴细胞上共表达,并且它的表达与t细胞耗竭和抑制t细胞反应相关(linhares等,front immunol.,9:1909(2018);das等immunol rev.276(1):97
‑
111(2017))。cd8
+
t细胞上高水平的tim
‑
3表达与肿瘤免疫逃避相关并且与癌症患者的不良预后相关(anderson等immunity 17;44(5):989
‑
1004(2016);das等immunol rev.276(1):97
‑
111(2017))。此外,已证实表达pd
‑
1的肿瘤浸润性淋巴细胞中的tim
‑
3上调介导对抗pd
‑
1治疗剂的抗性(koyama等,nat commun.,7:10501(2016))。与这些观测一致,单克隆抗体介导的tim
‑
3与抗pd
‑
1的共阻断已在若干临床前肿瘤模型中显示有前景的抗肿瘤效应(ngiow等,cancer res.,3540
‑
3551(2011);anderson等immunity 17;44(5):989
‑
1004(2016)),并且若干评估单独抗tim
‑
3单克隆抗体或与检查点抑制剂抗体的组合的功效的临床试验当前正在进行。
[0075]
免疫修饰粒子
[0076]
在一些实施方案中,本公开提供了具有负ζ电位并且不含相关抗原、肽或其他生物活性材料的粒子在治疗方法中的用途。在各个实施方案中,粒子为表面官能化的粒子。
[0077]
粒子可由广泛范围的材料形成。粒子优选由适合于生物用途的材料组成。举例来说,粒子可由玻璃、二氧化硅、羟基羧酸的聚酯、二羧酸的聚酸酐或羟基羧酸与二羧酸的共聚物以及生物相容性金属组成。在各个实施方案中,粒子可由直链或分支链、取代或未取代、饱和或不饱和、线性或交联的烷基、卤烷基、硫烷基、氨基烷基、芳基、芳烷基、烯基、芳烯基、杂芳基或烷氧基羟基酸的聚酯,或直链或分支链、取代或未取代、饱和或不饱和、线性或交联的烷基、卤烷基、硫烷基、氨基烷基、芳基、芳烷基、烯基、芳烯基、杂芳基或烷氧基二羧酸的聚酸酐组成。另外,粒子可为量子点,或由量子点组成,诸如量子点聚苯乙烯粒子(joumaa等(2006)langmuir 22:1810
‑
6)。还可采用包括酯和酸酐键的混合物(例如乙醇酸与癸二酸的共聚物)的粒子。举例来说,粒子可包含包括以下的材料:聚乙醇酸聚合物
(pga)、聚乳酸聚合物(pla)、聚癸二酸聚合物(psa)、聚(乳酸
‑
共
‑
乙醇酸)共聚物(plga或plg;术语可互换)、聚(乳酸
‑
共
‑
癸二酸)共聚物(plsa)、聚(乙醇酸
‑
共
‑
癸二酸)共聚物(pgsa)、聚丙烯硫化物聚合物、聚(己内酯)、壳聚糖等。可用于本发明中的其他生物相容性可生物降解聚合物包括己内酯、碳酸酯、酰胺、氨基酸、原酸酯、缩醛、氰基丙烯酸酯以及可降解氨基甲酸酯的聚合物或共聚物,以及这些物质与直链或分支链、取代或未取代的烷基、卤烷基、硫烷基、氨基烷基、烯基或芳族羟基羧酸或二羧酸的共聚物。此外,可将具有反应性侧链基团的生物学重要的氨基酸(诸如赖氨酸、精氨酸、天冬氨酸、谷氨酸、丝氨酸、苏氨酸、酪氨酸以及半胱氨酸)或其对映异构体与上述材料中的任一者一起包括在共聚物中,以提供用于缀合至抗原肽和蛋白质或缀合部分的反应性基团。适合于本发明的可生物降解材料包括金刚石、pla、pga、聚丙烯硫化物以及plga聚合物,以及金属,诸如铁(fe)、锌(zn)、镉(cd)、金(au)或银(ag)。生物相容但不可生物降解的材料也可用于本文所描述的粒子中。举例来说,可采用丙烯酸酯、乙烯乙酸乙烯酯、酰基取代的乙酸纤维素、不可降解的氨基甲酸酯、苯乙烯、氯乙烯、氟乙烯、乙烯基咪唑、氯磺化烯烃、环氧乙烷、乙烯醇、(dupont,wilmington,del.)以及尼龙的不可生物降解的聚合物。
[0078]
可通过本领域中已知的任何手段制造本公开的粒子。制造粒子的例示性方法包括但不限于微乳液聚合、界面聚合、沉淀聚合、乳液蒸发、乳液扩散、溶剂置换以及盐析(astete和sabliov,j.biomater.sci.polymer edn.,17:247
‑
289(2006))。美国专利9,616,113和国际专利公布wo/2017/143346中公开了本文涵盖的制备粒子的方法。操纵plga粒子的制造工艺可控制粒子性质(例如尺寸、尺寸分布、ζ电位、形态、疏水性/亲水性、多肽俘获等)。粒子的尺寸受许多因素影响,包括但不限于聚合物(例如plga)的浓度、粒子制造中所用的溶剂、有机相的性质、制造中所用的表面活性剂、连续和不连续相的粘度、所用溶剂的性质、所用水的温度、超声处理、蒸发速率、添加剂、剪切应力、灭菌以及任何所封装的抗原或多肽的性质。
[0079]
在各个实施方案中,粒子包含聚合物、共聚物、树状聚体、金刚石纳米粒子、聚苯乙烯纳米粒子或金属。在各个实施方案中,预期粒子包含聚乙醇酸聚合物(pga)、聚乳酸(pla)、聚苯乙烯、pga和pla的共聚物(聚(丙交酯
‑
共
‑
乙交酯)(plga))、金刚石(plga)、脂质体、peg、环糊精或金属,诸如铁(fe)、锌(zn)、镉(cd)、金(au)或银(ag)。
[0080]
在各个实施方案中,粒子为具有摩尔比为约50:50、约80:20至约100:0的聚乳酸:聚乙醇酸或约50:50、约80:20至约100:0的聚乙醇酸:聚乳酸的共聚物。在一些实施方案中,粒子为聚(乳酸
‑
共
‑
乙醇酸)粒子。在各个实施方案中,粒子包含50:50的聚乳酸:聚乙醇酸。在各个实施方案中,粒子包含约99:1至约1:99的聚乳酸:聚乙醇酸,包括位于这些值之间的所有值和范围。
[0081]
在一些实施方案中,粒子的ζ电位为约
‑
100mv至约
‑
1mv。在一些实施方案中,粒子的ζ电位为约
‑
100mv至约
‑
40mv、约
‑
80mv至约
‑
30mv、约
‑
75mv至约
‑
40mv、约
‑
70mv至约
‑
30mv、约
‑
60mv至约
‑
35mv或约
‑
50mv至约
‑
40mv。在各个实施方案中,ζ电位为约
‑
30mv、
‑
35mv、
‑
40mv、
‑
45mv、
‑
50mv、
‑
55mv、
‑
60mv、
‑
65mv、
‑
70mv、
‑
75mv
‑
80mv、
‑
85mv、
‑
90mv、
‑
95mv或
‑
100mv,包括位于这些值之间的所有值和范围。
[0082]
在一些实施方案中,粒子具有介于约0.1μm至约10μm之间的平均直径。在一些实施方案中,粒子具有介于0.2μm与约2μm之间的平均直径。在一些实施方案中,粒子具有介于约
0.3μm至约5μm之间的直径。在一些实施方案中,粒子具有介于约0.5μm至约3μm之间的直径。在一些实施方案中,粒子具有介于约0.5μm至约1μm之间的直径。在一些实施方案中,粒子具有约100至1500nm、约200至2000nm、约100至10000nm、约300至1000nm、约400至800nm或约200至700nm的直径,包括位于这些值之间的所有值和范围。
[0083]
为向人或其他哺乳动物施用如本文所描述的粒子,可将粒子配制在包含一种或多种无菌药学上可接受的载体的无菌组合物中。短语“药学上或药理学上可接受的”是指分子实体和组合物当如下文所描述使用本领域中熟知的途径施用时不产生过敏或其他有害反应。“药学上可接受的载体”包括任何和所有临床可用的溶剂、分散介质、包衣剂、抗细菌和抗真菌剂、等张和吸收延迟剂等。
[0084]
本公开的含有本文的粒子的药物组合物可根据施用途径含有无菌的药学上可接受的载体或添加剂。此类载体或添加剂的实例包括水、药学上可接受的有机溶剂、胶原蛋白、聚乙烯醇、聚乙烯吡咯烷酮、羧乙烯聚合物、羧甲基纤维素钠、聚丙烯酸钠、海藻酸钠、水溶性右旋糖酐、羧甲基淀粉钠、果胶、甲基纤维素、乙基纤维素、黄原胶、阿拉伯胶、酪蛋白、明胶、琼脂、双甘油、甘油、丙二醇、聚乙二醇、凡士林、石蜡、硬脂醇、硬脂酸、人血清白蛋白(hsa)、甘露糖醇、山梨糖醇、乳糖、药学上可接受的表面活性剂等。所用的添加剂根据本发明的剂型在适当时选自但不限于以上物质或它们的组合。对于溶液或乳液,适合的载体包括例如水性或酒精性/水性溶液、乳液或悬浮液,包括盐水和缓冲介质。肠胃外媒介物可包括氯化钠溶液、林格氏右旋糖(ringer's dextrose)、右旋糖和氯化钠、乳酸林格氏液(lactated ringer's)或固定油。静脉内媒介物可包括各种添加剂、防腐剂或流体、营养物或电解质补充剂。多种水性载体为适合的,例如无菌磷酸盐缓冲盐水溶液、抑细菌水、水、缓冲水、0.4%盐水、0.3%甘氨酸等,并且可包括经历适度化学修饰的用于获得增强的稳定性的其他蛋白质(诸如白蛋白、脂蛋白、球蛋白等)等。
[0085]
预期粒子可还包含表面活性剂。表面活性剂可为阴离子、阳离子或非离子的。粒子合成中常用泊洛沙姆(poloxamer)和poloaxamine家族中的表面活性剂。可使用的表面活性剂包括但不限于peg、吐温
‑
80(tween
‑
80)、明胶、右旋糖酐、普朗尼克(pluronic)l
‑
63、pva、甲基纤维素、卵磷脂、dmab以及pema。另外,可生物降解并且生物相容的表面活性剂包括但不限于维生素e tpgs(d
‑
α
‑
生育酚聚乙二醇1000琥珀酸酯)。在某些实施方案中,使用两种表面活性剂。举例来说,如果通过双乳液法产生粒子,那么所述两种表面活性剂可包括用于第一乳液的疏水性表面活性剂,以及用于第二乳液的疏水性表面活性剂。
[0086]
通过将具有所需纯度的粒子与任选的生理学上可接受的载体、赋形剂或稳定剂(remington's pharmaceutical sciences第16版,osol,a.编(1980))混合成冻干制剂或水溶液形式来制备粒子的治疗剂制剂以便储存。可接受的载体、赋形剂或稳定剂在所采用的剂量和浓度下对接受者无毒,并且包括缓冲剂,诸如磷酸盐、柠檬酸盐、琥珀酸盐以及其他有机酸;抗氧化剂,包括抗坏血酸和甲硫氨酸;防腐剂(诸如十八基二甲基苯甲基氯化铵;氯化六烃季铵;苯扎氯铵、苄索氯铵;苯酚、丁醇或苯甲醇;烷基对羟基苯甲酸酯,诸如对羟基苯甲酸甲酯或对羟基苯甲酸丙酯;儿茶酚;间苯二酚;环己醇;3
‑
戊醇;以及间甲酚);低分子量(少于约10个残基)多肽;蛋白质,诸如血清白蛋白、明胶或免疫球蛋白;亲水性聚合物,诸如聚乙烯吡咯烷酮;氨基酸,诸如甘氨酸、谷氨酰胺、天冬酰胺、组氨酸、精氨酸或赖氨酸;单糖、二糖以及其他碳水化合物,包括葡萄糖、甘露糖或糊精;螯合剂,诸如edta;糖,诸如蔗
糖、甘露糖醇、海藻糖或山梨糖醇;成盐反离子,诸如钠;或金属络合物(例如zn
‑
蛋白质络合物)。
[0087]
可通过冻干使粒子的制备稳定。添加的防冻剂(诸如海藻糖)可使冻干后粒子的聚集减少。可采用任何适合的冻干和复原技术。本领域技术人员将了解,冻干和复原可导致不同程度的抗体活性损失,并且可能不得不调整使用水平以进行补偿。
[0088]
使用方法
[0089]
本文提供了一种治疗受试者的癌症或增生性病症的方法,所述方法包括施用带负电荷的粒子与癌症治疗剂的组合,其中所述粒子不含附着的肽或抗原部分,并且其中所述施用改变肿瘤位点处的髓源性抑制细胞(mdsc)、肿瘤相关巨噬细胞(tam)、嗜中性粒细胞、树突细胞和/或单核细胞的群体。
[0090]
在各个实施方案中,本公开提供了一种治疗受试者的癌症或增生性病症的方法,所述方法包括向受试者施用如本文所描述的带负电荷的粒子与癌症治疗剂的组合,其中所述施用改变肿瘤相关基质,和/或其中所述施用改变基质结缔组织、成纤维细胞、内皮、脂肪组织、细胞外基质、外膜细胞、间充质干细胞和/或间充质基质细胞,和/或其中所述施用使肿瘤尺寸减小和/或使肿瘤生长减少,和/或其中所述施用调控抗肿瘤免疫反应,和/或其中所述施用调控肿瘤特异性免疫反应。
[0091]
在各个实施方案中,本公开提供了一种治疗受试者的癌症或增生性病症的方法,所述方法包括向受试者施用如本文所描述的带负电荷的粒子与癌症治疗剂的组合,其中所述施用调控癌症干细胞。
[0092]
可用于测定治疗剂对免疫细胞的效应的方法包括但不限于显微镜分析、组织学分析、细胞学分析、流式细胞术、聚合酶链反应(pcr)、定量聚合酶链反应(qpcr)、rna测序(rna
‑
seq)、单细胞rna测序(scrna
‑
seq)、下一代测序、全外显子组测序、表观遗传测序、atac
‑
seq、微阵列分析以及大量细胞计数或cytof。可单独或组合用于评估免疫细胞的生物标记物包括细胞表面标记物和分泌的蛋白质。例示性生物标记物包括但不限于cd45、cd3、cd4、cd8、cd25、cd44、cd134、cd252、cd137、cd79、cd39、foxp3、pd
‑
1、lag
‑
3、tim
‑
1、ifn
‑
γ、颗粒酶、穿孔素、cd11b、cd11c、ly6c、ly6g、cd14、cd16、cd80、marco、cd68、cd115、cd204、cd205、cd206、cd163、cd103、cd103c、f4/80、pd
‑
l1、pd
‑
l2、精氨酸酶、inos、ros、tnf
‑
α、tgf
‑
β、mhc
‑
i、mhc
‑
ii、nk1.1、nkg2d、cd244、ki67、cd19、cd20、ccr2、cxcr3、ccr4、ccr5、ccr6、ccr7、ccr10、ccl2、ccl5、cx3cr1、ccl10、icos、cd40、cd40l、il1α、il1β、il2、il4、il5、il6、il8、il12、il15、il17、il21、il22、tcrγ/δ、tcrα/β、stat3、ror1c以及rorγt。
[0093]
已将癌症干细胞(csc)描述为在实体肿瘤和血液学肿瘤内发现的致瘤并且能够自我更新、分化的细胞的子集。若干报道已描述csc在多种肿瘤的发病机理、治疗后肿瘤复发以及治疗剂抗性的发展中的重要性。可使用许多细胞表面标记物来区别实体肿瘤和血液学肿瘤内的csc。csc标记物包括但不限于cd19、cd20、cd24、cd34、cd38、cd44、cd90、cd133、醛脱氢酶1、ceacam
‑
6/cd66c、bmi
‑
1、连接蛋白43/gja1、dll4、epcam/trop1、gli
‑
1、gli
‑
2、整合素、pon1、pten、alcam/cd166、dppiv/cd26、lgr5、musashi
‑
1、a20、abcg2、cd15、分形素(fractalkine)、hif
‑
2α、l1cam、c
‑
maf、巢蛋白、平足蛋白、sox2、cd96、cd117、flt3、afp、cd13、cd90、nf2/merlin、abcb5、ngfr、粘结蛋白聚糖
‑
1、内皮素、stro
‑
1以及poni。
[0094]
为在细胞和分子水平对肿瘤进行表征所设计的多种诊断工具为fda批准的并且可
商购获得。批准的诊断工具的实例包括cdx、liquid、heme、bracanalysis cdx、therascreen egfr rgq pcr试剂盒、cobase egfr突变测试v2、pd
‑
l1 ihc 22c3pharmdx、abbott实时idh1、mrdx bcr
‑
abl测试、ventana alk(d5f3)cdx分析、abbott实时idh2、praxis延长ras面板、oncomine dx靶标测试、leukostrat cdx flt3突变分析、foundationfocus cdxbrca分析、vysis cll fish探针试剂盒、kitd816v突变检测、pdgfrb fish、cobas kras突变测试、therascreen kras rgq pcr试剂盒、ferriscan、dako c
‑
kit pharmdx、inform her
‑
2/neu、pathvysion her
‑
2dna探针试剂盒、spot
‑
light her2 cish试剂盒、bond oracle her2 ihc系统、her2 cish pharmdx试剂盒、inform her2 dual ish dna探针混合物、herceptest、her2 fish pharmdx试剂盒、thxid braf试剂盒、vysis alk分离fish探针试剂盒、cobas 4800braf v600突变测试、ventana pd
‑
l1(sp142)分析、therascreen fgfr rgq rt
‑
pcr试剂盒以及therascreen pik3ca rgq pcr试剂盒。
[0095]
本文预期,在用任选与癌症治疗剂组合的本文所描述的带负电荷的粒子处理之后,生物标记物中的一者或多者的水平增加的量在约1.1倍至约10倍范围内,例如约1.1、约1.5、约2、约2.5、约3、约3.5、约4、约4.5、约5、约5.5、约6、约6.5、约7、约7.5、约8、约8.5、约9、约9.5或约10倍。在用本文所描述的表面官能化的粒子处理之后,生物标记物中的一者或多者的水平降低的量在约1.1倍至约10倍范围内,例如约1.1、约1.5、约2、约2.5、约3、约3.5、约4、约4.5、约5、约5.5、约6、约6.5、约7、约7.5、约8、约8.5、约9、约9.5或约10倍。
[0096]
可使用本文的方法治疗的例示性疾病、疾患或病症包括癌症,诸如食管癌、胰腺癌、转移性胰腺癌、胰腺的转移性腺癌、膀胱癌、胃癌、纤维化癌症、神经胶质瘤、恶性神经胶质瘤、弥漫性内因性脑桥神经胶质瘤、复发性儿童期脑赘瘤肾细胞癌、透明细胞转移性肾细胞癌、肾癌、前列腺癌、转移性去势抗性前列腺癌、iv期前列腺癌、转移性黑素瘤、黑素瘤、恶性黑素瘤、复发性皮肤黑素瘤、黑素瘤脑转移、iiia期皮肤黑素瘤;iiib期皮肤黑素瘤、iiic期皮肤黑素瘤、iv期皮肤黑素瘤、头部和颈部恶性黑素瘤、肺癌、非小细胞肺癌(nsclc)、鳞状细胞非小细胞肺癌、乳腺癌、复发性转移性乳腺癌、肝细胞癌、霍奇金氏淋巴瘤(hodgkin’s lymphoma)、滤泡性淋巴瘤、非霍奇金氏淋巴瘤、晚期b细胞nhl、包括弥漫性大b细胞淋巴瘤(dlbcl)的hl、多发性骨髓瘤、慢性骨髓性白血病、缓解期的成人急性骨髓性白血病;成人急性骨髓性白血病伴inv(16)(p13.1q22);cbfb
‑
myh11;成人急性骨髓性白血病伴t(16;16)(p13.1;q22);cbfb
‑
myh11;成人急性骨髓性白血病伴t(8;21)(q22;q22);runx1
‑
runx1t1;成人急性骨髓性白血病伴t(9;11)(p22;q23);mllt3
‑
mll;成人急性前髓细胞性白血病伴t(15;17)(q22;q12);pml
‑
rara;烷基化剂相关急性骨髓性白血病、慢性淋巴细胞性白血病、里希特氏综合征(richter's syndrome);沃尔德斯特罗姆巨球蛋白血症(waldenstrom macroglobulinemia)、成人成胶质细胞瘤;成人胶质肉瘤、复发性成胶质细胞瘤、复发性儿童期横纹肌肉瘤、复发性尤文肉瘤(recurrent ewing sarcoma)/外周原始神经外胚层肿瘤、复发性成神经细胞瘤;复发性骨肉瘤、结肠直肠癌、msi阳性结肠直肠癌;msi阴性结肠直肠癌、鼻咽非角化性癌;复发性鼻咽未分化性癌、宫颈腺癌;宫颈腺鳞癌;宫颈鳞状细胞癌;复发性宫颈癌;iva期宫颈癌;ivb期宫颈癌、肛管鳞状细胞癌;转移性肛管癌;复发性肛管癌、复发性头颈癌;头部和颈部鳞状细胞癌、头部和颈部鳞状细胞癌(hnscc)、卵巢癌、结肠癌、结肠直肠癌、直肠癌、胃癌、晚期gi癌、胃腺癌;胃食管连接部腺癌、骨赘瘤、软组织肉瘤;
骨肉瘤、胸腺癌、尿路上皮癌、复发性默克细胞癌(recurrent merkel cell carcinoma);iii期默克细胞癌;iv期默克细胞癌、骨髓发育异常综合征以及复发性蕈样霉菌病以及塞扎里综合征(sezary syndrome)。在各个实施方案中,癌症选自脑癌、皮肤癌、眼癌、乳腺癌、前列腺癌、肺癌、食管癌、头颈癌、宫颈癌、肝癌、骨癌、子宫癌、卵巢癌、膀胱癌、胃癌、口腔癌、甲状腺癌、肾癌、睾丸癌、白血病、淋巴瘤以及间皮瘤。
[0097]
预期本文的方法使受试者中的肿瘤尺寸或肿瘤负荷减小,和/或使受试者中的转移减少。在各个实施方案中,所述方法使肿瘤尺寸减小10%、20%、30%或更多。在各个实施方案中,所述方法使肿瘤尺寸减小10%、15%、20%、25%、30%、35%、40%、45%、50%、55%、60%、65%、70%、75%、80%、85%、90%、95%或100%,包括位于这些值之间的所有值和范围。
[0098]
在各个实施方案中,本公开提供了一种通过将免疫抑制细胞隔离在脾脏和/或肝脏中使来自肿瘤位点的免疫抑制细胞的数目减少并且在受试者中诱导凋亡的方法,所述方法包括向受试者施用带负电荷的粒子与癌症治疗剂的组合。
[0099]
在各个实施方案中,在受试者中施用粒子防止在肿瘤位点或肿瘤微环境处造成单核细胞、巨噬细胞、粒细胞和/或嗜中性粒细胞的病变累积。
[0100]
在各个实施方案中,本公开提供了一种使肿瘤处的单核细胞、巨噬细胞、粒细胞和/或嗜中性粒细胞的数目减少的方法。在各个实施方案中,肿瘤处的单核细胞、巨噬细胞、粒细胞和/或嗜中性粒细胞的数目减少约2倍、3倍、4倍、5倍、6倍、7倍、8倍、9倍或10倍或更多。
[0101]
在各个实施方案中,本公开提供了一种改变受试者中的抗肿瘤免疫反应的方法,所述方法包括向受试者施用带负电荷的粒子与癌症治疗剂的组合。在各个实施方案中,所述改变使抗肿瘤apc、巨噬细胞、树突细胞、t细胞、b细胞、nk t细胞和/或nk细胞的水平或活性增加。
[0102]
在各个实施方案中,在受试者中施用粒子改变肿瘤位点或肿瘤微环境处的免疫细胞的活性和/或功能。在各个实施方案中,粒子的施用使肿瘤位点或肿瘤微环境处的炎性免疫细胞的数目增加。在各个实施方案中,在受试者中施用粒子使肿瘤位点或肿瘤微环境处的免疫细胞的抗肿瘤炎性功能或活性增加。
[0103]
在各个实施方案中,本公开提供了一种改变肿瘤相关基质的方法,所述方法包括向受试者施用带负电荷的粒子与癌症治疗剂的组合。
[0104]
在各个实施方案中,在受试者中施用粒子改变肿瘤位点或肿瘤相关基质处的成纤维细胞、癌症相关成纤维细胞、脂肪细胞、内皮细胞、外膜细胞、间充质基质细胞和/或ecm。
[0105]
在各个实施方案中,本公开提供了一种使受试者中的肿瘤尺寸减小和/或使肿瘤生长减少的方法,所述方法包括向受试者施用带负电荷的粒子与癌症治疗剂的组合。
[0106]
在各个实施方案中,本公开提供了一种改变癌症干细胞和/或间充质干细胞的方法,所述方法包括向受试者施用带负电荷的粒子与癌症治疗剂的组合。
[0107]
在各个实施方案中,在受试者中施用粒子经由直接粒子摄入诱导肿瘤细胞死亡、肿瘤细胞凋亡和/或肿瘤细胞坏死。
[0108]
施用和给药
[0109]
本文涵盖包括施用如本文所描述的带负电荷的粒子与癌症治疗剂的组合以治疗
罹患癌症或增生性病症的受试者的方法。
[0110]
使用任何医学上接受的用于将治疗剂直接或间接引入哺乳动物受试者中的方式进行本公开的方法,包括但不限于注射、经口摄取、鼻内、经表面、经真皮、肠胃外、吸入喷雾、经阴道或经直肠施用。如本文所用的术语肠胃外包括皮下、静脉内、肌肉内、关节内、腹膜内、鞘内以及脑池内注射,以及导管或输注技术。在各个实施方案中,静脉内施用粒子,但可通过其他施用途径施用,诸如但不限于:真皮内、皮下、经皮、经口、关节内以及鞘内。在各个实施方案中,在肿瘤位点处施用组合物。
[0111]
在各个实施方案中,以约0.1至约10mg/kg的剂量施用粒子。在各个实施方案中,以约0.1mg/kg、0.5mg/kg、1.0mg/kg、2.0mg/kg、4.0mg/kg、8.0mg/kg或10mg/kg的剂量施用粒子。在各个实施方案中,以约8.0mg、80mg、320mg、640mg或800mg的剂量施用粒子。还涵盖所叙述的剂量终点内和之间的值。这些浓度可作为单一剂型或作为多个剂量施用。
[0112]
预期如果为已知癌症治疗剂,那么如制造商和治疗医师所指导来施用癌症治疗剂。如果要在同一制剂中施用粒子和癌症治疗剂,那么可如本文所描述对它们进行配制。
[0113]
给定剂量中免疫调节剂或生物剂癌症治疗剂的量可根据施用疗法的个体的体型以及所治疗病症的特征而改变。在例示性治疗中,可能需要每天施用约1mg、5mg、10mg、20mg、50mg、75mg、100mg、150mg、200mg、250mg、500mg或1000mg。首先在动物模型中然后在临床测试中进行的标准剂量
‑
反应研究揭示了用于特定疾病状态和患者群体的最佳剂量。
[0114]
在各个实施方案中,以0.1至15mg/kg的剂量范围施用检查点调节剂,诸如pd
‑
1抗体、ctla
‑
4抗体或pd
‑
l1抗体。这些浓度可作为单一剂型或作为多个剂量施用。
[0115]
可通过本公开的方法治疗的疾患优选地发生在哺乳动物中。哺乳动物包括例如人和其他灵长类动物,以及宠物或伴侣动物,诸如狗和猫;实验室动物,诸如大鼠、小鼠以及兔;以及农场动物,诸如马、猪、绵羊以及牛。在各个实施方案中,受试者为人。
[0116]
在各个实施方案中,每周两次、每周一次、每两周一次、每三周一次、每4周一次、每两个月一次、每三个月一次、每6个月一次或每年一次地施用粒子。
[0117]
本公开还涵盖一种包含如本文所描述的粒子、癌症治疗剂以及药学上可接受的载体的无菌药物组合物。
[0118]
本公开还涵盖一种包含如本文所描述的粒子和药学上可接受的载体的无菌药物组合物。
[0119]
本公开还涵盖一种包含癌症治疗剂和药学上可接受的载体的无菌药物组合物。
[0120]
还涵盖注射器,例如一次性或预填充注射器;无菌密封容器,例如小瓶、瓶、容器;和/或包含前述抗体或组合物中的任一者任选加上适合的使用说明书的药盒或包装。
[0121]
组合疗法
[0122]
预期本文所描述的粒子与癌症治疗剂组合施用以治疗癌症或增生性病症。在各个实施方案中,癌症治疗剂为化学治疗剂、生物剂、基于细胞的疗法、激素疗法、抗体
‑
药物缀合物、溶瘤病毒或癌症疫苗。激素疗法包括用于乳腺癌的他莫昔芬(tamoxifen)、用于乳腺癌和前列腺癌的诺雷德(zoladex)、芳香酶抑制剂(例如阿那曲唑(anastrazole)、来曲唑(letrozole)、依西美坦(exemestane))。抗体药物缀合物包括用于淋巴瘤的维布妥昔单抗(brentuximab vedotin)(抗cd30mab+单甲基澳瑞他汀e(monomethyl auristatin e))、用于乳腺癌的恩美曲妥珠单抗(ado
‑
trastuzumab entansine)(抗her2/neu+类美登素
(maytansinoid))以及用于all的奥英妥珠单抗(inotuzumab ozagamicin)(抗cd22+加利车霉素(calicheamicin))。溶瘤病毒包括imlygic癌症疫苗包括用于前列腺癌的西普鲁塞
‑
t(sipuleucel
‑
t)。若干癌症疫苗正在研发中并且包括但不限于蛋白质、多肽、核酸以及树突细胞疫苗。
[0123]
在各个实施方案中,癌症治疗剂为选自由以下组成的组的化学治疗剂:生长抑制剂、细胞毒性剂、dna复制抑制剂、激酶抑制剂、信号传导级联反应抑制剂、血管生成抑制剂、代谢抑制剂、氨基酸合成抑制剂、致癌蛋白的选择性抑制剂、转移抑制剂、抗凋亡因子抑制剂、凋亡诱导剂、核苷信号传导抑制剂、酶抑制剂以及dna损伤剂。
[0124]
细胞毒性剂是指抑制或阻止细胞功能和/或引起细胞破坏的物质。所述术语旨在包括放射性同位素(例如i131、i125、y90以及re186)、化学治疗剂以及毒素,诸如来源于细菌、真菌、植株或动物的酶活性毒素或合成毒素或其片段。非细胞毒性剂是指不抑制或阻止细胞功能和/或不引起细胞破坏的物质。非细胞毒性剂可包括可被活化为具细胞毒性的剂。
[0125]
预期用于本公开的方法中的化学治疗剂包括但不限于表i中所列的那些化学治疗剂:
[0126]
表i
[0127]
[0128]
[0129]
[0130][0131]
还预期癌症治疗剂包含一种或多种生物剂,诸如细胞因子、血管生成抑制剂、免疫检查点调节剂以及单克隆抗体。细胞因子包括干扰素(ifn)和白介素(il),诸如ifn
‑
α、ifn
‑
β、ifn
‑
γ、il
‑
1、il
‑
2、il
‑
4、il
‑
5、il
‑
6、il
‑
7、il
‑
10、il
‑
11、il
‑
12、il
‑
13、il
‑
15、il
‑
17、il
‑
18、il
‑
21、转化生长因子β超家族的成员(包括tgf
‑
β1、tgf
‑
β2以及tgf
‑
β3)、肿瘤坏死因子α、粒细胞集落刺激因子(g
‑
csf)以及粒细胞巨噬细胞集落刺激因子(gm
‑
csf)。
[0132]
诸如免疫检查点调节剂等生物剂靶向pd1、pd
‑
l1、ctla
‑
4、timp
‑
3、lag
‑
3和/或tigit(具有ig和itim结构域的t细胞免疫受体)。在各个实施方案中,免疫检查点调节剂为对pd
‑
1、pd
‑
l1或ctla
‑
4具特异性的抗体。对检查点蛋白具特异性的抗体包括伊匹单抗(bristol
‑
myers squibb公司)以及结合ctla
‑
4的曲美木单抗;pd
‑
1的抗体,诸如派姆单抗(merck sharp&dohme公司)以及纳武单抗(bristol
‑
myers squibb);以及靶向pd
‑
l1的抗体,诸如阿特珠单抗阿维单抗以及德瓦鲁单抗(批准用于治疗尿路上皮癌和非小细胞肺癌)、赛米单抗(批准用于皮肤鳞状细胞癌)。
[0133]
在各个实施方案中,可用于所述方法中的单克隆抗体选自包含以下的组:阿仑单抗、贝伐单抗、本妥昔单抗、西妥昔单抗、地诺单抗、伊莫单抗、曲妥珠单抗、帕尼单抗、帕妥珠单抗以及利妥昔单抗。在各个实施方案中,可用于所述方法中的单克隆抗体靶向受体酪氨酸激酶、egfr、vegf、vegfr、pdgf、pdgfr、tgf
‑
β、tgf
‑
β
‑
lap、sirp
‑
α、cd47、cd39、cd73以及成纤维细胞活化蛋白(fap)。
[0134]
生物剂包括单克隆抗体,所述单克隆抗体为单特异性、双特异性、三特异性或双特异性t细胞衔接器(bite)。可用于治疗癌症的单克隆抗体包括贝伐单抗(genentech)、vegf
‑
a的抗体;埃罗替尼(erlotinib)(genentech和osi pharmaceuticals)、作用于egfr的酪氨酸激酶抑制剂、达沙替尼(dasatinib)(bristol
‑
myers squibb公司)、经口bcr
‑
abl酪氨酸激酶抑制剂;il
‑
21;聚乙
二醇化ifn
‑
α2b;阿西替尼(axitinib)(pfizer有限公司)、酪氨酸激酶抑制剂;以及曲美替尼(trametinib)(glaxosmithkline)、mek抑制剂(philips和atkins,int immunol.,27(1):39
‑
46(2015),该文献以引用的方式并入本文中)。krishnamurthy等,(pharmacol ther.2018年5月;185:122
‑
134)以及yu等,(j.hematol oncol 2017,10:155)中描述了可用于治疗癌症的双特异性抗体,包括博纳吐单抗(blinatumomab)和卡妥索单抗(catumaxomab)。
[0135]
所述方法还提供了包含一种或多种基于细胞的疗法的癌症治疗剂,所述一种或多种基于细胞的疗法包括过继性细胞转移、肿瘤浸润性白细胞疗法、嵌合抗原受体t细胞疗法、nk细胞疗法以及干细胞疗法。
[0136]
预期癌症治疗剂包含一种或多种免疫疗法,包括溶瘤病毒、溶瘤细菌或其他细菌组合物、微生物组调控因子、卡介苗、tlr激动剂、微生物组调节剂、sting路径调节剂以及癌症疫苗。所述方法还提供了包含病毒或细菌载体的癌症治疗剂。在各个实施方案中,tlr激动剂为tlr3、tlr4、tlr5、tlr7、tlr8、tlr9、tlr10、tlr11、tlr12和/或tlr13激动剂。在各个实施方案中,tlr激动剂源自于病毒、细菌和/或为合成制备的。
[0137]
在各个实施方案中,癌症治疗剂包含酶。在各个实施方案中,癌症治疗剂包含靶向t细胞、b细胞、apc、单核细胞、mdsc、tam、嗜中性粒细胞、其他单核细胞源性细胞、肿瘤相关基质、癌症干细胞、间充质干细胞、细胞外基质以及氨基酸的酶。在各个实施方案中,癌症治疗剂包含选自包含以下的组的酶:天冬酰胺酶、犬尿氨酸酶、l
‑
精氨酸脱亚氨酶、l
‑
甲硫氨酸
‑
γ
‑
裂解酶、一种或多种氨基酸降解酶以及一种或多种核苷降解酶。
[0138]
预期可并行、同时或依序给予粒子和癌症治疗剂。两种治疗剂的并行施用不要求同时或通过相同途径施用所述剂,只要所述剂发挥其治疗作用的时间段存在重叠即可。同时或依序施用被考虑为在不同天或不同周施用。
[0139]
预期可在同一制剂中同时给予粒子和癌症治疗剂。还预期以单独制剂施用并且并行地施用所述剂,并行是指在彼此30分钟内给予各剂。
[0140]
在另一方面中,在施用粒子组合物之前施用癌症治疗剂。事先施用是指在用粒子治疗之前一周至施用粒子之前30分钟范围内施用癌症治疗剂。还预期在施用粒子组合物之后施用癌症治疗剂。随后施用意在描述粒子治疗后30分钟至施用后一周的施用。
[0141]
药盒
[0142]
作为另一方面,本公开包括包含以有助于用于实践本公开的方法的方式包装的一种或多种化合物或组合物的药盒。在一个实施方案中,此类药盒包括包装于容器(诸如密封瓶或容器)中的本文所描述的化合物或组合物(例如包含单独或与癌症治疗剂组合的粒子的组合物),以及固定至容器上或包括在包装中并且描述在实践所述方法时化合物或组合物的使用的标签。优选地,以单位剂型包装化合物或组合物。药盒可还包括适合于根据特定施用途径来施用粒子、癌症治疗剂或组合物或适合于实践筛选分析的装置。优选地,药盒含有描述抑制剂组合物的使用的标签。
[0143]
由以下实施例,本公开的其他方面和细节将为清楚的,以下实施例旨在为说明性而非限制性的。
[0144]
实施例
[0145]
实施例1
[0146]
使用imp疗法与免疫检查点抑制剂抗pd
‑
1单克隆抗体的组合来治疗性靶向肿瘤
[0147]
为了测定imp疗法与pd
‑
1单克隆抗体(mab)的组合的抗肿瘤功效,将如kumar等(cancer cell 32,654
‑
668,(2017]))所描述使用6
‑
8周龄c57bl/6小鼠建立原位或同源肿瘤模型。举例来说,将通过皮下注射为小鼠植入llc(路易斯肺癌(lewis lung carcinoma))、mc38或el4(9,10
‑
二甲基
‑
1,2
‑
苯并蒽诱发的鼠胸腺瘤)细胞,并且随机分至4个处理组中,这4个处理组各自如下文所描述:
[0148]
组1:对照处理(n=7)
[0149]
组2:仅imp(n=10)
[0150]
组3:仅抗pd1 mab(n=10)
[0151]
组4:imp+抗pd1 mab(n=7)
[0152]
在皮下注射肿瘤细胞之后24小时,将小鼠用imp(1mg,静脉内)和/或抗pd1 mab(100μg,腹膜内)处理。遵循以下处理时间表并且在图1中说明:
[0153]
第0天:皮下注射llc细胞或el4细胞。
[0154][0155]
静脉内和/或腹膜内给予接受对照处理的小鼠盐水,替代imp和抗pd1 mab。在第0天、第14天、第19天、第22天、第25天以及第29天,通过使用标准卡尺测量肿瘤面积对各处理组中的肿瘤生长进行评估。
[0156]
接受盐水处理的小鼠到治疗期结束时产生面积在500
‑
600mm2范围内的大肿瘤,使得安乐死是合理的。相反地,使用imp与抗pd1 mab两者的组合疗法预期使得肿瘤生长减少,以至完全消除。组合处理组中的肿瘤在超出40天时可生长至面积仅为5
‑
10mm2。
[0157]
单独用imp或抗pd1 mab处理的小鼠预期显示中等效应,并且与盐水处理的小鼠相比肿瘤生长显著延迟。假定在这些组中,预期到处理结束时可观察到面积在100
‑
150mm2范围内的肿瘤。这些处理组中的肿瘤可生长至面积为200
‑
250mm2,但预期不会达到在盐水处理的小鼠中所见的肿瘤尺寸。
[0158]
在初始实验中,在第0天经由皮下注射为小鼠接种llc肿瘤细胞。将llc肿瘤细胞维持在补充有10%fbs(atlanta biologicals)、5nm谷氨酰胺、25mm hepes以及1%抗生素(invitrogen)的dmem(corning10
‑
013
‑
cv)中的单层培养物中。制备0.5x 106个llc细胞的悬浮液并且注入7
‑
10周龄c57bl/6小鼠的右下侧腹部。在第1天,将小鼠随机化至处理组中并且根据以下时间表进行处理。在第0天、第14天、第19天、第22天、第25天以及第29天,通过使用标准卡尺测量肿瘤面积对各处理组中的肿瘤生长进行评估。imp
为plga粒子。
[0159][0160]
图2中示出了结果。正如所料,盐水处理的(对照)小鼠到第29天时产生大肿瘤。单独使用抗pd1或imp的单一疗法显示类似的抗肿瘤效应,与盐水处理相比具有中等肿瘤生长抑制。与盐水处理或使用imp或抗pd
‑
1mab的单一疗法相比,使用imp和抗pd1 mab的组合疗法产生协同效应以及增强的肿瘤生长抑制。
[0161]
实施例2
[0162]
单独或与抗pd1组合施用的imp的治疗作用
[0163]
为了确定imp组合处理对同源肿瘤模型的影响,经由皮下注射至侧腹中为6
‑
8周龄c57bl/6小鼠植入mc38(结肠腺癌)肿瘤细胞。在具有5%co2的组织培养孵育器中在37℃下,将mc38小鼠肿瘤细胞维持在补充有10%加热灭活胎牛血清(fbs)和2mm l
‑
谷氨酰胺的dmem中的单层培养物中。在形成可触知的肿瘤(尺寸为约100mm3)之后,将动物随机化至如下四个处理组中的一者中:
[0164]
组1:对照处理(n=10)
[0165]
组2:imp(n=10)
[0166]
组3:抗pd1(n=10)
[0167]
组4:imp+抗pd1(n=10)
[0168]
将1x106个95%活细胞的单一细胞悬浮液再悬浮于0.1ml中。制备不含血清的dmem并且注入动物的右下侧腹部。在肿瘤尺寸达到约100mm3的尺寸之后开始处理。根据以下处理时间表,经由静脉内(i.v)注射施用imp(plga粒子)(1mg),并且经由腹膜内(i.p)注射施用抗pd
‑
1(100μg):
[0169][0170]
通过使用卡尺测量二维肿瘤尺寸对肿瘤生长进行评估。使用式v=0.5x a x b2计
算肿瘤体积,其中a和b分别为肿瘤的长直径和短直径。以mm3表示肿瘤尺寸。
[0171]
如图3a中所示,与对照处理相比,用imp处理产生强肿瘤生长抑制。imp功效类似于抗pd1处理。用imp和抗pd1组合处理展现协同作用,并且与相应单一疗法相比产生增加的肿瘤生长抑制。体现对肿瘤生长的影响,用imp处理使得带有mc38肿瘤的小鼠的存活延长。imp存活功效优于抗pd1,并且使用imp和抗pd1的组合疗法展现协同效应,从而在与相应单一疗法相比时产生增强的存活(图3b)。
[0172]
本领域技术人员预期可想到如以上说明性实施例中所阐述的本公开中的许多修改和变化。因此,仅诸如出现在随附权利要求书中的限制将对本公开构成限制。
相关技术
网友询问留言
已有0条留言
- 还没有人留言评论。精彩留言会获得点赞!
1