用于治疗和/或预防生态失调的治疗性微生物群的制作方法
用于治疗和/或预防生态失调的治疗性微生物群
1.相关申请的交叉引用
2.本技术根据美国法典第35篇第119条(e)款要求2018年11月9日提交的美国临时申请号62/758,276的权益,所述临时申请的内容以引用的方式整体并入本文。
3.政府支持
4.本发明是在由美国国立卫生研究院授予的批准号p30
‑
dk
‑
034854、1r56ai117983和1r01ai126915下借助政府资助完成。政府拥有本发明的某些权利。
5.序列表
6.本技术含有已经以电子方式以ascii格式提交并且特此以引用的方式整体并入的序列表。2019年10月31日创建的所述ascii拷贝名为043214
‑
093940wopt_sl.txt且大小为33,281字节。
技术领域
7.本公开涉及生态失调和相关疾患的治疗和/或预防。
背景技术:
8.越来越多的证据表明,微生物菌群是对体内大量生理信号传导机制的关键环境影响。此外,微生物菌群可影响疾病的发展。
技术实现要素:
9.本文提供了用于治疗和/或预防生态失调和相关疾病或病症的方法和组合物,所述疾病和病症包括但不限于炎症性疾病或病症、代谢疾病或病症以及特应性疾病或病症。本文所述的方法和组合物部分基于以下发现:改变的肠微生物群(例如,由于抗生素治疗、剖宫产术分娩(c
‑
section births)、饮食等)可促进生态失调以及炎症性和特应性疾病,而一些微生物组合可预防和/或改善或治愈生态失调以及炎症性和/或特应性疾病。
10.在一个方面,本文描述了一种药物组合物,所述药物组合物包含可培养物种的微生物聚生体和药学上可接受的载体,其中所述聚生体包含在选自由以下组成的组的至少两种制剂中:(i)一种或多种活的、可培养的厌氧肠道细菌菌株的制剂,所述细菌菌株表达促进调控性t细胞(t
reg
)发育的胞外多糖、脂磷壁酸(lta)、脂多糖(lps)或其它微生物佐剂分子;(ii)一种或多种活的、可培养的厌氧肠道细菌菌株的制剂,所述细菌菌株通过肠腔中的碳水化合物和其它碳源的发酵产生丁酸盐和/或丙酸盐发酵产物;(iii)一种或多种活的、可培养的厌氧肠道细菌菌株的制剂,所述细菌菌株单独或组合进行完整的胆汁酸转化;(iv)活的、可培养的厌氧肠道细菌菌株的制剂,所述细菌菌株产生能够刺激肠上皮细胞、抗原呈递细胞和/或t细胞中的芳烃受体(ahr)受体途径以刺激调控性t细胞应答的发展的化合物;(v)一种或多种活的、可培养的厌氧肠道细菌菌株的制剂,所述细菌菌株产生能够刺激孕烷x受体(其对肠道屏障功能具有有益作用)和/或调控性t细胞应答的发展的化合物;(vi)一种或多种活的、可培养的厌氧肠道细菌菌株的制剂,所述细菌菌株产生能够刺激ror
γ(rar相关的孤儿受体γ)途径以经由直接刺激或肠道抗原呈递细胞和/或上皮细胞中rorγ激活途径(所述rorγ激活途径然后刺激调控性t细胞应答)来刺激调控性t细胞应答的发展的化合物;(vii)一种或多种活的、可培养的厌氧肠道细菌菌株,所述细菌菌株宿主产生刺激粘蛋白和复合糖缀合物,所述粘蛋白和复合糖缀合物改善肠道屏障功能以及保护性共生物种的定殖;(viii)一种或多种活的、可培养的厌氧肠道细菌菌株的制剂,所述细菌菌株改变肠腔环境以减少生态失调(dysbiotic)物种的有害活动,所述生态失调物种的有害活动促进对例如食物抗原的不健康的过敏性t细胞应答的发展;(ix)一种或多种活的、可培养的厌氧肠道细菌菌株的制剂,所述细菌菌株改变肠腔环境以促进为了任何上述效应而施用的聚生体的其它成员的定殖和/或患者基础微生物群中存在的有益物种的定殖的改善;(x)一种或多种活的、可培养的厌氧肠道细菌菌株的制剂,所述细菌菌株在体内促进上述(i)
‑
(ix)的制剂中的细菌菌株的定殖或生长。
11.在另一个方面,本文描述了一种药物组合物,所述药物组合物包含:
12.a.足以治疗或预防有需要的个体的生态失调的量的包含经分离细菌的微生物聚生体的制剂,所述微生物聚生体包含2至20种活肠道细菌物种,其中至少两者选自由以下组成的组:普通拟杆菌、狄氏副拟杆菌和产黑色普雷沃菌,以及
13.b.药学上可接受的载体。
14.在另一个方面,本文描述了一种药物组合物,所述药物组合物包含:
15.a.当施用于有需要的个体时足以治疗或预防生态失调的量的包含至少两种经分离活厌氧肠道细菌物种的制剂,所述至少两种经分离活厌氧肠道细菌物种选自由以下组成的组:普通拟杆菌、狄氏副拟杆菌和产黑色普雷沃菌,以及
16.b.药学上可接受的载体。
17.在另一个方面,本文描述了一种药物组合物,所述药物组合物包含:
18.a.当施用于有需要的个体时足以治疗或预防生态失调的量的包含至少三种经分离活厌氧肠道细菌物种的制剂,所述至少三种经分离活厌氧肠道细菌物种包括:普通拟杆菌、狄氏副拟杆菌和产黑色普雷沃菌,以及
19.b.药学上可接受的载体。
20.在另一个方面,本文描述了一种药物组合物,所述药物组合物包含:
21.a.当施用于有需要的个体时足以治疗或预防生态失调的量的包含至少四种经分离活厌氧肠道细菌物种的制剂,所述至少四种经分离活厌氧肠道细菌物种选自由以下组成的组:脆弱拟杆菌、卵形拟杆菌、普通拟杆菌、狄氏副拟杆菌和产黑色普雷沃菌,以及
22.b.药学上可接受的载体。
23.在另一个方面,本文描述了一种药物组合物,所述药物组合物包含:
24.a.当施用于有需要的个体时足以治疗或预防生态失调的量的包含经分离活厌氧肠道细菌的制剂,所述经分离活厌氧肠道细菌包括以下中的每一者:脆弱拟杆菌、卵形拟杆菌、普通拟杆菌、狄氏副拟杆菌和产黑色普雷沃菌,以及
25.b.药学上可接受的载体。
26.在另一个方面,本文描述了一种用于治疗或预防受试者的生态失调的方法,所述方法包括:向受试者施用本文所述的药物组合物,从而治疗或预防所述受试者的生态失调。
27.在另一个方面,本文描述了一种用于治疗或预防肠道炎症或代谢性疾病或病症的
方法,所述方法包括:向受试者施用本文所述的药物组合物,从而治疗或预防所述受试者的肠道炎症或代谢性疾病或病症。
28.在另一个方面,本文描述了一种用于治疗或预防特应性疾病或病症的方法,所述方法包括:向受试者施用本文所述的药物组合物,从而治疗或预防所述受试者的特应性疾病或病症。
29.在另一个方面,本文描述了一种用于预防受试者的过敏症的发作的方法,所述方法包括:向受试者施用本文所述的任一种药物组合物的组合物,从而预防所述受试者的过敏症的发作。
30.在另一个方面,本文描述了一种用于减少或消除受试者对过敏原的免疫反应的方法,所述方法包括:向受试者施用包含如本文所述的微生物聚生体的药物组合物,从而减少或消除受试者对过敏原的免疫反应。
31.在另一个方面,本文描述了一种监测受试者的微生物组的方法,所述方法包括:测定从受试者获得的生物样品中的存在和/或生物量,并且其中如果选自由脆弱拟杆菌、卵形拟杆菌、普通拟杆菌、狄氏副拟杆菌和产黑色普雷沃菌组成的组的至少两种或更多种物种不存在或相对于参考较低,则用包含如本文所述的微生物聚生体的药物组合物治疗所述受试者。
32.在另一个方面,本文描述了一种治疗有需要的个体的特应性疾病或病症的方法,所述方法包括向所述个体施用包含如本文所述的微生物聚生体的药物组合物。
33.在另一个方面,本文描述了一种降低有需要的个体的组织中的t
h
2细胞的数量或活性的方法,所述方法包括向所述个体施用包含如本文所述的微生物聚生体的药物组合物。
34.在另一个方面,本文描述了一种协同微生物组合物,所述协同微生物组合物包含:
35.a.第一微生物聚生体,所述第一微生物聚生体基本上由2至5种活肠道细菌物种组成,所述活肠道细菌物种选自由以下组成的组:脆弱拟杆菌、卵形拟杆菌、普通拟杆菌、狄氏副拟杆菌和产黑色普雷沃菌;以及
36.b.第二微生物聚生体,所述第二微生物聚生体基本上由1至6种活肠道细菌物种组成,所述活肠道细菌物种选自由以下组成的组:多枝梭菌、闪烁梭菌、clostridium rhiranonsis、双酶梭菌、柔嫩梭菌和萨尔迪纳梭菌,其中所述第二微生物聚生体的一个或多个成员在哺乳动物宿主增加所述第一微生物聚生体的一个或多个成员的定殖和/或持久性。
37.在另一个方面,本文描述了一种协同微生物组合物,所述协同微生物组合物包含:
38.a.第一微生物聚生体,所述第一微生物聚生体基本上由1至6种活肠道细菌物种组成,所述活肠道细菌物种选自由以下组成的组:多枝梭菌、闪烁梭菌、平野氏梭菌(平野氏梭菌)、双酶梭菌、柔嫩梭菌和萨尔迪纳梭菌(clostridium sardiniensis);以及
39.b.第二微生物聚生体,所述第二微生物聚生体基本上由2至5种活肠道细菌物种组成,其中所述活肠道细菌物种选自由以下组成的组:脆弱拟杆菌、卵形拟杆菌、普通拟杆菌、狄氏副拟杆菌和产黑色普雷沃菌,
40.其中所述第二微生物聚生体的一个或多个成员在哺乳动物宿主中增加所述第一微生物聚生体的一个或多个成员的定殖和/或持久性。
41.在包括方法和组合物的任何方面的一个实施方案中,所述药物组合物或所述微生物聚生体还包含脆弱拟杆菌和卵形拟杆菌中的至少一者。在其它实施方案中,所述药物组合物或所述微生物聚生体还包含脆弱拟杆菌和卵形拟杆菌。在其它实施方案中,所述药物组合物或所述微生物聚生体还包含脆弱拟杆菌、卵形拟杆菌、普通拟杆菌、狄氏副拟杆菌和产黑色普雷沃菌中的每一者。在其它实施方案中,所述药物组合物或所述微生物聚生体还包含表4中的一种或多种细菌。
42.在包括方法和组合物的任何方面的另一个实施方案中,所述药物组合物或所述微生物聚生体包含选自由以下组成的组的至少三种或至少四种物种:脆弱拟杆菌、卵形拟杆菌、普通拟杆菌、狄氏副拟杆菌和产黑色普雷沃菌。在其它实施方案中,所述微生物聚生体包含以下物种中的每一者:脆弱拟杆菌、卵形拟杆菌、普通拟杆菌、狄氏副拟杆菌和产黑色普雷沃菌。
43.在包括方法和组合物的任何方面的另一个实施方案中,所述药物组合物或所述微生物聚生体还包含选自由以下组成的组的物种中的至少一种、至少两种、至少三种、至少四种或至少五种:多枝梭菌、闪烁梭菌、平野氏梭菌、双酶梭菌、柔嫩梭菌和萨尔迪纳梭菌。在其它实施方案中,所述药物组合物或所述微生物聚生体还包含以下物种中的每一者:多枝梭菌、闪烁梭菌、平野氏梭菌、双酶梭菌、柔嫩梭菌和萨尔迪纳梭菌。
44.在包括方法和组合物的任何方面的另一个实施方案中,所述药物组合物或所述微生物聚生体包含:脆弱拟杆菌、卵形拟杆菌、普通拟杆菌、狄氏副拟杆菌、产黑色普雷沃菌、多枝梭菌、闪烁梭菌、clostridium rhiranonsis、双酶梭菌、柔嫩梭菌和萨尔迪纳梭菌。
45.在包括方法和组合物的任何方面的另一个实施方案中,所述药物组合物或所述微生物聚生体基本上由以下组成:普通拟杆菌、狄氏副拟杆菌和产黑色普雷沃菌。在其它实施方案中,所述药物组合物或所述微生物聚生体基本上由脆弱拟杆菌、卵形拟杆菌、普通拟杆菌、狄氏副拟杆菌和产黑色普雷沃菌组成。在其它实施方案中,所述药物组合物或微生物聚生体基本上由以下组成:多枝梭菌、闪烁梭菌、平野氏梭菌、双酶梭菌、柔嫩梭菌、萨尔迪纳梭菌、脆弱拟杆菌、卵形拟杆菌、普通拟杆菌、狄氏副拟杆菌和产黑色普雷沃菌。在其它实施方案中,所述药物组合物或微生物聚生体基本上由以下组成:多枝梭菌、闪烁梭菌、平野氏梭菌、双酶梭菌、柔嫩梭菌、萨尔迪纳梭菌、普通拟杆菌、狄氏副拟杆菌和产黑色普雷沃菌。
46.在包括方法和组合物的任何方面的另一个实施方案中,所述药物组合物或微生物聚生体包含至少两种、至少三种、至少四种或至少五种细菌物种,所述细菌物种各自包含与参考菌株操作分类单位中存在的16s rdna序列至少97%同一的16s rdna序列,所述参考菌株选自以下物种:脆弱拟杆菌、卵形拟杆菌、普通拟杆菌、狄氏副拟杆菌和产黑色普雷沃菌。
47.在包括方法和组合物的任何方面的另一个实施方案中,所述药物组合物或微生物聚生体不包含以下物种中的任一者:大肠杆菌、肺炎克雷伯氏菌、奇异变形杆菌、阴沟肠杆菌、沃氏嗜胆菌、昂氏另枝菌(alistipes onderdonkii)、脱硫弧菌属物种、约氏乳杆菌或parasutterella excrementihominis。在包括方法和组合物的任何方面的另一个实施方案中,所述药物组合物或微生物聚生体不包含以下属的细菌:嗜胆菌属、肠杆菌属、埃希氏菌属、克雷伯氏菌属、变形杆菌属、另枝菌属、布劳特菌属、脱硫弧菌属和副萨特氏菌属。在其它实施方案中,所述药物组合物或微生物聚生体不包含以下科的细菌:脱硫弧菌科、肠杆菌科、理研菌科和萨特氏菌科、乳杆菌科或肠杆菌科。在其它实施方案中,所述药物组合物或
微生物聚生体不包含以下目的细菌:burkholdales、脱硫弧菌目或肠杆菌目。
48.在包括方法和组合物的任何方面的另一个实施方案中,所述药物组合物或微生物聚生体包含至少三种或至少四种非病原性活肠道细菌物种。在其它实施方案中,所述微生物聚生体包含至少两种且至多十一种非病原性活肠道细菌物种。
49.在包括方法和组合物的任何方面的另一个实施方案中,所述活肠道细菌是厌氧肠道细菌。在另一个实施方案中,所述活肠道细菌是人肠道细菌。在其它实施方案中,所述活肠道细菌物种从已知对选定过敏原(例如,食物过敏原)耐受的受试者分离和/或纯化。在其它实施方案中,通过在厌氧条件下培养来制备所述活肠道细菌物种。在其它实施方案中,配制所述活肠道细菌物种以维持厌氧条件。在其它实施方案中,通过以下中的一种或多种来维持厌氧条件:(i)不透氧的胶囊,(ii)向所述组合物中添加还原剂,包括n
‑
乙酰半胱氨酸、半胱氨酸或亚甲基蓝,或(iii)对形成孢子的生物体而言使用孢子。
50.在包括方法和组合物的任何方面的另一个实施方案中,所述活肠道细菌物种以基本相等的生物量存在。在其它实施方案中,所施用组合物中每种微生物的生物量大于关于参考的每种微生物的生物量。在其它实施方案中,所述药物组合物被配制来递送至少1x107个菌落形成单位(cfu)的剂量。在其它实施方案中,所述药物组合物被配制来递送至少1x108个cfu的剂量。在其它实施方案中,所述药物组合物被配制来递送至少1x109个cfu的剂量。在其它实施方案中,所述药物组合物被配制来递送至少1x10
10
个cfu的剂量。在其它实施方案中,所述药物组合物被配制来递送至少1x10
11
个cfu的剂量。在其它实施方案中,所述药物组合物被配制来递送至少1x10
12
个cfu的剂量。在其它实施方案中,所述药物组合物被配制来每单次剂量递送处于少于30个胶囊中的至少1x109个cfu。
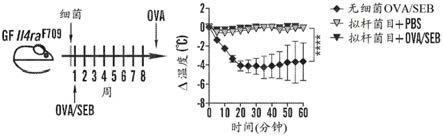
51.在包括方法和组合物的任何方面的另一个实施方案中,所述药物组合物被配制来将所述活细菌递送至小肠。在其它实施方案中,所述药物组合物是肠溶包衣的。在其它实施方案中,所述肠溶包衣包含聚合物、纳米颗粒、脂肪酸、虫胶或植物纤维。在其它实施方案中,所述药学上可接受的载体包括包封所述微生物聚生体的肠溶包衣组合物。在其它实施方案中,所述药学上可接受的载体包括胶囊、凝胶、软锭剂、片剂或丸剂。在其它实施方案中,所述药物组合物还包含益生元组合物。在其它实施方案中,所述药物组合物和/或微生物聚生体被冷冻以用于储存。在其它实施方案中,所述微生物聚生体被包封、冻干、配制在食物中,或者被配制为液体、凝胶、流体凝胶或液体中的纳米颗粒。
52.在包括方法和组合物的任何方面的另一个实施方案中,本文所述的生态失调与炎症性疾病或代谢性疾病或病症相关。在任何方面的其它实施方案中,所述生态失调与特应性疾病或病症相关。
53.在包括方法和组合物的任何方面的另一个实施方案中,所述炎症性疾病选自由以下组成的组:胃肠道感染、呼吸道感染、肾脏感染、胰腺炎、牙龈炎、牙周炎、炎症性肠病(ibd)、克罗恩氏病(cd)、溃疡性结肠炎(uc)、胃炎、肠炎、食管炎、胃食管返流疾病(gerd)、乳糜泻、憩室炎、食物耐受不良、溃疡、感染性结肠炎、肠易激综合征以及癌症。在其它实施方案中,所述特应性疾病或病症选自由以下组成的组:食物过敏、哮喘、湿疹和鼻结膜炎。在其它实施方案中,本文所述的过敏是食物过敏。在其它实施方案中,所述食物过敏包括对大豆、小麦、蛋、乳制品、花生、木本坚果、贝类、鱼类、蘑菇、核果和/或其它水果的过敏。
54.在包括方法和组合物的任何方面的另一个实施方案中,所述受试者用抗生素加以
预处理。在其它实施方案中,所述受试者以不长于24小时的禁食期加以预处理。在其它实施方案中,所述受试者用益生菌加以预处理。在其它实施方案中,所述受试者是人受试者。在任何方面的其它实施方案中,所述受试者是婴儿(例如,所述受试者是2岁以下);儿童(例如,所述受试者是2岁至5岁以下);青春期少年(例如,5岁至12岁以下);十几岁的青少年(例如,12岁至18岁以下);成人(例如,18岁至65岁以下);或高龄成人(例如,所述受试者是65岁以上)。在其它实施方案中,所述受试者是2岁以下。在其它实施方案中,所述受试者是2岁至5岁以下。在其它实施方案中,所述受试者是5岁至8岁以下。在其它实施方案中,所述受试者是5岁至12岁以下。在其它实施方案中,所述受试者是12岁至18岁以下。在其它实施方案中,所述受试者是18岁至65岁以下。在其它实施方案中,所述受试者是65岁以上。
55.在包括方法和组合物的任何方面的另一个实施方案中,所述药物组合物或所述施用还包含益生元组合物。在其它实施方案中,所述药物组合物通过口服施用、灌肠剂、栓剂或口胃管进行施用。在其它实施方案中,在首次暴露于潜在食物过敏原之前施用所述药物组合物。在其它实施方案中,在特应性症状的临床迹象出现后施用所述药物组合物。在其它实施方案中,将所述药物组合物施用于被诊断患有食物过敏的个体。在一些实施方案中,所述过敏是食物过敏。
56.在包括方法和组合物的任何方面的另一个实施方案中,所施用的药物组合物或治疗预防和/或逆转t
reg
和其它粘膜t细胞群体的t
h
2编程。在其它实施方案中,所述施用使t
h
1/t
h
2细胞的平衡转向t
h
1t细胞。在其它实施方案中,所述药物组合物或所述施用降低t
h
2 t细胞的数量或活性。
57.在包括方法和组合物的任何方面的另一个实施方案中,有需要的个体或本文所述的方法还包括将所述受试者或个体诊断为患有或可能发展炎症性疾病或特应性疾病或病症的步骤。在其它实施方案中,所述个体或本文所述的方法还包括将所述受试者或个体诊断为患有或可能发展过敏(例如,食物过敏)的步骤。
58.在任何方面的另一个实施方案中,本文所述的方法还包括针对所述微生物聚生体中的一种或多种细菌的存在和/或水平,对来自所述受试者的生物样品(例如,粪便样品)进行测试的步骤。在其它实施方案中,本文所述的方法还包括当所述至少两个成员不存在时、所述至少两个成员的生物量相对于参考较低时、或生态失调物种的至少一个成员存在或相对于参考升高时,预测受试者将对过敏原具有免疫应答。在其它实施方案中,本文所述的方法重复至少另外一次。在其它实施方案中,本文所述的生物样品是粪便样品。在其它实施方案中,所述生物样品是组织。在其它实施方案中,所述组织是肠道组织。
59.在任何方面的另一个实施方案中,本文所述的方法还包括将所述受试者或个体诊断为患有ige介导的过敏的步骤。在其它实施方案中,所述ig
‑
e介导的过敏是食物过敏。在其它实施方案中,所述食物过敏包括对大豆、小麦、蛋、乳制品、花生、木本坚果、贝类、鱼类、蘑菇、核果或其它水果的过敏。
附图说明
60.图1示出由于对食物抗原的口服耐受的失败所致的特应性疾病(如食物过敏)中的耐受失败的示意性图示。食物过敏的病理生理机制与t
h
2免疫和过敏原特异性ige应答相关。t调控性细胞(t
reg
)通常遏制2型先天淋巴样细胞(ilc2)、t
h
2细胞激活、肥大细胞激活和
树突状细胞(dc)激活。
61.图2示出特应性疾病实验模型:il4raf709突变型小鼠的示意性图示,所述小鼠易于发展食物过敏。i型il
‑
4受体itim中的突变(y709至f709)导致il
‑
4受体的功能获得。
62.图3示出示例性卵白蛋白致敏方案的示意性图示。将il4raf709突变型小鼠和wt小鼠分别用鸡蛋卵白蛋白(ova)和粘膜佐剂葡萄球菌肠毒素b(seb)激发,然后用ova随后激发。监测突变型小鼠和wt小鼠的核心体温、总血清ige、ova特异性血清ige、粘膜肥大细胞蛋白酶
‑
1(mmcp
‑
1)水平和肥大细胞计数的变化。
63.图4a
‑
4c示出il4raf709小鼠中卵白蛋白(ova)诱导的食物过敏反应。图4a示出随时间(分钟)推移响应于盐水或ova
‑
seb的wt和il4raf709小鼠的核心体温变化。用ova
‑
seb处理的il4raf709小鼠表现出核心体温的统计学上显著的下降,表明过敏反应。用ova
‑
seb处理的wt小鼠以及用盐水(pbs)处理的wt小鼠和il4raf709小鼠没有核心体温的显著变化。图4b示出用盐水或ova
‑
seb处理的wt和il4raf709小鼠中的总血清ige(i)、肥大细胞的数量(nbr)/lpf水平(ii)、ova特异性ige水平(iii)和mmcp
‑
1水平(iv)。图4c示出从wt和il4raf709小鼠分离的免疫细胞的流式细胞术。与用ova
‑
seb处理的wt小鼠相比,用ova
‑
seb处理的il4raf709小鼠表现出cd4+il
‑
4+ t细胞的百分比(%)和cd4+il
‑
4+ t细胞的数量(nbr)增加。
64.图5a
‑
5c示出过敏性il4raf709小鼠中的过敏原特异性t
reg
细胞缺乏。图5a示出cd4+foxp3+ t
reg
细胞的代表性流式细胞术图。图5b证明,与用ova
‑
seb处理的wt小鼠相比,在用ova
‑
seb处理的il4raf709小鼠中小肠(si)、肠系膜淋巴结(mln)和脾脏中cd4+fox3p+ t
reg
细胞的数量显著减少。在小肠中,与用盐水处理的wt小鼠相比,il4raf709小鼠表现出cd4+fox3p+ t
reg
细胞的数量减少。图5c示出在wt和il4raf709小鼠中在ova
‑
seb或盐水处理后cd4+foxp3+ t
reg
细胞增殖的分析。与用ova
‑
seb处理的wt小鼠相比,在用ova
‑
seb处理的il4raf709小鼠中cd4+foxp3+ t
reg
细胞增殖减少。
65.图6证明f709突变型小鼠中的口服过敏性致敏与生态失调相关。il4raf709小鼠表现出小肠中若干细菌门的减少。
66.图7提供用于测试致敏il4raf709小鼠的微生物群是否传递对食物过敏的易感性的示例性方案的示意性图示。将来自wt或il4raf704小鼠的微生物群转移至wt无菌(gf)小鼠,然后在转移后8周进行ova激发。
67.图8示出,il4raf709小鼠的微生物群在无菌(gf)小鼠中促进过敏性致敏和过敏反应。左图示出与接受wt微生物菌群的wt小鼠相比,在ova激发和施用的il4raf709菌群后wt无菌小鼠的核心体温表现出核心体温下降。此结果类似于在用ova激发的il4raf709小鼠中观察到的结果。右图证明,与接受wt菌群的gf wt小鼠相比,施用il4raf709菌群的gf wt小鼠在用ova再次激发后表现出mmcp
‑
1水平的显著增加。
68.图9示出il4raf709小鼠的微生物群促进过敏性致敏和过敏反应。左图示出接受wt或il4raf709菌群的wt gf小鼠中cd3+cd4+t细胞的分析。条形图(右)示出,与施用wt微生物菌群的wt gf小鼠相比,施用il4raf709菌群的gf wt小鼠表现出il4+细胞百分比的显著增加。
69.图10示出确定食物耐受的小鼠的微生物群是否传递针对食物过敏的保护的示例性方案的示意性图示。
70.图11a
‑
11d证明食物耐受的小鼠的微生物群在遗传易感宿主中防止过敏性致敏和过敏反应。图11a示出在施用wt或il4raf709微生物菌群的il4raf709小鼠中,在ova激发后核心体温随时间推移的变化。施用wt微生物菌群的il4raf709小鼠表现出保护免受过敏反应。图11b示出施用wt或il4raf709微生物菌群的il4raf709小鼠的总ige水平(左)和ova特异性ige水平(右)。图11c示出在ova激发后从施用wt或il4raf709微生物菌群的il4raf709小鼠分离的il
‑
4+和ifnγt细胞的流式细胞术分析。图11d示出从施用wt或il4raf709微生物菌群的il4raf709小鼠分离的ova特异性cd4+il
‑
4+ t细胞和cd4+ifnγ+ t细胞的百分比。与施用il4raf709微生物菌群的il4raf709小鼠相比,施用wt微生物菌群的il4raf709小鼠表现出总ige、ova
‑
ige和cd4+il
‑
4+ t细胞的显著减少。
71.图12a
‑
12d示出食物耐受的小鼠的微生物群促进过敏原特异性t
reg
细胞的形成。图12a示出从施用wt或il4raf709微生物菌群的il4raf709小鼠分离的cd4+fox3p+ t
reg
细胞的流式细胞术分析。图12b示出与施用il4raf709微生物菌群的il4raf709小鼠相比,施用wt微生物菌群的il4raf709小鼠表现出cd4+fox3p+ t
reg
细胞的百分比和数量(nbr)的显著增加。图12c
‑
12d示出使用紫色增殖染料,活跃增殖的fox3p+ t
reg
的流式细胞术分析。图12d证实,与施用il4raf709微生物菌群的il4raf709小鼠相比,施用wt微生物菌群的il4raf709小鼠表现出增殖cd4+fox3p+ t
reg
的百分比增加。
72.图13示出wt(上)和il4raf709小鼠(下)在8周时卵白蛋白(ova)处理后,门的相对丰度的图形可视化。
73.图14示出所选择的otu的表,展示wt小鼠和用ova激发的f709小鼠之间的差异。所述表示出十二指肠、空肠和回肠中的otu。
74.图15示出用于确定用限定的细菌混合物处理是否将防止食物过敏的示例性方案。在所述方案开始之前,向il4raf709突变型小鼠给予抗生素持续7天。
75.图16a
‑
16d示出,梭菌纲和拟杆菌门防止过敏原特异性应答和过敏反应的发展。图16a示出与未接受细菌处理的il4raf709小鼠相比,用梭菌纲、变形菌门或拟杆菌门处理的il4raf709小鼠在ova激发后核心体温的变化。用拟杆菌门和梭菌纲处理的突变型小鼠在ova激发后被保护免于核心体温下降。图16b示出与无细菌处理相比,施用梭菌纲、变形菌门或拟杆菌门的il4raf709小鼠中的肥大细胞数量和mmcp
‑
1水平。与未用细菌处理的突变型小鼠或施用变形菌门的那些小鼠相比,用拟杆菌门和梭菌纲处理的突变型小鼠在ova激发后表现出肥大细胞数量和mmcp
‑
1水平的降低。图16c示出与无细菌处理相比,用梭菌纲、变形菌门或拟杆菌门处理的ova激发的il4raf709小鼠中的空肠肥大细胞。图16d示出与无细菌处理相比,用梭菌纲、变形菌门或拟杆菌门处理的ova激发的il4raf709小鼠的总ige和ova特异性ige水平。
76.图17a
‑
17d示出口服过敏性致敏与t
reg
细胞t
h
2重编程相关。图17a示出针对il
‑
4和foxp3标志物,对来自ova致敏的wt和il4raf709小鼠的mln cd3+cd4+t细胞的流式细胞术分析。图17b示出在用ova
‑
seb致敏或用pbs处理的wt和il4raf709小鼠中il
‑
4+cd4+foxp3+ t细胞的百分比(上)。图17c示出用ova
‑
seb致敏的wt和il4raf709小鼠或用pbs处理的对照中gata3+ t细胞的流式细胞术分析。右侧示出gata3+cd4+foxp3+细胞的数量和百分比。图17d示出用ova
‑
seb致敏的wt和il4raf709小鼠或用pbs处理的对照中irf
‑
4+ t细胞的流式细胞术分析。右侧示出irf
‑
4+cd4+foxp3+细胞的数量和百分比。
77.图18a
‑
18f示出t
reg
细胞中il4/il13的耗减防止食物过敏。图18a示出il4raf709小鼠对比il4raf709 il4
‑
/
‑
,il
‑
13
‑
/
‑
小鼠中的cd4+foxp3
‑
对比cd4+foxp3+细胞中il
‑
4的倍数变化。图18b对于il4raf709小鼠il4raf709 il4
‑
/
‑
,il
‑
13
‑
/
‑
小鼠,在ova激发后随时间推移身体核心温度的变化。图18c示出il4raf709小鼠和il4raf709il4
‑
/
‑
,il
‑
13
‑
/
‑
小鼠中的总ige、ova特异性ige、mmcp
‑
1水平和肥大细胞数量。图18d
‑
图18e示出il4raf709小鼠对比il4raf709 il4
‑
/
‑
,il
‑
13
‑
/
‑
小鼠中cd4+fox3pd+细胞(18d)的数量(下)和百分比(上),irf
‑
4(18e,下)和gata3+(18e,上)cd4+foxp3+细胞的百分比。图18f示出il4raf709小鼠对比il4raf709 il4
‑
/
‑
,il
‑
13
‑
/
‑
小鼠中il
‑
4+cd4+foxp3
‑
细胞的数量(下)和百分比(上)。
78.图19示出t
h
2偏斜的t
reg
表型减少表明梭菌纲和拟杆菌门具有不同的分子作用机制。左:在未用细菌处理的ova激发的il4raf709小鼠和用梭菌纲、变形菌门或拟杆菌门处理的小鼠中,cd3+cd4+foxp3+ t
reg
细胞的数量和百分比。中心:在未用细菌处理的il4raf709小鼠和用梭菌纲、变形菌门或拟杆菌门处理小鼠中,cd3+cd4+foxp3+gata3+细胞的fac图和图形表示。梭菌纲和拟杆菌门均具有保护作用,但在t
reg
中的相对il
‑
4和gata3表达方面显示出显著差异。
79.图20a
‑
20d证明短链脂肪酸(scfa)疗法不能挽救il4raf709小鼠中的食物过敏。图20a示出在施用盐水或ova
‑
seb的wt和il4raf709小鼠中测量的scfa、异戊酸盐、戊酸盐、乙酸盐、丙酸盐和丁酸盐(mm)浓度。图20b示出在有和无scfa处理的情况下用pbs或ova
‑
seb处理的wt和il4raf709小鼠的核心体温的变化。图20c示出用ova
‑
seb、pbs
‑
scfa和ova
‑
seb+scfa处理的wt和il4raf709小鼠中的总ige和ova特异性ige。图20d示出从用ova
‑
eb、pbs
‑
scfa和ova
‑
seb
‑
scfa处理的wt和il4raf709小鼠的小肠分离的cd4+foxp3+细胞的流式细胞术分析。
80.图21a
‑
21i证明在特异性相关的无菌小鼠和在治疗上处理的常规il4raf709小鼠中,人拟杆菌目物种的限定聚生体防止食物过敏。图21a示出在具有拟杆菌目微生物聚生体无菌小鼠对比限菌(gnotobiotic)对照中的特异性关联研究的示意性图示。图21a还示出gf il4raf709小鼠中的核心体温变化,所述小鼠未定殖或用拟杆菌目聚生体重构,然后被假(pbs)或ova/seb致敏并用ova激发。图21b示出ova激发后的总体和ova特异性血清ige浓度。图21c示出ova激发后的血清mmcp
‑
1浓度。图21d示出mln cd4+foxp3+、il
‑
4+foxp3+和gata3+foxp3+ t细胞的频率。图21e示出helios
–
nrp1
–
foxp3+ t细胞的频率。对于图21a
‑
21e:n=5至10只小鼠/组。图21f示出spf小鼠研究的示意性图示;abx:抗生素。图21f还示出未用拟杆菌目聚生体处理或用拟杆菌目聚生体处理的ova/seb致敏的且ova激发的il4raf709小鼠中的核心体温变化。图21g示出ova激发后总体和ova特异性ige应答以及血清mmcp
‑
1浓度。图21h示出cd4+foxp3+、il
‑
4+foxp3+gata3+foxp3+的频率,并且图21i示出mln中的helios
–
nrp1
–
foxp3+ t细胞。对于f
‑
i:n=5
‑
8只小鼠/组。通过单向anova与dunnet事后分析,*p<0.05,**p<0.01,***p<0.001,****p<0.0001。对于核心体温测量值,通过重复测量值双向anova,****p<0.0001。
81.图22a
‑
22d证明用梭菌目或拟杆菌目治疗性聚生体进行的处理遏制常规il4raf709小鼠中已建立的食物过敏。图22a示出实验方案(左)和用相应细菌混合物处理的ova/seb致敏的且ova激发的il4raf709小鼠中的核心体温变化(右)。图22b示出总体和ova特异性ige。图22c示出ova激发后的空肠肥大细胞(箭头)、每低倍视野的肥大细胞计数以及
血清mmcp
‑
1浓度。图22d示出mln中cd4+foxp3+、il
‑
4+cd4+foxp3+、il
‑
4+cd4+foxp3
–
和gata3+foxp3+ t细胞的频率。n=5
‑
15只小鼠/组。通过单向anova与dunnet事后分析,**p<0.01,***p<0.001,****p<0.0001。对于核心体温测量值,通过重复测量值双向anova,***p<0.001。
82.图23a
‑
23f证明拟杆菌目聚生体在体内的持久性。图23a示出提取的粪便dna的结果,用对每种生物体具有特异性的探针对所述粪便dna进行qpcr。在施用所述聚生体之前,在来自小鼠的基线粪便中未发现交叉反应性(图a,右栏)。将ct值与掺入到常规粪便中的每种生物体的限定生物量的标准曲线进行比较,以获得归一化的log
10 cfu/g。图23b
‑
23f示出对于在所述剂量中施用的每种生物体,粪便样品的归一化的log
10 cfu/g值。n=6只小鼠组;灰色虚线表示检测或每个qpcr探针的灵敏度。对于落入检测灵敏度以下的小鼠,数据点位于log
10
=1。
83.图24示出细菌物种和菌株名称的表;微生物聚生体的生长条件;以及相应的16s rrna序列(seq id no:1
‑
15)。
具体实施方式
84.本文提供了用于在受试者中恢复标准微生物菌群的药物组合物、方法、微生物聚生体和微生物。本文所述的微生物或其混合物提供生态失调和相关疾患、炎症性疾病、代谢疾病或病症、特应性疾病或病症和/或过敏的治疗和预防。在一些情况下,本文所述的微生物或其混合物(例如,微生物聚生体)提供受试者的过敏症(例如食物过敏)的预防或治疗。
85.定义
86.如本文所用,“预防(preventing)”或“预防(prevention)”是指其中疾病状态由于方法的作用而没有发生的任何方法(例如,施用包含如本文所述的微生物聚生体的组合物)。在一个方面,应理解的是,预防还可意味着疾病没有建立至未治疗的对照中发生的程度。例如,相对于未治疗的对照,疾病频率的建立可降低5%、10%、15%、20%、25%、30%、35%、40%、50%、60%、70%、80%、90%或100%。因此,疾病的预防涵盖相对于未治疗的受试者(例如未用包含如本文所述的微生物聚生体的组合物治疗的受试者),受试者将发展所述疾病的可能性降低。
87.如本文所用,术语“完整的胆汁酸转化”是指初级胆汁酸代谢成次级胆汁酸。由肠道微生物进行的胆汁酸转化包括去缀合、去葡糖醛酸化、羟基的氧化、氧代基的还原以产生差向异构的羟基胆汁酸、酯化和脱羟基。关于胆汁酸的这些反应是完整的胆汁酸转化,如所述术语在本文所用。
88.术语“减少(decrease)”、“减轻(reduced)”、“减轻(reduction)”或“抑制”在本文中全部用于意指性质、水平或其它参数减少或降低统计上显著的量。在一些实施方案中,“减轻(reduce)”、“减轻(reduction)”或“减少(decrease)”或“抑制”通常意指与参考水平(例如,不存在给定治疗的情况下)相比减少至少10%并且可包括例如减少至少约10%、至少约20%、至少约25%、至少约30%、至少约35%、至少约40%、至少约45%、至少约50%、至少约55%、至少约60%、至少约65%、至少约70%、至少约75%、至少约80%、至少约85%、至少约90%、至少约95%、至少约98%、至少约99%或更多。如本文所用,“减轻”或“抑制”不涵盖与参考水平相比的完全抑制或减轻。“完全抑制”是与参考水平相比100%抑制。减少可优
选地降至被认为对于不患有给定病症的个体而言在正常范围内的水平。
89.术语“增加(increased)”、“增加(increase)”或“增强”或“激活”在本文中全部用于一般意指性质、水平或其它参数增加统计上显著的量;为避免任何疑问,术语“增加”、“增加”或“增强”或“激活”是指与参考水平相比增加至少10%,例如与参考水平相比增加至少约20%、或至少约30%、或至少约40%、或至少约50%、或至少约60%、或至少约70%、或至少约80%、或至少约90%或多达并包括100%增加、或介于10%
‑
100%之间的任何增加,或与参考水平相比至少约2倍、或至少约3倍、或至少约4倍、或至少约5倍或至少约10倍增加、至少约20倍增加、至少约50倍增加、至少约100倍增加、至少约1000倍增加或更多。
90.术语“药学上可接受的”可指化合物和组合物可施用于受试者(例如,哺乳动物或人)而没有过度毒性。
91.如本文所用,术语“药学上可接受的载体”可包括当与活性成分组合时允许所述成分保留生物活性并且与受试者的免疫系统不反应的任何材料或物质。实例包括但不限于任何标准药物载体,如磷酸盐缓冲盐水溶液、乳液如油/水乳液和各种类型的湿润剂。术语“药学上可接受的载体”不包括组织培养基。
92.如本文所用,术语“包含(comprising)”意指除了所呈现的限定要素之外还可存在其它要素。“包含”的使用表示包括而不是限制。
93.如本文所用,术语“基本上由
……
组成”是指给定实施方案所需的那些要素。所述术语允许存在不会实质上影响本发明的所述实施方案的一种或多种基本特征和新颖特征或功能特征的另外要素。
94.术语“由
……
组成”是指如本文所述的组合物、方法及其相应组分不包括实施方案的描述中未叙述的任何要素。
95.另外,除非上下文另有要求,否则单数术语应包括复数并且复数术语应包括单数。
96.应了解本发明不限于本文所述的特定方法、方案和试剂等,并且因此可由此变化。本文所用的术语仅出于描述特定实施方案的目的,并且不意图限制本发明的范畴,所述范围仅由权利要求限定。
97.微生物菌群
98.每个个体具有个人化的肠道菌群,包括位于消化道中的估计500至5000种或更多种细菌、真菌、病毒、古细菌和其它微生物物种,高达100万亿个个体生物体,从而提供许多有用的共生功能,例如包括帮助消化、为结肠提供营养、产生维生素、调控免疫系统、协助防御外源细菌、调节能量代谢以及产生短链脂肪酸(scfa)(例如通过膳食碳水化合物(包括抗性淀粉和膳食纤维),所述碳水化合物是用于发酵以产生scfa的底物,终产物主要是乙酸盐、丙酸盐、琥珀酸盐、丁酸盐、1,2丙二醇或1,3丙二醇)。
99.已知在人体中和人体上发现的微生物菌群的失衡与各种疾病状态相关。例如,人和实验小鼠模型二者中的肥胖均与肠道微生物群的改变(所述改变似乎是病原性的)相关。在
‘
生态失调’或破坏的共生的环境中,可能丧失或错乱的微生物群功能(导致对病原体的易感性增加)包括改变的代谢谱或诱导能够导致局部或全身性炎症或自身免疫的促炎信号。此外,在哮喘受试者中,细菌负荷和细菌多样性与对照受试者相比均显著较高,这也与支气管高反应性有关。因此,肠道微生物群在许多疾病和病症(包括肠道的各种病原性感染)的发病机制中起重要作用。例如,当由于使用广谱抗生素而使正常的肠微生物群受到干
扰时,患者变得更易受病原性感染的影响。许多这些疾病和病症是显著降低患者的生活质量并且最终可能致命的慢性疾患。
100.微生物聚生体
101.在一个实施方案中,可用于本文所述的组合物和方法中的分离细菌的微生物聚生体包含2至20、2至19、2至18、2至17、2至16、2至15、2至14、2至13、2至12、2至11、2至10、2至9、2至8、2至7、2至6、2至5、2至4或2至3种活肠道细菌物种。在另一个实施方案中,分离细菌的微生物聚生体包含至多40种物种、至多35种物种、至多30种物种或至多25种物种。在另一个实施方案中,所述微生物聚生体包含2至21种物种、2至22种物种、2至23种物种、2至24种物种、2至25种物种、2至26种物种、2至27种物种、2至28种物种、2至29种物种、2至30种物种、2至31种物种、2至32种物种、2至33种物种、2至34种物种、2至35种物种、2至36种物种、2至37种物种、2至38种物种、2至39种物种或2至40种物种。
102.在一些实施方案中,微生物聚生体包含至少2、至少3、至少4、至少5、至少6、至少7、至少8、至少9、至少10、至少11、至少12种或更多种不同的活细菌物种,例如15种或更多种、20种或更多种、25种或更多种、30种或更多种或甚至40种物种。在另一个实施方案中,所述微生物聚生体包含12种或更少、11种或更少、10种或更少、9种或更少、8种或更少、7种或更少、6种或更少、5种或更少、4种或更少或3种或更少的不同的活细菌物种。还考虑了2至40种物种、4至30种物种、4至25种物种、4至20种物种、4至15种物种、4至11种物种、5至40种物种、5至30种物种、5至25种物种、5至20种物种、5至15种物种、5至11种物种、6至40种物种、6至30种物种、6至25种物种、6至20种物种、6至15种物种、6至11种物种、7至40种物种、7至30种物种、7至25种物种、7至20种物种、7至15种物种、7至11种物种、8至40种物种、8至30种物种、8至25种物种、8至20种物种、8至15种物种、8至11种物种、9至40种物种、9至30种物种、9至25种物种、9至20种物种、9至15种物种、9至11种物种、10至40种物种、10至30种物种、10至25种物种、10至20种物种、10至15种物种或10至11种物种。
103.在一个实施方案中,用于治疗或预防如本文所述的适应症的治疗性微生物聚生体包含选自由以下组成的组的至少两种活肠道细菌的细菌菌株:脆弱拟杆菌、卵形拟杆菌、普通拟杆菌、狄氏副拟杆菌和产黑色普雷沃菌。在另一个实施方案中,用于治疗或预防如本文所述的适应症的治疗性微生物聚生体还包含一种或多种、两种或更多种、三种或更多种、四种或更多种、五种或更多种或所有六种物种,所述物种包括:多枝梭菌、闪烁梭菌、平野氏梭菌、双酶梭菌、柔嫩梭菌和萨尔迪纳梭菌。
104.在另一个实施方案中,治疗性微生物聚生体包含选自由以下组成的组的至少三种活肠道细菌的细菌菌株:脆弱拟杆菌、卵形拟杆菌、普通拟杆菌、狄氏副拟杆菌和产黑色普雷沃菌。在另一个实施方案中,用于治疗或预防如本文所述的适应症的治疗性微生物聚生体还包含一种或多种、两种或更多种、三种或更多种、四种或更多种、五种或更多种或所有六种物种,所述物种包括:多枝梭菌、闪烁梭菌、平野氏梭菌、双酶梭菌、柔嫩梭菌和萨尔迪纳梭菌。
105.在另一个实施方案中,治疗性微生物聚生体包含选自由以下组成的组的至少四种活肠道细菌的细菌菌株:脆弱拟杆菌、卵形拟杆菌、普通拟杆菌、狄氏副拟杆菌和产黑色普雷沃菌。在另一个实施方案中,用于治疗或预防如本文所述的适应症的治疗性微生物聚生体还包含一种或多种、两种或更多种、三种或更多种、四种或更多种、五种或更多种或所有
六种物种,所述物种包括:多枝梭菌、闪烁梭菌、平野氏梭菌、双酶梭菌、柔嫩梭菌和萨尔迪纳梭菌。
106.在另一个实施方案中,治疗性微生物聚生体包含选自由以下组成的组的活肠道细菌的细菌菌株中的每一者:脆弱拟杆菌、卵形拟杆菌、普通拟杆菌、狄氏副拟杆菌和产黑色普雷沃菌。在另一个实施方案中,用于治疗或预防如本文所述的适应症的治疗性微生物聚生体还包含一种或多种、两种或更多种、三种或更多种、四种或更多种、五种或更多种或所有六种物种,所述物种包括:多枝梭菌、闪烁梭菌、平野氏梭菌、双酶梭菌、柔嫩梭菌和萨尔迪纳梭菌。
107.在另一个实施方案中,所述微生物聚生体包含选自由以下组成的组的至少两种活肠道细菌物种:脆弱拟杆菌、卵形拟杆菌、普通拟杆菌、狄氏副拟杆菌、产黑色普雷沃菌,并且所述微生物聚生体还包含以下中的一者或多者、两者或更多者、三者或更多者、四者或更多者、五者或更多者或所有六者:多枝梭菌、闪烁梭菌、平野氏梭菌、双酶梭菌、柔嫩梭菌和萨尔迪纳梭菌。
108.在另一个实施方案中,所述微生物聚生体包含脆弱拟杆菌和卵形拟杆菌。在另一个实施方案中,所述微生物聚生体还包含由以下组成的组中的至少一者:普通拟杆菌、狄氏副拟杆菌和产黑色普雷沃菌。
109.在另一个实施方案中,所述微生物聚生体包含脆弱拟杆菌和卵形拟杆菌。在另一个实施方案中,所述微生物聚生体还包含由以下组成的组中的至少两者:普通拟杆菌、狄氏副拟杆菌和产黑色普雷沃菌。
110.在另一个实施方案中,所述微生物聚生体包含脆弱拟杆菌和卵形拟杆菌,并且所述微生物聚生体还包含由以下组成的组中的每一者:普通拟杆菌、狄氏副拟杆菌和产黑色普雷沃菌。
111.在另一个实施方案中,所述微生物聚生体包含脆弱拟杆菌和卵形拟杆菌,以及由以下组成的组中的至少一者:多枝梭菌、闪烁梭菌、平野氏梭菌、双酶梭菌、柔嫩梭菌和萨尔迪纳梭菌。
112.在另一个实施方案中,所述微生物聚生体包含脆弱拟杆菌和卵形拟杆菌,以及由以下组成的组中的至少两者:多枝梭菌、闪烁梭菌、平野氏梭菌、双酶梭菌、柔嫩梭菌和萨尔迪纳梭菌。
113.在另一个实施方案中,所述微生物聚生体包含脆弱拟杆菌和卵形拟杆菌,以及由以下组成的组中的至少三者:多枝梭菌、闪烁梭菌、平野氏梭菌、双酶梭菌、柔嫩梭菌和萨尔迪纳梭菌。
114.在另一个实施方案中,所述微生物聚生体包含脆弱拟杆菌和卵形拟杆菌,以及由以下组成的组中的至少四者:多枝梭菌、闪烁梭菌、平野氏梭菌、双酶梭菌、柔嫩梭菌和萨尔迪纳梭菌。
115.在另一个实施方案中,所述微生物聚生体包含脆弱拟杆菌和卵形拟杆菌,以及由以下组成的组中的至少五者:多枝梭菌、闪烁梭菌、平野氏梭菌、双酶梭菌、柔嫩梭菌和萨尔迪纳梭菌。
116.在另一个实施方案中,所述微生物聚生体包含脆弱拟杆菌和卵形拟杆菌,以及由以下组成的组中的每一者:多枝梭菌、闪烁梭菌、平野氏梭菌、双酶梭菌、柔嫩梭菌和萨尔迪
纳梭菌。
117.在另一个实施方案中,所述微生物聚生体包含脆弱拟杆菌和普通拟杆菌,以及由以下组成的组中的至少一者:卵形拟杆菌、狄氏副拟杆菌和产黑色普雷沃菌。
118.在另一个实施方案中,所述微生物聚生体包含脆弱拟杆菌和普通拟杆菌,以及由以下组成的组中的至少两者:卵形拟杆菌、狄氏副拟杆菌和产黑色普雷沃菌。
119.在另一个实施方案中,所述微生物聚生体包含脆弱拟杆菌和普通拟杆菌,并且还包含卵形拟杆菌、狄氏副拟杆菌和产黑色普雷沃菌。
120.在另一个实施方案中,所述微生物聚生体包含脆弱拟杆菌和普通拟杆菌,以及由以下组成的组中的至少一者:多枝梭菌、闪烁梭菌、平野氏梭菌、双酶梭菌、柔嫩梭菌和萨尔迪纳梭菌。
121.在另一个实施方案中,所述微生物聚生体还包含脆弱拟杆菌和普通拟杆菌,以及由以下组成的组中的至少两者:多枝梭菌、闪烁梭菌、平野氏梭菌、双酶梭菌、柔嫩梭菌和萨尔迪纳梭菌。
122.在另一个实施方案中,所述微生物聚生体还包含脆弱拟杆菌和普通拟杆菌,以及由以下组成的组中的至少三者:多枝梭菌、闪烁梭菌、平野氏梭菌、双酶梭菌、柔嫩梭菌和萨尔迪纳梭菌。
123.在另一个实施方案中,所述微生物聚生体包含脆弱拟杆菌和普通拟杆菌,以及由以下组成的组中的至少四者:多枝梭菌、闪烁梭菌、平野氏梭菌、双酶梭菌、柔嫩梭菌和萨尔迪纳梭菌。
124.在另一个实施方案中,所述微生物聚生体还包含脆弱拟杆菌和普通拟杆菌,以及由以下组成的组中的至少五者:多枝梭菌、闪烁梭菌、平野氏梭菌、双酶梭菌、柔嫩梭菌和萨尔迪纳梭菌。
125.在另一个实施方案中,所述微生物聚生体包含脆弱拟杆菌和普通拟杆菌,并且还包含多枝梭菌、闪烁梭菌、平野氏梭菌、双酶梭菌、柔嫩梭菌和萨尔迪纳梭菌。
126.本文所述的聚生体中的细菌物种或细菌菌株在人肠道中不是病原性的。
127.在一个实施方案中,活肠道细菌物种不包括大肠杆菌、肺炎克雷伯氏菌、奇异变形杆菌、阴沟肠杆菌、沃氏嗜胆菌、昂氏另枝菌、脱硫弧菌属物种、约氏乳杆菌和parasutterella excrementihominis。
128.在另一个实施方案中,所述聚生体不包含以下属的细菌:嗜胆菌属、肠杆菌属、埃希氏菌属、克雷伯氏菌属、变形杆菌属、另枝菌属、脱硫弧菌属、布劳特菌属或副萨特氏菌属。
129.在另一个实施方案中,所述聚生体不包含以下科的细菌:脱硫弧菌科、肠杆菌科、理研菌科和萨特氏菌科。
130.在另一个实施方案中,所述聚生体不包含以下科的细菌:乳杆菌科或肠杆菌科。
131.在另一个实施方案中,所述聚生体不包含以下目的细菌:burkholdales、脱硫弧菌目或肠杆菌目。
132.代谢特征:肠道微生物的各种特征有益于防止或治疗过敏症,包括食物过敏。在下文中,描述了被认为使得特定肠道微生物物种或分类群非常适合于如本文所述的保护性或治疗性微生物聚生体的特征及相应功能。实际上,包含这些特征及相应功能中的4种或更多
种(例如5种或更多种、6种或更多种、7种或更多种、8种或更多种、9种或更多种或10种或更多种)的聚生体被认为是针对食物过敏的保护或治疗的可能的候选者。
133.在一些实施方案中,所述微生物聚生体包含能够在哺乳动物受试者中产生丁酸盐的一种或多种类型的微生物。可在实验上鉴定产生丁酸盐的微生物,例如通过微生物产物的nmr或气相色谱分析或比色测定(rose i a.1955.methods enzymol.1:591
‑
5)。也可从计算方面鉴定产生丁酸盐的微生物,例如通过鉴定参与丁酸盐合成的一种或多种酶。在产生丁酸盐的微生物中发现的酶的非限制性实例包括丁酸激酶、磷酸转丁酰酶和丁酰coa:乙酸coa转移酶(louis p.,等人2004.jbact.186(7):2099
‑
2106)。产生丁酸盐的物种包括但不限于萨尔迪纳梭菌、平野氏梭菌、普氏粪杆菌(faecalibacterium prausnitzii)、丁酸弧菌属(butyrovibrio)物种、直肠真杆菌(eubacterium rectale)和肠罗斯氏菌(roseburia intestinalis)。
134.在一些实施方案中,药物组合物包含一种或多种类型的微生物或细菌物种,其中至少两种类型的微生物能够在哺乳动物受试者中产生丁酸盐。在其它实施方案中,所述组合物包含两种或更多种类型的微生物,所述微生物在哺乳动物受试者中协作(即交叉供应(cross
‑
feed))来产生免疫调节性短链脂肪酸(scfa)(例如丁酸盐)。在一个实施方案中,所述组合物包含至少一种类型的能够代谢益生元的微生物(例如,双歧杆菌属物种、普通拟杆菌、脆弱拟杆菌或多枝梭菌),所述益生元包括但不限于菊粉、菊粉型果聚糖、含果糖的糖缀合物(包括h1,h2,lewis a、b、x或y抗原)或低聚果糖,以使得所得代谢产物可被第二种类型的微生物(例如,产生丁酸盐的微生物,如罗斯氏菌属物种)转化成免疫调节性scfa(如丁酸盐)(falony g.,等人2006appl.environ.microbiol.72(12):7835
‑
7841)。在其它方面,所述组合物可包含至少一种消耗乙酸盐、产生丁酸盐的微生物(例如,普氏粪杆菌或肠罗斯氏菌)。
135.在一些实施方案中,所述组合物包含能够在哺乳动物受试者中产生丙酸盐和/或琥珀酸盐的一种或多种类型的微生物,任选地还包含适合于丙酸盐和/或琥珀酸盐生物合成的益生元或底物。用于产生丙酸盐的益生元或底物的实例包括但不限于l
‑
鼠李糖、d
‑
塔格糖、抗性淀粉、菊粉、聚右旋糖、阿糖基木聚糖、阿糖基木聚糖木聚糖寡糖、甘露寡糖和海带多糖(laminaran)(hosseini e.,等人2011.nutrition reviews.69(5):245
‑
258)。可在实验上鉴定产生丙酸盐的微生物,如通过微生物产物的nmr或气相色谱分析或比色测定(rose i a.1955.methods enzymol.1:591
‑
5)。也可从计算方面鉴定产生丙酸盐的微生物,如通过鉴定参与丙酸盐合成的一种或多种酶。在产生丙酸盐的微生物中发现的酶的非限制性实例包括琥珀酸盐途径的酶,包括但不限于磷酸烯醇式丙酮酸羧激酶、丙酮酸激酶、丙酮酸羧化酶、苹果酸脱氢酶、延胡索酸水合酶、琥珀酸脱氢酶、琥珀酰coa合成酶、甲基丙二酰coa脱羧酶和丙酸coa转移酶;以及丙烯酸酯途径的酶,包括但不限于l
‑
乳酸脱氢酶、丙酸coa转移酶、乳酰coa脱水酶、酰基coa脱氢酶、磷酸乙酰转移酶以及丙酸激酶。例如,利用琥珀酸盐途径的微生物包括拟杆菌属的某些物种,如脆弱拟杆菌、萨尔迪纳梭菌和平野氏梭菌。在一个实施方案中,产生丙酸盐的物种是脆弱拟杆菌、多形拟杆菌或卵形拟杆菌。在一个实施方案中,产生琥珀酸盐的物种是脆弱拟杆菌、多形拟杆菌、普通拟杆菌或卵形拟杆菌。
136.限定产生丁酸盐、丙酸盐和/或琥珀酸盐的物种的功能性方法包括短链脂肪酸
(scfa)产量的分析,使用气相色谱/液相色谱(gc/lc)来鉴定丙酸盐、丁酸盐和/或琥珀酸盐;或基于质谱学的方法,以检测这些scfa以及1,2
‑
丙二醇和1,3
‑
丙二醇。可在来自定殖的限菌小鼠以及来自常规患者和/或动物样品的培养上清液中进行进行研究。
137.用于鉴定产生丁酸盐的物种的另外方法包括表达用于由糖的厌氧发酵产生丁酸盐的丁酰
‑
coa:乙酸coa转移酶(but基因)或丁酸激酶(buk基因)的那些物种。在另一个实施方案中,产生丁酸盐(由氨基酸如赖氨酸、戊二酸或4
‑
氨基丁酸途径)的生物体表达酶,所述酶包括例如l2hgdh,2
‑
羟基戊二酸脱氢酶;gct,戊烯二酸coa转移酶(α亚基、β亚基);hgcoad,2
‑
羟基
‑
戊二酰
‑
coa脱氢酶(α亚基、β亚基、γ亚基);gcd,戊烯二酰
‑
coa脱羧酶(α亚基、β亚基);th1,硫解酶;hbd,β
‑
羟基丁酰
‑
coa脱氢酶;cro,巴豆酸酶;bcd,丁酰
‑
coa脱氢酶(包括电子转移蛋白α亚基、β亚基);kama,赖氨酸
‑
2,3
‑
氨基变位酶;kamd,e,β
‑
赖氨酸
‑
5,6
‑
氨基变位酶(α亚基、β亚基);kdd,3,5
‑
二氨基己酸脱氢酶;kce,3
‑
酮基
‑5‑
氨基己酸裂解酶;kal,3
‑
氨基丁酰
‑
coa解氨酶(ammonia lyase);abfh,4
‑
羟基丁酸脱氢酶;abfd,4
‑
羟基丁酰
‑
coa脱水酶;isom,乙烯基乙酰
‑
coa
‑
3,2
‑
异构酶(与abfd相同的蛋白质);4hbt,丁酰
‑
coa:4
‑
羟基丁酸coa转移酶;but,丁酰
‑
coa:乙酸coa转移酶;ato,丁酰
‑
coa:乙酰乙酸coa转移酶(α亚基、β亚基);ptb,磷酸丁酰转移酶;以及buk,丁酸激酶(参见例如vital等人mbio 5(2):e00889
‑
14)。
138.在一些实施方案中,微生物聚生体包含至少一种细菌物种,所述至少一种细菌物种产生能够刺激肠上皮细胞、抗原呈递细胞和/或t细胞中的芳烃(ahr)受体的化合物。不希望受理论束缚,ahr受体的刺激可帮助能够预防和/或治疗食物过敏的调控性t细胞过程的发展。刺激宿主芳烃受体途径的化合物的一些非限制性实例包括(i)吲哚;(ii)来自吲哚、色氨酸、酪氨酸和组氨酸的微生物合成的中间体;(iii)类黄酮、吩嗪类和/或醌类的微生物合成;或(iv)宿主摄取的类黄酮、吩嗪类和/或醌类的代谢的化合物或中间体。在一个实例中,产生足以刺激宿主芳烃受体途径的芳烃受体激动剂的活的、可培养的厌氧肠道细菌菌株包含至少一种与色氨酸合成或醌分子合成相关的基因。在另一实例中,活的、可培养的厌氧肠道细菌菌株通过类黄酮、吩嗪类和/或醌类的微生物合成产生足以刺激宿主芳烃受体途径的芳烃受体激动剂。因此,表达或编码参与类黄酮、吩嗪类和/或醌类合成的生物合成酶的微生物被鉴定为产生宿主芳烃受体激动剂的微生物。在一个实施方案中,所述生物合成酶包括途径中的最后一种酶,所述酶催化产生例如类黄酮、吩嗪或醌化合物的最终生物合成反应。
139.在一些实施方案中,微生物聚生体包含产生能够刺激孕烷x受体(其例如对肠道屏障功能具有有益作用)和/或调控性t细胞过程的发展的化合物的至少一种细菌物种。刺激孕烷x受体的化合物的非限制性实例包括(i)碳链裂解酶;(ii)羟基类固醇脱氢酶活性的化合物或中间体;或(iii)来源于类黄酮代谢酶的化合物或中间体。因此,预期编码和表达类固醇碳链裂解酶和/或羟基类固醇脱氢酶的细菌产生刺激孕烷x受体的化合物。萨尔迪纳梭菌和闪烁梭菌是产生能够刺激孕烷x受体的化合物的细菌物种的非限制性实例。
140.在一些实施方案中,微生物聚生体包含至少一种细菌物种,所述至少一种细菌物种产生能够刺激rar相关孤儿受体γ(rorγ)途径,以例如经由直接刺激或肠道抗原呈递细胞和/或上皮细胞中的rorγ
‑
激活途径(所述rorγ激活的途径然后刺激调控性t细胞应答)来刺激调控性t细胞应答的发展的化合物。在一个实施方案中,内源性地或通过代谢摄入的
前体产生能够刺激rorγ(rar相关孤儿受体γ)途径以刺激调控性t细胞应答的发展的化合物的活的、可培养的厌氧肠道细菌菌株是表达至少一种胆固醇还原酶和能够代谢固醇化合物的其它酶的菌株。产生刺激rorγ途径的化合物的微生物的非限制性实例包括闪烁梭菌、平野氏梭菌和萨尔迪纳梭菌。在一个实例中,表达胆汁酸转化酶的那些物种也能够产生rorγ途径激动剂。
141.在一些实施方案中,本文所述的微生物聚生体例如通过刺激宿主粘蛋白和复合糖缀合物以及改善保护性共生物种的定殖来改善肠道功能。在一个实施方案中,所述微生物聚生体包含刺激宿主产生粘蛋白和复合糖缀合物的至少一种细菌菌株(如普通拟杆菌)。
142.免疫调节:可用于治疗食物过敏的其它示例性组合物含有能够改变受试者中的免疫亚群(例如,t细胞亚群,例如,t
reg
)的比例的细菌物种。
143.例如,免疫调节细菌可增加或降低受试者中的t
reg
细胞、t
h
17细胞、t
h
1细胞或t
h
2的比例。免疫细胞亚群比例的增加或降低可以是系统性的,或者其可局限于定殖的聚生体的作用位点(例如在胃肠道中或远端生态失调的位点处)。在一些实施方案中,基于益生菌组合物对受试者中免疫细胞亚群的分化和/或扩增的所需作用,将包含免疫调节性细菌的微生物聚生体用于治疗食物过敏。
144.在一个实施方案中,所述微生物聚生体含有增加受试者中或受试者中的特定位置(例如肠道组织)中的t
reg
细胞比例的免疫调节性细菌。在一个实施方案中,微生物聚生体含有增加受试者中的t
h
17细胞比例的免疫调节性细菌。在另一个实施方案中,微生物聚生体含有降低受试者中的t
h
17细胞比例的免疫调节性细菌。在一个实施方案中,微生物聚生体含有增加受试者中的t
h
1细胞比例的免疫调节性细菌。在另一个实施方案中,微生物聚生体含有降低受试者中的t
h
1细胞比例的免疫调节性细菌。在一个实施方案中,微生物聚生体含有增加受试者中的t
h
2细胞比例的免疫调节性细菌。在另一个实施方案中,微生物聚生体含有降低受试者中的t
h
2细胞比例的免疫调节性细菌。
145.在一个实施方案中,微生物聚生体含有免疫调节性细菌,所述免疫调节性细菌能够调节受试者中的t
reg
细胞、t
h
17细胞、t
h
1细胞、t
h
2细胞以及它们的组合中的一者或多者的比例。对于治疗或预防炎症性病症(如食物过敏)而言,某些免疫细胞谱可能是特别合乎需要的。例如,在一些实施方案中,可通过增加t
reg
细胞和t
h
2细胞的数量以及减少t
h
17细胞和t
h
1细胞的数量来促进例如食物过敏的治疗或预防。因此,用于治疗或预防食物过敏的微生物聚生体可含有能够促进t
reg
细胞和t
h
2细胞并使t
h
17和t
h
1细胞减少的微生物聚生体。
146.在一个实施方案中,本文所述的方法和组合物中的厌氧肠道细菌菌株表达激动剂,所述激动剂能够结合至抗原呈递细胞、肠上皮细胞和/或t细胞中的toll样受体(tlr)、cd14和/或脂质结合蛋白并调节由所述toll样受体(tlr)、cd14和/或脂质结合蛋白介导的应答以促进调控性t细胞的发展。tlr激动剂的非限制性实例包括由拟杆菌属的共生成员产生的脂多糖(lps)、胞外多糖(psa)、肽聚糖或cpg基序;或由梭菌属的成员产生的脂磷壁酸(lta)。在一个实施方案中,充当tlr激动剂的厌氧肠道细菌菌株选自下表。
[0147][0148]
胆汁酸转化:初级胆汁酸(例如人的胆酸和鹅脱氧胆酸)主要通过与氨基酸牛磺酸或甘氨酸缀合在哺乳动物(包括人)的肝中生成,并分泌在胆汁中。在肠道中,初级胆汁酸被微生物代谢,所述微生物将初级胆汁酸转化为次级胆汁酸。初级胆汁酸的肠微生物转化可包括去缀合、去葡糖醛酸化、羟基的氧化、氧代基的还原以产生差向异构的羟基胆汁酸、酯化和脱羟基。进行初级胆汁酸的去缀合的细菌的非限制性实例包括拟杆菌属、双歧杆菌属、梭菌属以及乳杆菌属。进行初级胆汁酸的氧化和差向异构化的细菌的非限制性实例包括拟杆菌属、梭菌属、egghertella、真杆菌属、消化链球菌属和瘤胃球菌属。进行初级胆汁酸的7
‑
脱羟基的细菌的非限制性实例包括梭菌属和真杆菌属。进行初级胆汁酸的酯化的细菌的非限制性实例包括拟杆菌属、真杆菌属和乳杆菌属。
[0149]
在一个实施方案中,如本文所述的微生物聚生体包含通过去缀合转化胆汁酸的至少一种细菌成分。在另一个实施方案中,如本文所述的微生物聚生体包含通过7
‑
脱羟基转化胆汁酸的至少一种细菌成分。在另一个实施方案中,如本文所述的微生物聚生体包含通过酯化转化胆汁酸的至少一种细菌成分。
[0150]
在一个实施方案中,如本文所述的微生物聚生体包含至少2种、至少3种、至少4种、至少5种、至少6种、至少7种、至少8种、至少9种、至少10种、至少11种或更多种进行胆汁酸转化的细菌成分。
[0151]
在一个实施方案中,如本文所述的微生物聚生体包含11种或更少、10种或更少、9种或更少、8种或更少、7种或更少、6种或更少、5种或更少、4种或更少、3种或更少、2种或更少、1种或更少或0种进行胆汁酸转化(如去缀合、酯化或7
‑
脱羟基)的细菌成分。
[0152]
在一个实施方案中,微生物聚生体包含至少一种厌氧肠道细菌菌株,所述细菌菌株单独或组合地进行完整的胆汁酸转化。
[0153]
gp
‑
iia聚生体成员的靶标:如本文所述的微生物聚生体在宿主受试者内具有多个靶标。下表中总结了代表性靶标。
[0154]
gp
‑
iia聚生体成员的靶标
[0155][0156]
工程化的微生物:在一些实施方案中,微生物聚生体的一个或多个成员包含一种或多种工程化的微生物。例如,工程化的微生物包括具有以下的微生物:i)一种或多种引入的遗传变化,入细菌染色体上或内源性质粒上含有的一个或多个核苷酸的插入、缺失、易位或取代或它们的任何组合,其中所述遗传变化可导致一种或多种蛋白编码基因、非蛋白编码基因、基因调控区或它们的任何组合的改变、破坏、去除或添加,并且其中这种变化可以是两个或更多个独立的基因组区域的融合或者可合成得到;ii)一种或多种含有内源性基因的突变拷贝的外来质粒,这种突变是一个或多个核苷酸的插入、缺失或取代或它们的任何组合;以及iii)一种或多种外来质粒,所述外来质粒含有突变或非突变的外源性基因或者两种或更多种内源性基因、外源性基因或混合基因的融合。一种或多种工程化的微生物可使用包括但不限于以下的技术来产生:定点诱变、转座子诱变、敲除、敲入(knock
‑
ins)、聚合酶链式反应诱变、化学诱变、紫外光诱变、转化(化学上或通过电穿孔)、噬菌体转导或它们的任何组合。
[0157]
排除的细菌:在一个实施方案中,微生物聚生体不包含常规地被分类为病原性或机会致病(opportunistic)的生物体。可能的是,给定分类组(taxonomic group)的所有成员所具有的功能可以是有益的(例如对于提供特定的代谢物而言),但由于其它原因,所述组中的一个或多个特定成员的整体作用是无益的并且是例如病原性的。显然,引起发病机制(例如急性胃肠病状)的给定分类组的成员将被排除在本文所述的治疗性或预防性方法和组合物之外。
[0158]
在一个实施方案中,所述细菌组合物不包含以下中的至少一者:肠氨基酸球菌
(acidaminococcus intestinalis)、大肠杆菌、干酪乳杆菌(lactobacillus casei)、副干酪乳杆菌(lactobacillus paracasei)、拉乌尔菌属(raoultella sp.)和缓症链球菌(streptococcus mitis)。
[0159]
在另一个实施方案中,所述细菌组合物不包含以下中的至少一者:肠道巴恩斯氏菌(barnesiella intestinihominis);罗伊氏乳杆菌(lactobacillus reuteri);海氏肠球菌(enterococcus hirae)、屎肠球菌(enterococcus faecium)或耐久肠球菌(enterococcus durans);粪厌氧棒杆菌(anaerostipes caccae)或吲哚梭菌(clostridium indolis);沃氏葡萄球菌(staphylococcus wameri)或巴氏葡萄球菌(staphylococcus pasteuri);以及产液阿德勒克罗伊茨菌(adlercreutzia equolifaciens)。
[0160]
在另一个实施方案中,所述细菌组合物不包含以中的至少一者:肉毒梭菌(clostridium botulinum)、尸毒梭菌(clostridium cadaveris)、气肿疽梭菌(clostridium chauvoei)、梭状梭菌(clostridiumclostridioforme)、匙形梭菌(clostridium cochlearium)、艰难梭菌(clostridium difficile)、溶血梭菌(clostridium haemolyticum)、矛形梭菌(clostridium hastiforme)、溶组织梭菌(clostridium histolyticum)、吲哚梭菌、不规则梭菌(clostridium irregulare)、泥渣梭菌(clostridium limosum)、恶名梭菌(clostridium malenominatum)、诺维氏梭菌(clostridium novyi)、乳清酸梭菌(clostridium oroticum)、类腐败梭菌(clostridium paraputrificum)、产气荚膜梭菌(clostridium perfringens)、毛状梭菌(clostridium piliforme)、腐化梭菌(clostridium putrefaciens)、腐败梭菌(clostridium putrificum)、败毒梭菌(clostridium septicum)、索氏梭菌(clostridium sordellii)、楔形梭菌(clostridium sphenoides)和破伤风梭菌(clostridium tetani)。
[0161]
在另一个实施方案中,所述细菌组合物不包含大肠杆菌和约氏乳杆菌中的至少一者。
[0162]
在另一实施方案中,所述细菌组合物不包含以下中的至少一者:无害梭菌(clostridium innocuum)、丁酸梭菌(clostridium butyricum)、大肠杆菌和生产布劳特氏菌(blautia producta)(以前称为生产消化链球菌(peptostreptococcus productus))。
[0163]
在另一个实施方案中,所述细菌组合物不包含以下中的至少一者:真细菌、梭杆菌门(fusobacteria)、丙酸杆菌属(propionibacteria)、大肠杆菌和芽殖菌属(gemmiger)。
[0164]
在另一个实施方案中,本文所述的组合物不包含病原菌,例如,耶尔森氏菌属(yersinia)、弧菌属(vibrio)、密螺旋体属(treponema)、链球菌属(streptococcus)、葡萄球菌属(staphylococcus)、志贺氏菌属(shigella)、沙门氏菌属(salmonella)、立克次氏体属(rickettsia)、东方体属(orientia)、假单胞菌属(pseudomonas)、奈瑟氏菌属(neisseria)、支原体属(mycoplasma)、分枝杆菌属(mycobacterium)、李斯特氏菌属(listeria)、钩端螺旋体属(leptospira)、军团菌属(legionella)、克雷伯氏菌属、螺杆菌属(helicobacter)、嗜血杆菌属(haemophilus)、弗朗西丝氏菌属(francisella)、埃希氏菌属、埃立克体属(ehrlichia)、肠球菌属(enterococcus)、柯克斯氏体属(coxiella)、棒状杆菌属(corynebacterium)、衣原体属(chlamydia)、嗜衣原体属(chlamydophila)、弯曲杆菌属(campylobacter)、伯克霍尔德氏菌属(burkholderia)、布鲁氏菌属(brucella)、疏螺旋体属(borrelia)、博德特氏菌属(bordetella)、芽孢杆菌属(bacillus)、多药物耐药性细
菌、超广谱β
‑
内酰胺耐药性肠球菌(esbl)、碳青霉烯耐药性肠杆菌科(cre)和万古霉素耐药性肠球菌(vre)。
[0165]
在其它实施方案中,本文所述的组合物不包含病原性物种,如嗜水气单胞菌(aeromonas hydrophila)、胎儿弯曲杆菌(campylobacter fetus)、类志贺邻单胞菌(plesiomonas shigelloides)、蜡样芽孢杆菌(bacillus cereus)、空肠弯曲杆菌(campylobacter jejuni)、肉毒梭菌、艰难梭菌、产气荚膜梭菌、肠集聚型大肠杆菌(enteroaggregative escherichia coli)、肠出血性大肠杆菌(enterohemorrhagic escherichia coli)、肠侵袭性大肠杆菌(enteroinvasive escherichia coli)、肠毒素性大肠杆菌(enterotoxigenic escherichia coli,如但不限于lt和/或st)、大肠杆菌o157:h7、幽门螺杆菌(helicobacter pylori)、肺炎克雷伯氏菌、单核细胞增多性李斯特氏菌(lysteria monocytogenes)、类志贺邻单胞菌、沙门氏菌属物种、伤寒沙门氏菌(salmonella typhi)、副伤寒沙门氏菌(salmonella paratyphi)、志贺氏菌属物种、葡萄球菌属物种、金黄色葡萄球菌(staphylococcus aureus)、万古霉素耐药性肠球菌属物种、弧菌属物种、霍乱弧菌(vibrio cholerae)、副溶血弧菌(vibrio parahaemolyticus)、创伤弧菌(vibrio vulnificus)和小肠结肠炎耶尔森氏菌(yersinia enterocolitica)。
[0166]
在一个实施方案中,所述微生物聚生体及其组合物不包含大肠杆菌、肺炎克雷伯氏菌、奇异变形杆菌、阴沟肠杆菌和/或沃氏嗜胆菌。
[0167]
病原性生物体的减少:在一些实施方案中,包含如本文所述的微生物聚生体的组合物提供针对生态失调或针对由一种或多种目标gi病原体引起的感染的保护性或治疗性作用。在一个实施方案中,如本文所述的微生物聚生体减少一种或多种生态失调或病原性细菌物种或菌株的生物量。
[0168]
在一个实施方案中,与不存在用如本文所述的微生物聚生体治疗情况下的一种或多种生态失调或病原性细菌物种或菌株的生物量相比,如本文所述的微生物聚生体使一种或多种生态失调或病原性细菌物种或菌株的生物量降低至少10%。在其它实施方案中,与用微生物聚生体或其组合物治疗之前受试者肠道中的生态失调或病原性细菌物种或菌株的生物量相比,一种或多种病原性细菌物种或菌株的生物量降低至少20%、至少30%、至少40%、至少50%、至少60%、至少70%、至少80%、至少90%、至少95%、至少99%或甚至100%(即低于测定的可检测限)。
[0169]
在一些实施方案中,如本文所述的微生物聚生体改变肠道环境,以使得一种或多种生态失调或病原性生物体的数量、生物量或活性降低至少10%(例如,至少20%、至少30%、至少40%、至少50%、至少60%、至少70%、至少80%、至少90%、至少95%、至少99%或甚至100%(即低于测定的可检测限))。仅作为一个实例,拟杆菌属的定殖减少肠杆菌科或脱硫弧菌科中的生态失调物种的生物量。
[0170]
在一些实施方案中,所述病原菌选自由以下组成的组:耶尔森氏菌属、弧菌属、密螺旋体属、链球菌属、葡萄球菌属、埃希氏菌属/志贺氏菌属、沙门氏菌属、立克次氏体属、东方体属、假单胞菌属、奈瑟氏菌属、支原体属、分枝杆菌属、李斯特氏菌属、钩端螺旋体属、军团菌属、克雷伯氏菌属、螺杆菌属、嗜血杆菌属、弗朗西丝氏菌属、埃希氏菌属、埃立克体属、肠球菌属、柯克斯氏体属、棒状杆菌属、梭菌属、衣原体属、嗜衣原体属、弯曲杆菌属、伯克霍尔德氏菌属、布鲁氏菌属、疏螺旋体属、博德特氏菌属、双歧杆菌属、芽孢杆菌属、嗜胆菌属、
laboratories,carlsbad,calif.)、mo biodna分离试剂盒(mo bio laboratories,carlsbad,calif.)或qiaamp dna粪便小型试剂盒(qiagen,valencia,calif.)从样品中提取基因组dna。qpcr可使用hotmastermix(5prime,gaithersburg,md.)和对目标病原性或生态失调微生物具有特异性的引物进行,并且可在具有条形码的fast optical 96孔反应板(0.1ml)(life technologies,grand island,n.y.)上进行,并且在配备有cfx96
tm
实时系统的biorad c1000
tm
热循环仪(biorad,hercules,calif.)上进行,荧光读数为fam通道和rox通道。fam通道上每个孔的cq值由cfx manager
tm
软件版本2.1确定。通过将给定样品的cq值输入线性回归模型中来计算各实验样品的log
10
(cfu/ml),所述线性回归模型由比较标准曲线孔的cq值与那些样品的已知log
10
(cfu/ml)获得的标准曲线产生。熟练的技术人员可采用替代qpcr模式。
[0177]
还提供了确立细菌组合物的保护作用的体内测定。关于针对艰难梭菌的保护作用描述了所述测定,但本领域技术人员可使其适用于其它病原体或生态失调物种。提供了用于测试细菌组合物针对艰难梭菌的保护作用的体内小鼠模型。在此模型中(基于chen,等人,gastroenterology 135(6):1984
‑
1992(2008)),通过以下方式使小鼠对艰难梭菌易感:用经由它们的饮用水递送的5至7种抗生素(包括卡那霉素、粘菌素、庆大霉素、甲硝唑和万古霉素,以及任选地包括氨苄青霉素和环丙沙星)处理7天(实验的第
‑
12天至第
‑
5天);接着在第
‑
3天用克林霉素以单剂量处理;然后3天后,在第0天用104个艰难梭菌孢子经由口服管饲(即口胃灌洗)进行激发。细菌组合物可在艰难梭菌管饲之前(预防性处理)或之后(治疗性处理)给予。另外,可在(任选的)万古霉素处理后给予细菌组合物,以评估它们预防复发并由此在体内遏制病原体的能力。从第
‑
1天至第6天(或超过所述时间,对于预防复发),每天进行评估的结果是重量、临床体征、死亡率以及粪便中艰难梭菌的泄出(shedding)。在没有处理的情况下,通常观察到重量减轻、疾病的临床体征以及艰难梭菌泄出。在第
‑
1至第4天通过口服管饲提供的万古霉素防止这些后果,并充当阳性对照。临床体征是主观性的,并且每天由同一位经验丰富的观察者进行评分。对体重减轻等于或大于25%的动物实施安乐死并计数为感染相关的死亡率。每天从小鼠笼(每笼5只小鼠)中收集粪便,并且使用上述针对体外测定所描述的选择性涂铺测定或经由针对毒素基因的qpcr,对粪便中艰难梭菌孢子的泄出进行检测。通过以下方式来确定测试材料(包括10%人粪便的悬浮液(作为阳性对照)、细菌组合物或pbs(作为阴性媒介物对照))的作用:在第
‑
1天(艰难梭菌激发的前一天),处理的第1天、第2天和第3天,或万古霉素处理后第5天、第6天、第7天和第8天,将处于0.2ml体积中的测试样品经由口服管饲引入小鼠中。如上所述,在第1天至第4天给予万古霉素作为另一阳性对照。可采用替代给药方案和施用途径(例如直肠)(包括测试物品的多个剂量),并且可递送103至10
13
个给定生物体或组合物。
[0178]
有益生物体的增强:在一些实施方案中,包含微生物聚生体的组合物提供使gi道中的有益生物体增强的治疗作用。在一个实施方案中,如本文所述的微生物聚生体使一种或多种有益细菌物种的生物量增加至少10%。在其它实施方案中,与用微生物聚生体或其组合物处理之前受试者肠道中的有益细菌物种的生物量相比,使一种或多种有益细菌物种的生物量增加至少20%、至少30%、至少40%、至少50%、至少60%、至少70%、至少80%、至少90%、至少1倍、至少2倍、至少5倍、至少10倍、至少50倍、至少100倍、至少500倍、至少1000倍、至少5000倍、至少10,000倍、至少15,000倍或至少20,000倍。在一个实施方案中,有益生
物体是当前驻留或存在于肠道中的共生细菌物种。在另一个实施方案中,有益生物体是微生物聚生体本身中的一种或多种细菌物种。
[0179]
在一些实施方案中,如本文所述的微生物聚生体改变肠道环境,以使得一种或多种有益生物体的数量、生物量或活性增加至少10%(例如,至少20%、至少30%、至少40%、至少50%、至少60%、至少70%、至少80%、至少90%、至少1倍、至少2倍、至少5倍、至少10倍、至少50倍、至少100倍、至少500倍、至少1000倍、至少5000倍、至少10,000倍、至少15,000倍或至少20,000倍)。例如,微生物聚生体刺激宿主产生粘蛋白和复合糖缀合物以改善肠道屏障功能以及有益生物体、另外的益生菌组合物或微生物聚生体本身的定殖。在一些实施方案中,用于提高有益生物体的生物量和/或活性的微生物组合物包含例如拟杆菌属物种,其增强其它拟杆菌门和梭菌目的定殖。在一些实施方案中,微生物聚生体影响肠道ph、降低氧张力、分泌糖苷酶以及改善肠腔的还原电位,以增强有益生物体的定殖。
[0180]
在另一个实施方案中,有益物种包括梭菌属菌物种,如多枝梭菌、闪烁梭菌、平野氏梭菌、双酶梭菌、柔嫩梭菌、萨尔迪纳梭菌、哈氏梭菌(clostridium hathewayi)、系结梭菌、海氏梭菌、甘氨酸溶根瘤梭菌(clostridium glycyrrhizinilyticum)、拉瓦氏梭菌(clostridium lavalense)、菲氏梭菌(clostridium fimetarium)、共生梭菌或球孢梭菌。
[0181]
细菌和细菌聚生体的表征
[0182]
在某些实施方案中,提供了用于测试包含微生物聚生体的组合物的某些特性的方法。例如,确定细菌组合物对某些环境变量的敏感性,例如以便在给定的组合物、制剂和/或用途中选择特定合乎需要的特性。例如,可针对ph耐受性、胆汁酸耐受性和/或抗生素敏感性,对组合物的细菌组分以逐个成分的基础分别地或者作为由多种细菌成分构成的细菌组合物(在本章节中统称微生物聚生体)共同地进行测试。
[0183]
ph敏感性测试:如果将药物组合物以不同于施用至结肠或直肠来施用(即,例如口服途径),任选地测试ph耐受性增强微生物或治疗性组合物的选择,所述微生物或治疗性组合物通过gi道或泌尿生殖道的不同区域的变化ph环境将以可能最高的产量存活。了解细菌组合物如何对gi道或泌尿生殖道的ph作出反应也有助于制剂,以使得如果是有益的,可增加剂型中微生物的数量;和/或以使得可将所述组合物以肠溶包衣胶囊或片剂施用或者与缓冲性或保护性组合物一起施用。
[0184]
由于在高蛋白餐后短时间内胃的ph可降至ph 1至2,之后生理机制将其调节至ph 3至4,并且通常处于4至5的静息ph,并且由于小肠的ph可在ph 6至7.4的范围内,所以可制备细菌组合物,所述细菌组合物使其在这些不同的ph范围内存活(具体而言,其中经过不同的ph范围,至少1%、5%、10%、15%、20%、25%、30%、40%、50%、60%、70%、80%、90%或多达100%的细菌可存活肠道输送时间(gut transit times))。这可通过穿过那些ph范围的预期肠道输送时间使细菌组合物暴露至不同的ph范围来进行测试。因此,仅作为非限制性实例,可使包含一种或多种细菌物种的组合物的18小时培养物在添加ph调节剂的标准培养基(如肠道微生物群培养基(“gmm”,参见goodman等人,pnas 108(15):6252
‑
6257(2011))或另一种不含动物产物的培养基中生长:ph 1至2,持续30分钟;ph 3至4持续1小时;ph 4至5持续1至2小时;以及ph 6至7.4持续2.5至3小时。用于测试对酸的稳定性的替代方法描述于例如美国专利号4,839,281中。细菌的存活可通过以下来确定:培养细菌并在合适的选择性或非选择性培养基上对菌落进行计数。
[0185]
胆汁酸敏感性测试:另外,在一些实施方案中,测试胆汁酸耐受性增强对将在输送通过gi道期间暴露于胆汁酸后存活的微生物或治疗性组合物的选择。胆汁酸被分泌到小肠中,并且可像ph一样影响细菌组合物的存活。这可通过使所述组合物暴露于胆汁酸持续预期肠道暴露于胆汁酸的时间来进行测试。例如,可使用ph 9的0.05mm tris作为溶剂制备所需浓度的胆汁酸溶液。在胆汁酸溶解后,可用10%hcl将溶液的ph值调节至7.2。治疗性组合物的细菌组分可培养于2.2ml的胆汁酸组合物(模拟患者中胆汁酸的浓度和类型)、1.0ml的10%无菌过滤粪便培养基和0.1ml的给定细菌菌株的18小时培养物中。孵育可进行2.5至3小时或更长时间。用于测试对胆汁酸的稳定性的替代方法描述于例如美国专利号4,839,281中。细菌的存活可通过以下来确定:培养细菌并在合适的选择性或非选择性培养基上对菌落进行计数。
[0186]
抗生素敏感性测试:作为进一步任选的敏感性测试,可测试微生物组合物的细菌组分对抗生素的敏感性。在一个实施方案中,可对细菌组分进行选择,以使得它们对抗生素敏感,从而使得如果需要的话,可通过至少一种靶向细菌组合物的抗生素使所述细菌组分从患者的胃肠道中消除或大幅减少。
[0187]
对胃肠细胞的粘附:可任选地针对粘附至胃肠细胞的能力对组合物进行测试。用于测试对胃肠细胞的粘附的方法描述于例如美国专利号4,839,281中。
[0188]
免疫调节性细菌的鉴定:在一些实施方案中,通过调节孢子形成的核酸序列的存在来鉴定免疫调节性细菌。特别地,标签孢子形成基因在包括梭菌属和芽孢杆菌属在内的亲缘关系远的属的成员之间高度保守。正向遗传学的传统方法已鉴定了许多(如果不是全部)孢子形成(spo)所必需的基因。孢子形成的发育程序部分地由4种区室特异性σ因子的连续作用(按照σf、σε、σg和σk的顺序出现)决定,所述σ因子的活性局限于前胞子(σf和σg)或母细胞(σε和σk)。在其它实施方案中,通过产生dpa的酶的生物化学活性或通过分析培养物的dpa含量来鉴定免疫调节性细菌。作为细菌孢子形成的一部分,大量的dpa产生,并且占孢子质量的5%
‑
15%。由于在已知的培养基条件下并非所有活的孢子都萌发并生长,所以难以评估细菌群体中的总孢子计数。因此,dpa含量的测量结果与孢子含量高度相关,并且是用于表征细菌群体中的总孢子含量的适当测量。
[0189]
在其它实施方案中,通过以下来鉴定免疫调节性细菌:筛选细菌以确定所述细菌是否诱导宿主细胞分泌促炎性细胞因子或抗炎细胞因子。例如,可将能够分泌细胞因子的人或哺乳动物细胞如免疫细胞(例如pbmc、巨噬细胞、t细胞等)暴露于候选免疫调节性细菌或由候选免疫调节性细菌的培养物获得的上清液,并且可使用标准技术(如elisa、免疫印迹、luminex
tm
、抗体阵列、定量pcr、微阵列等)来测量细胞因子的表达或分泌的变化。可基于在人或哺乳动物细胞中诱导所需细胞因子谱的能力选择用于包含于微生物聚生体中的细菌。例如,可基于诱导一种或多种抗炎细胞因子分泌的能力和/或减少一种或多种促炎性细胞因子分泌的能力来选择抗炎细菌以包含(或者排除)于微生物聚生体或其组合物中。抗炎细胞因子包括例如il
‑
10、il
‑
13、il
‑
9、il
‑
4、il
‑
5以及它们的组合。其它炎性细胞因子包括例如tgfβ。促炎性细胞因子包括例如ifnγ、il
‑
12p70、il
‑
1α、il
‑
6、il
‑
8、mcp1、mip1α、mip1β、tnfα以及它们的组合。在一些实施方案中,可基于不同类型的细菌(例如来自不同物种的细菌或者来自同一物种的不同菌株的细菌)诱导的调节一种或多种抗炎细胞因子分泌的能力和/或减少宿主细胞的一种或多种促炎细胞因子分泌的能力来选择抗炎细菌以包含于微
生物聚生体中。
[0190]
在其它实施方案中,通过以下来鉴定免疫调节性细菌:筛选细菌以确定所述细菌是否影响免疫细胞的特定亚群的分化和/或扩增。例如,可针对促进来自前体细胞(例如初始t细胞)的t
reg
细胞、t
h
17细胞、t
h
1细胞和/或t
h
2细胞的分化和/或扩增的能力来筛选候选细菌。作为举例,可在存在候选细菌或由候选细菌的培养物获得的上清液的情况下培养初始t细胞,并且可使用标准技术(如facs分析)来确定t
reg
细胞、t
h
17细胞、t
h
1细胞和/或t
h
2细胞的数量。指示t
reg
细胞的标志物包括例如cd25
+
cd127
lo
。指示t
h
17细胞的标志物包括例如cxcr3
‑
ccr6
+
。指示t
h
1细胞的标志物包括例如cd4
+
、cxcr3
+
和ccr6
‑
。指示t
h
2细胞的标志物包括例如cd4
+
、ccr4
+
和cxcr3
‑
、ccr6
‑
。指示特定t细胞亚群的其它标志物是本领域已知的,并且可用于本文所述的测定中,例如以鉴定受候选免疫调节性细菌影响的免疫细胞群体。可基于促进所需免疫细胞亚群的分化和/或扩增的能力来选择细菌以包含(或排除)于微生物聚生体中。
[0191]
在其它实施方案中,通过以下来鉴定免疫调节性细菌:筛选细菌以确定所述细菌是否分泌短链脂肪酸(scfa)(例如丁酸盐、乙酸盐、丙酸盐或戊酸盐,或它们的组合)。例如,可使用标准技术来测量细菌上清液中短链脂肪酸的分泌。在一个实施方案中,可使用nmr、质谱法(例如gc
‑
ms、串联质谱法、基质辅助激光解吸/电离等)、elisa或免疫印迹来筛选细菌上清液,以测量一种或多种短链脂肪酸的水平。也可通过标准技术(如rna印迹、微阵列或定量pcr)来确定负责产生短链脂肪酸的细菌基因的表达。
[0192]
示例性的最小微生物聚生体:最小微生物聚生体在本文中的实施例部分中示出,并且能够预防和/或治疗现有的食物过敏症状。这些示例性的最小微生物聚生体不应被解释为限制,并且仅意图更好地理解本文所述的方法和组合物。
[0193]
在一个实施方案中,最小微生物聚生体基本上由以下组成:多枝梭菌、闪烁梭菌、平野氏梭菌、双酶梭菌、柔嫩梭菌和萨尔迪纳梭菌。
[0194]
在一个实施方案中,最小微生物聚生体用于预防和/或治疗现有的对食物的过敏反应,所述最小微生物聚生体基本上由以下组成:多枝梭菌、闪烁梭菌、平野氏梭菌、双酶梭菌、柔嫩梭菌和萨尔迪纳梭菌。
[0195]
在一个实施方案中,最小微生物聚生体基本上由以下组成:脆弱拟杆菌、卵形拟杆菌、普通拟杆菌、狄氏副拟杆菌和产黑色普雷沃菌。
[0196]
在一个实施方案中,最小微生物聚生体用于治疗现有的特应性疾病或病症、过敏反应(例如对食物的过敏),所述最小微生物聚生体基本上由以下组成:脆弱拟杆菌、卵形拟杆菌、普通拟杆菌、狄氏副拟杆菌和产黑色普雷沃菌。
[0197]
在此上下文中,“基本上由
……
组成”是指如果添加另一微生物并未改善如本文所述和定义的过敏症的治疗或预防,则所述微生物对于保护性或治疗性作用而言不是必需的。
[0198]
益生元
[0199]
益生元是选择性发酵的成分,所述成分允许对宿主安宁和健康赋予中性或积极益处的胃肠微生物群的组成和/或活性的特定变化。益生元可包括对细菌组合物的存活、定殖和持久性有用的复合碳水化合物、氨基酸、肽或其它营养组分。益生元包括但不限于氨基酸、生物素、低聚果糖、低聚半乳糖、菊粉、乳果糖、甘露聚糖寡糖、富含果寡糖的菊粉、果寡
糖、右旋寡糖、塔格糖、反式低聚半乳糖和低聚木糖。
[0200]
合适的益生元通常是植物来源的复合碳水化合物、寡糖或多糖。一般而言,益生元是不可消化的或难以被人消化,并且充当细菌的食物来源。可用于本文提供的药物剂型和药物组合物中的益生元包括但不限于:低聚半乳糖(gos)、反式低聚半乳糖、低聚果糖或果寡糖(fos)、菊粉、富含果寡糖的菊粉、乳果糖、阿糖基木聚糖、低聚木糖(xos)、甘露寡糖、瓜尔胶、阿拉伯树胶、塔格糖、直链淀粉、支链淀粉、木聚糖、果胶等,以及它们的组合。益生元可存在于某些食物中,例如菊苣根、菊芋(jerusalem artichoke)、蒲公英嫩叶(dandelion greens)、大蒜、韭菜、洋葱、芦笋、麦麸、小麦粉、香蕉、牛奶、酸奶、高粱、牛蒡、西兰花、抱子甘蓝(brussels sprouts)、卷心菜、花椰菜、绿叶羽衣甘蓝(collard greens)、羽衣甘蓝、萝卜和芜青甘蓝和味噌。或者,益生元可为纯化的或化学合成的或酶促合成的。
[0201]
在一些实施方案中,所述组合物包含至少一种益生元。在一个实施方案中,益生元是碳水化合物。在一些实施方案中,所述组合物包含益生元混合物,所述益生元混合物包含至少一种碳水化合物。碳水化合物是糖或糖的聚合物。术语“糖”、“多糖”、“碳水化合物”和“寡糖”可互换使用。大多数碳水化合物是具有许多羟基的醛类或酮类,通常在分子的每个碳原子上具有一个羟基。碳水化合物通常具有分子式(ch2o)n。碳水化合物可以是单糖、二糖、三糖、寡糖或多糖。最基本的碳水化合物是单糖,如葡萄糖、蔗糖、半乳糖、甘露糖、核糖、阿拉伯糖、木糖和果糖。二糖是两个连接的单糖。示例性二糖包括蔗糖、麦芽糖、纤维二糖和乳糖。通常,寡糖包括三个与六个之间的单糖单元(例如棉子糖、水苏糖),并且多糖包括六个或更多个单糖单元。示例性多糖包括淀粉、糖原和纤维素。碳水化合物可含有经修饰的糖单元,如2
’‑
脱氧核糖(其中羟基被移除)、2
’‑
氟代核糖(其中羟基被氟置换)或n
‑
乙酰基葡糖胺、含氮形式的葡萄糖(例如,2
’‑
氟代核糖、脱氧核糖和己糖)。碳水化合物可以许多不同形式存在,例如构象异构体、环状形式、无环形式、立体异构体、互变异构体、端基异构体和异构体。碳水化合物可由天然(例如植物或微生物)来源纯化(即,它们是酶促合成的),或者它们可以是化学合成或修饰的。
[0202]
合适的益生元碳水化合物可包括碳水化合物,碳水化合物单体,碳水化合物低聚物或碳水化合物聚合物中的一种或多种。在某些实施方案中,药物组合物或剂型包含至少一种类型的微生物和至少一种类型的不可消化的糖,其包括不可消化的单糖、不可消化的低聚糖或不可消化的多糖。在一个实施方案中,低聚糖或多糖的糖单元可连接在单个直链中,或者可以是具有一个或多个侧支的链。低聚糖或多糖的长度可因来源而异。在一个实施方案中,链中也可含有少量的葡萄糖。在另一个实施方案中,益生元组合物可被部分水解或含有作为初级低聚糖的组分的单独糖部分(参见例如美国专利号8,486,668)。
[0203]
益生元碳水化合物可包括但不限于单糖(例如,丙糖、丁糖、戊糖、戊醛糖、戊酮糖、己糖、环状半缩醛、己酮糖、庚糖)及其多聚体,以及其差向异构体、环状异构体、立体异构体和端基异构体。单糖的非限制性实例包括(处于l
‑
构象或d
‑
构象)甘油醛、苏糖、核糖、阿卓糖、葡萄糖、甘露糖、塔罗糖、半乳糖、古洛糖(gulose)、艾杜糖、来苏糖、阿拉伯糖、木糖、阿洛糖、赤藓糖、赤藓酮糖、塔格酮糖(tagalose)、山梨糖、核酮糖、阿洛酮糖、木酮糖、果糖、二羟基丙酮以及它们的环状(α或β)形式。其多聚体(二糖、三糖、低聚糖、多糖)包括但不限于:蔗糖、乳糖、麦芽糖、乳果糖、海藻糖、纤维二糖、曲二糖、黑曲霉糖(nigerose)、异麦芽糖、槐糖、昆布二糖、龙胆二糖(gentioboise)、松二糖、麦芽酮糖、帕拉金糖、龙胆二酮糖
(gentiobiulose)、甘露二糖、车前二糖(melibiulose)、芸香糖、rutinulose、木二糖、樱草糖、直链淀粉、支链淀粉、淀粉(包括抗性淀粉)、甲壳素、纤维素、琼脂、琼脂糖、木聚糖、糖原、细菌多糖(如荚膜多糖、lps和肽聚糖)以及生物膜胞外多糖(例如藻酸盐、eps))、n
‑
连接的聚糖以及o
‑
连接的聚糖。可对益生元糖进行修饰,并且碳水化合物衍生物包括氨基糖(例如唾液酸、n
‑
乙酰基葡糖胺、半乳糖胺)、脱氧糖(例如鼠李糖、岩藻糖、脱氧核糖)、磷酸糖、葡基胺(glycosylamine)、糖醇以及酸性糖(例如葡糖醛酸、抗坏血酸)。
[0204]
在一个实施方案中,药物组合物的益生元碳水化合物组分基本上由一种或多种不可消化的糖组成。
[0205]
在一个实施方案中,药物组合物的益生元碳水化合物组分允许定期维持共生结肠微生物群,所述微生物群包含与健康状态的微生物组相关的微生物或者呈现患者发展自身免疫性或炎性性疾患的低风险。在一个实施方案中,益生元碳水化合物允许一种或多种共同施用或共同配制的微生物在哺乳动物受试者中移植、生长和/或定期维持。
[0206]
在一些实施方案中,哺乳动物受试者是人受试者,例如患有或疑似患有食物过敏的人受试者。在一些实施方案中,益生元有利于所施用的微生物的生长,其中所施用的微生物的生长和/或由所施用的微生物进行的所施用的益生元发酵减缓或减少病原体或致病有机体的生长。例如,fos、neosugar或菊粉促进结肠中产酸菌(如属于乳杆菌属或双歧杆菌属的细菌)的生长,并且嗜酸乳杆菌和两歧双歧杆菌可在减少结肠中的病原性细菌的数量方面发挥作用(参见例如,美国专利号8,486,668)。还已知其它聚合物,例如各种半乳聚糖,乳果糖和碳水化合物基胶,例如车前草,瓜尔胶,角叉菜胶,结冷胶和魔芋,可改善胃肠道(gi)健康。还已知其它聚合物,如各种半乳聚糖、乳果糖以及基于碳水化合物的树胶(如车前草、瓜尔胶、卡拉胶(carrageen)、结冷胶和魔芋))可改善胃肠(gi)健康。
[0207]
在一些实施方案中,益生元包括以下中的一者或多者:gos、乳果糖、棉子糖、水苏糖、低聚乳果糖、fos(即果寡糖或寡果聚糖(oligofructan))、菊粉、低聚异麦芽糖、低聚木糖、低聚帕拉金糖、反式半乳糖基化寡糖(即反式半乳寡糖)、反式半乳糖苷二糖(transgalactosylate disaccharides)、大豆低聚糖(即soyoligosaccharides)、低聚龙胆糖、低聚葡萄糖、果胶低聚糖、帕拉金糖缩聚物、二果糖酐iii、山梨醇、麦芽糖醇、乳糖醇、多元醇、聚右旋糖、还原型帕拉金糖、纤维素、β
‑
葡萄糖、β
‑
半乳糖、β
‑
果糖、毛蕊花糖、肌醇半乳糖苷和β
‑
葡聚糖、瓜尔胶、果胶、高、海藻酸钠以及λ卡拉胶,或它们的混合物。gos可以是短链gos、长链gos或它们的任何组合。fos可以是短链fos、长链fos或它们的任何组合。
[0208]
在一些实施方案中,益生元组合物包含处于至少1:1、至少2:1、至少5:1、至少9:1、至少10:1、约20:1或至少20:1的混合物中的两种碳水化合物种类(非限制性实例是gos和fos)。
[0209]
在一些实施方案中,益生元包含一种或多种不可消化的寡糖、不可消化的多糖、游离单糖、不可消化的糖、淀粉或非淀粉多糖的混合物。
[0210]
寡糖通常被认为具有还原端和非还原端,无论位于还原端的糖是否实际上是还原糖。本文所述的大部分寡糖用以下方式来描述:非还原糖的名称或缩写(例如gal或d
‑
gal),前接或后接糖苷键构型(α或β)、环键、参与所述键的还原糖的环位置,然后是还原糖的名称或缩写(例如glc或d
‑
glc)。两个糖单元之间的键联(例如,糖苷键联、半乳糖苷键联、葡糖苷键联)可表示为例如1,4、1
‑
>4或(1
‑
4)。
[0211]
fos和gos两者都是不可消化的糖。糖的β糖苷键联(如但不限于在fos和gos中存在的那些)使得这些益生元主要在胃和小肠中不可消化且不可吸收。α
‑
连接的gos(α
‑
gos)也无法被人唾液淀粉酶水解,但可被两歧双歧杆菌和丁酸梭菌利用(yamashita a.等人,2004.j.appl.glycosci.51:115
‑
122)。fos和gos可基本完整地穿过小肠并进入大肠(结肠),除了在作为药物组合物的一部分所施用的共生微生物和微生物能够代谢寡糖的地方。
[0212]
gos(也称为半乳寡糖(galacto
‑
oligosaccharides)、低聚半乳糖(galactooligosaccharides)、反式低聚糖(tos)、反式半乳寡糖(trans
‑
galacto
‑
oligosaccharide(tgos)和反式低聚半乳糖)是半乳糖分子的低聚物或聚合物,主要以葡萄糖结尾或有时以半乳糖分子结尾,并且具有不同的聚合度(dp通常介于2
‑
20之间)和键联类型。在一个实施方案中,gos包含半乳糖分子和葡萄糖分子。在另一个实施方案中,gos仅包含半乳糖分子。在另一实施方案中,gos是[β
‑
d
‑
gal
‑
(1
‑
6)]
n
‑
β
‑
d
‑
gal
‑
(1
‑
4)
‑
d
‑
glc(其中n是2
‑
20)形式的含半乳糖的寡糖。在另一个实施方案中,gos是glcα1
‑4‑
[βgal 1
‑
6)]
n
(其中n=2
‑
20)形式的含半乳糖的寡糖。在另一个实施方案中,gos呈α
‑
d
‑
glc(1
‑
4)
‑
[β
‑
d
‑
gal
‑
(1
‑
6)
‑
]
n
的形式,其中n=2
‑
20。gal是吡喃半乳糖单元,并且glc(或glu)是吡喃葡萄糖单元。
[0213]
在一个实施方案中,益生元组合物包含gos相关化合物。gos相关化合物可具有以下性质:a)“乳糖”部分;例如具有gal
‑
glu部分以及任何聚合值或键联类型的gos;或b)对人gi道中的“乳糖发酵”微生物是刺激性的;例如,棉子糖(gal
‑
fru
‑
glu)是对乳酸杆菌和双歧杆菌两者均有刺激性的“相关”gos化合物。
[0214]
在gos和其它寡糖中发现的单独糖单元之间的键联包括β
‑
(1
‑
6)键联、β
‑
(1
‑
4)键联、β
‑
(1
‑
3)键联和β
‑
(1
‑
2)键联。在一个实施方案中,所施用的寡糖(例如gos)是支链糖。在另一个实施方案中,所施用的寡糖(例如gos)是直链糖。
[0215]
α
‑
gos(也称为α
‑
键gos或α
‑
连接的gos)是具有α
‑
吡喃半乳糖基的寡糖。α
‑
gos在糖单元之间包含至少一个α糖苷键联。α
‑
gos通常表示为α
‑
(gal)
n
(n通常表示2至10的整数)或α
‑
(gal)
n
glc(n通常表示1至9的整数)。实例包括α
‑
半乳糖基葡萄糖、α
‑
半乳二糖、α
‑
半乳三糖、α
‑
半乳四糖和更高级寡糖的混合物。另外的非限制性实例包括蜜二糖、甘露三糖、棉子糖、水苏糖等,它们可由甜菜、大豆寡糖等产生。
[0216]
市售的和酶合成的α
‑
gos产物也可用于本文所述的组合物中。使用半乳糖、含半乳糖的物质或葡萄糖作为底物,利用α
‑
半乳糖苷酶的脱水缩合反应,用酶合成α
‑
gos。含半乳糖的物质包括含半乳糖的物质的水解产物(例如,通过使β
‑
半乳糖苷酶作用于乳糖而获得的半乳糖和葡萄糖的混合物)等。葡萄糖可与半乳糖单独混合,并且可用作α
‑
半乳糖苷酶的底物(参见例如,wo 02/18614)。已经描述了制备α
‑
gos的方法(参见例如,ep 514551和ep2027863)。
[0217]
在一个实施方案中,gos组合物包含糖的混合物,所述糖是α
‑
gos和使用β
‑
半乳糖苷酶通过转半乳糖基化(transgalactosylation)产生的糖。在另一个实施方案中,gos包含α
‑
gos。在另一个实施方案中,α
‑
gos包含10重量%至100重量%的
‑
(gal)2。在一个实施方案中,gos仅包含使用β
‑
半乳糖苷酶通过转半乳糖基化产生的糖。
[0218]
在一个实施方案中,除了一种或多种微生物之外,药物组合物还包含寡糖组合物,所述寡糖组合物是包含1重量%
‑
20重量%的二糖、1重量%
‑
20重量%的三糖、1重量%
‑
20
重量%的四糖和1重量%
‑
20重量%的五糖的寡糖混合物。在另一个实施方案中,寡糖组合物是基本上由1重量%
‑
20重量%的二糖、1重量%
‑
20重量%的三糖、1重量%
‑
20重量%的四糖和1重量%
‑
20重量%的五糖组成的寡糖混合物。
[0219]
在一个实施方案中,益生元组合物是寡糖的混合物,所述寡糖混合物包含1重量%
‑
20重量%的聚合度(dp)为1
‑
3的糖、1重量%
‑
20重量%的dp为4
‑
6的糖、1重量%
‑
20重量%的dp为7
‑
9的糖以及1重量%
‑
20重量%的dp为10
‑
12的糖、1重量%
‑
20重量%的dp为13
‑
15的糖。
[0220]
在另一个实施方案中,益生元组合物包含寡糖的混合物,所述寡糖混合物包含50重量%
‑
55重量%的二糖、20重量%
‑
30重量%的三糖、10重量%
‑
20重量%的四糖以及1重量%
‑
10重量%的五糖。在一个实施方案中,gos组合物是寡糖的混合物,所述寡糖混合物包含52重量%的二糖、26重量%的三糖、14重量%的四糖和5重量%的五糖。在另一个实施方案中,益生元组合物包含寡糖的混合物,所述寡糖混合物包含45重量%
‑
55重量%的三糖、15重量%
‑
25重量%的四糖、1重量%
‑
10重量%的五糖。
[0221]
在某些实施方案中,所述组合物包含中性和酸性寡糖的混合物,如例如在wo 2005/039597(n.v.nutricia)和美国专利申请20150004130中所公开的。在一个实施方案中,酸性寡糖具有介于1与5000之间的聚合度(dp)。在另一个实施方案中,dp介于1与1000之间。在另一个实施方案中,dp介于2与250之间。如果使用具有不同聚合度的酸性寡糖的混合物,则所述酸性寡糖混合物的平均dp优选介于2与1000之间。酸性寡糖可以是同质或异质的碳水化合物。酸性寡糖可由以下物质制备:果胶、果胶酸盐、海藻酸盐、软骨素、透明质酸、肝素、乙酰肝素(heparane)、细菌性碳水化合物、唾液酸聚糖(sialoglycans)、岩藻依聚糖、低聚岩藻糖或卡拉胶,并且优选由果胶或海藻酸盐制备。酸性寡糖可通过在例如wo 01/60378中描述的方法来制备,所述专利特此以引用的方式并入。酸性寡糖优选由高甲氧基化的果胶制备,所述果胶的特征在于甲氧基化度高于50%。如本文所用,“甲氧基化度”(也称为de或“酯化度”)是指在聚半乳糖醛酸链中所含有的游离羧酸基被酯化(例如,通过甲基化)的程度。在一些实施方案中,酸性寡糖的甲氧基化度高于约10%、高于约20%、高于约50%、高于约70%。在一些实施方案中,酸性寡糖的甲基化度高于约10%、高于约20%、高于约50%、高于约70%。
[0222]
中性寡糖是单糖单元的聚合度超过2、超过3、超过4、或超过10,在肠内不被消化或通过人上消化道(小肠和胃)中存在的酸或消化酶的作用仅被部分消化、但通过人肠菌群发酵并优选缺少酸性基团的糖。中性寡糖在结构上(化学上)不同于酸性寡糖。中性寡糖是寡糖的聚合度低于60个单糖单元的糖。单糖单元是具有闭环结构的糖单元,例如吡喃糖或呋喃糖形式。在一些实施方案中,基于其中所含有的单糖单元的总数计算,中性寡糖包含至少90%或至少95%的单糖单元,所述单糖单元选自由以下组成的组:甘露糖、阿拉伯糖、果糖、岩藻糖、鼠李糖、半乳糖、
‑
d
‑
吡喃半乳糖、核糖、葡萄糖、木糖以及它们的衍生物。合适的中性寡糖优选通过肠道菌群而发酵。合适的中性寡糖的非限制性实例是:纤维二糖(4
‑
o
‑
β
‑
d
‑
吡喃葡萄糖基
‑
d
‑
葡萄糖)、纤维糊精((4
‑
o
‑
β
‑
d
‑
吡喃葡萄糖基)n
‑
d
‑
葡萄糖)、β
‑
环糊精(α
‑1‑
4连接的d
‑
葡萄糖的环状分子;α
‑
环糊精
‑
六聚体、β
‑
环糊精
‑
七聚体和γ
‑
环糊精
‑
八聚体)、难消化性糊精、低聚龙胆糖(β
‑1‑
6连接的葡萄糖残基的混合物,一些是1
‑
4键联连接的)、低聚葡萄糖(α
‑
d
‑
葡萄糖的混合物)、低聚异麦芽糖(线性α
‑1‑
6连接的葡萄糖残基,一
些是1
‑
4键联连接的)、异麦芽糖(6
‑
o
‑
α
‑
d
‑
吡喃葡萄糖基
‑
d
‑
葡萄糖);异麦芽三糖(6
‑
o
‑
α
‑
d
‑
吡喃葡萄糖基
‑
(1
‑
6)
‑
α
‑
d
‑
吡喃葡萄糖基
‑
d
‑
葡萄糖)、潘糖(6
‑
o
‑
α
‑
d
‑
吡喃葡萄糖基
‑
(1
‑
6)
‑
α
‑
d
‑
吡喃葡萄糖基
‑
(1
‑
4)
‑
d
‑
葡萄糖)、明串珠菌二糖(5
‑
o
‑
α
‑
d
‑
吡喃葡萄糖基
‑
d
‑
吡喃果糖苷)、帕拉金糖或异麦芽酮糖(6
‑
o
‑
α
‑
d
‑
吡喃葡萄糖基
‑
d
‑
果糖)、theanderose(o
‑
α
‑
d
‑
吡喃葡萄糖基
‑
(1
‑
6)
‑
o
‑
α
‑
d
‑
吡喃葡萄糖基
‑
(1
‑
2)
‑
b
‑
d
‑
呋喃果糖苷)、d
‑
塔格糖(d
‑
agatose)、d
‑
来苏
‑
己酮糖(d
‑
lyxo
‑
hexylose)、低聚乳果糖(o
‑
β
‑
d
‑
吡喃半乳糖基
‑
(1
‑
4)
‑
o
‑
α
‑
d
‑
吡喃葡萄糖基
‑
(1
‑
2)
‑
β
‑
d
‑
呋喃果糖苷)、α
‑
低聚半乳糖(包括棉子糖、水苏糖以及其它大豆寡糖)(o
‑
α
‑
d
‑
吡喃半乳糖基
‑
(1
‑
6)
‑
α
‑
d
‑
吡喃葡萄糖基
‑
β
‑
d
‑
呋喃果糖苷)、β
‑
低聚半乳糖或反式半乳寡糖(β
‑
d
‑
吡喃半乳糖基
‑
(1
‑
6)
‑
[β
‑
d
‑
吡喃葡萄糖基]n
‑
(1
‑
4)α
‑
d葡萄糖)、乳果糖(4
‑
o
‑
β
‑
d
‑
吡喃半乳糖基
‑
d
‑
果糖)、4'
‑
半乳糖基乳糖(galatosyllactose)(β
‑
d
‑
吡喃半乳糖基
‑
(1
‑
4)
‑
o
‑
β
‑
d
‑
吡喃葡萄糖基
‑
(1
‑
4)
‑
d
‑
吡喃葡萄糖)、合成低聚半乳糖(新半乳二糖(neogalactobiose)、异半乳二糖(isogalactobiose)、galsucrose、异乳糖i、异乳糖ii和异乳糖iii)、左聚糖型果聚糖(fructans
‑
levan
‑
type)(β
‑
d
‑
(2
→
6)
‑
呋喃果糖基)nα
‑
d
‑
吡喃葡萄糖苷)、菊粉型果聚糖(β
‑
d
‑
((2
→
1)
‑
呋喃果糖基)nα
‑
d
‑
吡喃葡萄糖苷)、1f
‑
β
‑
呋喃果糖基蔗果四糖(fructofuranosylnystose)(β
‑
d
‑
((2
→
1)
‑
呋喃果糖基)n b
‑
d
‑
呋喃果糖苷)、低聚木糖(b
‑
d
‑
((1
→
4)
‑
木糖)n)、lafinose、低聚乳果糖以及低聚阿拉伯糖(arabinooligosaccharides)。
[0223]
在一些实施方案中,中性寡糖选自由以下组成的组:果聚糖、低聚果糖、难消化性糊精低聚半乳糖(包括反式低聚半乳糖)、低聚木糖、低聚阿拉伯糖、低聚葡萄糖、低聚甘露糖、低聚岩藻糖以及它们的混合物。
[0224]
合适的寡糖及其生产方法进一步描述于k.j.m.(laere,k.j.m.,degradation of structurally different non
‑
digestible oligosaccharides by intestinal bacteria:glycosylhydrolases of bi.adolescentis.phd
‑
thesis(2000),wageningen agricultural university,wageningen,the netherlands)中,所述文献的全部内容特此以引用的方式并入)。反式低聚半乳糖(tos)例如以商标vivinal
tm
(borculo domo ingredients,netherlands)出售。可由玉米淀粉的热解而产生的难消化性糊精包含如天然淀粉中存在的α(1
→
4)和α(1
→
6)糖苷键,并且含有1
→
2和1
→
3键联以及左旋葡聚糖。由于这些结构特性,难消化性糊精含有充分开发的能够被人消化酶部分水解的支化颗粒(branched particles)。许多其它商业来源的难消化性寡糖易于获得并且为本领域技术人员所知。例如,反式低聚半乳糖可从日本东京的yakult honsha co.获得。大豆寡糖可从ajinomoto u.s.a.inc.,teaneck,n.j.分销的calpis corporation获得。
[0225]
在另一实施方案中,本文所述的药物组合物的益生元混合物包含dp介于1与5000之间的酸性寡糖,其由果胶、海藻酸盐以及它们的混合物制备;和中性寡糖,其选自以下组中:果聚糖、低聚果糖、难消化性糊精、低聚半乳糖(包括反式低聚半乳糖)、低聚木糖、低聚阿拉伯糖、低聚葡萄糖、低聚甘露糖、低聚岩藻糖以及它们的混合物。
[0226]
在某些实施方案中,益生元混合物包含木糖。在其它实施方案中,益生元混合物包含木糖聚合物(即木聚糖)。在一些实施方案中,益生元包含木糖衍生物,如木糖醇(通过木糖的催化氢化还原木糖而产生的糖醇)以及木糖低聚物(例如低聚木糖)。虽然经由木糖基转移酶活性,木糖可被人消化,但人所摄入的大部分木糖都被排泄到尿液中。相比之下,一
些微生物在木糖代谢方面有效或者可被选择用于增强的木糖代谢。微生物木糖代谢可通过至少四种途径发生,所述途径包括异构酶途径、weimburg途径、dahms途径以及对真核微生物而言,氧化还原酶途径。
[0227]
木糖异构酶途径涉及通过木糖异构酶直接将d
‑
木糖转化为d
‑
木酮糖,之后通过木酮糖激酶将d
‑
木酮糖磷酸化得到d
‑
木酮糖
‑5‑
磷酸(戊糖磷酸途径的中间体)。
[0228]
在weimberg途径中,d
‑
木糖通过d
‑
木糖脱氢酶被氧化成d
‑
木糖酸
‑
内酯。然后,d
‑
木糖脱氢酶被内酯酶水解得到d
‑
木糖酸,并且木糖酸脱水酶活性然后得到2
‑
酮基
‑3‑
脱氧
‑
木糖酸。weimberg途径的最终步骤是形成2
‑
酮戊二酸半醛的脱水酶反应和形成2
‑
酮戊二酸(krebs循环的中间体)的氧化反应。
[0229]
dahms途径遵循与weimberg途径相同的机制,但一旦其产生了2
‑
酮基
‑3‑
脱氧
‑
木糖酸就分叉。在dahms途径中,醛缩酶将2
‑
酮基
‑3‑
脱氧
‑
木糖酸分解成丙酮酸和乙醇醛。
[0230]
木糖氧化还原酶途径(也称为木糖还原酶
‑
木糖醇脱氢酶途径)首先通过木糖还原酶将d
‑
木糖还原成木糖醇,然后通过木糖醇脱氢酶将木糖醇氧化成d
‑
木酮糖。与异构酶途径一样,氧化还原酶途径中的下一步是通过木酮糖激酶使d
‑
木酮糖磷酸化得到d
‑
木酮糖
‑5‑
磷酸。
[0231]
木糖存在于食物(如水果和蔬菜)以及其它植物(如用于木材和纸浆生产的树)中。因此,可在此类植物的提取物中获得木糖。可使用已知的方法(包括酸水解、然后各种类型的色谱法),从各种植物来源获得木糖。用于产生木糖的此类方法的实例包括描述于以下文献中的那些方法:maurelli,l.等人(2013),appl.biochem.biotechnol.170:1104
‑
1118;hooi h.t等人(2013),appl.biochem.biotechnol.170:1602
‑
1613;zhang h
‑
j.等人(2014),bioprocess biosyst.eng.37:2425
‑
2436。
[0232]
聚生体成分的培养和储存
[0233]
为了库存(banking),细菌组合物中所含的物种可为:(1)直接分离自样本或取自库存的原种;(2)任选地在支持生长的营养琼脂或肉汤上进行培养,以产生活的生物量;以及(3)将所述生物量以多个等份任选地保存,以长期储存。
[0234]
在使用培养步骤的实施方案中,琼脂或肉汤含有营养素,所述营养素提供促使生长的必需元素和特定因子。实例将是由以下组成的培养基:20g/l葡萄糖、10g/l酵母提取物、10g/l大豆蛋白胨、2g/l柠檬酸、1.5g/l磷酸二氢钠、100mg/l柠檬酸铁铵、80mg/l硫酸镁、10mg/l氯化氯高铁血红素、2mg/l氯化钙和1mg/l甲萘醌。各种微生物学培养基及变型为本领域所熟知(例如r.m.atlas,handbook of microbiological media(2010)crc press)。培养基可在开始时添加到培养物中,可在培养期间添加,或者可在整个培养期间间歇地/连续地流动。可将细菌组合物中的物种以细菌组合物的子集或以包含细菌组合物的完整集合形式进行单独培养。作为一个实例,在混合连续培养中,可以低于任一细胞的最大生长速率的稀释率将第一菌株与第二菌株共同培养,以防止培养物免于培养的洗出。
[0235]
在有利的条件下将接种的培养物孵育足以建立生物量的时间。对于人使用的细菌组合物,这通常为值与正常人小生境(niche)相似的正常体温(37℃)、ph和其它参数。可对环境进行主动控制、被动控制(例如通过缓冲剂)、或者允许漂移。例如,对于厌氧细菌组合物(例如肠道微生物群),可采用缺氧/还原环境。这可通过向肉汤中添加还原剂/还原因子(如半胱氨酸)和/或剥离其中的氧来实现。作为一个实例,细菌组合物的培养物可在37℃、
ph 7下在用1g/l半胱氨酸
·
hcl预还原的上述培养基中生长。
[0236]
当培养物产生了足够的生物量时,可将其保存以用于库存或储存。可将生物体放置于防止冷冻(添加
‘
冷冻保护剂’)、干燥(
‘
冻干保护剂’)和/或渗透休克(
‘
渗透保护剂(osmoprotectants)’)的化学环境中,分装至多个(任选相同的)容器中以建立统一的库,然后处理所述培养物以用于保存。容器通常是不可渗透的并且具有确保与环境隔离的封闭件。冷冻保存处理通过在超低温(例如
‑
80℃或
‑
80℃以下)下冷冻液体来实现。干燥保存通过蒸发(在喷雾干燥或
‘
冷干燥’的情况下)或通过升华(例如,对于冷冻干燥、喷雾冷冻干燥而言)从培养物中移除水。移除水可改善在高于上述低温的温度下的长期细菌组合物储存稳定性。如果细菌组合物包含形成孢子的物种,并且导致孢子产生,则最终组合物可通过另外的手段(如梯度密度离心)进行纯化,然后使用上述技术保存。细菌组合物库存可通过将物种分别培养和保存来实现,或者通过将物种混合在一起以建立组合库来实现。作为冷冻保存的实例,可通过以下方式收获细菌组合物培养物:离心以使细胞从培养基中沉淀出来,倾析上清液并用含15%甘油的新鲜培养肉汤更换。然后将培养物等分至1ml冷冻管中,密封并置于
‑
80℃,以保持长期活力。当从冷冻储存中恢复时,这种程序实现可接受的活力。
[0237]
可使用与库存类似的培养步骤(包括培养基组成和培养条件)进行生物体生产。它可较大规模的操作来实施,特别是用于临床开发或商业生产。在较大规模下,在最终培养之前可存在细菌组合物的数次传代培养。在培养结束时,收获培养物以使得能够进一步配制成用于施用的剂型。这可能涉及浓缩、移除不需要的培养基组分,和/或引入到保存细菌组合物并使其对于经由选择的途径施用而言是可接受的化学环境中。例如,可将细菌组合物培养至浓度为10
10
cfu/ml,然后通过切向流微量过滤浓缩20倍;用完的培养基可通过用保存培养基(由2%明胶、100m m海藻糖和10mm磷酸钠缓冲剂组成)渗滤进行交换。然后,可将悬浮液冷冻干燥成粉末并进行滴定。
[0238]
干燥后,可将粉末掺混至适当的效价,与其它培养物和/或填充剂(如微晶纤维素)混合以为了一致且便于处理,并且如本文所提供配制细菌组合物。
[0239]
在一个实施方案中,包含如本文所述的微生物聚生体的组合物不是粪便移植物。在一些实施方案中,在纯化的群体中存在的所有或基本上所有的细菌实体最初获自粪便材料,并且随后例如为了生产药物组合物,使其在如本文所述或本领域已知的培养中生长。在一个实施方案中,如本文所述,细菌细胞从细菌原种进行培养并纯化。在一个实施方案中,对细菌细胞的每个群体独立地进行培养和纯化,例如每个群体单独进行培养,且随后混合在一起。在一个实施方案中,对组合物中的细菌细胞的群体中的一个或多个进行共培养。
[0240]
剂量、施用和制剂
[0241]
在一些实施方案中,可在包含微生物聚生体的组合物中施用例如在2
‑
5x105个或更多个(例如1x106个、1x107个、1x108个、5x108个、1x109个、5x109个、1x10
10
个、5x10
10
个或更多个)范围内的细胞。细菌的剂量范围取决于效价,并且包括大到足以产生所需作用(例如经治疗受试者中食物过敏的至少一种症状减轻)的量。剂量不应太大以至于引起不可接受的不良副作用。一般而言,剂量将随疾病的类型以及患者的年龄、状况和性别而变化。剂量可由本领域的技术人员确定,并且在任何并发症的情况下也可由个别医师进行调整。
[0242]
为了在本文所述的各个方面中使用,如本文所述的组合物中有效量的细胞包含至少102个细菌细胞、至少1x103个细菌细胞、至少1x104个细菌细胞、至少1x105个细菌细胞、至
少1x106个细菌细胞、至少1x107个细菌细胞、至少1x108个细菌细胞、至少1x109个细菌细胞、至少1x10
10
个细菌细胞、至少1x10
11
个细菌细胞、至少1x10
12
个细菌细胞或更多。当从对选定食物过敏原耐受的受试者分离和/或纯化微生物聚生体时,细菌细胞可来源于一个或多个供体,或者可从自体来源获得。在本文所述的方面的一些实施方案中,在向有需要的患者施用之前,将微生物聚生体的细胞在培养中进行扩增或维持。在一个实施方案中,微生物聚生体获自微生物库。治疗性或预防性/防治性聚生体的成员通常一起施用(例如以单一掺混物的形式)。然而,本文具体考虑了给定聚生体的成员可作为单独剂型或聚生体成员的子混合物或子组合施用。因此,对例如6个成员的聚生体而言,所述聚生体可例如作为包含所有6个成员的单一制剂(在一个或多个剂量单位,例如一个或多个胶囊中)或者作为两个或更多个单独制剂进行施用,所述两个或更多个单独制剂合起来包含给定聚生体的所有成员。虽然作为单一掺混物施用是优选的,但是对于聚生体的每个成员而言,使用例如单独单元的潜在优点是可通过选择例如合起来包含所需聚生体的单个物种剂量单元对的适当组合对向任何给定受试者施用的实际物种根据需要进行调整。
[0243]
所施用的物种的生物量(每剂量)对比已知的体内生物量:本文考虑将聚生体组合物配制成递送比“健康”个体中共生生物体的正常生物量更大的生物量。例如,与健康个体中的正常生物量(如表1第3栏和第4栏所示)相比,考虑用于递送和定殖的生物量的范围可见于表1第2栏。下表示出相对于所公开的具体部位处的数据,所施用的生物体的生物量的范围。要注意的是,在许多情况下,gustafsson,1982中的细菌定量是针对生物体的大体分类(如梭菌纲),并且将多种物种并入在那些标题下。因此,在具体部位处,聚生体中的个别物种可能少于实际报告的最高生物量;小肠和大肠生物量数据因此应当被认为是正常个体体内可能发生的上限。
[0244]
表1:将聚生体生物量与健康个体中共生生物体的生物量进行比较
[0245]
[0246][0247]
包含微生物聚生体的药物组合物可通过适于沉积在受试者(例如人、哺乳动物、动物等)的胃肠道、优选结肠中的任何方法来施用。施用途径的实例包括通过结肠镜检查、栓剂、灌肠剂、上部内视镜检查或上部推进式内窥镜检查的直肠施用。另外,可利用借助鼻胃管、鼻肠管或鼻空肠管经由鼻或口的插管术。还可利用通过固体的口服施用,所述固体如丸剂、片剂、悬浮剂、凝胶、凝胶片(geltab)、半固体、片剂、囊剂、锭剂或胶囊或微胶囊、或作为肠内制剂;或者所述固体被重新配制成液体、悬浮剂、凝胶、凝胶片、半固体、片剂、囊剂、锭剂或胶囊、或作为肠内制剂用于最终递送。本文还考虑了接种有本文所述的微生物聚生体的食品。组合物还可为经处理或未处理的粪便菌群,完整(或基本上完整的)的微生物群,或部分、基本上或完全分离的或纯化的粪便菌群,并且可冻干、冷冻干燥或冷冻,或者加工成粉末。
[0248]
在一些实施方案中,本文所述的组合物可以含有一种或多种药学上可接受的载体的形式进行施用。合适的载体是本领域众所周知的并且随所需的组合物施用形式和模式而变化。例如,药学上可接受的载体可包括稀释剂或赋形剂,如填充剂、粘合剂、湿润剂、崩解剂、表面活性剂、助流剂、润滑剂等。通常,载体可以是固体(包括粉末)、液体或它们的组合。各载体在与组合物中的其它成分相容并且对受试者无害的意义上优选“可接受的”。载体可以是生物学上可接受的并且是惰性的(例如,其允许组合物维持生物材料的活力直至递送至适当的部位)。
[0249]
口服组合物可包含惰性稀释剂或可食用载体。出于口服治疗施用的目的,活性化合物可与赋形剂合并,并且以片剂、锭剂、软锭剂、糖锭剂或胶囊剂(例如明胶胶囊)的形式使用。口服组合物也可通过将本公开的组合物与食物组合来制备。在一个实施方案中,用于施用的食物是冷的,例如冰镇的调味水。在某些实施方案中,食品不是潜在过敏原性食品(例如,不是大豆、小麦、花生、木本坚果、乳制品、蛋、贝类或鱼类)。可包含药学上相容的粘合剂和/或佐剂物质作为组合物的一部分。片剂、丸剂、胶囊剂、糖锭剂等可含有任何以下成分或具有类似性质的化合物:粘合剂,诸如微晶纤维素、黄芪胶或明胶;赋形剂,诸如淀粉或乳糖;崩解剂,诸如海藻酸、羟基乙酸淀粉钠(primogel)或玉米淀粉;润滑剂,诸如硬脂酸镁或sterotes;助流剂,诸如胶体二氧化硅;增甜剂,诸如蔗糖或糖精;或调味剂,诸如薄荷、水
杨酸甲酯、橙味调味剂或其它适合的调味剂。这些仅出于举例的目的,并且不旨在进行限制。
[0250]
还可将包含微生物聚生体的组合物制备成用于直肠递送的栓剂(如,使用常硅栓剂基质如可可油和其它甘油酯)或持留灌肠剂形式。可用将防止聚生体被机体快速消除的载体(如控释制剂,包括植入物)制备组合物。可使用可生物降解的、生物相容的聚合物,如乙烯乙酸乙烯酯、聚酐、聚乙醇酸、胶原、聚原酸酯以及聚乳酸。此类制剂可使用标准技术制备。所述材料也可从例如alza corporation和nova pharmaceuticals,inc.商业上获得。脂质体悬浮剂也可用作药学上可接受的载体。这些可根据本领域技术人员已知的方法制备。
[0251]
在一些实施方案中,可将组合物包封(例如,肠溶包衣制剂)。例如,当将口服施用该组合物时,将剂型配制成使得组合物在小肠之前不暴露至胃肠道中普遍存在的条件,例如胃中存在的高酸度和消化酶,这种制剂可将活细菌递送至小肠。用于治疗用途的组合物的包封在本领域中是常规的。包封可包括硬壳胶囊,其可用于干燥的粉末状成分;软壳胶囊。胶囊可由胶凝剂的水性溶液制成,如动物蛋白(例如明胶)、植物多糖或衍生物(如卡拉胶)、以及改性形式的淀粉和纤维素。可向胶凝剂溶液中添加其它成分,如增塑剂(例如甘油和/或山梨醇)、着色剂、防腐剂、崩解剂、润滑剂和表面处理剂。
[0252]
在一个实施方案中,用肠溶包衣对如本文所述的微生物聚生体进行配制。肠溶包衣可控制微生物聚生体在消化系统中释放的位置。因此,可使用肠溶包衣,以使得含有微生物聚生体的组合物不在胃(对许多微生物而言,其可能是有毒环境)中溶解和释放微生物,而是行进到小肠,在小肠中组合物溶解并将微生物释放在它们能够存活的环境中。肠溶包衣可以是在低ph下(如在胃中)稳定的,并且可在较高ph(例如在小肠中)下溶解。因此,肠溶包衣制剂还可允许将活细菌递送至小肠。可用于肠溶包衣的材料包括:例如,海藻酸、邻苯二甲酸乙酸纤维素、塑料、蜡类、虫胶以及脂肪酸(例如硬脂酸、棕榈酸)。肠溶包衣描述于例如美国专利号5,225,202、5,733,575、6,139,875、6,420,473、6,455,052和6,569,457,所述专利全部以引用的方式整体并入本文。肠溶包衣可以是水性肠溶包衣。可用于肠溶包衣的聚合物的实例包括:例如,虫胶(商品名emcoat 120n、marcoat 125);邻苯二甲酸乙酸纤维素(商品名aquacoat
tm
、aquacoat ecd
tm
、sepifilm
tm
、klucel
tm
和metolose
tm
);聚乙烯乙酸邻苯二甲酸酯(商品名sureteric
tm
);和甲基丙烯酸(商品名eudragit
tm
)。在一个实施方案中,将包含如本文所述的微生物聚生体的成员的肠溶包衣益生菌组合物施用于受试者。在另一个实施方案中,将肠溶包衣的益生菌和益生元组合物施用于受试者。
[0253]
适于直肠施用的制剂包括凝胶、霜剂、洗剂、水性或油性悬浮液、可分散的粉末或颗粒剂、乳液、可溶性固体材料、灌洗剂等。所述制剂优选提供为单位剂量的栓剂,所述栓剂包含形成栓剂基体的一种或多种固体载体(例如可可脂)中的活性成分。用于此类制剂的适合载体包括凡士林油、羊毛脂、聚乙二醇、醇类以及它们的组合。或者,可将具有本公开的快速重新定殖展开剂的结肠洗涤剂配制用于结肠或直肠施用。
[0254]
适于口服施用的制剂可以以下形式提供:离散单位,如片剂、胶囊、扁囊剂、糖浆、酏剂、制备的食品、微乳液、溶液、悬浮液、锭剂或凝胶包衣的安瓿,各自含有预定量的活性化合物;粉末或颗粒剂;处于水性液体或非水性液体中的溶液或悬浮液;或者水包油乳液或油包水乳液。
[0255]
在一些实施方案中,微生物聚生体可配制在食品中。与本文所述的方法和组合物
一起使用的食品的一些非限制性实例包括:冰棒、奶酪、奶油、巧克力、牛奶、肉、饮料、酸奶、腌渍蔬菜、开菲尔(kefir)、味噌、德国泡菜(sauerkraut)等。在其它实施方案中,所述食品可以是:果汁、清凉饮料、茶饮料、饮料制品、果冻饮料和功能性饮料;酒精饮料,如啤酒;含碳水化合物的食物,如大米食物产品、面条、面包和面食;酱制品(paste products),如鱼肉、火腿、香肠、海鲜类的酱制品;软罐头产品(retort pouch products),如咖喱、用粘稠的淀粉汁制做的食物和中式汤;汤;乳制品,如牛奶、乳制品饮料、冰淇淋、奶酪和酸奶;发酵制品,如发酵大豆酱、发酵饮料以及酱菜;豆制品;各种糖果产品,包括饼干、曲奇饼等、糖果、口香糖、胶质软糖、冷甜点(包括果冻、奶油焦糖和冷冻甜点);即食食物,如速溶汤和速食大豆汤;等等。优选在与微生物聚生体混合后不需要烹饪的食物制剂,以避免杀死微生物。
[0256]
微生物聚生体的制剂可通过任何适合的方法来制备,通常通过按所需的比例将聚生体与液体或细分的固体载体或二者均一地且紧密地混合,然后如果需要的话,将所得混合物成型为所需形状。此外,可对微生物聚生体进行处理以延长保质期,优选地将通过冷冻干燥使预定肠道菌群的保质期延长。
[0257]
在一些实施方案中,在对受试者进行治疗前,将如本文所述的微生物聚生体与一种或多种另外的益生菌生物体组合。如本文所用,益生菌是指至少形成瞬时或内源性的菌群或微生物聚生体的一部分并由此对宿主生物体表现出有益的预防性和/或治疗性作用的微生物。本领域技术人员已知益生菌通常是在临床上安全的(即非病原性的)。可用作本发明的益生菌的典型的产乳酸菌是有效的乳酸生产者,其包括生产细菌素(bacteriocins)或抑制病原性生物体生长的其它化合物的芽孢杆菌属的非病原性成员。
[0258]
示例性的产乳酸非病原性芽孢杆菌属物种包括但不限于:凝结芽孢杆菌、hammer凝结芽孢杆菌和短芽孢杆菌凝结亚种。
[0259]
示例性的产乳酸的乳杆菌属物种包括但不限于:嗜酸乳杆菌、干酪乳杆菌、乳杆菌dds
‑
1、乳杆菌gg、鼠李糖乳杆菌、植物乳杆菌、罗伊氏乳杆菌、格氏乳杆菌、詹氏乳杆菌、德氏乳杆菌、保加利亚乳杆菌、唾液乳杆菌以及芽孢乳杆菌(也称为凝结芽孢杆菌)。示例性产乳酸的芽孢乳杆菌属物种包括所有的芽孢乳杆菌属物种,例如芽孢乳杆菌p44。
[0260]
示例性产乳酸的双歧杆菌属物种包括但不限于:青春双歧杆菌、动物双歧杆菌、双歧双歧杆菌(bifidiobacterium bifidum)、两歧双歧杆菌(bifidiobacterium bifidus)、短双歧杆菌、婴儿双歧杆菌、bifidiobacterium infantus、长双歧杆菌及其任何遗传变体。
[0261]
合适的非产乳酸芽孢杆菌的实例包括但不限于:枯草芽孢杆菌、bacillus uniflagellatus、侧孢芽孢杆菌(bacillus lateropsorus)、侧孢芽孢杆菌bod、巨大芽孢杆菌、多粘芽孢杆菌、地衣芽孢杆菌、短小芽孢杆菌和嗜热脂肪芽孢杆菌。由于益生菌活性而可被采用的其它物种包括链球菌属(肠球菌属)的成员。例如,屎肠球菌通常被用作牲畜的益生菌,并因此可用作共同施用剂。此外,还意图,可将本领域已知的益生菌或营养细菌中的产酸物种中的任一种用于包含如本文所述的微生物聚生体的组合物中。
[0262]
包含如本文所述的微生物聚生体的营养补充剂可包括任何多种营养剂,包括维生素、矿物质、必需氨基酸和非必需氨基酸、碳水化合物、脂质、食品、膳食补充剂、短链脂肪酸等。优选的组合物包含处于任何组合的维生素和/或矿物质。用于本文所述的组合物中的维生素可包括维生素b、维生素c、维生素d、维生素e、叶酸、维生素k、烟酸以及类似的维生素。所述组合物可含有任一种或多种被认为对具体应用可能有用的维生素,并且因此维生素的
含量不应当被解释为限制性的。例如,典型的维生素是推荐用于日常消耗并处于推荐的日用量(rda)的维生素,尽管精确的量可能变化。所述组合物可优选包含以下物质的复合体:rda维生素、矿物质和微量矿物质,以及不具有已确立的rda但在健康人或哺乳动物生理学中具有有益作用的营养素。优选的矿物质形式将包括处于葡萄糖酸盐形式或柠檬酸盐形式的矿物质,因为这些形式更容易被乳酸菌代谢。在相关的实施方案中,考虑了使本文所述的组合物包含与活乳酸菌和待吸收的任何材料组合的微生物聚生体,所述待吸收的材料包括但不限于:营养补充剂、食品、维生素、矿物质、药物、治疗性组合物、抗生素、激素、类固醇以及类似化合物,其中期望确保将材料从胃肠道有效且健康地吸收进血液中。组合物中所含的材料的量可根据材料及吸收其的预期目的而广泛变化,因此所述组合物不应被认为是限制性的。
[0263]
在一些实施方案中,本文所述的组合物还可包含益生元和/或纤维。许多形式的纤维表现出一定水平的益生元作用。因此,可归类为“益生元”的物质与可归类为“纤维”的物质之间存在着相当程度的重叠。适合在所述组合物和方法中使用的益生元的非限制性实例包括:车前草、低聚果糖、菊粉、果寡糖、半乳寡糖、低聚异麦芽糖、低聚木糖、大豆寡糖、低聚葡萄糖、低聚甘露糖、阿拉伯半乳聚糖、阿糖基木聚糖、乳蔗糖、gluconannan、乳果糖、聚右旋糖、葡聚寡糖(oligodextran)、低聚龙胆糖、果胶寡糖、黄原胶、阿拉伯树胶、半纤维素、抗性淀粉及其衍生物、以及它们的混合物和/或组合。每天或者在不到一天的日程中,组合物可包含约100mg至约100g、可替代地约500mg至约50g、以及可替代地约1g至约40g的益生元。
[0264]
本文所述的技术方面还包括短链脂肪酸(scfa)和中链甘油三酯(mct)。短链脂肪酸可具有免疫调节(即免疫遏制)作用,因此它们的产生(即生物合成或通过发酵转化)有利于预防、控制、缓解和治疗自身免疫性病症和/或炎性病症(lara
‑
villoslada f.等人,2006.eur j nutr.45(7):418
‑
425)。在无菌小鼠和万古霉素处理的常规小鼠中,scfa(乙酸盐、丙酸盐或丁酸盐)的施用在大肠中恢复了t
reg
的正常数量(smith pm,等人science.2013;569
‑
573)。短链脂肪酸(scfa)由一些细菌产生,作为木糖发酵的副产物。scfa是由肠道微生物组(特别是梭菌科,包括梭菌属、瘤胃球菌属或布劳特菌属的成员)产生的最丰富的代谢物之一。在一些方面,药物组合物、剂型或药盒包含至少一种类型的微生物(例如,一种或多种微生物物种,如一种细菌物种或者多于一种特定微生物物种的菌株)和至少一种类型的益生元,从而使得所述组合物、剂型或药盒能够增加哺乳动物受试者中一种或多种免疫调节性scfa(例如乙酸盐、丙酸盐、丁酸盐或戊酸盐)的水平。任选地,所述药物组合物、剂型或药盒还包含一种或多种产scfa的发酵和/或生物合成途径的一种或多种底物。在某些实施方案中,向哺乳动物受试者施用所述组合物、剂型或药盒使哺乳动物受试者中一种或多种scfa增加了大约1.5倍、2倍、5倍、10倍、20倍、50倍、100倍或大于100倍。在一些实施方案中,生态失调由产生短链脂肪酸的微生物的缺乏引起。因此,在一些实施方案中,益生菌组合物可含有产生短链脂肪酸的细菌物种。
[0265]
mct从胃肠道被动扩散至门脉系统(较长的脂肪酸被吸收至淋巴系统中),而不需要像长链脂肪酸或超长链脂肪酸那样进行修饰。另外,mct不需要胆汁盐用于消化。用mct治疗患有营养不良或吸收不良综合征的患者,因为mct不需要能量来进行吸收、使用或储存。中链甘油三酯通常被认为是一种人体相当容易代谢的良好的生物惰性能量来源。它们在蛋白代谢中具有潜在的有益属性,但由于它们倾向于诱发生酮作用和代谢性酸中毒,在一些
情况下可能是禁用的。由于其能够被机体快速吸收的能力,中链甘油三酯已用于治疗各种吸收不良疾病。认为伴随低脂饮食的mct补充是治疗原发性肠淋巴管扩张症(waldmann's病)的基础。mct为肠胃外营养乳液中的成分。
[0266]
本文还考虑以最小限度包含微生物聚生体制剂(prep)或制剂(formulation)的药盒,所述微生物聚生体制剂制剂或制剂在掺混物中包含所有的聚生体成员,或者在子组合或子混合物中包含所有的聚生体成员。在一些实施方案中,药盒还包含由执业医生填充的空胶囊和/或用于肠溶包衣的一种或多种试剂(如胶囊)。本文还考虑了以干燥、冻干或粉末形式提供微生物制剂。
[0267]
在一个实施方案中,药盒包含选自由以下组成的组的至少两种物种:脆弱拟杆菌、卵形拟杆菌、普通拟杆菌、狄氏副拟杆菌和产黑色普雷沃菌。在另一个实施方案中,药盒包含选自由以下组成的组的物种中的至少三种、至少四种、至少五种或全部六种:多枝梭菌、闪烁梭菌、平野氏梭菌、双酶梭菌、柔嫩梭菌和萨尔迪纳梭菌。
[0268]
在另一个实施方案中,药盒包含选自由以下组成的组的至少两种、至少三种、至少四种或所有五种物种:脆弱拟杆菌、卵形拟杆菌、普通拟杆菌、狄氏副拟杆菌和产黑色普雷沃菌;以及选自由以下组成的组的至少一种、至少两种、至少三种、至少四种、至少五种或所有六种物种:多枝梭菌、闪烁梭菌、平野氏梭菌、双酶梭菌、柔嫩梭菌和萨尔迪纳梭菌。在另一个实施方案中,药盒包含至少一种还原剂(如n
‑
乙酰半胱氨酸、半胱氨酸或亚甲基蓝)用于使微生物在厌氧条件下生长、保持和/或包封。还考虑使本文所述的药盒包括用于扩增微生物制剂所需的细胞生长培养基和补充剂。还考虑本文所述的药盒包括如本文所述的一种或多种益生元。
[0269]
在施用细菌组合物之前,患者可任选地具有预处理方案以使胃肠道准备好接收细菌组合物。在某些实施方案中,预处理方案是可取的,如当患者急性感染有高度恢复力(resilient)病原体时。在其它实施方案中,预处理方案是完全任选的,例如当引起感染的病原体不具恢复力时,或者当患者患过急性感染,其已被成功治疗但医生担心感染可能会复发时。在这些情况下,预处理方案可提高细菌组合物影响患者微生物组的能力。在替代实施方案中,未用抗生素对受试者进行预处理。
[0270]
作为准备患者以进行微生物生态系统的施用的一种方式,可施用至少一种抗生素以改变患者内的细菌。作为准备患者以进行微生物生态系统的施用的另一方式,可向患者施用标准的结肠清洗制剂以基本上清空结肠内容物,如用于使患者准备结肠镜检查。对于“基本上清空结肠内容物”,本技术意味着移除结肠内容物的平常体积的至少75%、至少80%、至少90%、至少95%或约100%的内容物。抗生素治疗可在结肠清洗方案之前。
[0271]
如果患者接受了抗生素用于治疗感染,或者如果患者接受了抗生素作为具体预处理方案的一部分,那么在一个实施方案中,在施用微生物组合物之前,抗生素应停止足够的时间,以使得抗生素在肠道内的浓度大幅度地减少。在一个实施方案中,可在施用细菌组合物之前1天、2天或3天停用抗生素。在一个实施方案中,可在施用细菌组合物之前3个、4个、5个、6个或7个抗生素半衰期停用抗生素。如果预处理方案是急性感染治疗的一部分,可选择抗生素以使感染对所述抗生素敏感,但细菌组合物中的组分对所述抗生素不敏感。
[0272]
本文所述的任何制剂可在单一时刻施用一次,或在多个时刻施用,诸如一天一次持续数天,或在施用当天一天超过一次(包括每日两次、每日三次或每日多达五次)。或者,
制剂可根据设定的日程间歇地施用,例如每周一次、每月一次或当患者原发病复发时。在另一个实施方案中,可在长期基础上施用制剂以确保保护性或治疗性作用的维持。
[0273]
在一个实施方案中,在施用第二微生物聚生体之前,向受试者施用第一微生物聚生体,所述第一微生物聚生体包含已知增强有益生物体(例如普通拟杆菌和卵形拟杆菌)的定殖的至少一种细菌菌种。
[0274]
本文所述的另一方面涉及用于增强微生物聚生体的定殖和/或持久性的方法,所述方法包括:在施用第二微生物聚生体之前,向受试者施用第一微生物聚生体,所述第一微生物聚生体包含选自由以下组成的组的至少两种细菌物种:脆弱拟杆菌、卵形拟杆菌、普通拟杆菌、狄氏副拟杆菌、产黑色普雷沃菌;所述第二微生物聚生体包含选自由以下组成的组的至少4种细菌物种:多枝梭菌、闪烁梭菌、c.hiranonsis、双酶梭菌、柔嫩梭菌和c.sardiniensis;其中,所述第一微生物聚生体增强所述第二微生物聚生体的定殖和/或持久性。
[0275]
在这种情况下,持久性是指受试者(例如胃肠道)中的微生物聚生体的一个或多个成员维持在等于或高于用于治疗和/或预防食物过敏的阈值的数量、生物量或活性。持久性可通过获得粪便样品来确定微生物聚生体的一个或多个成员的数量、生物量和/或活性来测量。在一些实施方案中,可通过获得粪便样品中微生物聚生体的至少两个成员的所测量的生物量的比率来测量持久性。
[0276]
本文还考虑在施用第二微生物聚生体之前,向受试者施用第一微生物聚生体,所述第一微生物聚生体包含选自由以下组成的组的至少两种细菌物种:多枝梭菌、闪烁梭菌、c.hiranonsis、双酶梭菌、柔嫩梭菌和c.sardiniensis;所述第二微生物聚生体包含选自由以下组成的组的至少两种细菌物种:脆弱拟杆菌、卵形拟杆菌、普通拟杆菌、狄氏副拟杆菌、产黑色普雷沃菌。
[0277]
本文还考虑将第一微生物聚生体与第二微生物聚生体组合(例如同时)施用至受试者,所述第一微生物聚生体包含选自由以下组成的组的至少两种细菌物种:多枝梭菌、闪烁梭菌、c.hiranonsis、双酶梭菌、柔嫩梭菌和c.sardiniensis;所述第二微生物聚生体包含选自由以下组成的组的至少两种细菌物种:脆弱拟杆菌、卵形拟杆菌、普通拟杆菌、狄氏副拟杆菌、产黑色普雷沃菌。
[0278]
功效
[0279]
通常,特异性应答,例如食物过敏其其它过敏性应答可尤其表现为以下症状或指征中的一种或多种:(i)核心体温显著下降;(ii)总ige增加;(iii)过敏原特异性ige增加;(iv)肥大细胞扩增;(v)肥大细胞颗粒蛋白酶1(mmcp
‑
1)释放;以及(vi)t
h
2细胞偏移增加。因此,如上所述,使用本文所述的方法和组合物对食物过敏的有效治疗和/或预防可减少或消除与食物过敏相关的症状或指征中的至少一种。在此上下文中,减少的症状或指征意味着至少20%减少、至少30%减少、至少40%减少、至少50%减少、至少60%减少、至少70%减少、至少80%减少、至少90%减少、至少95%减少、至少98%减少或甚至至少99%或进一步减少。用于测量这些参数中的每一个的方法是本领域普通技术人员已知的。
[0280]
本文所述的方法和组合物提供了对涉及或引发过敏性反应(即ige
‑
介导的组胺释放或直接抗原介导的肥大细胞和嗜碱性粒细胞的脱颗粒以及导致的病理)的食物过敏的治疗或预防。如本发明其它地方所述,非限制性实例包括对花生、木本坚果和贝类的过敏或过
enzymology:guide to molecular cloning techniques第152卷,s.l.berger和a.r.kimmel编,academic press inc.,san diego,usa(1987);current protocols in protein science(cpps)(john e.coligan,等人,编,john wiley and sons,inc.),current protocols in cell biology(cpcb)(juan s.bonifacino等人编,john wiley and sons,inc.)和culture of animal cells:a manual of basic technique by r.ian freshney,publisher:wiley
‑
liss;第5版(2005);animal cell culture methods(methods in cell biology,第57卷,jennie p.mather和david barnes编辑,academic press,第1版,1998)中所描述,所述文献全部以引用的方式整体并入本文。
[0287]
其它术语在本文中在本发明的各个方面的描述内定义。
[0288]
在本技术通篇所引用的所有专利和其它出版物(包括文献参考、颁布的专利、公布的专利申请和共同未决的专利申请)都出于描述和公开例如此类出版物中所述的可能结合本文所述的技术使用的方法的目的以引用的方式明确并入本文。这些出版物仅仅出于其在本技术的提交日期之前公开而提供。就此而言,任何事物都不应解释为认可由于先前发明或因为任何其它原因而使发明者无权先于所述公开。所有关于日期的陈述或关于这些文档的内容的表述都是基于可为申请人所用的信息且不构成关于这些文档的日期或内容的正确性的任何认可。
[0289]
本公开的实施方案的描述不意图是详尽的或将本公开限于所公开的确切形式。尽管本文出于说明目的描述了本公开的具体实施方案和实施例,但如熟习相关技术的技术人员所将认识到,在本公开的范围内,各种等效修改是可能的。例如,当以给定顺序呈现方法步骤或功能时,替代实施方案可以不同顺序执行功能,或者功能可以大致上同时执行。本文所提供的本公开的教导可适当时适用于其它程序或方法。可组合本文所述的各种实施方案来提供另外的实施方案。如有必要,本公开的多个方面可被修改,以采用以上参考文献和申请的组合物、功能和概念从而提供本公开的又另外的实施方案。此外,由于生物学功能等效考虑,可对蛋白质结构进行一些变化,而不以种类或量影响生物学或化学作用。可根据详细描述对本公开进行这些和其它变化。所有此类修改意图包括在随附权利要求书的范围内。
[0290]
前述实施方案中任一项的具体要素可组合或取代其它实施方案中的要素。此外,这些实施方案上下文中已经描述了与本公开的某些实施方案相关联的优点,但是其它实施方案也可表现出此类有点,并且不必所有实施方案均必须表现出此类优点以属于本公开的范围。
[0291]
通过以下实施例进一步说明本文所述的技术,所述实施例不应解释为进一步限制。
[0292]
本文所述的方法和组合物的一些实施方案可根据以下编号段落中的任一项来定义:
[0293]
1)一种药物组合物,所述药物组合物包含:
[0294]
a.当施用于有需要的个体时足以治疗或预防生态失调的量的包含经分离细菌的微生物聚生体的制剂,所述微生物聚生体包含2至20种活肠道细菌物种,其中至少两者选自由以下组成的组:普通拟杆菌、狄氏副拟杆菌和产黑色普雷沃菌;以及
[0295]
b.药学上可接受的载体。
[0296]
2)如段落1所述的药物组合物,所述药物组合物还包含脆弱拟杆菌和卵形拟杆菌
中的至少一者。
[0297]
3)如段落1所述的药物组合物,所述药物组合物还包含脆弱拟杆菌和卵形拟杆菌。
[0298]
4)如段落1所述的药物组合物,其中所述制剂包含以下中的每一者:脆弱拟杆菌、卵形拟杆菌、普通拟杆菌、狄氏副拟杆菌和产黑色普雷沃菌。
[0299]
5)如段落1
‑
4中任一项所述的药物组合物,所述药物组合物还包含表4中的一种或多种细菌。
[0300]
6)如段落1
‑
5中任一项所述的药物组合物,其中所述生态失调与炎症性疾病或代谢病症相关。
[0301]
7)如段落1
‑
6中任一项所述的药物组合物,其中所述生态失调与特应性疾病或病症相关。
[0302]
8)如段落1
‑
7中任一项所述的药物组合物,其中所述活肠道细菌是厌氧肠道细菌。
[0303]
9)如段落1
‑
8中任一项所述的药物组合物,所述药物组合物被配制来将所述活细菌递送至小肠。
[0304]
10)如段落1
‑
9中任一项所述的药物组合物,其中所述药学上可接受的载体包括包封所述微生物聚生体的肠溶包衣组合物。
[0305]
11)如段落10所述的药物组合物,其中所述肠溶包衣组合物呈胶囊、凝胶、软锭剂、片剂或丸剂的形式。
[0306]
12)如段落1
‑
11中任一项所述的药物组合物,其中所述活肠道细菌是人肠道细菌。
[0307]
13)如段落1
‑
12中任一项所述的组合物,其中所述聚生体包含选自由以下组成的组的至少三种物种:脆弱拟杆菌、卵形拟杆菌、普通拟杆菌、狄氏副拟杆菌和产黑色普雷沃菌。
[0308]
14)如段落1
‑
13中任一项所述的药物组合物,其中所述聚生体包含选自由以下组成的组的至少四种物种:脆弱拟杆菌、卵形拟杆菌、普通拟杆菌、狄氏副拟杆菌和产黑色普雷沃菌。
[0309]
15)如段落1
‑
14中任一项所述的药物组合物,其中所述聚生体还包含选自由以下组成的组的至少一种物种:多枝梭菌、闪烁梭菌、平野氏梭菌、双酶梭菌、柔嫩梭菌和萨尔迪纳梭菌。
[0310]
16)如段落1
‑
15中任一项所述的药物组合物,其中所述聚生体还包含选自由以下组成的组的至少两种物种:多枝梭菌、闪烁梭菌、平野氏梭菌、双酶梭菌、柔嫩梭菌和萨尔迪纳梭菌。
[0311]
17)如段落1
‑
16中任一项所述的药物组合物,其中所述聚生体还包含选自由以下组成的组的至少三种物种:多枝梭菌、闪烁梭菌、平野氏梭菌、双酶梭菌、柔嫩梭菌和萨尔迪纳梭菌。
[0312]
18)如段落1
‑
17中任一项所述的药物组合物,其中所述聚生体还包含选自由以下组成的组的至少四种物种:多枝梭菌、闪烁梭菌、平野氏梭菌、双酶梭菌、柔嫩梭菌和萨尔迪纳梭菌。
[0313]
19)如段落1
‑
18中任一项所述的药物组合物,其中所述聚生体还包含选自由以下组成的组的至少五种物种:多枝梭菌、闪烁梭菌、平野氏梭菌、双酶梭菌、柔嫩梭菌和萨尔迪纳梭菌。
[0314]
20)如段落1
‑
19中任一项所述的药物组合物,其中所述聚生体还包含以下物种中的每一者:多枝梭菌、闪烁梭菌、平野氏梭菌、双酶梭菌、柔嫩梭菌和萨尔迪纳梭菌。
[0315]
21)如段落1
‑
20中任一项所述的药物组合物,其中所述活肠道细菌物种以基本相等的生物量存在。
[0316]
22)如段落1
‑
21中任一项所述的药物组合物,其中所述组合物被配制来递送至少1x109个菌落形成单位(cfu)的剂量。
[0317]
23)如段落1
‑
22中任一项所述的药物组合物,其中所述组合物被配制来每单次剂量递送处于少于30个胶囊中的至少1x109个cfu。
[0318]
24)如段落1
‑
23中任一项所述的药物组合物,其中所述组合物被冷冻以用于储存。
[0319]
25)如段落1
‑
24中任一项所述的药物组合物,其中所述活肠道细菌物种在厌氧条件下进行包封。
[0320]
26)如段落25所述的药物组合物,其中厌氧条件包括以下中的一种或多种:
[0321]
a.不透氧的胶囊,
[0322]
b.向所述组合物中添加还原剂,包括n
‑
乙酰半胱氨酸、半胱氨酸或亚甲基蓝,或
[0323]
c.对形成孢子的生物体而言使用孢子。
[0324]
27)如段落1
‑
26中任一项所述的药物组合物,其中所述组合物包含至少两种细菌物种,所述细菌物种各自包含与参考菌株操作分类单位中存在的16s rdna序列至少97%同一的16s rdna序列,所述参考菌株选自所述物种普通拟杆菌、狄氏副拟杆菌和产黑色普雷沃菌。
[0325]
28)如段落1
‑
27中任一项所述的药物组合物,其中所述组合物包含至少三种细菌物种,所述细菌物种各自包含与参考菌株操作分类单位中存在的16s rdna序列至少97%同一的16s rdna序列,所述参考菌株选自物种普通拟杆菌、狄氏副拟杆菌和产黑色普雷沃菌。
[0326]
29)如段落1
‑
28中任一项所述的药物组合物,其中所述组合物包含至少四种细菌物种,所述细菌物种各自包含与参考菌株操作分类单位中存在的16s rdna序列至少97%同一的16s rdna序列,所述参考菌株选自所述物种脆弱拟杆菌、卵形拟杆菌、普通拟杆菌、狄氏副拟杆菌和产黑色普雷沃菌。
[0327]
30)如段落1
‑
29中任一项所述的药物组合物,其中所述组合物包含至少五种细菌物种,所述细菌物种各自包含与参考菌株操作分类单位中存在的16s rdna序列至少97%同一的16s rdna序列,所述参考菌株包括以下物种中的每一者:脆弱拟杆菌、卵形拟杆菌、普通拟杆菌、狄氏副拟杆菌和产黑色普雷沃菌。
[0328]
31)如段落1
‑
30中任一项所述的药物组合物,其中所述组合物不包含以下物种中的任一者:大肠杆菌、肺炎克雷伯氏菌、奇异变形杆菌、阴沟肠杆菌、沃氏嗜胆菌、昂氏另枝菌、脱硫弧菌属物种、约氏乳杆菌或parasutterella excrementihominis。
[0329]
32)如段落1
‑
31中任一项所述的药物组合物,其中所述组合物不包含以下属的细菌:嗜胆菌属、肠杆菌属、埃希氏菌属、克雷伯氏菌属、变形杆菌属、另枝菌属、布劳特菌属、脱硫弧菌属和副萨特氏菌属。
[0330]
33)如段落1
‑
32中任一项所述的药物组合物,其中所述组合物不包含以下科的细菌:脱硫弧菌科、肠杆菌科、理研菌科和萨特氏菌科。
[0331]
34)如段落1
‑
33中任一项所述的药物组合物,其中所述组合物不包含以下科的细
菌:乳杆菌科或肠杆菌科。
[0332]
35)如段落1
‑
34中任一项所述的药物组合物,其中所述组合物不包含以下目的细菌:burkholdales、脱硫弧菌目或肠杆菌目。
[0333]
36)如段落1所述的药物组合物,所述药物组合物包含至少四种非病原性活肠道细菌物种。
[0334]
37)如段落1
‑
36中任一项所述的药物组合物,所述药物组合物包含至少两种且至多十一种非病原性活肠道细菌物种。
[0335]
38)如段落1
‑
37中任一项所述的药物组合物,其中所述微生物聚生体包含脆弱拟杆菌、卵形拟杆菌、普通拟杆菌、狄氏副拟杆菌、产黑色普雷沃菌、多枝梭菌、闪烁梭菌、clostridium rhiranonsis、双酶梭菌、柔嫩梭菌和萨尔迪纳梭菌。
[0336]
39)如段落1
‑
35或段落37中任一项所述的药物组合物,其中所述聚生体基本上由以下组成:普通拟杆菌、狄氏副拟杆菌和产黑色普雷沃菌。
[0337]
40)如段落1
‑
39中任一项所述的药物组合物,其中所述聚生体基本上由以下组成:脆弱拟杆菌、卵形拟杆菌、普通拟杆菌、狄氏副拟杆菌和产黑色普雷沃菌。
[0338]
41)如段落1
‑
40中任一项所述的药物组合物,其中所述聚生体基本上由以下组成:多枝梭菌、闪烁梭菌、平野氏梭菌、双酶梭菌、柔嫩梭菌、萨尔迪纳梭菌、脆弱拟杆菌、卵形拟杆菌、普通拟杆菌、狄氏副拟杆菌和产黑色普雷沃菌。
[0339]
42)如段落10或段落11所述的药物组合物,其中所述肠溶包衣包含聚合物、纳米颗粒、脂肪酸、虫胶或植物纤维。
[0340]
43)如段落1
‑
42中任一项所述的药物组合物,其中所述微生物聚生体被包封、冻干、配制在食物中,或者被配制为液体、凝胶、流体凝胶或液体中的纳米颗粒。
[0341]
44)如段落1
‑
43中任一项所述的药物组合物,所述药物组合物还包含益生元组合物。
[0342]
45)一种药物组合物,所述药物组合物包含:
[0343]
a.当施用于有需要的个体时足以治疗或预防生态失调的量的包含至少两种经分离活厌氧肠道细菌物种的制剂,所述至少两种经分离活厌氧肠道细菌物种选自由以下组成的组:普通拟杆菌、狄氏副拟杆菌和产黑色普雷沃菌,以及
[0344]
b.药学上可接受的载体。
[0345]
46)一种药物组合物,所述药物组合物包含:
[0346]
a.当施用于有需要的个体时足以治疗或预防生态失调的量的包含至少三种经分离活厌氧肠道细菌物种的制剂,所述至少三种经分离活厌氧肠道细菌物种包括:普通拟杆菌、狄氏副拟杆菌和产黑色普雷沃菌,以及
[0347]
b.药学上可接受的载体。
[0348]
47)一种药物组合物,所述药物组合物包含:
[0349]
a.当施用于有需要的个体时足以治疗或预防生态失调的量的包含至少四种经分离活厌氧肠道细菌物种的制剂,所述至少四种经分离活厌氧肠道细菌物种选自由以下组成的组:脆弱拟杆菌、卵形拟杆菌、普通拟杆菌、狄氏副拟杆菌和产黑色普雷沃菌,以及
[0350]
b.药学上可接受的载体。
[0351]
48)一种药物组合物,所述药物组合物包含:
[0352]
a.当施用于有需要的个体时足以治疗或预防生态失调的量的包含经分离活厌氧肠道细菌的制剂,所述经分离活厌氧肠道细菌包括以下中的每一者:脆弱拟杆菌、卵形拟杆菌、普通拟杆菌、狄氏副拟杆菌和产黑色普雷沃菌,以及
[0353]
b.药学上可接受的载体。
[0354]
49)如段落45
‑
48中任一项所述的药物组合物,其中所述生态失调与炎症性疾病或代谢疾病或病症相关。
[0355]
50)如段落45
‑
48中任一项所述的药物组合物,其中所述生态失调与特应性疾病或病症相关。
[0356]
51)如段落45
‑
48中任一项所述的药物组合物,所述药物组合物包含至多四十种活厌氧肠道细菌物种。
[0357]
52)如段落45
‑
48中任一项所述的药物组合物,所述药物组合物包含至多三十种活厌氧肠道细菌物种。
[0358]
53)如段落45
‑
48中任一项所述的药物组合物,所述药物组合物包含至多二十种活厌氧肠道细菌物种。
[0359]
54)如段落45
‑
48中任一项所述的药物组合物,所述药物组合物包含至多十五种活厌氧肠道细菌物种。
[0360]
55)如段落45
‑
48中任一项所述的药物组合物,所述药物组合物包含至多十一种活厌氧肠道细菌物种。
[0361]
56)如段落45
‑
50中任一项所述的药物组合物,所述药物组合物还包含选自由以下组成的组的至少一种细菌物种:多枝梭菌、闪烁梭菌、平野氏梭菌、双酶梭菌、柔嫩梭菌和萨尔迪纳梭菌。
[0362]
57)如段落45
‑
56中任一项所述的药物组合物,所述药物组合物还包含选自由以下组成的组的至少两种细菌物种:多枝梭菌、闪烁梭菌、平野氏梭菌、双酶梭菌、柔嫩梭菌和萨尔迪纳梭菌。
[0363]
58)如段落45
‑
57中任一项所述的药物组合物,所述药物组合物还包含选自由以下组成的组的至少三种细菌物种:多枝梭菌、闪烁梭菌、平野氏梭菌、双酶梭菌、柔嫩梭菌和萨尔迪纳梭菌。
[0364]
59)如段落45
‑
58中任一项所述的药物组合物,所述药物组合物还包含选自由以下组成的组的至少四种细菌物种:多枝梭菌、闪烁梭菌、平野氏梭菌、双酶梭菌、柔嫩梭菌和萨尔迪纳梭菌。
[0365]
60)如段落45
‑
59中任一项所述的药物组合物,所述药物组合物还包含选自由以下组成的组的至少五种细菌物种:多枝梭菌、闪烁梭菌、平野氏梭菌、双酶梭菌、柔嫩梭菌和萨尔迪纳梭菌。
[0366]
61)如段落45
‑
60中任一项所述的药物组合物,所述药物组合物还包含多枝梭菌、闪烁梭菌、平野氏梭菌、双酶梭菌、柔嫩梭菌和萨尔迪纳梭菌。
[0367]
62)如段落45
‑
61中任一项所述的药物组合物,其中所述微生物物种不包括以下物种中的任一者:大肠杆菌、肺炎克雷伯氏菌、奇异变形杆菌、阴沟肠杆菌、沃氏嗜胆菌、昂氏另枝菌、脱硫弧菌属物种、约氏乳杆菌或parasutterella excrementihominis。
[0368]
63)如段落45
‑
62中任一项所述的药物组合物,其中所述微生物物种不包括以下属
的细菌:嗜胆菌属、肠杆菌属、埃希氏菌属、克雷伯氏菌属、变形杆菌属、另枝菌属、布劳特菌属、脱硫弧菌属和副萨特氏菌属。
[0369]
64)如段落45
‑
63中任一项所述的药物组合物,其中所述微生物物种不包括以下科的细菌:脱硫弧菌科、肠杆菌科、理研菌科和萨特氏菌科。
[0370]
65)如段落45
‑
64中任一项所述的药物组合物,其中所述微生物物种不包括以下科的细菌:乳杆菌科或肠杆菌科。
[0371]
66)如段落45
‑
65中任一项所述的药物组合物,其中所述微生物物种不包括以下目的细菌:burkholdales、脱硫弧菌目或肠杆菌目。
[0372]
67)如段落45
‑
66中任一项所述的药物组合物,其中所述药学上可接受的载体包括包封所述微生物聚生体的肠溶包衣组合物。
[0373]
68)如段落45
‑
67中任一项所述的药物组合物,所述药物组合物被配制来将所述活细菌递送至小肠。
[0374]
69)如段落45
‑
68中任一项所述的药物组合物,其中所述药学上可接受的载体包括胶囊、凝胶、软锭剂、片剂或丸剂。
[0375]
70)如段落45
‑
69中任一项所述的药物组合物,其中活肠道细菌的所述聚生体用肠溶包衣进行配制。
[0376]
71)如段落45
‑
70中任一项所述的药物组合物,其中所述活肠道细菌物种是人肠道细菌。
[0377]
72)如段落45
‑
71中任一项所述的药物组合物,其中所述活肠道细菌物种以基本相等的生物量存在。
[0378]
73)如段落45
‑
72中任一项所述的药物组合物,其中所述组合物被配制来递送至少1x109个菌落形成单位(cfu)的剂量。
[0379]
74)如段落45
‑
73中任一项所述的药物组合物,其中所述组合物被配制来每单次剂量递送处于少于30个胶囊中的至少1x109个cfu。
[0380]
75)如段落45
‑
74中任一项所述的药物组合物,其中所述组合物被冷冻以用于储存。
[0381]
76)如段落45
‑
75中任一项所述的药物组合物,其中所述活肠道细菌物种在厌氧条件下进行包封。
[0382]
77)如段落76所述的药物组合物,其中厌氧条件包括以下中的一种或多种:
[0383]
a.不透氧的胶囊,
[0384]
b.向所述组合物中添加还原剂,包括n
‑
乙酰半胱氨酸、半胱氨酸或亚甲基蓝,或
[0385]
c.对形成孢子的生物体而言使用孢子。
[0386]
78)如段落67所述的药物组合物,其中所述肠溶包衣包含聚合物、纳米颗粒、脂肪酸、虫胶或植物纤维。
[0387]
79)如段落45
‑
78中任一项所述的药物组合物,所述药物组合物还包含益生元组合物。
[0388]
80)如段落45
‑
79中任一项所述的药物组合物,其中所述组合物被包封、是冻干物、被配制在食物中,或者被配制为液体、凝胶、流体凝胶或液体中的纳米颗粒。
[0389]
81)一种用于治疗或预防受试者的生态失调的方法,所述方法包括:向受试者施用
段落1
‑
80中任一项所述的药物组合物,从而治疗或预防所述受试者的生态失调。
[0390]
82)一种用于治疗或预防肠道炎症或代谢性疾病或病症的方法,所述方法包括:向受试者施用段落1
‑
80中任一项所述的药物组合物,从而治疗或预防所述受试者的所述肠道炎症或代谢性疾病或病症。
[0391]
83)一种用于治疗或预防特应性疾病或病症的方法,所述方法包括:向受试者施用段落1
‑
80中任一项所述的药物组合物,从而治疗或预防所述受试者的所述特应性疾病或病症。
[0392]
84)如段落83所述的方法,其中所述特应性疾病或病症选自由以下组成的组:食物过敏、湿疹、哮喘和鼻结膜炎。
[0393]
85)如段落81
‑
84中任一项所述的方法,其中所述药物组合物通过口服施用、灌肠剂、栓剂或口胃管进行施用。
[0394]
86)如段落81
‑
85中任一项所述的方法,其中所述活肠道细菌物种从已知对选定食物过敏原耐受的受试者分离和/或纯化。
[0395]
87)如段落81
‑
86中任一项所述的方法,其中通过在厌氧条件下培养来制备所述活肠道细菌物种。
[0396]
88)如段落81
‑
87中任一项所述的方法,其中配制所述活肠道细菌物种以维持厌氧条件。
[0397]
89)如段落88所述的方法,其中通过以下中的一种或多种来维持厌氧条件:
[0398]
a.不透氧的胶囊,
[0399]
b.向所述组合物中添加还原剂,包括n
‑
乙酰半胱氨酸、半胱氨酸或亚甲基蓝,或
[0400]
c.对形成孢子的生物体而言使用孢子。
[0401]
90)如段落81
‑
89中任一项所述的方法,所述方法还包括施用益生元组合物。
[0402]
91)如段落81
‑
90中任一项所述的方法,其中所述药物组合物是肠溶包衣的。
[0403]
92)如段落81
‑
91中任一项所述的方法,其中所施用治疗预防和/或逆转t
h
2编程。
[0404]
93)如段落81
‑
92中任一项所述的方法,其中所述受试者是人受试者。
[0405]
94)如段落81
‑
93中任一项所述的方法,其中所述受试者是2岁以下。
[0406]
95)如段落81
‑
93中任一项所述的方法,其中所述受试者是2岁至5岁以下。
[0407]
96)如段落81
‑
93中任一项所述的方法,其中所述受试者是5岁至12岁以下。
[0408]
97)如段落81
‑
93中任一项所述的方法,其中所述受试者是12岁至18岁以下。
[0409]
98)如段落81
‑
93中任一项所述的方法,其中所述受试者是18岁至65岁以下。
[0410]
99)如段落81
‑
93中任一项所述的方法,其中所述受试者是65岁以上。
[0411]
100)如段落81
‑
99中任一项所述的方法,所述方法还包括将所述受试者诊断为患有或可能发展炎症性疾病或特应性疾病或病症的步骤。
[0412]
101)如段落81
‑
100中任一项所述的方法,所述方法还包括针对所述药物组合物中的一种或多种细菌的存在和/或水平,对来自所述受试者的粪便样品进行测试的步骤。
[0413]
102)如段落83
‑
101中任一项所述的方法,其中所述特应性疾病是食物过敏,并且其中所述食物过敏包括对大豆、小麦、蛋、乳制品、花生、木本坚果、贝类、鱼类、蘑菇、核果和/或其它水果的过敏。
[0414]
103)如段落83
‑
102中任一项所述的方法,其中在首次暴露于潜在食物过敏原之前
施用所述药物组合物。
[0415]
104)如段落83
‑
103中任一项所述的方法,其中在特应性症状的临床迹象出现后施用所述药物组合物。
[0416]
105)如段落81
‑
104中任一项所述的方法,其中将所述药物组合物施用于被诊断患有食物过敏的个体。
[0417]
106)如段落81
‑
105中任一项所述的方法,其中所述受试者用抗生素加以预处理。
[0418]
107)一种用于减少或消除受试者对过敏原的免疫反应的方法,所述方法包括:向受试者施用段落1
‑
80中任一项所述的药物组合物,从而减少或消除受试者对过敏原的免疫反应。
[0419]
108)如段落107所述的方法,其中所述过敏原是食物过敏原。
[0420]
109)如段落108所述的方法,其中所述过敏原选自由以下组成的组:大豆、小麦、蛋、乳制品、花生、木本坚果、贝类、鱼类、蘑菇、核果和其它水果。
[0421]
110)如段落107
‑
109中任一项所述的方法,其中所述药物组合物通过口服施用、灌肠剂、栓剂或口胃管进行施用。
[0422]
111)如段落107
‑
110中任一项所述的方法,其中所述治疗预防和/或逆转t
h
2编程。
[0423]
112)如段落107
‑
111中任一项所述的方法,其中所述受试者是人受试者。
[0424]
113)如段落107
‑
112中任一项所述的方法,其中所述受试者是2岁以下。
[0425]
114)如段落107
‑
112中任一项所述的方法,其中所述受试者是2岁至5岁以下。
[0426]
115)如段落107
‑
112中任一项所述的方法,其中所述受试者是5岁至12岁以下。
[0427]
116)如段落107
‑
112中任一项所述的方法,其中所述受试者是12岁至18岁以下。
[0428]
117)如段落107
‑
112中任一项所述的方法,其中所述受试者是18岁至65岁以下。
[0429]
118)如段落107
‑
112中任一项所述的方法,其中所述受试者是65岁以上。
[0430]
119)如段落107
‑
118中任一项所述的方法,所述方法还包括将所述受试者诊断为患有ige介导的过敏的步骤。
[0431]
120)如段落107
‑
119中任一项所述的方法,所述方法还包括针对所述药物组合物中的一种或多种细菌的存在和/或水平,对来自所述受试者的粪便样品进行测试的步骤。
[0432]
121)如段落119所述的方法,其中所述ige介导的过敏是选自由以下组成的组的食物过敏:对大豆、小麦、蛋、乳制品、花生、木本坚果、贝类、鱼类、蘑菇、核果和其它水果的过敏。
[0433]
122)如段落107
‑
121中任一项所述的方法,其中在对潜在过敏原的初始暴露和/或反应之后施用所述药物组合物。
[0434]
123)如段落107
‑
122中任一项所述的方法,其中所施用组合物中每种微生物的生物量大于关于参考的每种微生物的生物量。
[0435]
124)如段落107
‑
123中任一项所述的方法,其中所述受试者用抗生素加以预处理。
[0436]
125)如段落107
‑
124中任一项所述的方法,其中所述受试者以不长于24小时的禁食期加以预处理。
[0437]
126)一种监测受试者的微生物组的方法,所述方法包括:测定从受试者获得的生物样品中的存在和/或生物量,并且其中如果选自由脆弱拟杆菌、卵形拟杆菌、普通拟杆菌、狄氏副拟杆菌和产黑色普雷沃菌组成的组的至少两种或更多种物种不存在或相对于参考
较低,则用段落1
‑
80中任一项所述的组合物治疗所述受试者。
[0438]
127)如段落126所述的方法,其中所述方法还包括当所述至少两个成员不存在时、所述至少两个成员的生物量相对于参考较低时、或生态失调物种的至少一个成员存在或相对于参考升高时,预测受试者将对过敏原具有免疫应答。
[0439]
128)如段落127所述的方法,其中所述方法重复至少另外一次。
[0440]
129)如段落126所述的方法,其中所述生物样品是粪便样品。
[0441]
130)一种治疗有需要的个体的特应性疾病或病症的方法,所述方法包括向所述个体施用段落1
‑
80中任一项所述的组合物。
[0442]
131)如段落130所述的方法,其中所述施用使t
h
1/t
h
2细胞的平衡转向t
h
1 t细胞。
[0443]
132)如段落130所述的方法,其中所述施用降低t
h
2 t细胞的数量或活性。
[0444]
133)一种降低有需要的个体的组织中的t
h
2细胞的数量或活性的方法,所述方法包括向所述个体施用段落1
‑
80中任一项所述的药物组合物。
[0445]
134)如段落133所述的方法,其中所述组织是肠道组织。
[0446]
实施例
[0447]
本文中,例如在图和其它地方中提供的数据示出几种物种(即,例如3种、4种、5种或6种物种)的微生物聚生体能够在小鼠模型中防止发展生态失调和相关的疾患。用这样的细菌聚生体治疗能够逆转t
reg
的t
h
2编程。对使用微生物的类似微生物聚生体在人中治疗和/或预防生态失调和相关的疾患进行了具体说明。
[0448]
在食物过敏的小鼠模型中测试或测量微生物聚生体的功效的其它方法是本领域已知的和/或可在例如noval rivas等人j allergy clin immunol(2013)131(1):201
‑
212或noval rivas等人,immunity(2015)42:512
‑
523中找到,所述文献的内容各自整体并入本文。
[0449]
实施例1:用于治疗食物过敏的治疗性微生物群
[0450]
概述
[0451]
食物过敏是日益严重的全国性问题,影响了6%的儿童和3%的美国青少年和成人。不幸的是,对这些儿童及其家人来说,护理标准仍然是避免令人不适的食物以及在出现症状时对症状加以控制。单独或与抗ige(omalizumab
tm
)联合使用口服脱敏的疗法仍然是实验性的,成效有限。需要靶向异常免疫应答的疗法。因此,本研究表明使用肠道微生物群作为治疗性干预来促进能够预防或减轻t
h
2/过敏性应答的作用的致耐受应答。
[0452]
随着针对食品的t
h
2过敏性应答的发展,食物过敏发生,其与减轻此类粘膜应答的致耐受t调控性应答形成对照。t
h
2应答促进食物抗原特异性ige抗体和粘膜肥大细胞的募集,与抑制这些作用的调控性应答形成对照。一旦对一种或多种食物抗原敏感,再次暴露可诱导威胁生命的过敏应答。促进致耐受应答的能力支持具有广泛基础的治疗方法,所述方法可在暴露的最早阶段以及在已致敏的患者中起作用,从而防止对各种食品的异常过敏性应答。
[0453]
利用遗传易感的il4ra f709小鼠食物过敏模型,已经开发了在临床前模型中能够预防和治愈食物过敏的限定人共生群落。这些群落利用针对患者的新的治疗途径
–
来自肠道腔侧(其中肠道微生物群驻留的空间)的免疫调节。人肠道微生物群由数百种物种组成,在正常人类发育和健康中从以下方面提供关键功能:免疫系统的成熟;提供必需的营养素,
如b族维生素和维生素k;以及协助对膳食和外源化合物(包括药物和摄入的食品)的消化和代谢。
[0454]
聚生体开发
[0455]
对于小鼠中的临床前研究,在适当的厌氧条件下将组成成员在富含营养素的培养基中分别生长,对生物量进行定量,然后在厌氧条件下将聚生体混合(每种组成生物体的生物量大约相等)至终浓度约5.0x108个菌落形成单位(cfu)/ml。每种物种的输入培养体积在100ml
‑
1l的范围内。根据需要,通过在厌氧条件下处理的离心与重悬,对固定相生物量<5x108cfu/ml的培养物进行浓缩。
[0456]
混合时,总生物量保持大约5x108cfu/ml。将2ml等分试样置于具有厌氧/预还原气氛的冷冻小瓶中,在液氮上快速冷冻,并在
‑
80℃下储存直至使用。快速冷冻显示出对组成生物体的生物量具有<1/2log影响并且对动物模型中的功效没有影响。为了进行研究,将管解冻,并通过口服管饲每周一次至每周两次向小鼠施用200ul此溶液,使得总的引入生物量为1x10
8 cfu/小鼠。成年小鼠的肠道内容物(胃,经过肛门)的测量结果在4
‑
8ml物质的范围内。因此,管饲的聚生体是小鼠肠道中内容物总体积的2.5%
‑
5%,并且是>10%的小肠中内容物的体积。
[0457]
关于来自常规微生物群的预先存在的微生物生物量
‑‑
小鼠小肠在十二指肠近端平均具有约104cfu/ml,在回肠增加至108cfu/ml。在盲肠和结肠中生物量增加至109‑
10
10
cfu/ml。从小鼠小肠(聚生体促进调控性t细胞应答的主要作用位置)中各位置的微生物生物量的角度来看,聚生体是10,000x十二指肠微生物群的生物量,并且是1
‑
2x空肠和结肠微生物群的生物量。
[0458]
相比之下,成人肠道可含有4.5l的物质,其中1l涉及摄取的食品,3.5l分泌物(包括唾液、胆汁以及来自胰腺和肠的其它流体)。这些流体和电解质大部分在右结肠被吸收,继粪便压实并通过之后。在肠内,生物体的生物量也变化,在盲肠和右侧结肠中具有最高浓度(10
10
‑
10
12
cfu/ml)。相比之下,在小肠(所认为的作用位置)中,生物量也在从十二指肠中的104cfu/ml至回肠中的108cfu/ml的范围内。
[0459]
人给药
[0460]
人的cfu/剂量是基于以下参数:
[0461]
(1)用人粪便的口服胶囊制剂处理艰难梭菌:来自openbiome和其它组的数据显示用胶囊制剂(在每单次剂量所服用12
‑
30个胶囊的范围内施用3
‑
5x109cfu)成功治疗了艰难梭菌结肠炎。预期标准的12
‑
胶囊方案递送大约4.2x109cfu/剂量。
[0462]
(2)改变小肠微生物群来促进免疫调节。在小肠近端释放内容物的包封制剂将递送3
‑
5x109cfu的剂量,超过十二指肠生物量10,000倍,并且与空肠和回肠中群落的比率接近1:1。
[0463]
考虑了其它制剂,包括处于液体中的纳米颗粒(具有增强定殖和活力的任选的益生元化合物)或重构的冻干物,然而,考虑到需要防止暴露至氧气并易于储存和施用,第一制剂使用包封材料。
[0464]
施用
[0465]
鉴于组成物种的专性厌氧性质,i期研究使用具有以下性质的包封制剂:
[0466]
阶段i:
[0467]
‑‑
可被成人或>8岁的儿童吞食
[0468]
‑‑
不含氧
[0469]
‑‑
保持使个人每剂量需要服用15粒或更少胶囊的体积
[0470]
‑‑
可冷冻储存(
‑
20℃或
‑
80℃)并在施用前解冻
[0471]
‑‑
经过胃之后释放内容物
[0472]
在一个实施方案中,使用针对口服fmt疗法的openbiome
tm
所使用的胶囊来包封gp
‑
i和gp
‑
ii混合物。其它选择也可商购并在本文中考虑。在一些实施方案中,所述胶囊由冷冻材料组成(为了确保充足的产品),所述材料在施用前解冻并以不含氧的方式用完整地存活至小肠中的材料包封。
[0473]
培养规模
[0474]
动物研究使用在100
‑
1000ml范围内的试验性培养物。为了产生人剂量,培养物按比例调整至少10倍。本文考虑了以下步骤:
[0475]
(1)在不同培养基条件下完成生长曲线
–
以优化生长条件并且使od600与所涂铺的生物量相关联。
[0476]
(2)在液体培养基中使组成成员厌氧地生长。将培养基预先还原并在37℃下进行孵育,伴有一定水平的搅动(例如,150rpm或使用搅拌/发酵罐挡板)以确保最大的培养密度。取决于发酵罐系统,可喷射氮或厌氧气体混合物来保持厌氧条件。然而,除了保持适当的酸/碱平衡之外,组成物种均不需要h2或co2进行生长。
[0477]
(3)对根据需要选择的成员进行浓缩以获得期所需的输入密度:通常通过在厌氧条件下以5
‑
10k rpm进行离心,弃去上清液,并重悬于较少体积的新培养基或适当的悬浮缓冲液中来实现。新的
[0478]
培养物密度通过od600读取来确定,并且活力通过涂铺至固体培养基上来确定。
[0479]
(4)将培养物聚集成组合的聚生体:将来自od600读取的估计生物量用于估计体积以及制备聚集体。
[0480]
(5)制备胶囊:在厌氧条件下进行以保存活力。
[0481]
(6)储存胶囊:最佳为在临床上可获得的条件(例如
‑
20℃)下储存。
[0482]
(7)质量控制:除了对之前的步骤和培养基进行qc外,还将对最终的群落进行评价以确保适当的物种存在并处于所需的活的生物量。用基于qpcr的方法,对用于临床前研究的材料的分析使用培养物的16s rrna基因种系分型。也可使用宏基因组学方法来排除非细菌物种或病毒的污染。
[0483]
本文进一步考虑针对规模化的培养物对生长条件进行优化。
[0484]
在一些实施方案中,开发了培养基制剂,使得它们缺少可能与食品中的致敏抗原相关的动物产品和/或底物。此外,本领域技术人员可评估接种物中的添加剂是否增强胶囊中和在体内释放时的活力。材料可包括防腐剂和益生元化合物。
[0485]
阶段ii:本文进一步考虑将本文所述的聚生体配制成可施用于婴儿和幼儿的液体制剂。本文考虑此类制剂包含来自孢子形成物种的孢子混合物,利用有限耐氧性的非孢子形成专性厌氧菌,并在液体配方中包含还原因子以缓冲对环境空气中氧的短期暴露并进入消化道。考虑了已在婴儿中治疗性地使用并具有稳健安全谱的化合物(如氨基酸半胱氨酸或正乙酰半胱氨酸)。
[0486]
用于测试制剂的另外临床前动物模型包括例如食物过敏的新生猪模型,包括针对人和猪两者的饮食中常见的食品的食物过敏。
[0487]
实施例2:来自人和动物研究的数据的otu聚类方法
[0488]
dna提取和用于16s rrna基因种系分型的测序。覆盖16srdna基因的v4区域的多重扩增子文库由提取自人粪便、小鼠粪便团粒或快速冷冻的肠道组织段的dna产生,所述dna使用mo bio
tm
power
‑
fecal
tm dna分离试剂盒(mo bio
tm laboratories)进行提取,所述试剂盒带有自定义修饰以增强对革兰氏阳性共生体(具有厚细胞壁)的裂解。文库制备的其余部分遵循双索引条形码的方案。在illumina
tm miseq平台上用配对末端250bp读数对聚集的文库进行测序。根据制造商的说明书,在pippin
tm prep 1.5%琼脂糖盒(sage sciences
tm
)上,聚集体文库池的大小选自300
‑
500bp。通过qpcr(kapa biosystems
tm
)测量池的浓度,并且根据illumina
tm
的标准负载方案,以6
‑
9pm(具有20%phix掺入以补偿低碱基多样性)负载到miseq
tm
(illumina
tm
)上。
[0489]
16s rrna数据预处理。测序旨在进行质量过滤后每样品获得10k
‑
50k的可用读数。使用mothur软件包(v.1.35.1)和自定义的python和r脚本对原始测序读数进行处理(进行去噪音、质量过滤、与16srdna基因序列的arb silva参考数据库的比对),并以97%同一性聚类成操作分类单位(otu)。
[0490]
16s rrna数据分析。为了针对对照与食物过敏受试者在微生物分类群丰度(otu)方面的差异进行统计学检验,利用deseq2软件包来支持有关宿主协变量(如年龄、食物过敏状态、饮食以及人群组中的抗生素使用)的分析,表明显著性差异的otu由以下定义:(1)校正的p值<=0.1;(2)对照组或食物过敏组的相对丰度>=0.01;(3)log2倍数变化的绝对值>=2。
[0491]
为了改善分类学调用的分辨率并显示系统发育关系,一种独立的方法使用pplacer软件包来完成单个otu的系统发育定位。pplacer使用基于可能性的方法学将16s rrna扩增子的短测序读数放置于参考树上,并且使用基于最小共有祖先的算法来生成短测序读数的分类学分类。系统发育定位所需的参考树使用来自核糖体数据库项目(rdp)的模式物种的全长或接近全长(>1,200nt)16s rdna序列来生成。
[0492]
对于16s rdna数据分析的所有统计学检验,使用benjamini和hochberg(bh)方法对p
‑
值进行调整以用于多重假设检验。使用自定义的r脚本生成热图。
[0493]
使用shannon熵计算α多样性值(就其中观察到的otu的多样性而言的样品丰富度)以测量每个样品中的多样性。使用未加权/加权的unifrac相异度(dissimilarity)测量计算β多样性值(基于各个样品中存在的otu中的差异的样品间的距离),以估计整个微生物群落结构的差异。
[0494]
(3)对限定的物种的otu映射
[0495]
将以下操作分类单位映射至限定的物种,如在定殖有这些聚生体的限菌小鼠中所鉴定的(表2和表3)。在v4可变区上对粪便团粒进行上述的16s rrna基因种系分型。
[0496]
表2:基于16s rrna v4区域的限定治疗性物种至otu的映射。
[0497]
[0498][0499]
表3:基于16s rrnav4区域的生态失调聚生体物种至otu的映射
[0500]
[0501][0502]
在儿科人受试者的纵向研究中,鉴定了与防止食物过敏的发展相关的微生物的物种(表4)。
[0503]
表4:在纵向儿科人群组中鉴定的与防止食物过敏的发展相关的另外“有益”otu
[0504]
[0505][0506]
在儿科人受试者的纵向研究中鉴定了与食物过敏的发展相关的微生物(表5)。
[0507]
表5:在纵向儿科人群组中鉴定的与食物过敏的发展相关的另外的“生态失调”otu
[0508]
[0509][0510]
实施例3:用于限定物种的选择中的微生物学水平活性
[0511]
根据具有在宿主中影响有益免疫调节应答的能力的已知生物化学功能、免疫学功能和微生物学功能对限定聚生体中的物种进行选择。不希望受理论束缚,微生物学作用机制可包括以下:
[0512]
微生物产物的佐剂效应:
[0513]
本文描述了刺激调控性t细胞(t
reg
)和其它免疫细胞途径的发育、增殖和活性的微生物产物的实施方案。来自共生厌氧菌的关键微生物抗原的产生(包括它们的脂磷壁酸(lta)、胞外多糖(psa)、lps、细菌鞭毛蛋白和细菌dna)可通过刺激toll样受体途径(例如,tlr
→
myd88和其它免疫细胞途径)起作用,以使粘膜t细胞相对于过敏性表型向调控性表型偏移。相比之下,公开的数据显示来自阴性对照聚生体成员的细菌细胞壁部分可促进对过敏性(t
h
2)应答和促炎(t
h
1)应答两者的异常刺激。这些分子(所述分子倾向于耐受而不是过敏或炎症)的不同部分突出了哺乳动物宿主与定殖微生物群之间的相互影响,包括向宿主发送信号以相对于引发病原性免疫应答维持健康稳态的微生物产物。
[0514]
微生物代谢终产物的粘膜和免疫保护功能:
[0515]
短链脂肪酸(scfa)是微生物厌氧发酵的天然终产物,是来自不同碳源的厌氧发酵的额外小分子代谢物。终产物(如丁酸盐)显示出为肠道上皮细胞提供主要能量来源,并且有助于在粘膜位置中致耐受应答的发展。根据饮食和宿主因子的分泌,通过可能在肠腔中的简单和复杂碳水化合物的发酵,所选择的聚生体产生大量的丁酸盐和丙酸盐。这些因子可能与其它微生物活性组合起作用,以介导所需的免疫调节作用。
[0516]
生物化学活性:
[0517]
所选择的物种完成完整的胆汁酸转化,并且还转化各种其它分子,包括其它胆固醇衍生物、生物胺、脂质)以及产生可在微生物细胞内充当微生物铁载体、群体感应分子以及其它代谢中间体的芳烃。此类代谢物潜在地能够刺激已证明促进肠道粘膜中的致耐受应答的宿主芳烃受体(ahr)途径。
[0518]
肠道调理:
[0519]
从微生物学角度而言,已知聚生体的选定成员有助于其它物种的后续定殖、生物化学作用和进一步的免疫保护作用。当包括在限定菌群中时,脆弱拟杆菌和多形拟杆菌两者均有助于拟杆菌门、厚壁菌门和放线菌门的更苛养成员的生长。多枝梭菌在限定的无菌小鼠定殖方面表现出与其它共生体相当的作用。作用是多因素的,并且包括肠上皮应答的成熟;改变的宿主糖缀合物(其可充当共生菌群的碳源)分泌;增强肠道蠕动和消化;降低肠腔氧张力,从而能够使更多的专性厌氧物种繁荣;以及释放微生物消化的代谢物和/或胞外产物,所述代谢物和/或胞外产物通过提供碳源和/或氮源、维生素以及其它必需微量营养素来支持另外物种的生长。
[0520]
降低生态失调或病原性物种的生物量:
[0521]
由团队实施的动物模型还表明,肠道保护群落中的物种可降低阴性对照聚生体中的变形菌门物种的生物量。不希望受理论的束缚,从机制上讲,这些生物量降低还使来自于优先向过敏性应答偏移的这些物种的产物的抗原负荷降低。
[0522]
实施例4:肠道保护(gp
‑
ii)聚生体
‑
gpiia
[0523]
gp
‑
iia的组成:脆弱拟杆菌、卵形拟杆菌、普通拟杆菌、狄氏副拟杆菌、产黑色普雷沃菌
[0524]
gp
‑
iia可用于预防、治疗和治愈小鼠il4raf709食物过敏模型中的食物过敏。
[0525]
引言:
[0526]
病原性生态失调在食物过敏(fa)中的作用尚不清楚。观察到,fa婴儿表现出随时间推移在组分上进化的生态失调粪便微生物群。患有fa的婴儿和小鼠均具有降低的分泌性iga和增加的与粪便细菌的ige结合,表明fa的口服耐受性破坏程度比迄今所认识的更广泛。共生人梭菌目物种的聚生体(反映受生态失调影响的分类群)遏制了小鼠的fa,并使肠道粘膜免疫应答正常化,人起源的拟杆菌目物种的单独免疫调节聚生体也是如此。两种聚生体诱导在fa受试者和小鼠中缺乏的调控性t(t
reg
)细胞的不同亚群。因此,不同的共生体用于刺激特异性t
reg
细胞群体以防止fa,而生态失调则损害这种调控性应答而促进疾病。
[0527]
食物过敏(fa)是主要的公共卫生问题,在过去十年中其发病率急剧上升。fa现在影响6%的5岁以下的儿童,以及3%的青少年和成人。大多数fa是在生命的第一年或第二年获得的,从而表明儿童早期暴露产生深远的长期健康影响。卫生假说规定,微生物暴露在防止过敏性疾病的过程中起着关键作用,并且那些暴露的改变(包括宿主微生物菌群的变化)可能是过敏性疾病上升的基础。在这方面,一些研究表明,影响生命早期的肠道微生物定殖和组成的因素(包括分娩方法(即剖宫产)、抗生素使用和母乳喂养)都会影响特应性疾病的发展。关于肠道微生物群在人fa中的作用的信息很少。婴儿早期肠道微生物群多样性降低和肠杆菌科物种与拟杆菌科物种的丰度比例升高一直与随后的食物致敏相关,从而表明肠道被特定微生物群落定殖的初始阶段可能促成特应性疾病(包括fa)的发展。
[0528]
先前的研究表明,肠道微生物群的存在和组成影响宿主对fa的易感性。在无菌环
境中饲养的小鼠不能耐受口服给予的抗原,具有降低的iga水平和产生il
‑
10的调控性t(t
reg
)细胞。相比之下,用分节丝状(sfb)和梭菌纲物种进行定殖分别促进产生il
‑
17的t细胞和t
reg
细胞的发育
11,12
。
[0529]
本文提供的结果表明,在fa易发遗传小鼠模型(il4ra
f709
小鼠)中,fa的获得与肠道微生物群特征相关,所述肠道微生物群特征与fa耐受小鼠不同。此外,粪便微生物群从fa而不是耐受小鼠转移至无菌(gf)接受者传递对fa的易感性。最近,stefka等人发现在用抗生素治疗或缺乏共生微生物群的小鼠中对食物过敏原的致敏增加。通过选择性地定殖限菌小鼠,梭菌纲优势微生物群赋予过敏保护性能力。
[0530]
这些发现表明,生命早期肠道微生物群发育的不利改变有利于生态失调群落的出现,同时有益物种随之减少。总的来说,此类变化可导致无法促进耐受性免疫应答,从而增加宿主对过敏性应答和炎症应答的易感性。共生微生物群可促进对食物过敏原的口服耐受性的机制包括其增强上皮细胞屏障完整性和引发保护性粘膜t
reg
细胞应答。通过诸如梭菌纲物种的共生体产生短链脂肪酸如乙酸盐、丙酸盐和丁酸盐,通过在肠道中募集和稳定t
reg
细胞来增强粘膜耐受性。共生细菌的定殖还扩增肠道中诱导的t
reg
(it
reg
)细胞的群体。
[0531]
在此,证明fa婴儿表现出影响有益肠道功能的不断进化的生态失调。此外,施用人起源共生体的限定细菌微生物群(由来自梭菌目的可培养物种和来自拟杆菌目的其它物种组成)成功地预防了fa,并遏制了fa易发il4ra
f709
小鼠中的确定的疾病。两种聚生体均通过诱导保护性t
reg
细胞群体来赋予保护,所述细胞群体在fa受试者和fa易发小鼠中均缺乏。因此,这些结果鉴定共身体预防fa的共同机制,并且强调了采用限定微生物聚生体作为口服微生物疗法在促进疾病预防和缓解方面的潜力。
[0532]
结果:
[0533]
通过免疫调节性人拟杆菌目物种促进fa中的口服耐受性。
[0534]
为了确定促进fa中的口服耐受性的能力是仅限于梭菌目物种还是由其它免疫调节性细菌所共有,测试了5种人起源拟杆菌目物种的聚生体,包括脆弱拟杆菌、卵形拟杆菌、普通拟杆菌、产黑色普雷沃菌和狄氏副拟杆菌(otu24,crs狄氏副拟杆菌)。类似于梭菌目聚生体的情况,这些物种的选择反映了它们作为模式物种的可用性、它们的良好表征的基因组谱和代谢谱、易于培养性以及它们先前在促进肠道中的t
reg
细胞方面的影响。结果表明,在它们用ova/seb敏化后,拟杆菌目聚生体的定殖完全防止gf il4ra
f709
小鼠中的fa诱导(图21a
‑
21e)。此外,按照梭菌目混合物,当在敏化方案期间将它与ova/seb一起给予时,拟杆菌目聚生体保护常规spf il4ra
f709
小鼠免于发展fa(图21f
‑
21i)。这些结果表明,针对fa的保护不是梭菌纲物种的独特属性,而是可受到其它免疫调节性细菌的影响。
[0535]
为了确定一旦疾病建立,使用梭菌目和拟杆菌目聚生体的细菌疗法是否能够抑制fa,将常规il4raf709小鼠每周一次用ova/seb致敏持续八周以建立疾病。然后用短疗程的抗生素治疗小鼠,并在有或没有使用梭菌目、拟杆菌目或变形菌门聚生体的细菌疗法的情况下进一步用ova/seb致敏另外4周。然后用ova口服激发小鼠并进行分析。结果表明,用梭菌目或拟杆菌目而不是变形菌门聚生体的疗法保护ova/seb致敏的il4ra
f709
小鼠免于对ova激发的反应(图22a)。梭菌目和拟杆菌目而不是变形菌门聚生体遏制了总体和ova特异性血清ige应答、ova激发后血清mmcp
‑
1的升高以及肥大细胞扩增(图22b,图22c)。虽然在这种疾病治愈模型中所有细菌聚生体都增加了mln t
reg
细胞的频率(图22d),但是只有梭菌目
和拟杆菌目聚生体而不是变形菌门聚生体遏制了食物过敏相关的t
reg
细胞t
h
2细胞样重编程(图22d)。
[0536]
拟杆菌目聚生体证明,单剂量后小鼠体内的持久性延长。
[0537]
为了确定聚生体成员的持久性,在给药之前和之后,对接受单剂量聚生体的常规il4raf709小鼠进行3周跟踪,连续收集粪便样品。剂量含有大约1x10
7 cfu/g每种生物体。用于每种物种并且不与常规微生物群交叉反应的特异性定量qpcr探针(图23a)用于评估以聚生体剂量施用的生物体的分子生物量。如图23b
‑
23f所示,在采样期过程中,在所有小鼠中,普通拟杆菌和卵形拟杆菌持续存在。在超过一半的小鼠中,可检测到脆弱拟杆菌。在12小时可检测到狄氏副拟杆菌,但此后未检测到。在施用后12小时未检测到产黑色普雷沃菌(在成年小鼠中的肠道运输时间为6
‑
7小时)。
[0538]
序列
[0539]
seq id no:1(脆弱拟杆菌菌株atcc 25285 16s核糖体rna,部分序列)
[0540]
ncbi参考序列:nr_119164.1
[0541][0542]
seq id no:2(卵形拟杆菌菌株atcc 8483 16s核糖体rna,部分序列)
[0543]
ncbi参考序列:nr_119165.1
[0544][0545][0546]
seq id no:3(普通拟杆菌菌株atcc 8482 16s核糖体rna,部分序列)
[0547]
ncbi参考序列:nr_074515.1
[0548][0549][0550]
seq id no:4(沃氏嗜胆菌16s核糖体rna基因,部分序列)
[0551]
genbank:u82813.1
[0552][0553]
seq id no:5([梭菌属]双酶梭菌菌株atcc 638 16s核糖体rna基因,部分序列)
[0554]
ncbi参考序列:nr_112171.1
[0555][0556]
seq id no:6(16s rrna的平野氏梭菌基因,部分序列,菌株:to
‑
931)
[0557]
genbank:ab023970.1
[0558][0559]
seq id no:7(梭柔嫩梭菌16s核糖体rna)
[0560]
genbank:m59095.1
[0561][0562]
seq id no:8(多枝梭菌16s核糖体rna小亚基。)
[0563]
登录:m23731.1
[0564]
[0565][0566]
seq id no:9(16s rrna的萨尔迪纳梭菌基因,菌株:dsm599,亚_克隆:c1。)
[0567]
序列:ab161369.1
[0568]
[0569][0570]
seq id no:10([梭菌属]闪烁梭菌菌株atcc 35704 16s核糖体rna,部分序列
[0571]
ncbi参考序列:nr_028785.1
[0572][0573][0574]
seq id no:11(尼氏大肠杆菌1917菌株urcs8 16s核糖体rna基因,部分序列)
[0575]
genbank:kt000039.1
[0576][0577]
seq id no:12(产酸克雷伯氏菌)
‑
培养物保藏atcc:700324克隆d08 16s
‑
23s核糖体rna基因间间隔区,部分序列;以及trna
‑
ile和trna
‑
ala基因,完整序列)
[0578]
genbank:eu623169.1
[0579][0580]
seq id no:13(狄氏副拟杆菌菌株atcc 8503 16s核糖体rna,部分序列)
[0581]
ncbi参考序列:nr_074376.1
[0582][0583]
seq id no:14(产黑色普雷沃菌菌株atcc 25845 16s核糖体rna基因,部分序列)
[0584]
ncbi参考序列:nr_042843.1
[0585][0586]
seq id no:15(奇异变形杆菌菌株atcc 29906 16s核糖体rna基因,部分序列)
[0587]
ncbi参考序列:nr_114419.1
[0588]
相关技术
网友询问留言
已有0条留言
- 还没有人留言评论。精彩留言会获得点赞!
1