可滤过的含倍癌霉素抗体-药物缀合物组合物及相关方法与流程
本发明涉及包含含倍癌霉素(duocarmycin)抗体-药物缀合物(antibody-drugconjugate,adc)和任选的非缀合形式的倍癌霉素接头-药物的组合物。特别地,所述组合物允许容易地滤出adc并与非缀合形式的倍癌霉素接头-药物(如果存在的话)分离。
本发明还涉及用于组合物制备和用于批准含倍癌霉素adc批次的方法。
背景技术:
单克隆抗体(monoclonalantibody,mab)是制药行业最重要的试剂之一。mab也已与多种细胞毒性药物缀合以形成抗体-药物缀合物或“adc”。通常来说,接头将细胞毒性药物连接至mab。因此,adc包含单克隆抗体、接头和细胞毒性药物。可以使用表面暴露的赖氨酸(p.m.lorussoetal.,clinicalcancerresearch,2011,17(20),6437-6447)或通过链间二硫键的还原产生的游离半胱氨酸(j.katzetal.,clinicalcancerresearch,2011,17(20),6428-6436;p.dsenteretal.,naturebiotechnology2012,30(7),631-637)的侧链使接头-药物与抗体缀合。或者,缀合可以是通过突变mab的合适位置处的工程化半胱氨酸残基的侧链进行的位点特异性缀合(c.r.behrensandb.liu,mabs,2014,6(1),46-53)。
倍癌霉素已经用作adc中的细胞毒性药物(wo2008/083312、wo2010/062171、wo2011/133039、wo2015/177360)。倍癌霉素,首次分离自链霉菌属(streptomyces)物种的培养液,是抗肿瘤抗生素家族的成员,该家族包括倍癌霉素a、倍癌霉素sa和cc-1065。倍癌霉素与dna的小沟结合并且随后引起dna的不可逆烷基化。这破坏了核酸结构,最终导致肿瘤细胞死亡。
近年来,含倍癌霉素adc如曲妥珠单抗多卡马嗪(trastuzumabduocarmazine)(syd985,曲妥珠单抗vc-seco-duba)已进入临床前和临床开发(m.m.c.vanderleeetal.,molecularcancertherapeutics,2015,14(3),692-703;j.blacketal.,molecularcancertherapeutics,2016,15(8),1900-1909;clinicaltrials.govnct02277717)。基于其潜在的抗肿瘤活性,预期将研究更多的含倍癌霉素adc。
在用于生产adc的工业方法中,在接头-药物与mab缀合之后,进行多种纯化步骤。进行质量控制程序以确保这些生物治疗分子的批次间可重复性。由于其毒性,adc组合物中必须严格控制的杂质之一是游离接头-药物、即非缀合形式的接头-药物的含量。
为了确定游离接头-药物的含量,通常实践是首先相对于游离接头-药物降低adc的浓度,然后测量游离接头-药物的量。否则,adc的高浓度使得很难确定接头-药物的非常低的含量。实际上,adc的量可能为约10mg/ml,而游离接头-药物的量通常小于10μg/ml,并且通常小得多,例如为0.2μg/ml或0.1μg/ml。在常规色谱分析技术中,极大过量的adc通常掩盖了游离接头-药物的非常小的含量(如果有的话);例如,非常低的浓度导致游离接头-药物被其他组分所掩盖和/或另外低于检出限(limitofdetection)。
因此,常规上,可以通过将adc与含水样品的其余部分分离然后分析样品的其余部分中(游离)接头-药物的存在来确定游离接头-药物的含量。例如,使用截留分子量为约30kda的过滤器的离心过滤对含水样品进行直接过滤通常可以获得包含游离接头-药物的滤液,而adc则保留在过滤器上(参见wo2015/095953,第194页,组织蛋白酶b接头裂解试验)。或者,已经通过用冷甲醇处理样品并对其进行离心以使得adc沉淀而非缀合形式的接头-药物保留在上清液中来使游离接头-药物与adc分离(参见,l.chenetal.,mabs,2016,8(7),1210-1223)。
然而,我们发现,倍癌霉素接头-药物存在异常困难。如本领域中所公开的典型过滤程序或直接沉淀无法将游离倍癌霉素接头-药物与含倍癌霉素adc充分分离。例如,在过滤过程中,游离倍癌霉素接头-药物倾向于不通过过滤器进入滤液,而是与含倍癌霉素adc一起保留在过滤器上。这导致在滤液中捕获的游离接头-药物的量不充分,并且使得游离接头-药物含量的测定不准确。因此,需要用于使游离倍癌霉素接头-药物与含倍癌霉素adc分离的方法。类似地,需要用于在含有含倍癌霉素adc和倍癌霉素接头-药物(如果存在的话)的样品中对倍癌霉素接头-药物进行检测和定量的方法。
技术实现要素:
本发明部分地基于以下发现:乙腈可有助于通过过滤使非缀合形式的倍癌霉素接头-药物与含倍癌霉素adc分离。
因此,本发明的第一方面涉及组合物,其包含:(a)包含水和乙腈的溶剂体系;(b)酸;(c)式(i)的抗体-药物缀合物:
ab-(l-d)m(i),
其中ab是抗体或其抗原结合片段,l-d是倍癌霉素接头-药物,并且m表示平均dar,其为1至12;以及任选地,(d)非缀合形式的倍癌霉素接头-药物;
其中所述组合物包含30%至60%(v/v)的所述乙腈,优选35%至55%的所述乙腈。
本发明的另一方面涉及一种方法,其包括将(i)式(i)的抗体-药物缀合物的水溶液或冻干产品与(ii)包含水、乙腈和酸的稀释介质合并以形成组合物:
ab-(l-d)m(i),
其中ab是抗体或其抗原结合片段,l-d是倍癌霉素接头-药物,并且m表示平均dar,其为1至12,所述水溶液或冻干产品任选地还包含非缀合形式的倍癌霉素接头-药物,
其中所述组合物包含30%至60%(v/v)、优选35%至55%的所述乙腈。
本发明的另一方面涉及放行(releasing)/批准(approving)抗体-药物缀合物批次的方法,其包括:
1)从抗体-药物缀合物批次获得样品,其中所述批次包含与倍癌霉素接头-药物缀合的抗体和任选的非缀合形式的倍癌霉素接头-药物;
2)将所述样品与包含水、乙腈和酸的稀释介质合并以形成可滤过的组合物,所述可滤过的组合物包含30%至60%(v/v)、优选35%至55%的所述乙腈;
3)过滤所述可滤过的组合物以获得基本上不含所述抗体-药物缀合物的滤液;
4)分析所述滤液并确定所述滤液包含的所述非缀合形式的倍癌霉素接头-药物是否低于预定水平;以及
5)如果所述非缀合形式的倍癌霉素接头-药物低于所述预定水平,则放行/批准所述抗体-药物缀合物批次。
附图说明
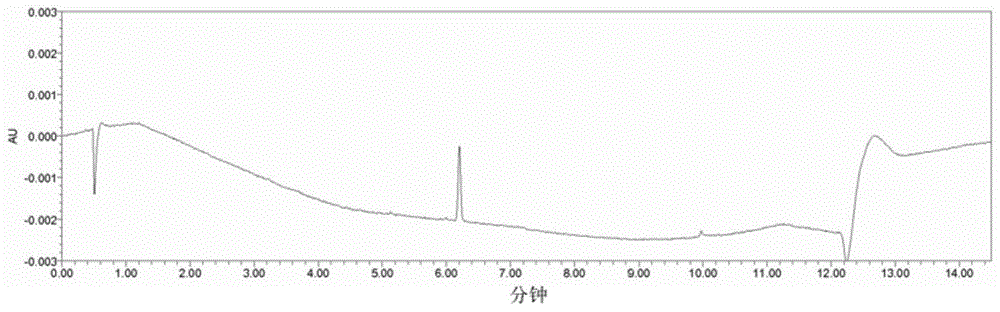
图1示出根据实施例1的非缀合的倍癌霉素接头-药物vc-seco-duba的色谱图。
图2示出来自实施例2的色谱图,其中分析了来自曲妥珠单抗多卡马嗪批次的样品,并且发现其没有可检出的游离倍癌霉素接头-药物,并且因此是满足放行/批准条件的批次。
图3示出来自实施例3的三个色谱图,其中乙腈的百分比随着色谱图向下而提高,使得顶部色谱图使用30%的乙腈形成,中间使用40%的乙腈,并且底部使用55%的乙腈。
具体实施方式
本发明涉及组合物,其包含:(a)包含水和乙腈的溶剂体系;(b)酸;(c)式(i)的抗体-药物缀合物:
ab-(l-d)m(i),
其中ab是抗体或其抗原结合片段,l-d是倍癌霉素接头-药物,并且m表示平均药物-抗体比(dar),其为1至12;以及任选地,(d)非缀合形式的倍癌霉素接头-药物;
其中所述组合物包含30%至60%(v/v)、优选35%至55%的所述乙腈。
本发明中使用的溶剂体系包含水和乙腈。如本文所用,术语“溶剂体系”是指可以使非缀合形式的倍癌霉素接头-药物溶解的溶剂的混合物。通常来说,溶剂体系由水和乙腈组成,但是在一些实施方案中可以存在另外的溶剂。例如,可以任选地存在其他可与水混溶的有机溶剂,例如c1-c6醇(例如,甲醇或乙醇)或多元醇。一般地,任何另外的溶剂占组合物的少于20%(v/v);通常少于10%;并且通常少于5%。通常来说,溶剂体系由水和乙腈组成。水的质量没有特别限制,但是出于实际原因,有利地使用相对纯的水,例如di水,并且更优选milli-q水。
乙腈以30%至60%(v/v)的浓度使用。高于60%的浓度倾向于导致含倍癌霉素adc过多地渗漏通过过滤器。这种渗漏将导致滤液的adc浓度与游离接头-药物的低浓度相比过高,并且从而干扰游离接头-药物的量的准确测定;例如掩盖。通常来说,当样品中超过1.0%的adc进入滤液时,渗漏量就过高,并且通常不超过0.5%是可接受的。通常来说,当存在渗漏时,进入滤液的adc的量为0.3%或更少,更经常为0.2%或更少,并且通常为0.1%或更少。另一方面,乙腈的浓度低于30%时倾向于导致分离不充分;即非缀合形式的倍癌霉素接头-药物(大部分)不能通过过滤器,并且因此无法分离。不希望受到理论的束缚,发明人推断,倍癌霉素接头-药物(非缀合形式)与含倍癌霉素adc之间的疏水相互作用阻止或阻碍了分离。添加足量的乙腈作为溶剂体系的一部分允许充分克服这些力,从而允许更容易通过过滤分离。通过不添加过多的乙腈,避免了损坏过滤器,并且可以使含倍癌霉素adc的渗漏最小化或被阻止。此外,浓度为30%至60%(v/v)的乙腈不会影响adc、抗体或倍癌霉素接头-药物的稳定性。因此,发明人惊奇地发现,游离倍癌霉素接头-药物当处于包含水、酸以及浓度为30%至60%(v/v)、优选35%至55%、最优选40%的乙腈的组合物中时可以容易且充分地滤过。
用于本发明的合适的酸是有机酸或无机矿物酸。通常来说,用于本发明的酸选自三氟乙酸、甲酸和盐酸。酸的量不是关键的,只要组合物是酸性的即可,即使仅略微酸性。通常来说,使用酸以使得组合物的ph低于7。组合物可具有浓度为0.01%至5%(v/v)、或0.05%至2%、或0.05%至1.5%、或0.1%至1%的酸。
在本发明的组合物中,adc含量没有特别限制。通常来说,组合物包含浓度为0.1至100mg/ml、更典型地0.5至50mg/ml、并且通常1.0至10mg/ml的adc。非缀合(游离)倍癌霉素接头-药物的量典型地为0至100μg/ml、更典型地0至10μg/ml、并且通常0至1μg/ml。在多个实施方案中,adc浓度为游离倍癌霉素接头-药物的浓度的至少1,000倍高。
组合物可以包含另外的成分,例如缓冲剂和/或盐,例如通常用于柱色谱或uf/df的那些,或糖,例如甘露醇,和/或可以存在于最终剂型(也称为药物产品)中其他赋形剂。
在式(i)的adc中,ab可以是任何抗体或其抗原结合片段,例如f(ab′)2或fab′片段、单链(sc)抗体、scfv、单结构域(sd)抗体、双抗体或微抗体。通常来说,抗体或其任何抗原结合片段是具有治疗活性的那些,但是如adc领域中已知的那样,这种独立功效不是必需的。抗体可以是任何同种型,例如igg、iga或igm抗体。优选地,抗体是igg抗体,更优选地是igg1或igg2抗体。抗体可以是嵌合的、人源化的或人的。优选地,抗体是人源化的。甚至更优选地,抗体是人源化或人igg抗体,最优选地是人源化或人igg1单克隆抗体(mab)。优选地,所述抗体具有κ(kappa)轻链,即人源化或人igg1-κ抗体。
为了清楚起见,“人源化”抗体是指具有源自来自非人物种(通常为小鼠、大鼠或兔)的抗体的抗原结合互补决定区(cdr)但是具有至少部分为人的框架的抗体。例如,可以将非人cdr置于重链(hc)和轻链(lc)的可变区的人框架(框架区(fr)fr1、fr2、fr3和fr4)之内;即,完全人框架支持非人cdr。然而,可以将人fr中的所选氨基酸交换为相应的非人框架氨基酸,例如以改善结合亲和力,同时保持低免疫原性。进一步地,非人框架可以大部分保留并且可以将非人物种fr的仅所选氨基酸交换成其相应人氨基酸以降低免疫原性,同时保留抗体的结合亲和力。所有这些选项都被认为是用于本发明目的的“人源化”可变区。如此人源化的可变区与人恒定区组合以形成人源化抗体。
这些抗体可以重组、合成或通过本领域已知的其他合适方法产生。
抗体可以是单特异性的(即对一种抗原具有特异性;这样抗原可以在物类之间共有或在物类之间具有相似的氨基酸序列)或双特异性的(即对一个物类的两种不同抗原具有特异性),并且包含与选自以下的靶标结合的至少一个hc和lc可变区:膜联蛋白a1、b7h4、ca6、ca9、ca15-3、ca19-9、ca27-29、ca125、ca242(癌抗原242)、ccr2、ccr5、cd2、cd19、cd20、cd22、cd30(肿瘤坏死因子8)、cd33、cd37、cd38(环状adp核糖水解酶)、cd40、cd44、cd47(整联蛋白相关蛋白)、cd56(神经细胞粘附分子)、cd70、cd74、cd79、cd115(集落刺激因子1受体)、cd123(白介素-3受体)、cd138(黏结蛋白聚糖1)、cd203c(enpp3)、cd303、cd333、cea、ceacam、clca-1(c型凝集素样分子-1)、cll-1、c-met(肝细胞生长因子受体)、cripto、dll3、egfl、egfr、epcam、eph(例如epha2或ephb3)、etbr(内皮素b型受体)、fap、fcrl5(fc受体样蛋白5、cd307)、fgfr(例如fgfr3)、folr1(叶酸受体α)、gcc(鸟苷酸环化酶c)、gpnmb、her2、hmw-maa(高分子量黑素瘤相关抗原)、整联蛋白a(例如αvβ3和αvβ5)、igf1r、tm4sf1(或l6抗原)、路易斯a样糖类、路易斯x、路易斯y(cd174)、livl、间皮素(msln)、mn(ca9)、muc1、muc16、napi2b、连接蛋白-4(nectin-4)、pd-1、pd-l1、psma、ptk7、slc44a4、steap-1、5t4抗原(或tpbg,滋养层糖蛋白)、tf(组织因子、促凝血酶原激酶、cd142)、tf-ag、tag72、tnfr、trop2(肿瘤相关钙信号转导子2)、vegfr和vla。
合适抗体的实例包括博纳吐单抗(blinatumomab)(cd19)、依帕珠单抗(epratuzumab)(cd22)、伊妥木单抗(iratumumab)和本妥昔单抗(brentuximab)(cd30)、伐达妥昔单抗(vadastuximab)(cd33)、tetulumab(cd37)、伊沙妥昔单抗(isatuximab)(cd38)、比伐珠单抗(bivatuzumab)(cd44)、洛沃妥珠单抗(lorvotuzumab)(cd56)、沃瑟妥珠单抗(vorsetuzumab)(cd70)、米拉珠单抗(milatuzumab)(cd74)、波妥珠单抗(polatuzumab)(cd79)、洛伐妥珠单抗(rovalpituzumab)(dll3)、伏妥昔单抗(futuximab)(egfr)、奥珀妥珠单抗(oportuzumab)(epcam)、法乐妥珠单抗(farletuzumab)(folr1)、格巴妥木单抗(glembatumumab)(gpnmb)、曲妥珠单抗和帕妥珠单抗(pertuzumab)(her2)、伊瑞西珠单抗(etaracizumab)(整联蛋白)、阿奈妥单抗(anetumab)(间皮素)、潘科曼单抗(pankomab)(muc1)、恩弗妥单抗(enfortumab)(连接蛋白-4)以及h8、a1、和a3(5t4抗原)。
在一个优选的实施方案中,式(i)化合物中的ab是抗her2抗体,甚至更优选的ab是抗her2抗体曲妥珠单抗。
在本发明的上下文中,式(i)化合物中的-l-d可以是任何倍癌霉素接头-药物部分。倍癌霉素部分优选如下式之一所示:
其中:
r1、r2和r3独立地选自h、oh、sh、nh2、n3、no2、no、cf3、cn、c(o)nh2、c(o)h、c(o)oh、卤素、ra、sra、s(o)ra、s(o)2ra、s(o)ora、s(o)2ora、os(o)ra、os(o)2ra、os(o)ora、os(o)2ora、ora、nhra、n(ra)rb、+n(ra)(rb)rc、p(o)(ora)(orb)、op(o)(ora)(orb)、sirarbrc、c(o)ra、c(o)ora、c(o)n(ra)rb、oc(o)ra、oc(o)ora、oc(o)n(ra)rb、n(ra)c(o)rb、n(ra)c(o)orb、n(ra)c(o)n(rb)rc和水溶性基团,其中ra、rb和rc独立地选自h和任选取代的(ch2ch2o)aach2ch2x1ra1、c1-15烷基、c1-15杂烷基、c3-15环烷基、c1-15杂环烷基、c5-15芳基或c1-15杂芳基,其中aa选自1至1000,x1选自o、s和nrb1,并且rb1和ra1独立地选自h和c1-3烷基,并且进一步地条件是,ra、rb和/或rc中的一个或更多个任选的取代基可以任选地是水溶性基团,并且ra、rb和rc中的两个或更多个任选地可以通过一个或更多个键连接以形成一个或更多个任选取代的碳环和/或杂环。
接头部分(-l-)可以是用于将药物连接至抗体或其抗原结合片段的任何已知的或合适的部分。通常来说,接头在某些条件下是可裂解的,从而从抗体中释放药物,如本领域中已知的。
接头的与抗体(或其片段)键合的末端通常包含可以在相对温和的条件下与ab的天然或非天然氨基酸反应的官能团。该官能团在本文中称为反应性部分(rm)。反应性部分的实例包括但不限于氨基甲酰卤、酰基卤、活性酯、酸酐、α-卤代乙酰基、α-卤代乙酰胺、马来酰亚胺、异氰酸酯、异硫氰酸酯、二硫化物、硫醇、肼、酰肼、磺酰氯、醛、甲基酮、乙烯砜、卤代甲基和甲基磺酸酯。
在本发明的一个优选实施方案中,rm是:
其中:
x5选自-cl、-br、-i、-f、-oh、-o-n-琥珀酰亚胺、-o-(4-硝基苯基)、-o-五氟苯基、-o-四氟苯基、-o-c(o)-r4和-o-c(o)-or4;
x6选自-cl、-br、-i、-o-甲磺酰基、-o-三氟甲磺酰基和-o-甲苯磺酰基;
r4是支化或非支化的c1-c10烷基或芳基。
倍癌霉素接头-药物可以以缀合形式(-l-d)或非缀合形式(l-d)表示,非缀合形式也称为“游离”接头-药物。因此,下式(ii)和(iv)分别表示缀合形式和非缀合形式的优选的倍癌霉素接头-药物。类似地,式(iii)和(v)分别表示缀合形式和非缀合形式的替代的优选的倍癌霉素接头-药物:
其中:
n为0至3;
r5选自:
y为1至16;并且
r6选自:
如式(iii)(缀合形式)和式(v)(非缀合形式)所示的替代倍癌霉素接头-药物如下示出:
其中:
v1是条件可裂解或条件可转化的部分,其可通过化学、光化学、物理、生物或酶促方法裂解或转化;z为倍癌霉素衍生物,n为0、1、2或3;并且p为0或1。
优选地,z为下式的倍癌霉素部分:
如上文所述(和限定)。用于本发明的此类倍癌霉素部分(例如z)的具体实例包括:
特别优选的一种倍癌霉素接头-药物物质以以下形式所示:缀合形式:
以及相应的非缀合形式(即vc-seco-duba):
为简洁起见,以下倍癌霉素接头-药物物质仅以缀合形式示出,然而应理解,如本领域技术人员所理解的,也考虑了相应的非缀合形式:
本发明的组合物可用于便于仅通过过滤就使含倍癌霉素adc与游离倍癌霉素接头-药物分离。这种分离允许在没有大量adc负担的情况下分析滤液中非常少量的游离接头-药物。从广义上讲,本发明的组合物使得adc组合物中游离接头-药物的存在和/或量的检测更加准确、方便且实用。
游离倍癌霉素接头-药物的量的检测和/或定量可具有多种作用,包括开发稳健的adc纯化方法,adc药物或药物产品的质量控制以及药物或药物产品的稳定性测试等应用。应当理解,在adc的大多数药物应用中,目的是存在很少乃至不存在游离接头-药物。倍癌霉素药物是强效的。当与抗体或其抗原结合片段缀合时,倍癌霉素药物作为细胞毒性载荷被递送至抗体靶向部位。然而,作为游离倍癌霉素接头-药物,可破坏随机的健康细胞;因此,需要将游离倍癌霉素接头-药物的量严格控制至低水平。提供具有显著量的游离倍癌霉素接头-药物的含倍癌霉素adc可给患者带来无法接受的风险。因此,游离倍癌霉素接头-药物仅任选地存在于本发明的可滤过的组合物中,因为纯化方案有望除去了所有游离接头-药物。无论是否存在,重要的是要有方法可以确认adc组合物中游离倍癌霉素接头-药物不存在和/或将其量定量(如果存在的话)至非常低的检出水平。
本发明的组合物可以通过将溶剂、酸和adc组合的任何方法来制备。成分的添加顺序以及是按顺序还是同时进行均不受限制。然而,通常将水溶液或冻干产品形式的adc与包含水、乙腈和酸的稀释介质合并以形成本发明的可滤过的组合物。
因此,本发明的另一方面涉及一种方法,其包括将(i)式(i)adc的水溶液(或冻干产品)与(ii)包含水、乙腈和酸的稀释介质合并以形成本发明的可滤过的组合物:
ab-(l-d)m(i),
所述水溶液(或冻干产品)任选地还包含相应的非缀合形式的倍癌霉素接头-药物,
所述组合物包含30%至60%(v/v)、优选35%至55%的所述乙腈。
adc的水溶液可来自多种来源。例如,adc水溶液可以取自其中发生使接头-药物与抗体(或其抗原结合片段)连接的缀合反应的反应介质,或取自随后纯化或分离的缀合反应产物,即经纯化形式的倍癌霉素adc,例如作为冻干产品。
这些adc水溶液中的任选的游离倍癌霉素接头-药物通常是未反应的接头-药物。由于缀合反应通常使用摩尔过量的接头-药物,因此经常采用纯化以确保去除任何游离倍癌霉素接头-药物。因此,来自这些来源的水溶液可旨在监测缀合反应的程度或评估纯化方案。
adc水溶液的另一个来源是从最终adc药物物质或药物产品中获取样品。adc通常作为可注射组合物递送,并且因此药物物质以及药物产品通常为水溶液的形式。这样的水溶液中的游离倍癌霉素接头-药物(如果有的话)可由于在纯化过程中游离倍癌霉素接头-药物的不完全去除和/或由于倍癌霉素接头-药物意外地从adc裂解而引起的。这些来源可来自稳定性测试和/或参考样品,以确定或监测adc组合物随时间的稳定性,例如,确认在储存条件下游离接头-药物没有形成/裂解。
或者,药物物质或药物产品可以是冻干形式(“冻干产品”)。冻干产品通常用水重构以形成adc水溶液。该重构液体组合物的全部或一部分可以用作adc水溶液。另一种选择是直接将冻干产品与本发明的稀释介质合并,而无需制备中间的重构水溶液。
如本领域技术人员理解的,鉴于溶液的不同来源,adc水溶液可以包含另外的成分,例如缓冲剂、盐、糖(例如甘露醇)、冻干结块剂等。同样地,冻干产品可包含另外的成分,例如缓冲剂、冻干保护剂、表面活性剂、稳定剂等。
向adc水溶液或冻干产品中添加单一稀释介质是形成本发明的可滤过的组合物的方便方法。稀释介质包含水、足够量的乙腈和酸,以形成期望的乙腈浓度;例如,30%至60%(v/v),优选35%至55%,并且最优选40%。通过添加足够量的稀释介质以形成期望的乙腈浓度,本发明的可滤过的组合物在单个步骤中形成。
可以通过过滤器过滤本发明的组合物以形成基本上不含adc的滤液。如在本发明中使用的,术语“基本上不含”是指包含不超过1%的存在于本发明组合物中的adc量的滤液。通常来说,量为0.5%或更少,更典型地为0.2%或更少,并且通常为0.1%或更少。为了清楚起见,如果本发明的组合物包含2.5mg/ml的adc,则滤液中可以存在不超过1%或0.025mg/ml的adc。
如本领域技术人员将理解的,过滤器的截留分子量是抗体或抗原结合片段的分子量的1/3至1/6倍小。实际上,过滤器的截留分子量为1至100kda,更优选为3kda至50kda,甚至更优选为10至30kda。对于式(i)的adc,特别优选的是截留分子量为10kda的过滤器。
过滤技术没有特别限定;但是通常认为离心过滤是最方便的。可以使用重力过滤,但这需要更多时间才能完成。多种商业离心过滤装置是已知的和可用的。例如,pall公司制造了
允许使adc与相应的游离倍癌霉素接头-药物分离的任何合适的过滤器材料均可用于本发明,并且可由本领域技术人员确定。一些过滤器材料比其他过滤器材料更稳健,因为有机溶剂(乙腈)可对过滤器造成损坏。这种损坏可能导致过滤器材料不适合于分离,例如,造成允许adc过多地渗漏通过过滤器的孔或漏洞。商业过滤器材料通常包含由改性尼龙、亲水性聚丙烯、聚醚砜材料或改性聚醚砜材料制成的膜。为了本发明的目的,优选的过滤器材料包含改性聚醚砜材料,例如可从pallcorp获得的可商购的
在进行过滤之前,使组合物均质化可以是有用的。均质化可用允许乙腈在组合物中均匀分布的任何合适的装置进行。均质化可进一步有利于仅通过过滤就使含倍癌霉素adc与游离倍癌霉素接头-药物分离。
在将本发明的组合物施加于过滤器之后,通过过滤器的液体(即“滤液”)将基本上不含式(i)的adc。然后可以分析滤液的倍癌霉素接头-药物以确定(如果有的话,并且任选地)滤液中存在多少浓度。可以使用任何合适的技术。通常来说,使用(液相)色谱法,例如高效液相色谱(hplc)或超高效液相色谱(uplc)。通常来说,所使用的色谱是反相的;例如反相高效液相色谱(rp-hplc),或更优选,反相超高效液相色谱(rp-uplc)。如本领域技术人员已知的,选择合适的色谱条件,包括柱填充材料、流动相、使用的梯度以及一般的上样/结合条件和洗脱条件是常规技术的问题。为了检测非缀合形式的倍癌霉素接头-药物,在本发明中可以使用任何合适的检测器。通常来说,使用uv检测器。有利的是,与uv检测器偶联的uplc为分析包含少量非缀合形式的倍癌霉素接头-药物的样品提供了良好的解决方案。
存在于所述滤液中的非缀合形式的倍癌霉素接头-药物的量(如果有的话)的测量(定量测定)通常与水溶液中包含的游离倍癌霉素接头-药物的量相关。通过在过滤过程中使用本发明的组合物以获得基本上不含adc的滤液,色谱分离和检测对于游离接头-药物的定量限可以为0.2μg/mgadc或更小。即,通过将定量测定与原始adc水溶液(例如药物物质)相关联,可以将游离接头-药物的量测定低至每1mgadc至少0.2μg。实际上,定量限可以更低,例如为0.1μg/mg或0.01μg/mg,等等。
本发明的一项具体应用涉及放行/批准adc批次的方法,其包括:
1)从adc批次获得样品,其中所述批次包含与倍癌霉素接头-药物缀合的抗体和任选的非缀合形式的倍癌霉素接头-药物;
2)将所述样品与包含水、乙腈和酸的稀释介质合并以形成可滤过的组合物,所述可滤过的组合物包含30%至60%(v/v)、优选35%至55%的所述乙腈;
3)过滤所述可滤过的组合物以获得基本上不含所述adc的滤液;
4)分析所述滤液并确定所述滤液包含的所述非缀合形式的倍癌霉素接头-药物是否低于预定水平;以及
5)如果所述非缀合形式的倍癌霉素接头-药物低于所述预定水平,则放行/批准所述adc批次。
如本文所用,术语“抗体-药物缀合物批次”或“adc批次”是指商业规模的adc生产,其已完成所有加工阶段,因此其为经纯化形式并且任选地包含赋形剂,例如适合于肠胃外制剂或冻干产品的那些。实际上,adc的批次大小通常为至少30l。监管机构(例如ema、fda等)要求药品的这种商业批次满足多种纯度和质量标准。对于adc,这些纯度标准之一是游离接头-药物的量。上述方法结合了本发明的组合物并且其有利地用于使倍癌霉素adc与游离倍癌霉素接头-药物分离以更好地检测这种游离接头-药物的存在(如果有的话)。因此,通常通过rp-uplc分析滤液,以确定非缀合的倍癌霉素接头-药物的量是否低于监管限值(即“预定水平”)。预定水平通常非常低,并且通常要求游离倍癌霉素接头-药物相对于adc量的最大量为0.2μg/mg,优选0.1μg/mg,更优选0.02μg/mg。预定水平的确定可以通过数值或作为检出限(lod)测试来进行。在后一种情况下,检出限可以等于或小于预定水平,并且因此阴性结果(没有游离的连接体-药物)被认为满足(小于)预定水平。可以采用使用定量限(loq)的类似策略,其中观察到游离接头-药物的存在,但其低于定量限。因为定量限等于或低于预定水平,因此任何低于定量限的检出量都被认为低于预定水平。在任一种情况下,即使未确定数值也可以批准该批次,因为量仍低于预定限。
一旦样品显示非缀合的倍癌霉素接头-药物的量低于预定水平,则可以放行或批准adc批次出售、运输、患者使用等。在本发明的上下文中,术语“放行/批准”是指adc批次至少在游离倍癌霉素接头-药物要求方面满意。高于游离倍癌霉素接头-药物的预定水平的样品将不适合放行进入临床试验或批准作为商业药物(不适合销售或使用)。这样的批次将不会被放行或批准。通常来说,药品必须通过许多质量测量,并且其中任一项的失败都会阻碍最终放行或批准。因此,如在本发明上下文中使用的,放行/批准是指在游离倍癌霉素接头-药物含量方面获得adc产品批次的放行或批准,而不一定是该批次的最后或最终放行和/或批准。
尽管已出于确定滤液是否包含非缀合形式的倍癌霉素接头-药物的目的对上述发明进行了详细描述,但是对于本领域普通技术人员来说显而易见的是,可以采用类似的方法来确定其他杂质。特别地,组合物及其过滤可用于提供其中可以测量倍癌霉素接头-药物相关杂质的样品。如本发明中所用的术语“倍癌霉素接头-药物相关杂质”是指在含倍癌霉素adc药物物质和药物产品的合成、纯化和储存过程中可以由倍癌霉素接头-药物的降解产生的杂质。这些分子量通常小于2,000da(典型接头-药物的分子量)的小分子杂质也可能导致毒性,并且因此监管机构可以为一种或更多种这样的杂质建立最大阈值(或预定水平)。利用本发明的方法,可以确定这些杂质的存在和定量测定。
以下实施例旨在举例说明本发明的范围,但其不限于此。
实施例
材料和方法
使用wo2011/133039中描述的材料和程序获得曲妥珠单抗多卡马嗪(syd985)和接头-药物vc-seco-duba(syd980)。试剂、溶剂和缓冲液购自商业供应商。
样品和空白样品如下所述制备。
样品制备或空白品制备
使用移液管取出100μl的含有含倍癌霉素adc(10mg/ml)并且还可能含有一些非缀合形式的倍癌霉素接头-药物的样品并将其引入10k过滤器(
空白品制备按照与上述相同的程序进行,但使用100μlmilli-q水代替含有含倍癌霉素adc和非缀合形式的倍癌霉素接头-药物的样品。
外标样品制备
外标样品用于计算样品中非缀合形式的倍癌霉素接头-药物的浓度。用0.25μg/ml非缀合形式的倍癌霉素接头-药物制备外标样品。
rp-uplc
为了分析目的,将10μl的hplc小瓶样品或hplc空白小瓶样品进样到具有异丁基侧链和tms封端的十八烷基(c18)衍生二氧化硅的反相超高效液相色谱(rp-uplc)柱(kinetex1.7μm,xb-c18
cl-d是样品中非缀合形式的倍癌霉素接头-药物的浓度,al-d是样品中非缀合形式的倍癌霉素接头-药物的峰面积,cstd是外标品中非缀合形式的倍癌霉素接头-药物的浓度,n是样品的稀释因子,astd是外标品中非缀合形式的含倍癌霉素接头-药物的平均(至少3次运行的平均值)峰面积。
用式(vii)计算倍癌霉素相关杂质的量,
ci是样品中倍癌霉素相关杂质的浓度,ai是样品中倍癌霉素相关杂质的峰面积,cstd是外标品中非缀合形式的倍癌霉素接头-药物的浓度,n是样品的稀释因子,astd如上定义,并且rrfi是倍癌霉素相关杂质的相对响应因子。
表1.梯度程序
实施例1-外标样品
用上文讨论的rp-uplc方法分析非缀合形式的倍癌霉素接头-药物vc-seco-duba(syd980)(0.25μg/ml)。图1是由此获得的色谱图的一个代表。图1示出了6.205分钟处对应于非缀合的倍癌霉素接头-药物(vc-seco-duba)的清晰的峰。
实施例2-adc分析
按照上述样品制备程序处理来自曲妥珠单抗多卡马嗪批次的样品,并且利用上述rp-uplc方法进行分析。获得的色谱图显示不存在非缀合的接头-药物vc-seco-duba。图2是由此获得的色谱图的一个代表,并且在6.2分钟或其附近未检测到峰。该分析确定了样品中游离倍癌霉素接头-药物的量低于检出限,并且因此低于预定水平(即,通过/失败检测测试)。因此,放行/批准该批次是适当的。
实施例3-组合物的比较
将100μl的包含曲妥珠单抗多卡马嗪(10mg/ml)和vc-seco-duba(0.25μg/ml)的样品引入10k过滤器(
表2.vc-seco-duba的回收结果
a:三个样品的相对标准偏差
b:在平均值和rsd中仅使用了两个样品,因为第三个具有adc渗漏,其程度使得排除了该样品。
第一实验系列表明,乙腈有利于仅通过过滤就使曲妥珠单抗多卡马嗪与其非缀合的倍癌霉素接头-药物vc-seco-duba分离。当使用与甲酸或三氟乙酸组合的40%乙腈时,获得了vc-seco-duba的最佳回收。当使用甲醇代替乙腈时,无法获得vc-seco-duba的回收。
第二实验系列表明,乙腈量的提高有利于vc-seco-duba的回收,其从12%(在25%乙腈下)提高到90%(在50%乙腈下)。如果乙腈为至少30%,则获得的回收是可接受的。图3分别代表从实验5(30%acn)、实验1(40%acn)和实验10(55%acn)获得的色谱图,按降序排列。从图中可以看出,随着acn百分比提高,在6.2分钟左右的峰升高,该峰对应于回收的游离倍癌霉素接头-药物的量。
第三实验系列进一步探究了酸的类型或量的影响。结果表明,酸的类型或量不是关键的,只要组合物的ph低于7就足够了。
- 还没有人留言评论。精彩留言会获得点赞!