一种木脂素化合物在制备治疗和/或预防肾病的药物中的用途的制作方法
本发明涉及药物化学领域,具体涉及一种木脂素化合物在制备治疗和/或预防肾病的药物中的用途。
背景技术:
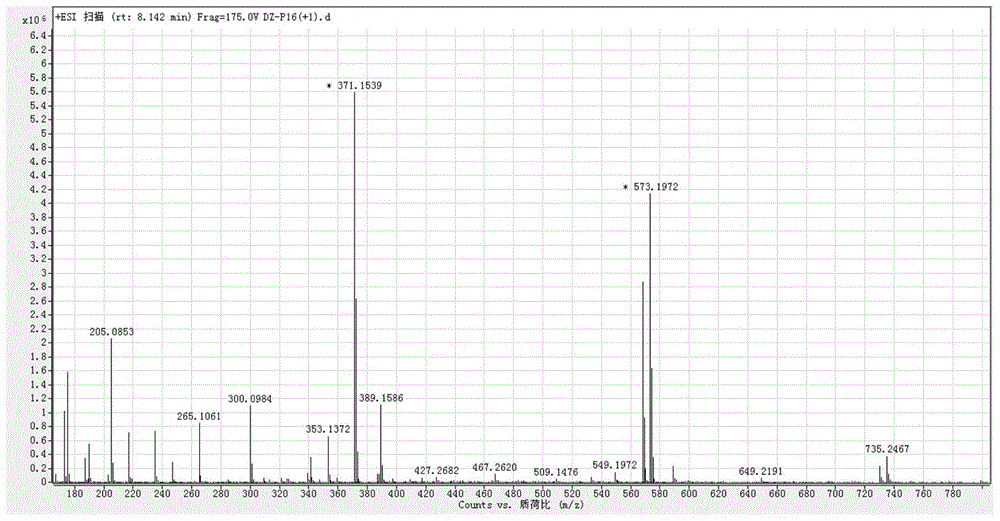
:糖尿病肾病(diabeticnephropathy,dn)是糖尿病最严重和最常见的微血管并发症,占糖尿病患者总数的20~40%。dn的临床表现主要为蛋白尿、高血压和肾功能进行性损伤、水肿等,最终可发展为终末期肾衰竭。然而,目前dn有效治疗药物和手段相对缺乏,因此,研制新型防治dn的有效药物,已成为当今全球医、药学界共同面临的重要课题。dn发病机制复杂,病因尚未明确。一些与高血糖有关的生物化学机制在dn中所起到的作用已经被证实,其中关注最多的是多元醇通路(polyolpathway,pp)及其通路中的限速酶-醛糖还原酶(aldosereductase,ar)。多元醇通路失衡可导致系列连锁反应,包括氧化应激机制(oxidativestress)、蛋白质非酶糖基化(proteinnon-enzymatic)、蛋白激酶c(proteinkinasec,pkc)等。这其中,ar起着重要的枢纽作用,已经成为目前研发防治dn药物的热门靶点。目前醛糖还原酶抑制剂(aldosereductaseinhibitors,aris)以化学药为主,主要包括海因类、羧酸类和杂环化合物。但其中许多药物存在选择性不高、毒副作用明显、生物利用度低以及临床使用剂量较大等问题。因此,寻找经济、高效、低毒、特异性强的新型aris具有重大的学术价值和临床意义。技术实现要素:本发明旨在至少解决现有技术中存在的技术问题之一。为此,本发明提出一种木脂素化合物在制备治疗和/或预防肾病的药物中的用途,能够对肾病有良好的治疗效果。本发明还提出了一种治疗和/或预防肾病的药物。本发明还提出了一种治疗和/或预防肾病的药用组合物。根据本发明的第一方面实施例的用途,所述化合物具有如下结构式:根据本发明实施例的用途,至少具有如下有益效果:本发明提供的化合物能够有效抑制高糖诱导的人肾小球系膜细胞增殖作用以及抑制h2o2损伤对原代肾小管细胞的损伤作用,所述化合物的作用机理在于通过增强细胞内gsh表达、sod的酶活力、抑制mda生成和诱导nrf2/ho-1信号通路的激活从而发挥抗氧化作用,为开发新的预防和/或治疗肾病的药物提供了良好的先导化合物,对于肾病治疗具有重要的研究价值和应用前景。根据本发明的一些实施例,所述肾病包括糖尿病肾病、肾炎、中毒性肾病和肾病综合征中的至少一种。根据本发明的一些实施例,优选地,所述肾病包括糖尿病肾病。根据本发明的第二方面实施例的药物,包含上述化合物和/或其药学上可接受的盐。根据本发明的一些实施例,所述药物的剂型为片剂、胶囊剂或注射剂。根据本发明的第三方面实施例的药物组合物,包含上述化合物和/或其药学上可接受的盐。本发明的附加方面和优点将在下面的描述中部分给出,部分将从下面的描述中变得明显,或通过本发明的实践了解到。附图说明图1为本发明实施例1中化合物的质谱图(hresims);图2为本发明实施例1中化合物的氢谱图(1hnmr);图3为本发明实施例1中化合物的碳谱图(13cnmr);图4为本发明实施例1中化合物的圆二色谱图(cd);图5为本发明实施例2中化合物抑制高糖诱导hrmc细胞增殖结果;图6为本发明实施例2中化合物对正常细胞nrf2和ho-1的表达诱导;图7为本发明实施例2中化合物对高糖诱导细胞nrf2和ho-1的表达诱导;图8为本发明实施例2中化合物对高糖诱导下hrmc细胞中sod的表达影响;图9为本发明实施例2中化合物对高糖诱导下hrmc细胞中mda的表达影响;图10为本发明实施例3中化合物对h2o2损伤的原代肾小管细胞增殖的影响;图11为本发明实施例3中化合物对h2o2损伤的原代肾小管细胞中的sod的表达影响;图12为本发明实施例3中化合物对h2o2损伤的原代肾小管细胞中的mda的表达影响;图13为本发明实施例3中化合物对h2o2损伤的原代肾小管细胞中的nrf2和ho-1的表达诱导;图14为本发明实施例3中化合物对h2o2损伤的原代肾小管细胞中的gsh的表达影响。具体实施方式为详细说明本发明的技术内容、所实现目的及效果,以下结合实施方式并配合附图予以说明。mtt检测液:称取50mg的mtt粉末,用10ml的pbs稀释成5mg/ml检测液,并用0.22μm的滤膜过滤后,分装,储存于-20℃。葡萄糖母液:以8ml的pbs溶解0.26gd-(+)-葡萄糖,配制成250mm的葡萄糖母液,并用0.22μm的滤膜过滤后待用,现配现用。培养基:配制10%fbs的不同葡萄糖浓度的dmem培养基:低糖dmem培养基(l-dmem):47.5ml,双抗500μl,丙酮酸500μl,memneaa500μl,hepes500μl,fbs500μl,葡萄糖终浓度5.6mm;无糖dmem培养基(n-dmem):47.5ml,双抗500μl,丙酮酸500μl,memneaa500μl,hepes500μl,fbs500μl。hrmc细胞培养:hrmc细胞置于37℃、5%co2、100%相对湿度的细胞培养箱中培养2~3天。待细胞贴壁生长到80%汇合度,0.25%胰酶消化1~2分钟,吸出胰酶,加入含10%fbs的培养基终止消化。吸出细胞悬液至离心管中,1000rpm离心5min,去除培养基。用新鲜的培养基重悬细胞,以1:4的比例放入培养瓶中继续传代培养。采用graphpad7.0软件进行数据分析,计算各组细胞活率。实施例1:目标化合物的结构确证1、质谱:hresims:m+na573.1972(calculated573.1948);质谱图如图1所示。2、核磁:氢谱(图2)和碳谱(图3)的数据表格如下表1所示,溶剂为meoh-d4,氢谱600mhz,碳谱150mhz:表1.目标化合物的氢谱和碳谱信号归属(δ单位为ppm)3、圆二色谱:ecd的谱图如图4所示。通过上述核磁和质谱数据,分析得到化合物为已知化合物isoeucommina,其结构式如下:实施例2:isoeucommina(在附图中,为避免标识占用空间过大,将其标记为p16)抗高糖诱导的人肾小球系膜细胞(hrmc)增殖作用研究一、高糖诱导hrmc细胞增殖模型构建1、取增殖良好处于对数生长期的hrmc细胞,弃培养液,经0.25%胰酶及edta各半的消化液分散后计数,制成细胞悬液;2、用l-dmem培养基调整细胞密度为1×104个/孔,接种至96孔板,80μl/孔,置于37℃、5%co2、100%相对湿度培养箱中预培养24h;3、blank组、control组加入20μl/孔的l-dmem,glucose组加入20μl/孔的l-dmem与250mm葡萄糖母液混合配置的培养基(葡萄糖终浓度为30mm),继续培养24h;4、加入不同浓度的isoeucommina,使其终浓度为250μm,125μm,62.5μm,31.25μm,15.63μm,7.8μm,3.9μm,1.9μm,继续培养24h后使用mtt法检测细胞活率。细胞活率结果如图5所示,结果证明,化合物isoeucommina能够有效抑制高糖诱导的人肾小球系膜细胞增殖作用,具有明显的剂量效应,当剂量不小于31.25μm即具有显著的效果。二、nrf2及其通路下游ho-1蛋白水平的调控作用1、目标化合物对正常hrmc细胞nrf2和ho-1的调控作用1)样品制备a)取增殖良好处于对数生长期的hrmc细胞,弃培养液,pbs洗涤一遍,经0.25%胰酶及edta各半的消化液消化后用新鲜的培养基终止并吹打分散后计数,制成细胞悬液;b)用l-dmem培养基调整细胞密度为3×105细胞/孔,接种至6孔板,2ml/孔,置37℃、5%co2、100%相对湿度培养箱中培养24h;c)blank组、control组以及给药组加入2ml/孔的l-dmem培养24h。d)空白组加入2μldmso,给药组加入不同浓度的目标化合物2μl,使其终浓度分别为31.25μm,62.5μm和125μm,置co2培养箱中再培养24h收取细胞样品;e)弃去培养基上清,pbs洗涤一遍,用0.25%胰酶消化,1ml培养基终止消化后低速离心收集细胞,pbs再洗涤一遍;f)每1×106个细胞加入100μlripa裂解液充分重悬,置冰上裂解15~30min;4℃,12000g离心10min;g)吸取上清少许进行bca定量,将a液:b液=50:1的比例配制检测工作液,加入5μl上清或者标准品,置于37℃孵育30min,于562nm波长处检测吸光度;h)根据标准品浓度绘制成线性图,计算上清中总蛋白的浓度,并用buffer配置成适当浓度。按照3:1的比例加入4×sds上样缓冲液,金属浴煮沸10min,-80℃保存。2)电泳a)在制备好的凝胶上上样;b)电泳:调节电压60v,当蛋白浓缩后,调节电压至120v,直到溴酚蓝前沿到达胶底,结束电泳;c)转膜:通电恒压,18v,转模2h;d)封闭:取下膜置于5%脱脂奶粉封闭液中,室温下摇床上摇动封闭1h;e)一抗孵育:按所需稀释浓度滴加一抗,4℃孵育过夜或37℃孵育3h;f)二抗孵育:取出pvdf膜,用tbst洗三次,每次10min。按所需稀释浓度滴加二抗,室温孵育1h。取出膜,用tbst洗三次每次10min;g)打开显影仪,配制ecl显影液,均匀涂布于膜上,进行显影。实验结果如图6所示,化合物isoeucommina能够显著性诱导正常hrmc的nrf2和ho-1的表达,其中,tublin为微管蛋白。2、目标化合物对高糖诱导hrmc细胞nrf2和ho-1的调控作用:a)取增殖良好处于对数生长期的hrmc细胞,弃培养液,经0.25%胰酶及edta各半的消化液分散后计数,制成细胞悬液;b)blank组、control组加入2ml/孔的l-dmem,glucose组加入2ml/孔的l-dmem与250mm葡萄糖母液混合配置的培养基(葡萄糖终浓度为30mm),继续培养24h;c)空白组和glucose组加入2μldmso,给药组加入不同浓度的目标化合物2μl,使其终浓度分别为62.5μm和125μm,置co2培养箱中再培养24h收取细胞样品;其他处理步骤及检测方法同上述目标化合物对正常hrmc细胞nrf2和ho-1的调控作用。实验结果如图7所示,由图可见,高糖诱导下hrmc细胞中nrf2的表达显著性下降,在isoeucommina作用后发现gsk-3β的磷酸化修饰水平显著性增强,降低gsk3β的蛋白稳定性,使得其对nrf2的抑制作用减弱,从而显著性增强nrf2和ho-1的蛋白表达水平,发挥抗氧化作用,进而抑制系膜细胞在高糖环境中的增殖,减少高糖对肾的损伤作用。三、超氧歧化酶(sod)活性检测1、取增殖良好处于对数生长期的hrmc细胞,弃培养液,经0.25%胰酶及edta各半的消化液分散后计数,制成细胞悬液;2、blank组、control组加入2ml/孔的l-dmem,glucose组加入2ml/孔的l-dmem与250mm葡萄糖母液混合配置的培养基(葡萄糖终浓度为30mm),继续培养24h;3、空白组加入和glucose组2μldmso,给药组加入不同浓度的isoeucommina2μl,使其终浓度分别为31.25μm,62.5μm和125μm,置co2培养箱中再培养24h收取细胞样品;4、胰酶消化收集细胞,用预冷的pbs洗涤1-2遍,加入40μlpbs后液氮破碎细胞后。4℃下7500rpm离心10min,取上清为待测样品;5、样品检测方法1)wst-8/酶工作液配制:按照每个反应160μl的体积配制适量的wst-8酶工作液。均匀混合151μlsod检测缓冲液、8μlwst-8和1μl酶溶液,即可配制成160μlwst-8/酶工作液,配制好的工作液尽量现配现用。2)反应启动工作液配制:将40x的反应启动液溶解后混匀,按1μl反应启动液(40x)加入39μlsod检测缓冲液的比例稀释,混匀后即为反应启动工作液。3)样品测定:a.参考下表2使用96孔板设置样品孔和各种空白对照孔,并依次加入样品与工作液。加入反应启动液后充分混匀。表2.反应体系样品空白对照1空白对照2空白对照3待测样品20μl——20μlsod检测缓冲液—20μl40μl20μlwst-8/酶工作液160μl160μl160μl160μl反应启动工作液20μl20μl——b.37℃孵育30分钟,在450nm测定吸光度。4)样品中总sod活力的计算:抑制百分率=[(a空白对照1-a空白对照2)-(a样品-a空白对照3)]/(a空白对照1-a空白对照2)*100%;待测样品中sod酶活力单位=检测体系中sod酶活力单位=抑制百分率/(1-抑制百分率)units。实验结果如图8所示,结果表明高糖诱导下hrmc细胞中sod的表达显著性下降,isoeucommina作用后可以增强sod的表达水平,发挥抗氧化作用。四、丙二醛(mda)表达水平检测1、取增殖良好处于对数生长期的hrmc细胞,弃培养液,经0.25%胰酶及edta各半的消化液分散后计数,制成细胞悬液;2、blank组、control组加入2ml/孔的l-dmem,glucose组加入2ml/孔的l-dmem以及250mm葡萄糖母液(葡萄糖终浓度为30mm),继续培养24h;3、空白组和glucose组加入2μldmso,给药组加入不同浓度的isoeucommina2μl,使其终浓度分别为31.25μm,62.5μm和125μm,置co2培养箱中再培养24h收取细胞样品;4、样品测定:1)tba储存液的配制:称取适量硫代巴比妥酸(thiobarbituricacid,tba),用tba配制液配制成浓度为0.37%的tba储存液。2)mda检测工作液的配制:将4x的tba溶液溶解后混匀,按50μltba储存液加入150μltba稀释液的比例稀释,并加入3μl抗氧化剂,混匀后即为mda检测工作液。3)在离心管或其它适当容器内加入0.1ml匀浆液、裂解液或pbs等适当溶液作为空白对照,加入0.1ml上述不同浓度标准品用于制作标准曲线,加入0.1ml样品用于测定;随后加入0.2mlmda检测工作液。a.可参考下表3设置检测反应体系:表3.反应体系空白对照标准品样品匀浆液、裂解液或pbs0.1ml--标准品-0.1ml-待测样品--0.1mlmda检测工作液0.2ml0.2ml0.2mlb.混匀后,100℃或沸水浴加热15分钟。c.水浴冷却至室温,1000g室温离心10分钟。取200微升上清加入到96孔板中,随后用酶标仪在532nm测定吸光度。如果不方便测定532nm的吸光度,也可以测定530-540nm之间的吸光度。可以设定450nm为参考波长进行双波长测定。d.mda含量的计算:根据标准曲线计算获得mda的摩尔浓度。实验结果如图9所示,结果表明高糖诱导下hrmc细胞中mda的表达显著性上升,isoeucommina作用后可以降低mda的诱导表达,发挥抗氧化作用。实施例3:isoeucommina抗sd大鼠原代肾小管细胞中氧化信号通路研究一、目标化合物对h2o2损伤sd大鼠原代肾小管细胞的影响:a)取增殖良好的原代肾小管细胞以1500个/孔的密度分别接种至96孔板,置于37℃、5%co2、100%相对湿度细胞培养箱中预培养24h。b)blank、control及model组中加入10%fbsrpmil-dmem,给药组加入isoeucommina使其终浓度为31.25μm、62.5μm、125μm。振荡混匀后,继续培养24h。c)24h后,除blank和control组换成l-dmem,model及给药组换成含400μmol/lh2o2的l-dmem,37℃孵箱培养2h。每孔加入发光细胞活力检测试剂100μl,放置于恒温振荡器中室温振荡15min,在酶标仪500nm处检测。各组细胞增殖率=(观察组od值-空白组od值)/(对照组od值-空白组od值)×100%。实验重复3次,取平均值。细胞活性实验结果如图10所示,化合物isoeucommina能够有效抑制h2o2对原代肾小管的杀伤作用,呈剂量效应。二、h2o2损伤模型中isoeucommina作用后对细胞内sod、mda、gsh和nrf2信号通路的影响1)取增殖良好的原代肾小管细胞以3×105个/孔的密度分别接种至6孔板,置于37℃、5%co2、100%相对湿度细胞培养箱中预培养24h。2)blank、control及model组加入10%fbsrpmil-dmem,给药组加入isoeucommina使其终浓度为31.25μm、62.5μm、125μm,振荡混匀后,继续培养24h。3)24h后,除blank和control组换成l-dmem,model及给药组换成含400μmol/lh2o2的l-dmem,振荡混匀后,37℃孵箱培养2h。收取细胞进行sod、mda、gsh和western-blot检测,sod、mda和western-blot的检测方法同上。所得sod酶活力检测结果如图11所示,isoeucommina作用后能够有效增强h2o2损伤的原代肾小管细胞中的sod酶活力,呈剂量效应;mda表达水平检测结果如图12所示,isoeucommina作用后有效抑制h2o2损伤的原代肾小管细胞中的mda的生成,呈剂量效应;蛋白nrf2和ho-1的表达结果如图13所示,图13(a)为western-blot蛋白凝胶电泳结果,可以明显看出当剂量增加,nrf2和ho-1的蛋白含量增加,图13(b)和(c)分别为不同剂量下nrf2和ho-1的蛋白表达差异,当剂量不小于31.25μm均有显著差异,因此,isoeucommina作用后有效增强h2o2损伤的原代肾小管细胞中nrf2和ho-1的蛋白表达,呈剂量效应。其中,gsh检测操作过程如下:a)样品准备:用预冷的pbs洗涤1-2遍,每个细胞样品用60μl5%磺基水杨酸(ssa)重悬,液氮速冻,37℃水浴反复快速冻融2次裂解细胞,冰上放置10min后10000rpm离心10min,收集上清为待测样品;b)样品检测:1)配制工作液:取3.8μl谷胱甘肽还原酶用1×检测液稀释至250μl即酶溶液。8ml1×检测液中加入228μl酶溶液和228μldtnb原液,混合均匀;2)配制nadph溶液:吸取10μlnadph原溶液加入到2.5ml1×检测液中混匀;3)谷胱甘肽标准品:用5%磺基水杨酸(ssa)将gsh原液稀释200倍,即为50μm的标准品1,标准品1稀释2倍为标准品2,再依次2倍稀释为标准品5;4)按下表4的说明加入样品及所需溶液:表4在412nm波长下,用酶标仪检测每5min平均吸光度变化量。由图14所示的结果,isoeucommina作用后有效增强h2o2损伤的原代肾小管细胞中的gsh的表达,呈剂量效应。综上所述,本发明提供的化合物isoeucommina能够有效抑制高糖诱导的人肾小球系膜细胞增殖作用以及抑制h2o2对原代肾小管细胞的损伤作用进而抑制肾脏细胞的凋亡。所述化合物isoeucommina的作用机理在于通过增强细胞内gsh表达、sod的酶活力、抑制mda生成和诱导nrf2/ho-1信号通路的激活从而发挥抗氧化作用,为开发新的预防和/或治疗肾病的药物提供了良好的先导化合物,对于肾病治疗具有重要的研究价值和应用前景。以上所述仅为本发明的实施例,并非因此限制本发明的专利范围,凡是利用本发明说明书及附图内容所作的等同变换,或直接或间接运用在相关的
技术领域:
,均同理包括在本发明的专利保护范围内。当前第1页12
相关技术
网友询问留言
已有0条留言
- 还没有人留言评论。精彩留言会获得点赞!
1