一种活性天然小分子介导的共组装光敏药物的制备方法及应用与流程
本发明属于生物医药材料领域;具体涉及一种活性天然小分子介导的共组装光敏药物的制备方法及应用。
背景技术:
当前,一系列具有自组装性质的萜类天然小分子(nsms)不断被发现,由于其广泛的生物相容性及生物易降解性,将具有抗癌活性的萜类天然小分子作为载体在生物医学抗癌方面呈现巨大的前景。正是由于这种独特的自组装性质,多数小分子能够形成纳米粒子,这使的他们作为医药载体成为可能。但较低的载药量、较差的水溶性、以及部分自组装形成的大纳米粒子并不适合于药物运输,严重限制了萜类天然小分子作为新型药物运输载体的广泛应用。
超分子共组装作为一种制备纳米药物的有效策略广泛被报道。其绿色、快捷的制备方法备受关注。其中,两亲性的光敏剂二氢卟吩e6(ce6)也被报道作为共组装纳米药物的构建单元,实现无载体运输的化疗及光动力治疗协同抗癌治疗目的。然而目前基于天然小分子共组装光敏剂是没有报道的。
技术实现要素:
本发明为解决现有天然小分子作为医药载药量低、水溶性差的技术问题,而提供了一种活性天然小分子介导的共组装光敏药物的制备方法及应用。
本发明的一种活性天然小分子介导的共组装光敏药物的制备方法按以下步骤进行:
一、分别配制浓度为10mmol/l~50mmol/l的nsms的二甲基亚砜(dmso)溶液和浓度为10mmol/l~50mmol/l的ce6的二甲基亚砜(dmso)溶液;
二、将步骤一得到的nsms的二甲基亚砜(dmso)溶液和ce6的二甲基亚砜(dmso)溶液混合均匀后加入到naoh的二次蒸馏水溶液中,得到混合溶液,超声反应,反应完成后离心处理,得到nsms-ce6nps,即活性天然小分子介导的共组装光敏药物。
进一步限定,步骤一中所述nsms为三环二萜类天然小分子、三环三萜类天然小分子、四环三萜类天然小分子或五环三萜类天然小分子。
进一步限定,所述三环二萜类天然小分子的结构为:
进一步限定,所述三环二萜类天然小分子具体为脱氢枞酸(dehydroabieticacid),其结构为
进一步限定,所述五环三萜类天然小分子具体为白桦酯酮酸(betulonicacid,简称bc),其结构为
进一步限定,步骤一中所述nsms的dmso溶液的浓度为33mmol/l~34mmol/l。
进一步限定,步骤一中所述nsms的dmso溶液的浓度为33.5mmol/l。
进一步限定,步骤一中所述ce6的dmso溶液的浓度为33mmol/l~34mmol/l。
进一步限定,步骤一中所述ce6的dmso溶液的浓度为33.5mmol/l。
进一步限定,步骤二中所述nsms的dmso溶液和ce6的dmso溶液的体积比为(0.5~8):1。
进一步限定,步骤二中所述nsms的dmso溶液和ce6的dmso溶液的体积比为(1~5):1。
进一步限定,步骤二中所述nsms的二甲基亚砜溶液和ce6的二甲基亚砜溶液的体积比为3:1。
进一步限定,根据权利要求1所述的一种活性天然小分子介导的共组装光敏药物的制备方法,其特征在于,步骤二中所述混合溶液中naoh与ce6的摩尔比为(2~4):1。
进一步限定,根据权利要求1所述的一种活性天然小分子介导的共组装光敏药物的制备方法,其特征在于,步骤二中所述混合溶液中naoh与ce6的摩尔比为3:1。
进一步限定,步骤二中所述混合溶液中二甲基亚砜与二次蒸馏水的体积比为(0.2~1):10
进一步限定,步骤二中所述超声反应的参数为:超声频率为50hz~250hz,超声时间为0.1min~25min。
进一步限定,步骤二中所述离心处理的转速为13000rpm~14000rpm。
进一步限定,步骤二中所述离心处理的转速为13500rpm。
本发明的一种活性天然小分子介导的共组装光敏药物作为化疗-光动力联合抗癌药物应用于生物医药领域。
本发明与现有技术相比具有的显著效果,具体如下:
本发明通过简单的共组装,不仅可以充分利用活性天然小分子的特殊药理活性,实现天然小分子产物作为药物载体的可能性,克服其作为载药体系的缺陷;同时,生物相容的抗癌活性小分子的引入可以实现安全、高效、协同的化疗-光动力治疗联合抗癌的目的,同时克服传统化疗的毒副作用,实现安全的联合抗肿瘤策略。将具有优良的生物相容性、及生物易降解性的抗癌天然小分子应用于肿瘤抗癌,有望成为安全、高效的肿瘤治疗试剂及药物运输载体。
附图说明
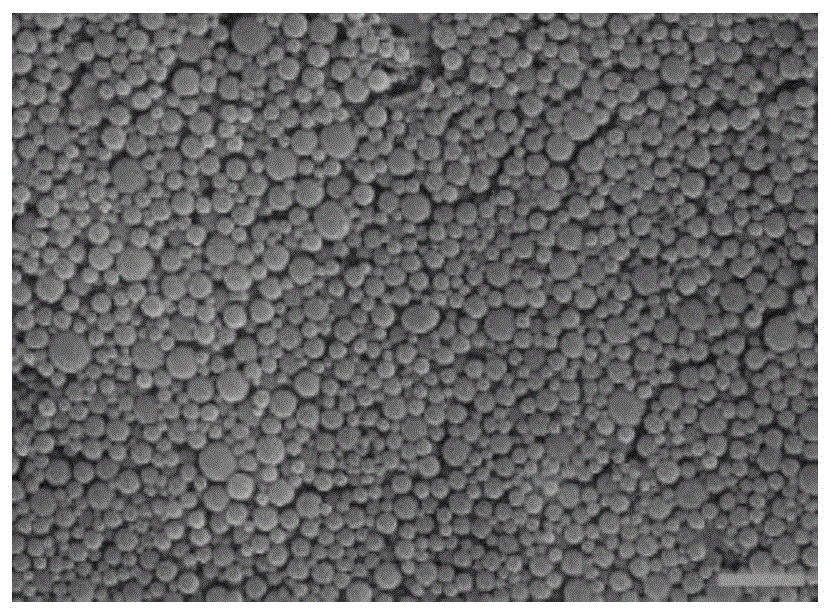
图1为具体实施方式一得到的bc-ce6nps的sem图;
图2为具体实施方式二得到的nsms-ce6nps的sem图;
图3为具体实施方式三得到的nsms-ce6nps的sem图;
图4为具体实施方式四得到的nsms-ce6nps的sem图;
图5为具体实施方式五得到的nsms-ce6nps的sem图;
图6为具体实施方式六得到的nsms-ce6nps的sem图;
图7为具体实施方式七得到的nsms-ce6nps的sem图;
图8为具体实施方式八得到的nsms-ce6nps的sem图;
图9为具体实施方式九得到的nsms-ce6nps的sem图;
图10为具体实施方式十得到的nsms-ce6nps的sem图;
图11为具体实施方式十一得到的nsms-ce6nps的sem图;
图12为具体实施方式一至十一中所用nsms的体外抗癌活性曲线图;
图13为具体实施方式一得到的bc-ce6nps的紫外可见吸收光谱图;
图14为经具体实施方式一得到的bc-ce6nps处理后的mtt细胞存活率图;
图15为不同处理后的老鼠肿瘤体积变化曲线图;
图16为经不同药物治疗期间的老鼠体重变化图。
具体实施方式
具体实施方式一:本实施方式的一种活性天然小分子介导的共组装光敏药物的制备方法按以下步骤进行:
一、分别配制浓度为33.5mmol/l的白桦酯酮酸(betulonicacid,简称bc)的dmso溶液和浓度为33.5mmol/l的ce6的dmso溶液;
二、将步骤一得到的15μl的bc的dmso溶液和5μl的ce6的dmso溶液混合均匀后加入到naoh的二次蒸馏水溶液中,得到混合溶液,于150hz下超声反应10min,反应完成后于13500rpm下离心处理,得到活性天然小分子介导的共组装光敏药物,记为bc-ce6nps;所述naoh的二次蒸馏水溶液由10μl浓度为50.25mmol/l的naoh水溶液和1ml的二次蒸馏水混合而成。
具体实施方式二:本实施方式与具体实施方式一不同的是:步骤一所用nsms为白桦脂酸(betulinicacid),其他步骤及参数与具体实施方式一相同。
具体实施方式三:本实施方式与具体实施方式一不同的是:步骤一所用nsms为甘草次酸(glycyrrhetinicacid),其他步骤及参数与具体实施方式一相同。
具体实施方式四:本实施方式与具体实施方式一不同的是:步骤一所用nsms为松香酸(abieticacid),其他步骤及参数与具体实施方式一相同。
具体实施方式五:本实施方式与具体实施方式一不同的是:步骤一所用nsms为12-羟基松香酸(12-hydroxyabieticacid),其他步骤及参数与具体实施方式一相同。
具体实施方式六:本实施方式与具体实施方式一不同的是:步骤一所用nsms为脱氢枞酸(dehydroabieticacid),其他步骤及参数与具体实施方式一相同。
具体实施方式七:本实施方式与具体实施方式一不同的是:步骤一所用nsms为15-羟基脱氢枞酸(15-hydroxydehydroabieticacid),其他步骤及参数与具体实施方式一相同。
具体实施方式八:本实施方式与具体实施方式一不同的是:步骤一所用nsms为茯苓酸(poricoicacid),其他步骤及参数与具体实施方式一相同。
具体实施方式九:本实施方式与具体实施方式一不同的是:步骤一所用nsms为熊果酸(ursolicacid),其他步骤及参数与具体实施方式一相同。
具体实施方式十:本实施方式与具体实施方式一不同的是:步骤一所用nsms为脱氧胆酸(deoxycholicacid),其他步骤及参数与具体实施方式一相同。
具体实施方式十一:本实施方式与具体实施方式一不同的是:步骤一所用nsms为熊脱氧胆酸(ursodeoxycholicacid),其他步骤及参数与具体实施方式一相同。
检测(一):具体实施方式一至十一得到的nsms-ce6nps的sem图如图1~11所示,(标尺:1um)。通过简单的共组装策略,这些小分子均能与ce6形成共组装纳米粒子,均可以作为药物运输体系,实现化疗-光动力治疗联合抗癌的目的。
检测(二):对具体实施方式一至十一所用nsms进行对4t1肿瘤细胞的体外抗癌活性评估,分别在3.125μmol/l、6.25μmol/l、12.5μmol/l、25μmol/l、50μmol/l、100μmol/l、150μmol/l、200μmol/l下培养24h,得到如图12所示的曲线图,从图中可以看出,这些小分子对4t1细胞均呈现浓度相关的抗癌活性,随着药物浓度的增加,细胞存活率逐渐降低。尤其是五环三萜酸类物质抗癌活性明显,对肿瘤细胞的毒性可达到90%以上。这表明这些萜类小分子有望实现化疗-光疗协同抗癌的目的。
检测(三):采用hplc法对具体实施方式一得到的bc-ce6nps中光敏剂ce6含量进行检测,具体测试条件:流动相:柱温30℃,流动相:0.2%磷酸水溶液/乙腈=40/60(体积比),流速:1ml/min,检测波长:402nm。结果:ce6的含量为17.2%。
检测(四):对具体实施方式一得到的bc-ce6nps进行紫外可见吸收光检测,得到如图13所示的紫外可见吸收光谱图。从图中可以看出,共组装的bc-ce6nps同时含有ce6409nm、669nm及bc212nm左右的特征吸收峰,且bc-ce6nps的最大吸收波长较单独的ce6(665nm)发生了明显的红移现象,说明两者组装成功,且分子间存在一定的相互作用力,进一步也证实共组装策略的可行性。
检测(五):对具体实施方式一得到的bc-ce6nps进行体外化疗及光动力抗癌活性评估,以鼠源4t1乳腺癌细胞为细胞株,采用标准的mtt法检测bc-ce6nps的化疗活性及bc-ce6nps的光动力抗癌活性。具体过程如下:采用96孔板接种4t1细胞,待细胞贴壁后,加入不同浓度等当量的ce6的bc-ce6nps药物,对于评估化疗活性,细胞无需光照处理;对于评估药物光动力治疗活性,在加入药物后,继续培养4h后,并在675±10nm的红外光下光照10min,mtt法检测细胞存活率。
结果:得到如图14所示的mtt细胞存活率图,从图中可以看出,bc-ce6nps在光照条件下具有明显的光毒性,即使是非常低的ce6浓度下(0.5ug/ml)依旧能够导致75%细胞致死率,且其ic50(0.30ug/ml的ce6)明显低于阳性药物ce6(1.36ug/ml),进一步证实bc-ce6nps的显著抗癌活性。此外,在不光照条件下,bc-ce6nps同样对4t1细胞有一定的细胞毒性,且明显高于游离的bc,这也证实了共组装药物的化疗活性。以上结果表明bc-ce6nps具有显著改善的联合抗癌效率。
检测(六):对具体实施方式一得到的bc-ce6nps进行体内抗癌活性评估,以荷4t1乳腺癌肿瘤的雌性balb-c老鼠为研究对象,以尾静脉注射给药方式,研究药物bc-ce6nps在不光照下的化疗特性,及在光照条件下的光动力与化疗相结合的抗癌活性。
具体过程为:实验分为4组,每组5只老鼠,组1:空白组为5%葡萄糖溶液;组2:ce6光照组4mg/kg;组3:bc-ce6nps不光照组(含有与组2等当量的ce64mg/kg);组4:bc-ce6nps(含有与组2等当量的ce64mg/kg)光照组,每组实施三次给药治疗,并在给药后2h时对肿瘤部位实施光照15min处理。期间记录体重及老鼠体重等参数,肿瘤体积按照如下公式记录,计算公式:v=(l×w2)/2,其中v代表肿瘤体积,l和w分别代表肿瘤的长和宽。
结果:得到如图15所示的肿瘤体积变化曲线图。从图中可以看出,相比如光照下游离ce6和未光照处理的bc-ce6nps,以上两组存在适量的肿瘤抑制率,而光照条件下,bc-ce6nps存在显著的肿瘤抑制率(93.6%),这说明很强的协同增强疗效。通过共组装策略,实现了化疗-光动力治疗联合增强抗癌的目的,有望实现临床抗癌目的。
检测(七):对具体实施方式一得到的bc-ce6nps进行生物安全性检测,得到如图16所示的经不同药物治疗期间的体重变化图。从图中可以看出,各组的老鼠体重没有特别明显的变化,即使在第二天出现轻微降低,但后续的持续观察中体重很快恢复正常,这进一步说明bc-ce6nps的安全无毒性,同时也证明了这类天然小分子的生物相容性,有望作为一种安全高效的生物载体应用于临床。
- 还没有人留言评论。精彩留言会获得点赞!