博宁霉素抑制PD-L1高表达肿瘤的应用的制作方法
本发明属于生物制药技术领域,具体的,涉及一种博宁霉素抑制pd-l1高表达肿瘤的应用。
背景技术:
博宁霉素(boningmycin)是中国医学科学院医药生物技术研究所从浙江省平阳市获得的土壤中分离的轮枝链霉菌平阳变种,发酵分离得到的一种单一化学结构的新抗生素,属于博来霉素家族(专利号:98101253.1,发明名称:一种抗肿瘤抗生素和其微生物发酵生产法)。博宁霉素可以抑制肿瘤细胞的增殖和裸鼠体内肿瘤,如人肝癌、食管癌等的生长,具有良好的抗肿瘤活性。此外,博宁霉素对银屑病、脂溢性皮炎具有较强的抑制作用(专利号:03141374,发明名称:博宁霉素在治疗银屑病和脂溢性皮炎中的新用途),对乳头瘤病毒引起的疾病如尖锐湿疣也具有良好的疗效。与其它博来霉素族抗生素相比较而言,博宁霉素的肺毒性低,经过发酵工艺改良,博宁霉素的产量已经显著提高(见其他相关专利),具有良好的开发应用前景。
随着人类社会的发展、疾病谱的变化,肿瘤成为全球性仍然未被临床满足需求的疾病,部分肿瘤致死率高,5年存活率低。肿瘤的治疗经过手术、放疗和化疗,靶向治疗,到目前的免疫治疗新阶段。肿瘤免疫治疗主要包括免疫细胞疗法和免疫检查点疗法。免疫检查点是免疫系统活化后,通过抑制免疫反应,使其恢复正常的分子,例如:程序性细胞死亡蛋白1(programmedcelldeath1,pd-1)及其配体pd-l1。pd-l1在多数肿瘤细胞中高表达,它与人体t淋巴细胞上的pd-1结合,导致t淋巴细胞误认为是正常细胞,使肿瘤细胞逃逸免疫系统的攻击。pd-1抗体通过与pd-1/pd-l1的相互作用解除免疫抑制,从而使t淋巴细胞杀死肿瘤细胞。目前,美国fda和国家药监局均批准了多种pd-1抗体用于抗肿瘤治疗。
虽然pd-l1抗体治疗具有明显的优势,但患者的总体反应率不高,大约为20%-40%,限制了免疫检查点抑制剂的临床应用。多项研究显示:与靶向药物、细胞毒药物组合应用,是提高pd-1抗体疗效的关键。
技术实现要素:
本发明首先涉及一种博宁霉素或其药学上可接受的盐在制备治疗肿瘤的药物中的应用,所述的肿瘤为pd-l1天然高表达或因为肿瘤的治疗导致pd-l1高表达的肿瘤。
本发明还涉及一种博宁霉素或其药学上可接受的盐在制备治疗肿瘤的联用制剂中的应用,所述的联用制剂中还包括:靶向肿瘤标志物的小分子靶向药物;所述的肿瘤为pd-l1天然高表达或因为肿瘤的治疗导致pd-l1高表达的肿瘤;
优选的,所述的小分子靶向药物为靶向egfr的小分子靶向药物,更优选的,为吉非替尼或阿法替尼;
优选的,所述的肿瘤为非小细胞肺癌;
本发明的有益效果在于:
1、本发明提供了一种针对检查点抑制剂的支路调控方式,有助于中晚期肿瘤患者的治疗,尤其是对于pd1抗体治疗不良反应较高的患者,本发明提供了能够改善其治疗效果的方法;
2、本发明发现了博宁霉素在治疗肿瘤中的潜力,为传统抗生素在肿瘤治疗领域中的二次开发提供了一定的参考和启示。
3、本发明为肿瘤患者精准用药提供了新的选择,有益于满足癌症治疗未被满足的需求。
4、本发明为药物的组合使用提供新思路,以进一步提高治疗效果,降低治疗费用。
附图说明
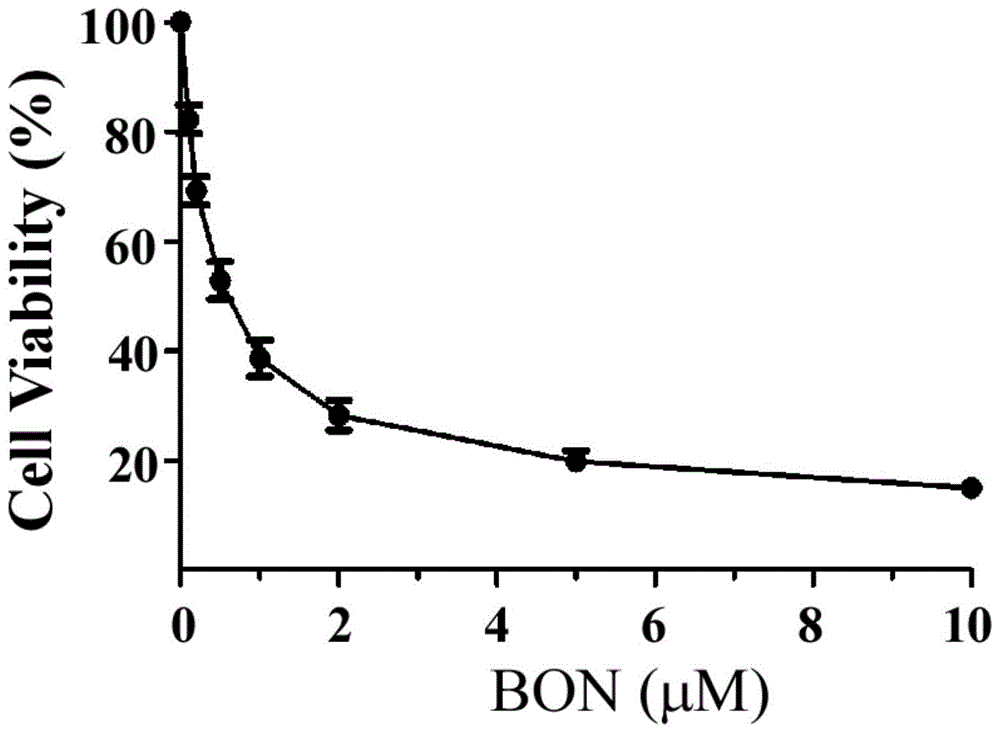
图1、博宁霉素对人非小细胞肺癌nci-h460细胞的增殖抑制作用。
图2、博宁霉素或博来霉素降低人肺癌nci-h460细胞中pd-l1蛋白的水平。
图3、博宁霉素降低人肺癌a549细胞中诱导性pd-l1蛋白的水平。
图4、博宁霉素增强靶向药物吉非替尼、阿法替尼对人非小细胞肺癌nci-h460细胞的抑制作用。
具体实施方式
实施例1、博宁霉素对人肺癌nci-h460细胞的增殖抑制作用
1.1、实验材料
博宁霉素(bon)的纯度大于95%(有关hplc鉴定方法同专利cn101607986a,一种化学半合成制备博宁霉素的方法);
nci-h460细胞购于中国医学科学院基础医学研究所细胞中心;
rpmi-1640培养基(c11875500bt)、胎牛血清(fetalbovineserum,fbs,10099-141)、hank’s平衡盐缓冲液(hank’sbalancedsaltsolution,hbss,14025-092)和0.25%胰蛋白酶(trypsin-edta,25200-072)购自赛默飞世尔科技有限公司(gibco);
培养细胞用的60mm平皿(430166)、96孔板(3599)购自corning公司;
cck-8试剂(b34302)购自bimake公司。
1.2、实验方法
(1)将处于对数生长期的nci-h460细胞用0.25%的胰蛋白酶消化后,进行细胞计数,并以3x103个/孔的密度接种于96孔板,并置于含5%co2的37℃恒温保湿培养箱中孵育;
(2)24h后对细胞进行不同浓度bon的给药处理,每个浓度设置3个复孔;
(3)药物作用72h后,在细胞培养液中直接加入20μl的cck-8试剂,充分混匀后将96孔板重新放回到细胞培养箱中,继续孵育2h;
(4)将96孔板置于酶标板振荡器上振荡30s以充分混匀,确认无气泡产生后通过酶标仪测定不同浓度组450nm波长处的吸光度值(od)。
通过下列公式,计算各组的细胞存活率,其中对照组的细胞存活率设定为100%。计算公式如下:
细胞存活率(%)=(给药组的od450值–空白组的od450值)/(对照组的od450值-空白组的od450值)x100%。
1.3、实验结果
结果如图1所示,横坐标为博宁霉素的给药浓度,纵坐标为细胞存活率。可以看到随着博宁霉素浓度的升高,细胞存活率迅速下降,其ic50值为0.68μm。博宁霉素具有十分明显的抑制nci-h460细胞增殖的作用。
实施例2:博宁霉素或博来霉素短时间特异降低nci-h460细胞pd-l1蛋白水平
2.1、实验材料
pd-l1抗体(#13684,1:1000)购自cellsignalingtechnology公司;
β-actin抗体(sc-47778,1:100000)购自santacruzbiotechnology公司;
辣根过氧化物酶标记的的山羊抗兔(稀释比为1:1000,hs101-01)和山羊抗鼠(稀释比为1:1000,hs201-01)的第二抗体购自北京全式金生物技术有限公司;
十二烷基磺酸钠购自sigma-aldrich公司;
40%(w/v)丙烯酰胺(invitrogen,hc2040)购自赛默飞世尔科技有限公司;
bradford蛋白测定液(#500-0205)、eclplus化学发光显色液(#170-5661)、预染marker(#161-0374)、四甲基乙二胺(temed,#161-0801)、厚滤纸和3mm薄滤纸来自bio-rad公司;
蛋白酶抑制剂(#30827-99-7)购自roche公司;
抗体稀释液(p0023a)购自上海碧云天生物技术有限公司。
2.2、实验方法
2.2.1、细胞培养及给药处理:
将处于对数生长期的nci-h460细胞以6x105个/皿的密度接种于60mm的培养皿中,并置于含5%co2的37℃恒温保湿培养箱中孵育。培养细胞24h后,加入不同浓度的博宁霉素或博来霉素作用8h。
2.2.2、细胞收集及蛋白免疫印迹实验
(1)收集细胞:弃去60mm平皿中的上清液,加入1ml4℃预冷的pbs,用细胞刮刀轻柔地将皿底的细胞全部刮下来并转移到1.5ml离心管中;用高速离心机以12000r/min的速度离心20s后弃去上清液,再次离心20s,直到将残留的pbs全部去掉,将收集到的细胞样品置于-80℃冰箱保存。
(2)裂解细胞:将收集到的细胞样品置于冰上,加入适量的ripa裂解液(配方为50mmph7.5的tris-hcl,150mmnacl,5mmedta,50mmnaf,2mm焦磷酸钠,1%脱氧胆酸钠,0.1%sds,1%tritonx-100,1mm钒酸钠和蛋白酶抑制剂)重悬细胞并振荡,冰上静置15min后再次振荡细胞并打开低温离心机进行预冷,再次裂解15min后将离心管转移到低温离心机中以12000r/min的速度离心15min,然后将上清液转移到新的1.5ml离心管中。
(3)测定蛋白液浓度:在96孔板中先加入198μl的bradford蛋白测定液,然后加入2μl的蛋白液,每个样品设置2个复孔,同时设置2个只加200μlbradford蛋白测定液的空白孔,将96孔板置于酶标板振荡器上振荡1min后采用酶标仪读取570nm波长处的吸光度值,根据已经制定的标准曲线计算各样品的蛋白液浓度。
(4)蛋白样品制备及上样:在新的1.5ml离心管中首先加入10μlloadingbuffer,然后加入20μg蛋白(根据算好的蛋白浓度),最后加入适量的ripa裂解液补充总体积到30μl;将加好的样品置于高速离心机(12000r/min)中离心10s后在漩涡混合器上略微振荡,随后置于105℃的金属浴锅中加热5min,加热完成后将离心管迅速置于冰上冷却,并在高速离心机(12000r/min)中离心10s后在漩涡混合器上再次略微振荡,最后将制备好的样品转移到预制胶的孔道中;同时配制转膜液(5x转膜液:甲醇:双蒸水=1:1:3),将甲醇润湿的pvdf膜、2张薄滤纸和2张厚滤纸浸泡在转膜液中备用。
(5)电泳及转膜:首先恒压60v跑胶30min,然后将电压调整为200v,恒压跑38min待溴酚蓝全部进入电泳液;然后取下胶板,将浸泡在转膜液中的pvdf膜和滤纸按照厚滤纸-薄滤纸-电泳胶-pvdf膜-薄滤纸-厚滤纸的顺序(从上到下)放置在转膜仪上,转膜45min。
(6)封闭:转膜结束后,将pvdf膜置于甲醇中固定10s左右后取出晾干,然后用pbs-t配制的5%脱脂奶粉于4℃封闭蛋白条带1h。
(7)孵育一抗:封闭完成后,然后置于相应的一抗稀释液(一抗:一抗稀释液=1:1000)中于4℃进行孵育过夜。
(8)二抗孵育:将蛋白泳带用pbs-t洗3次,每次3min,然后用5%脱脂奶粉配制的二抗稀释液(二抗:5%脱脂奶粉=1:1000)与蛋白条带在室温下孵育1h。
(9)电泳条带的显色:将孵育好二抗的蛋白泳带用pbs-t洗3次,每次3min,然后在室温下与eclplus发光液(使用前1:1混匀)孵育3min,最后利用超灵敏多功能成像仪进行显色。
2.3、实验结果
与对照组相比,博宁霉素(bon)处理后引起nci-h460细胞内pd-l1蛋白水平显著降低,且下降幅度表现出一定的浓度依赖性(图2-a)。同样的方法,也检测到博来霉素(blm)处理引起nci-h460细胞内pd-l1蛋白水平下降(图2-b),不过,其作用低于博宁霉素。
实施例3:博宁霉素明显降低a549细胞内诱导性pd-l1蛋白的水平
人肺癌a549细胞pd-l1蛋白处于低表达水平,通过重组人干扰素ifn-γ处理后,pd-l1蛋白水平明显上升。使用博宁霉素处理,如果能明显引起pd-l1蛋白水平下降,说明其作用具有特异性。本实施例采用的检测方法与实施例2相同,也是蛋白免疫印迹法。
3.1、实验材料
人非小细胞肺癌a549细胞购自中国医学科学院基础医学研究所细胞中心;
重组人ifn-γ(#300-02)购自peprotech公司;
f12培养基(c11765500bt)购自赛默飞世尔科技有限公司(gibco)。
3.2、实验方法
3.2.1、细胞培养及给药处理:
(1)将新购的100μg重组人ifn-γ溶于100μl超纯水中制备成1mg/ml的母液储存于-20℃冰箱中;
(2)将处于对数生长期的2x105个a549细胞接种于35mm的培养皿中,并置于含5%co2的37℃恒温保湿培养箱中孵育;
(3)24h后加入10ng/ml的ifn-γ作用6h,随后弃去药物并用4℃预冷的pbs洗细胞3次后加入新鲜的含有10%胎牛血清的f12培养基继续培养a549细胞,换液18h后,加入20μm的bon分别作用8、12、24h。
3.2.2、细胞收集及蛋白免疫印迹实验
方法同实施例2中的2.2.2部分。
3.3、实验结果
结果如图3所示,
(1)与对照组相比,ifn-γ处理后a549细胞内pd-l1蛋白水平显著升高,且表现出时间依赖性;
(2)加入bon处理,可以观察到pd-l1蛋白水平明显下降。bon作用8h后,诱导性pd-l1蛋白水平即出现明显下降,随着bon作用时间的延长,诱导性pd-l1蛋白水平的下降幅度逐渐增大;
该结果表明bon可以特异降低肿瘤细胞内诱导性pd-l1蛋白水平。
实施例4、博宁霉素增强靶向药物吉非替尼、阿法替尼对人非小细胞肺癌nci-h460细胞的抑制作用本实施例采用的方法同实施例1。
4.1实验材料
吉非替尼(gefitinbib,zd1839,s1025)和阿法替尼(afatinib,bibw2992,s1011)购自selleck公司。用dmso配制成50mm的吉非替尼母液备用,用dmso和无水乙醇(1:1)配制成50mm的阿法替尼母液备用。
4.2实验方法
将处于对数生长期的nci-h460细胞以3x103个/孔的密度接种于96孔板,并置于含5%co2的37℃恒温保湿培养箱中孵育。24h后对细胞进行给药处理。药物作用72h后,在细胞培养液中加入20μl的cck-8试剂,充分混匀后将96孔板重新放回到细胞培养箱中。待cck-8与细胞共孵育2h后,将96孔板置于酶标板振荡器上振荡30s以充分混匀,确认无气泡产生后通过酶标仪测定不同浓度组450nm波长处的吸光度值,并计算各组的细胞存活率以及药物的联合应用指数(combinationindex,ci)。其中对照组的细胞存活率被认为是100%,其余组的细胞存活率(%)=(给药组的od450值–空白组的od450值)/(对照组的od450值-空白组的od450值)x100%。ci值是使用compusyn1.0软件计算的。
4.3实验结果
如图4a所示,与吉非替尼单药组相比,合用不同浓度的bon后,细胞存活率显著下降,如10μm吉非替尼组的细胞存活率为64.5%,而与0.5,1μm的bon合用后,细胞存活率下降分别到30.7%和24.2%,ci值均为0.6,表现出高度的协同作用。
阿法替尼与bon合用也具有协同作用(图4b),合用0.5,1μm的bon后,细胞存活率均有一定程度的下降,1μm阿法替尼组的细胞存活率为92.6%,而与0.5、1μm的bon合用后,细胞存活率分别下降到51.1%和41.3%,ci值分别为0.7和0.8,表现出中度的协同作用。
最后需要说明的是,以上实施例仅用作帮助本领域技术人员理解本发明的实质,不用于限定本发明的保护范围。
- 还没有人留言评论。精彩留言会获得点赞!