具有抗氧化活性的单环刺螠多肽及其应用的制作方法
本发明属于生物医药技术领域,尤其涉及具有抗氧化活性的单环刺螠多肽及其应用。
背景技术:
自由基是指在人体内广泛分布,以游离形式存在的一类物质。自由基因带有不成对电子而不稳定,在机体内易发生亲核亲电子反应,造成机体内生物大分子(核酸、蛋白质、脂质等)的损伤。人体内正常代谢产生的或机体损伤过度产生的含还原态氧的一类自由基统称为活性氧(ros)。
ros在细胞内起重要的信号传导的作用,如调节细胞内ca2+水平及各种转录因子的活化等,其次,ros是活泼的反应中间体,能够引发一系列快速的连锁的反应,对脂质、蛋白质、糖类物质和核酸等造成损伤。这些损伤能够破坏生物膜,导致蛋白质结构和功能的丧失和dna发生突变。这些自由基引发的变化将最终导致炎症、癌症、退行性疾病及衰老的发生。机体本身存在内源性的抗氧化防御机制,机体自身可利用过氧化氢酶(cat),超氧化物歧化酶(sod)等多种酶和维生素c/e,谷胱甘肽等内源性物质来清除机体内氧化物质。但是内源性的抗氧化作用是有限的,且随着年龄的增加,疾病的发生或机体受其他刺激、创伤,都会导致机体积累过量自由基,破坏机体氧化-还原的平衡状态,这时外源性的抗氧剂可以作为补充而纠正这种失衡。
外源性的抗氧化剂包括化学合成的抗氧化剂及天然来源的抗氧化剂。化学合成的抗氧化剂通常具有多种毒副作用,因此天然来源的抗氧化剂,如生育酚、茶多酚等越来越引起人们的关注。天然来源的抗氧化剂包括黄酮类、酚类、多糖类及多肽类等。其中,多肽类即抗氧化肽的研究因多种蛋白酶的发现及分离纯化技术的发展和多种蛋白质底物的存在而更多的被发掘出来。
目前已经分离得到多种抗氧化活性的多肽复合物或具特定序列的肽段,如鼠尾草蛋白的酶解液在体外和体内均可产生较好的抗氧化活性。木瓜蛋白酶水解的麸皮纤粘蛋白产生的多肽复合物对abts自由基有较强的猝灭能力及金属离子螯合能力。但是目前,现有技术还没有任何关于单环刺螠来源的多肽在制备抗氧化剂中的记载或报道。
技术实现要素:
本发明的目的在于提供具有抗氧化活性的单环刺螠多肽及其应用,本发明的单环刺螠多肽具有血管紧张素转化酶竞争性抑制活性。
为了实现上述发明目的,本发明提供以下技术方案:
本发明提供了具有抗氧化活性的单环刺螠多肽,所述单环刺螠多肽包括第一多肽和/或第二多肽;所述第一多肽的氨基酸序列如seqidno.1所示;所述第二多肽的氨基酸序列如seqidno.2所示。
本发明还提供了上述方案所述单环刺螠多肽在制备抗氧化剂中的应用。
本发明还提供了上述方案所述单环刺螠多肽在制备降低血压的药物中的应用。
优选的,所述单环刺螠多肽通过竞争性抑制ace活性和/或修复huvec细胞氧化损伤来降低血压。
优选的,所述药物中单环刺螠多肽的含量为50~200μm。
本发明的有益效果:本发明提供了具有血管紧张素转化酶(ace)抑制活性和抗氧化活性的单环刺螠多肽,所述单环刺螠多肽包括第一多肽和/或第二多肽;所述第一多肽的氨基酸序列如seqidno.1所示;所述第二多肽的氨基酸序列如seqidno.2所示。本发明的单环刺螠多肽能够清除angii与其受体结合时所产生的大量超氧阴离子,降低内皮细胞受损程度,从而降低高血压。并且本发明的单环刺螠多肽对h2o2损伤的huvec细胞具有显著的保护作用,能够促进血管舒张因子no的释放,从而对内皮细胞起到了一定程度的保护作用,能够增加氧化损伤细胞中的sod含量和mda含量,提高氧化损伤细胞中的cat活力,降低氧化损伤细胞中的ldh的释放,降低氧化损伤造成的细胞内ros的升高,从而保证细胞膜的完整性,进而减轻细胞受到的损伤。除此之外,本发明的单环刺螠多肽具有ace竞争性抑制活性,其中第一多肽的ace抑制活性ic50(mg/ml)为0.32;第二多肽的ace抑制活性ic50(mg/ml)为0.29。本发明的单环刺螠多肽对huvec细胞的增殖没有抑制作用,能够拮抗去甲肾上腺素(ne)抑制细胞中no释放的作用,能够抑制由于ne所引起的促进细胞释放et-1的作用,进而达到降压的目的。本发明的单环刺螠多肽通过抑制ace的活性,提高缓激肽含量,影响一氧化氮合成酶(enos)处的磷酸化作用,从而提高enos活性,释放更多的no,进而抑制et-1,达到降血压的效果。
此外,本发明的单环刺螠多肽能够清除angii与其受体结合时所产生的大量超氧阴离子,降低内皮细胞受损程度,从而降低高血压;本发明的第一多肽和第二多肽对h2o2损伤的huvec细胞具有显著的修复作用,能够增加氧化损伤细胞中的sod含量和mda含量,降低氧化损伤造成的细胞内ros的升高,提高氧化损伤细胞中的cat活力,降低氧化损伤细胞中的ldh的释放,从而保证细胞膜的完整性,进而减轻细胞受到的损伤。
附图说明
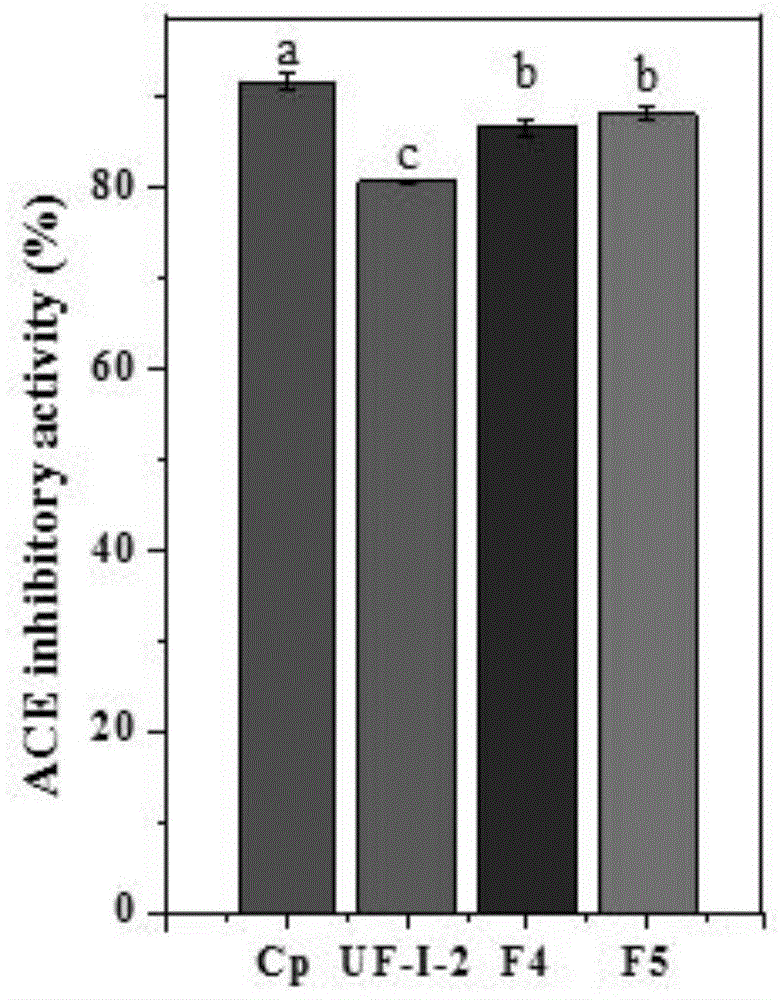
图1为条纯肽的ace抑制活性a-c间字母相同无显著性(p>0.05);
图2为f4的ace抑制作用lineweaver-burk图;
图3为f5的ace抑制作用lineweaver-burk图;
图4为f4与ace的结合方式;
图5为f4肽结合模式的二维示意图,虚线表示在肽和结合位点的残基之间形成的相互作用力;
图6为f5与ace的结合方式;
图7为f5肽结合模式的二维示意图,虚线表示在肽和结合位点的残基之间形成的相互作用力;
图8为不同浓度多肽(f4和f5)对huvec细胞增殖活性的影响,注:a~c间字母相同无显著性(p>0.05);
图9为bsa蛋白标准曲线;
图10为不同浓度多肽(f4和f5)对huvec细胞no含量的影响,其中:##p<0.01,#p<0.05vscontrol组;**p<0.01,*p<0.05vsne组;
图11为et-1标准曲线;
图12为不同浓度多肽(f4和f5)对人脐静脉内皮细胞et-1含量的影响;
图13为不同浓度多肽(f4和f5)对人脐静脉内皮细胞inos活性的影响;其中,##p<0.01,#p<0.05vscontrol组;**p<0.01,*p<0.05vsne组;
图14为不同浓度多肽(f4和f5)对人脐静脉内皮细胞enos(b)活性的影响;其中,##p<0.01,#p<0.05vscontrol组;**p<0.01,*p<0.05vsne组;
图15为f4、f5对氧化损伤changliver细胞修复作用;##p<0.01vscontrol组;**p<0.01,*p<0.05vs模型组;
图16为不同浓度f4、f5对huvec细胞氧化损伤的修复作用;##p<0.05vscontrol组;**p<0.01,*p<0.05vs模型组;
图17为不同浓度f4、f5对细胞中no的影响;a-g表示相同字母间无显著性差异(p>0.05);
图18为不同浓度f4、f5对huvec细胞中sod水平的影响;a-g表示相同字母间无显著性差异(p>0.05);
图19不同浓度f4、f5对huvec细胞中mda水平的影响;a-g表示相同字母间无显著性差异(p>0.05);
图20为不同浓度f4、f5对huvec细胞中cat水平的影响;a-f表示相同字母间无显著性差异(p>0.05);
图21为不同浓度多肽f4、f5对huvec细胞中ldh水平的影响;a-g表示相同字母间无显著性差异(p>0.05);
图22为dcfh-da染色法测定细胞内ros含量;##p<0.01vscontrol组;**p<0.01,*p<0.05vs模型组。
具体实施方式
本发明提供了具有抗氧化活性的单环刺螠多肽,所述单环刺螠多肽包括第一多肽和/或第二多肽;所述第一多肽的氨基酸序列如seqidno.1所示,具体为trp-pro-gly-lys-ala;所述第二多肽的氨基酸序列如seqidno.2所示,具体为:gly-leu-thr-lys-pro。
本发明还提供了上述方案所述单环刺螠多肽在制备抗氧化剂中的应用。
本发明还提供了上述方案所述单环刺螠多肽在制备降低血压的药物中的应用。
在本发明中,所述单环刺螠多肽通过竞争性抑制ace活性和/或修复huvec细胞氧化损伤来降低血压;所述药物中单环刺螠多肽的含量优选为50~200μm,更优选为100~150μm。
下面将结合本发明中的实施例,对本发明中的技术方案进行清楚、完整地描述。显然,所描述的实施例仅仅是本发明一部分实施例,而不是全部的实施例。基于本发明中的实施例,本领域普通技术人员在没有做出创造性劳动前提下所获得的所有其他实施例,都属于本发明保护的范围。
实施例1本发明的单环刺螠多肽对血管内皮细胞中血压调控因子的影响
1、实验材料与仪器
1.1实验材料
f4:trp-pro-gly-lys-ala;f5:gly-leu-thr-lys-pro;
人脐静脉内皮细胞(huvec),由中科院上海生科院细胞库提供。
1.2主要试剂参见表1
表1主要试剂
1.3实验仪器参见表2
表2实验仪器
2实验方法
2.1多肽抑制模式
根据先前研究报道的方法(参见【forghanib,zareim,ebrahimpoura,etal.purificationandcharacterizationofangiotensinconvertingenzyme-inhibitorypeptidesderivedfromstichopushorrens:stabilitystudyagainsttheaceandinhibitionkinetics[j].journaloffunctionalfoods,2016,20:276-290.】),通过使用lineweaver-burk图确定多肽的acei活性动力学。根据“acei活性的测定”部分,将hhl溶解在硼酸钠缓冲液中,按照实验需求依次配制hhl溶液,至终浓度为8mg/ml、4mg/ml、2mg/ml、1mg/ml和0.5mg/ml。将多肽溶于去离子水中至终浓度为1mg/ml和0.5mg/ml。不同浓度的多肽与不同浓度的hhl反应。取20μl反应溶液,使用如下方法测定两种固定多肽的浓度(0.5mg/ml、1mg/ml)的ha峰面积。用1/[s]和1/area描绘lineweaver-burk曲线,并通过比较所获得的曲线评估多肽的acei动力学。
ha峰面积的测定方法如下:
根据cushman和cheung的方法确定ace抑制活性,并稍作了一些修改(参见【lih,alukore.kineticsoftheinhibitionofcalcium/calmodulin-dependentproteinkinaseiibypeaprotein-derivedpeptides[j].thejournalofnutritionalbiochemistry,2005,16(11):656-662.】)。将ace溶于硼酸缓冲液中至终浓度为0.1u/ml以便用于后续实验测定。将超滤冻干所得样品溶解在去离子水中以制备不同浓度的样品肽溶液;然后将180μlhhl溶液与30μl一定浓度的肽溶液混合,将混合物在37℃下孵育5min,随后将15μl、0.1u/mlace添加到上述混合物中以启动反应。将反应在37℃保持60min,然后添加225μl的1mhcl以终止反应。将反应液用0.22μm滤膜过滤,用针管抽取20μl过滤后的反应液加载到rp-hplc中,并在228nm处检测其吸光度。所有测定均重复三次。ace抑制活性计算如下:
其中ainhibitor是ace和hhl与抑制剂(acei)反应得到的马尿酸(ha)峰的相对面积。acontrol是无抑制剂的ace和hhl的反应所得的马尿酸(ha)峰的相对面积。
2.2分子对接模拟
使用autodock软件包(vina,圣地亚哥,加利福尼亚,美国)通过分子对接详细说明纯化的ace抑制肽与ace相互作用的机制及其活性之间的关系。ace的天然晶体结构(pdb代码:1o8a)和ace与卡托普利的晶体复合结构(pdb代码:1uzf)可从proteindatabank下载,并使用ucsfchimera1.13.1软件绘制肽结构并进行能量最小化;autodocktools用于制备ace和用于对接的肽。通过autodockvina,计算结合自由能,并选择对蛋白质显示最低结合亲和力的肽作为最佳构象;使用pymol2.3.0分子图形系统使蛋白质-配体结构可视化。
2.3实验分组及处理
将对数生长期的huvec细胞,接种于若干6孔细胞培养板中,每孔1.8ml,细胞数5.0×105个/孔,接种结束后将其置于37℃、5%co2的恒温细胞箱中孵育24h,实验时随机分组如下表3所示:
表3实验分组与具体实验操作
2.4多肽对细胞增殖作用的影响(mtt法)
将对数生长期的人脐静脉内皮细胞(huvec),接种于若干96孔培养板。每孔180μl,细胞数1.5×104个/孔,置于37℃、5%co2的恒温箱中孵育24h。将每个96孔板分为空白对照组和样品组,空白对照组加入20μlpbs,样品组加入20μl的多肽(样品浓度为50μm、100μm、200μm),恒温细胞培养箱中培养24h。每孔加mtt溶液20μl,于37℃、5%co2培养4h,将孔内液体倒置在吸水纸上吸干,每孔再加入180μl的二甲基亚砜(dmso),37℃避光震荡15min,使用酶标仪在570nm波长处测定od值。mtt法测细胞相对存活率,计算公式为:
细胞存活率(%)=(od实验组/od空白对照组)×100%
2.5总蛋白含量测定(bca法)
将对数生长期的人脐静脉内皮细胞(huvec),接种于6孔培养板中。每孔1.8ml,细胞数5.0×105个/孔,置于37℃、5%co2的恒温箱中孵育24h。将每个6孔板分为空白对照组、卡托普利组(cp,1μm)、去甲肾上腺组(ne,0.5μm)、样品组(50μm、100μm、200μm)以及ace抑制肽+ne组(100μm+0.5μm)。
细胞处理:轻轻移去6孔板中的培养液,用少量胰酶室温消化3min,随后加完全培养液终止消化,用移液器将依然贴壁的细胞轻轻吹下,并将细胞液吸入到4mlep管中。在3000r/min条件下离心10min,弃上清,加1mlpbs重悬沉淀的细胞,重复离心两次后留沉淀细胞。在沉淀细胞中加入一定量pbs,在功率300w,冰水浴条件下用细胞超声破碎仪超声,频率为3~5秒/次,间隔4次,每次间隔30秒。实验操作:将所得细胞破碎液用bca试剂盒测其蛋白浓度,具体操作步骤(bca工作液的配制、绘制标准曲线以及样品测定)参照solarbio公司生产的bca试剂盒说明书。根据样品在562nm处的吸光值,带入根据标准品已绘制好的标准曲线可计算得样品的蛋白总含量。
2.6no含量测定
细胞处理:同2.5总蛋白含量测定的细胞处理方法。
实验操作:将所得破碎细胞液用bca试剂盒测其蛋白浓度,其余步骤即具体试剂添加顺序与添加量按南京建成生物工程研究所所生产的no试剂盒说明书进行。将反应所得混合液进行混匀,室温静置10min,波长550nm,光径0.5cm,双蒸水调零,测定各管吸光度值。
计算公式为:
2.7内皮素(et-1)含量测定
细胞处理:同2.5总蛋白含量测定的细胞处理方法。
检测原理:该试剂盒采用双抗体一步夹心法进行酶联免疫吸附测定(elisa法)。向预先涂有内皮素-1(et-1)抗体的包被的微孔中,依次加入标本,标准品和辣根过氧化物酶(hrp)标记的检测抗体,在恒温条件下孵育并彻底洗涤。当使用底物四甲基联苯胺(tmb)进行显色时,tmb将被过氧化物酶催化转化为蓝色,而在酸的作用下转化为最终的黄色。颜色的深浅与样品中内皮素1(et-1)的含量呈正相关。用酶标仪测量450nm处的吸光度(od值),绘制标准曲线,并计算样品浓度。
实验操作:et-1含量测定的具体操作方法按试剂盒说明书进行。
2.8一氧化氮合酶(nos)活力测定
细胞处理:同2.5总蛋白含量测定的细胞处理方法。
实验操作:将所得破碎细胞液用bca试剂盒测其蛋白浓度,其余步骤按表4进行。
表4实验操作表
混匀,530nm处,1cm光径,蒸馏水调零,测各管的吸光度值。
计算公式如下:
3、结果与分析
3.1纯化多肽的ace抑制活性分析
如图1所示,在1mg/ml的条件下,参照2.1测定第一多肽(f4)和第二多肽(f5)的ace抑制率。测定2条纯肽的活性如下所示:78.34±0.85%(f4,642.8da)、84.95±0.53%(f5,630.86da)。
与卡托普利(91.53±0.86%)相比,分别测定f4和f5在不同浓度下的ace抑制率,结果表5所示。
表5f4和f5五条纯肽的ace抑制活性
3.2多肽抑制ace抑制模式的表征
不同的acei动力学是由肽的不同结构引起的,通常使用lineweaver-burk图确定acei肽的动力学,抑制性参数由y轴和x轴截距表示(参见【刁静静,王凯凯,张丽萍,等.模拟移动床色谱分离纯化绿豆ace抑制肽[j].中国食品学报,2017,17(9):142-150.】)。图2和图3分别表示的是多肽f4和f5的ace抑制作用的lineweaver-burk图。从图2和图3中可以看出,随着多肽f4和f5浓度的增加,三条线在y轴上截取了同一点,这证实了多肽f4和f5与底物竞争ace的活性位点,从而揭示了竞争性抑制模式(参见【raos,sunj,liuy,etal.aceinhibitorypeptidesandantioxidantpeptidesderivedfrominvitrodigestionhydrolysateofheneggwhitelysozyme[j].foodchemistry,2012,135(3):1245-1252.】)。
3.3分子对接
为了进一步阐明多肽f4和f5与ace的分子相互作用以及潜在的抑制机制,使用autodock软件进行对接模拟,结果参见图4~图7。已知ace分子中有三个主要的活性位点口袋,包括s1(ala354,glu384和tyr523),s2(gln281,his353,lys511,his513和tyr520)和s3(glu162残基)(参见【wuq,duj,jiaj,etal.productionofaceinhibitorypeptidesfromsweetsorghumgrainproteinusingalcalase:hydrolysiskinetic,purificationandmoleculardockingstudy[j].foodchemistry,2016,199:140-149.】)。但通过分析ace与卡托普利晶体的复合结构,发现其作用残基除了传统的s1、s2和s3三个活性口袋外,还有his383、his387、phe457三个残基。
肽和ace残基主要通过氢键,疏水作用以及极性,范德华力和静电力连接(参见【suns,xux,sunx,etal.preparationandidentificationofaceinhibitorypeptidesfromthemarinemacroalgaulvaintestinalis[j].marinedrugs,2019,17(3):179.】)。如图5所示,f4(wpgka)与ace残基tyr520、tyr523、ala354、ala356、his353、his383、ser355之间形成氢键;与glu384、glu411、his387通过静电力相互作用;而与phe527、val380之间则形成疏水作用力。如图7所示,多肽f5(gltkp)与cys352、glu162之间形成氢键;与lys454、glu162、asp415、his383、glu411通过静电力相互作用;而与pro163、val379则形成疏水作用力。综上,f4与活性口袋s1(tyr523、ala354),s2(tyr520、his353)相互作用;f5与s3口袋(glu162)相互作用,因此多肽f4和f5是竞争性抑制剂。
3.4ace抑制肽对细胞增殖作用的影响
如图8所示,与空白对照组相比,多肽f4和f5在浓度50~200μm的范围内,细胞存活率均在90%以上,说明在该系列浓度下,f4和f5ace抑制肽对huvec细胞的增殖没有抑制作用。因此,选择浓度在50~200μm范围内的f4和f5多肽进行下一步实验。
3.5总蛋白含量标准曲线的绘制
经bca试剂盒测定,计算所得蛋白标准曲线如图9所示:曲线方程为y=1.0077x+0.1,r2=0.997,呈良好的线性关系。可通过此方程计算细胞样本的蛋白浓度,以便于后期相关ace抑制因子计算的使用。
3.6no含量的测定
从图10中可以看出各实验组中no含量的变化,如图10所示:阳性药卡托普利(cp)组与各浓度抑制肽组的no含量呈上升趋势,其中cp组no含量最高,说明其能极大的促进细胞释放no,从而实现降压;当抑制肽浓度为200μm时,no的释放量较浓度为50μm有极大的提升,因此选择高剂量组(200μm)进行后续实验。从图中可以看出去甲肾上腺素(ne)能够明显抑制细胞中的no释放,当向实验组中加入100μmace抑制肽后,no含量显著增加,表明ne抑制细胞中no释放的作用可能被一定浓度的ace抑制肽所拮抗,进而达到降压的目的。
3.7et-1含量的测定
本实验选用elisa试剂盒测定细胞中的et-1含量,在excel中,以标准品浓度作横坐标,各浓度相对应的吸光度值(od值)作纵坐标,绘制标准曲线,并根据曲线方程来计算各样本浓度值。所得标准曲线如图11所示,回归方程为y=0.0111x+0.2561,r2=0.9926,说明该曲线具有较好的拟合能力。
从图12中可以看出各组的et-1含量变化,如图所示:与空白组相比,阳性药卡托普利(cp)和单环刺螠ace抑制肽可以显著降低细胞内的et-1含量,并且呈一定程度的浓度依赖关系。由此可知,ace抑制肽(f4和f5)与卡托普利(cp)的作用类似,是通过抑制血管内皮细胞释放et-1从而起到降压的作用。与促进细胞no释放的作用相同,均是高浓度组对et-1释放的抑制作用最明显,说明一定浓度的ace抑制肽(acei)能够抑制由于去甲肾上腺素(ne)所引起的促进细胞释放et-1的作用。
3.8一氧化氮合酶(nos)活力的测定
内皮型nos(enos)在维持内皮细胞功能完整性方面发挥了十分重要的作用,它可以激活鸟苷酸环化酶并引起细胞内环磷酸鸟苷(cgmp)增加,从而发挥一系列的生物作用。一旦enos产生的no降低,血管的正常舒张状态不能保持,血压上升。另一方面,诱导型nos(inos)的表达将引发过量的no的产生,而no会与超氧阴离子自由基反应产生过氧化硝基阴离子,从而引起细胞损伤(参见【taddeis,virdisa,ghiadonil,etal.vitamincimprovesendothelium-dependentvasodilationbyrestoringnitricoxideactivityinessentialhypertension[j].circulation,1998,97(22):2222-2229.】)。本实验所选用的nos试剂盒为分型测定试剂盒,可以分别测定总nos(tnos)和诱导型nos(inos),而内皮型nos(enos)可以用tnos减去inos得到。
如图13和图14可知:卡托普利和ace抑制肽组可以激活enos,抑制inos的活性,从而释放更多的no。其中对inos的抑制作用随着多肽浓度的增加而增加,呈一定的浓度依赖关系。
综合3.6与3.7的结果,可以看出,多肽(f4和f5)对huvecs释放no及nos活性的影响作用机制为:多肽通过抑制ace的活性,提高缓激肽含量,影响enos处的磷酸化作用从而提高enos活性,释放更多的no,进而抑制et-1,达到降血压的效果。
由上述内容可以看出,本发明中f4(trp-pro-gly-lys-ala,557.66da)和f5(gly-leu-thr-lys-pro,514.63da)的ace抑制活性良好,其ic50分别为f4(0.32mg/ml),f5(0.29mg/ml)。
通过酶动力学研究,绘制lineweaver-burk图发现,随着多肽f4和f5的浓度增加,三条线在y轴上相交于同一点,从而揭示了其为竞争性抑制模式。为了进一步阐明多肽f4和f5与ace分子的相互作用以及潜在的抑制机制,使用autodock软件进行对接模拟。分子对接结果与lineweaver-burk图结果相一致,进一步证实f4和f5是竞争性抑制剂。
细胞水平实验验证了:在50~200μm的浓度范围内,具有ace抑制活性的多肽(f4和f5)对huvecs的增殖无显著性抑制作用,其细胞存活率皆为90%以上,说明此五条多肽在该浓度范围内对huvecs无毒副作用。对属于血管舒张因子的no,f4和f5与降压药物卡托普利均显示出不同程度的促进所用;对属于血管紧张因子的et-1,f4和f5也呈现出不同程度的抑制作用;对于一氧化氮合酶(nos)的不同类型,其能激活enos,抑制inos的活性,从而释放更多的no。f4和f5对内皮型nos(enos)和诱导型nos(inos)的双重作用表明其对细胞的降压功能具有一定的促进作用。
综上所述:f4和f5与阳性药(卡托普利,cp)均可以促进细胞激活内皮型nos(enos),抑制诱导型nos(inos)的活性从而释放更多的no,以达到降低血压的目的。f4和f5还能够延迟由ne引起的内皮细胞的增殖,纠正其生理功能,增加no含量,降低et含量,从而达到降压的效果。
实施例2本发明的单环刺螠多肽对氧化应激所致huvec细胞损伤的修复作用
本实施例中采用的实验材料、试剂和仪器同实施例1。
1、实验方法
1.1超氧阴离子清除能力测定
将f4和f5配制成一系列的浓度梯度,按照表6添加试剂,在25℃水浴5min,于560nm测吸光度。
表6超氧阴离子清除率的测定
清除率测定公式如下:
1.2构建氧化损伤模型
将对数生长期的人脐静脉内皮细胞(huvec),接种于96孔培养板。每孔180μl,细胞数1.5×104个/孔,置于37℃、5%co2的恒温箱中孵育24h。将96孔板分为空白对照组和八个实验组,空白组加入20μl细胞培养基,各实验组分别加入20μl的双氧水,其终浓度不同(300,400,500,600,700,800,900,1000μm),平行6个复孔。在37℃、5%co2恒温细胞培养箱中培养4h后,每孔加mtt溶液20μl,于37℃、5%co2恒温细胞培养箱中培养4h,将孔内液体倒置在吸水纸上吸干,每孔再加入180μl的dmso,37℃避光震荡15min,使用酶标仪在570nm波长处测定od值。mtt法测细胞相对存活率,计算公式为:
细胞存活率(%)=(od实验组/od空白对照组)×100%
1.3初筛对huvec细胞损伤具有修复作用的多肽
将对数生长期的人脐静脉内皮细胞(huvec),接种于若干96孔培养板。每孔160μl,细胞数1.5×104个/孔,置于37℃、5%co2的恒温箱中孵育24h。将每个96孔板分为空白对照组、模型组和样品组,空白对照组和模型组加入20μlpbs,样品组加入20μl的多肽(样品浓度为200μm),恒温细胞培养箱中培养2h。空白组加入20μlpbs,各模型组和样品组加入20μl终浓度为700μm的双氧水,恒温培养箱中培养4h。每孔加mtt溶液20μl,于37℃、5%co2培养4h,将孔内液体倒置在吸水纸上吸干,每孔再加入180μl的dmso,37℃避光震荡15min,使用酶标仪在570nm波长处测定od值。mtt法测细胞相对存活率,计算公式为:
细胞存活率(%)=(od实验组/od空白对照组)×100%
1.4不同浓度多肽对huvec细胞损伤的保护
将对数生长期的人脐静脉内皮细胞(huvec),接种于若干96孔培养板。每孔160μl,细胞数1.5×104个/孔,置于37℃、5%co2的恒温箱中孵育24h。将每个96孔板分为空白对照组、模型组、阳性药组和样品组,空白对照组和模型组加入20μlpbs,阳性药组加入20μl乙酰半胱氨酸(nac,终浓度为1000μm),样品组加入20μl的多肽(样品终浓度分别为50、100、200μm),恒温细胞培养箱中培养2h。空白组加入20μlpbs,各模型组和样品组加入20μl终浓度为700μm的双氧水,恒温培养箱中培养4h。每孔加mtt溶液20μl,于37℃、5%co2培养4h,将孔内液体倒置在吸水纸上吸干,每孔再加入180μl的dmso,37℃避光震荡15min,使用酶标仪在570nm波长处测定od值。mtt法测细胞相对存活率,计算公式为:
细胞存活率(%)=(od实验组/od空白对照组)×100%。
1.5总蛋白含量测定(bca法)
实验分组:将对数生长期的人脐静脉内皮细胞(huvec),接种于若干6孔培养板。每孔1.4ml,细胞数5×105个/孔,置于37℃、5%co2的恒温箱中孵育24h。将每个6孔板分为空白对照组、模型组、阳性药组和样品组,空白对照组和模型组加入300μlpbs,阳性药组加入300μl的乙酰半胱氨酸(nac),样品组加入300μl的多肽(样品终浓度分别为50、100、200μm),恒温细胞培养箱中培养2h。空白组加入300μlpbs,各模型组、阳性药组和样品组加入300μl终浓度为700μm的双氧水,恒温细胞培养箱中培养4h。
细胞处理:轻轻移去6孔板中的细胞培养液,用少量胰酶室温消化3min,随后加完全培养液终止消化,用移液器将依然贴壁的细胞轻轻吹下,并将细胞液吸入1.5mlep管中。在1000r/min条件下离心10min,弃上清,加1mlpbs重悬沉淀的细胞,重复离心两次后留沉淀细胞。在沉淀细胞中加入一定量pbs,在功率300w,冰水浴条件下用细胞超声破碎仪超声,频率为3~5秒/次,间隔4次,每次间隔30秒。将所得细胞破碎液用bca试剂盒测其蛋白浓度。
测定方法:参照实施例1中2.5。
1.6no含量测定
实验分组同1.5。细胞处理同1.5。测定方法参照实施例1中2.6进行。
1.7超氧化物歧化酶(sod)活力测定
实验分组同1.5。细胞处理同1.5。
测定方法:将所得破碎细胞液用bca试剂盒测其蛋白浓度,其余步骤按表7进行:
表7实验操作表
计算公式:
1.8丙二醛(mda)含量测定
实验分组同1.5。细胞处理同1.5。
测定方法:将所得破碎细胞液用bca试剂盒测其蛋白浓度,其余步骤按表8进行:
表8实验操作表
离心管盖上盖子,用针在盖上扎一小孔,漩涡混匀器混匀,95℃水浴40min,流水冷却,3500~4000r/min,离心10min,取上清,532nm处,1cm光径,蒸馏水调零,测定吸光值。
计算公式:
1.9过氧化氢酶(cat)活力测定
实验分组同1.5。细胞处理同1.5。
测定方法:将所得破碎细胞液用bca试剂盒测其蛋白浓度,其余步骤按表9进行:
表9实验操作表
混匀,波长405nm,光径0.5cm,双蒸水调零,测定吸光度。
计算公式:
1.10乳酸脱氢酶(ldh)活力测定
实验分组同1.5。细胞处理:轻轻吸取6孔板中的细胞培养液,小心的吸入1.5mlep管中。在1000r/min条件下离心10min,弃沉淀,保留上清液以便进行试剂盒的测定。
测定方法:按表10进行:
表10实验操作表
混匀,室温静置5min,波长450nm,测定吸光度。
计算公式:
1.11dcfh-da染色
细胞处理:将对数生长期的人脐静脉内皮细胞(huvec),接种于若干6孔培养板。每孔1.6ml,细胞数2.5×105个/孔,置于37℃、5%co2的恒温箱中孵育24h。将每个6孔板分为空白对照组、模型组、阳性药组和样品组,空白对照组和模型组加入200μlpbs,阳性药组加入200μl乙酰半胱氨酸(终浓度为1mm),样品组加入200μl的多肽(样品终浓度为50、100、200μm),恒温培养箱中培养2h。空白组加入200μlpbs,各模型组和样品组加入200μl终浓度为700μm的双氧水,并在恒温细胞培养箱中培养4h。
将经过双氧水处理过的细胞,用pbs轻轻洗涤两次。每孔需加入1ml10μm的dcfh-da探针,以充分覆盖住待染色的细胞。并在37℃、5%co2的恒温箱中培养60min。然后用pbs洗涤细胞两次。通过荧光显微镜(激发/发射波长为485nm/535nm)观察细胞形态,并对其荧光强度进行定量分析。
2结果与分析
2.1超氧阴离子清除能力的测定结果参见表11。
表11f4和f5的超氧阴离子清除活性
结果如表11所示:f4与f5具有较好的清除超氧阴离子自由基的能力,其ic50值分别为0.099mg/ml,0.091mg/ml。f4的氨基酸序列疏水性氨基酸为色氨酸(trp)、脯氨酸(pro)和丙氨酸(ala);f5中的为亮氨酸(leu)和脯氨酸(pro)。机体内的活性氧(ros)过量堆积,增强了氧化应激(os)的作用,从而增加了人体组织和细胞中氧自由基的积累,抗氧化剂系统功能的失衡,进而导致内皮细胞损害和功能障碍。f4与f5能够清除angii与其受体结合时所产生的大量超氧阴离子,降低内皮细胞受损程度,从而降低高血压。
2.2氧化损伤模型的构建及初步验证f4,f5对huvec细胞损伤修复作用
选用700μmh2o2诱导huvec细胞损伤,诱导时间为4h,建立模型组。样品组预先加入200μm多肽(f4或f5)作用细胞,后加h2o2诱导细胞损伤。以mtt测定各实验组细胞存活率。结果如图15所示,模型组的细胞存活率较空白组具有较显著性的差异(p<0.01),为47.57±0.76%,说明所建氧化损伤模型可用。与模型组相比,f4,f5对h2o2损伤的huvec细胞具有显著的修复作用。其中f4,f5能显著提高经h2o2损伤过的细胞的存活率(p<0.01),使细胞存活率由47.57±0.76%分别提高到59.78±0.38%和57.62±0.87%。
2.3不同浓度f4,f5对huvec细胞损伤的保护
选用700μmh2o2诱导huvec细胞损伤,建立模型组;以乙酰半胱氨酸(nac,终浓度为1mm)作为阳性对照样品组。以50μm,100μm,200μm多肽(f4,f5)预先作用于细胞,后加h2o2诱导细胞损伤。以mtt法测定各实验组细胞存活率,以此测定不同浓度多肽对人脐静脉内皮细胞损伤的修复作用。结果如图16所示,模型组的细胞存活率较空白组具有较显著性的差异(p<0.01),为47.60±0.64%,说明所建氧化损伤模型可用。与模型组相比,多肽样品组(f4,f5)细胞存活率随着浓度的增加,其对h2o2损伤的huvec细胞的修复作用逐渐升高。其中f4,f5在50μm浓度下对huvec细胞损伤修复作用较模型组不明显(p<0.05)。但它们在200μm浓度下能显著提高经h2o2损伤过的细胞存活率(p<0.01),使细胞存活率由47.60±0.64%分别提高到59.78±0.58%和57.32±0.88%。
2.4no含量测定
选用700μmh2o2诱导huvec细胞损伤,建立模型组;以乙酰半胱氨酸(nac,终浓度为1mm)作为阳性对照样品组。以50μm,100μm,200μm多肽(f4,f5)预先作用于细胞,后加h2o2诱导细胞损伤,以细胞中no含量评价不同浓度多肽对人脐静脉内皮细胞损伤的修复作用。结果如图17所示:模型组细胞比空白组细胞的舒张因子no释放量减少,在加入不同浓度的降压肽作用后,no的释放量呈明显的上升趋势。从图中可以看出,f4和f5组降压肽在浓度为100μm时,no含量相比于模型组显著提高。结果表明,h2o2作用于huvec细胞使其no的释放量减少,当多肽f4、f5作用之后,促进了血管舒张因子no的释放,从而对内皮细胞起到了一定程度的修复作用。
2.5抗氧化指标试剂盒测定结果
2.5.1超氧化物歧化酶(sod)含量测定
选用700μmh2o2诱导huvec细胞损伤,建立模型组。以乙酰半胱氨酸(nac,终浓度为1mm)作为阳性对照样品组。以50μm,100μm,200μm多肽(f4,f5)预先作用于细胞,后加h2o2诱导细胞损伤。以细胞中sod含量评价不同浓度多肽对人脐静脉内皮细胞损伤的修复作用。结果如图18所示:模型组的sod含量较空白组具有较显著性降低(p<0.05),说明氧化损伤模型建立成功。与模型组相比,多肽样品组(f4,f5)细胞中sod含量随着多肽浓度的增加而增加,表明其对h2o2损伤的huvc细胞的修复作用逐渐增强。其中f4在100μm,200μm;f5在200μm浓度下使人脐静脉内皮细胞中sod含量较模型组有显著增加(p<0.05)。多肽f4,f5在200μm浓度下能显著提高氧化损伤细胞中的sod含量(p<0.01)。
2.5.2丙二醛(mda)含量测定
选用700μmh2o2诱导huvec细胞损伤,建立模型组。以乙酰半胱氨酸(nac,终浓度为1mm)作为阳性对照样品组。以50μm,100μm,200μm多肽(f4,f5)预先作用于细胞,后加h2o2诱导细胞损伤。以细胞中mda含量评价不同浓度多肽对人脐静脉内皮细胞损伤的修复作用。结果如图19所示:模型组的mda含量较空白组具有较显著性升高(p<0.01),说明氧化损伤模型建立成功。与模型组相比,多肽样品组(f4,f5)细胞中mda含量随着多肽浓度的增加而降低,表明其对h2o2损伤的huvec细胞的修复作用逐渐增强。其中f4、f5在50μm浓度下使人脐静脉内皮细胞中mda含量较模型组略有降低,但无显著性差异(p<0.05)。而f4在100μm、200μm,f5在200μm浓度下能显著降低氧化损伤细胞中的mda含量(p<0.05)。从总体趋势来看,f4,f5可降低氧化损伤细胞中的mda含量,且呈浓度依赖性。
2.5.3过氧化氢酶(cat)活力测定
选用700μmh2o2诱导huvec细胞损伤,建立模型组。以乙酰半胱氨酸(nac,终浓度为1mm)作为阳性对照样品组。以50μm,100μm,200μm多肽(f4,f5)预先作用于细胞,后加h2o2诱导细胞损伤。以细胞中cat的活力来评价不同浓度多肽对人脐静脉内皮细胞损伤的修复作用。结果如图20所示:模型组的cat活力较空白组具有较显著性降低(p<0.05),说明氧化损伤模型建立成功。与模型组相比,多肽样品组(f4,f5)细胞中cat活力随着多肽浓度的增加而增强,表明其对h2o2损伤的huvec细胞的修复作用逐渐增强,但二者在以50μm,100μm的浓度作用于细胞时,两者之间并无显著性差异(p<0.05)。
2.5.4乳酸脱氢酶(ldh)活力测定
选用700μmh2o2诱导huvec细胞损伤,建立模型组。以乙酰半胱氨酸(nac,终浓度为1mm)作为阳性对照样品组。以50μm,100μm,200μm多肽(f4,f5)预先作用于细胞,后加h2o2诱导细胞损伤。以细胞中ldh含量来评价不同浓度多肽对人脐静脉内皮细胞损伤的修复作用。结果如图21所示:模型组的ldh活力较空白组具有较显著性升高(p<0.01),说明氧化损伤模型建立成功。与模型组相比,多肽样品组(f4,f5)细胞中ldh含量随着多肽浓度的增加而降低,表明其对h2o2损伤的huvec细胞的修复作用逐渐升高。其中f4、f5在50μm浓度下使人脐静脉内皮细胞中mda含量较模型组略有降低,但无明显的显著性差异(p<0.05)。而f4、f5在50-200μm浓度梯度下能显著降低氧化损伤细胞中的ldh活力(p<0.05)。从总趋势来看,f4,f5可降低氧化损伤细胞中的ldh的释放,从而保证细胞膜的完整性,进而减轻细胞受到的损伤。
2.6dcfh-da染色(ros检测)
2',7'-二氯荧光黄双乙酸盐(2',7'-dichlorofluorescindiacetate,dcfh-da)是最常用的活性氧检测探针。dcfh-da本身没有荧光,但进入细胞后,在酶的作用下被水解为dcfh(dichlorofluorescin);若细胞内存在活性氧ros(超氧自由基、过氧化氢、羟化物等),dcfh则会变成强绿色荧光物质dcf(dichlorofluorescein),但因其不能透过细胞膜,所以可以用来检测细胞内ros含量。
以双氧水(h2o2)诱导huvec细胞损伤,建立细胞损伤模型,以乙酰半胱氨酸(nac,终浓度为1mm)作为阳性对照样品组。以50μm,100μm,200μm多肽(f4,f5)作用于细胞,后加h2o2诱导细胞损伤。结果如图22所示,经dcfh-da染色后,模型组较正常组huvec细胞中(p<0.01)ros明显增多(p<0.01),说明所建氧化损伤模型可用。与模型组相比,多肽样品组(f4,f5)随着样品浓度的增加,其使得h2o2损伤的huvec细胞内的ros含量逐渐降低。从结果来看,单环刺螠多肽f4,f5能降低氧化损伤造成的细胞内ros的升高。
从超氧阴离子清除实验可以看出,肽f4与f5具有较好的清除超氧阴离子自由基的能力,其ic50值分别为0.099mg/ml,0.091mg/ml。f4与f5可以清除angⅱ与其受体结合时所产生的大量超氧阴离子,降低内皮细胞受损程度,从而降低高血压。f4和f5具有较好细胞修复作用,且细胞相对存活率随加样浓度增加而上升。
超氧化物歧化酶(sod),是生物体内重要的抗氧化酶,它可阻抗氧自由基对细胞造成的损害,并能够及时修复受损细胞;丙二醛(mda)是细胞膜脂质过氧化的产物之一,它能够引起生命大分子如蛋白质和核酸等发生交联聚合作用,且对其它细胞具有毒性作用;过氧化氢酶(cat)是生物体内抗氧化系统的关键酶之一,可促使h2o2分解为氧与水,清除体内过氧化氢,从而使细胞免受h2o2的毒害;乳酸脱氢酶(ldh)是内皮细胞损伤的标志物,正常情况下胞内含量大于胞外,但当细胞受到氧化损伤时,细胞膜受损,ldh外漏导致胞外大于胞内,因此测定其释放情况可反映细胞内的损伤情况。sod、mda、cat和ldh对细胞的氧化还原有着至关重要的作用,通过观察它们在细胞中的含量可判断多肽对氧化损伤细胞的修复作用强弱。结果显示:f4和f5均能提高损伤细胞中sod和cat水平,降低受损细胞内mda和ldh含量;通过dcfh-da染色,发现多肽f4,f5可以降低细胞内ros的水平,说明f4和f5对氧化损伤细胞具有一定的保护效果。
综上所述,通过f4和f5对h2o2诱导huvec细胞损伤模型的保护和对抗氧化系列酶以及细胞内活性氧(ros)的影响,得出f4和f5具有抗氧化活性,进一步说明单环刺螠多肽f4与f5能够清除angii与其受体结合时所产生的大量超氧阴离子,从而降低内皮细胞受损程度,进而降低高血压。
以上所述仅是本发明的优选实施方式,应当指出,对于本技术领域的普通技术人员来说,在不脱离本发明原理的前提下,还可以做出若干改进和润饰,这些改进和润饰也应视为本发明的保护范围。
序列表
<110>浙江海洋大学
<120>具有抗氧化活性的单环刺螠多肽及其应用
<160>2
<170>siposequencelisting1.0
<210>1
<211>5
<212>prt
<213>人工序列(artificialsequence)
<400>1
trpproglylysala
15
<210>2
<211>5
<212>prt
<213>人工序列(artificialsequence)
<400>2
glyleuthrlyspro
15
- 还没有人留言评论。精彩留言会获得点赞!