具有促成骨及血管再生生物功能的医用钛合金及其制备的制作方法
本发明属于生物医用材料领域,涉及一种自身具有多种生物医学功能的新型医用钛合金。
背景技术:
医用纯钛及钛合金由于其较低的弹性模量、高比强度、优异的耐腐蚀性和生物相容性等特点,从20世纪40年代开始,逐渐被广泛应用于人工关节(髋、膝、肩、踝、肘、腕、指关节等)、骨创伤产品(髓内钉、骨钉、接骨板等)、脊柱矫形固定系统、牙种植体、牙托、牙矫形丝、人工心脏瓣膜、介入支架等植入医疗器械。其中,以航空应用为背景开发的Ti-6Al-4V钛合金从20世纪70年代起开始在医学领域中得到应用,到目前为止仍然是骨科中应用最多的医用钛合金材料。但Ti-6Al-4V合金自身所表现出的生物惰性使其与植入部位的整合性差,易因微动、感染、炎症刺激等因素导致植入体松动,进而会影响治疗效果,最终可能会导致植入失败,这已经成为医用钛合金植入器械临床应用中需要迫切解决的一个重要问题。
理想的骨科植入物应该具有促进成骨的生物功能,这样就能实现骨组织与植入物界面在机械与生物两方面实现更完美的结合,进而加快骨生长过程,促进骨重建及修复。同时,骨的形成与丰富的血供密不可分。血液可以为骨组织提供丰富的营养物质、运送生长因子、生化信号等,并且能够将其产生的废物通过血液排出。因此,如果植入物自身同时具有成骨及 血管生成的生物医学功能(活性),无疑将会大大提升骨组织的修复能力和速度,缩短骨重建及修复时间,增强植入材料与骨组织的整合强度。
目前,主要是通过表面改性技术提高钛合金的表面生物活性,使其具备了一定的成骨功能,甚至具有血管再生趋势等生物医学功能。然而,表面改性技术仍然存在一定的不足和局限性,例如,涂层与钛合金基底的理化性质差异大导致的结合力太差,使涂层易于脱落;涂层所载的生物活性因子因快速释放导致的副作用;活性因子不能长期持续释放导致的不能发挥持久生物活性作用;复杂的涂层制备工艺而带来的制造成本增加等问题。
因此,现有技术的不足在于:目前还没有安全可靠、稳定持久,并自身具有促进成骨与血管再生功能的骨科植入物用医用金属材料。
技术实现要素:
本发明针对上述问题,提出了一种医用钛合金及其制备、热加工、热处理方法与应用,以解决现有骨科植入材料植入后因其生物惰性使其与植入部位的整合性差导致的植入体松动甚至植入失败的问题。
为实现上述目的,本发明采用的技术方案是:在现有(α+β)双相医用钛合金Ti-6Al-4V的化学成分基础上,添加适量的铜元素(Cu)与锶元素(Sr),其化学成分为重量百分比:Al:5.5-6.5;V:3.5-4.5;Cu:6-12;Sr:0.1-2;其余为Ti及不可避免的杂质,杂质元素含量应满足我国外科植入物用Ti-6Al-4V合金的相关要求。其中Cu与Sr元素的重量百分比优选为:Cu:8-10;Sr:0.5-1.5。
在本发明的具有促成骨及血管再生等生物功能的新型医用钛合金的成分设计中,Cu是本发明所述医用钛合金中最重要的合金元素,这是保证钛 合金具有促进成骨与血管再生的必要条件,也是本发明的主要创新点之一。本发明是在医用钛合金中加入适量的铜元素,以保证在特殊热处理条件下,微量铜离子能够从钛合金表面持久释放,从而赋予钛合金促进成骨与血管再生的生物功能。如果铜含量相对较低,即使经过特殊热处理,钛合金也无法释放足量的铜离子,因而不具备促进成骨与血管再生的生物功能。如果铜含量相对过高,则会导致钛合金释放过多的铜离子,会影响钛合金的耐蚀性能及生物安全性,过高的铜含量对钛合金的力学性能和加工性能也会产生负面影响。只有在本发明提供的Cu含量的范围内,钛合金才能保证优异的力学性能、加工性能、耐蚀性能以及生物安全性等。Sr也是本发明所述医用钛合金中的重要合金元素,其能发挥促进骨组织生长的作用,因此其可与Cu元素协同发挥促进成骨的作用,使本发明提供的新型医用钛合金具有更加优异的成骨功能。如果Sr含量太低,其与Cu元素相互协同发挥的成骨作用就会减弱。Sr本不是钛合金化元素,也是首次创新地加入到钛合金中。如果Sr含量相对过高,则会影响合金的显微组织、力学性能和加工性能。
本发明还提供了所述新型医用钛合金的制备方法、热加工、热处理工艺:
首先,利用真空电弧炉熔炼,得到合金铸锭,铸锭需重复熔炼不少于5次,并在均匀化处理的温度范围内保温至合金中的各元素充分均匀化,均匀化处理的温度范围为1200-1250℃,保温时间为2-4小时。
热加工是将该合金铸锭开坯锻造,分多火锻造成棒材和/或初轧坯料,终锻温度≥900℃。
热加工后获得新型医用钛合金需进行特殊的热处理,即固溶处理,在固溶温度范围内保温至医用钛合金中Cu、Sr元素充分固溶于基体中,水冷,固溶处理的温度范围为900-1000℃,保温时间为1-2小时。
采用本发明所述方式制备得到的医用钛合金可作为骨科植入物材料进行应用,发挥独特的促进成骨、血管再生功能。
本发明的有益效果是:
本发明所述医用钛合金当作为骨科植入物时,可向其附近组织中持续释放微量Cu与Sr元素,不仅能够促进骨组织的生长,还能有效地促进血管再生,进而大大提升骨组织的修复能力和速度,缩短骨重建及修复,增强植入材料与骨组织的整合强度,解决现有骨科植入材料植入后因其生物惰性使其与植入部位的整合性差导致的植入体松动甚至植入失败的问题。
附图说明
图1 VEGF(血管内皮生长因子)表达结果。
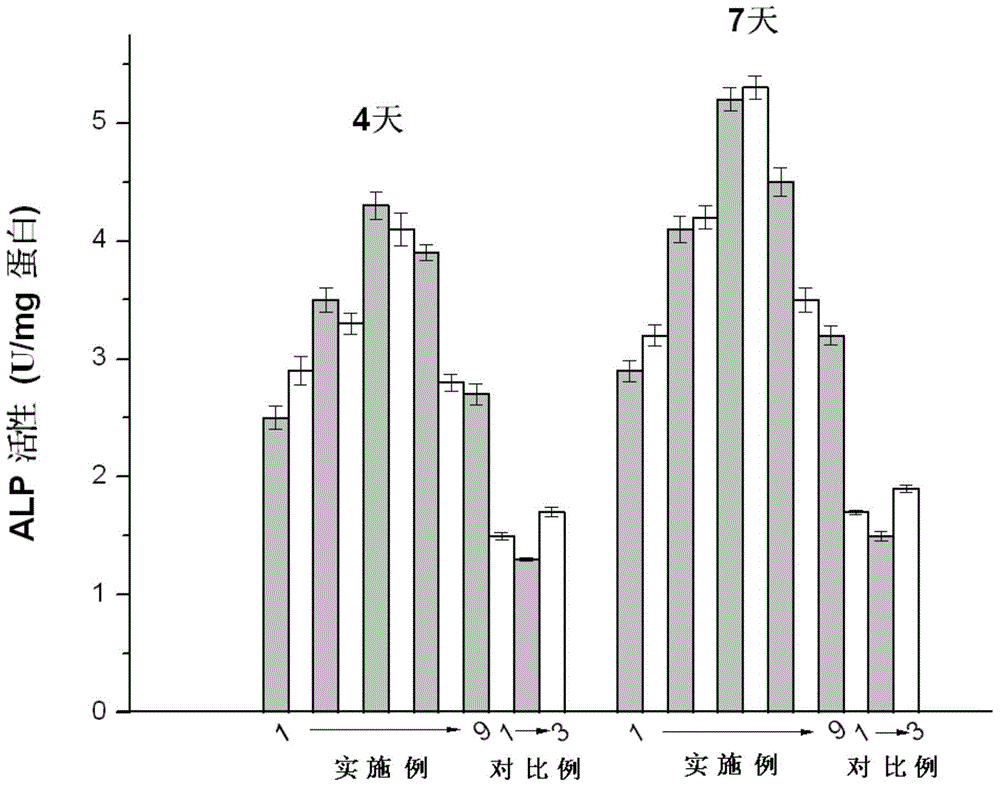
图2 碱性磷酸酶(ALP)活性。
具体实施方式
实施例1~9:
将钛合金(成分含量数据见表1)进行热加工和热处理,具体为:
1、将钛合金在1200-1250℃均匀化处理2小时,至钛合金中的各元素充分均匀化;
2、将钛合金开坯锻造,分多火锻造成棒材,终锻温度为900℃。
3、热处理:将钛合金在900-1000℃固溶处理1小时至钛合金中铜元素、鍶元素充分固溶于基体,水冷。
对比例1~3:
重复实施例1,合金成分含量数据见表1。
表1实施例和对比例钛合金的化学成分(重量%)
实施例10:
将实施例1-9和对比例1-3的钛合金采用INSTRON 5582型号拉伸仪进行力学性能检测,获得拉伸强度Rm/MPa、延伸率δ/(%)等常规力学性能数据,检测结果见表2。
其中,拉伸强度的计算公式为:
Rm=p/(b×d),式中,Rm为拉伸强度(MPa);p为最大负荷(N);b为试样宽度(mm);d为试样厚度(mm)。
延伸率的计算公式为:
δ=ΔL/L×100%,式中,ΔL为试样拉伸断裂后标距段的总变形,L为原标距长度。
从表2可以看出,添加适量Cu、Sr元素的钛合金与原有钛合金相比,强度明显升高,塑性有少量下降,可见本发明提供的实施例中添加Cu、Sr元素的钛合金具有较好的力学性能,其中实施例3-7的抗拉强度达到1000MPa以上。
实施例11:
将实施例1-9和对比例1-3的钛合金进行耐蚀性能检测,即采用不锈钢点蚀电位测量方法(国家标准:GB/T 17899-1999),对本发明实施例1-9和对比例1-3的钛合金进行阳极极化曲线测试,测试结果见表2。
电化学腐蚀性能测试是证明材料耐微生物腐蚀能力的一种手段,特别是根据点蚀电位的变化,能够较好地说明材料耐生物腐蚀能力的高低。
从表2可以看出,本发明实施例所述钛合金的点蚀电位较现有Ti6Al4V钛合金有大幅度提高,特别是实施例3-7所述钛合金的点蚀电位显著提高。本发明所述合金的点蚀电位满足国家相应标准要求,即点蚀电位超过800mV,能够显著增强材料的耐微生物腐蚀能力,提高材料的抗腐蚀风险。
表2实施例和对比例钛合金的性能检测结果
实施例12:
将实施例1-9和对比例1-3的钛合金进行MTT(3-(4,5)-dimethylthiahiazo(-z-y1)-3,5-di-phenytetrazoliumromide,3-(4,5-二甲基噻唑-2)-2,5-二苯基四氮唑溴盐)生物安全性能检测,即根据国标GBT16886.5-2003医疗器械生物学评价,包括细胞相对增殖率(RGR)。
采用噻唑蓝MTT比色法测定细胞生存率,进而评价样品的生物安全性。MTT法是一种检测细胞存活和生长的方法,其检测原理为活细胞线粒体中的琥珀酸脱氢酶能使外源性MTT还原为水不溶性的蓝紫色结晶甲瓒(Formazan)并沉积在细胞中,而死细胞无此功能。
具体操作步骤为:将人成骨肉瘤细胞MG63的冻存管从液氮中取出, 37℃水浴中快速融化,离心弃上清,加入新鲜配制的含10%胎牛血清的DMEM(dulbecco's modified eagle medium,高糖培养基)高糖培养基中,反复吹打成细胞悬液后移入培养瓶中,置于37℃、饱和湿度、体积分数为5%的CO2恒温培养箱中静置培养,隔日换液。3-4天传代培养,在倒置相差显微镜下观察细胞形态。取生长旺盛的MG63细胞,2.5g/L胰蛋白酶消化后,用含10%胎牛血清的DMEM培养液制备成细胞密度约为6×104/mL的单细胞悬液,接种于9块96孔培养板,每板设A、B、C、D、E、F、G、H、I实验组及调零组,每组10孔,实验组每孔中均加入细胞悬液100μL,37℃、5%CO2条件下静置培养。待细胞贴壁生长后弃去原培养液,PBS反复冲洗,按实验分组加样。加样24小时、48小时、72小时、96小时、120小时后,每孔加入新鲜配制的5mg/mL的无菌MTT溶液,继续培养4小时终止培养。小心弃去原培养液,每孔加入150μL DMSO(Dimethyl sulfoxide,二甲基亚砜),室温下微量振荡器振荡培养板10分钟使结晶物充分溶解。用酶联免疫检测仪在490nm波长处测定各孔O.D.(optical density,光学密度)值。实验重复三次取各组平均值。计算RGR(relative growth rate,细胞相对增殖率),计算公式:RGR=(实验组O.D.值/培养基O.D.值)×100%,对各组结果进行评价,结果见表2。
从表2可以看出,本发明实施例所述钛合金的细胞相对增值率与普通钛合金Ti6Al4V相当,甚至实施例3-7所述钛合金的细胞相对增值率更高,均符合生物医用材料的细胞毒性要求,是生物安全的。
实施例13:
将实施例1-9和对比例1-3的钛合金进行Real time PCR测定VEGF(血管内皮细胞生长因子)mRNA表达水平,评价钛合金促进血管再生的能力。将处于对数生长期的血管内皮细胞(VECs)消化后均匀接种于6孔板中,培养4天和7天,按RNAisoPlus说明提取VECs总RNA,测总RNA浓度和纯度。按逆转录试剂盒说明书操作,在20μL逆转录反应体系中,以1μg总RNA为模板进行逆转录反应,合成cDNA。用RT-PCR仪以20μL反应体系进行PCR反应,以β-actin为内参。引物序列:VEGF:上游引物5′-GAGCCTTGCCTTGCTGC-TCTAC-3′,下游引物5′-CACCAGGGTCTCGA-TTGGATG-3′;β-actin:上游引物5′-TGGCAC-CCAGCACAATGAA-3′,下游引物5′-CTAAGT-CATAGTCCGCCTAGAAGCA-3′。PCR反应条件:预变性95℃ 30s,变性95℃ 5s,退火60℃ 15s,延伸72℃ 25s,共30个循环,熔解72~95℃。结果用2-ΔΔCt计算VEGF mRNA的相对表达量,每个实验组重复3次计算统计量。对各组结果进行评价,结果分别见图1。
经过4天的培养,与对比例钛合金相比,实施例钛合金表面表达更高的VEGF(p≤0.01),其中,实施例3-7的VEGF表达更高。与此同时,培养7天后,和对比例钛合金相比,实施例3-7也表达出更高的VEGF(p≤0.01)。结果表明,本发明提供的含Cu、Sr的医用钛合金可提高VEGF,有利于血管再生。
实施例14:
将实施例1-9和对比例1-3的钛合金进行碱性磷酸酶(ALP)活性测试,评价钛合金的促进成骨能力。取长势良好的3代细胞以2×104cell/孔的密度接种于实施例1-9和对比例1-3的钛合金表面,分别培养4天和7天,以1%TritonX-100裂解细胞,得到细胞裂解液。BCA蛋白检测试剂盒根据标准曲线检测裂解液中的蛋白总量,进而利用ALP试剂盒检测得到相应的ALP活性,490nm处检测吸光值。ALP是骨生成的早期标志,较高ALP活性有助于提高骨组织的矿化能力。图2显示了各钛合金表面培养4天和7天后成骨细胞的碱性磷酸酶活性。
经过4天的培养,与对比例钛合金相比,实施例钛合金表面具有更高的碱性磷酸酶活性(p≤0.01),其中,实施例3-7表现出更高的ALP活性。与此同时,培养7天后,和对比例钛合金相比,实施例3-7也表现出更好的ALP活性(p≤0.01)。结果表明,本发明提供的含铜、鍶的医用钛合金可提高碱性磷酸酶活性,有利于早期骨生成,进而提高矿化能力。
综上,通过以上实施例可知,当Cu、Sr含量在一定的范围内时,经过合适的热处理,可获得使新型钛合金合金具备优异的力学性能、耐蚀性能,以及促进成骨、血管再生功能和较好的生物安全性。
上述实施例只为说明本发明的技术构思及特点,其目的在于让熟悉此项技术的人士能够了解本发明的内容并据以实施,并不能以此限制本发明的保护范围。凡根据本发明精神实质所作的等效变化或修饰,都应涵盖在本发明的保护范围之内。
- 还没有人留言评论。精彩留言会获得点赞!