从低级含钛矿石生产高级合成金红石的制作方法
本发明总体涉及一种使用浓盐酸的两段式沥滤方法,其使各种各样的低质量钛铁矿石升级成优质钛精矿和铁氧化物产品。
背景技术:
高级合成金红石是一种极好的用于流化床氯化的进料,其也是一种用于制作颜料或海绵钛的良好原料。
金红石类型的精矿的逐渐枯竭已经促进研究新的从低级矿石生产改善的精矿的方法,该新方法可有利地被用作替代方案。目前由行业所研究的许多方法优先选择通过化学方法或物理方法去除铁,而将钛留在不需要的脉石材料中。QIT方法是该升级的一个例子。在这种方法中,40%的TiO2的钛铁矿石在高温反应后被升级至70%的TiO2矿渣。这些方法生产更为廉价的精矿,但是由于起始材料必须是包含40%-50%的TiO2的高级钛铁矿(ilmenite),因此这些方法是受限的。相应地,由于相对不含某些元素,因此所获得的产品容易在流化床中氯化。
已开发多个常规的湿法冶金方法,其涉及从钛铁矿中沥滤铁以获得富含钛(90%-95%的TiO2)的残留物,其被称作“合成金红石”。
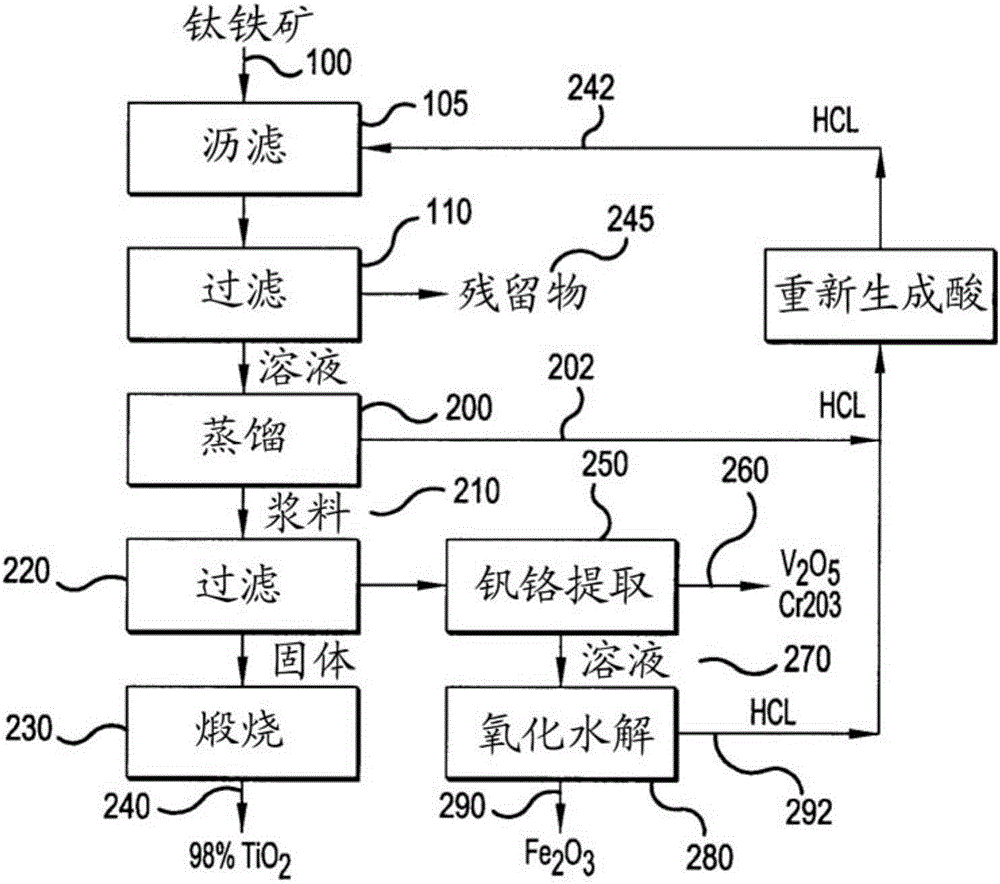
下面的框图示出了常规的用于从高级钛铁矿生产合成金红石的湿法冶金方法。
[框图1]
如在上图中所示,高级钛铁矿在高压釜中在120℃和200kPa下通过20%的HCl被分解,且铁溶解为氯化亚铁,留下包含大约93%的TiO2的固体,如在下面式1中所示。
式1:FeTiO3+2H+→TiO2[不纯的]+Fe2++H2O
合成金红石然后利用氯进行处理以制备TiCl4,从TiCl4获得TiO2或钛金属而没有污染问题。氯化亚铁溶液然后通过下面的式2通过氧化水解(oxydydrolysis)作用被重新生成HCl和Fe2O3:
式2:2FeCl2+2H2O+l/2O2→Fe2O3+HCl
如在表1中所示,介绍了对于该技术的修改。然而,这些常规的方法的缺陷在于它们不适于包含低于15%的TiO2的低级钛铁矿,这是由于存在残留在合成金红石内的硅酸盐脉石。相反,常规的方法仅仅适于包含30%-50%的TiO2的高级钛铁矿。合成金红石中的硅酸盐脉石的存在降低了其钛的品位。
表1-合成金红石的生产厂
已经尝试从钛铁矿直接地生产颜料。颜料被定义为一种粉状物质,其与液体混合,在该液体中该粉状物质是相对不溶的且尤其用于赋予涂料(如油漆)或油墨、塑料和橡胶颜色。TiO2颜料是涂料行业中最重要的白色颜料。由于其优异的性能的独特组合,包括高折射率、低比重、高的遮盖力和不透明性、和无毒性,它被广泛地使用。
例如,美国专利No.6,375,923、美国专利No.7,803,336和美国专利No.2,167,628描述了湿法冶金方法,其涉及在矿物酸(诸如盐酸或硫酸)中消解矿石以从矿石中提取包括二氧化钛的有价值的金属。各个前述提到的方法的另一值得注意的缺陷在于它们在TiO2回收之前需要沥滤溶液的净化步骤,通过将现有的三价铁还原为亚铁态,或者通过单独的溶剂提取步骤以回收更加纯的形式的钛。
技术实现要素:
因此,进行了本发明以解决上述问题中的一个或多个问题。本发明的目的在于提供一种从钛铁矿、尤其从低级矿石中生产高级合成金红石的方法,该低级矿石是广泛可获取的。在本发明中生产的高级合成金红石优选地包含95%-98%的TiO2,其中98%的TiO2是最优选的量。例如,本发明的目的在于从包含大约11%的TiO2的Magpie沉积物中生产高级合成金红石,Magpie沉积物在加拿大的魁北克省(Quebec)是大量可获取的。然而,可使用包含低于20%的TiO2的任何低级矿石。优选地,低级矿石包含10%-20%的TiO2,其中,20%的TiO2是最优选的量。然而,应理解到,本发明不限于包含11%的TiO2的Magpie沉积物,且可包含任何沉积物,包括在加拿大的Lac Lablache和Lac Brule(魁北克)、Pipestone Lake(曼尼托巴省)和其他地方的沉积物。此外,所述方法有利地可容易应用于更高级的含有钛的矿石和精矿。
本发明的另一目的在于提供一种提取方法,其具有适于许多铁钛矿石的优点,而与脉石矿物的百分含量无关,条件是这些脉石矿物不是碳酸盐或其他高酸消耗物。在本发明中使用的铁钛矿石可从沉积物中获得,该沉积物如Balia Balia(澳大利亚)、Panzhua(中国)、Abu Ghalaga(埃及)、Itaituba(巴西)、以及在俄罗斯新发现的许多其他的沉积物。
根据本发明的另一方面,用于回收高级合成金红石的方法涉及利用两种不同量的盐酸来沥滤磨碎的矿石,在此后,通过水解作用从滤液中析出溶解的钛。可溶的氯化铁又被水解或者被还原为金属和盐酸。然而,本发明不限于盐酸,且可包括其他卤化氢(在此,通过定义,卤化物指氟、氯、溴或碘)。
根据本发明的又一方面,在用于回收高级合成金红石的过程之后,未反应的盐酸被回收以及铁或铁氧化物被生成。
附图说明
结合附图,从下面的详细描述可以更加清晰地理解本发明的上述目的、特征和优点以及其他目的、特征和其他优点,其中:
图1示出具有两段式沥滤方法的工艺流程图。
图2示出具有一段式沥滤方法的工艺流程图。
具体实施方式
在下文中,将详细地描述本发明。
本发明提供了一种用于从低级矿物中回收高级合成金红石的两段式沥滤方法,其包括但不限于下面的步骤:
(a)通过在60℃-70℃的温度下,以在2和2.5之间的酸与矿石的比率使低级矿石(100)与35%-40%的盐酸(200)接触来执行第一沥滤反应(105)以获得浆料;
(b)从在步骤(a)中获得的浆料中过滤(110)滤饼(115);
(c)通过在75℃-80℃的温度下,以在2和2.5之间的酸与固体的比率使在步骤(b)中获得的固体(115)与现配的35%-40%的盐酸(200)接触来执行第二沥滤反应(120);和
(d)过滤(125)在步骤(c)中获得的产物以去除氧化铝和二氧化硅的残留物(130)。
通过使来自第一沥滤方法(105)的滤液(174)和来自第二沥滤方法(120)的滤液(176)混合、以及蒸馏出盐酸(194)和水,直到钛被水解(135)且大部分的氯化铁作为水合物沉淀(178)来进行回收游离的未反应的酸。过滤去除了残留的饱和液体(140)。
氯化物晶体用最小量的稀酸进行溶解(145),留下作为非常容易过滤的微细的粒状固体的不溶的TiO(OH)2。
在执行煅烧工艺后(150),产物包含98%的TiO2(155)、小于1.5%的Fe2O3、0.06%的CaO和0.02%的MgO、0.1%的SiO2和0.07%的Al2O3。因此,所获得的合成金红石组合物将是用于流化床氯化极好的进料,以及用于制造颜料或海绵钛的良好的原料。煅烧工艺为材料的热分解(参见Fathi Habashi,Textbook of Pyrometallurgy.Quebec City,加拿大:Metallurgie Extractive Quebec,2002)。在本发明中,煅烧工艺涉及钛氧基氢氧化物TiO(OH)2分解为二氧化钛(TiO2)和水蒸汽。
从两段式沥滤方法生产的高级合成金红石具有的钛氧化物的量在95%-98%TiO2的范围内。所生产的高级合成金红石优选地包含95%-98%的TiO2,其中大于98%的TiO2是最优选的。
在本发明中所生产的高级合成金红石可还包括通过使低级钛铁矿与稀盐酸接触以从中去除大量的磷内容物的预沥滤步骤。矿石(进料)中磷酸盐(P2O5)的初始量在0.12%-0.15%的范围内。在最终的TiO2产物中磷酸盐的量在1.8%-2.1%的范围内。在产物中优选的磷酸盐含量低于0.05%。进行预沥滤步骤导致产物中的P2O5含量低于0.05%。
低级钛铁矿石沉积物是不受限制的。低级矿石沉积物可包括任意量的TiO2。考虑具有低于20%的TiO2的任意矿石为低级钛铁矿,具有范围10%-12%的TiO2的低级钛铁矿是优选的,且具有大于12%的TiO2的低级钛铁矿是最优选的。另外,沉积物可从任何发现低级矿石的地方获得,因此,本发明对沉积物没有限制。
在本发明的方法中,可使用二氧化钛沉淀器。二氧化钛沉淀器包含加热器,加热器用于使沥滤溶液沸腾,以经由盐酸出口以及收集和排放沉淀的二氧化钛浆料的部件释放游离的氯化氢。
在本发明的方法中,不含TiO2的滤液(180)可进一步被处理以回收钒和铬(184)。钒和铬的回收(184)涉及溶剂提取或选择性沉淀。
在本发明的方法中,不含钛、钒和铬的氯化物溶液可被送到喷淋式反应器,在该喷淋式反应器中,在轻微氧化气氛下的高温水解作用(188)产生铁氧化物(190)和盐酸(196)。
另外,如在图2中所示,本发明提供了一种用于从低级矿石(100)回收高级合成金红石的一段式沥滤方法(105),其包括但不限于下面的步骤:
使低级矿石(100)与37%的盐酸(242)以固定的酸与矿石的比率6.1进行接触,以生成高的残留酸浓度以防止钛的水解。
在该一段式沥滤方法(105)中,在75℃下的搅拌槽可在环境压力下与37%的浓盐酸(242)一起使用,该浓盐酸具有6.1的酸与矿石的比率。这些条件使全部的铁和钛溶解。在过滤(110)以去除硅酸盐脉石矿物之后,将溶液进行蒸馏(200)以排出过量的盐酸(202)。
在一段式沥滤方法(105)期间,钛氧基-氢氧化物和TiO(OH)2沉淀但是铁不沉淀。在通过第二过滤步骤(220)固体-液体分离后,钒和铬可通过有机溶剂进行提取(250),然后氯化亚铁溶液(270)进行氧化水解作用(280)以回收Fe2O3(290)和盐酸(292)。
此后,煅烧(230)钛氧基氢氧化物导致以98.2%回收的包含大约98%的TiO2的产物(240)。
因此,尽管已经详细描述了本发明的各种实施方式,但是应该理解到通过上文段落定义的本发明并不局限于在上文描述中提出的具体的细节,在不偏离本发明的精神或范围的情况下,其许多明显的变型是可能的。
在下文中,通过使用制造实施例和实施方式详细描述了本发明。下文提到的详细的描述仅仅示例性的,以帮助理解本发明。然而,本发明不限于此。
[实施例1]来自加拿大的魁北克省的Magpie沉积物的低级矿石(包含11%的TiO2)的溶解以及去除不溶的物质。
第一阶段:
a.低级矿石被细磨至200目,其中优选50%的范围以及更优选80%的范围的低级矿石分别通过-200目。
b.通过利用在2到2.5之间的矿石与酸的比率,使低级矿石与35%-40%范围浓度的盐酸接触进行第一沥滤反应。由于矿浆浓度和细的粒度测定,只需要轻微的搅拌以防止沉降。该第一沥滤反应在大约一个小时内溶解磁铁矿。温度保持在60℃-70℃。
c.目前仅包含2%-4%的HCl的母液优选地被现配的浓酸所替代以溶解钛铁矿和在矿石中存在的钛以获得浆料。然后过滤浆料,在不冲洗的情况下将固体传送至第二沥滤反应。
d.通过分别以2至2.5的比率将现配的酸添加至滤饼中进行第二沥滤反应,该酸具有在35%-40%范围内的浓度。该反应持续又一小时,且温度保持在75℃-80℃。通过第二过滤过程去除残留物,然后冲洗。
由于其多孔结构,冲洗不能够清除全部的闭塞溶液。因此,任选的步骤是在高温下干燥该废弃物以去除全部的酸。在干燥之前,游离的HCl的量的损失为约0.1吨/1吨沥滤的矿石。由于溶液不能够被去除,因此不可回收的损失的量为全部铁的1.4%-1.6%以及全部TiO2的4%-4.5%。如果考虑不可溶的铁和钛,则总的回收为铁大约95%且钛大约90%。
随后的步骤沥滤-过滤-沥滤增强了钛铁矿的溶解。铁氧化物矿物比钛矿物更为快速地响应于HCl沥滤。在这些条件下,来自第一沥滤的溶液包含更多的铁以及只有少量的钛。在所述方法的该阶段时,全部铁的70%和钛氧化物的30%在第一阶段后被沥滤到溶液中。少量的钛归因于在当盐酸浓度高时在沥滤开始时的钛矿物的溶解,但是当酸浓度下降时,钛矿物的溶解减缓,且可进行水解。
在第一沥滤期间控制温度具有双重目的:(1)它降低了钛的溶解;和(2)它降低了被溶解的少量钛的水解作用。
在第二沥滤反应中现配的酸的添加允许溶解剩余的铁矿物和钛矿物。该酸浓度并不与在第一沥滤反应中一样明显地下降,由此即使在约60℃下仍将钛保持在溶液中。
[实施例2]通过蒸馏未反应的酸来沉淀TiO(OH)2。
第二阶段:
在实施例1讨论的两个沥滤反应消耗了超过一半的可用酸。游离的未反应的酸的回收通过将两种过滤后的溶液混合,然后蒸馏出盐酸和水,直到钛水解且大部分的氯化钛作为水合物沉降来执行,该两种过滤后的溶液来自在实施例1中讨论的第一沥滤反应和第二沥滤反应。大约90%的氯化钛作为水合物沉淀。另一过滤步骤去除残留的饱和液体。
氯化物晶体利用最少量的稀酸进行溶解,留下微细的粒状固体形式的不溶性TiO(OH)2,其容易过滤。在煅烧工艺之后,高级合成金红石包含TiO2的量在95%-98%的TiO2的范围内,这满足了合成金红石精矿的要求。
[实施例3]回收结合的盐酸以及生产铁或铁氧化物。
第三阶段:
存在数种可能的方式以回收铁和结合的盐酸,这些方式包括:
1.利用铁还原氯化铁且溶液部分蒸发以使水合的氯化亚铁结晶,其可然后通过氢被还原成金属以生产铁粉。
2.在高温、氢气氛下,将氯化物溶液送入喷淋式反应器中。生产铁粉,以及同时重新生成盐酸和蒸发水。所生产的铁包含0.4%的TiO2和1%-3.5%的Cr2O3。
3.将氯化物溶液送入喷淋式反应器中,在该喷淋式反应器中,在轻微氧化气氛下的高温水解作用生成铁氧化物和盐酸。
尽管出于说明的目的已经公开了本发明的优选的实施方式,但是本领域技术人员应理解到,在不偏离如在所附权利要求所公开的本发明的精神和范围的情况下,可进行各种修改、添加和替换。
- 还没有人留言评论。精彩留言会获得点赞!