含铜CHA型沸石、其制造方法和用途与流程
本发明涉及脱硝领域,更具体地,涉及一种含铜cha型沸石及其制备方法和用途。
背景技术:
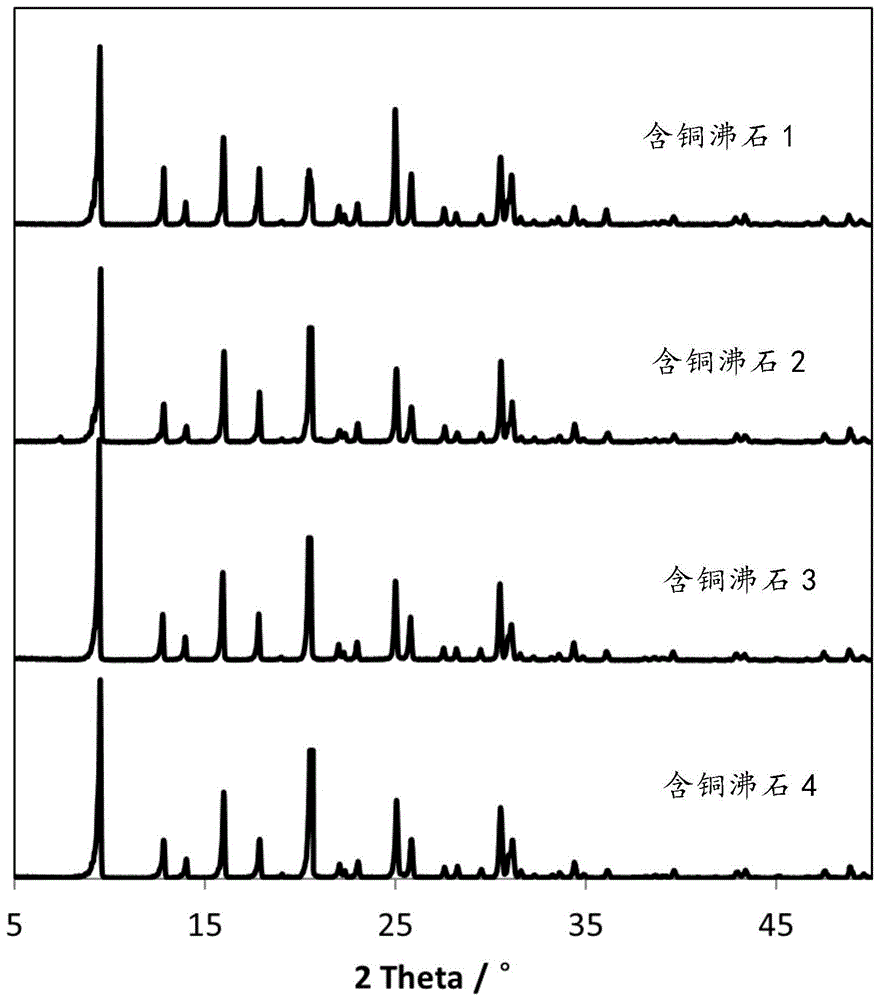
:氮氧化合物(nox)具有强刺激性与腐蚀性,对人体健康十分有害。大气中的氮氧化合物还容易与其他有害化合物相互作用,生成硫酸盐、硝酸盐等有害物。因而氮氧化合物作为一种环境有害气体,和氧化硫、氨气以及挥发性有机物并列为四大空气污染物。目前对于含有氮氧化合物的工业废气以及内燃机废气,主要采用尿素或者氨作为还原剂,对氮氧化合物进行选择性催化还原(scr),生成无害的氮气。专利文献us7601662b2和jp2013095653提出了一种硅/铝摩尔比为7.5以上的含铜cha型沸石作为scr催化剂,这种催化剂具有十分优异的低温催化活性,尤其是在200℃以下的温度区间内,其催化转化nox的效率是常规钒钨钛氧化物催化剂的2倍以上。然而,这种含铜cha型沸石面临着制造成本高、抗硫性能差、水热稳定性差等技术问题。另外,作为具有较高的低温催化活性的催化剂,这种含铜cha型沸石的催化氧化能力较强,转而导致在高温区间内催化氧化作为scr还原剂的氨,从而在高温区间、尤其是500℃以上的温度区间内,脱硝性能急剧下降。专利文献wo2010054034a2和cn102215960b报道了硅/铝摩尔比为7.5以下的cha型沸石,但是这种cha型沸石同样高温水热稳定性较低,不能满足移动源尾气脱硝催化剂的要求。本发明的发明人经过大量的研究,提出了一种新型含铜cha型沸石,该含铜沸石在200℃以下的低温区以及500℃以上的高温区内都具有良好的scr脱硝性能,从而解决了本领域已存的一些技术问题。技术实现要素:在本发明的第一方面,提供了一种含铜cha型沸石,其骨架原子还包括硅和铝,其中,硅与铝的摩尔比为大于等于5且小于7.5,并且铜与铝的摩尔比为大于等于0.2且小于等于0.5。在一个实施方案中,所述含铜cha型沸石的晶粒小于等于1μm,优选小于等于0.8μm,更优选小于等于0.6μm。在又一个实施方案中,所述含铜cha型沸石的晶粒大于等于50nm,优选大于等于100nm。在另一个实施方案中,所述含铜cha型沸石的bet比表面积为550m2/g以上,优选600m2/g以上。在又一个实施方案中,所述含铜cha型沸石还包含选自钛、锆、钒、铬、锰、铁、钴、锌、镓、锗、砷、锡和硼中的一种或多种其他元素,并且所述其他元素的摩尔数占所述沸石中的非氧元素的总摩尔数的40%以下,优选30%以下、更优选20%以下。在进一步的实施方案中,所述含铜cha型沸石还包含选自碱金属、碱土金属、稀土金属和过渡金属中的一种或多种阳离子。在本发明的第二方面,提供了一种制备上述含铜cha型沸石的方法,所述方法包括:(a)将铜源溶解在磷酸溶液中,以获得含铜凝胶;(b)向由硅源、铝源、无机碱、有机模板剂与水构成的混合物中,加入步骤(a)得到的所述含铜凝胶,以获得初凝胶;(c)使所述初凝胶经历水热合成反应,并经固液分离得到反应产物;(d)去除步骤(c)得到的反应产物的有机模板剂,得到含铜含碱金属的沸石;(e)用铜离子置换步骤(d)得到的含铜含碱金属沸石中的碱金属离子,经干燥和焙烧获得含铜cha型沸石。在一个实施方案中,在步骤(a)中,所述含铜凝胶中的磷与铜的摩尔比为1~5。在另一个实施方案中,在步骤(a)中,所述含铜凝胶中的磷与铜的摩尔比为1.5~4。在又一个实施方案中,在步骤(a)中,所述含铜凝胶中的磷与铜的摩尔比为2~3。在一个实施方案中,在步骤(b)中,硅源、铝源、无机碱、有机模板剂、水、铜、磷的摩尔比为1sio2:0.067~0.1al2o3:0.05~0.6oh-:0.02~0.4模板剂:15~80水:0.01~0.1cu:0.01~0.5p。在另一个实施方案中,在步骤(b)中,所述硅源选自气相二氧化硅、二氧化硅溶胶、胶体二氧化硅、水玻璃、硅酸乙酯以及硅酸甲酯中的一种或多种。在又一个实施方案中,在步骤(b)中,所述硅源选自气相二氧化硅、二氧化硅溶胶以及胶体二氧化硅中一种或多种。在一个实施方案中,在步骤(b)中,所述铝源选自拟薄水铝石、异丙醇铝、烷醇铝、氢氧化铝、氧化铝溶胶以及铝酸钠中的一种或多种。在另一个实施方案中,在步骤(b)中,所述铝源选自拟薄水铝石、氢氧化铝以及铝酸钠中的一种或多种。在一个实施方案中,在步骤(b)中,所述有机模板剂为容易形成cha沸石结构的含氮有机化合物和/或可以与铜元素生成络合物的含氮有机化合物。在另一个实施方案中,在步骤(b)中,所述有机模板剂为季铵盐。在又一个实施方案中,在步骤(b)中,所述有机模板剂选自n,n,n-三甲基金刚烷铵、苄基三甲基铵、铜-四乙烯五胺络合物、四乙基氢氧化铵以及四丙基氢氧化铵中的一种或多种。在一个实施方案中,在步骤(b)中,所述无机碱为一价碱金属无机碱或其组合。在另一个实施方案中,在步骤(b)中,所述无机碱选自氢氧化锂、氢氧化钠或氢氧化钾中的一种或几种。在一个实施方案中,在步骤(c)中,水热合成反应的反应温度为100~200℃,合成时间为12~96小时。在另一个实施方案中,在步骤(c)中,水热合成反应的反应温度为120~180℃,合成时间为18~72小时。在又一个实施方案中,在步骤(c)中,水热合成反应的反应温度为150~180℃,合成时间为24~48小时。在一个实施方案中,在步骤(d)中,通过干燥和焙烧所述步骤(c)得到的反应产物来去除有机模板剂。在另一个实施方案中,在步骤(d)中,干燥温度为40~120℃并且干燥时间为12~48小时,焙烧温度为300~800℃并且焙烧时间为0.5~24小时。在又一个实施方案中,在步骤(d)中,干燥温度为80~100℃并且干燥时间为18~36小时,焙烧温度为400~700℃并且焙烧时间为1~12小时。在一个实施方案中,在步骤(e)中,通过离子交换法直接将所述含铜含碱金属沸石中的碱金属离子置换为铜离子。在另一个实施方案中,在步骤(e)中,通过离子交换法首先将所述含铜含碱金属沸石中的碱金属离子置换为铜以外的离子,再通过离子交换法将所述铜以外的离子置换为铜离子。在又一个实施方案中,在步骤(e)中,通过离子交换法首先将所述含铜含碱金属沸石中的碱金属离子置换为铵离子,再通过离子交换法将铵离子置换为铜离子。在另一个实施方案中,在步骤(e)中,所述离子交换法在0~100℃的温度下进行0.5~96小时,随后将经离子交换的产物分离,并在40~120℃干燥12~36小时、在300~800℃焙烧1~5小时,获得含铜cha型沸石。在本发明的第三方面,提供了一种氮氧化物净化用催化器,其中,所述催化器中设置有含有本文所述的含铜cha型沸石或者根据本文所述的方法制备得到的含铜cha型沸石的脱硝催化剂。在本发明的第四方面,提供了一种氮氧化物净化用系统,其中,所述系统中设置有本文所述的氮氧化物净化用催化器。在本发明的第五方面,提供了本文所述的含铜cha型沸石在净化氮氧化物方面的用途。本发明的一个实施方案提供了含铜cha型沸石在氮氧化物净化用催化器中用作脱硝催化剂的用途。本发明的发明人发现cha型沸石的骨架所含的硅/铝摩尔比对scr脱硝性能的影响较大,既决定了沸石的固体酸量,也决定了通过离子交换位点的数量,而后者直接影响沸石所能负载的高分散状态的铜物种的数量。本发明公开的含铜cha型沸石在低温区和高温区均具有良好的催化活性,这是因为本发明的沸石由于进一步限定了铜/铝摩尔比,因而既含有足够的高分散状态的铜物种的数量,也含有足够的布朗斯特酸点。附图说明本文提供了附图,以使本领域技术人员更好地理解本文所例示的实施方式,但是这些附图不旨在限定本发明的范围。图1为根据本发明的实施方案的含铜沸石1、2、3、4的xrd图;图2为根据本发明的一个实施方案的含铜沸石1的sem图;图3为根据本发明的一个实施方案的含铜沸石2的sem图;图4为根据本发明的一个实施方案的含铜沸石3的sem图;图5为根据本发明的一个实施方案的含铜沸石4的sem图。具体实施方式在下文中,将通过具体实施方案来进一步阐述本发明的内容。然而,所列举的具体实施方案仅出于例示目的,而并不旨在限制本发明的范围。本领域技术人员会认识到,以下任一实施方案中所给出的具体技术特征可以用于其他实施方案,只要其不背离本发明的主旨即可。含铜cha型沸石本发明的沸石是指国际沸石协会(internationalzeoliteassociation)(以下简称iza)规定的沸石。沸石通常为由骨架原子四面体(如sio4四面体、alo4四面体或者po4四面体)的各个顶点的氧原子通过共用联结而成的规则网目状结构,并且通常将氧元素之外的元素原子称为非氧原子或t原子。网目状结构的基本单元之一是n个to4四面体连接而成的环状,将其称作n元环(n一般为3以上的正整数,如3元环,6元环、8元环等)。在本发明的一个实施方式中,所述含铜cha型沸石为iza所规定的cha型沸石,这种沸石的结构可以通过x射线衍射法(xrd)确定。在本发明中,含铜cha型沸石是指至少含有氧、铝、硅作为构成骨架结构的原子的沸石,并且骨架原子中的一部分可以被一种或多种前述3种元素以外的元素所取代,其中,铜在沸石中存在的位置及其具体的化学价态不受特别的限定,即,铜可以存在于沸石的骨架处,也可以存在于沸石的骨架之外。从催化活性的角度来看,铜优选存在于骨架之外且呈离子价态。在一个实施方案中,含铜cha型沸石的骨架原子包括硅和铝,其中,硅与铝的摩尔比为大于等于5且小于7.5,例如大于5且小于7.5,并且铜与铝的摩尔比为大于等于0.2且小于等于0.5,例如大于0.2且小于0.5。经研究,发现具有上述特征的含铜cha型沸石在低温以及高温区均具有优良的脱硝催化活性。虽然不希望受到任何理论的约束,但据信,本发明所述的含铜cha型沸石在低温和高温区均具有优良的催化活性,可以归因于沸石中铜元素、硅元素、铝元素的合适的摩尔比例,以及特定的沸石构型。一般认为,硅铝酸盐沸石中骨架铝的存在导致沸石中布朗斯特酸性位点以及离子交换位点的形成,其含量决定了沸石的酸量与可以通过离子交换形式导入骨架外离子的数量。硅与铝的摩尔比在5至7.5的范围,可以保证含铜cha型沸石可以引入足够的铜离子,同时保留一定的固体酸性。在这种cha型沸石中,铜离子的比例还决定了此种沸石的低温催化脱硝性能,而保留一定的固体酸性可以使得此种沸石在高温区间内仍能保留吸附氨气的能力,从而在高温区间也具有良好的催化脱硝性能。然而,硅与铝的摩尔比在5以下,或者铜与铝的摩尔比在0.5以上,会导致催化剂骨架铝太多且含铜量过高,进而导致含铜cha型沸石的高温水热稳定性降低,不利于实际使用。在一个实施方案中,所述含铜cha型沸石的晶粒小于等于1μm。在另一个实施方案中,所述含铜cha型沸石的晶粒小于等于0.6μm。在又一个实施方案中,所述含铜cha型沸石的晶粒小于等于0.5μm。对于本发明的cha型沸石而言,晶粒的大小可以影响沸石脱硝性能,较小的晶粒可以大幅降低反应物的扩散路径,提高沸石的催化效率。发明人发现,对于本发明的含铜cha型沸石而言,通常50nm以上且1μm以下的晶粒可以保证反应气体在沸石内部的良好扩散性能,进而和沸石中的催化活性位点充分接触。因此,在一个实施方案中,所述含铜cha型沸石的晶粒大于等于50nm。在另一个实施方案中,所述含铜cha型沸石的晶粒大于等于100nm。在一个实施方案中,所述含铜cha型沸石的bet比表面积为550m2/g以上。在另一个实施方案中,所述含铜cha型沸石的bet比表面积为600m2/g以上。在一个实施方案中,所述含铜cha型沸石还包含选自钛、锆、钒、铬、锰、铁、钴、锌、镓、锗、砷、锡和硼中的一种或多种其他元素。在另一个实施方案中,这些其他元素的摩尔数占所述沸石中的非氧元素的总摩尔数的40%以下,优选30%以下、更优选20%以下。在一个实施方案中,所述含铜cha型沸石还包含选自碱金属、碱土金属、稀土金属和过渡金属中的一种或多种阳离子。本发明所述的含铜cha型沸石可以有效地解决现有技术中存在的含铜沸石温度窗口较窄的问题,不仅在200℃以下的低温区间催化活性高,在500℃以上的高温区间也具有优异的催化性能,从而能够有效地用于氮氧化物的催化净化,尤其是氮氧化物的选择性催化还原。含铜cha型沸石的制备本发明的含铜cha型沸石可以采用水热合成法制备,其中通过将原料与水配制成初凝胶(下文中有时也称水性凝胶),然后置入反应容器内进行水热合成反应,从而合成目标沸石。在一个实施方案中,制备含铜cha型沸石的方法包括:(a)将铜源溶解在磷酸溶液中,以获得含铜凝胶;(b)向由硅源、铝源、无机碱、有机模板剂与水构成的混合物中,加入步骤(a)得到的所述含铜凝胶,以获得初凝胶;(c)使所述初凝胶经历水热合成反应,并经固液分离得到反应产物;(d)去除步骤(c)得到的反应产物的有机模板剂,得到含铜含碱金属的沸石;(e)用铜离子置换步骤(d)得到的含铜含碱金属沸石中的碱金属离子,经干燥和焙烧获得所述含铜cha型沸石。在一个实施方案中,在步骤(a)中,所述含铜凝胶中的磷与铜的摩尔比为1~5。在另一个实施方案中,在步骤(a)中,所述含铜凝胶中的磷与铜的摩尔比为1.5~4。在又一个实施方案中,在步骤(a)中,所述含铜凝胶中的磷与铜的摩尔比为2~3。本发明的铜源不受特别的限定,可以使本领域常用的铜源。可以使用铜盐,例如铜的硝酸盐、硫酸盐、醋酸盐、盐酸盐等,也可以使用铜氧化物,例如氧化铜等。在步骤(a)中,可以通过加热等方式使得铜源更充分地溶解于磷酸溶液中。在一个实施方案中,在步骤(b)中,硅源、铝源、无机碱、有机模板剂、水、铜、磷的摩尔比为1sio2:0.067~0.1al2o3:0.05~0.6oh-:0.02~0.4模板剂:15~80水:0.01~0.1cu:0.01~0.5p,但不限于此。通过水热反应得到的沸石的元素组成与初凝胶中的组成相关,因此可以调节水性凝胶的组成,得到具有期望组成的沸石。本发明的硅源不受特别的限定,可以使本领域常用的硅源。在一个实施方案中,所述硅源可以选自气相二氧化硅、二氧化硅溶胶、胶体二氧化硅、水玻璃、硅酸乙酯以及硅酸甲酯中的一种或多种。在又一个实施方案中,所述硅源可以选自气相二氧化硅、二氧化硅溶胶以及胶体二氧化硅中一种或多种。本发明的铝源不受特别的限定,可以使本领域常用的铝源。在一个实施方案中,所述铝源可以选自拟薄水铝石、异丙醇铝、烷醇铝(例如三乙醇铝)、氢氧化铝、氧化铝溶胶以及铝酸钠中的一种或多种。在另一个实施方案中,所述铝源可以选自拟薄水铝石、氢氧化铝以及铝酸钠中的一种或多种。一般而言,合成的沸石结构与选用的模板剂有关。在一个实施方案中,模板剂可以是有机物模板剂,例如容易形成cha结构的有机模板剂,由此可以使得制备的沸石具有cha结构。在一个实施方案中,在步骤(b)中,所述有机模板剂为容易形成cha沸石结构的含氮有机化合物和/或可以与铜元素生成络合物的含氮有机化合物。在另一个实施方案中,在步骤(b)中,所述有机模板剂为季铵盐。在另一个实施方案中,在步骤(b)中,所述有机模板剂选自n,n,n-三甲基金刚烷铵、苄基三甲基铵、铜-四乙烯五胺络合物中的一种或多种。本发明的有机模板剂也可以是其他类型的季铵盐,例如四甲基氢氧化铵、四乙基氢氧化铵、四丙基氢氧化铵、二甲基二乙基氢氧化铵、甲基三乙基氢氧化铵、三甲基乙基氢氧化铵等,优选为四乙基氢氧化铵和/或四丙基氢氧化铵。本发明的无机碱不受特别的限定,可以使本领域常用的无机碱。在一个实施方案中,在步骤(b)中,所述无机碱为一价碱金属无机碱或其组合。在另一个实施方案中,在步骤(b)中,所述无机碱选自氢氧化锂、氢氧化钠或氢氧化钾中的一种或几种。在步骤(b)中,各种原料与水的混合顺序并无限特别制,本领域技术人员可以根据使用的条件进行适当选择,例如可以首先将水与无机碱、铝源,硅源和有机模板剂混合,再与含铜凝胶混合,也可以在与模板剂混合前,将水先与含铜凝胶等混合。在一个实施方式中,所使用的硅源、铝源、无机碱、铜源、磷源、模板剂、水的摩尔比可以为1sio2:0.067~0.1al2o3:0.05~0.6aoh:0.01~0.1cu:0.005~0.25p2o5:0.02~0.4r:15~80h2o(一价碱金属离子用“a”表示;模板剂用“r”表示),优选为1sio2:0.07~0.09al2o3:0.05~0.4aoh:0.02~0.05cu:0.02~0.15p2o5:0.05~0.2r:40~60h2o;当沸石意欲包含其他骨架元素时,硅源与其他骨架元素的摩尔比可以为1:0.01~0.4,优选为1:0.03~0.3。在本发明中,用于计算摩尔比的上述硅源、铝源、铜源和磷源的摩尔用量分别是指原料中硅元素、铝元素、铜元素和磷元素折算为氧化物的摩尔量。在一个实施方案中,在步骤(c)中,水热合成反应的反应温度为100~200℃,合成时间为12~96小时。在另一个实施方案中,在步骤(c)中,水热合成反应的反应温度为120~180℃,合成时间为18~72小时。在又一个实施方案中,在步骤(c)中,水热合成反应的反应温度为150~180℃,合成时间为24~48小时。在步骤(c)中,反应温度和合成时间的组合可以根据本领域技术人员的知识常规选择,只要能够使产物完全结晶即可。在上述水热合成反应过程中,过长的保温时间亦无必要,相反还会增加时间成本,而较低的保温温度同样会要求相对较长的保温时间。本发明的发明人经过试验获得,上述范围内的反应温度和合成时间既可以保证最终获得的cha型沸石的结构,也可以节省生产成本。另外,反应容器内的升温速率为10~40℃/小时,例如15、20或30℃/小时,优选的升温速率为15~20℃/小时,升温速率过快容易导致密封的反应容器内温度不均匀,进而导致原料反应不均;升温速率过低,增加时间成本。在一个实施方案中,在步骤(c)中,对所获得的产物进行固液分离,分离方法不受特别的限定,例如可以通过过滤、离心、静置分层等方法进行分离。所得的固体还可以经水洗后,再次分离。在一个实施方案中,在步骤(d)中,通过干燥和焙烧所述步骤(c)得到的反应产物来去除有机模板剂。在另一个实施方案中,在步骤(d)中,干燥温度为40~120℃并且干燥时间为12~48小时,焙烧温度为300~800℃并且焙烧时间为0.5~24小时。在又一个实施方案中,在步骤(d)中,干燥温度为80~100℃并且干燥时间为18~36小时,焙烧温度为400~700℃并且焙烧时间为1~12小时。包含有机模板剂的沸石通常可以通过在含有少量空气或氧的惰性气体气氛下、或者在惰性气体气氛下进行焙烧,从而去除有机模板剂。当然,也可以使用乙醇水溶液、含hcl的醚等的萃取溶剂进行萃取,从而去除有机模板剂。在本发明中,优选通过焙烧除去沸石中的有机模板剂。本发明中的焙烧设备无特别限定,可以采用马弗炉、隧道窑或回转窑等常见的工业窑炉。从连续生产的便利性来考虑,优选使用回转窑。对此,上文所指的焙烧温度均是窑炉内的温度。在一个实施方案中,在步骤(e)中,通过离子交换法直接将所述含铜含碱金属沸石中的碱金属离子置换为铜离子。在另一个实施方案中,在步骤(e)中,通过离子交换法首先将所述含铜含碱金属沸石中的碱金属离子置换为铜以外的离子,再通过离子交换法将所述铜以外的离子置换为铜离子。在又一个实施方案中,在步骤(e)中,通过离子交换法首先将所述含铜含碱金属沸石中的碱金属离子置换为铵离子,再通过离子交换法将铵离子置换为铜离子。对此,可以将所述含铜含碱金属沸石分散在无机铵盐溶液或酸性溶液中,在0~100℃的温度下离子交换0.5~96小时。此后,可以对产物进行分离,分离方法不受特别的限定,例如可以通过过滤、离心、静置分层等方法进行分离,所得的沸石即为本发明的含铜cha型沸石。在一个优选的实施方案中,可以将经离子交换的产物分离,并在40~120℃干燥12~36小时、在300~800℃焙烧1~5小时,获得含铜cha型沸石。在另一个优选的实施方案中,可以将经离子交换的产物分离,并在80~100℃干燥18~24小时、在400~600℃焙烧2~4小时,获得含铜cha型沸石。在又一个优选的实施方案中,可以将经离子交换的产物分离,并在80~100℃干燥18~24小时、在500℃焙烧2~3小时,获得含铜cha型沸石。在进一步的实施方案中,可以将步骤(e)得到的含铜cha型沸石和含铜离子的材料再接触,通过固体或者液体离子交换的方法,得到具有更高铜含量的含铜cha型沸石。在这样的实施方案中,本发明的方法包括步骤(f):将步骤(e)得到的含铜cha型沸石与含铜溶液混合并进行离子交换,随后固液分离、干燥并烧结,得到含铜cha型沸石。在一个这样的实施方案中,所述含铜溶液是铜盐溶液,例如硝酸铜、硫酸铜、醋酸铜、盐酸铜的溶液。在另一个这样的实施方案中,在步骤(f)中,干燥温度为40~120℃并且干燥时间为12~48小时,焙烧温度为300~800℃并且焙烧时间为0.5~5小时。在又一个实施方案中,在步骤(f)中,干燥温度为80~100℃并且干燥时间为18~36小时,焙烧温度为400~700℃并且焙烧时间为1~3小时。对此,去除含铜cha型沸石中的碱金属离子有利于通过离子交换的方法,进一步提高铜含量,有利于提高含cha型铜沸石的高温水热稳定性。含铜cha型沸石的用途本发明的含铜cha型沸石可以直接以粉末状使用,也可以与胶粘剂混合,制成含有沸石的混合物后使用。所用的胶粘剂通常可以为二氧化硅、氧化铝、氧化锆等无机胶粘剂或者聚硅氧烷类有机胶粘剂。胶粘剂的用量不受特别的限定,以最终制成的混合物计,通常可以为1~20重量%,从成形强度方面考虑,优选2~15重量%。本发明的含铜cha型沸石或者含该沸石的混合物也可造粒或成形后使用。造粒或成形的方法不受特别的限定,可以采用各种公知的方法进行。通常,使本发明的含铜cha型沸石混合物成形,作为成形体使用,成形体的形状可以为多种。例如,当本发明的含铜cha型沸石用作汽车等运输工具的废气中的氮氧化物净化用催化剂时,应用该沸石的方法可以是涂敷法或成形法,以将沸石成形为蜂窝状催化剂。涂敷法通常将沸石与二氧化硅、氧化铝或氧化锆等无机胶粘剂混合,制作成浆,再将其涂敷在由堇青石等无机物制作的蜂窝状物的表面,随后干燥、烧制而成。成形法通常将沸石与二氧化硅、氧化铝等无机胶粘剂或氧化铝纤维、玻璃纤维等无机纤维混炼,通过挤出法或压缩法成形为蜂窝状,并进而干燥、烧制而成。本发明的含铜cha型沸石作为催化剂时,沸石通过与含有氮氧化物的废气接触来净化氮氧化物。可用本发明的含铜cha型沸石净化的氮氧化物包括一氧化氮、二氧化氮、一氧化二氮等。在本发明中,净化氮氧化物是指使氮氧化物在催化剂上反应,转化成氮气和氧气等。对此,氮氧化物可以直接反应,也可以出于提高净化效率的目的,本发明的含铜cha型沸石与还原剂共同使用。同时使用还原剂时,能使氮氧化合物的净化反应更容易进行,还原剂可以使用氨、尿素、有机胺类、一氧化碳、烃、氢等,优选使用氨、尿素。采用本发明的含铜cha型沸石作为催化剂时,可以净化从柴油汽车、汽油汽车、固定式发电船舶、农业机械、建设机械、摩托车、航空器用的各种汽柴油发动机、锅炉、燃气轮机等中排出的各种废气所含的氮氧化物。实施例在下文,通过具体的实施例对本发明进行更进一步的说明,但本发明并不仅限于以下实施例。在以下实施例中,所用的化学试剂如未特别说明,均为化学纯。x射线衍射(xrd)测定x射线衍射测定仪器为日本理学制造的x射线粉末衍射仪测定装置(ulitmaiv)。组分分析方法通过电感耦合等离子光谱测定沸石中各组分的含量。电感耦合等离子光谱(icp)测定采用perkinelmeroptima8x00,其中将标准样品稀释后,获得浓度梯度吸收曲线。具体地,将样品用氢氟酸溶解后加水稀释,然后通过吸收峰强测定样品中各个元素的浓度。比表面积测定测试的仪器:贝士德仪器科技(北京)有限公司制造的高性能比表面及微孔径分析仪(3h-2000)进行测定。催化剂活性的评价方法将制备的沸石冲压成型后,弄碎,整粒。将整粒过的沸石(1ml)填充到常压固定床流通式反应管内。以1500ml/min(空间速度sv=100000/小时),使含表1所示的组成的气体在催化剂层上流通,同时对催化剂层进行加热。分别在不同的温度下,根据出口no浓度,由下式的值来评价催化剂的氮氧化物除去活性。(no净化率)={(入口no浓度)-(出口no浓度)}/(入口no浓度)[表1]气体组分浓度no500ppmnh3500ppmo214vol%h2o5vol%n2剩余组分含铜凝胶1的制备在690g水中加入690g磷酸(浓度85重量%),然后加入240g氧化铜,在80℃下反应2小时,得到含铜凝胶1。含铜凝胶2的制备在690g水中加入1035g磷酸(浓度85重量%),然后加入240g氧化铜,在80℃下反应2小时,得到含铜凝胶2。实施例1向450g水中加入13g氢氧化钠,搅拌溶解,加入135g的25%的n,n,n-三甲基金刚烷铵(tmada)水溶液,混合均匀后,加入10g氢氧化铝,然后再加入120g的40重量%的二氧化硅溶胶(硅溶胶),搅拌反应4小时后,加入26g含铜凝胶1,继续搅拌2小时,充分反应后得到具有以下组成的初凝胶混合物:1sio2:0.07al2o3:0.2na2o:0.06cu:0.06p2o5:0.2tmada:50h2o。将凝胶混合物投入高压反应釜内,2小时升温至160℃后,恒温反应48小时,进行水热合成反应。反应后,冷却至室温,过滤、所得产物用去离子水进行洗涤三次后,100℃干燥24小时后,得到含有机模板剂的含铜沸石。将含有机模板剂的含铜沸石放入马弗炉中,550℃焙烧6小时,得到去除了模板剂的含铜沸石。将30g氯化铵溶解于200g水中,加入去除了模板剂的含铜沸石,室温下搅拌8小时,过滤、所得产物用去离子水进行洗涤三次后,100℃干燥24小时,得到去除钠离子的含铜沸石。然后将去除钠离子的含铜沸石加入到200g饱和醋酸铜水溶液中,室温下搅拌8小时,过滤、所得产物用去离子水进行洗涤三次后,100℃干燥24小时。所得粉体经500℃焙烧2小时后,得到含铜沸石1。含铜沸石1的xrd测试结果如图1所示,证实其为cha型沸石。扫描显微镜(sem)测试结果如图2所示,方形晶粒均小于0.6μm。元素组成分析的结果表明,硅与铝的摩尔比为7.3;铜与铝的摩尔比为0.32。bet比表面积测定结果为610m2/g。实施例2向450g水中加入13g氢氧化钠,搅拌溶解,加入135g的25%的n,n,n-三甲基金刚烷铵(tmada)水溶液,混合均匀后,加入10g氢氧化铝,然后再加入120g的40重量%的二氧化硅溶胶(硅溶胶),搅拌反应4小时后,加入26g含铜凝胶2,继续搅拌2小时,充分反应后得到具有以下组成的初凝胶混合物:1sio2:0.07al2o3:0.2na2o:0.06cu:0.09p2o5:0.2tmada:50h2o。将凝胶混合物投入高压反应釜内,2小时升温至160℃后,恒温反应48小时,进行水热合成反应。反应后,冷却至室温,过滤、所得产物用去离子水进行洗涤三次后,100℃干燥24小时后,得到含有机模板剂的含铜沸石。将含有机模板剂的含铜沸石放入马弗炉中,550℃焙烧6小时,得到去除了模板剂的含铜沸石。将30g氯化铵溶解于200g水中,加入去除了模板剂的含铜沸石,室温下搅拌8小时,过滤、所得产物用去离子水进行洗涤三次后,100℃干燥24小时,得到去除钠离子的含铜沸石。然后将去除钠离子的含铜沸石加入到200g饱和醋酸铜水溶液中,室温下搅拌8小时,过滤、所得产物用去离子水进行洗涤三次后,100℃干燥24小时。所得粉体经500℃焙烧2小时后,得到含铜沸石2。含铜沸石2的xrd测试结果如图1所示,证实其为cha型沸石。其扫描显微镜(sem)测试结果如图3所示,方形晶粒均小于0.6μm。元素组成分析的结果表明,硅与铝的摩尔比为7.1;铜与铝的摩尔比为0.35。bet比表面积测定结果为595m2/g。实施例3向450g水中加入氢氧化钠13g,搅拌溶解,加入135g的25%的n,n,n-三甲基金刚烷铵(tmada)水溶液,混合均匀后,加入13g氢氧化铝,然后再加入120g的40重量%的二氧化硅溶胶,搅拌反应4小时后,加入30g含铜凝胶1,继续搅拌2小时,充分反应后得到具有以下组成的初凝胶混合物:1sio2:0.09al2o3:0.2na2o:0.06cu:0.06p2o5:0.2tmada:50h2o。将凝胶混合物投入高压反应釜内,2小时升温至160℃后,恒温反应48小时,进行水热合成反应。反应后,冷却至室温,过滤、所得产物用去离子水进行洗涤三次后,100℃干燥24小时后,得到含有机模板剂的含铜沸石。将含有机模板剂的含铜沸石放入马弗炉中,550℃焙烧6小时后然后得到去除了模板剂的含铜沸石。将30g氯化铵溶解于200g水中,加入去除了模板剂的含铜沸石,室温下搅拌8小时,过滤、所得产物用去离子水进行洗涤三次后,100℃干燥24小时,得到去除钠离子的含铜沸石。然后将去除钠离子的含铜沸石加入到200g饱和醋酸铜水溶液中,室温下搅拌8小时,过滤、所得产物用去离子水进行洗涤三次后,100℃干燥24小时。所得粉体经500℃焙烧2小时后,得到含铜沸石3。含铜沸石3的xrd测试结果如图1所示,证实其为cha型沸石。其扫描显微镜(sem)测试结果如图4所示,方形晶粒均小于0.5μm。元素组成分析的结果表明,硅与铝的摩尔比为5.5;铜与铝的摩尔比为0.41。bet比表面积测定结果为582m2/g。实施例4450g水中加入13g氢氧化钠,搅拌溶解,加入135g的25%的n,n,n-三甲基金刚烷铵(tmada)水溶液,混合均匀后,加入13g氢氧化铝,然后再加入120g的40重量%二氧化硅溶胶,搅拌反应4小时后,加入26g含铜凝胶2,继续搅拌2小时,充分反应后得到具有以下组成的初凝胶混合物:1sio2:0.09al2o3:0.2na2o:0.06cu:0.09p2o5:0.2tmada:50h2o。将凝胶混合物投入高压反应釜内,2小时升温至160℃后,恒温反应48小时,进行水热合成反应。反应后,冷却至室温,过滤、所得产物用去离子水进行洗涤三次后,100℃干燥24小时后,得到含有机模板剂的含铜沸石。将含有机模板剂的含铜沸石放入马弗炉中,550℃焙烧6小时,得到去除了模板剂的含铜沸石。将30g氯化铵溶解于200g水中,加入去除了模板剂的含铜沸石,室温下搅拌8小时,过滤、所得产物用去离子水进行洗涤三次后,100℃干燥24小时,得到去除钠离子的含铜沸石。然后将去除钠离子的含铜沸石加入到200g饱和醋酸铜水溶液中,室温下搅拌8小时,过滤、所得产物用去离子水进行洗涤三次后,100℃干燥24小时。所得粉体经500℃焙烧2小时后,得到含铜沸石4。含铜沸石4的xrd测试结果如图1所示,证实其为cha型沸石。扫描显微镜(sem)测试结果如图5所示,方形晶粒均小于0.5μm。元素组成分析的结果表明,硅与铝的摩尔比为5.7;铜与铝的摩尔比为0.43。bet比表面积测定结果为564m2/g。比较例1向450g水中加入6.6g氢氧化钠,搅拌溶解,加入135g的25%的n,n,n-三甲基金刚烷铵(tmada)水溶液,混合均匀后,加入5g氢氧化铝,然后再加入125g的40重量%的二氧化硅溶胶,搅拌反应4小时后,得到具有以下组成的初凝胶混合物:1sio2::0.03al2o3:0.2na2o:0.2tmada:50h2o,将凝胶混合物投入高压反应釜内,2小时升温至160℃后,恒温反应48小时,进行水热合成反应。冷却至室温,过滤、所得产物用去离子水进行洗涤三次后,100℃干燥24小时后,得到含有机模板剂的沸石a。将含有机模板剂的沸石放入马弗炉中,550℃焙烧6小时后然后得到去除了模板剂的沸石a。将30g氯化铵溶解于200g水中,加入去除了模板剂的沸石a,室温下搅拌8小时,过滤、所得产物用去离子水进行洗涤三次后,100℃干燥24小时,得到去除钠离子的沸石a。然后将去除钠离子的沸石a加入到200g饱和醋酸铜水溶液中,室温下搅拌8小时,过滤、所得产物用去离子水进行洗涤三次后,100℃干燥24小时。所得粉体经500℃焙烧2小时后,得到含铜沸石5。含铜沸石5的xrd测试结果显示,其为cha型沸石。元素组成分析的结果表明,硅与铝的摩尔比为14.3;铜与铝的摩尔比为0.45。bet比表面积测定结果为620m2/g。比较例2按照专利文献cn102215960b实施例1的方法合成含有钾离子的cha型沸石b。将30g氯化铵溶解于200g水中,加入含有钾离子的cha型沸石b,室温下搅拌8小时,过滤、所得产物用去离子水进行洗涤三次后,100℃干燥24小时,得到去除钾离子的沸石b。然后将去除钾离子的沸石b加入到200g饱和醋酸铜水溶液中,室温下搅拌8小时,过滤、所得产物用去离子水进行洗涤三次后,100℃干燥24小时。所得粉体经500℃焙烧2小时后,得到含铜沸石6。元素组成分析的结果表明,硅与铝的摩尔比为2.8;铜与铝的摩尔比为0.12。bet比表面积测定结果为485m2/g。根据上文所述的催化剂活性的评价方法,测试含铜沸石1-6的催化活性,所得结果如以下表2所示。[表2]由上可见,采用本发明的含铜cha型沸石,不仅在200℃以下的低温区间具有高催化活性,在500℃以上的高温区间也具有优异的催化性能,适宜用作为scr脱硝净化催化剂。尽管上文参考特定的实施例来描述本发明的具体实施方式,但是应当理解,本领域技术人员会对其作出多种调整和改变,只要其不违背本发明的范围和主旨即可。当前第1页12
相关技术
网友询问留言
已有0条留言
- 还没有人留言评论。精彩留言会获得点赞!
1