阿司匹林‑Arg‑Gly‑Asp‑Val缀合物,其合成,纳米结构和作为载药体系的应用的制作方法与工艺
阿司匹林-Arg-Gly-Asp-Val缀合物,其合成,纳米结构和作为载药体系的应用技术领域本发明涉及一种新型阿司匹林-Arg-Gly-Asp-Val(A-RGDV)缀合物,还涉及它的制备方法以及它作为抗血栓剂的应用。A-RGDV的特征在于,在血液中能够以纳米颗粒选择性地转运,到达血栓形成部位之后与被激活的血小板表面的GPIIb/IIIa受体作用,释放阿司匹林。因此,A-RGDV是阿司匹林的靶向给药体系。A-RGDV具有强的抗血栓活性,具有良好的临床应用前景。本发明属于生物医药领域。下面是A-RGDV的结构式。
背景技术:
阿司匹林在临床上被广泛应用已逾百年,用于治疗急性炎症,疼痛,心血管疾病,中风,妊娠并发症,癌症,糖尿病和阿尔兹海默症,这些表明它卓越的疗效。对于不同的适应症,阿司匹林有不同的治疗方案。然而,临床也已经揭示了阿司匹林的严重局限性。最主要的局限性是患者对阿司匹林治疗出现耐药或者丧失疗效。患者对阿司匹林治疗出现耐药或者丧失疗效,一方面表现在阿司匹林不完全地抑制患者的血小板功能,尽管患者服用了足够临床剂量阿司匹林。这种情况严重地降低了阿司匹林的对多种疾病包括二型糖尿病,哮喘,心血管疾病,中风,冠心病和小儿心脏手术的治疗效果。为了克服阿司匹林的不足,人们做出了许多努力。例如,为增强糖尿病人血小板的敏感性,实施代谢控制和服用阿司匹林的交替给药方案;为增强高血浆胆固醇的心血管疾病患者的血小板敏感性,将阿司匹林与脂质过氧化抑制剂联用;为增强动脉粥样硬化血栓患者血小板的敏感性,将阿司匹林与他汀类药物联用;为避免患者对阿司匹林的不良容忍性,将阿司匹林与其它药物交替使用;为增强因阿司匹林致呼吸道疾病加重的病人口服阿司匹林的安全性,使用采用预处理过的白三烯改造的药物。尽管这些工作取得了一些成就,患者对阿司匹林治疗出现耐药或者丧失疗效至少仍然是限制阿司匹林治疗心血管疾病的主要临床障碍。RGD序列肽是整合素识别胶原,纤连蛋白,玻连蛋白,层粘连蛋白,免疫球蛋白超家族成员和血浆蛋白质的触发点。虽然整合素与RGD序列肽的相互作用被广泛用于制备大分子药物载体,但是没有任何研究使用单一的RGD四肽直接输送药物。在RGD四肽与小分子形成的缀合物的生物学研究中,发明人发现,当缀合物的RGD四肽部分与活化的血小板表面的GPIIb/IIIa受体相互作用时,缀合物的小分子部分可以分解下来。也就是说,当RGD四肽与小分子形成的缀合物的RGD四肽部分与血栓中活化的血小板表面的GPIIb/IIIa受体相互作用时,缀合物的小分子部分可以分解下来。而在没有活化血小板的血液循环中,RGD四肽与小分子形成的缀合物不发生任何分解。根据这些认识,发明人提出了本发明。
技术实现要素:
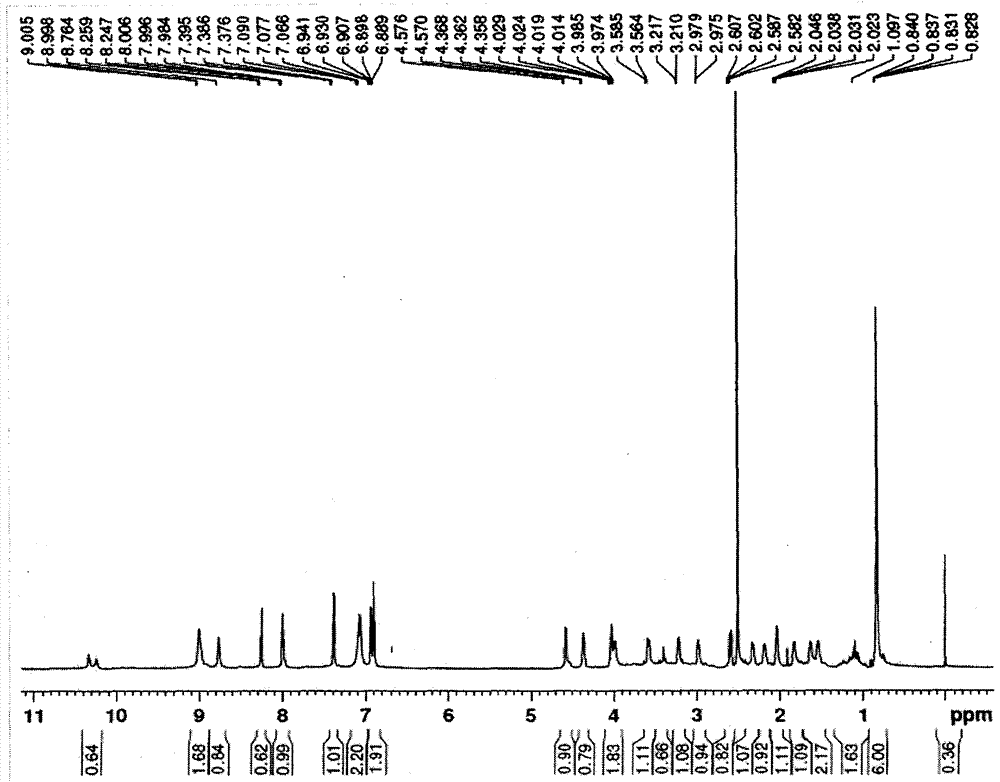
本发明的第一个内容是将RGDV与阿司匹林缀合,制备新型阿司匹林-Arg-Gly-Asp-Val(A-RGDV)缀合物。下面是该缀合物A-RGDV的结构式。本发明的第二个内容是提供一种制备A-RGDV的方法,该方法包括:1)采用液相合成方法,通过逐步接肽分别合成Arg-Gly的保护中间体和Asp-Val的保护中间体;2)脱去Arg-Gly的保护中间体的C端保护基;3)脱去Asp-Val的保护中间体的N端保护基;4)把N端游离的Asp-Val的保护中间体和C端游离的Arg-Gly保护中间体偶联得到Arg-Gly-Asp-Val的保护中间体;5)脱去Arg-Gly-Asp-Val的保护中间体的N端保护基;6)把N端游离的Arg-Gly-Asp-Val保护中间体和阿司匹林偶联得到A-RGDV的保护中间体;7)把A-RGDV的保护中间体脱去保护基,得到A-RGDV。其中,所述的N端保护基是对多肽的N端进行保护时常用的保护基团,例如可以是叔丁氧羰基(Boc),所述的C端保护基是对多肽的C端进行保护时常用的保护基团,例如可以是苄氧基(OBzl)。以上所述的液相合成中间体并加以保护的方法是本领域的常规并公知的技术。本发明的第三个内容是用透射电子显微镜(TEM),扫描电子显微镜(SEM)和原子力显微镜(AFM)测定A-RGDV的纳米结构。通过ROESY2DNMR图谱,ESl-MS图谱和介观理论计算,考察A-RGDV形成纳米颗粒的机理。本发明的第四个内容是研究A-RGDV与GPIIb/IIIa和COX-1的相互作用,说明A-RGDV在血液中保持缀合物分子的完整性,在血栓中释放阿司匹林,以及显示的靶向抗血栓作用。附图说明图1阿司匹林-Arg-Gly-Asp-Val(A-RGDV)的合成路线图。i)二环己基羰二亚胺(DCC),N-羟基苯并三氮唑(HOBt),N-甲基吗啉(NMM);ii)NaOH(1M);iii)氯化氢-乙酸乙酯(6M);iv)H2和Pd/C。图2A-RGDV的1HNMR图谱。图3A-RGDV的ROESY2DNMR图谱和4个相关峰。相关峰1表示A-RGDV的构造,相关峰2-4表示A-RGDV的分子间聚集。图4A-RGDV的ESI-MS图谱。图5左图为A-RGDV的透射电镜照片,右图为A-RGDV的扫描电镜照片。图6A-RGDV的原子力显微镜照片。A)A-RGDV在水中的原子力显微镜照片;B)大鼠血浆的原子力显微镜照片;C)A-RGDV在大鼠血浆中的原子力显微镜照片。图7A-RGDV形成四聚体从而形成纳米结构组图。图8A-RGDV在大鼠血浆中孵育30min后的ESI-MS图谱。图9A-RGDV加GPIIb/IIIa在水中孵育30min后的ESI-MS图谱。图10A-RGDV加COX-1在水中孵育30min后的ESI-MS图谱。图11不同剂量阿司匹林,RGDV和不同剂量A-RGDV的体内抗血栓活性。图12A-RGDV对GPIIb/IIIa表达水平的影响。具体实施方式为了进一步阐述本发明,下面给出一系列实施例。这些实施例完全是例证性的,它们仅用来对本发明进行具体描述,不应当理解为对本发明的限制。实施例1制备Boc-Arg(NO2)-Gly-OBzl将10.0g(31.3mmol)Boc-Arg(NO2)用100ml无水四氢呋喃(THF)溶解,冰浴冷却,向得到的溶液中加入4.3g(31.3mmol)N-羟基苯并三氮唑(HOBt)和6.4g(31.3mmol)二环己基羰二亚胺(DCC),将此反应液冰浴下搅拌10min。加入10.6g(31.3mmol)Tos·Gly-OBzl和3.5g(31.3mmol)N-甲基吗啉(NMM),室温搅拌24h。反应混合物过滤,滤除二环己基脲(DCU)。滤液减压浓缩,残留物用150ml乙酸乙酯溶解。得到的溶液依次用5%NaHCO3水溶液洗,饱和NaCl水溶液洗,5%KHSO4水溶液洗和饱和NaCl水溶液洗。有机相用无水Na2SO4干燥,过滤,滤液减压浓缩至干,残留物经柱层析纯化(氯仿/甲醇,30∶1),得到12.84g(88%)油状标题化合物。ESI-MS(m/e):467[M+H]+。实施例2制备Boc-Arg(NO2)-Gly将11.85g(25.4mmol)Boc-Arg(NO2)-Gly-OBzl溶解在50ml甲醇中,冰浴冷却,加入12ml氢氧化钠-甲醇溶液(1M),搅拌1小时,反应液用2M盐酸中和至pH=7,减压浓缩除去甲醇,残留物用2M盐酸酸化至pH=2,减压浓缩除去水。残留物用100ml乙酸乙酯溶解。得到的溶液用饱和NaCl水溶液洗。有机相用无水Na2SO4干燥,过滤,滤液减压浓缩至干。加少量石油醚将残留物研磨成8.9g(93%)标题化合物,直接投下步反应。ESI-MS(m/e):377[M-H]-。实施例3制备Boc-Asp(OBzl)-Val-OBzl按照实施例1的方法由7.7g(23.7mmol)Boc-Asp(OBzl)和9.0g(23.7mmol)Tos.Val-OBzl制得10.7g(89%)油状标题化合物。ESI-MS(m/e):513[M+H]+。实施例4制备Asp(OBzl)-Val-OBzl将10.7g(20.9mmol)Boc-Asp(OBzl)-Val-OBzl溶解在100ml氯化氢-乙酸乙酯溶液(6M)中,冰浴下搅拌反应2h,TLC(氯仿/甲醇,5∶1)监测反应。减压浓缩,残留物加100ml乙酸乙酯溶解,水泵抽干以除去游离HCl,重复3次。加100ml乙醚将残留物研磨得标题化合物,直接投下步反应。ESI-MS(m/e):413[M+H]+。实施例5制备Boc-Arg(NO2)-Gly-Asp(OBzl)-Val-OBzl按照实施例1的方法由8.9g(23.5mmol)Boc-Arg(NO2)-Gly和9.7g(23.5mmol)Asp(OBzl)Val-OBzl制得15.9g(88%)标题化合物,为无色粉末。ESI-MS(m/e):771[M+H]+。实施例6制备Arg(NO2)-Gly-Asp(OBzl)-Val-OBzl按照实施例4的方法由2.0g(2.6mmol)Boc-Arg(NO2)-Gly-Asp(OBzl)-Val-OBzl制得1.7g(96%)标题化合物,为无色粉末。ESI-MS(m/e):671[M+H]+。实施例7制备N-(2-乙酰氧基苯甲酰基)-Arg(NO2)-Gly-Asp(OBzl)-Val-OBzl按照实施例1的方法由322mg(1.8mmol)阿司匹林和1.2g(1.8mmol)Arg(NO2)-Gly-Asp(OBzl)Val-OBzl制得262mg(21%)标题化合物,为无色粉末。Mp62℃;[α]D25=-391(c=0.25,CH3OH)。ESI-MS(m/e):791[M-42+H]+。IR(KBr):3277,2939,2868,1734,1639,1603,1544,1492,1456,1367,1303,1234,1207,1026,995,756,663。1HNMR(300MHz,DMSO-d6):8.86(m,1H),8.53(s,1H),8.39(t,J=5.4Hz,J=5.4Hz,1H),8.27(d,J=6.6Hz,1H),8.18(d,J=8.1Hz,1H),7.95(d,J=7.5Hz,1H),7.43(s,1H),7.33(m,10H),6.92(m,2H),5.07(m,4H),4.78(m,1H),4.56(m,1H),4.17(m,1H),3.74(m,2H),3.17(m,2H),2.74(m,1H),2.58(m,1H),2.05(m,1H),1.79(m,2H),1.56(m,2H),0.83(d,J=6.6Hz,6H)。13CNMR(125MHz,DMSO-d6):δ/ppm=172.01,171.93,171.47,171.03,171.01,170.23,169.21,169.19,169.12,168.10,167.98,159.17,136.46,136.27,134.01,129.58,128.86,128.84,128.56,128.48,128.43,128.31,119.33,119.28,117.56,117.47,116.73,116.68,79.62,66.41,66.17,58.17,53.07,53.01,49.56,49.46,42.38,42.27,42.24,36.67,36.64,30.24,29.66,19.32,18.56。实施例8制备N-(2-乙酰氧基苯甲酰基)-Arg-Gly-Asp-Val(A-RGDV)将200mg(0.2mmo1)N-(2-乙酰氧基苯甲酰基)-Arg(NO2)-Gly-Asp(OBzl)-Val-OBzl溶解在25ml甲醇中,加入1.0gPd/C,搅拌混悬。0.02Mba氢气环境中反应5h至反应完成。制得131mg(90%)标题化合物,为无色粉末。Mp71℃;[α]D25=-196(c=0.1,H2O)。ESI-MS(m/e):565[M-42+H]+。IR(KBr):3350,2964,2937,1660,1639,1597,1533,1496,1454,1373,1307,1234,1161,1026,756。1HNMR(300MHz,DMSO-d6):9.75(s,1H),8.95(d,J=6.6Hz,1H),8.79(d,J=8.1Hz,1H),8.69(m,1H),8.24(s,2H),7.97(d,J=7.5Hz,1H),7.38(t,J=7.2Hz,J=7.2Hz,1H),7.21(d,J=8.4Hz,2H),6.89(m,2H),4.56(m,1H),4.41(m,1H),4.03(m,2H),3.58(m,1H),3.42(m,2H),3.18(s,1H),3.02(s,1H),2.57(m,1H),2.39(m,1H),2.05(m,2H),1.81(m,2H),1.57(m,2H),1.11(m,4H),0.83(d,J=6.6Hz,6H)。13CNMR(75MHz,DMSO-d6):δ/ppm=174.79,173.65,172.50,170.93,169.06,168.06,167.83,164.42,159.89,159.32,159.20,157.82,133.90,129.74,119.16,117.61,116.90,65.35,63.27,58.00,56.49,53.10,50.36,42.78,37.49,30.92,30.39,25.19,19.53,19.00,18.22,15.61。实验例1ROESY2DNMR与A-RGDV的分子内和分子间相互作用将A-RGDV用氘代DMSO溶解,800MHz核磁共振仪上测得ROESY2DNMR谱(图3),用以支持分子间和分子内的相互作用能促使A-RGDV形成纳米粒子。如图3,标出了4个相关峰。相关峰1表示阿司匹林上的乙酰基甲基H和精氨酸上的胍基H的距离相关峰1表明精氨酸上的胍基H和阿司匹林上的乙酰基O可能形成氢键,A-RGDV的阿司匹林-精氨酸部分能形成一个环状结构。相关峰2表示天冬氨酸的羧基氢和精氨酸的胍基氢相关。相关点3表示阿司匹林苯环上对位氢和天冬氨酸的羧基氢相关。相关峰4表示缬氨酸的甲基氢和精氨酸侧链的β-和γ-CH2的氢相关。这些相关峰表明,一个分子的苯环H到另一个分子的肽链H的距离和一个分子的肽链H到另一个分子的肽链H的距离都这些H靠近既反映了A-RGDV分子间相互接近的立体化学关系,也反映了A-RGDV分子间相互接近的立体化学关系来自分子间缔合。实验例2ESI-MS谱图支持A-RGDV以四聚体存在于溶液中将A-RGDV溶于水进行质谱测试,ESI-MS高分辨谱图如图4。右上角放大图显示质荷比为2261.45306的离子峰表示4个A-RGDV失去乙酰基同时加H。意味着A-RGDV在水中以四聚体存在。质谱图还给出了质荷比为1697.73621,1131.45904和566.11528的离子峰,它们分别对应3个A-RGDV失去乙酰基同时加H,2个A-RGDV失去乙酰基同时加H,1个A-RGDV失去乙酰基同时加H。可见,在高分辨质谱条件下A-RGDV的四聚体溶液裂解丢失乙酰基,并释放三聚体,二聚体和单体。在这些离子峰中,二聚体的峰最高。实验例3A-RGDV的透射电镜和扫描电镜照片1)制样配制A-RGDV的水溶液,调pH=7.2,将此溶液滴在铜网上,再滴一滴无水甲醇促进溶剂挥发。挥干溶剂后在透射电镜(TEM)下观察其纳米形态。将A-RGDV溶于超纯水(1.2mM),冻干。用双面胶将冻干粉粘在铜板上,扫描电镜(SEM)下观察。2)实验结果A-RGDV在pH=7.2的水溶液中能形成直径为5-175nm的纳米球,90%以上的纳米颗粒的直径小于50nm。这种尺寸既能使纳米颗粒避开巨噬细胞吞噬,也有利于纳米颗粒中的A-RGDV在血液循环中转运。SEM下观察A-RGDV的固体形态,为长2-14μm的椭球。在粉线标识的固体颗粒表面能看到一些小点,暗示这些颗粒是由一些小颗粒构成的。由SEM照片不难想象,在水中这些颗粒能分散成之前提到的尺寸的纳米颗粒。图5左为A-RGDV的TEM照片,图5右为A-RGDV的SEM照片。实验例4A-RGDV在大鼠血浆中的原子力显微镜照片1)制样将A-RGDV溶于水或大鼠血浆中,配制成8.0×10-7M的浓度,调pH=7.2。2)实验结果拍摄A-RGDV在大鼠血浆中的原子力显微镜(AFM)照片如图6,用以了解A-RGDV在血液中的纳米特征。如图6所示,在水中和大鼠血浆中,A-RGDV呈直径约为50nm的纳米颗粒,然而单纯大鼠血浆的照片没有观察到相似的纳米结构。这些观察结果表明,即便在大鼠血浆中,A-RGDV的纳米粒仍然稳定,能够在血液循环中完整地转运。实验例5A-RGDV四聚体形成纳米颗粒的过程通过计算机辅助的分子动力学方法,模拟了A-RGDV的优势构象。用系统搜索方法产生30个构象,用BEST方法产生195个构象。生成的这225个构象通过可视化的检测,符合ROESY2DNMR图谱上相关峰1并选出有最低自由能的构象。为满足结构要求,分子间氢键相互作用通过ROESY2DNMR图谱上相关峰2-4规定,ESI-MS谱图上2260.63965离子峰说明4个分子应该在附近并形成一个四聚体。通过计算机辅助的介观模拟软件使用四聚体作为构造块,构建纳米颗粒。发现,形成一个直径为5nm的纳米颗粒需要24个四聚体。图5和图7d,7e,7g所示,A-RGDV形成的最小的纳米颗粒的直径为5nm。因此,最小的纳米颗粒包含24个A-RGDV四聚体。实验例6A-RGDV在血栓中释放阿司匹林1)制样大鼠眼眶取血,往血样中加3.8%柠檬酸钠水溶液或不加3.8%柠檬酸钠水溶液。往200μL血样中加50μLA-RGDV水溶液(3μM)或不加50μLA-RGDV水溶液(3μM)。血液凝固后,不含3.8%柠檬酸钠溶液的样品在37℃孵育30min。离心10min,转速10000r/m。将不含3.8%柠檬酸钠的血样形成的血栓磨碎,离心10min,转速10000r/m。取10μL进样。2)实验结果用ESI-MS检测A-RGDV在血浆和血栓中的变化,考察RGDV是否能作为阿司匹林的载体,谱图见图8。图8A2表明,A-RGDV在大鼠血浆中孵化30minESI-MS谱只给出A-RGDV的离子峰(606.23637),没有发现RGDV自身的离子峰(444.25338)。另一方面,不含A-RGDV大鼠血浆的ESI-MS谱(图8A1)也没有类似的离子峰。可见,A-RGDV在大鼠血浆中孵化30min不释放阿司匹林。图8B2表示A-RGDV在大鼠血栓中孵化30min,ESI-MS谱给出A-RGDV(606.23637),RGDV(444.25338)和阿司匹林二聚体加C1-(395.13477)的离子峰。可见,在大鼠血浆中孵化30min,A-RGDV会释放阿司匹林。另一方面,不含A-RGDV的大鼠血栓的ESI-MS谱(图8B1)上没有类似的峰。实验例7与GPIIb/IIIa的相互作用导致A-RGDV释放阿司匹林1)制样制备A-RGDV的水溶液(100μg/mL),GPIIb/IIIa的水溶液(0.4μg/mL),A-RGDV和GPIIb/IIIa的混合水溶液(100μg/mL和0.4μg/mL)37℃下孵化30min。各取10μL进样。2)实验结果众所周知,在被激活血小板的表面存在RGD序列的受体GPIIb/IIIa。用ESI-MS谱检测GPIIb/IIIa对A-RGDV释放阿司匹林的影响,谱图如图9。在GPIIb/IIIa自身的ESI-MS谱(图9A)中没有与A-RGDV,RGDV及阿司匹林有关的离子峰。而在A-RGDV加GPIIb/IIIa的ESI-MS谱(图9B)中存在A-RGDV(606.23637),A-RGDV裂解乙酰基(564.24836,强度为6×107)和RGDV(444.22655)的离子峰。存在RGDV的离子峰,表明GPIIb/IIIa和A-RGDV的相互作用导致A-RGDV释放了阿司匹林。实验例8与COX-1的相互作用导致A-RGDV转移乙酰基1)制样制备COX-1的水溶液(2.2μg/mL),A-RGDV的水溶液(100μg/mL),A-RGDV和COX-1的混合水溶液(100μg/mL和2.2μg/mL)37℃下孵化30min。各取10μL进样。2)实验结果众所周知,环氧合酶-1(COX-1)是促使花生四烯酸产生前列腺素G2的关键酶。用ESI-MS谱检测COX-1与A-RGDV的作用,如图10。在COX-1的ESI-MS图谱(图10A)中没有发现与A-RGDV,RGDV和阿司匹林有关的离子峰,在A-RGDV加COX-1的ESI-MS谱(图10B)中只存在A-RGDV丢失乙酰基(564.24803)的离子峰。在A-RGDV自身的ESI-MS谱(图10C)中,同时存在A-RGDV(606.23637)和A-RGDV丢失乙酰基(564.24803)的离子峰。可见,A-RGDV与COX-1的相互作用导致A-RGDV彻底消失。很明显,这与A-RGDV向COX-1转变乙酰基有关。实验例9A-RGDV体外抗血小板聚集活性实验1)配液血小板聚集诱导剂(均来源于SIGMA公司)均用生理盐水(NS)溶解,二磷酸腺苷(ADP,浓度500μmol/ml),花生四稀酸(AA,浓度7.4mg/ml),凝血酶(TH,浓度1-5U/ml)。A-RGDV,RGDV,阿司匹林用NS配成浓度为10-4M的溶液。3)实验方法猪颈动脉取血,用经硅烷化处理的血清瓶收集,预先按10%的比例加入3.8%枸橼酸钠溶液抗凝,37℃下保存。将新鲜猪全血迅速以1000r/min的转速离心10min,收集上清液即为富血小板血浆(PRP)。剩下的全血1500r/min离心10min,收集上清液即为贫血小板血浆(PPP)。PRP与PPP均保存在37℃下。在血小板聚集仪上测定ADP,TH和AA为诱导剂诱导的血小板聚集。每个测量平行6次。表1为RGDV,阿司匹林,A-RGDV对ADP,TH,AA诱导的血小板聚集作用的影响。数据说明,阿司匹林和RGDV不能抑制TH和AA诱导的血小板聚集,A-RGDV抑制TH和AA诱导的血小板聚集的能力明显高于阿司匹林和RGDV。A-RGDV抑制ADP诱导的血小板聚集的能力低于RGDV。A-RGDV选择性地抑制AA诱导的血小板聚集,比RGDV高出23倍。表1RGDV,阿司匹林,A-RGDV对ADP,TH和AA诱导的血小板聚集的抑制率实验例10A-RGDV的体内抗血栓活性实验1)分组,剂量及配液阳性对照组:阿司匹林16.7μmol/kg,167μmol/kg;试验组:RGDV100nmol/kg,A-RGDV1nmol/kg,0.1nmol/kg,0.01nmol/kg;空白对照为生理盐水。麻醉剂为乌拉坦20g/100ml,7ml/kg,腹腔注射。抗凝剂为肝素钠50IU/ml。以上均用生理盐水配制。2)实验动物Wister大鼠,255-302g,每组12只。3)制备旁路旁路插管为硅烷化过的聚乙烯胶管,分三段,中段为聚乙烯胶管,长6.0cm,内径3.5mm;两端为相同的聚乙烯管,管长10.0cm,内径1.0mm,外径2.0mm,该管的一端拉成尖管(用于插入大鼠颈动脉或静脉)外径为1.0mm。欲插大鼠颈动脉的一端套上一根充满肝素钠生理盐水溶液的注射器,将旁路中充满肝素钠,同时保证注射器中还留有足够的肝素钠。4)实验方法麻醉大鼠仰卧位固定,分离右颈总动脉和左颈总静脉,结扎颈总动脉远心端,结扎颈总静脉远心端,剪一小口,将一根充满肝素钠生理盐水溶液的聚乙烯管插入颈总静脉并固定,按1mL/kg的剂量推注肝素钠生理盐水溶液。拔下肝素钠注射器,换上吸有计算量药液的药液注射器,将药品缓缓推入大鼠体内。用动脉夹夹住颈总动脉近心端,在颈总动脉远心端剪一小口,将聚乙烯管另一端插入颈总动脉并固定。松开动脉夹,血流从右侧颈总动脉经聚乙烯管流入左侧颈总静脉,形成旁路循环。15min后小心取出取出丝线,在滤纸上轻轻蘸掉血滴,精确称重并记录血栓湿重。统计各组的血栓湿重并做t检验。5)实验结果16.7μmol/kg阿司匹林和100nmol/kgRGDV无抗栓活性。0.1和1nmol/kgA-RGDV有明显的抗栓活性,且抗栓活性存在剂量依赖性。阿司匹林的无效剂量(16.7μmol/kg)是A-RGDV的有效剂量(0.1nmol/kg)的16700倍。图11表示,不同剂量阿司匹林,RGDV和不同剂量A-RGDV的体内抗栓活性。实验结果说明,A-RGDV具有优秀的抗栓活性,这与它能靶向定位于被激活的血小板,释放阿司匹林作用于被激活的血小板,同时能抑制血栓形成有关。实验例11A-RGDV对GPIIb/IIIa表达水平的影响1)实验方法大鼠取血,按1/9的比例加入3.8%柠檬酸钠水溶液,迅速离心(160×g,15min),收集富血小板血浆(PRP)。往600μLPRP中加入5400μL稀释液,制得PRP样品。往960μLPRP中加入浓度为0.4mM的A-RGDV或RGDV的NS溶液20μL,37℃孵育5min,加入20μL浓度为0.15mg/ml的AA的NS溶液,37℃孵育3min。以上作为A-RGDV或RGDV处理PRP的受试样品。往960μLPRP中加入20μLNS溶液,37℃孵育5min,然后加入20μL浓度为0.15mg/ml的AA的NS溶液,37℃孵育3min作为空白对照。往包被了酶的空白孔和受试孔中分别加入50μLNS处理过的PRP和50μLNS处理过的PRP。将板在37℃孵育30min后,弃去孔中试剂,用300μL洗剂清洗5次,每次300μL。往空白孔中加入50μLNS,往受试孔中加入50μL酶标记液。将板在37℃孵育30min后,弃去孔中试剂,用300μL洗剂清洗5次,每次300μL。往各孔中依次加入50μL染色剂A和50μL染色剂B,37℃避光轻轻混合并染色15min。往各孔中加入50μL终止剂终止染色10min。450nm波长下测得各孔OD值,根据标准曲线计算GPIIb/IIIa的表达水平。测试前样品可在-20℃保存不超过10天。2)实验结果用ELISA试剂盒检测RGDV和A-RGDV处理过的血小板的GPIIb/IIIa的表达水平,考察RGDV对A-RGDV与GPIIb/IIIa受体相互作用的影响,结果如图12。0.4mM浓度下RGDV和A-RGDV都显著抑制了GPIIb/IIIa表达。另一方面,A-RGDV的抑制活性显著高于RGDV。该比较说明,GPIIb/IIIa同时是RGDV和A-RGDV的受体,阿司匹林和RGDV的缀合物明显增强了RGDV和GPIIb/IIIa的相互作用。
相关技术
网友询问留言
已有0条留言
- 还没有人留言评论。精彩留言会获得点赞!
1