一种棉花同源异型‑亮氨酸拉链蛋白HDbZIP‑2及其编码基因与应用的制作方法
本发明涉及植物蛋白及其编码基因与应用,特别是涉及一个来源于棉花的同源异型-亮氨酸拉链蛋白HDbZIP-2及其编码基因,以及其在培育耐旱性提高的转基因植物中的应用。
背景技术:
温度、盐渍和干旱等逆境胁迫会对高等植物的生长发育造成严重危害,导致作物产量降低,品质下降,严重威胁农业生产和自然环境。其中干旱对作物产量的影响,在诸多自然逆境中占首位,其危害相当于其它灾害之和,是许多地区是农业发展的瓶颈。据统计,世界干旱、半干旱地区占陆地面积的34%;我国干旱、半干旱地区约占国土面积的52%,年受旱面积达200-270万公顷,全国灌溉区每年缺水约30亿立方米,因缺水而少收粮食350-400亿公斤;特别是我国主要产粮区如华北、东北和西北,是我国缺水最严重的地区,春旱频繁达到十年九遇。
植物耐旱性大多属于多基因控制的数量性状,利用常规育种方法改良作物的抗旱性受到周期长、优质种质资源缺乏的限制。近年来的转录组学、蛋白组学和基因表达调控的研究初步揭示了植物干旱胁迫的作用分子机理。目前,利用干旱胁迫相关基因提高植物的抗旱能力,已经成为植物抗逆分子生物学的研究热点和植物抗逆基因工程重要的研究方向。
植物受到逆境胁迫时会产生相应的应答反应,以降低或消除逆境胁迫给植物带来的危害。植物的这种应答反应是一个涉及多基因、多信号途径及多基因产物的复杂过程。但就目前的研究状况而言,由于其机制十分复杂,许多植物对逆境的生物化学和生理学响应机制仍有待深入研究。在抗逆应答基因的功能及表达调控方面的研究将为植物抗逆相关的信号传递途径之间的联系以及整个信号传递网络系统的研究提供重要的基础。
技术实现要素:
本发明人利用SSH(抑制差减杂交)与RACE(cDNA末端快速扩增)相结合的方法克隆了棉花的一个同源异型-亮氨酸拉链蛋白(本文命名为HDbZIP-2)的编码基因,并测定了其DNA序列。并且发现将其导入受体植物并超量表达后,可显著改善转基因植株的耐旱性,而且这些性状可稳定遗传。
本发明第一方面提供棉花的一个同源异型-亮氨酸拉链蛋白HDbZIP-2的编码基因(本文命名为GhHDbZIP-2),其序列为SEQ ID NO:2。
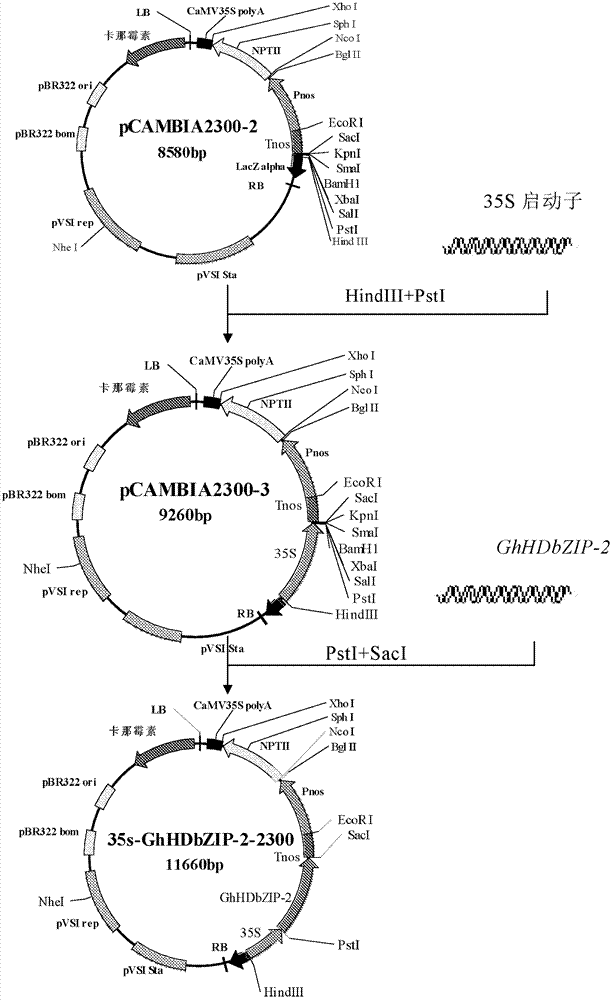
本发明第二方面提供一种重组表达载体,其含有本发明第一方面所述的基因,其是通过将所述基因插入到一种表达载体而获得的,优选地,所述表达载体是pCAMBIA2300;并且所述基因的核苷酸序列与所述重组表达载体的表达控制序列可操作地连接;优选地,所述重组表达载体为附图2所示的35S-GhHDbZIP-2-2300载体。
本发明第三方面提供一种重组细胞,其含有本发明第一方面所述的基因或者本发明第二方面所述的重组表达载体;优选地,所述重组细胞为重组农杆菌细胞。
本发明第四方面提供一种改善植物耐旱性的方法,包括:将本发明第一方面所述的基因或者本发明第二方面所述的重组表达载体导入植物或植物组织并使所述基因表达;优选地,所述植物是拟南芥。
本发明第五方面提供一种制备转基因植物的方法,包括:在有效产生植物的条件下培养含有本发明第一方面所述的基因或者本发明第二方面所述的重组表达载体的植物或植物组织;优选地,所述植物是拟南芥。
本发明第六方面提供本发明第一方面所述的基因、本发明第二方面所述的重组表达载体或者本发明第三方面所述的重组细胞用于改善植物耐旱性以及用于植物育种的用途;优选地,所述植物是拟南芥。
本发明第七方面提供由本发明第一方面所述的基因编码的蛋白质,其氨基酸序列如SEQ ID NO:1所示。
附图说明
图1是GhHDbZIP-2基因的植物表达载体(35S-GhHDbZIP-2-2300)的构建流程(图1a-1b)。
图2是GhHDbZIP-2基因的植物表达载体(35S-GhHDbZIP-2-2300)的质粒图。
图3是GhHDbZIP-2基因的T2代转基因拟南芥植株(图中,T2G1;T2G2)和作为对照的非转基因拟南芥植株(图中,CK1、CK2)的耐旱模拟实验结果。(图3a为正常生长20天的拟南芥植株;图3b为正常生长20天后干旱处理14天的拟南芥植株)。
图4干旱胁迫和正常生长条件下的T2代转基因拟南芥植株及对照植株ABA含量变化检测结果。1-8依次为株系:T2G1、T2G2、T2G3、T2G4、T2G5、T2G6、CK1、CK2,其中T2G1、T2G2、T2G3、T2G4、T2G5、T2G6为转基因植株,CK1、CK2为对照植株。
图5是利用反转录PCR对T2代转基因拟南芥植株和非转基因对照植株中GhHDbZIP-2基因在转录水平上的分子检测验证结果。M为DNA Ladder Marker(DL2000,TakaRa),1-5为非转基因的对照拟南芥植株,6-9为耐旱效果不显著的转基因拟南芥T2代植株,10-17为耐旱效果显著的转基因拟南芥T2代植株(依次为:T2G1、T2G2、T2G3、T2G4、T2G5、T2G6、T2G7、T2G8)。
具体实施方式
下面结合非限制性实施例对本发明进行进一步说明。
下面实施例中提到的未注明来源的限制性内切酶均购自New England Biolabs公司。
实施例1、干旱胁迫下棉花SSH文库构建:
具体方法为:
按照Clontech公司的PCR-selectTM cDNA Subtraction Kit试剂盒说明书所示的方法通过抑制差减杂交方法构建SSH文库(差减文库)。在实验过程中以干旱处理的棉花幼苗的叶片的mRNA作为样本(Tester mRNA),以未处理的棉花幼苗的叶片的mRNA作为对照(Driver mRNA)。具体步骤如下:
(1)供试材料:
冀棉14(国家棉花中期库,获取单位中国棉花研究所,统一编号:ZM-30270)播种到灭过菌的蛭石上,在25℃、光周期16h光照/8h黑暗(光强2000-3000Lx)条件下培养,每周浇1/2MS液体培养基(含9.39mM KNO3,0.625mM KH2PO4,10.3mM NH4NO3,0.75mM MgSO4,1.5mM GaGl2,50μM KI,100μM H3BO3,100μM MnSO4,30μM ZnSO4,1μM Na2MoO4,0.1μM CoCl2,100μM Na2EDTA,100μM FeSO4)一次。当苗株高达25-30cm时用于实验。
(2)材料处理:
将上述供试幼苗分为2组,每组4盆,每盆1株。第一组为对照组,在25℃、光周期16h光照/8h黑暗条件下培养,正常浇灌。第二组为干旱处理组,25℃、光周期16h光照/8h黑暗条件下培养,停止浇灌,处理10天,处理完毕后及时剪取两组幼苗顶端1/3的叶片,用液氮迅速冷冻后,于-70℃冰箱中保存。
(3)总RNA提取:
分别取对照组和干旱处理组的棉花叶片各0.5g,用植物RNA提取试剂盒(购自Invitrogen)提取棉花叶片的总RNA。用HITACHI公司的紫外分光光度计U-2001测定所得总RNA在260nm和280nm的吸光度值,OD260/OD280比值为1.8-2.0,表明总RNA纯度较高;用1.0%的琼脂糖凝胶电泳检测总RNA的完整性,28S条带的亮度约为18S条带的2倍,表明RNA的完整性良好。使用Qiagen公司的Oligotex mRNA纯化试剂盒(purification of polyA+RNA from total RNA)分离mRNA。
(4)抑制差减杂交:
按Clontech公司的PCR-selectTM cDNA Subtraction Kit试剂盒说明书所示的方法进行抑制差减杂交。先将Driver mRNA和Tester mRNA分别反转录,得到双链cDNA,再以2μg Tester cDNA和2μg Driver cDNA作为起始材料进行差减杂交。在37℃水浴下分别将Tester cDNA和Driver cDNA用Rsa I酶切1.5h,然后将酶切后的Tester cDNA分成两等份,连接上不同的接头,而Driver cDNA不连接头。两种连有不同接头的Tester cDNA分别与过量的Driver cDNA混合,进行第一次正向差减杂交。将两种第一次差减杂交的产物混合,再与新变性的Driver cDNA进行第二次正向差减杂交,然后通过两次抑制性PCR扩增差异表达的片段,使其得到富集。
为了增加获得表达序列标签(Expressed Sequence Tag,EST)(Unigene)的有效性,避免基因无酶切位点及所获得序列在非翻译区,除RsaI酶以外,本实验同时用内切酶HaeIII按上述步骤对Tester cDNA和Driver cDNA进行酶切并先后进行两次正向差减杂交和两次抑制性PCR扩增。最后合并两组正向差减杂交cDNA片段的第二次抑制性PCR产物。
(5)差减文库的构建与初步筛选、克隆及鉴定
依照pGEM-T Easy试剂盒(购自Promega)的产品说明书所示方法,将上述合并的正向差减杂交cDNA片段的第二次PCR产物(使用QIAquick PCR Purification Kit纯化,购自Qiagen)与pGEM-T Easy载体连接,其具体步骤如下:向200μl PCR管中依次加入下列成分:纯化的合并后的正向差减杂交cDNA片段的第二次抑制性PCR产物3μl,2×T4DNA连接酶缓冲液5μl,pGEM-T Easy载体1μl,T4DNA连接酶1μl,于4℃连接过夜。取10μL连接反应产物,加入到100μL感受态大肠杆菌JM109(购自TAKARA)中并混匀,冰浴30min、42℃热休克60s、冰浴2min,另加250μL LB培养液(含1%Tryptone购自OXOID,0.5%Yeast Extract购自OXOID,1%NaCl购自国药)后置于37℃摇床中,以225r/min振荡培养30min,所得菌液即为差减文库菌液。加甘油至终浓度20%(V/V),于-80℃保存备用。
取200μL所述差减文库菌液涂布于含50μg/mL氨苄青霉素(购自北京拜尔迪)、40μg/mL X-gal(5-溴-4氯-3-吲哚-β-D-半乳糖苷)、24μg/mL IPTG(异丙基-β-D-硫代吡喃半乳糖苷)(X-gal和IPTG均购自TAKARA)的LB(同上)固体培养平板上,37℃培育18h。计数培养板中直径>1mm的清晰白色及蓝色菌落数,随机挑取198个白色菌落(编号:Gh-B001至Gh-B198)。将所有白色菌落分别接种于含有50μg/mL氨苄青霉素的LB液体培养基的96孔细胞培养板(CORNING)中,37℃培养过夜后加甘油至终浓度20%,于-80℃保存备用。以巢式PCR引物Primer 1和Primer 2R(Clontech公司的PCR-selectTM cDNA Subtraction Kit试剂盒自带)进行菌液PCR扩增验证,得到190个阳性克隆,然后将所有阳性克隆在送英潍捷基(上海)贸易有限公司测序。
(6)差异克隆的cDNA测序分析:
将DNA测序结果去除载体和不明确序列及冗余的cDNA后,共得到173条EST(Unigene)。经分析有27个重叠群,有146个单一的序列。经BlastN发现其中85条EST(Unigene)在GenBank中有同源序列(蛋白同源性50%以上),29条EST功能未知或者为假定蛋白,另有32条未获得同源匹配,推测可能是处于3’或5’末端非翻译区的较短序列。
实施例2棉花同源异型-亮氨酸拉链蛋白编码基因GhHDbZIP-2的克隆
将编号为Gh-B83的阳性克隆的测序结果去掉冗余DNA后,序列为SEQ ID No:3,序列分析表明该序列编码的蛋白质属于同源异型-亮氨酸拉链蛋白,本文将SEQ ID No:3对应的全长编码基因命名为GhHDbZIP-2,其对应的蛋白命名为HDbZIP-2。
SEQ ID No:3
GhHDbZIP-2全长编码基因的克隆
根据已经获得的SEQ ID No:3序列分析发现SEQ ID No:3为编码基因GhHDbZIP-2的3’端序列。
根据已经获得的SEQ ID NO:3序列,设计如下三条特异性引物,作为反转录引物及5’RACE的3’端特异性引物。
GhB83 GSP1:SEQ ID NO:4:
GAGGTCTGCCTGGATCATCC
Gh B83 GSP2:SEQ ID NO:5:
CCTTACATCA TCCGCCCCAG
Gh B83 GSP3:SEQ ID NO:6:
GCAAGTCTCATGGCTACTAAC
试剂盒自带通用引物:
AAP:SEQ ID NO:7:
GGCCACGCGTCGACTAGTACGGGIIGGGIIGGGIIG
AUAP:SEQ ID NO:8:
GGCCACGCGTCGACTAGTAC
实验步骤按试剂盒说明书操作(5’RACE System for Rapid Amplification of cDNA Ends试剂盒购自Invitrogen公司)。
以SEQ ID NO:4为反转录引物,以棉花mRNA为模板进行反转录,获得cDNA模板,然后按照上述5’RACE试剂盒说明书中的步骤加Poly C尾,以加尾后的产物为模板进行第一轮PCR扩增,所用引物为SEQ ID NO:4与通用引物SEQ ID NO:7(试剂盒自带,I为次黄嘌呤修饰的a、c、g或t),具体步骤如下:
50μl PCR反应体系:5μl 10×Ex Buffer、3μl 2.5mM的dNTP、2.0μl mRNA反转录并加Poly C尾后的cDNA、1.0μl Ex Taq(购自TAKARA)、10μM的引物SEQ ID NO:4和SEQ ID NO:7各2.0μl,以及35μl的双蒸水。PCR反应条件:94℃预变性5min,33个循环(94℃变性30s,59℃退火30s,72℃延伸1min),72℃延伸10min。
将所得的PCR产物用双蒸水稀释50倍后取2.0μl作为模板,用SEQ ID NO:5与通用引物SEQ ID NO:8进行第二轮PCR扩增,具体步骤如下:
50μl PCR反应体系:5μl 10×Ex Buffer、3μl 2.5mM的dNTP、2.0μl稀释的第一轮PCR产物、1.0μl Ex Taq、10μM的引物SEQ ID NO:5和SEQ ID NO:8各2.0μl,以及35μl的双蒸水。PCR反应条件:94℃预变性5min,33个循环(94℃变性45s,59℃退火45s,72℃延伸1min),72℃延伸10min。回收第二轮PCR产物中约为900bp大小的条带(Gel Extraction Kit购自OMEGA),并将其连接到pGEM-T Easy载体,然后转化到大肠杆菌JM109感受态细胞中(具体方法同上),并将转化后的菌液涂布于含50μg/mL氨苄青霉素的LB固体培养基上进行筛选。随机挑取10个白色菌落分别接种于含有50μg/mL氨苄青霉素的LB液体培养基中培养,37℃培养过夜后加甘油至终浓度20%,-80℃保存备用。用引物SEQ ID NO:5与3’端引物SEQ ID NO:6进行菌液PCR扩增(反应体系及反应条件同上),得到3个阳性克隆(GhA1、GhA6和GhA8),送英潍捷基(上海)贸易有限公司测序,获得该基因的cDNA的一段5’端序列。
将所得的5’RACE产物中阳性克隆GhA6测序获得序列为SEQ ID NO:9:
将5’RACE获得的序列SEQ ID NO:9,与上述获得的序列SEQ ID NO:3拼接,获得SEQ ID NO:10:
根据SEQ ID NO:10序列分析,SEQ ID NO:10非GhHdbZIP-2的全长序列。需进一步进行5’RACE。设计如下三条特异性引物,作为新一轮的反转录引物及5’RACE的3’端特异性引物。
SEQ10 GSP1:SEQ ID NO:11:
AGTAGACCACTGGTGCACATC
SEQ10 GSP2:SEQ ID NO:12:
AGCTTCGCCTTTGAAGCCG
SEQ10 GSP3:SEQ ID NO:13:
GGTCGATAAATGCGCCTGC
实验步骤按试剂盒说明书操作(5’RACE System for Rapid Amplification of cDNA Ends试剂盒购自Invitrogen公司)。
以SEQ ID NO:11为反转录引物,以棉花mRNA为模板进行反转录,获得cDNA模板,然后按照上述5’RACE试剂盒说明书中的步骤加Poly C尾,以加尾后的产物为模板进行第一轮PCR扩增,所用引物为SEQ ID NO:11与通用引物SEQ ID NO:7(试剂盒自带,I为次黄嘌呤修饰的a、c、g或t),具体步骤如下:
50μl PCR反应体系:5μl 10×Ex Buffer、3μl 2.5mM的dNTP、2.0μl mRNA反转录并加Poly C尾后的cDNA、10μl Ex Taq(购自TAKARA)、10μM的引物SEQ ID NO:11和SEQ ID NO:7各2.0μl,以及35μl的双蒸水。PCR反应条件:94℃预变性5min,33个循环(94℃变性30s,56℃退火30s,72℃延伸1min30s),72℃延伸10min。
将所得的PCR产物用双蒸水稀释50倍后取2.0μl作为模板,用SEQ ID NO:12与通用引物SEQ ID NO:8进行第二轮PCR扩增,具体步骤如下:
50μl PCR反应体系:5μl 10×Ex Buffer、3μl 2.5mM的dNTP、2.0μl稀释的第一轮PCR产物、1.0μl Ex Taq、10μM的引物SEQ ID NO:12和SEQ ID NO:8各2.0μl,以及35μl的双蒸水。PCR反应条件:94℃预变性5min,33个循环(94℃变性45s,58℃退火45s,72℃延伸1min30s),72℃延伸10min。回收第二轮PCR产物中约为1K bp大小的条带(Gel Extraction Kit购自OMEGA),并将其连接到pGEM-T Easy载体,然后转化到大肠杆菌JM109感受态细胞中并在含50μg/mL氨苄青霉素的LB固体培养基上进行筛选(具体方法同上)。随机挑取8个白色菌落分别接种于含有50μg/mL氨苄青霉素的LB液体培养基中培养,37℃培养过夜后加甘油至终浓度20%,-80℃保存备用。用引物SEQ ID NO:12与3’端引物SEQ ID NO:13进行菌液PCR扩增(反应体系及反应条件同上),得到3个阳性克隆(Gh8-1、Gh8-3和Gh8-5),送英潍捷基(上海)贸易有限公司测序,获得该基因的cDNA的一段5’端序列。所得的第二轮5’RACE产物中阳性克隆Gh8-3测序获得序列为SEQ ID NO:14:
SEQ ID NO:14:
将第二轮5’RACE获得的序列SEQ ID NO:14,与上述获得的序列SEQ ID NO:10拼接,获得SEQ ID NO:15:
根据SEQ ID NO:15序列设计一对引物如下:
GhHDbZIP-2F:SEQ ID NO:16:
ATGCCGGCCGGTGTAATG
GhHDbZIP-2R:SEQ ID NO:17:
TCATGCATTCTCGCATGATAG
并合成反转录引物AP:SEQ ID NO:18:
GGCCACGCGTCGACTAGTACTTTTTTTTTTTTTTTTT
通过SEQ ID NO:16和SEQ ID NO:17来克隆GhHDbZIP-2全长编码序列。
提取棉花RNA,以引物SEQ ID NO:18为反转录引物,获取棉花cDNA。采用Stratagene的PfuUltra II Fusion HS DNA Polymerase,以棉花的cDNA为模板进行PCR反应。50μl PCR反应体系:5μl 10×PfuUltra II reaction Buffer、0.5μl 25mM的dNTP、2.0μl cDNA、1.0μl PfuUltra II Fusion HS DNA Polymerase、10μM的引物SEQ ID NO:16和SEQ ID NO:17各2.0μl,以及37.5μl的双蒸水。PCR反应条件:95℃预变性2min,35个循环(95℃变性25s,58℃退火30s,72℃延伸1min30s),72℃延伸5min。
PCR扩增产物加A尾:PCR产物加2.5倍体积的无水乙醇,-20℃放置10min,离心,去上清,晾干,用21μl双蒸水溶解。加入2.5μl 10×Ex Buffer,0.5μl 5mM的dATP,1.0μl Ex Taq。反应条件:70℃反应30min。将得到的约2.3Kbp的DNA片段回收(Omega回收试剂盒),并将其连接至pGEM T-easy载体上(得到GhHDbZIP-2-pGEM质粒),然后转化到大肠杆菌JM109感受态细胞中并在含50μg/mL氨苄青霉素的LB固体培养基上进行筛选(方法同上)。随机挑取8个白色菌落分别接种于含有50μg/mL氨苄青霉素的LB液体培养基中培养,37℃培养过夜后加甘油至终浓度20%,-80℃保存备用。用引物SEQ ID NO:16与SEQ ID NO:17进行菌液PCR扩增(反应体系及反应条件同上),得到3个阳性克隆,送至英潍捷基(上海)贸易有限公司测序,所得序列为SEQ ID NO:2,其编码的蛋白的氨基酸序列为SEQ ID NO:1
HDbZIP-2蛋白的氨基酸序列:SEQ ID NO:1
编码基因GhHDbZIP-2的核苷酸序列:SEQ ID NO:2
实施例3 GhHDbZIP-2基因植物表达载体构建
选择植物双元表达载体pCAMBIA2300(购自北京鼎国昌盛生物技术有限责任公司)作为植物表达载体,用Pnos启动子替换NPTII基因含双增强子的35S启动子,以降低NPTII蛋白在植物中的表达。选择含双增强子的35S启动子及Tnos终止子分别作为GhHDbZIP-2基因的启动子和终止子,构建流程如图1所示。
使用引物SEQ ID NO:19和SEQ ID NO:20以植物表达载体pBI121(购自北京华夏远洋科技有限公司)为模板扩增Pnos,采用TaKaRa的PrimeSTAR HS DNA聚合酶。50μl PCR反应体系:10μl 5×PS Buffer、3μl 2.5mM的dNTP、1.0μl pBI121、1.0μl PrimeSTAR、10μM的引物SEQ ID NO:19和SEQ ID NO:20各2.0μl,以及31μl的双蒸水。PCR反应条件:94℃预变性5min,33个循环(94℃变性30s,56℃退火30s,72℃延伸30s),72℃延伸10min。通过EcoRI、BglII酶切后将所得PCR产物连接到pCAMBIA2300(Promega,T4连接酶盒)获得pCAMBIA2300-1。
SEQ ID NO:19:
GCACGAATTCATACAAATGGACGAACGGAT
SEQ ID NO:20:
ATCCAGATCTAGATCCGGTGCAGATTATTTG
使用引物SEQ ID NO:21和SEQ ID NO:22以pBI121为模板扩增Tnos,采用TaKaRa的PrimeSTAR HS DNA聚合酶。50μl PCR反应体系:10μl 5×PS Buffer、3μl2.5mM的dNTP、1.0μl pBI121、1.0μl PrimeSTAR、10μM的引物SEQ ID NO:21和SEQ ID NO:22各2.0μl,以及31μl的双蒸水。PCR反应条件:94℃预变性5min,33个循环(94℃变性30s,58℃退火30s,72℃延伸30s),72℃延伸10min。通过SacI、EcoRI酶切后将所得PCR产物连接到pCAMBIA2300-1(Promega T4连接酶盒)获得pCAMBIA2300-2。
SEQ ID NO:21:
AAGGAGCTCGAATTTCCCCGATCGTTCAAA
SEQ ID NO:22:
TCAGAATTCCCAGTGAATTCCCGATCTAGTA
使用引物SEQ ID NO:23和SEQ ID NO:24以pCAMBIA2300质粒为模板扩增35S启动子。采用TaKaRa的PrimeSTAR HS DNA聚合酶。50μl PCR反应体系:10μl 5×PS Buffer,3μl 2.5mM的dNTP,1.0μl稀释50倍的pCAMBIA2300质粒,1.0μl PrimeSTAR、10μM的引物SEQ ID NO:23和SEQ ID NO:24各2.0μl,以及31μl的双蒸水。PCR反应条件:94℃预变性5min,33个循环(94℃变性30s,50℃退火30s,72℃延伸30s),72℃延伸10min。通过HindIII、PstI酶切后将所得PCR产物连接到(连接方法同上)pCAMBIA2300-2获得pCAMBIA2300-3
SEQ ID NO:23:
ACTAAGCTTATGGTGGAGCACGACACTCT
SEQ ID NO:24:
TGACTGCAGAGAGATAGATTTGTAGAGAGAGAC
以SEQ ID NO:25和SEQ ID NO:26为引物,以实施例2中含有全长GhHDbZIP-2基因的阳性GhHDbZIP-2-pGEM质粒为模板,扩增两端带有所设计酶切克隆位点的GhHDbZIP-2基因。采用Stratagene的PfuUltra II Fusion HS DNA Polymerase。50μl PCR反应体系:5μl 10×PfuUltra II reaction Buffer、0.5μl 25mM的dNTP、2.0μl GhHDbZIP-2-pGEM质粒、1.0μl PfuUltra II Fusion HS DNA Polymerase、10μM的引物SEQ ID NO:25和SEQ ID NO:26各2.0μl,以及37.5μl的双蒸水。PCR反应条件:95℃预变性2min,35个循环(95℃变性25s,58℃退火30s,72℃延伸1min30s,72℃延伸5min。通过PstI、SacI酶切后将所得PCR产物连接(连接方法同上)到pCAMBIA2300-3,获得植物表达载体35S-GhHDbZIP-2-2300(图2)。
SEQ ID NO:25:
AACTGCAGATGCCGGCCGGTGTAATG
SEQ ID NO:26:
AAGGAGCTCTCATGCATTCTCGCATGATAG
实施例4 35S-GhHDbZIP-2-2300表达载体转化农杆菌
农杆菌LBA4404(购自Biovector Science Lab,Inc)感受态细胞的制备:将农杆菌LBA4404在含50μg/ml利福平和50μg/ml链霉素的LB固体培养基上划单斑接种,28℃培养1至2天。挑取单菌落接种于5ml含50μg/ml利福平和50μg/ml链霉素的LB液体培养基中,28℃下摇动培养过夜(约12-16h)至OD600值为0.4,形成种子菌液。取5ml活化后的种子菌液(1∶20的比例)接种于100ml含50μg/ml利福平和50μg/ml链霉素的LB液体培养基中,28℃摇动培养2-2.5h至OD600=0.8。冰浴菌液10min,每隔3min摇匀一次,使细菌均匀进入休眠状态。于4℃下4000g离心10min,弃上清液;加入一定量冰预冷的10%甘油重悬浮菌体,4℃下4000g离心10min,收集沉淀;用冰预冷的10%甘油重复洗3-4次;加入适量冰浴预冷的10%甘油重新悬浮细菌沉淀,即制得LBA4404感受态细胞,以40μl/管将其分装,于-70℃保存备用。
转化农杆菌:在冰上融化LBA4404感受态细胞,向40μl的所述感受态细胞中加入1μl实施例3中所得的阳性35S-GhHDbZIP-2-2300质粒,混匀后冰浴约10min。将冰浴后的所述感受态细胞和所述阳性35S-GhHDbZIP-2-2300质粒的混合物用微量移液器转移到冰预冷的电击杯中,轻敲使悬浮液到达底部,注意不要有气泡。将电击杯(购自Bio-Rad)放到电击室的滑道上,推动滑道将电击杯放至电击室基座电极处。使用0.1cm规格的电击杯,MicroPuMUer(购自Bio-Rad)的程序设置为“Agr”,电击一次。立即取出电击杯,加入1ml 28℃预热的LB培养基。快速而轻柔的用微量移液器将混合物打匀。将悬浮液转入1.5ml的离心管,28℃,225rpm培养1h。取100-200μl的菌液涂布于相应的抗性筛选培养基平板上(LB固体培养基,含50μg/ml利福平、50μg/ml链霉素、50μg/ml卡那霉素),28℃培养。筛选阳性转化克隆,并将其菌液于-70℃保存备用。
实施例5利用农杆菌介导的转化法获得转基因拟南芥
待转化植株培养:将拟南芥种子(哥伦比亚型,来自美国俄亥俄州立大学的拟南芥生物资源中心)播种在泥炭土中,经4℃低温处理3天后,置于23℃、16h光照/8h黑暗的培养箱中发芽。7-10天后移栽到装有泥炭土和蛭石(体积比3∶1)的口径为7.5cm的塑料钵中,每钵栽种6株,置于23℃,16h光照/8h黑暗的培养箱中生长。移栽前每钵浇1/2MS液体培养基40ml,移栽后视土壤湿度及时补充水分。在生长期间适当浇灌1/2MS液体培养基。按需要每3-4周一次(或者时间更长)。为了在每个植株上得到较多的花芽,当大多数植株第一个花序形成后剪去第一个花序,以解除顶端优势,促使多个次生花序的同步出现。当大多数花序约1-10cm高(剪去第一个花序后4-8d)时准备浸染。
农杆菌的培养:取出实施例4中保种的农杆菌阳性转化克隆的菌液活化后,挑取农杆菌单菌落接种到10mL无菌LB液体培养基中(含75mg/L利福平、100mg/L链霉素和100mg/L卡那霉素),28℃恒温下250r/min振摇过夜培养。再将所得到的菌液按1%-2%的比例接种到200mL同样含上述抗生素的LB液体培养基中,28℃恒温振摇使农杆菌的浓度达到OD600=1.8,然后3000r/min室温离心15min,弃去上清液后用浸染培养基(含有5.0%的蔗糖和0.05%(500μL/L)的Silwet L-77)重新悬浮农杆菌,悬浮至OD600约0.80。
花序的浸染:将上述含农杆菌的浸染培养基加入大口容器中,每个口径9cm的容器中加入200-300mL所述含农杆菌的浸染培养基用于浸染。将植株倒置,使地上组织全部浸没在农杆菌悬浮液中3-5s,并要轻轻搅动。浸润后植株上应该有一层液体膜。浸染过的植株放在塑料盘中,用干净的塑料或保鲜膜覆盖以保湿,然后放置在弱光或暗处过夜,注意小心防止阳光直射植株。处理后约12-24h去掉覆盖。正常培养植株,植株进一步生长3-5周,直至角果变褐变干。收获T1代转基因种子,并将所述种子用离心管在4℃下干燥贮存。
转基因种子筛选:配制1/2MS液体培养基,加入0.8%(W/V)琼脂粉,用微波炉加热至琼脂完全溶化,待冷却到50℃左右,加入卡那霉素至终浓度为50mg·L-1,摇匀后每培养皿中倒入25mL,置实验台冷却凝固后所得固体培养基即可用于播种。将称量好的种子倒在一张普通复印纸上,用手指轻敲复印纸,将种子均匀地播种在所述固体培养基上,盖上培养皿盖,置4℃冰箱冷处理72h后,移至23℃、16h光照/8h黑暗的培养箱中发芽,定期统计种子发芽和幼苗生长情况,将抗性幼苗及时移栽到营养土中。移栽后视土壤湿度及时补充水分。在生长期间适当浇灌1/2MS液体培养基。取生长20天的卡那霉素抗性拟南芥叶片0.1g,提取DNA,用SEQ ID NO:11和SEQ ID NO:12扩增GhHDbZIP-2(50μl PCR反应体系:5μl 10×Ex Buffer,3μl 2.5mM的dNTP,2.0μl DNA,1.0μl Ex Taq、10μM的引物SEQ ID NO:11和SEQ ID NO:12各2.0μl,以及35μl的双蒸水。PCR反应条件:94℃预变性5min,33个循环(94℃变性30s,58℃退火30s,72℃延伸1min),72℃延伸7min),将PCR鉴定为阳性的植株进行编号,正常培养植株,植株进一步生长3-5周,直至角果变褐变干。收获T2代转基因种子(编号为:T2G1-T2G16),并将种子用离心管在4℃下干燥贮存。
实施例6过表达GhHDbZIP-2的转基因拟南芥T2代植株的耐旱模拟实验及功能鉴定
将灭过菌的蛭石用1/2MS液体培养基浸透。将实施例5所得的编号为T2G1-T2G9的转基因种子及对照拟南芥(非转基因)种子分别播种在所述蛭石上,每盆播种10颗种子,25℃、10h光培养/14h暗培养循环,每7天浇一次1/2MS液体培养基,培养20天之后,使用2000PPM卡那霉素涂叶片筛选阳性植株,每盆保留大小较一致的4棵卡那霉素抗性苗,用于干旱实验。转基因拟南芥和对照拟南芥干旱14天(不浇水),25℃、10h光培养/14h暗培养循环。T2代转基因植株的抗旱性鉴定表明,对照植株都萎蔫严重,而T2G1、T2G2、T2G3、T2G4、T2G5、T2G6、T2G7、T2G8、T2G9共9个株系共36棵(每株系各4棵)拟南芥中34棵能够存活并继续生长显现出显著的耐旱性(参见图3a和3b,以T2G1、T2G2为例,T2G3、T2G4、T2G5、T2G6、T2G7、T2G8、T2G9的结果与T2G1、T2G2类似,在此未示出)。
实施例7干旱胁迫后ABA含量的测定
ABA是公认的与逆境胁迫相关的一种植物激素,可以作为信号分子调控多个逆境诱导基因的表达,从而提高植物的抗逆能力。我们取萌发后生长20天然后干旱胁迫10天和正常生长条件下的转基因植株(T2G1、T2G2、T2G3、T2G4、T2G5、T2G6)及对照植株(CK1、CK2)叶片各0.2g,用中国农业大学作物化控研究中心制备的试剂盒测定ABA含量(见图4)。实验结果表明,无论干旱处理还是正常生长条件下,转基因植株的ABA含量均高于对照(CK1、CK2),证明GhHDbZIP-2基因可以正调控植物内源的ABA含量。
实施例8在转录水平上验证GhHDbZIP-2基因的表达
分别取萌发后生长20天然后干旱10天的对照拟南芥(非转基因)植株、显著耐旱转基因拟南芥T2代植株(分别属于T2G1、T2G2、T2G3、T2G4、T2G5、T2G6六个株系)、和显著不耐旱转基因拟南芥T2代植株的叶片各0.05g,用植物RNA提取试剂盒(Invitrogen)提取总RNA。用HITACHI公司的紫外分光光度计U-2001测定所得总RNA在260nm和280nm的吸光度值,计算各个RNA浓度。依照Invitrogen反转录试剂盒SuperScript III Reverse Transcriptase所示方法进行反转录(2μg总RNA作为模板,反转录引物SEQ ID NO:18)。通过SEQ ID NO:16和SEQ ID NO:17扩增GhHDbZIP-2,检测GhHDbZIP-2基因相对表达情况。
采用TaKaRa的PrimeSTAR HS DNA聚合酶,以上述反转录的cDNA为模板进行PCR反应。50μl PCR反应体系:10μl 5×PS Buffer,3μl 2.5mM的dNTP,2.0μl cDNA,1.0μl PrimeSTAR、10μM的引物SEQ ID NO:16和SEQ ID NO:17各2.0μl,以及30μl的双蒸水。PCR反应条件:94℃预变性5min,29个循环(94℃变性45s,58℃退火45s,72℃延伸2min),72℃延伸10min。
产物电泳结果如图5所示:M为DNA Ladder Marker(DL2000,TakaRa),1-5为非转基因拟南芥对照,6-9为不显著耐旱转基因拟南芥T2代植株,10-17为显著耐旱转基因拟南芥T2代植株(依次为:T2G1、T2G2、T2G3、T2G4、T2G5、T2G6、T2G7、T2G8)。图中所示PCR产物电泳条带大小与GhHDbZIP-2的大小一致(约2.3kbp)。结果表明,对照拟南芥没有GhHDbZIP-2转录信号,耐旱转基因拟南芥T2代植株中GhHDbZIP-2的转录较强,不耐旱转基因拟南芥T2代植株没有GhHDbZIP-2转录。
- 还没有人留言评论。精彩留言会获得点赞!
- 一种针对氨浸法处理高碱性脉石型低品位氧化锌矿浸出液进行电解的方法
- 一种加速肿瘤细胞凋亡的药物的制作方法
- 拉链合链模的制作方法
- 一种带亮氨酸拉链结构域蛋白单克隆抗体的制备及鉴定方法
- 肝癌相关的亮氨酸富集不育阿尔法模体1基因甲基化位点及应用的制作方法
- 一种新的多肽——人含亮氨酸拉链激酶12.65和编码这种多肽的多核苷酸的制作方法
- 一种新的多肽——人亮氨酸拉链蛋白9.13和编码这种多肽的多核苷酸的制作方法
- 一种新的多肽——人含亮氨酸拉链的鸟苷酸转换蛋白延长因子1-12.54和编码这种多肽 ...的制作方法
- 使用短干扰核酸(siNA)的RNA干扰介导的BTB和CNC同系物1,碱性亮氨酸拉链转录因子1 ...的制作方法
- 小麦渐渗系应答非生物胁迫调控基因TaGBF及其应用的制作方法