表皮生长因子受体3(HER3)的抗体的制作方法
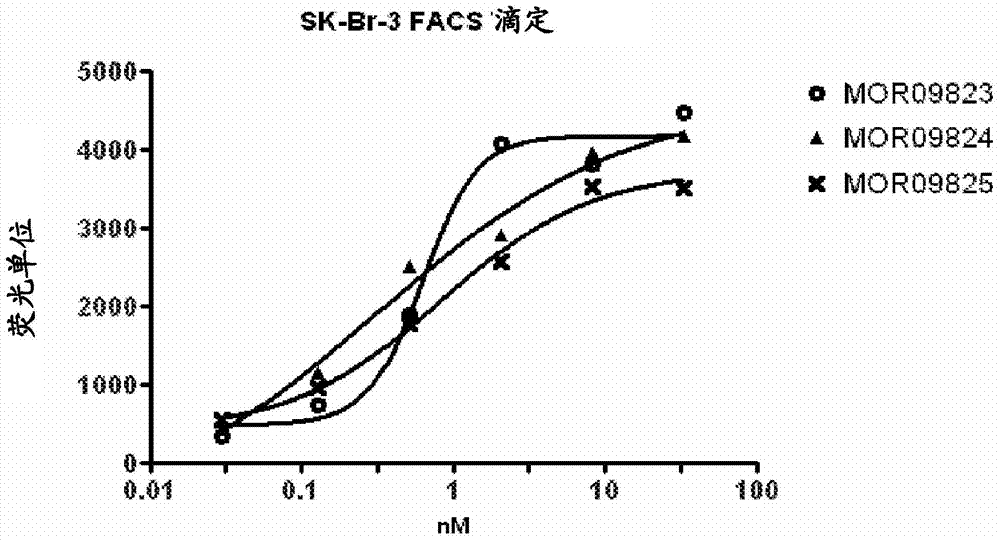
本申请要求2011年12月5日提交的美国临时申请号61/566,890的优先权,其内容在此以其整体引入作为参考。
技术领域:
本发明一般涉及与HER受体家族,例如HER3受体相互作用的抗体或其片段。具体而言,本发明涉及这样的抗体或其片段,该抗体或其片段识别HER3受体上包含来自结构域2和4二者的残基的构象表位,导致对配体依赖性和非配体依赖性信号转导二者的抑制;并且允许配体结合(例如神经调节蛋白),但阻止配体诱导的信号转导激活。这些抗体或片段可用于治疗以HER3表达水平提高为特征的许多疾病或病症(例如食管癌)。这些抗体或片段可用于治疗以该抗体或片段能够减小组织重量(例如前列腺或子宫重量)或诱导组织萎缩(例如雄性乳腺萎缩)为特征的许多疾病或病症。
背景技术:
:人表皮生长因子受体3(ErbB3,也称HER3)是一种受体蛋白酪氨酸激酶,属于受体蛋白酪氨酸激酶的表皮生长因子受体(EGFR)亚家族,该亚家族还包括EGFR(HER1、ErbB1)、HER2(ErbB2、Neu)和HER4(ErbB4)(Plowman等人,(1990)Proc.Natl.Acad.Sci.U.S.A.87:4905-4909;Kraus等人,(1989)Proc.Natl.Acad.Sci.U.S.A.86:9193-9197;和Kraus等人,(1993)Proc.Natl.Acad.Sci.U.S.A.90:2900-2904)。与原型表皮生长因子受体一样,跨膜受体HER3由胞外配体结合结构域(ECD)、ECD内的二聚化结构域、跨膜结构域、胞内蛋白酪氨酸激酶样结构域(TKD)和C-端磷酸化结构域组成。与其他HER家族成员不同,HER3的激酶结构域显示极低的内在激酶活性。配体神经调节蛋白1(NRG)或神经调节蛋白2结合HER3的胞外结构域,并通过促进与其他二聚化配偶体(如HER2)的二聚化来激活受体介导的信号传导途径。异源二聚化导致HER3胞内结构域的激活和转磷酸作用,这不仅是信号多样化的手段,而且也是信号放大的手段。此外,HER3异源二聚化也可在缺乏激活配体的情况下发生,这通常称为非配体依赖性HER3激活。例如,在HER2由于基因扩增(例如在乳腺癌、肺癌、卵巢癌或胃癌中)而以高水平表达时,可形成自发的HER2/HER3二聚体。在这种情况下,HER2/HER3被认为是活性最高的ErbB信号传导二聚体,并因此是高度转化性的。已经在若干癌症类型中发现了增加的HER3,例如乳腺癌、肺癌、胃肠癌和胰腺癌。有意义的是,已证实了HER2/HER3的表达和从非侵袭期进展至侵袭期之间的相关性(Alimandi等人,(1995)Oncogene10:1813-1821;DeFazio等人,(2000)Cancer87:487-498;Naidu等人,(1988)Br.J.Cancer78:1385-1390)。因此,需要干扰HER3介导的信号传导的药物。发明概述本发明所基于的是:结合HER3受体构象表位的抗原结合蛋白(例如抗体或其片段)的发现,所述构象表位包含HER3结构域2和结构域4内的氨基酸残基。抗体或其片段与结构域2和结构域4的结合将HER3受体稳定在失活或封闭的构象(closedconformation),由此抑制HER3的激活。令人惊奇的是,抗体或其片段与此构象表位的结合可以阻断配体依赖性(例如神经调节蛋白)和非配体依赖性HER3信号传导途径二者。此外,抗体介导的对配体诱导的信号传导的抑制在不阻断配体结合的情况下发生(即配体和抗体都可结合HER3),这可能是由于HER3不能进行激活所需的构象重排。本发明还公开了用抗体或其片段治疗以提高的HER3表达为特征的许多疾病或病症;及以抗体或片段能够减小组织重量(例如前列腺或子宫重量)或诱导组织萎缩(例如雄性乳腺萎缩)为特征的疾病或病症的方法。因此,一方面,本发明涉及治疗食管中以HER3表达水平提高为特征的病症的方法,其包括:选择在食管中具有提高的HER3表达水平的患者;施用特异性结合HER3受体的抗体或其片段,使得该抗体或其片段与HER3受体中包含结构域2和结构域4内的氨基酸残基的构象表位结合,并阻断配体依赖性和非配体依赖性信号转导二者,从而治疗所述病症。在一个实施方案中,病症选自食管癌和巴雷特食管癌(Barrettsesophagealcancer)。在另一方面,本发明涉及治疗胃癌的方法,其包括:选择患有胃癌的患者;施用特异性结合HER3受体的抗体或其片段,使得该抗体或其片段与HER3受体中包含结构域2和结构域4内的氨基酸残基的构象表位结合,并阻断配体依赖性和非配体依赖性信号转导二者,从而治疗胃癌。在另一方面,本发明涉及治疗头颈癌的方法,其包括:选择患有头颈癌的患者;施用特异性结合HER3受体的抗体或其片段,使得该抗体或其片段与HER3受体中包含结构域2和结构域4内的氨基酸残基的构象表位结合,并阻断配体依赖性和非配体依赖性信号转导二者,从而治疗头颈癌。在另一方面,本发明涉及治疗良性前列腺增生的方法,其包括:选择患有良性前列腺增生的患者;施用特异性结合HER3受体的抗体或其片段,使得该抗体或其片段与HER3受体中包含结构域2和结构域4内的氨基酸残基的构象表位结合,并阻断配体依赖性和非配体依赖性信号转导二者,从而治疗良性前列腺增生。还在另一方面,本发明涉及治疗男子乳腺发育(gynacomastica)的方法,其包括:选择患有男子乳腺发育的患者;施用特异性结合HER3受体的抗体或其片段,使得该抗体或其片段与包含HER3受体的结构域2和结构域4内的氨基酸残基的构象表位结合,并阻断配体依赖性和非配体依赖性信号转导二者,从而治疗男子乳腺发育。还在另一方面,本发明涉及治疗子宫内膜异位(endometiosis)的方法,其包括:选择患有子宫内膜异位的患者;施用特异性结合HER3受体的抗体或其片段,使得该抗体或其片段与HER3受体中包含结构域2和结构域4内的氨基酸残基的构象表位结合,并阻断配体依赖性和非配体依赖性信号转导二者,从而治疗子宫内膜异位。在一个实施方案中,抗体或其片段通过选自口服、皮下、腹膜内、肌内、脑室内、实质内、鞘内、颅内、颊、黏膜、鼻和直肠施用的途径施用。在一个实施方案中,抗体或其片段配制为含有生理可用载体、赋形剂或稀释剂的药物组合物。在另一实施方案中,药物组合物包含另外的治疗剂。在一个实施方案中,该另外的治疗剂选自:HER1抑制剂、HER2抑制剂、HER3抑制剂、HER4抑制剂、mTOR抑制剂和PI3激酶抑制剂。在一个实施方案中,该另外的治疗剂是选自马妥珠单抗(Matuzumab)(EMD72000)、/西妥昔单抗(Cetuximab)、/帕尼单抗(Panitumumab)、mAb806、尼莫珠单抗(Nimotuzumab)、/吉非替尼(Gefitinib)、CI-1033(PD183805)、拉帕替尼(Lapatinib)(GW-572016)、/二甲苯磺酸拉帕替尼(LapatinibDitosylate)、/盐酸埃罗替尼(ErlotinibHCL)(OSI-774)、PKI-166和的HER1抑制剂;选自帕妥珠单抗(Pertuzumab)、曲妥珠单抗(Trastuzumab)、MM-111、来那替尼(neratinib)、拉帕替尼或二甲苯磺酸拉帕替尼/的HER2抑制剂;选自MM-121、MM-111、IB4C3、2DID12(U3PharmaAG)、AMG888(Amgen)、AV-203(Aveo)、MEHD7945A(Genentech)、MOR10703(Novartis)和抑制HER3的小分子的HER3抑制剂;和HER4抑制剂。在一个实施方案中,该另外的治疗剂是选自坦罗莫司(Temsirolimus)/ridaforolimus/Deforolimus、AP23573、MK8669、依维莫司(everolimus)/的mTOR抑制剂。在一个实施方案中,该另外的治疗剂是选自GDC0941、BEZ235、BKM120和BYL719的PI3激酶抑制剂。在另一方面,本发明涉及特异性结合HER3受体的抗体或其片段在制备用于治疗食管病症、或胃癌、或头颈癌、或良性前列腺增生(BPH)、或男子乳腺发育、或子宫内膜异位的药物中的用途,其中该抗体或其片段与HER3受体中包含结构域2和结构域4内的氨基酸残基的构象表位结合,并阻断配体依赖性和非配体依赖性信号转导二者。附图简述图1:用人、小鼠、大鼠和食蟹猴(cyno)HER3获得的代表性MOR10701SET曲线。图2:通过FACS滴定进行的SK-Br-3细胞结合测定。图3:HER3结构域结合ELISA。图4:氢氘交换表位作图。A)在HDX-MS分析后回收的HER3ECD肽用虚线指示。潜在的N连接糖基化位点被突出显示。B)在通过MS鉴定的肽中观察到的相对氘化程度。C)作图在公开的HER3晶体结构上的受保护的残基。图5:A)HER3/MOR09823和HER3/MOR09825的X射线晶体结构的表面图。HER3(浅灰色)处于封闭的构象中,而MOR09823或MOR09825(最深的灰色)结合结构域2和4。B)HER3/MOR09823结构中HER3的表面视图,以与(A)相似的取向显示。为了清楚,略去了MOR09823。C)用带形结构(ribbonstructure)图示的HER3/MOR09823结构,相对图(A)、(B)和(D)旋转90°观察。D)被MOR09823Fab识别的失活的HER3构象的带形图示,特写放大显示结构域2/结构域4的界面,突出显示在Fab的之内的HER3残基。E)通过ELISA滴定进行的突变体HER3/MOR10703结合的测定。图6:配体诱导(A)的或非配体依赖性(B)的HER3磷酸化的抑制。图7:HER2扩增的细胞系中HER3依赖性下游信号传导途经的抑制。图8:在A)BT-474细胞和B)神经调节蛋白刺激的MCF7细胞中HER3抑制对细胞生长的影响。图9:MOR09823和MOR09825对神经调节蛋白结合MCF7细胞的影响。图10:通过BiacoreTM评估的MOR09823结合对HER3/神经调节蛋白复合物形成的影响。无抗体(黑色柱)、MOR09823(白色柱)、105.5(灰色柱)和对照IgG(条纹柱)。图11:体内MOR09823介导的对(A)非配体依赖性(BT-474)和(B)配体依赖性(BxPC3)HER3信号传导的抑制。图12:MOR10701和MOR10703对BT-474肿瘤生长的影响。图13:MOR10701和MOR10703对BxPC3肿瘤生长的影响。图14:MOR10703体外药物组合等效应图(isobologram)(A)MOR09823/曲妥珠单抗、(B)MOR09823/拉帕替尼、(C)MOR10703/BEZ235、(D)MOR10703/BKM120、(E)MOR10703/BYL719、(F)MOR10703/RAD001、(G)MOR10703/西妥昔单抗、和(H)MOR10703/埃罗替尼。图15:在BT-474和L3.3中MOR10701或MOR10703与(A)曲妥珠单抗和(B)埃罗替尼的体内组合。图16:在食管细胞上MOR10703单独或MOR10703与(A)西妥昔单抗和(B)BYL719的体外组合。图17:KYSE140和KYSE180食管肿瘤模型中MOR10703单独或MOR10703与(A)西妥昔单抗和(B)BYL719的体内组合。图18:CHE007食管肿瘤模型中MOR10703单独或MOR10703与(A)西妥昔单抗和(B)BYL719的体内组合,及CHES015食管肿瘤模型中(C)MOR10703单独或MOR10703与西妥昔单抗的体内组合。图19:N87胃肿瘤模型中MOR10703单独或MOR10703与BYL719的体内组合,显示延长的肿瘤消退(tumorregresssion)。图20:A253SCCHN模型中MOR10703单独或MOR10703与西妥昔单抗的体内组合,用MOR10703或西妥昔单抗作为单个活性剂治疗导致了肿瘤停滞。MOR10703与西妥昔单抗的组合导致肿瘤消退。发明详述定义为了使本发明更易于理解,首先定义某些术语。其它定义在整个发明详述中给出。本文所用的短语“信号转导”或“信号传导活性”指,一般由蛋白质-蛋白质相互作用(如生长因子与受体的结合)起始的生化因果关系,导致信号从细胞的一部分传递到细胞的另一部分。对HER3而言,该传递涉及在一系列反应中对一种或多种蛋白质上的一个或多个酪氨酸、丝氨酸或苏氨酸残基的特异性磷酸化,导致信号转导。倒数第二个过程一般包括细胞核事件,导致基因表达的改变。“HER受体”是属于HER受体家族的受体蛋白酪氨酸激酶,包括EGFR、HER2、HER3和HER4受体以及待将来鉴定的此家族的其他成员。HER受体一般包含可结合HER配体的胞外结构域、亲脂性跨膜结构域、保守的胞内酪氨酸激酶结构域;和含有若干可被磷酸化的酪氨酸残基的羧基端信号传导结构域。优选地,HER受体是天然序列的人HER受体。术语“HER1”、“ErbB1”、“表皮生长因子受体”和“EGFR”在本文中可互换使用,指例如在Carpenter等人Ann.Rev.Biochem.56:881-914(1987)中公开的EGFR,包括其天然存在的突变体形式(例如在Humphrey等人,(1990)PNAS(USA)87:4207-4211中的缺失突变体EGFR)。erbB1指编码EGFR蛋白产物的基因。术语“HER2”和“ErbB2”在本文中可互换使用,指例如在Semba等人,(1985)PNAS(USA)82:6497-6501和Yamamoto等人(1986)Nature319:230-234(Genebank登录号X03363)中描述的人HER2蛋白。术语“erbB2”指编码人ErbB2的基因,“neu”指编码大鼠p185neu的基因。本文中的术语“HER4”和“ErbB4”指例如在EP专利申请号599,274;Plowman等人,(1993)Proc.Natl.Acad.Sci.USA,90:1746-1750;和Plowman等人,(1993)Nature,366:473-475中公开的受体多肽,包括其同种型,例如在1999年4月22日公开的WO99/19488中公开的同种型。本文所用的术语“HER3”或“HER3受体”又称“ErbB3”,指哺乳动物HER3蛋白,“her3”或"erbB3"指哺乳动物her3基因。优选的HER3蛋白是存在于细胞的细胞膜中的人HER3蛋白。人her3基因在美国专利号5,480,968和Plowman等人,(1990)Proc.Natl.Acad.Sci.USA,87:4905-4909中描述。登录号NP_001973(人)中定义的人HER3,在下文中显示为SEQIDNO:1。所有的命名表示全长、未成熟的HER3(氨基酸1-1342)。在位置19和20之间切割该未成熟的HER3,产生成熟的HER3蛋白(20-1342氨基酸)。mrandalqvlgllfslargsevgnsqavcpgtlnglsvtgdaenqyqtlyklyercevvmgnleivltghnadlsflqwirevtgyvlvamnefstlplpnlrvvrgtqvydgkfaifvmlnyntnsshalrqlrltqlteilsggvyiekndklchmdtidwrdivrdrdaeivvkdngrscppchevckgrcwgpgsedcqtltkticapqcnghcfgpnpnqcchdecaggcsgpqdtdcfacrhfndsgacvprcpqplvynkltfqlepnphtkyqyggvcvascphnfvvdqtscvracppdkmevdknglkmcepcgglcpkacegtgsgsrfqtvdssnidgfvnctkilgnldflitglngdpwhkipaldpeklnvfrtvreitgylniqswpphmhnfsvfsnlttiggrslynrgfsllimknlnvtslgfrslkeisagriyisanrqlcyhhslnwtkvlrgpteerldikhnrprrdcvaegkvcdplcssggcwgpgpgqclscrnysrggvcvthcnflngeprefaheaecfschpecqpmegtatcngsgsdtcaqcahfrdgphcvsscphgvlgakgpiykypdvqnecrpchenctqgckgpelqdclgqtlvligkthltmaltviaglvvifmmlggtflywrgrriqnkramrrylergesiepldpsekankvlarifketelrklkvlgsgvfgtvhkgvwipegesikipvcikviedksgrqsfqavtdhmlaigsldhahivrllglcpgsslqlvtqylplgslldhvrqhrgalgpqlllnwgvqiakgmyyleehgmvhrnlaarnvllkspsqvqvadfgvadllppddkqllyseaktpikwmalesihfgkythqsdvwsygvtvwelmtfgaepyaglrlaevpdllekgerlaqpqictidvymvmvkcwmidenirptfkelaneftrmardpprylvikresgpgiapgpephgltnkkleevelepeldldldleaeednlatttlgsalslpvgtlnrprgsqsllspssgympmnqgnlgescqesavsgssercprpvslhpmprgclasesseghvtgseaelqekvsmcrsrsrsrsprprgdsayhsqrhslltpvtplsppgleeedvngyvmpdthlkgtpssregtlssvglssvlgteeededeeyeymnrrrrhspphpprpssleelgyeymdvgsdlsaslgstqscplhpvpimptagttpdedyeymnrqrdgggpggdyaamgacpaseqgyeemrafqgpghqaphvhyarlktlrsleatdsafdnpdywhsrlfpkanaqrt(SEQIDNO:1)本文所用的术语“HER配体”指结合并激活HER受体如HER1、HER2、HER3和HER4的多肽。HER配体的实例包括但不限于神经调节蛋白1(NRG)、神经调节蛋白2、神经调节蛋白3、神经调节蛋白4、β动物纤维素、肝素结合表皮生长因子、表皮调节蛋白(epiregulin)、表皮生长因子、双调蛋白和转化生长因子α。该术语包括天然存在的多肽的生物活性片段和/或变体。本文所用的术语“HER3配体”指结合并激活HER3的多肽。HER3配体的实例包括但不限于神经调节蛋白1(NRG)和神经调节蛋白2、肝素结合表皮生长因子和表皮调节蛋白。该术语包括天然存在的多肽的生物活性片段和/或变体。“HER-HER蛋白复合物”是含有任意组合的HER共同受体(例如,HER1-HER2、HER1-HER3、HER1-HER4、HER2-HER3、HER3-HER4,等等)的非共价结合的寡聚物。在表达这两种受体的细胞暴露于HER配体例如NRG时,或在HER受体有活性或过表达时,可形成此复合物。“HER2-HER3蛋白复合物”是含有HER2受体和HER3受体的非共价结合的寡聚物。在表达这两种受体的细胞暴露于HER3配体(如NRG)时,或在HER2有活性/过表达时,可形成此复合物。本文所用的短语“HER3活性”或“HER3激活”指寡聚化(例如包含HER3的复合物的增加)、HER3磷酸化、构象重排(例如由配体诱导的那些)和HER3介导的下游信号传导的增加。在HER3的背景中使用的术语“稳定化”或“稳定化的”指,抗体或其片段直接维持住(锁住、缚住、保持、优先结合、利于)HER3的失活态或失活构象而不阻断配体结合HER3,由此配体结合不再能够激活HER3。可用实施例中所述的测定试验(例如Biacore测定试验)测量配体与稳定化的HER3受体的结合。本文所用的术语“配体依赖性信号传导”指HER(例如HER3)通过配体的激活。HER3激活表现为:增加的寡聚化(例如异源二聚化)和/或HER3磷酸化,由此下游信号传导途径(例如PI3K)被激活。如使用实施例中所述的测定试验测量的,相对于未处理(对照)细胞,在暴露于抗原结合蛋白(例如抗体)的受刺激的细胞中,抗体或其片段可统计学显著地减少磷酸化的HER3的量。表达HER3的细胞可以是天然存在的细胞系(例如MCF7),或可以通过在宿主细胞中引入编码HER3蛋白的核酸而重组产生。可通过外源加入激活性HER3配体或通过内源表达激活性配体来进行细胞刺激。“减少细胞中由神经调节蛋白诱导的HER3激活”的抗体或其片段是这样的抗体或其片段,在用实施例中所述的测定试验测量时,相对于未处理(对照)细胞,该抗体或其片段统计学显著地减少HER3酪氨酸磷酸化。这可以基于在将HER3暴露于NRG和目的抗体之后的HER3磷酸化水平确定。表达HER3蛋白的细胞可以是天然存在的细胞或细胞系(例如MCF7),或可以是重组产生的细胞或细胞系。本文所用的术语“非配体依赖性信号传导”指不需要配体结合的细胞HER3活性(例如磷酸化)。例如,非配体依赖性HER3激活可以是HER2过表达的结果或是HER3异源二聚体配偶体(如EGFR和HER2)中激活性突变的结果。相对于未处理(对照)细胞,在暴露于抗原结合蛋白(例如抗体)的细胞中,抗体或其片段可统计学显著地减少磷酸化的HER3的量。表达HER3的细胞可以是天然存在的细胞系(例如SK-Br-3),或可以是通过在宿主细胞中引入编码HER3蛋白的核酸而重组产生的细胞。本文所用的术语“阻断”指终止或阻止相互作用或过程,例如,终止配体依赖性或非配体依赖性信号传导。本文所用的术语“识别”指抗体或其片段找到其构象表位并与之相互作用(例如结合)。本文所用的短语“同时结合”指,HER配体可,与HER抗体一起,结合HER受体上的配体结合部位。这意味着,配体和抗体二者可一起结合HER受体。仅为了举例说明的目的,HER3配体NRG可与HER3抗体一起结合HER3受体。测量配体和抗体的同时结合的测定试验在实施例章节中描述(例如Biacore)。本文所用的术语“未能/不能”指抗体或其片段不引起特定事件。例如,“未能激活信号转导”的抗体或其片段是不触发信号转导的抗体或其片段;“未能诱导构象变化”的抗体或其片段是不引起HER受体的结构改变的抗体或其片段;将HER受体稳定在失活态以致该HER受体“不能二聚化”的抗体或其片段是不导致形成蛋白质-蛋白质复合物的抗体或其片段。本文所用的术语“抗体”指与HER3表位相互作用(例如,通过结合、位阻、稳定化/去稳定化、空间分布)并抑制信号转导的全抗体。天然存在的"抗体"是包含通过二硫键相互连接的至少2条重(H)链和2条轻(L)链的糖蛋白。每条重链由重链可变区(本文中简称VH)和重链恒定区组成。重链恒定区由三个结构域CH1、CH2和CH3组成。每条轻链由轻链可变区(本文中简称VL)和轻链恒定区组成。轻链恒定区由一个结构域CL组成。VH和VL区可进一步细分为称作互补决定区(CDR)的高变区,其间散布更保守的称为构架区(FR)的区域。每个VH和VL由三个CDR和4个FR组成,从氨基端到羧基端以如下顺序排列:FR1、CDR1、FR2、CDR2、FR3、CDR3、FR4。重链和轻链的可变区包含与抗原相互作用的结合结构域。抗体的恒定区可介导免疫球蛋白与宿主组织或因子(包括免疫系统的多种细胞(例如效应细胞)和经典补体系统的第一组分(C1q))的结合。术语“抗体”包括例如单克隆抗体、人抗体、人源化抗体、驼源化(camelised)抗体、嵌合抗体、单链Fv(scFv)、二硫键连接的Fv(sdFv)、Fab片段、F(ab')片段和抗独特型(抗-Id)抗体(包括例如针对本发明抗体的抗-Id抗体)、及以上任一种的表位结合片段。抗体可以属于任何同种型(例如IgG、IgE、IgM、IgD、IgA和IgY)、类(例如IgG1、IgG2、IgG3、IgG4、IgA1和IgA2)或亚类。轻链和重链都可以分为结构和功能同源的区域。术语“恒定”和“可变”是在功能上使用的。就此点而言,应当理解,轻(VL)链和重(VH)链部分的可变结构域都决定抗原识别和特异性。相反,轻链(CL)和重链(CH1、CH2或CH3)的恒定结构域赋予重要的生物学特性,如分泌、跨胎盘的迁移、Fc受体结合、补体结合,等等。按照惯例,恒定区结构域的编号随着其距离抗体的抗原结合部位或氨基端越远而增大。N-端为可变区,C-端为恒定区;CH3和CL结构域实际上分别包含重链和轻链的羧基端。本文所用的短语“抗体片段”指保留与HER3表位特异性相互作用(例如,通过结合、位阻、稳定化/去稳定化、空间分布)和抑制信号转导的能力的抗体的一个或多个部分。结合片段的实例包括但不限于Fab片段,由VL、VH、CL和CH1结构域组成的单价片段;F(ab)2片段——包含在铰链区通过二硫键连接的两个Fab片段的二价片段;由VH和CH1结构域组成的Fd片段;由抗体单条臂的VL和VH结构域组成的Fv片段;dAb片段(Ward等,(1989)Nature341:544-546),其由VH结构域组成;和分离的互补决定区(CDR)。此外,尽管Fv片段的两个结构域VL和VH由分开的基因编码,但可用重组方法,通过合成接头将它们连接,该合成接头使得它们能够制备成单条蛋白质链,其中VL和VH区配对形成单价分子(称为单链Fv(scFv);参阅例如Bird等,(1988)Science242:423-426;和Huston等,(1988)Proc.Natl.Acad.Sci.85:5879-5883)。此类单链抗体也旨在涵盖于术语“抗体片段”之内。可以用本领域技术人员已知的常规技术获得这些抗体片段,以及筛选与完整抗体以相同方式发挥功用的片段。抗体片段也可掺入到单结构域抗体、巨型抗体(maxibody)、微型抗体(minibody)、胞内抗体(intrabody)、双抗体(diabody)、三抗体(triabody)、四抗体(tetrabody)、v-NAR和bis-scFv中(参阅例如Hollinger和Hudson,(2005)NatureBiotechnology23:1126-1136)。抗体片段可移植到基于多肽如III型纤连蛋白(Fn3)的支架中(参阅美国专利号6,703,199,其描述了纤连蛋白多肽单抗体)。抗体片段可掺入到包含一对串联Fv区段(VH-CH1-VH-CH1)的单链分子中,该串联Fv区段与互补轻链多肽一起形成一对抗原结合区(Zapata等,(1995)ProteinEng.8:1057-1062;和美国专利号5,641,870)。术语“表位”包括能够特异性结合免疫球蛋白或以其他方式与分子相互作用的任何蛋白质决定簇。表位决定簇一般由分子的化学活性表面基团,如氨基酸或糖或糖侧链组成,并可具有特异的三维结构特征、以及特异的电荷特征。表位可为“线性”或“构象”表位。术语“线性表位”指这样的表位,其中蛋白质和相互作用分子(如抗体)之间的所有相互作用点沿蛋白质的一级氨基酸序列线性存在(连续的)。一旦确定了抗原上的期望表位,即可以产生针对该表位的抗体,例如使用本发明中所述的技术。备选地,在开发过程中,抗体的产生和表征可阐明有关期望表位的信息。通过此信息,然后可以竞争性地筛选结合相同表位的抗体。实现方法是进行交叉竞争研究,以寻找彼此竞争性结合的抗体,例如竞争结合抗原的抗体。国际专利申请号WO2003/48731中描述了基于抗体的交叉竞争用于“装箱(binning)”抗体的高通量方法。本领域技术人员应当理解,实际上,抗体可特异性结合的任何物质都可以是表位。表位可包含抗体结合的那些残基。术语“构象表位”指这样的表位,其中不连续的氨基酸在三维构象中聚集在一起。在构象表位中,相互作用点出现在蛋白质上彼此分开的氨基酸残基上。在一个实施方案中,该表位是在本说明书的实施例中描述的表位。在一个实施方案中,构象表位由SEQIDNO:1的(i)HER3氨基酸残基265-277和315(结构域2)和(ii)HER3氨基酸残基571、582-584、596-597、600-602、609-615(结构域4)、或其子集定义。本领域技术人员理解,由创造分子形状的残基或侧链所占据的空间有助于决定表位是什么。一般而言,对特定靶抗原特异的抗体将优先识别蛋白质和/或大分子的复杂混合物中的靶抗原上的表位。可使用任意数目的本领域熟知的表位作图技术,鉴定包括表位的给定多肽的区域。见例如MethodsinMolecularBiology,66卷(GlennE.Morris,编,1996)HumanaPress,Totowa,NewJersey中的EpitopeMappingProtocols。例如,可通过如下方式确定线性表位:例如在固相支持物上同时合成大量肽,这些肽对应于蛋白质分子的部分,在肽仍然附着于支持物时使肽与抗体反应。这类技术是本领域已知的,并在例如美国专利号4,708,871;Geysen等人,(1984)Proc.Natl.Acad.Sci.USA8:3998-4002;Geysen等人,(1985)Proc.Natl.Acad.Sci.USA82:78-182;Geysen等人,(1986)Mol.Immunol.23:709-715中描述。类似地,可以例如通过如氢/氘交换、X射线晶体学和二维核磁共振,确定氨基酸的空间构象,从而容易地鉴定构象表位。见例如EpitopeMappingProtocols,上引文。也可用标准抗原性和亲水性图(例如用例如从OxfordMolecularGroup获得的Omiga版本1.0软件程序计算出的那些图),鉴定蛋白质的抗原性区域。此计算机程序利用Hopp/Woods法(Hopp等人,(1981)Proc.Natl.Acad.SciUSA78:3824-3828)确定抗原性谱,利用Kyte-Doolittle技术(Kyte等人,(1982)J.MoI.Biol.157:105-132)确定亲水性图。本文所用的术语“互补位”指,决定与表位结合的结合区的一般结构。此结构影响结合区是否可结合表位和以何种方式结合表位。互补位可指负责抗体或其片段结合抗原决定簇的抗体的抗原性位点。互补位也可以指抗体的独特位及结合表位的互补决定区(CDR)。在一个实施方案中,互补位是与包含SEQIDNO:1的(i)HER3氨基酸残基265-277和315(结构域2)和(ii)HER3氨基酸残基571、582-584、596-597、600-602、609-615(结构域4)或其子集的构象表位结合的抗体区域。在一个实施方案中,互补位是包含CDR序列的抗体区域。在一个实施方案中,互补位包含表1中所列的序列。在一个实施方案中,互补位包含与HER3残基Asn266、Lys267、Leu268、Thr269、Gln271、Glu273、Pro274、Asn275、Pro276、His277、Asn315、Asp571、Pro583、His584、Ala596、Lys597结合的至少一个氨基酸残基。在一个实施方案中,互补位包含与HER3残基Tyr265、Lys267、Leu268、Phe270、Gly582、Pro583、Lys597、Ile600、Lys602、Glu609、Arg611、Pro612、Cys613、His614、Glu615结合的至少一个氨基酸残基。本领域技术人员应当理解,可通过本申请所述的方式测定任何抗体或其变体的互补位。本文所用的短语“单克隆抗体”或“单克隆抗体组合物”指具有基本相同的氨基酸序列或来源于相同的遗传来源的多肽,包括抗体、抗体片段、双特异性抗体等。此术语也包括具有单分子组成的抗体分子的制剂。单克隆抗体组合物展示对特定表位的单一结合特异性和亲和力。本文所用的短语“人抗体”包括具有如下可变区的抗体,其中构架区和CDR区都来自人来源的序列。此外,如果抗体包含恒定区,则该恒定区也来自这样的人序列,例如人种系序列、或人种系序列的突变形式、或含有来自人构架序列分析(例如Knappik等人,(2000)JMolBiol296:57-86)中所述)的共有构架序列的抗体。免疫球蛋白可变结构域(例如CDR)的结构和位置可用熟知的编号方案定义,例如,Kabat编号方案、Chothia编号方案、或Kabat和Chothia的组合(见例如,SequencesofProteinsofImmunologicalInterest,U.S.DepartmentofHealthandHumanServices(1991),Kabat等人编;Lazikani等人,(1997)J.Mol.Bio.273:927-948);Kabat等人,(1991)SequencesofProteinsofImmunologicalInterest,第五版,NIH公开号91-3242U.S.DepartmentofHealthandHumanServices;Chothia等人,(1987)J.Mol.Biol.196:901-917;Chothia等人,(1989)Nature342:877-883;和Al-Lazikani等人,(1997)J.Mol.Biol.273:927-948。本发明的人抗体可包括不由人序列编码的氨基酸残基(例如,通过体外的随机或定点诱变或通过体内的体细胞突变而引入的突变、或保守替换,以促进稳定性或生产)。本文所用的短语“人单克隆抗体”指展示单一结合特异性的抗体,其具有构架区和CDR区都来自人序列的可变区。在一个实施方案中,通过杂交瘤产生人单克隆抗体,该杂交瘤包括从转基因非人动物例如转基因小鼠得到的、与永生细胞融合的B细胞,所述转基因非人动物具有包含人重链转基因和轻链转基因的基因组。本文所用的短语“重组人抗体”包括通过重组手段制备、表达、产生或分离的所有人抗体,例如从人免疫球蛋白基因的转基因或转染色体动物(例如小鼠)或从所述动物制备的杂交瘤分离的抗体,从转化以表达人抗体的宿主细胞(例如从转染瘤(transfectoma))分离的抗体,从重组的组合人抗体文库分离的抗体,和通过涉及将人免疫球蛋白基因、序列的全部或部分剪接至其他DNA序列的任意其他手段制备、表达、产生或分离的抗体。这样的重组人抗体具有如下可变区,其中构架区和CDR区来自人种系免疫球蛋白序列。但是,在某些实施方案中,可对这样的重组人抗体进行体外诱变(或,当使用人Ig序列的转基因动物时进行体内体细胞诱变),从而重组抗体的VH和VL区的氨基酸序列是这样的序列,该序列尽管来自人种系VH和VL序列并与之相关,但可能并不天然存在于体内的人抗体种系库中。两个实体之间的特异性结合是指以至少102M-1、至少5x102M-1、至少103M-1、至少5x103M-1、至少104M-1、至少5x104M-1、至少105M-1、至少5x105M-1、至少106M-1、至少5x106M-1、至少107M-1、至少5x107M-1、至少108M-1、至少5x108M-1、至少109M-1、至少5x109M-1、至少1010M-1、至少5x1010M-1、至少1011M-1、至少5x1011M-1、至少1012M-1、至少5x1012M-1、至少1013M-1、至少5x1013M-1、至少1014M-1、至少5x1014M-1、至少1015M-1、或至少5x1015M-1的平衡常数(KA)(kon/koff)结合。短语“特异性(或选择性)结合”抗体(例如,HER3结合抗体)指,在蛋白质和其它生物产品的异质群体中确定关连抗原(例如人HER3)的存在的结合反应。除上文指出的平衡常数(KA)外,本发明的HER3结合抗体通常还具有低于5x10-2M、低于10-2M、低于5x10-3M、低于10-3M、低于5x10-4M、低于10-4M、低于5x10-5M、低于10-5M、低于5x10-6M、低于10-6M、低于5x10-7M、低于10-7M、低于5x10-8M、低于10-8M、低于5x10-9M、低于10-9M、低于5x10-10M、低于10-10M、低于5x10-11M、低于10-11M、低于5x10-12M、低于10-12M、低于5x10-13M、低于10-13M、低于5x10-14M、低于10-14M、低于5x10-15M、或低于10-15M或更低的解离速率常数(KD)(koff/kon),并且以比其结合非特异性抗原(例如HSA)的亲和力高至少2倍的亲和力结合HER3。在一个实施方案中,抗体或其片段具有低于3000pM、低于2500pM、低于2000pM、低于1500pM、低于1000pM、低于750pM、低于500pM、低于250pM、低于200pM、低于150pM、低于100pM、低于75pM、低于10pM、低于1pM的解离常数(Kd),该解离常数用本文描述或本领域技术人员公知的方法评估(例如,BIAcore测定、ELISA、FACS、SET)(BiacoreInternationalAB,Uppsala,瑞典)。本文所用的术语“Kassoc”或“Ka”指特定抗体-抗原相互作用的结合速率,而本文所用的术语“Kdis”或“Kd”指特定抗体-抗原相互作用的解离速率。本文所用的术语“KD”指解离常数,其从Kd与Ka的比值(即Kd/Ka)获得并表示为摩尔浓度(M)。可使用本领域熟知的方法测定抗体的KD值。用于测定抗体KD的方法是通过使用表面等离振子共振,或使用生物传感器系统如系统。本文所用的术语“亲和力”(affinity)指,抗体与抗原在单个抗原部位上相互作用的强度。在每一抗原部位中,抗体“臂”的可变区与抗原在许多位点上通过弱的非共价力相互作用;相互作用越多,亲和力越强。本文所用的术语“亲合力”(avidity)指抗体-抗原复合物的总体稳定性或强度的信息化量度。它受三个主要因素控制:抗体表位亲和力;抗原与抗体两者的效价;及相互作用部分的结构排列。最终,这些因素决定了抗体的特异性,即特定抗体结合精确抗原表位的可能性。本文所用的术语“效价”指多肽中潜在靶结合部位的数目。每个靶结合部位特异性结合一个靶分子或靶分子上的特异性部位(即表位)。当多肽包含一个以上靶结合部位时,每个靶结合部位可特异性结合相同或不同的分子(例如可结合不同分子,例如不同的抗原,或相同分子上的不同表位)。本文所用的短语“拮抗剂抗体”指结合HER3并中和HER3信号传导的生物活性(例如,在磷酸-HER3或磷酸-Akt测定试验中,例如降低、减少和/或抑制HER3诱导的信号传导活性)的抗体。测定试验的实例在以下实施例中更详细地描述。因此,应当理解,根据本领域公知和本文所述的方法测定的“抑制”一种或多种这些HER3功能特性(例如生化、免疫化学、细胞、生理或其他生物活性,等等)的抗体,涉及相对于在没有抗体时(例如,或当存在具有无关特异性的对照抗体时)所观察到的,特定活性的统计学显著性减少。抑制HER3活性的抗体引起这样的统计上显著的减少,即测量参数的至少10%,至少50%、80%或90%的减少,在某些实施方案中,如由细胞HER3磷酸化水平的降低所展示的,本发明的抗体可抑制超过95%、98%或99%的HER3功能活性。短语“分离的抗体”指,抗体基本不含具有不同抗原特异性的其他抗体(例如,特异性结合HER3的分离的抗体基本不含特异性结合除HER3外的抗原的抗体)。然而,特异性结合HER3的分离的抗体可对其他抗原具有交叉反应性。此外,分离的抗体可基本不含其他细胞物质和/或化学品。短语“保守修饰的变体”适用于氨基酸和核酸序列。对于特定核酸序列,保守修饰的变体指编码相同或基本相同氨基酸序列的那些核酸,或者在核酸不编码氨基酸序列时指基本相同的序列。因为遗传密码的简并性,任何给定的蛋白质可以由大量的功能相同的核酸编码。例如,密码子GCA、GCC、GCG和GCU均编码氨基酸丙氨酸。因此,在由密码子规定丙氨酸的每一位置上,可将该密码子改变成所述任何对应的密码子,而不改变所编码的多肽。此类核酸变异是“沉默变异”,其为保守修饰变异的一种。本文中编码多肽的每一核酸序列也描述该核酸的每一种可能的沉默变异。本领域技术人员将认识到,可修饰核酸中的每一密码子(除了AUG——其通常是甲硫氨酸的唯一密码子,和TGG——其通常是色氨酸的唯一密码子),以产生功能上相同的分子。因此,在每一所述序列中隐含了编码多肽的核酸的每一沉默变异。对于多肽序列,“保守修饰的变体”包括对多肽序列的替换、缺失或添加,其导致用化学上类似的氨基酸对氨基酸进行替换。提供功能上类似的氨基酸的保守替换表为本领域所熟知。此类保守修饰变体还有并且不排除本发明多态性变体、种间同源物和等位基因。以下8组含有互为保守替换的氨基酸:1)丙氨酸(A)、甘氨酸(G);2)天冬氨酸(D)、谷氨酸(E);3)天冬酰胺(N)、谷氨酰胺(Q);4)精氨酸(R)、赖氨酸(K);5)异亮氨酸(I)、亮氨酸(L)、甲硫氨酸(M)、缬氨酸(V);6)苯丙氨酸(F)、酪氨酸(Y)、色氨酸(W);7)丝氨酸(S)、苏氨酸(T);和8)半胱氨酸(C)、甲硫氨酸(M)(参阅例如,Creighton,Proteins(1984))。在一些实施方案中,术语“保守序列修饰”用于指不显著影响或改变含有氨基酸序列的抗体的结合特征的氨基酸修饰。术语“交叉竞争”和“交叉竞争的”在此处可互换使用,意指抗体或其他结合剂在标准的竞争性结合测定试验中干扰其他抗体或结合剂与HER3结合的能力。可使用标准竞争结合测定试验,测定抗体或其他结合剂能够干扰另一抗体或结合分子与HER3结合的能力或程度,从而确定是否可以将之称为本发明的交叉竞争。一种适宜的测定试验涉及使用Biacore技术(例如通过使用BIAcore3000仪器(Biacore,Uppsala,瑞典)),其可以用表面等离振子共振技术测量相互作用的程度。用于测量交叉竞争的另一测定试验使用基于ELISA的方法。本文所用的术语“优化的”指,核苷酸序列已经进行了改变,从而以在生产细胞或生物中优选的密码子编码氨基酸序列,所述生产细胞或生物一般是真核细胞,例如毕赤酵母属(Pichia)细胞、木霉属(Trichoderma)细胞、中国仓鼠卵巢细胞(CHO)或人细胞。可以对该优化的核苷酸序列进行改造,以完全或尽可能多地保留由起始核苷酸序列(也称为“亲本”序列)最初编码的氨基酸序列。用于评价抗体对多个物种的HER3的结合能力的标准试验是本领域公知的,包括例如ELISA、Western印迹和RIA。适宜的测定试验在实施例中详细描述。也可通过本领域公知的标准测定试验,评估抗体的结合动力学(例如结合亲和力),例如通过Biacore分析,或FACS相对亲和力(Scatchard)。在实施例中还详细描述了用于评价抗体对HER3的功能特性的影响的测定试验(例如,受体结合测定试验,调节Her通路)。就两条或更多核酸或多肽序列而言,短语“百分比相同的”或“百分比同一性”指,相同的两条或更多序列或子序列。当两个序列在比较窗中或在指定区域中进行比较和比对以获得最大对应性后,如果这两个序列具有规定百分比的相同氨基酸或核苷酸(即,在特定区域上,或在不指明时在全长序列上,60%同一性,任选地65%、70%、75%、80%、85%、90%、95%或99%同一性),则这两个序列是“基本相同的”,这可以通过使用以下序列比较算法之一或通过手工比对和视觉检查来测定。任选地,同一性存在于长度至少约50个核苷酸(或10个氨基酸)的区域上,或更优选地在长度100到500或1000或更多个核苷酸(或20、50、200或更多个氨基酸)的区域上。对于序列比较,通常一条序列作为参考序列,测试序列与其进行比较。当使用序列比较算法时,将测试和参考序列输入计算机,如果需要,指定子序列坐标,并指定序列算法程序参数。可使用默认程序参数,或可指定备选参数。序列比较算法然后基于程序参数计算测试序列相对于参考序列的百分比序列同一性。本文所用的“比较窗口”包括:提及具有选自20到600、通常约50到约200,更通常约100到约150的任一个连续位置数的区段,在所述窗口中一条序列可以与具有相同连续位置数的参考序列在最佳比对后进行比较。用于比较的序列比对方法为本领域所熟知。例如可以通过Smith和Waterman(1970)Adv.Appl.Math.2:482c的局部同源性算法,通过Needleman和Wunsch,(1970)J.Mol.Biol.48:443的同源性比对算法,通过Pearson和Lipman,(1988)Proc.Nat’l.Acad.Sci.USA85:2444的相似性搜索方法,通过这些算法的计算机化程序(WisconsinGeneticsSoftwarePackage,GeneticsComputerGroup,575ScienceDr.,Madison,WI中的GAP、BESTFIT、FASTA和TFASTA),或通过手工比对和视觉检查(参阅,例如Brent等,(2003)CurrentProtocolsinMolecularBiology),进行序列最佳比对用于比较。适于测定百分比序列同一性和序列相似性的算法的两个实例是BLAST和BLAST2.0算法,其分别描述于Altschul等,(1977)Nuc.AcidsRes.25:3389-3402;和Altschul等,(1990)J.Mol.Biol.215:403-410中。用于进行BLAST分析的软件可通过NationalCenterforBiotechnologyInformation公开获得。此算法涉及:首先通过在查询序列中鉴定长度为W的短字来鉴定高得分序列对(HSP),其中当与数据库序列中相同长度的字比对时,所述短字匹配或满足某一正值阈值得分T。T称为邻近字得分阈值(Altschul等,上文)。这些初始邻近字命中物作为起始搜索的种子,以发现含有它们的更长HSP。只要累积比对得分可增加,这些字命中物就沿每一序列向两个方向延长。对于核苷酸序列,用参数M(一对匹配残基的奖赏得分;总是大于0)和N(错配残基的罚分;总是小于0),计算累积得分。对于氨基酸序列,用得分矩阵来计算累积得分。在如下情况下字命中物在每个方向上的延伸终止:累积比对得分从其最高达到值跌落数量X;累积比对得分因一个或多个负得分残基比对的堆积而到达零或以下;或到达任一序列的末端。BLAST算法参数W、T和X决定比对的灵敏度和速度。BLASTN程序(对于核苷酸序列)使用默认字长(W)11、期望值(E)10、M=5、N=-4和两条链的比较。对于氨基酸序列,BLASTP程序使用默认字长3、期望值(E)10和BLOSUM62得分矩阵(参阅Henikoff和Henikoff,(1989)Proc.Natl.Acad.Sci.USA89:10915)比对(B)50、期望值(E)10、M=5、N=-4和两条链的比较。BLAST算法也进行两条序列之间相似性的统计学分析(参阅例如,Karlin和Altschul,(1993)Proc.Natl.Acad.Sci.USA90:5873-5787)。BLAST算法提供的一种相似性测量是最小总和概率(smallestsumprobability,P(N)),其指示两条核苷酸或氨基酸序列之间偶然发生匹配的概率。例如,如果测试核酸与参考核酸的比较中最小总和概率低于约0.2,更优选低于约0.01,并最优选低于约0.001,那么认为该核酸与参考序列相似。也可使用已经整合入ALIGN程序(版本2.0)的E.Meyers和W.Miller,(1988)Comput.Appl.Biosci.,4:11-17)算法,使用PAM120加权残基表、空位长度罚分12和空位罚分4,测定两条氨基酸序列之间的百分比同一性。此外,可使用已经整合入GCG软件包(可在www.gcg.com上获得)的GAP程序中的Needleman和Wunsch(1970)J.Mol,Biol.48:444-453)算法,使用Blossom62矩阵或PAM250矩阵,以及空位权重16、14、12、10、8、6或4、和长度权重1、2、3、4、5或6,测定两条氨基酸序列之间的百分比同一性。除了上文指出的序列同一性百分比外,两条核酸序列或多肽基本相同的另一指示是,第一核酸编码的多肽与针对第二核酸编码的多肽产生的抗体具有免疫交叉反应性,如下文描述。由此,例如,当一条多肽与第二多肽的差异仅在于保守替换时,则该多肽典型地与第二多肽基本相同。两条核酸序列基本相同的另一指示是,两个分子或其互补序列在严格条件下彼此杂交,如下文描述。两条核酸序列基本相同的再一指示是,可使用相同的引物来扩增该序列。短语“核酸”此处与术语“多核苷酸”可互换使用,并指单链或双链形式的脱氧核糖核苷酸或核糖核苷酸及其聚合物。该术语涵盖含有已知的核苷酸类似物或修饰的骨架残基或键的核酸,其可以为合成的、天然存在的和非天然存在的,其与参考核酸具有相似的结合性质,并且其以与参考核苷酸相似的方式进行代谢。此类类似物的实例包括但不限于硫代磷酸酯、氨基磷酸酯、甲基膦酸酯、手性-甲基膦酸酯、2-O-甲基核糖核苷酸、肽核酸(PNA)。除非另有指出,特定核酸序列也隐含地涵盖其保守修饰的变体(例如简并密码子替换)和互补序列、以及明确指出的序列。尤其是,如下文详细描述,可通过产生如下序列完成简并密码子替换,其中用混和碱基和/或脱氧肌苷残基替换一个或多个选定的(或全部的)密码子的第三个位置(Batzer等,(1991)NucleicAcidRes.19:5081;Ohtsuka等,(1985)J.Biol.Chem.260:2605-2608;和Rossolini等,(1994)Mol.Cell.Probes8:91-98)。短语“有效连接”指两个和更多个多核苷酸(例如DNA)区段之间的功能关系。通常,它指转录调节序列与转录序列之间的功能关系。例如,如果启动子或增强子序列刺激或调节编码序列在适当宿主细胞或其他表达系统中的转录,那么该启动子或增强子序列有效连接至编码序列。一般地,有效连接至转录序列的启动子转录调节序列与转录序列在物理上邻近,即它们是顺式作用。然而,一些转录调节序列,如增强子,不需要与转录被其增加的编码序列在物理上邻近或位于紧靠其的位置。术语“多肽”和“蛋白质”此处互换使用,指氨基酸残基的聚合物。该术语适用于氨基酸聚合物,其中一个或多个氨基酸残基是相应天然存在的氨基酸的人工化学模拟物;该术语还适用于天然存在的氨基酸聚合物和非天然存在的氨基酸聚合物。除非另有指出,特定的多肽序列也隐含地涵盖其保守修饰的变体。术语“个体”包括人和非人动物。非人动物包括所有的脊椎动物,例如哺乳动物和非哺乳动物,如非人灵长类、绵羊、狗、奶牛、鸡、两栖动物和爬行动物。除了被指出,否则术语“患者”或“个体”在本文中可互换使用。术语“抗癌剂”意指可用于治疗细胞增生性疾病(如癌症)的任何药物,包括细胞毒性剂、化疗剂、放射疗法和放射治疗剂、靶向抗癌剂和免疫治疗剂。“肿瘤”指无论是恶性还是良性的赘生性细胞生长和增殖,及所有癌变前和癌变的细胞和组织。“抗肿瘤活性”意指肿瘤细胞的增殖速率、存活力或转移活性的降低。显示抗肿瘤活性的一种可能方式是,显示在治疗期间出现的异常细胞生长速率的下降、或肿瘤大小的稳定性或降低。这种活性可使用公认的体外或体内肿瘤模型评估,包括但不限于异种移植模型、同种异体移植模型、MMTV模型和本领域公知的用于研究抗肿瘤活性的其他已知模型。术语“恶性肿瘤”指非良性肿瘤或癌症。本文所用的术语“癌症”包括表征为失调或失控的细胞生长的恶性肿瘤。示例性癌症包括:癌、肉瘤、白血病和淋巴瘤。术语“癌症”包括原发性恶性肿瘤(例如,其细胞没有迁移到个体体内原始肿瘤部位以外的部位的恶性肿瘤)和继发性恶性肿瘤(例如,通过转移产生的恶性肿瘤,肿瘤细胞迁移至与原始肿瘤部位不同的继发部位)。在以下章节和细分章节中更详细地描述本发明各个方面。HER受体的结构和激活机制所有4种HER受体都具有胞外配体结合结构域、单跨膜结构域和含有细胞质酪氨酸激酶的结构域。HER受体的胞内酪氨酸激酶结构域高度保守,但HER3的激酶结构域含有关键氨基酸的替换并因此缺乏激酶活性(Guy等人,(1994):PNAS91,8132-8136)。配体诱导的HER受体的二聚化诱导激酶激活、C-端尾中的酪氨酸残基上的受体转磷酸作用、及随后的胞内信号传导效应子的募集和激活(Yarden和Sliwkowski,(2001)NatureRev2,127-137;Jorissen等人,(2003)ExpCellRes284,31-53。HER的胞外结构域的晶体结构提供了一些有关配体诱导的受体激活过程的信息(Schlessinger,(2002)Cell110,669-672)。每种HER受体的胞外结构域均由4个亚结构域组成:亚结构域I和III合作形成配体结合部位,而亚结构域II(也许还有亚结构域IV)通过直接的受体-受体相互作用而参与受体二聚化。在结合配体的HER1结构中,亚结构域II中的β发夹(称为二聚化环)与配偶体受体的二聚化环相互作用,介导受体二聚化(Garrett等人,(2002)Cell110,763-773;Ogiso等人,(2002)Cell110,775-787)。相反,在失活的HER1、HER3和HER4的结构中,二聚化环参与和亚结构域IV的分子内相互作用,在没有配体的情况下这阻止了受体二聚化(Cho和Leahy,(2002)Science297,1330-1333;Ferguson等人,(2003)MolCell12,541-552;Bouyan等人,(2005)PNAS102,15024-15029)。HER2的结构在HER中是独特的。在没有配体的情况下,HER2具有与HER1的配体激活态类似的构象,具有突出的二聚化环,可以用于与其他HER受体相互作用(Cho等人,(2003)Nature421,756-760;Garrett等人,(2003)MolCell11,495-505)。这可以解释HER2增强的异源二聚化能力。尽管HER受体晶体结构为HER受体的同源和异源二聚化提供了模型,但一些HER同源和异源二聚体比其他二聚体更普遍的背景(Franklin等人,(2004)CancerCell5,317-328)、以及每个结构域在受体二聚化和自身抑制中的构象作用(Burgess等人,(2003)MolCell12,541-552;Mattoon等人,(2004)PNAS101,923-928)仍然不太清楚。如下文所述,HER3X射线晶体结构提供了更多的信息。HER3结构和构象表位本文提供了抗原结合性蛋白(例如抗HER3抗体)所结合的构象表位。首次显示了与抗体复合的HER3的胞外结构域的截短形式(残基20-640)的三维结构。分别在和的分辨率下测定了HER3-MOR09823Fab复合物和HER3-MOR09825,并在图5A中显示。本文的公开内容也首次显示了结合HER3的失活态并使该受体稳定于失活态的抗体或其片段。本发明的抗体也允许HER3配体(如神经调节蛋白)与HER3受体的同时结合。尽管不必提供理论,一个可能的作用机制模型是HER3典型地以失活(封闭、束缚)或活性(开放)态存在。配体结合诱导了构象变化,使得HER3以能够结合异源二聚体配偶体的活性(开放)态存在,导致下游信号传导的激活。诸如MOR09823的抗体结合HER3的失活(束缚)态但不阻断配体结合部位。诸如MOR09823的抗体通过阻止HER3转变为活性构象所需的配体诱导的结构重排而抑制HER3,从而阻止信号转导。在一个实施方案中,本发明的抗体或其片段结合HER3的失活(束缚)态但不阻断配体结合部位。在另一实施方案中,抗体或其片段通过阻止HER3转变为活性构象所需的配体诱导的结构重排来抑制HER3,从而阻止信号转导。在另一实施方案中,抗体或其片段稳定化(直接地维持、锁住、束缚、保持、优先结合,或促成)处于失活态或失活构象的HER3受体。在一个实施方案中,失活的HER3受体可能易于发生优先内化或降解,这导致细胞表面HER3受体的丧失。实施例章节中展示的生物学数据支持这些实施方案。可通过在合适的宿主细胞中表达编码HER3或其变体的核苷酸序列,然后使纯化的蛋白质在相关HER3靶向的Fab的存在下结晶,制备HER3晶体。优选地,HER3多肽含有胞外结构域(人多肽的氨基酸20至640或其截短形式,优选包含氨基酸20-640),但缺乏跨膜结构域和胞内结构域。也可以将HER3多肽产生为融合蛋白,例如便于提取和纯化。融合蛋白配偶体的实例包括谷胱甘肽-S-转移酶(GST)、组氨酸(HIS)、六聚组氨酸(6HIS)、GAL4(DNA结合和/或转录活化结构域)和β-半乳糖苷酶。也可方便地在融合蛋白配偶体和目的蛋白质序列之间加入蛋白水解切割位点,以允许去除融合蛋白序列。表达后,可纯化和/或浓缩蛋白质,例如通过固定化金属亲和层析、离子交换层析和/或凝胶过滤。可用本文描述的技术结晶蛋白质。通常,在结晶过程中,将含有蛋白质溶液的液滴与结晶缓冲液混合,并允许在密封的容器中平衡。可通过公知的技术例如“悬滴”或“坐滴”法实现平衡。在这些方法中,液滴悬挂在多得多的结晶缓冲液库上方或坐落于其旁边,通过蒸汽扩散达到平衡。备选地,可通过其他方法达到平衡,例如在油下面,通过半渗透膜,或通过自由界面扩散(见例如,Chayen等人,(2008)NatureMethods5,147–153)。一旦得到晶体,即可通过已知的X射线衍射技术解析结构。许多技术使用化学修饰的晶体,如通过重原子衍生至近似相(approximatephases)而修饰的晶体。实际上,在含有重金属原子盐或有机金属化合物(例如氯化铅、硫代苹果酸金、硫柳汞或乙酸双氧铀)的溶液中浸泡晶体,该重金属原子盐或有机金属化合物可通过晶体扩散并与蛋白质表面结合。然后可通过对浸泡的晶体的X射线衍射分析,测定结合的重金属原子的位置。可通过数学方程解析晶体原子(散射中心)衍射X射线单色光束得到的谱,以得到数学坐标。用衍射数据来计算晶体重复单位的电子密度图。得到相信息的另一种方法是使用称为分子替换的技术。在此方法中,对从相关结构得到的检索模型应用旋转和平移算法,得到目的蛋白质的近似定位(见Rossmann,(1990)ActaCrystalsA46,73-82)。用电子密度图来确立各个原子在晶体的晶胞中的位置(Blundel等人,(1976)ProteinCrystallography,AcademicPress)。本公开首次描述了HER3和抗HER3抗体的Fab的三维结构。HER3胞外结构域的大约结构域边界如下:结构域1:氨基酸20-207;结构域2:氨基酸208-328;结构域3:氨基酸329-498;和结构域4:氨基酸499-642。HER3和抗体的三维结构还允许鉴定潜在HER3调节物的靶结合部位。优选的靶结合部位是参与HER3激活的部位。在一个实施方案中,靶结合部位位于HER3的结构域2和结构域4内。因此,与结构域2或结构域4结合及优选地与这两个结构域结合的抗体或其片段可通过阻止这些结构域彼此解离或通过修饰这些结构域的相对位置,调节HER3激活。因此,抗体或其片段与结构域2或结构域4内的氨基酸残基的结合可导致蛋白质采用阻止激活的构象。本文的公开内容还首次显示了可与HER3配体,如神经调节蛋白同时结合的抗体或其片段。在一些实施方案中,抗体或其片段识别HER3的特定构象态,使得抗体或其片段阻止HER3与共同受体(包括但不限于HER1、HER2和HER4)相互作用。在一些实施方案中,抗体或其片段通过稳定化处于失活态或封闭态的HER3受体来阻止HER3与共同受体相互作用。在一个实施方案中,抗体或其片段通过与HER3的结构域2和结构域4内的氨基酸残基结合来稳定化HER3受体。在此失活态中,位于结构域2中的二聚化环未暴露,因此不能用于与其他共同受体(包括但不限于HER1、HER2和HER4)二聚化。在一些实施方案中,抗体或其片段与具有如下构象表位的人HER3蛋白结合,该构象表位包含SEQIDNO:1的(i)(结构域2的)HER3氨基酸残基265-277和315及(ii)(结构域4的)HER3氨基酸残基571、582-584、596-597、600-602、609-615、或其子集。在一些实施方案中,抗体或其片段与SEQIDNO:1的(i)(结构域2的)氨基酸残基265-277和315及(ii)(结构域4的)HER3氨基酸残基571、582-584、596-597、600-602、609-615内的氨基酸或与之重叠的氨基酸结合。在一些实施方案中,抗体或其片段与SEQIDNO:1的(i)(结构域2的)氨基酸265-277和315及(ii)(结构域4的)HER3氨基酸残基571、582-584、596-597、600-602、609-615、或其子集内的氨基酸(和/或由之组成的氨基酸序列)结合。在一些实施方案中,抗体或其片段结合构象表位,使得结构域2和结构域4的移动性受到限制,将其稳定在失活或封闭的构象。不能形成活性构象将导致不能激活信号转导。在一些实施方案中,抗体或其片段结合构象表位,使得结构域2中的二聚化环被封闭,从而使其不能用于受体-受体相互作用。未能形成同源或异源二聚体将导致不能激活信号转导。在另一方面,抗体或其片段结合HER受体(如HER3受体)的构象表位。在一个实施方案中,抗体或其片段将HER3受体稳定在失活态。在另一个实施方案中,抗体或其片段与HER3受体的活性态结合并驱使其变为失活态。因此,抗体或其片段可结合HER3的活性态或失活态,但利于失活态的形成并驱使HER3的活性态变为失活态,导致不能激活信号转导。在另一方面,抗体或其片段结合HER受体(如HER3受体)的构象表位,其中抗体或其片段的结合稳定化处于失活态的HER3受体,使得HER3受体不能与共同受体二聚化形成受体-受体复合物。受体-受体复合物形成的失败将阻止配体依赖性和非配体依赖性信号转导二者的激活。在另一方面,抗体或其片段结合HER受体(如HER3受体)的构象表位,其中抗体或其片段与HER3受体的结合允许与共同受体二聚化以形成失活的受体-受体复合物。失活的受体-受体复合物的形成阻止非配体依赖性信号转导的激活。例如,在非配体依赖性信号转导中,HER3可以以失活态存在,但是HER2的过表达导致HER2-HER3复合物的形成,然而这些得到的复合物是失活的,阻止非配体依赖性信号转导的激活。所示结构也允许鉴定抗体或其片段(例如,MOR09823)与HER3的相互作用界面的特异性核心HER3氨基酸残基。这定义为MOR09823蛋白VH链之内的残基。核心残基如下:Asn266、Lys267、Leu268、Thr269、Gln271、Glu273、Pro274、Asn275、Pro276、His277、Asn315、Asp571、Pro583、His584、Ala596、Lys597。该结构也可用于鉴定与抗体或其片段(例如,MOR09823)相互作用界面的边界HER3氨基酸残基。这些残基可为距MOR09823蛋白VH链的HER3残基。边界残基如下:Pro262、Val264、Tyr265、Phe270、Leu272、Thr278、Lys314、Gly316、Glu321、Asn566、Ser568、Gly569、Ser570、Thr572、Arg580、Asp581、Gly582、Gly595、Gly598、Ile600。所示结构也允许鉴定抗体或其片段(例如,MOR09823)与HER3的相互作用界面的特异性核心HER3氨基酸残基。这定义为MOR09823蛋白VL链之内的残基。核心残基如下:Tyr265、Lys267、Leu268、Phe270、Gly582、Pro583、Lys597、Ile600、Lys602、Glu609、Arg611、Pro612、Cys613、His614、Glu615。该结构也可用于鉴定与抗体或其片段(例如,MOR09823)相互作用界面的边界HER3氨基酸残基。这些残基可为距MOR09823蛋白VL链的HER3残基。边界残基如下:Asn266、Thr269、Asp571、Arg580、Asp581、His584、Pro590、Ala596、Pro599、Tyr601、Tyr603、Asp605、Gln607、Cys610、Asn616、Cys617、Cys621、Gly623、Pro624。如分别可在表11和12(MOR09823)及表13和14(MOR09825)中看到,重链主要参与该抗原结合蛋白与表位的结构域2内氨基酸残基的结合,与结构域4的氨基酸残基具有较少的相互作用,而轻链主要参与与表位的结构域4内氨基酸残基的结合,与结构域2内的氨基酸残基具有较少的相互作用。由此,基于本发明的教导,本领域技术人员可预测抗原结合蛋白的哪些残基和区域可被改变,而不过度干扰抗原结合蛋白结合HER3的能力。测定了核心相互作用界面氨基酸,即具有至少一个距离HER3配偶体蛋白小于或等于的原子的所有氨基酸残基。选择作为核心区截断距离,以允许原子在一个范德华半径加可能的水介导的氢键内。测定了边界相互作用界面氨基酸,即具有至少一个距离HER3配偶体蛋白小于或等于的原子、但不包括在核心相互作用列表中的所有氨基酸残基。在一些实施方案中,结合、掩盖任何上述残基、或阻止MOR09823与任何上述残基相互作用的任何抗原结合蛋白都可用于结合或中和HER3。在一些实施方案中,抗体或其片段结合至少一个以下HER3残基(SEQIDNO:1)或与其相互作用:Asn266、Lys267、Leu268、Thr269、Gln271、Glu273、Pro274、Asn275、Pro276、His277、Asn315、Asp571、Pro583、His584、Ala596、Lys597。在一些实施方案中,抗体及其片段结合至少一个以下HER3残基(SEQIDNO:1)或与其相互作用:Tyr265、Lys267、Leu268、Phe270、Gly582、Pro583、Lys597、Ile600、Lys602、Glu609、Arg611、Pro612、Cys613、His614、Glu615。在一些实施方案中,抗体或其片段结合至少一个以下HER3残基(SEQIDNO:1)或与其相互作用:Asn266、Lys267、Leu268、Thr269、Gln271、Glu273、Pro274、Asn275、Pro276、His277、Asn315、Asp571、Pro583、His584、Ala596、Lys597、Tyr265、Lys267、Leu268、Phe270、Gly582、Pro583、Lys597、Ile600、Lys602、Glu609、Arg611、Pro612、Cys613、His614、Glu615。在一些实施方案中,抗体或其片段结合以下HER3残基(SEQIDNO:1)的组合或与该组合相互作用:Asn266、Lys267、Leu268、Thr269、Gln271、Glu273、Pro274、Asn275、Pro276、His277、Asn315、Asp571、Pro583、His584、Ala596、Lys597、Tyr265、Lys267、Leu268、Phe270、Gly582、Pro583、Lys597、Ile600、Lys602、Glu609、Arg611、Pro612、Cys613、His614、Glu615。在一些实施方案中,抗体或其片段结合所有以下HER3残基(SEQIDNO:1)或与其相互作用:Asn266、Lys267、Leu268、Thr269、Gln271、Glu273、Pro274、Asn275、Pro276、His277、Asn315、Asp571、Pro583、His584、Ala596、Lys597、Tyr265、Lys267、Leu268、Phe270、Gly582、Pro583、Lys597、Ile600、Lys602、Glu609、Arg611、Pro612、Cys613、His614、Glu615。在一些实施方案中,抗体或其片段在一个或多个上述残基的5埃内。在一些实施方案中,抗体或其片段距离一个或多个上述残基5-8埃。在一些实施方案中,抗体或其片段与1、2、3、4、5、6、7、8、9、10、11、12、13、14、15、20、25、30、35、40、45或50个上述残基相互作用、封闭这些残基或在其8埃内。例如,HER3和HER3:MOR09823复合物的3D结构的获得,为更详细地探索其他HER3抗体,提供了框架。HER3的3D结构允许对单克隆抗体的表位进行作图并推测其作用模式,因为有些抑制细胞生长、有些刺激细胞生长、其他对细胞生长没有影响。MOR09823的构象表位已被定位于HER3的结构域2和4。此受体的3D结构的获得将便于确定这些抑制剂的精确作用机制和设计新的方法来干扰HER3受体功能。在一个实施方案中,本发明的抗体结合与MOR09823相同的构象表位。在一些实施方案中,表1中列出的任何抗体所结合的构象表位特别有用。在某些实施方案中,HER3构象表位可用于分离结合HER3的抗体或其片段。在某些实施方案中,HER3构象表位可用于产生结合HER3的抗体或其片段。在某些实施方案中,HER3构象表位可用作免疫原来产生结合HER3构象表位的抗体或其片段。在某些实施方案中,可对动物施用HER3构象表位,随后可从动物中得到结合HER3的抗体。在一些实施方案中,可以通过突变HER3(例如野生型抗原)中的特定残基并测定抗体或其片段是否可结合该突变的HER3蛋白或变体HER3蛋白或测量相对野生型的亲和力变化,从而鉴定含有与抗体接触或被抗体遮盖的残基的结构域/区域。通过产生许多单突变,可鉴定在结合中起直接作用的残基、或足够紧靠抗体以致于突变可影响抗体和抗原之间的结合的残基。通过这些氨基酸的信息,可阐明含有与抗体接触或被抗体掩蔽的残基的抗原(HER3)结构域或区域。使用诸如丙氨酸扫描等已知技术的诱变可帮助定义功能上相关的表位。也可应用使用精氨酸/谷氨酸扫描方案的诱变(见例如,Nanevicz等人,(1995),J.Biol.Chem.270(37):21619-21625和Zupnick等人,(2006),J.Biol.Chem.281(29):20464-20473)。一般而言,用精氨酸和谷氨酸替换(一般单个地)野生型多肽中的氨基酸,这是因为这些氨基酸带电荷且体积大,因此具有在引入突变的抗原区域中破坏抗原结合蛋白和抗原之间的结合的潜力。在野生型抗原中存在的精氨酸替换为谷氨酸。可得到多种这样的单突变体,分析收集的结合结果以确定哪个残基影响结合。可产生一系列突变体HER3抗原,每个突变体抗原具有单突变。可测量每个突变体HER3抗原与多种HER3抗体或其片段的结合并与选定的抗体或其片段结合野生型HER3(SEQIDNO:1)的能力比较。本文所用的抗体或其片段和突变体或变体HER3之间的结合的改变(例如减少或增加)意味着,结合亲和力(例如,通过已知方法,如Biacore检测或下文实施例中所述的基于球珠的测定试验,测量)、EC50的变化,和/或抗原结合蛋白的总结合能力的变化(例如减少)(例如,抗原结合蛋白浓度对抗原浓度的图中Bmax的减少所证明的)。结合的显著改变指示突变的残基涉及与抗体或其片段的结合。在一些实施方案中,结合的显著减少意指,相对于抗体或其片段与野生型HER3(例如,SEQIDNO:1)之间的结合,抗体或其片段与突变体HER3抗原之间的结合亲和力、EC50和/或能力减少10%以上、20%以上、40%以上、50%以上、55%以上、60%以上、65%以上、70%以上、75%以上、80%以上、85%以上、90%以上或95%以上。在一些实施方案中,与野生型HER3蛋白(例如,SEQIDNO:1)相比,抗体或其片段对具有一个或多个(例如,1、2、3、4、5、6、7、8、9、10个或更多个)突变的突变体HER3蛋白的结合显著减少或增加。尽管这些变体形式参照SEQIDNO:1所示的野生型序列来述及,但应理解,在HER3的等位基因变体或剪接变体中氨基酸可不同。本发明也考虑这样的抗体或其片段,其显示对此类HER3的等位基因形式显著改变的结合(例如更低或更高的结合)。除了抗体的一般结构方面,通过结构方法可研究互补位和表位之间的更特异的相互作用。在一个实施方案中,CDR的结构促成互补位,抗体通过该互补位能够与表位结合。可用多种方式测定此互补位的形状。可使用传统的结构检查方法,如NMR或X射线晶体学。这些方法可以检查互补位单独的形状,或在互补位与表位结合时的形状。备选地,可在硅片上(insilico)生成分子模型。可用商业软件包(例如来自Accelrys(SanDiego,Calif.)的InsightII建模软件包)辅助,通过同源建模来生成结构。简言之,可用待查抗体的序列针对已知结构的蛋白质的数据库(如ProteinDataBank)进行检索。在鉴定到具有已知结构的同源蛋白质后,用这些同源蛋白质作为建模模板。可比对每个可能的模板,从而在模板之间产生基于结构的序列比对。然后可将具有未知结构的抗体的序列与这些模板比对,以生成具有未知结构的抗体的分子模型。本领域技术人员理解,存在许多用于在硅片上生成此类结构的备选方法,可以使用其中任一种。例如,可使用类似Hardman等人所述的方法(以美国专利号5,958,708授权),应用QUANTA(PolygenCorp.,Waltham,Mass.)和CHARM(Brooks等人,(1983),J.Comp.Chem.4:187)(在此以其整体引入作为参考)。不仅互补位的形状对确定可能的互补位是否将结合表位以及结合得有多好很重要,而且表位和互补位之间的相互作用本身是变体抗体设计中重要信息的来源。本领域技术人员应当理解,有多种方式可研究此相互作用。一种方式是使用生成的结构模型(也许如上述),然后使用例如InsightII(Accelrys,SanDiego,Calif.)的程序,该程序具有对接模块,能够例如在互补位和其表位之间的构象和定向空间上进行MonteCarlo检索。结果是,能够估计表位与互补位相互作用的位置和如何相互作用。在一个实施方案中,仅用表位的片段或变体来帮助确定相关的相互作用。在一个实施方案中,在互补位和表位之间的相互作用的建模中使用整个表位。通过使用这些建模的结构,能够预测哪个残基在表位和互补位之间的相互作用中最重要。因此,在一个实施方案中,能够容易地选择改变哪个残基以改变抗体的结合特征。例如,从对接模型中可能明显的,互补位中某些残基的侧链可能在空间上阻碍表位的结合,因此将这些残基改变为具有较小侧链的残基可以是有利的。可通过许多方式确定这点。例如,可简单地观察2个模型并基于官能团和接近性估计相互作用。备选地,可如上述进行表位和互补位的重复配对,以得到更有利的能量相互作用。也可针对多种抗体变体测定这些相互作用,以确定抗体可以结合表位的备选方式。也可组合多种模型来确定应当如何改变抗体结构以得到具有期望的特定特征的抗体。可通过多种技术测试上面确定的模型。例如,可用上文讨论的程序测定相互作用能量,以确定进一步检查哪个变体。此外,可以用库仑和范德华相互作用,确定表位和变体互补位的相互作用能量。也可以用定点诱变来观察所预测的抗体结构改变是否真的导致期望的结合特征的改变。备选地,可对表位进行改变,以验证模型是正确的、或确定互补位和表位之间可存在的一般结合主题。本领域技术人员理解,尽管这些模型可以提供制备本实施方案的抗体及其变体所需的指导,但可能仍然期望对硅片上模型进行常规测试,可能地通过体外研究。此外,对本领域技术人员显而易见地,任何修饰也可能对抗体的活性具有额外的副作用。例如,尽管预测导致更强结合的任何改变可诱导更强的结合,但它也可能导致其他结构改变,该其他结构改变可能减少或改变抗体活性。确定是否如此是本领域常规的,并可用多种方式进行。例如,可通过ELISA测试来测试活性。备选地,可通过使用表面等离振子共振设备来测试样品。HER3抗体本发明提供识别HER3的构象表位的抗体。本发明基于如下惊人发现:一类针对HER3的抗体可以阻断配体依赖性和非配体依赖性的HER3信号转导途径二者。表1公开了一类结合HER3的特定构象表位的抗体。在一个实施方案中,抗体抑制配体依赖性和非配体依赖性HER3信号传导。在另一实施方案中,抗体结合HER3并且不阻断HER配体与配体结合部位结合(即配体和抗体都可同时结合HER3)。本发明提供特异性结合HER3蛋白(例如、人和/或食蟹猴HER3)的抗体,该抗体包含具有SEQIDNO:15、33、51、69、87、105、123、141、159、177、195、213、231、249、267、285、303、321、339、357和375的氨基酸序列的VH结构域。本发明提供特异性结合HER3蛋白(例如、人和/或食蟹猴HER3)的抗体,该抗体包含具有SEQIDNO:14、32、50、68、86、104、122、140、158、176、194、212、230、248、266、284、302、320、338、356和374的氨基酸序列的VL结构域。本发明还提供特异性结合HER3蛋白(例如、人和/或食蟹猴HER3)的抗体,该抗体包含具有下文表1中列出的任一VHCDR的氨基酸序列的VHCDR。尤其是,本发明提供特异性结合HER3蛋白(例如、人和/或食蟹猴HER3)的抗体,该抗体包含(或备选地组成是)1、2、3、4、5或更多个具有下文表1中列出的任意VHCDR的氨基酸序列的VHCDR。本发明的其他抗体包括已突变的氨基酸,但在CDR区中与表1所述序列所示的CDR区仍具有至少60、70、80、90、95或98的百分比同一性。在一些实施方案中,抗体包括突变氨基酸序列,其中与表1所述序列所示的CDR区相比时,CDR区中已经突变了不超过1、2、3、4或5个氨基酸,但仍然维持其对原始抗体的表位的特异性。本发明的其他抗体包括已突变的氨基酸,但在构架区中与表1所述序列所示的构架区具有至少60、70、80、90、95或98的百分比同一性。在一些实施方案中,抗体包括突变的氨基酸序列,其中在与表1所述序列所示的构架区相比时,构架区中已经突变了不超过1、2、3、4、5、6或7个氨基酸,但仍然维持其对原始抗体的表位的特异性。本发明还提供核酸序列,其编码特异性结合HER3蛋白(例如、人和/或食蟹猴HER3)的抗体的VH、VL、全长重链和全长轻链。本发明的HER3抗体结合HER3的构象表位,该构象表位包含来自HER3的结构域2和结构域4的氨基酸残基。表1:本发明的HER3抗体的实例本发明的其他抗体包括下述抗体,其中氨基酸或编码氨基酸的核酸已突变,但与表1中所述的序列仍具有至少60、70、80、90、95、96、97、98和99的百分比同一性。在一些实施方案中,其包括突变的氨基酸序列,其中在与表1所述序列所示的可变区相比时,可变区中已突变了不多于1、2、3、4或5个氨基酸,但保留基本相同的治疗活性。因为这些抗体或其片段中的每一个都可结合HER3,故可以“混合和匹配”VH、VL、全长轻链和全长重链序列(氨基酸序列和编码氨基酸序列的核苷酸序列)来产生本发明的其他HER3结合抗体。可用本领域公知的结合测定试验(例如ELISA和在实施例章节中描述的其他测定试验),测试此类“混合和匹配”的HER3结合抗体。在混合和匹配这些链时,应当将来自具体VH/VL配对的VH序列替换为结构相似的VH序列。同样地,应当将来自具体全长重链/全长轻链配对的全长重链序列替换为结构相似的全长重链序列。同样地,应当将来自具体VH/VL配对的VL序列替换为结构相似的VL序列。同样地,应当将来自具体全长重链/全长轻链配对的全长轻链序列替换为结构相似的全长轻链序列。因此,在一方面,本发明提供分离的单克隆抗体或其片段,其具有:包含选自SEQIDNO:15、33、51、69、87、105、123、141、159、177、195、213、231、249、267、285、303、321、339、357和375的氨基酸序列的重链可变区;和包含选自SEQIDNO:14、32、50、68、86、104、122、140、158、176、194、212、230、248、266、284、302、320、338、356和374的氨基酸序列的轻链可变区;其中抗体特异性结合HER3(例如、人和/或食蟹猴HER3)。在另一方面,本发明提供HER3结合抗体,其包含表1中所述的重链和轻链CDR1,CDR2和CDR3、或其组合。抗体的VHCDR1的氨基酸序列在SEQIDNO:2、8、20、26、38、44、56、62、74、80、92、98、110、116、128、134、146、152、164、170、182、188、200、206、218、224、236、242、254、260、272、278、290、296、308、314、326、332、344、350、362和368中显示。抗体的VHCDR2的氨基酸序列在SEQIDNO:3、9、21、27、39、45、57、63、75、81、93、99、111、117、129、135、147、153、165、171、183、189、201、207、219、225、237、243、255、261、273、279、291、297、309、315、327、333、345、351、363和369中显示。抗体的VHCDR3的氨基酸序列在SEQIDNO:4、10、22、28、40、46、58、64、76、82、94、100、112、118、130、136、148、154、166、172、184、190、202、208、220、226、238、244、256、262、274、280、292、298、310、316、328、334、346、352、364和370中显示。抗体的VLCDR1的氨基酸序列在SEQIDNO:5、11、23、29、41、47、59、65、77、83、95、101、113、119、131、137、149、155、167、173、185、191、203、209、221、227、239、245、257、263、275、281、293、299、311、317、329、335、347、353、365和371中显示。抗体的VLCDR2的氨基酸序列在SEQIDNO:6、12、24、30、42、48、60、66、78、84、96、102、114、120、132、138、150、156、168、174、186、192、204、210、222、228、240、246、258、264、276、282、294、300、312、318、330、336、348、354、366和372中显示。抗体的VLCDR3的氨基酸序列在SEQIDNO:7、13、25、31、43、49、61、67、79、85、97、103、115、121、133、139、151、157、169、175、187、193、205、211、223、229、241、247、259、265、277、283、295、301、313、319、331、337、349、355、367和373中显示。用Kabat系统(Kabat等人,(1991)SequencesofProteinsofImmunologicalInterest,第五版,U.S.DepartmentofHealthandHumanServices,NIH公开号91-3242;Chothia等人,(1987)J.Mol.Biol.196:901-917;Chothia等人,(1989)Nature342:877-883;和Al-Lazikani等人,(1997)J.Mol.Biol.273,927-948)描述CDR区。在一个具体实施方案中,结合HER3的抗体包含SEQIDNO:2的重链可变区CDR1、SEQIDNO:3的重链可变区CDR2、SEQIDNO:4的重链可变区CDR3、SEQIDNO:5的轻链可变区CDR1、SEQIDNO:6的轻链可变区CDR2和SEQIDNO:7的轻链可变区CDR3。在一个具体实施方案中,结合HER3的抗体包含SEQIDNO:20的重链可变区CDR1、SEQIDNO:21的重链可变区CDR2、SEQIDNO:22的重链可变区CDR3、SEQIDNO:23的轻链可变区CDR1、SEQIDNO:24的轻链可变区CDR2和SEQIDNO:25的轻链可变区CDR3。在一个具体实施方案中,结合HER3的抗体包含SEQIDNO:38的重链可变区CDR1、SEQIDNO:39的重链可变区CDR2、SEQIDNO:40的重链可变区CDR3、SEQIDNO:41的轻链可变区CDR1、SEQIDNO:42的轻链可变区CDR2和SEQIDNO:43的轻链可变区CDR3。在一个具体实施方案中,结合HER3的抗体包含SEQIDNO:56的重链可变区CDR1、SEQIDNO:57的重链可变区CDR2、SEQIDNO:58的重链可变区CDR3、SEQIDNO:59的轻链可变区CDR1、SEQIDNO:60的轻链可变区CDR2和SEQIDNO:61的轻链可变区CDR3。在一个具体实施方案中,结合HER3的抗体包含SEQIDNO:74的重链可变区CDR1、SEQIDNO:75的重链可变区CDR2、SEQIDNO:76的重链可变区CDR3、SEQIDNO:77的轻链可变区CDR1、SEQIDNO:78的轻链可变区CDR2和SEQIDNO:79的轻链可变区CDR3。在一个具体实施方案中,结合HER3的抗体包含SEQIDNO:92的重链可变区CDR1、SEQIDNO:93的重链可变区CDR2、SEQIDNO:94的重链可变区CDR3、SEQIDNO:95的轻链可变区CDR1、SEQIDNO:96的轻链可变区CDR2和SEQIDNO:97的轻链可变区CDR3。在一个具体实施方案中,结合HER3的抗体包含SEQIDNO:110的重链可变区CDR1、SEQIDNO:111的重链可变区CDR2、SEQIDNO:112的重链可变区CDR3、SEQIDNO:113的轻链可变区CDR1、SEQIDNO:114的轻链可变区CDR2和SEQIDNO:115的轻链可变区CDR3。在一个具体实施方案中,结合HER3的抗体包含SEQIDNO:128的重链可变区CDR1、SEQIDNO:129的重链可变区CDR2、SEQIDNO:130的重链可变区CDR3、SEQIDNO:131的轻链可变区CDR1、SEQIDNO:132的轻链可变区CDR2和SEQIDNO:133的轻链可变区CDR3。在一个具体实施方案中,结合HER3的抗体包含SEQIDNO:146的重链可变区CDR1、SEQIDNO:147的重链可变区CDR2、SEQIDNO:148的重链可变区CDR3、SEQIDNO:149的轻链可变区CDR1、SEQIDNO:150的轻链可变区CDR2和SEQIDNO:151的轻链可变区CDR3。在一个具体实施方案中,结合HER3的抗体包含SEQIDNO:164的重链可变区CDR1、SEQIDNO:165的重链可变区CDR2、SEQIDNO:166的重链可变区CDR3、SEQIDNO:167的轻链可变区CDR1、SEQIDNO:168的轻链可变区CDR2和SEQIDNO:169的轻链可变区CDR3。在一个具体实施方案中,结合HER3的抗体包含SEQIDNO:182的重链可变区CDR1、SEQIDNO:183的重链可变区CDR2、SEQIDNO:184的重链可变区CDR3、SEQIDNO:185的轻链可变区CDR1、SEQIDNO:186的轻链可变区CDR2和SEQIDNO:187的轻链可变区CDR3。在一个具体实施方案中,结合HER3的抗体包含SEQIDNO:200的重链可变区CDR1、SEQIDNO:201的重链可变区CDR2、SEQIDNO:202的重链可变区CDR3、SEQIDNO:203的轻链可变区CDR1、SEQIDNO:204的轻链可变区CDR2和SEQIDNO:205的轻链可变区CDR3。在一个具体实施方案中,结合HER3的抗体包含SEQIDNO:218的重链可变区CDR1、SEQIDNO:219的重链可变区CDR2、SEQIDNO:220的重链可变区CDR3、SEQIDNO:221的轻链可变区CDR1、SEQIDNO:222的轻链可变区CDR2和SEQIDNO:223的轻链可变区CDR3。在一个具体实施方案中,结合HER3的抗体包含SEQIDNO:236的重链可变区CDR1、SEQIDNO:237的重链可变区CDR2、SEQIDNO:238的重链可变区CDR3、SEQIDNO:239的轻链可变区CDR1、SEQIDNO:240的轻链可变区CDR2和SEQIDNO:241的轻链可变区CDR3。在一个具体实施方案中,结合HER3的抗体包含SEQIDNO:254的重链可变区CDR1、SEQIDNO:255的重链可变区CDR2、SEQIDNO:256的重链可变区CDR3、SEQIDNO:257的轻链可变区CDR1、SEQIDNO:258的轻链可变区CDR2和SEQIDNO:259的轻链可变区CDR3。在一个具体实施方案中,结合HER3的抗体包含SEQIDNO:272的重链可变区CDR1、SEQIDNO:273的重链可变区CDR2、SEQIDNO:274的重链可变区CDR3、SEQIDNO:275的轻链可变区CDR1、SEQIDNO:276的轻链可变区CDR2和SEQIDNO:277的轻链可变区CDR3。在一个具体实施方案中,结合HER3的抗体包含SEQIDNO:290的重链可变区CDR1、SEQIDNO:291的重链可变区CDR2、SEQIDNO:292的重链可变区CDR3、SEQIDNO:293的轻链可变区CDR1、SEQIDNO:294的轻链可变区CDR2和SEQIDNO:295的轻链可变区CDR3。在一个具体实施方案中,结合HER3的抗体包含SEQIDNO:308的重链可变区CDR1、SEQIDNO:309的重链可变区CDR2、SEQIDNO:310的重链可变区CDR3、SEQIDNO:311的轻链可变区CDR1、SEQIDNO:312的轻链可变区CDR2和SEQIDNO:313的轻链可变区CDR3。在一个具体实施方案中,结合HER3的抗体包含SEQIDNO:326的重链可变区CDR1、SEQIDNO:327的重链可变区CDR2、SEQIDNO:328的重链可变区CDR3、SEQIDNO:329的轻链可变区CDR1、SEQIDNO:330的轻链可变区CDR2和SEQIDNO:331的轻链可变区CDR3。在一个具体实施方案中,结合HER3的抗体包含SEQIDNO:344的重链可变区CDR1、SEQIDNO:345的重链可变区CDR2、SEQIDNO:346的重链可变区CDR3、SEQIDNO:347的轻链可变区CDR1、SEQIDNO:348的轻链可变区CDR2和SEQIDNO:349的轻链可变区CDR3。在一个具体实施方案中,结合HER3的抗体包含SEQIDNO:362的重链可变区CDR1、SEQIDNO:363的重链可变区CDR2、SEQIDNO:364的重链可变区CDR3、SEQIDNO:365的轻链可变区CDR1、SEQIDNO:366的轻链可变区CDR2和SEQIDNO:367的轻链可变区CDR3。在一个具体实施方案中,结合HER3的抗体包含SEQIDNO.15的VH和SEQIDNO:14的VL。在一个具体实施方案中,结合HER3的抗体包含SEQIDNO:33的VH和SEQIDNO:32的VL。在一个具体实施方案中,结合HER3的抗体包含SEQIDNO:51的VH和SEQIDNO:50的VL。在一个具体实施方案中,结合HER3的抗体包含SEQIDNO:69的VH和SEQIDNO:68的VL。在一个具体实施方案中,结合HER3的抗体包含SEQIDNO:87的VH和SEQIDNO:86的VL。在一个具体实施方案中,结合HER3的抗体包含SEQIDNO:105的VH和SEQIDNO:104的VL。在一个具体实施方案中,结合HER3的抗体包含SEQIDNO:123的VH和SEQIDNO:122的VL。在一个具体实施方案中,结合HER3的抗体包含SEQIDNO:141的VH和SEQIDNO:140的VL。在一个具体实施方案中,结合HER3的抗体包含SEQIDNO:159的VH和SEQIDNO:158的VL。在一个具体实施方案中,结合HER3的抗体包含SEQIDNO:177的VH和SEQIDNO:176的VL。在一个具体实施方案中,结合HER3的抗体包含SEQIDNO:195的VH和SEQIDNO:194的VL。在一个具体实施方案中,结合HER3的抗体包含SEQIDNO:213的VH和SEQIDNO:212的VL。在一个具体实施方案中,结合HER3的抗体包含SEQIDNO:231的VH和SEQIDNO:230的VL。在一个具体实施方案中,结合HER3的抗体包含SEQIDNO:249的VH和SEQIDNO:248的VL。在一个具体实施方案中,结合HER3的抗体包含SEQIDNO:267的VH和SEQIDNO:266的VL。在一个具体实施方案中,结合HER3的抗体包含SEQIDNO:285的VH和SEQIDNO:284的VL。在一个具体实施方案中,结合HER3的抗体包含SEQIDNO:303的VH和SEQIDNO:302的VL。在一个具体实施方案中,结合HER3的抗体包含SEQIDNO:321的VH和SEQIDNO:320的VL。在一个具体实施方案中,结合HER3的抗体包含SEQIDNO:339的VH和SEQIDNO:338的VL。在一个具体实施方案中,结合HER3的抗体包含SEQIDNO:357的VH和SEQIDNO:356的VL。在一个具体实施方案中,结合HER3的抗体包含SEQIDNO:375的VH和SEQIDNO:374的VL。在一个实施方案中,HER3抗体是拮抗剂抗体。在某些实施方案中,结合HER3的抗体是表1中所述的抗体。在本文中,人抗体可以包含“产生自”或“衍生自”特定种系序列的重链或轻链可变区或全长重链或轻链,其中该抗体的可变区或全长链获自使用人种系免疫球蛋白基因的系统。此类系统包括用目的抗原免疫携带人免疫球蛋白基因的转基因小鼠、或用目的抗原筛选在噬菌体上展示的人免疫球蛋白基因文库。可通过如下方式,鉴定“产生自”或“衍生自”人种系免疫球蛋白序列的人抗体:比较人抗体的氨基酸序列与人种系免疫球蛋白的氨基酸序列,选择与人抗体的序列在序列上最相近(即最高%同一性)的人种系免疫球蛋白序列。“产生自”或“衍生自”特定人种系免疫球蛋白序列的人抗体可含有与种系序列不同的氨基酸,例如由天然存在的体细胞突变或刻意引入的定点突变引起的氨基酸差异。然而,在VH或VL构架区中,选定的人抗体在氨基酸序列上典型地与人种系免疫球蛋白基因编码的氨基酸序列具有至少90%的同一性,并含有这样的氨基酸残基,在与其他物种的种系免疫球蛋白氨基酸序列(例如,鼠种系序列)比较时,所述氨基酸残基将该人抗体鉴定为人的。在某些情况下,人抗体在氨基酸序列上与种系免疫球蛋白基因编码的氨基酸序列具有至少60%、70%、80%、90%、或至少95%、或甚至96%、97%、98%或99%的同一性。通常,重组人抗体与人种系免疫球蛋白基因编码的氨基酸序列在VH或VL构架区中具有不多于10个氨基酸的差异。在某些情况下,人抗体可以与种系免疫球蛋白基因编码的氨基酸序列具有不多于5个,或甚至不多于4、3、2或1个氨基酸的差异。使用Kabat系统,在表2中显示了一系列代表性HER3抗体的不同种系形式(使用VH和VL种系序列)。粗体突出CDR位置。表中对种系序列使用的符号如下:MOR10701-VH_3-07表示MOR10701CDR环在VH种系序列3-07的构架区中(根据Vbase命名),MOR10703-VK_L1表示来自MOR10703的CDR在来自VK_L1的种系构架区中,其中VK是κ轻链。表2:一系列选定的代表性抗体的不同种系形式表3:JH区段SEQIDNO:462JH1WGQGTLVTVSSSEQIDNO:463JH2WGRGTLVTVSSSEQIDNO:464JH3WGQGTMVTVSSSEQIDNO:465JH4WGQGTLVTVSSSEQIDNO:466JH5WGQGTLVTVSSSEQIDNO:467JH6WGQGTTVTVSS表4:JK区段SEQIDNO:468JK1FGQGTKVEIKSEQIDNO:469JK2FGQGTKLEIKSEQIDNO:470JK3FGPGTKVDIKSEQIDNO:471JK4FGGGTKVEIKSEQIDNO:472JK5FGQGTRLEIK可使用VH-种系序列与JH区段的任意组合。组合的代表性实例在表5中显示。表5:VH-种系序列与JH区段的组合的代表性实例可使用VL-种系序列与JK区段的任意组合。组合的代表性实例在表6中显示。表6:VK-种系序列与JK区段的组合的代表性实例一旦VH与JH组合以及VK与JK组合后,则可以使用VH或JH与VK或JK的任何组合。在一个实施方案中,对每个抗体,任何VH种系区均可以与任何VK(VL)种系区组合。组合的许多代表性实例在表7中显示。表7:种系序列组合的代表性实例在一个实施方案中,本发明涉及包含序列Xaa1-HCDR1-Xaa2-HCDR2-Xaa3-HCDR3-Xaa4的重链可变区,其中重链HCDR1、HCDR2、HCDR3是选自表1和2的任何重链CDR。仅仅为了举例说明的目的,该序列可以是:Xaa1-SYAMS-Xaa2-AINSQGKSTYYADSVKG-Xaa3-WGDEGFDI-Xaa4(SEQIDNO:493),其中,Xaa1是任意30个氨基酸的构架区;Xaa2是任意14个氨基酸的构架区;Xaa3是任意32个氨基酸的构架区;Xaa4是任意11个氨基酸的构架区。在一个实施方案中,本发明涉及包含序列Xaa1-LCDR1-Xaa2-LCDR2-Xaa3-LCDR3-Xaa4的轻链可变区,其中轻链LCDR1、LCDR2、LCDR3是选自表1和2的任何轻链CDR。仅仅为了举例说明的目的,该序列可以是:Xaa1-RASQGISNWLA-Xaa2-GASSLQS-Xaa3-QQYSSFPTT-Xaa4(SEQIDNO:494),其中,Xaa1是任意23个氨基酸的构架区;Xaa2是任意15个氨基酸的构架区;Xaa3是任意32个氨基酸的构架区;和Xaa4是任意10个氨基酸的构架区。本文公开的抗体可以是单链抗体、双抗体、结构域抗体、纳米抗体和单抗体(unibody)的衍生物。“单链抗体”(scFv)由包含与VH结构域相连的VL结构域的单条多肽链组成,其中VL结构域和VH结构域配对形成单价分子。可根据本领域公知的方法制备单链抗体(见例如,Bird等人,(1988)Science242:423-426和Huston等人,(1988)Proc.Natl.Acad.Sci.USA85:5879-5883)。“双抗体”由两条链组成,每条链包含在同一多肽链上通过短肽接头连接的重链可变区和轻链可变区,其中同一链上的两个区域不彼此配对,而是与另一条链上的互补结构域配对以形成双特异性分子。制备双抗体的方法是本领域公知的(见例如,Holliger等人,(1993)Proc.Natl.Acad.Sci.USA90:6444-6448和Poljak等人,(1994)Structure2:1121-1123)。结构域抗体(dAb)是抗体的小功能性结合单位,对应抗体的重链或轻链的可变区。结构域抗体在细菌、酵母和哺乳动物细胞系统中良好表达。结构域抗体及其产生方法的进一步细节是本领域公知的(见例如,美国专利号6,291,158;6,582,915;6,593,081;6,172,197;6,696,245;欧洲专利0368684&0616640;WO05/035572、WO04/101790、WO04/081026、WO04/058821、WO04/003019和WO03/002609。纳米抗体衍生自抗体的重链。纳米抗体通常包含单个可变结构域和2个恒定结构域(CH2和CH3),并保留原始抗体的抗原结合能力。可通过本领域公知的方法制备纳米抗体(见例如,美国专利号6,765,087、美国专利号6,838,254、WO06/079372)。单抗体(Unibody)由IgG4抗体的一条轻链和一条重链组成。可通过去除IgG4抗体的铰链区制备单抗体。单抗体及其制备方法的进一步细节可见WO2007/059782。同源抗体在另一实施方案中,本发明提供包含与表1中所述的序列同源的氨基酸序列的抗体或其片段,所述抗体结合HER3蛋白(例如,人和/或食蟹猴HER3),并保留表1中所述的那些抗体的期望的功能特性。例如,本发明提供包含重链可变区和轻链可变区的分离的单克隆抗体(或其功能片段),其中重链可变区包含与选自SEQIDNO:15、33、51、69、87、105、123、141、159、177、195、213、231、249、267、285、303、321、339、357和375的氨基酸序列具有至少80%、至少90%或至少95%同一性的氨基酸序列;轻链可变区包含与选自SEQIDNO:14、32、50、68、86、104、122、140、158、176、194、212、230、248、266、284、302、320、338、356和374的氨基酸序列具有至少80%、至少90%或至少95%同一性的氨基酸序列;所述抗体结合HER3(例如,人和/或食蟹猴HER3)并中和HER3的信号传导活性,这可在磷酸化测定试验或HER信号传导的其他测量方法(例如,实施例中所述的磷酸-HER3测定试验、磷酸-Akt测定试验、细胞增殖和配体阻断测定试验)中测量。在本发明的范围内也包括可变重链和可变轻链的亲本核苷酸序列;和为在哺乳动物细胞中表达而优化的全长重和轻链序列。本发明的其他抗体包括已突变的氨基酸或核酸,但与上述序列仍具有至少60、70、80、90、95或98%百分比同一性。在一些实施方案中,其包括突变的氨基酸序列,其中在与上述序列中所示的可变区相比时,已通过氨基酸缺失、插入或替换,突变了可变区中不超过1、2、3、4或5个氨基酸。在其他实施方案中,VH和/或VL氨基酸序列可以与表1中所示的序列具有50%、60%、70%、80%、90%、95%、96%、97%、98%或99%的同一性。在其他实施方案中,除了在不超过1、2、3、4或5个氨基酸位置处具有氨基酸替换外,VH和/或VL氨基酸序列可以相同。可通过诱变(例如定点诱变或PCR介导诱变)获得这样的抗体,该抗体的VH和VL区与表1中所述抗体的VH和VL区具有高(即80%或更高)同一性,然后用本文所述的功能测定法测试所编码的经改变的抗体是否保留功能。在其他实施方案中,重链和/或轻链可变区核苷酸序列与上文所述的序列具有60%、70%、80%、90%、95%、96%、97%、98%或99%的同一性。本文中,两条序列之间的“百分比同一性”是这些序列共有的相同位置数的函数(即%同一性等于相同位置数/位置总数x100),其中考虑为实现两条序列的最佳比对而所需引入的空位数和每一空位的长度。如下文非限制性实例中所述,可用数学算法实现两条序列之间的序列比较和百分比同一性的确定。此外或备选地,本发明的蛋白质序列可进一步用作“查询序列”,针对公共数据库进行搜索,例如以鉴定相关序列。例如,可用Altschul等,(1990)J.Mol.Biol.215:403-10的BLAST程序(版本2.0),进行此类搜索。具有保守修饰的抗体在某些实施方案中,本发明的抗体具有包含CDR1、CDR2和CDR3序列的重链可变区及包含CDR1、CDR2和CDR3序列的轻链可变区,其中这些CDR序列中的一个或多个具有基于本文所述抗体的详述的氨基酸序列或其保守修饰,并且其中该抗体保留本发明HER3结合抗体的期望功能特性。因此,本发明提供分离的HER3单克隆抗体或其片段,其由包含CDR1、CDR2和CDR3序列的重链可变区和包含CDR1、CDR2和CDR3序列的轻链可变区组成,其中:重链可变区CDR1氨基酸序列选自SEQIDNO:2、8、20、26、38、44、56、62、74、80、92、98、110、116、128、134、146、152、164、170、182、188、200、206、218、224、236、242、254、260、272、278、290、296、308、314、326、332、344、350、362和368及其保守修饰;重链可变区CDR2氨基酸序列选自SEQIDNO:3、9、21、27、39、45、57、63、75、81、93、99、111、117、129、135、147、153、165、171、183、189、201、207、219、225、237、243、255、261、273、279、291、297、309、315、327、333、345、351、363和369及其保守修饰;重链可变区CDR3氨基酸序列选自SEQIDNO:4、10、22、28、40、46、58、64、76、82、94、100、112、118、130、136、148、154、166、172、184、190、202、208、220、226、238、244、256、262、274、280、292、298、310、316、328、334、346、352、364和370及其保守修饰;轻链可变区CDR1氨基酸序列选自SEQIDNO:5、11、23、29、41、47、59、65、77、83、95、101、113、119、131、137、149、155、167、173、185、191、203、209、221、227、239、245、257、263、275、281、293、299、311、317、329、335、347、353、365和371及其保守修饰;轻链可变区CDR2氨基酸序列选自SEQIDNO:6、12、24、30、42、48、60、66、78、84、96、102、114、120、132、138、150、156、168、174、186、192、204、210、222、228、240、246、258、264、276、282、294、300、312、318、330、336、348、354、366和372及其保守修饰;轻链可变区CDR3氨基酸序列选自SEQIDNO:7、13、25、31、43、49、61、67、79、85、97、103、115、121、133、139、151、157、169、175、187、193、205、211、223、229、241、247、259、265、277、283、295、301、313、319、331、337、349、355、367和373及其保守修饰;该抗体或其片段特异性结合HER3,并通过抑制HER信号传导途经而中和HER3活性,这可在磷酸化测定试验或HER信号传导的其他测量方法(例如、实施例中所述的磷酸-HER3测定试验、磷酸-Akt测定试验、细胞增殖和配体阻断测定试验)中测量。结合相同表位的抗体本发明提供这样的抗体,所述抗体与表1和图7中所述的HER3结合抗体和相同的表位发生相互作用(例如通过结合、位阻、稳定化/去稳定化、空间分布)。因此,可基于在HER3结合测定试验中与本发明其他抗体交叉竞争(例如以统计学上显著的方式竞争性抑制结合)的能力,鉴定额外的抗体。测试抗体抑制本发明抗体与HER3蛋白(例如,人和/或食蟹猴HER3)结合的能力证明,该测试抗体可与本发明抗体竞争结合HER3;根据非限制性理论,这种抗体可能和与其竞争的抗体结合HER3蛋白上相同或相关(例如,结构上相似或空间上接近)的表位。在某实施方案中,与本发明抗体结合HER3上相同表位的抗体是人单克隆抗体。可按本文所述制备并分离此人单克隆抗体。在一个实施方案中,抗体或其片段结合HER3的结构域2和结构域4二者以维持HER3处于失活构象,这阻止存在于结构域2内的二聚化环的暴露。这阻止了与其他家族成员,如HER1、HER2和HER4的异源二聚化。抗体或其片段抑制配体依赖性和非配体依赖性HER3信号转导。在另一实施方案中,抗体或其片段结合HER3的结构域2和结构域4二者而不阻断HER3配体(如神经调节蛋白)的同时结合。尽管不需要提供理论,但可能的是,抗体或其片段结合HER3的结构域2和结构域4二者,将HER3维持在失活构象但不阻断HER3上的配体结合部位。因此,HER3配体(例如,神经调节蛋白)能够与抗体或其片段同时结合HER3。本发明的抗体或其片段抑制HER3的配体依赖性和非依赖性激活但不阻止配体结合。基于以下原因,这被认为是有利的:(i)因为每种HER3激活机制各驱动不同的肿瘤类型,故相比靶向单种HER3激活机制(即配体依赖性或非配体依赖性)的抗体,本发明治疗性抗体将在广谱肿瘤中具有临床用途。(ii)本发明治疗性抗体将在同时涉及两种HER3激活机制的肿瘤类型中有效。靶向单种HER3激活机制(即配体依赖性或非配体依赖性)的抗体将在这些肿瘤类型中展示低效力或无效力。(iii)对于抑制HER3的配体依赖性激活而不阻止配体结合的抗体,其效力受增加的配体浓度的不良影响的可能性较低。这将转化为在由极高浓度HER3配体驱动的肿瘤类型中的增加的效力、或在HER3配体的上调介导药物抗性的情况下减小的药物抗性倾向。(iv)通过稳定失活形式来抑制HER3激活的抗体将不易产生由HER3激活的旁路机制驱动的药物抗性。因此,本发明的抗体可用于治疗现有治疗性抗体临床无效的病症。改造和修饰的抗体还可用具有一个或多个本文所示VH和/或VL序列的抗体作为起始材料,改造出修饰的抗体,以制备本发明的抗体,所述修饰的抗体可以具有相对于起始抗体改变的性质。可通过修饰一个或两个可变区(即VH和/或VL)内,例如一个或多个CDR区内和/或一个或多个构架区内的一个或多个残基来改造抗体。此外或备选地,可通过修饰恒定区内的残基来改造抗体,例如改变抗体的效应子功能。可以进行的一类可变区改造是CDR移植。抗体主要通过定位在六个重链和轻链互补决定区(CDR)中的氨基酸残基与靶抗原相互作用。为此,CDR内的氨基酸序列在各抗体之间比CDR外的序列更多样化。因为CDR序列负责大部分抗体-抗原相互作用,所以可以通过构建如下表达载体来表达模拟特定天然存在的抗体的性质的重组抗体,其中所述表达载体包括来自该特定天然存在的抗体的CDR序列,该CDR序列移植到来自不同性质的不同抗体的构架序列上(参阅例如,Riechmann等,(1998)Nature332:323-327;Jones等,(1986)Nature321:522-525;Queen等,(1989)Proc.Natl.Acad.,U.S.A.86:10029-10033;Winter的美国专利号5,225,539;和Queen等的美国专利号5,530,101;5,585,089;5,693,762和6,180,370)。因此,本发明的另一实施方案涉及分离的HER3结合单克隆抗体,或其片段,其包含重链可变区和轻链可变区,重链可变区包含具有选自SEQIDNO:2、8、20、26、38、44、56、62、74、80、92、98、110、116、128、134、146、152、164、170、182、188、200、206、218、224、236、242、254、260、272、278、290、296、308、314、326、332、344、350、362和368的氨基酸序列的CDR1序列;具有选自SEQIDNO:3、9、21、27、39、45、57、63、75、81、93、99、111、117、129、135、147、153、165、171、183、189、201、207、219、225、237、243、255、261、273、279、291、297、309、315、327、333、345、351、363和369的氨基酸序列的CDR2序列;具有SEQIDNO:4、10、22、28、40、46、58、64、76、82、94、100、112、118、130、136、148、154、166、172、184、190、202、208、220、226、238、244、256、262、274、280、292、298、310、316、328、334、346、352、364和370的氨基酸序列的CDR3序列;轻链可变区包含具有选自SEQIDNO:5、11、23、29、41、47、59、65、77、83、95、101、113、119、131、137、149、155、167、173、185、191、203、209、221、227、239、245、257、263、275、281、293、299、311、317、329、335、347、353、365和371的氨基酸序列的CDR1序列;具有选自SEQIDNO:6、12、24、30、42、48、60、66、78、84、96、102、114、120、132、138、150、156、168、174、186、192、204、210、222、228、240、246、258、264、276、282、294、300、312、318、330、336、348、354、366和372的氨基酸序列的CDR2序列;和具有选自SEQIDNO:7、13、25、31、43、49、61、67、79、85、97、103、115、121、135、139、151、157、169、175、187、193、205、211、223、229、241、247、259、265、277、283、295、301、313、319、331、337、349、355、367和373的氨基酸序列的CDR3序列。因此,此抗体含有单克隆抗体的VH和VLCDR序列,但可以含有与这些抗体不同的构架序列。可从包括种系抗体基因序列的公共DNA数据库或出版的参考文献中获得此类构架序列。例如,人重链和轻链可变区基因的种系DNA序列可见于“Vase”人种系序列数据库(可在互联网www.mrc-cpe.cam.ac.uk/vbase上获得),以及Kabat等人,(1991)SequencesofProteinsofImmunologicalInterest,第五版,U.S.DepartmentofHealthandHumanServices,NIH公开号91-3242;Chothia等人,(1987)J.Mol.Biol.196:901-917;Chothia等人,(1989)Nature342:877-883;和Al-Lazikani等人,(1997)J.Mol.Biol.273:927-948;Tomlinson等人,(1992)J.fol.Biol.227:776-798;和Cox等人,(1994)Eur.JImmunol.24:827-836;各文献的内容在此明确引入作为参考。用于本发明的抗体的构架序列的实例是与所选本发明抗体使用的构架序列在结构上相似的那些构架序列(例如本发明的单克隆抗体使用的共有序列和/或构架序列)。VHCDR1、2和3序列及VLCDR1、2和3序列可移植到与构架序列所源自的种系免疫球蛋白基因中的序列具有相同序列的构架区上,或者CDR序列可移植到与种系序列相比含有一个或多个突变的构架区上。例如,已经发现,在某些情况下,有利的是,突变构架区内的残基以维持或增强抗体的抗原结合能力(参阅例如,Queen等的美国专利号5,530,101;5,585,089;5,693,762和6,180,370)。另一类可变区修饰是突变VH和/或VLCDR1、CDR2和/或CDR3区内的氨基酸残基,由此改善目的抗体的一种或多种结合性质(例如,亲和力),称为“亲和力成熟”。可进行定点诱变或PCR介导的诱变来引入突变,并在如本文所述以及实施例中提供的体外或体内测定试验中评估对抗体结合或其他目的功能性质的影响。可引入保守修饰(如上文讨论)。突变可以是氨基酸替换、添加或缺失。此外,通常改变CDR区内不超过1、2、3、4或5个残基。因此,在另一实施方案中,本发明提供分离的HER3结合性单克隆抗体,或其片段,其由重链可变区和轻链可变区组成,该重链可变区具有:由选自SEQIDNO:2、8、20、26、38、44、56、62、74、80、92、98、110、116、128、134、146、152、164、170、182、188、200、206、218、224、236、242、254、260、272、278、290、296、308、314、326、332、344、350、362和368的氨基酸序列、或与SEQIDNO:2、8、20、26、38、44、56、62、74、80、92、98、110、116、128、134、146、152、164、170、182、188、200、206、218、224、236、242、254、260、272、278、290、296、308、314、326、332、344、350、362和368相比具有1、2、3、4或5个氨基酸替换、缺失或添加的氨基酸序列组成的VHCDR1区;具有选自SEQIDNO:3、9、21、27、39、45、57、63、75、81、93、99、111、117、129、135、147、153、165、171、183、189、201、207、219、225、237、243、255、261、273、279、291、297、309、315、327、333、345、351、363和369的氨基酸序列、或与SEQIDNO:3、9、21、27、39、45、57、63、75、81、93、99、111、117、129、135、147、153、165、171、183、189、201、207、219、225、237、243、255、261、273、279、291、297、309、315、327、333、345、351、363和369相比具有1、2、3、4或5个氨基酸替换、缺失或添加的氨基酸序列的VHCDR2区;具有选自SEQIDNO:4、10、22、28、40、46、58、64、76、82、94、100、112、118、130、136、148、154、166、172、184、190、202、208、220、226、238、244、256、262、274、280、292、298、310、316、328、334、346、352、364和370的氨基酸序列、或与SEQIDNO:4、10、22、28、40、46、58、64、76、82、94、100、112、118、130、136、148、154、166、172、184、190、202、208、220、226、238、244、256、262、274、280、292、298、310、316、328、334、346、352、364和370相比具有1、2、3、4或5个氨基酸替换、缺失或添加的氨基酸序列的VHCDR3区;具有选自SEQIDNO:5、11、23、29、41、47、59、65、77、83、95、101、113、119、131、137、149、155、167、173、185、191、203、209、221、227、239、245、257、263、275、281、293、299、311、317、329、335、347、353、365和371的氨基酸序列、或与SEQIDNO:5、11、23、29、41、47、59、65、77、83、95、101、113、119、131、137、149、155、167、173、185、191、203、209、221、227、239、245、257、263、275、281、293、299、311、317、329、335、347、353、365和371相比具有1、2、3、4或5个氨基酸替换、缺失或添加的氨基酸序列的VLCDR1区;具有选自SEQIDNO:6、12、24、30、42、48、60、66、78、84、96、102、114、120、132、138、150、156、168、174、186、192、204、210、222、228、240、246、258、264、276、282、294、300、312、318、330、336、348、354、366和372的氨基酸序列、或与SEQIDNO:6、12、24、30、42、48、60、66、78、84、96、102、114、120、132、138、150、156、168、174、186、192、204、210、222、228、240、246、258、264、276、282、294、300、312、318、330、336、348、354、366和372相比具有1、2、3、4或5个氨基酸替换、缺失或添加的氨基酸序列的VLCDR2区;和具有选自SEQIDNO:7、13、25、31、43、49、61、67、79、85、97、103、115、121、135、139、139、151、157、169、175、187、193、205、211、223、229、241、247、259、265、277、283、295、301、313、319、331、337、349、355、367和373的氨基酸序列、或与SEQIDNO:7、13、25、31、43、49、61、67、79、85、97、103、115、121、135、139、139、151、157、169、175、187、193、205、211、223、229、241、247、259、265、277、283、295、301、313、319、331、337、349、355、367和373相比具有1、2、3、4或5个氨基酸替换、缺失或添加的氨基酸序列的VLCDR3区。将抗体片段移植入备选构架或支架可使用多种抗体/免疫球蛋白构架或支架,只要所得到的多肽包括至少一个特异性结合HER3的结合区即可。此类构架或支架包括人免疫球蛋白的5个主要独特型或其片段,并包括其他动物物种的免疫球蛋白,优选具有人源化方面的免疫球蛋白。新的构架、支架和片段不断被本领域技术人员发现和发展出来。在一方面,本发明涉及,用其上可移植本发明CDR的非免疫球蛋白支架产生基于非免疫球蛋白的抗体。可以利用已知的或将来的非免疫球蛋白构架和支架,只要它们包含对靶HER3蛋白质(例如,人和/或食蟹猴HER3)特异的结合区。已知的非免疫球蛋白构架或支架包括,但不限于纤连蛋白(CompoundTherapeutics,Inc.,Waltham,MA)、锚蛋白(MolecularPartnersAG,Zurich,瑞士)、结构域抗体(Domantis,Ltd.,Cambridge,MA,andAblynxnv,Zwijnaarde,比利时)、脂笼蛋白(PierisProteolabAG,Freising,德国)、小模块免疫药物(smallmodularimmuno-pharmaceuticals,TrubionPharmaceuticalsInc.,Seattle,WA)、maxybody(Avidia,Inc.,MountainView,CA)、蛋白A(AffibodyAG,瑞典)和affilin(γ-晶体蛋白或泛素)(ScilProteinsGmbH,Halle,德国)。纤连蛋白支架基于III型纤连蛋白结构域(例如,III型纤连蛋白的第十个模块(10Fn3结构域))。III型纤连蛋白结构域具有分布在两个β折叠之间的7个或8个β链,该两个β折叠自身彼此堆叠在一起形成蛋白质的核心,并还含有将β链彼此连接且暴露在溶剂中的环(与CDR类似)。在β折叠夹心的每一边各具有至少三个这样的环,其中所述边是与β链方向垂直的蛋白质边界(参阅US6,818,418)。这些基于纤连蛋白的支架不是免疫球蛋白,但是总体折叠与骆驼和羊骆IgG中的最小功能抗体片段(包含整个抗原识别单位的重链可变区)十分相近。由于此结构,该非免疫球蛋白抗体模拟抗原结合性质,该抗原结合性质与抗体的抗原结合性质在性质和亲和力上相似。这些支架可用于体外环随机化和改组策略,该策略与体内抗体的亲和力成熟过程相似。这些基于纤连蛋白的分子可用作支架,其中使用标准克隆技术用本发明的CDR替换分子的环区。锚蛋白技术基于将具有锚蛋白来源的重复模块的蛋白质用作携带可变区的支架,该可变区可用于结合不同靶。锚蛋白重复模块是由两个反向平行的α螺旋和β转角组成的33个氨基酸的多肽。通过使用核糖体展示,对可变区的结合可以被极大地优化。Avimers衍生自含有A结构域的天然蛋白质,如HER3。这些结构域天生用于蛋白质-蛋白质相互作用,并且在人中超过250个蛋白质在结构上基于A结构域。Avimers由通过氨基酸接头连接的多个不同的“A结构域”单体(2-10)组成。可用例如美国专利申请公开号20040175756、20050053973、20050048512和20060008844中所述的方法,产生可以结合靶抗原的Avimers。Affibody亲和配体是由三螺旋束组成的小的简单蛋白质,基于蛋白A的一个IgG结合域的支架。蛋白A是来自细菌金黄色葡萄球菌(Staphylococcusaureus)的表面蛋白。该支架结构域由58个氨基酸组成,其中13个用于随机化以产生具有大量配体变体的affibody文库(参阅例如,US5,831,012)。Affibody分子模拟抗体,与抗体150kDa的分子量相比,它们具有6kDa的分子量。尽管其尺寸小,但affibody分子的结合部位与抗体的结合部位类似。Anticalins是PierisProteoLabAG公司开发的产品。它们衍生自脂笼蛋白,脂笼蛋白是一大类小而结实的蛋白质,通常涉及化学敏感的或不溶性的化合物的生理运输或储藏。在人组织或体液中存在几种天然脂笼蛋白。该蛋白质结构使人想起免疫球蛋白,在刚性构架顶上具有高变环。然而,与抗体或其重组片段不同,脂笼蛋白由具有160到180个氨基酸残基的单条多肽链组成,仅比单个免疫球蛋白结构域稍大。构成结合口袋的四环组,显示明显的结构可塑性,并耐受各种侧链。因此该结合部位在专利方法中可被重塑,从而以高亲和力和特异性识别不同形状的规定的靶分子。脂笼蛋白家族的一个蛋白质——欧洲粉蝶(PierisBrassicae)的后胆色素结合蛋白(BBP)——已经用于通过诱变处理该四环组来开发anticalins。描述anticalins的专利申请的一个实例是PCT公开号WO199916873。Affilin分子是设计以对蛋白质和小分子具有特异性亲和力的小的非免疫球蛋白蛋白质。新affilin分子可从两个文库中非常快速地选择,所述文库的每一个基于不同的人源支架蛋白。Affilin分子与免疫球蛋白蛋白质不显示任何结构同源性。目前,利用两种affilin支架,其一是γ晶体蛋白——人结构晶状体蛋白质,另一是“泛素”超家族蛋白质。两种人支架都非常小,显示高的温度稳定性,并几乎抵抗pH改变和变性剂。该高稳定性的主要原因是蛋白质的扩展的β折叠结构。γ晶体蛋白来源的蛋白质的实例描述于WO200104144中,“泛素样”蛋白质的实例描述于WO2004106368中。蛋白质表位模拟物(PEM)是中等大小的环状肽样分子(MW1-2kDa),模拟蛋白质β发夹二级结构——参与蛋白质-蛋白质相互作用的主要二级结构。在一些实施方案中,通过改变Fc区,将Fab转变为沉默的IgG1形式。例如,可将表1中的抗体转变为IgG形式。人抗体或人源化抗体本发明提供特异性结合HER3蛋白质(例如,人和/或食蟹猴/小鼠/大鼠HER3)的全人抗体。与嵌合抗体或人源化抗体相比,在对人个体施用时,本发明的人HER3结合抗体具有进一步降低的抗原性。可用本领域已知的方法,产生人HER3结合抗体。例如,用人工程化技术(humaneeringtechnology),将非人抗体转变成工程化的人抗体。美国专利公开号20050008625描述了一种体内方法,该方法可以用于在抗体中将非人抗体可变区替换为人可变区,同时与非人抗体相比维持相同的结合特征或提供更好的结合特征。该方法依赖于表位引导的、全人抗体对非人参考抗体可变区的替换。所得人抗体一般在结构上与参考非人抗体不相关,但与该参考抗体结合相同抗原上的相同表位。简言之,该系列表位引导的互补性替换方法通过如下方式实现:在响应测试抗体结合抗原的报告系统存在下,在细胞中在“竞争者”与参考抗体的多样杂合体文库(“测试抗体”)之间建立对有限量抗原的结合竞争。竞争者可以是参考抗体或其衍生物,如单链Fv片段。竞争者也可以是天然的或人造的抗原配体,其与参考抗体结合相同的表位。对竞争者仅有的要求是,其与参考抗体结合相同的表位,并且其与参考抗体竞争结合抗原。测试抗体具有来自非人参考抗体的一个共同的抗原结合V区、以及从多样化的来源(如全部人抗体的文库)随机选择的其他V区。来自参考抗体的共同V区用作引导,将该测试抗体定位于抗原上的相同表位上,并且采取同一方向,从而使选择偏向于相对于参考抗体的最大抗原结合保真度。许多类型的报告系统可用于检测测试抗体与抗原之间期望的相互作用。例如,可以将互补的报告分子片段分别连接到抗原和测试抗体,这样仅在测试抗体结合抗原时才发生由片段互补导致的报告分子激活。在测试抗体-和抗原-报告分子片段融合物与竞争者共表达时,报告分子的激活将依赖于该测试抗体与竞争者竞争的能力,该能力与该测试抗体对抗原的亲和力成比例。可使用的其他报告系统包括:如美国专利申请系列号10/208,730(公开号20030198971)中公开的、自抑制的报告分子再激活系统(RAIR)的再激活子,或在美国专利申请系列号10/076,845(公开号20030157579)中公开的竞争激活系统。利用系列表位引导的互补替换系统,进行选择,以鉴定表达单个测试抗体与竞争者、抗原和报告分子组分的细胞。在这些细胞中,每一测试抗体一对一地与竞争者竞争结合有限量的抗原。报告分子的活性与结合测试抗体的抗原的量成比例,该抗原量又与测试抗体对抗原的亲和力和测试抗体的稳定性成比例。在表达为测试抗体后,最初地测试抗体以其相对于参考抗体的活性为基础进行选择。第一轮选择的结果是一组“杂合”抗体,其中每一“杂合”抗体都由来自参考抗体的相同非人V区和来自文库的人V区组成,并且每一杂合抗体与参考抗体结合抗原上的相同表位。在第一轮中选择的一个或多个杂合抗体将对抗原具有与参考抗体相当或更高的亲和力。在第二个V区替换步骤中,用在第一步骤中选择的人V区作为指导,用关联人V区的多样化文库替换剩余的非人参考抗体V区,对该人替换物进行选择。第一轮中选择的杂合抗体也可用作第二轮选择的竞争者。第二轮选择的结果是一组全人抗体,其在结构上不同于参考抗体,但与参考抗体竞争结合相同的抗原。一些所选人抗体与参考抗体结合相同抗原上的相同表位。在这些所选人抗体中,一个或多个抗体以与参考抗体相当或比其高的亲和力结合相同表位。用上文所述的一种小鼠或嵌合HER3结合抗体作为参考抗体,可容易地利用该方法来产生以相同的结合特异性及相同或更好的结合亲和力结合人HER3的人抗体。此外,也可从定制生产人抗体的公司,例如KaloBios,Inc.(MountainView,CA),通过商业途径获得此类人HER3结合抗体。驼源(camelid)抗体从骆驼和单峰骆驼(双峰驼(Camelusbactrianus)和单峰驼(Calelusdromaderius))家族的成员,包括新大陆成员如美洲驼物种(羊驼(Lamapaccos)、原驼(Lamaglama)和瘦驼(Lamavicugna)),中获得的抗体蛋白质已经就大小、结构复杂性和对人个体的抗原性方面进行了表征。自然界中发现的来自该哺乳动物家族的某些IgG抗体缺少轻链,并因此在结构上不同于来自其他动物的抗体的具有两条重链和两条轻链的典型四链四级结构。参阅PCT/EP93/02214(1994年3月3日公开的WO94/04678)。可通过遗传改造,获得鉴定为VHH的驼源抗体的区域——小的单个可变结构域,以产生对靶具有高亲和力的小蛋白质,得到低分子量的抗体衍生蛋白质,称为“驼源纳米抗体”。参阅1998年6月2日授权的美国专利号5,759,808;还参阅Stijlemans等人,(2004)JBiolChem279:1256-1261;Dumoulin等人,(2003)Nature424:783-788;Pleschberger等人,(2003)BioconjugateChem14:440-448;Cortez-Retamozo等人,(2002)IntJCancer89:456-62;及Lauwereys等人,(1998)EMBOJ17:3512-3520。驼源抗体和抗体片段的工程化文库可以商购获得,例如从Ablynx,Ghent,比利时购得。(例如,US20060115470;Domantis(US20070065440、US20090148434)。如同非人来源的其他抗体一样,可重组改变驼源抗体的氨基酸序列来获得与人序列更相似的序列,即该纳米抗体可以进行“人源化”。因此,驼源抗体对人的天然低抗原性可进一步降低。驼源纳米抗体的分子量为人IgG分子的分子量的大概十分之一,并且该蛋白质物理直径仅几纳米。小尺寸带来的一个结果是,驼源纳米抗体能够结合对较大的抗体蛋白质而言在功能上不可见的抗原部位,即驼源纳米抗体可用作试剂检测在经典免疫技术下为隐藏的抗原,以及用作可能的治疗剂。因此,小尺寸的另一结果是,驼源纳米抗体可通过与靶蛋白质的沟或窄缝中的特定部位的结合而抑制靶蛋白质,并因而可以在性能上更类似于经典的低分子量药物的功能而非经典抗体。低分子量和紧凑的尺寸还导致驼源纳米抗体具有极端热稳定性、抵抗极端pH和蛋白酶解消化的稳定性、以及弱抗原性。另一结果是,驼源纳米抗体容易从循环系统转移到组织,甚至穿过血脑屏障,可治疗影响神经组织的病症。纳米抗体可进一步有利于药物运输跨过血脑屏障。参阅2004年8月19日公开的美国专利申请20040161738。这些特征与对人的低抗原性组合指示了巨大的治疗潜能。另外,这些分子可在原核细胞,如大肠杆菌(E.coli)中充分表达,并可以用噬菌体表达为融合蛋白,且是有功能的。因此,本发明的一个方面是,对HER3具有高亲和力的驼源抗体或纳米抗体。在本文的某些实施方案中,驼源抗体或纳米抗体在驼类动物中天然产生,即使用本文针对其他抗体所述的技术,用HER3或其肽片段免疫驼类动物后由驼类动物产生。备选地,可以工程化构建结合HER3的驼源纳米抗体,即通过选择而产生,例如,如本文实施例中所述,用HER3作为靶标,使用淘选方案,从适当诱变处理的驼源纳米抗体蛋白质的噬菌体展示文库中选择。可通过遗传改造,进一步定制工程化纳米抗体,以在受体个体中具有从45分钟到两周的半衰期。在一个具体实施方案中,如例如PCT/EP93/02214中所述,通过将本发明人抗体的重链或轻链的CDR序列移植入纳米抗体或单结构域抗体构架序列中,获得驼源抗体或纳米抗体。在一个实施方案中,驼源抗体或纳米抗体与以下HER3残基中的至少一个结合:Asn266、Lys267、Leu268、Thr269、Gln271、Glu273、Pro274、Asn275、Pro276、His277、Asn315、Asp571、Pro583、His584、Ala596、Lys597。在一个实施方案中,驼源抗体或纳米抗体与以下HER3残基中的至少一个结合:Tyr265、Lys267、Leu268、Phe270、Gly582、Pro583、Lys597、Ile600、Lys602、Glu609、Arg611、Pro612、Cys613、His614、Glu615。双特异性分子和多价抗体在另一方面,本发明涉及包含本发明的HER3结合抗体或其片段的双互补位、双特异性或多特异性分子。本发明的抗体或其片段可衍生或连接至另一功能分子,例如另一肽或蛋白质(例如,另一抗体或受体的配体),以产生结合至少两个不同结合部位或靶分子的双特异性分子。本发明的抗体可实际上衍生或连接至一种以上的其他功能分子,以产生结合两个以上不同结合部位和/或靶分子的双互补位或多特异性分子;此类双互补位或多特异性分子。为了产生本发明的双特异性分子,本发明的抗体可功能性地连接(例如,通过化学偶联、遗传融合、非共价结合或其他方式)一个或多个其他结合分子,如另一抗体、抗体片段、肽或结合模拟物,由此产生双特异性分子。可以通过在一个抗体内结合2个或更多个抗原,提供另外的临床益处(Coloma等人,(1997);Merchant等人,(1998);Alt等人,(1999);Zuo等人,(2000);Lu等人,(2004);Lu等人,(2005);Marvin等人,(2005);Marvin等人,(2006);Shen等人,(2007);Wu等人,(2007);Dimasi等人,(2009);Michaelson等人,(2009)).(Morrison等人,(1997)NatureBiotech.15:159-163;Alt等人(1999)FEBSLetters454:90-94;Zuo等人,(2000)ProteinEngineering13:361-367;Lu等人,(2004)JBC279:2856-2865;Lu等人,(2005)JBC280:19665-19672;Marvin等人,(2005)ActaPharmacologicaSinica26:649-658;Marvin等人,(2006)CurrOpinDrugDiscDevelop9:184-193;Shen等人,(2007)JImmunMethods218:65-74;Wu等人,(2007)NatBiotechnol.11:1290-1297;Dimasi等人,(2009)JMolBiol.393:672-692;和Michaelson等人,(2009)mAbs1:128-141。可使用本领域已知的方法,通过缀合成分结合特异性,制备本发明的双特异性分子。例如,可分开产生双特异性分子的每一结合特异性,然后相互缀合。在结合特异性是蛋白质或肽时,可用多种偶联或交联剂来进行共价缀合。交联剂的实例包括蛋白A、碳化二亚胺、N-琥珀酰亚胺基-S-乙酰基-硫代乙酸酯(SATA)、5,5'-二硫代双(2-硝基苯甲酸)(DTNB)、邻-亚苯基二马来酰亚胺(oPDM)、N-琥珀酰亚胺基-3-(2-吡啶基二硫代)丙酸酯(SPDP)、和磺基琥珀酰亚胺基4-(N-马来酰亚胺基甲基)环己烷-1-羧酸酯(磺基-SMCC)(见例如,Karpovsky等人,(1984)J.Exp.Med.160:1686;Liu等人,(1985)Proc.Natl.Acad.Sci.USA82:8648)。其他方法包括在Paulus(1985)BehringIns.Mitt.No.78:118-132;Brennan等人,(1985)Science229:81-83),和Glennie等人,(1987)J.Immunol.139:2367-2375)中描述的那些。缀合剂可以是SATA和磺基-SMCC,两者均可从PierceChemicalCo.(Rockford,IL)获得。在结合特异性是抗体时,它们可通过两条重链的C端铰链区的巯基成键而缀合。在一个具体实施方案中,在缀合之前修饰铰链区,以含有奇数个巯基残基,例如1个。备选地,两种结合特异性可在相同载体中编码,并在相同宿主细胞中表达和装配。在双特异性分子是mAbxmAb、mAbxFab、FabxF(ab')2或配体xFab融合蛋白时,该方法尤其有用。本发明的双特异性分子可以是包含一个单链抗体和一个结合决定簇的单链分子、或包含两个结合决定簇的单链双特异性分子。双特异性分子可包含至少两个单链分子。制备双特异性分子的方法例如在美国专利号5,260,203;美国专利号5,455,030;美国专利号4,881,175;美国专利号5,132,405;美国专利号5,091,513;美国专利号5,476,786;美国专利号5,013,653;美国专利号5,258,498;和美国专利号5,482,858中描述。可以通过例如酶联免疫吸附测定(ELISA)、放射免疫测定(REA)、FACS分析、生物测定(例如生长抑制)、或Western印迹测定,验证双特异性分子与其特异性靶标的结合。这些测定法一般都通过利用对目的蛋白质-抗体复合物特异的标记试剂(例如抗体)来检测特别感兴趣的蛋白质-抗体复合物的存在。另一方面,本发明提供多价化合物,其包含本发明的结合HER3的抗体的至少两个相同或不同的片段。该抗体片段可通过蛋白质融合或共价或非共价键而连接在一起。例如,可以通过用结合本发明抗体的恒定区(例如Fc或铰链区)的抗体来交联本发明的抗体,获得四价化合物。三聚化结构域例如在Borean专利EP1012280B1中描述。五聚化模块例如在PCT/EP97/05897中描述。在一个实施方案中,双互补位/双特异性分子结合HER3的结构域2和结构域4内的氨基酸残基。在另一实施方案中,本发明涉及双功能抗体,其中单个单克隆抗体经修饰,使得抗原结合部位结合一个以上抗原,如结合HER3和另一抗原(例如,HER1、HER2和HER4)二者的双功能抗体。在另一个实施方案中,本发明涉及靶向具有相同构象的抗原(例如与处于“封闭”或“失活”态的HER3具有相同构象的抗原)的双功能抗体。与“封闭”或“失活”态的HER3具有相同构象的抗原的实例包括但不限于HER1和HER4。因此,双功能抗体可结合HER3和HER1二者;HER3和HER4二者;或HER1和HER4二者。双功能抗体的双重结合特异性可进一步转化为双重活性、或双重活性抑制。(见例如,JennyBostrom等人,(2009)Science:323;1610-1614)。具有延长的半衰期的抗体本发明提供特异性结合HER3蛋白质的、在体内具有延长的半衰期的抗体。许多因素可影响蛋白质在体内的半衰期。例如,肾过滤、肝代谢、通过蛋白水解酶(蛋白酶)的降解和免疫原性反应(例如,通过抗体对蛋白质的中和,以及通过巨噬细胞和树突状细胞的摄取)。多种策略可用于延长本发明抗体的半衰期。例如,通过化学连接聚乙二醇(PEG)、reCODEPEG、抗体支架、聚唾液酸(PSA)、羟乙基淀粉(HES)、白蛋白结合配体和糖保护层;通过与结合血清蛋白质如白蛋白、IgG、FcRn并转移的蛋白质遗传融合;通过偶联(遗传上或化学上)到其他结合部分,该其他结合部分结合血清蛋白质,如纳米抗体、Fab、DARPin、avimer、affibody和anticalin;通过遗传融合rPEG、白蛋白、白蛋白的结构域、白蛋白结合蛋白质和Fc;或通过掺入到纳米载体、缓释制剂或医疗设备中。为了延长抗体在体内的血清循环,可使用或不使用多官能接头,通过将PEG位点特异性缀合到抗体N端或C端或通过赖氨酸残基上存在的ε氨基,将惰性聚合物分子(如高分子量PEG)附着到抗体或其片段上。为了聚乙二醇化抗体,抗体或其片段通常与聚乙二醇(PEG)(如PEG的活性酯或醛衍生物)在可以使一个或多个PEG基团附着到抗体或抗体片段的条件下进行反应。可用反应性PEG分子(或类似的反应性水溶性聚合物)通过酰化反应或烷基化反应进行聚乙二醇化。本文所用的术语“聚乙二醇”旨在包括已经用于衍生化其他蛋白质的PEG的任何形式,如单(C1-C10)烷氧基或芳氧基-聚乙二醇或聚乙二醇-马来酰亚胺。在某些实施方案中,待聚乙二醇化的抗体是去糖基化的(aglycosylated)抗体。使用导致生物活性损失最小的线性或分支聚合物衍生化。可通过SDS-PAGE和质谱密切监测缀合的程度,以保证PEG分子与抗体的正确缀合。可通过大小排阻层析或通过离子交换层析从抗体-PEG缀合物中分离未反应的PEG。可使用本领域技术人员熟知的方法,例如通过本文描述的免疫测定试验,测试PEG衍生的抗体的结合活性以及体内功效。聚乙二醇化蛋白质的方法为本领域已知,并可应用于本发明的抗体。参阅例如,Nishimura等的EP0154316和Ishikawa等的EP0401384。其他改良的聚乙二醇化技术包括重构化学正交定向工程化技术(ReCODEPEG),其将化学上规定的侧链通过包括tRNA合成酶和tRNA的重构系统掺入到生物合成蛋白质中。该技术能够在大肠杆菌、酵母和哺乳动物细胞中将多于30个新氨基酸掺入到生物合成蛋白质中。tRNA可以将非天然氨基酸掺入到琥珀密码子定位的任何位置,将琥珀密码子从终止密码子转化成发信号使化学上规定的氨基酸掺入的密码子。重组聚乙二醇化技术(rPEG)也可用于血清半衰期延长。该技术涉及将300-600个氨基酸的无结构蛋白质尾巴遗传融合到现有的药物蛋白质上。因为这种无结构蛋白质链的表观分子量比其实际分子量大大约15倍,所以极大增加了该蛋白质的血清半衰期。与需要化学缀合和再纯化的传统聚乙二醇化不同,该制备方法极其简化并且产品是均质的。多唾液酸化是另一种技术,其用天然聚合物聚唾液酸(PSA)来延长治疗性肽和蛋白质的活性期并提高其稳定性。PSA是唾液酸的聚合物(糖)。在用于蛋白质和治疗性肽药物递送时,聚唾液酸在缀合后提供保护性微环境。这增加了治疗性蛋白质在循环中的活性期并防止其被免疫系统识别。PSA聚合物天然见于人体中。其被某些细菌采用,这些细菌经过超过数百万年的进化,用PSA聚合物包被自身的壁。通过分子拟态,这些天然聚唾液酸化细菌然后能够战胜身体的防御系统。PSA是自然界的终极隐形技术,可容易地从此类细菌大量地并以预定的物理特征产生。细菌PSA是完全非免疫原性的,甚至在与蛋白质偶联时也如此,这是因为它与人体中的PSA在化学上相同。另一技术包括使用羟乙基淀粉(“HES”)衍生物连接抗体。HES是衍生自蜡质玉米淀粉的改性天然聚合物,并可以被身体的酶代谢。一般施用HES溶液来替代不足的血液容量和改善血液的流变学性质。抗体的羟乙基淀粉化通过提高分子的稳定性,以及通过降低肾清除率,使循环半衰期延长,导致提高的生物学活性。通过改变不同的参数,如HES的分子量,可定制广泛多种的HES抗体缀合物。也可通过向IgG恒定结构域或其FcRn结合片段(优选Fc或铰链Fc结构域片段)中引入一个或多个氨基酸修饰(即替换、插入或缺失),产生具有增加的体内半衰期的抗体。参阅例如,国际公开号WO98/23289;国际公开号WO97/34631;和美国专利号6,277,375。另外,抗体可缀合到白蛋白上,以使抗体或抗体片段在体内更稳定或在体内具有更长的半衰期。该技术为本领域所熟知,参阅例如国际公开号WO93/15199、WO93/15200和WO01/77137;和欧洲专利号EP413,622。HER3抗体或其片段也可与一个或多个人血清白蛋白(HSA)多肽或其部分融合。成熟形式的HSA为585个氨基酸的蛋白质,负责血清渗透压的大部分,也充当内源和外源配体的载体。白蛋白作为载体分子的功能及其惰性性质,对于用作多肽的体内载体和转运体而言,是理想的性质。在WO93/15199、WO93/15200和EP413622中已提出将白蛋白以白蛋白融合蛋白组分的形式用作多种蛋白质的载体的用途。也已提出用HSA的N-端片段与多肽融合(EP399666)。因此,通过将抗体或其片段与白蛋白遗传或化学融合或缀合,可稳定或延长储存期,和/或在溶液中、体外和/或体内在延长的时期内保持分子活性。可通过遗传操作实现白蛋白与另一蛋白质的融合,其中编码HSA或其片段的DNA与编码蛋白质的DNA连接。然后用融合的核苷酸序列转化或转染合适的宿主,其中该融合的核苷酸序列被放置在合适的质粒上以便表达融合多肽。可以从例如原核或真核细胞进行体外表达,或从转基因生物进行体内表达。涉及HSA融合的其他方法可见于例如WO2001077137和WO200306007中,在此引入作为参考。在一个具体实施方案中,在哺乳动物细胞系,例如CHO细胞系中进行融合蛋白的表达。在本发明的范围内也考虑抗体与受体在低或高pH下改变的差异结合。例如,通过在抗体的CDR中包括额外的氨基酸(如组氨酸)来修饰抗体,可对抗体的亲和力进行修饰,使得其在低pH(例如溶酶体内的低pH)下保持与其受体结合(见例如,TomoyukiIgawa等人(2010)NatureBiotechnology;28,1203-1207)。抗体缀合物本发明提供特异性结合HER3蛋白的抗体或其片段,该抗体或其片段重组融合或化学缀合(包括共价和非共价缀合)到异源蛋白质或多肽(或其片段,优选至少10、至少20、至少30、至少40、至少50、至少60、至少70、至少80、至少90或至少100个氨基酸的多肽),以产生融合蛋白。尤其是,本发明提供包含本文所述抗体片段(例如,Fab片段、Fd片段、Fv片段、F(ab)2片段、VH结构域、VHCDR、VL结构域或VLCDR)和异源蛋白质、多肽或肽的融合蛋白。用于将蛋白质、多肽或肽融合或缀合到抗体或抗体片段上的方法为本领域所知。参阅例如美国专利号5,336,603、5,622,929、5,359,046、5,349,053、5,447,851和5,112,946;欧洲专利号EP307,434和EP367,166;国际公开号WO96/04388和WO91/06570;Ashkenazi等,(1991),Proc.Natl.Acad.Sci.USA88:10535-10539;Zheng等,(1995),J.Immunol.154:5590-5600;和Vil等,(1992),Proc.Natl.Acad.Sci.USA89:11337-11341。可通过基因改组、基序改组、外显子改组和/或密码子改组(统称为“DNA改组”)技术,产生其他融合蛋白。可利用DNA改组来改变本发明抗体或其片段的活性(例如,具有更高亲和力和更低解离速率的抗体或其片段)。一般参阅美国专利号5,605,793、5,811,238、5,830,721、5,834,252和5,837,458;Patten等,(1997),Curr.OpinionBiotechnol.8:724-33;Harayama,(1998),TrendsBiotechnol.16(2):76-82;Hansson等,(1999),J.Mol.Biol.287:265-76;以及Lorenzo和Blasco,(1998),Biotechniques24(2):308-313(这些专利和出版物中的每一个以其整体引入作为参考)。可在重组之前,通过易错PCR、随机核苷酸插入或其他方法进行随机诱变,改变抗体或其片段、或编码的抗体或其片段。编码特异性结合HER3蛋白质的抗体或其片段的多核苷酸可与一个或多个异源分子的一个或多个组分、基序、节段、部分、结构域、片段等重组。此外,可将抗体或其片段融合到标记序列(如肽)以便于纯化。在优选实施方案中,标记氨基酸序列是六组氨酸肽,如pQE载体(QIAGEN,Inc.,9259EtonAvenue,Chatsworth,CA,91311)中提供的标签等,其中许多是市售的。如Gentz等,(1989),Proc.Natl.Acad.Sci.USA86:821-824中所述,例如,六组氨酸为纯化融合蛋白提供了便利。可用于纯化的其他肽标签包括,但不限于,血凝素(“HA”)标签(对应于源自流感血凝素蛋白质的表位(Wilson等,(1984),Cell37:767))、和“flag”标签。在其他实施方案中,本发明的抗体或其片段与诊断剂或可检测剂缀合。此类抗体可作为临床检查程序的一部分,用于对疾病或病症的起始、发展、进程和/或严重性进行监测或预后,如确定特定疗法的功效。可通过将抗体与可检测物质偶联来实现此类诊断和检测,该可检测物质包括但不限于多种酶,如但不限于辣根过氧化物酶、碱性磷酸酶、β-半乳糖苷酶、或乙酰胆碱酯酶;辅基,如但不限于链霉抗生物素蛋白/生物素和抗生物素蛋白/生物素;荧光物质,如但不限于伞形酮、荧光素、异硫氰酸荧光素、罗丹明、二氯三嗪基胺荧光素、丹磺酰氯或藻红蛋白;发光物质,如但不限于鲁米诺;生物发光物质,如但不限于萤光素酶、萤光素和水母发光蛋白;放射性物质,如但不限于碘(131I、125I、123I和121I)、碳(14C)、硫(35S)、氚(3H)、铟(115In、113In、112In和111In)、锝(99Tc)、铊(201Ti)、镓(68Ga、67Ga)、钯(103Pd)、钼(99Mo)、氙(133Xe)、氟(18F)、153Sm、177Lu、159Gd、149Pm、140La、175Yb、166Ho、90Y、47Sc、186Re、188Re、142Pr、105Rh、97Ru、68Ge、57Co、65Zn、85Sr、32P、153Gd、169Yb、51Cr、54Mn、75Se、113Sn和117Tin;及使用多种正电子发射断层术的正电子发射金属,和非放射性顺磁金属离子。本发明还包括与治疗性部分缀合的抗体或其片段的用途。抗体或其片段可缀合到治疗性部分,如细胞毒素(例如细胞生长抑制剂或细胞杀伤剂),治疗剂或放射性金属离子,例如α粒子发射体。细胞毒素或细胞毒性剂包括对细胞有害的任意物质。另外,抗体或其片段可缀合到修饰给定生物学反应的治疗性部分或药物部分。治疗性部分或药物部分不应解释为限制于经典的化学治疗剂。例如,药物部分可以是具有想要的生物学活性的蛋白质、肽或多肽。此类蛋白质可包括例如,毒素,如相思豆毒蛋白、蓖麻毒蛋白A、假单胞菌外毒素、霍乱毒素或白喉毒素;蛋白质,如肿瘤坏死因子、α-干扰素、β-干扰素、神经生长因子、血小板衍生生长因子、组织纤溶酶原激活物、细胞凋亡剂、抗血管生成剂;或生物应答修饰因子,例如淋巴因子。在一个实施方案中,抗HER3抗体或其片段与治疗性部分(例如细胞毒素、药物(例如免疫抑制剂)或放射性毒素)缀合。这类缀合物在本文中称为“免疫缀合物”。包括一种或多种细胞毒素的免疫缀合物称为“免疫毒素”。细胞毒素或细胞毒性剂包括有害于(例如杀死)细胞的任意物质。实例包括taxon、细胞松弛素B、短杆菌肽D、溴化乙锭、吐根碱、丝裂霉素、依托泊苷、替尼泊苷、长春新碱、长春碱、秋水仙素、阿霉素、柔红霉素、二羟炭疽菌素二酮、米托蒽醌、光神霉素、放线菌素D、1-去氢睾酮、糖皮质激素、普鲁卡因、丁卡因、利多卡因、普萘洛尔和嘌呤霉素及其类似物或同系物。治疗剂也包括,例如,抗代谢物(例如,甲氨蝶呤、6-巯基嘌呤、6-硫鸟嘌呤、阿糖胞苷、5-氟尿嘧啶氮烯咪胺(decarbazine))、ablatingagent(例如,氮芥、塞替派、苯丁酸氮芥、美法仑、卡莫司汀(BSNU)和罗氮芥(CCNU)、环磷酰胺、白消安、二溴甘露醇、链脲霉素、丝裂霉素C和顺-二氯二胺铂(II)(DDP)顺铂、蒽环类(例如,柔红霉素(以前称为诺霉素)和阿霉素)、抗生素(例如,更生菌素(以前称为放线菌素)、博来霉素、光神霉素和氨茴霉素(AMC))和抗有丝分裂剂(例如,长春新碱和长春碱)。(见例如,SeattleGeneticsUS20090304721)。可与本发明的抗体缀合的治疗性细胞毒素的其他实例包括duocarmycin、加利车霉素、美登素(maytansine)和auristatin,及其衍生物。加利车霉素抗体缀合物的实例可购得(MylotargTm;Wyeth-Ayerst)。可用本领域可得的接头技术,将细胞毒素与本发明的抗体缀合。已经用于将细胞毒素与抗体缀合的接头类型的实例包括但不限于腙、硫醚、酯、二硫化物和含肽接头。可选择这样的接头,例如所述接头易于通过溶酶体区室内的低pH切割,或易于通过蛋白酶(如在肿瘤组织中优先表达的蛋白酶,如组织蛋白酶(例如,组织蛋白酶B、C、D))切割。有关细胞毒素、接头的类型和用于将治疗剂与抗体缀合的方法的进一步讨论也可见Saito等人,(2003)Adv.DrugDeliv.Rev.55:199-215;Trail等人,(2003)CancerImmunol.Immunother.52:328-337;Payne,(2003)CancerCell3:207-212;Allen,(2002)Nat.Rev.Cancer2:750-763;Pastan和Kreitman,(2002)Curr.Opin.Investig.Drugs3:1089-1091;Senter和Springer,(2001)Adv.DrugDeliv.Rev.53:247-264。本发明的抗体也可与放射性同位素缀合,以产生细胞毒性放射性药物,又称放射性免疫缀合物。可与抗体缀合用于诊断或治疗的放射性同位素的实例包括但不限于,碘l31、铟111、钇90和镥177。用于制备放射性免疫缀合物的方法为本领域公知。放射性免疫缀合物的实例可购得,包括ZevalinTM(DECPharmaceuticals)和BexxarTM(CorixaPharmaceuticals),并且可用本发明的抗体通过类似的方法来制备放射性免疫缀合物。在某些实施方案中,大环螯合剂是1,4,7,10-四氮杂环十二烷-N,N’,N”,N”’-四乙酸(DOTA),其可通过接头分子附着到抗体上。此类接头分子为本领域公知,并描述于Denardo等,(1998),ClinCancerRes.4(10):2483-90;Peterson等,(1999),Bioconjug.Chem.10(4):553-7;和Zimmerman等,(1999),Nucl.Med.Biol.26(8):943-50中,每一参考文献以其整体引入作为参考。用于将治疗性部分缀合到抗体上的技术是众所周知的,参阅例如Arnon等,“MonoclonalAntibodiesForImmunotargetingOfDrugsInCancerTherapy”,MonoclonalAntibodiesAndCancerTherapy,Reisfeld等(编辑),第243-56页(AlanR.Liss,Inc.1985);Hellstrom等,“AntibodiesForDrugDelivery”,ControlledDrugDelivery(第2版Robinson等(编辑),第623-53页(MarcelDekker,Inc.1987);Thorpe,“AntibodyCarriersOfCytotoxicAgentsInCancerTherapy:AReview”,MonoclonalAntibodies84:BiologicalAndClinicalApplications,Pinchera等(编辑),第475-506页(1985);“Analysis,Results,AndFutureProspectiveOfTheTherapeuticUseOfRadiolabeledAntibodyInCancerTherapy”,MonoclonalAntibodiesForCancerDetectionAndTherapy,Baldwin等(编辑),第303-16页(AcademicPress1985);和Thorpe等,(1982),Immunol.Rev.62:119-58。抗体也可附着到固相支持物上,该固相支持物尤其可以用于靶抗原的免疫测定或纯化。此类固相支持物包括但不限于玻璃、纤维素、聚丙烯酰胺、尼龙、聚苯乙烯、聚氯乙烯或聚丙烯。抗体组合在另一方面,本发明涉及本发明的HER3抗体或其片段与其他治疗剂联用,所述其它治疗剂例如另外的抗体、小分子抑制剂、mTOR抑制剂或PI3激酶抑制剂。实例包括但不限于以下:HER1抑制剂:HER3抗体或其片段可与HER1抑制剂一起使用,HER1抑制剂包括但不限于,马妥珠单抗(EMD72000)、/西妥昔单抗(Imclone)、/帕尼单抗(Amgen)、mAb806和尼妥珠单抗(TheraCIM)、/吉非替尼(Astrazeneca);CI-1033(PD183805)(Pfizer)、拉帕替尼(GW-572016)(GlaxoSmithKline)、/二甲苯磺酸拉帕替尼(SmithKlineBeecham)、/盐酸埃罗替尼(OSI-774)(OSIPharma)、PKI-166(Novartis)和N-[4-[(3-氯-4-氟苯基)氨基]-7-[[(3″S″)-四氢-3-呋喃基]氧]-6-喹唑啉基]-4(二甲氨基)-2-丁烯酰胺(由BoehringerIngelheim以商标名出售)。HER2抑制剂:HER3抗体或其片段可与HER2抑制剂一起使用,HER2抑制剂包括但不限于,帕妥珠单抗(由Genentech以商标出售)、曲妥珠单抗(由Genentech/Roche以商标出售)、MM-111、来那替尼(又称HKI-272,(2E)-N-[4-[[3-氯-4-[(吡啶-2-基)甲氧基]苯基]氨基]-3-氰基-7-乙氧基喹啉-6-基]-4-(二甲氨基)丁-2-烯酰胺,在PCT公开号WO05/028443中描述)、拉帕替尼或二甲苯磺酸拉帕替尼(由GlaxoSmithKline以商标出售)。HER3抑制剂:HER3抗体或其片段可与HER3抑制剂一起使用,HER3抑制剂包括但不限于,MM-121、MM-111、IB4C3、2DID12(U3PharmaAG)、AMG888(Amgen)、AV-203(Aveo)、MEHD7945A(Genentech)和抑制HER3的小分子。HER4抑制剂:HER3抗体或其片段可与HER4抑制剂一起使用。PI3K抑制剂:HER3抗体或其片段可与PI3激酶抑制剂一起使用,PI3激酶抑制剂包括但不限于,4-[2-(1H-吲哚-4-基)-6-[[4-(甲磺酰基)哌嗪-1-基]甲基]噻吩并[3,2-d]嘧啶-4-基]吗啉(又称GDC0941,在PCT公开号WO09/036082和WO09/055730中描述)、2-甲基-2-[4-[3-甲基-2-氧代-8-(喹啉-3-基)-2,3-二氢咪唑并[4,5-c]喹啉-1-基]苯基]丙腈(又称BEZ235或NVP-BEZ235,在PCT公开号WO06/122806中描述)、BMK120和BYL719。mTOR抑制剂:HER3抗体或其片段可与mTOR抑制剂一起使用,mTOR抑制剂包括但不限于,坦罗莫司(由Pfizer以商标名出售)、ridaforolimus(以前称为deferolimus,(1R,2R,4S)-4-[(2R)-2[(1R,9S,12S,15R,16E,18R,19R,21R,23S,24E,26E,28Z,30S,32S,35R)-1,18-二羟-19,30-二甲氧基-15,17,21,23,29,35-六甲基-2,3,10,14,20-五氧代-11,36-二氧杂-4-氮杂三环[30.3.1.04,9]三十六烷-16,24,26,28-四烯-12-基]丙基]-2-甲氧基环己基二甲基膦酸酯,又称deforolimus、AP23573和MK8669(AriadPharm.),在PCT公开号WO03/064383中描述)、依维莫司(RAD001)(由Novartis以商标名出售)。一种或多种治疗剂可与本发明的HER3抗体或其片段同时施用,或在施用本发明的HER3抗体或其片段之前或之后施用。产生本发明抗体的方法(i)编码抗体的核酸本发明提供基本纯化的核酸分子,其编码包含上文所述的HER3结合抗体链的区段或结构域的多肽。本发明的一些核酸包含编码HER3抗体重链可变区的核苷酸序列、和/或编码轻链可变区的核苷酸序列。在一个具体实施方案中,核酸分子是在表1中鉴定的那些核酸分子。本发明的一些其他核酸分子包含与表1中鉴定的那些核酸分子的核苷酸序列基本相同(例如至少65%、80%、95%或99%)的核苷酸序列。在从适当的表达载体表达时,由这些多核苷酸编码的多肽能够显示HER3抗原结合能力。本发明还提供这样的多核苷酸,该多核苷酸编码来自上文所示的HER3结合抗体的重链或轻链的至少一个CDR区以及通常所有三个CDR区。一些其他多核苷酸编码上文所示的HER3结合抗体的重链和/或轻链的所有或基本上所有可变区序列。由于密码子的简并性,每一种免疫球蛋白氨基酸序列可以由多种核酸序列编码。本发明的核酸分子可编码抗体的可变区和恒定区二者。本发明的一些核酸序列包含编码成熟重链可变区序列的核苷酸,该成熟重链可变区序列与表1中所示的HER3抗体的成熟重链可变区序列基本相同(例如,至少80%、90%或99%)。一些其他核酸序列包含编码成熟轻链可变区序列的核苷酸,该成熟轻链可变区序列与表1中所示的HER3抗体的成熟轻链可变区序列基本相同(例如,至少80%、90%或99%)。可通过从头固相DNA合成、或通过对编码HER3结合抗体或其结合片段的现有序列(例如,下文实施例中所述的序列)进行PCR诱变,产生本发明多核苷酸序列。可通过本领域已知的方法实现核酸的直接化学合成,如Narang等,(1979),Meth.Enzymol.68:90的磷酸三酯法;Brown等,(1979)Meth.Enzymol.68:109的磷酸二酯法;Beaucage等,(1981)Tetra.Lett.,22:1859的二乙基亚磷酰胺法;和美国专利号4,458,066的固相支持物法。可按例如PCRTechnology:PrinciplesandApplicationsforDNAAmplification,H.A.Erlich(编辑),FreemanPress,NY,NY,1992;PCRProtocols:AGuidetoMethodsandApplications,Innis等(编辑),AcademicPress,SanDiego,CA,1990;Mattila等,(1991)NucleicAcidsRes.19:967;和Eckert等,(1991)PCRMethodsandApplications1:17中所述,通过PCR向多核苷酸序列中引入突变。本发明还提供用于产生上文所述的HER3结合抗体的表达载体和宿主细胞。可用多种表达载体来表达编码HER3结合抗体链或结合片段的多核苷酸。基于病毒的表达载体和非病毒表达载体都可用于在哺乳动物宿主细胞中产生抗体。非病毒载体和系统包括质粒、游离型载体(通常具有用于表达蛋白质或RNA的表达盒)和人工染色体(参阅例如,Harrington等,(1997)NatGenet15:345)。例如,用于在哺乳动物(例如人)细胞中表达HER3结合多核苷酸和多肽的非病毒载体包括pThioHisA、B&C、pcDNA3.1/His、pEBVHisA、B&C(Invitrogen,SanDiego,CA)、MPSV载体及本领域已知用于表达其他蛋白质的许多其他载体。有用的病毒载体包括基于逆转录病毒、腺病毒、腺伴随病毒、疱疹病毒的载体,基于SV40、乳头瘤病毒、HBPEB病毒、痘苗病毒载体和SemlikiForest病毒(SFV)的载体。参阅,Brent等,(1995)上文;Smith,Annu.Rev.Microbiol.49:807;和Rosenfeld等,(1992)Cell68:143。表达载体的选择依赖于待在其中表达该载体的预期宿主细胞。通常,表达载体含有有效连接编码HER3结合抗体链或片段的多核苷酸的启动子和其他调节序列(例如增强子)。在一些实施方案中,用诱导型启动子来防止插入序列在诱导条件之外的条件下表达。诱导型启动子包括,例如阿拉伯糖、lacZ、金属硫蛋白启动子或热激启动子。可在非诱导条件下扩大转化的生物培养物,而不偏向表达产物能更好地被宿主细胞耐受的编码序列群体。除启动子外,还可能要求或希望将其他调节元件用于HER3结合抗体链或片段的有效表达。这些元件通常包括ATG起始密码子和邻近核糖体结合位点或其他序列。此外,可通过包括适合于所使用的细胞系统的增强子来增强表达的效率(参阅例如,Scharf等,(1994)ResultsProbl.CellDiffer.20:125;和Bittner等,(1987)Meth.Enzymol.,153:516)。例如,SV40增强子或CMV增强子可用于提高哺乳动物宿主细胞中的表达。表达载体也可提供分泌信号序列位置,以与所插入的HER3结合抗体序列编码的多肽形成融合蛋白。更经常地,在包括进入载体之前,将该插入的HER3结合抗体序列与信号序列连接。待用于接受编码HER3结合抗体轻链和重链可变结构域的序列的载体有时也编码恒定区或其部分。此类载体允许可变区表达为与恒定区的融合蛋白,由此导致完整抗体或其片段的产生。通常,此类恒定区是人的恒定区。用于包含和表达HER3结合抗体链的宿主细胞可以是原核细胞或真核细胞。大肠杆菌是可以用于克隆和表达本发明的多核苷酸的一种原核宿主。适于使用的其他微生物宿主包括芽孢杆菌,如枯草芽孢杆菌(Bacillussubtilis),和其他肠杆菌科(enterobacteriaceae),如沙门氏菌属(Salmonella)、沙雷氏菌属(Serratia)和多种假单胞菌属(Pseudomonas)物种。在这些原核宿主中,也可以制备表达载体,其通常含有与宿主细胞相容的表达控制序列(例如复制起点)。此外,可以存在任意数目的众所周知的启动子,如乳糖启动子系统、色氨酸(trp)启动子系统、β-内酰胺酶启动子系统、或来自λ噬菌体的启动子系统。启动子通常,可选地与操纵子序列一起,控制表达,并具有核糖体结合位点序列等,用于起始并完成转录和翻译。其他微生物,如酵母也可用于表达本发明的HER3结合多肽。也可组合使用昆虫细胞与杆状病毒载体。在一些优选实施方案中,哺乳动物宿主细胞用于表达和产生本发明的HER3结合多肽。例如,它们可以是表达内源免疫球蛋白基因的杂交瘤细胞系(例如,实施例中所述的1D6.C9骨髓瘤杂交瘤克隆)或包含外源表达载体的哺乳动物细胞系(例如下文所示例的SP2/0骨髓瘤细胞)。这包括任何正常的非永生的或正常或非正常的永生的动物细胞或人细胞。例如,已经开发了能够分泌完整免疫球蛋白的大量适宜的宿主细胞系,包括CHO细胞系、多种Cos细胞系、HeLa细胞、骨髓瘤细胞系、经转化的B细胞和杂交瘤。有关哺乳动物组织细胞培养物在表达多肽中的应用,一般可以参阅例如Winnacker,FROMGENESTOCLONES,VCHPublishers,N.Y.,N.Y.,1987中的讨论。用于哺乳动物宿主细胞的表达载体可包括表达控制序列,如复制起点、启动子和增强子(参阅例如,Queen等,(1986)Immunol.Rev.89:49-68)、及必要的加工信息位点,如核糖体结合位点、RNA剪接位点、多腺苷酸化位点和转录终止子序列。这些表达载体一般含有源自哺乳动物基因或源自哺乳动物病毒的启动子。合适的启动子可以是组成型的、细胞类型特异型的、阶段特异型的、和/或可调整的或可调节的。有用的启动子包括但不限于金属硫蛋白启动子、组成型腺病毒主要晚期启动子、地塞米松诱导型MMTV启动子、SV40启动子、MRPpolIII启动子、组成型MPSV启动子、四环素诱导型CMV启动子(如人立即早期CMV启动子)、组成型CMV启动子和本领域已知的启动子-增强子组合。用于引入含有目的多核苷酸序列的表达载体的方法根据细胞宿主的类型而不同。例如,氯化钙转染通常用于原核细胞,而磷酸钙处理或电穿孔可用于其他细胞宿主。(一般参阅Sambrook,等,上文)。其他方法包括,例如电穿孔、磷酸钙处理、脂质体介导的转化、注射和显微注射、生物射弹方法、病毒体、免疫脂质体、聚阳离子:核酸缀合物、裸DNA、人工病毒体、与疱疹病毒结构蛋白VP22的融合物(Elliot和O'Hare,(1997)Cell88:223)、DNA的活性剂增强的摄取、和离体转导。对于重组蛋白质的长期高产率产生,通常期望稳定表达。例如,可用含有病毒复制起点或内源表达元件和选择标记基因的本发明表达载体,制备稳定表达HER3结合抗体链或结合片段的细胞系。引入载体后,可以使细胞在富集培养基中生长1-2天,然后转换到选择性培养基。选择标记的目的可以是赋予对选择的抗性,其存在允许成功表达所引入的序列的细胞在选择性培养基中生长。可以用适于该细胞类型的组织培养技术,增殖具有抗性的稳定转染的细胞。(ii)本发明单克隆抗体的产生可通过多种技术来产生单克隆抗体(mAb),包括常规单克隆抗体方法,例如Kohler和Milstein,(1975)Nature256:495的标准体细胞杂交技术。可利用产生单克隆抗体的许多技术,例如,B淋巴细胞的病毒转化或致癌性转化。用于制备杂交瘤的动物系统是鼠系统。在小鼠中产生杂交瘤是已经成熟建立的程序。免疫方案和分离经免疫的脾细胞用于融合的技术为本领域所知。融合配偶体(例如鼠骨髓瘤细胞)和融合程序也是已知的。可在上述制备的鼠单克隆抗体的序列基础上,制备本发明的嵌合抗体或人源化抗体。可用标准分子生物学技术,从目的鼠杂交瘤中获得编码重链和轻链免疫球蛋白的DNA,并进行改造以含有非鼠(例如人)免疫球蛋白序列。例如,为了产生嵌合抗体,可用本领域已知的方法将鼠可变区连接到人恒定区(参阅例如,Cabilly等的美国专利号4,816,567)。为了产生人源化抗体,可用本领域已知的方法将鼠CDR区插入人构架中。参阅例如,Winter的美国专利号5225539和Queen等的美国专利号5530101、5585089、5693762和6180370。在某实施方案中,本发明的抗体是人单克隆抗体。可用携带部分人免疫系统而非小鼠系统的转基因或转染色体小鼠,产生针对HER3的此类人单克隆抗体。这些转基因和转染色体小鼠包括本文分别称为HuMAb小鼠和KM小鼠的小鼠,并在此处统称为“人Ig小鼠”。HuMAb小鼠(Medarex,Inc.)含有编码未重排的人重链(μ和γ)和κ轻链免疫球蛋白序列的人免疫球蛋白基因小基因座(miniloci)、以及失活内源μ和κ链基因座的靶向突变(参阅例如,Lonberg,等,(1994)Nature368(6474):856-859)。因此,该小鼠显示降低表达的小鼠IgM或κ,并且响应免疫时,所引入的人重链和轻链转基因经历类别转换和体细胞突变,以产生高亲和力人IgGκ单克隆抗体(Lonberg,N.等,(1994)上文;综述于Lonberg,(1994)HandbookofExperimentalPharmacology113:49-101;Lonberg和Huszar,(1995)Intern.Rev.Immunol.13:65-93;及Harding和Lonberg,(1995)Ann.N.Y.Acad.Sci.764:536-546中)。HuMAb小鼠的制备和用途以及该小鼠所携带的基因组修饰进一步描述于Taylor等,(1992)NucleicAcidsResearch20:6287-6295;Chen等,(1993)InternationalImmunology5:647-656;Tuaillon等,(1993)Proc.Natl.Acad.Sci.USA94:3720-3724;Choi等,(1993)NatureGenetics4:117-123;Chen等,(1993)EMBOJ.12:821-830;Tuaillon等,(1994)J.Immunol.152:2912-2920;Taylor等,(1994)InternationalImmunology579-591;及Fishwild等,(1996)NatureBiotechnology14:845-851中,所有参考文献的内容在此以其整体明确引入作为参考。进一步参阅Lonberg和Kay的美国专利号5,545,806、5,569,825、5,625,126、5,633,425、5,789,650、5,877,397、5,661,016、5,814,318、5,874,299和5,770,429;Surani等的美国专利号5,545,807;Lonberg和Kay的PCT公开号WO92103918、WO93/12227、WO94/25585、WO97113852、WO98/24884和WO99/45962;及Korman等的PCT公开号WO01/14424。在另一实施方案中,可用在转基因和转染色体上携带人免疫球蛋白序列的小鼠,如携带人重链转基因和人轻链转染色体的小鼠来产生本发明的人抗体。Ishida等的PCT公开WO02/43478中详细描述了本文称为“KM小鼠”的此类小鼠。另外,表达人免疫球蛋白基因的备选转基因动物系统在本领域中可得,并可用于制备本发明的HER3结合抗体。例如,可使用称为Xenomouse(Abgenix,Inc.)的备选转基因系统。例如Kucherlapati等的美国专利号5,939,598、6,075,181、6,114,598、6,150,584和6,162,963中描述了此类小鼠。此外,表达人免疫球蛋白基因的备选转染色体动物系统在本领域中可得,并可用于制备本发明的HER3结合抗体。例如,可使用称为“TC小鼠”的携带人重链转染色体和人轻链转染色体二者的小鼠;Tomizuka等,(2000)Proc.Natl.Acad.Sci.USA97:722-727中描述了此类小鼠。此外,携带人重链和轻链转染色体的奶牛在本领域中已有描述(Kuroiwa等,(2002)NatureBiotechnology20:889-894),并可用于制备本发明的HER3结合抗体。也可以用噬菌体展示法筛选人免疫球蛋白基因文库,制备本发明的人单克隆抗体。用于分离人抗体的此类噬菌体展示法在本领域中已经建立或在下文实施例中描述。参阅例如:Ladner等的美国专利号5,223,409、5,403,484和5,571,698;Dower等的美国专利号5,427,908和5,580,717;McCafferty等的美国专利号5,969,108和6,172,197;及Griffiths等的美国专利号5,885,793、6,521,404、6,544,731、6,555,313、6,582,915和6,593,081。也可用SCID小鼠制备本发明的人单克隆抗体,在该SCID小鼠中,已经重构了人免疫细胞,使得可在免疫后产生人抗体应答。例如Wilson等的美国专利号5,476,996和5,698,767中描述了此类小鼠。(iii)构架或Fc改造本发明的改造(工程化)抗体包括其中VH和/或VL内的构架残基已被修饰例如以改善抗体性质的那些抗体。通常进行这类构架修饰来降低抗体的免疫原性。例如,一种方法是将一个或多个构架残基“回复突变”成相应的种系序列。更具体而言,已经经历了体细胞突变的抗体可以含有不同于该抗体所衍生自的种系序列的构架残基。可通过比较抗体构架序列与该抗体所衍生自的种系序列来鉴定此类残基。为了将构架区序列恢复成它们的种系构型,可以例如通过定点诱变来将体细胞突变“回复突变”到种系序列。此类“回复突变的”抗体也旨在包括在本发明内。另一类型的构架修饰涉及突变构架区,或甚至一个或多个CDR区内,的一个或多个残基,以去除T细胞表位,由此降低抗体的潜在免疫原性。该方法也称为“去免疫化”,并进一步详细描述于Carr等的美国专利公开号20030153043中。除在构架或CDR区内进行的修饰外,本发明的抗体还可以或备选地可以被改造以包括Fc区内的修饰,通常用来改变抗体的一种或多种功能性质,如血清半衰期、补体固定、Fc受体结合、和/或抗原依赖性细胞毒性。此外,可化学修饰(例如,一个或多个化学部分可附着到抗体上)或修饰本发明的抗体以改变其糖基化,进而改变抗体的一种或多种功能性质。下文中进一步详细描述了这些实施方案中的每一个。Fc区中残基的编号是Kabat的EU索引中的编号。在一个实施方案中,修饰CH1的铰链区,使得改变,例如增加或减少铰链区中半胱氨酸残基的数目。Bodmer等的美国专利号5,677,425中进一步描述了该方法。改变CH1的铰链区中半胱氨酸残基的数目,例如用来便于轻链和重链的装配、或提高或降低抗体的稳定性。在另一实施方案中,突变抗体的Fc铰链区,以降低抗体的生物半衰期。更特别地,可以向Fc铰链片段的CH2-CH3结构域界面区引入一个或多个氨基酸突变,使得抗体相对于天然的Fc铰链结构域SpA结合具有受损的葡萄球菌蛋白A(SpA)结合。Ward等的美国专利号6,165,745中进一步详细描述了该方法。还在其他实施方案中,通过将至少一个氨基酸残基替换为不同氨基酸残基,改变Fc区,以改变抗体的效应子功能。例如,可用不同氨基酸残基替换一个或多个氨基酸,使得抗体对效应子配体具有改变的亲和力,但保留亲本抗体的抗原结合能力。亲和力被改变的效应子配体可以是例如,Fc受体或补体的C1组分。Winter等的美国专利号5,624,821和5,648,260中都进一步详细描述了该方法。在另一实施方案中,可用不同氨基酸残基替换选自氨基酸残基的一个或多个氨基酸,使得抗体具有改变的C1q结合/或降低的或消除的补体依赖性细胞毒性(CDC)。Idusogie等的美国专利号6,194,551中进一步详细描述了该方法。在另一实施方案中,改变一个或多个氨基酸残基,由此改变抗体固定补体的能力。Bodmer等的PCT公开WO94/29351中进一步详细描述了该方法。还在另一实施方案中,修饰Fc区以提高抗体介导抗体依赖性细胞毒性(ADCC)的能力,和/或通过修饰一个或多个氨基酸来增加抗体对Fcγ受体的亲和力。Presta的PCT公开WO00/42072中进一步详细了描述该方法。此外,已经作图定位了人IgG1上的FcγRl、FcγRII、FcγRIII和FcRn结合位点,并且已经描述了具有提高的结合的变体(参阅Shields等,(2001)J.Biol.Chen.276:6591-6604)。还在另一实施方案中,修饰抗体的糖基化。例如,可制备去糖基化的抗体(aglycoslated,即该抗体缺乏糖基化)。可改变糖基化,例如用来增加抗体对“抗原”的亲和力。可通过例如改变抗体序列内的一个或多个糖基化位点来实现此类糖修饰。例如,可进行一个或多个氨基酸替换,以导致一个或多个可变区构架糖基化位点消除,由此消除该位点处的糖基化。这种去糖基化可增加抗体对抗原的亲和力。Co等的美国专利号5,714,350和6,350,861中进一步详细描述了该方法。此外或备选地,可以制备具有改变类型的糖基化的抗体,如具有减少的岩藻糖残基量的低岩藻糖基化抗体或具有增加的二分型GlcNac结构的抗体。已经证明,此类改变的糖基化模式提高抗体的ADCC能力。可以例如通过在具有改变的糖基化机器的宿主细胞中表达抗体来实现此类糖修饰。已经在本领域中描述了具有改变的糖基化机器的细胞,并且该细胞可用作表达本发明重组抗体的宿主细胞,由此产生具有改变的糖基化的抗体。例如,Hang等的EP1,176,195描述了具有功能被破坏的FUT8基因的细胞系(该基因编码岩藻糖基转移酶),使得在这种细胞系中表达的抗体显示低岩藻糖基化。Presta的PCT公开WO03/035835描述了变体CHO细胞系Lecl3细胞,其将岩藻糖附着到Asn(297)-连接的糖上的能力降低,也导致在该宿主细胞中表达的抗体的低岩藻糖化(也参阅Shields等,(2002)J.Biol.Chem.277:26733-26740)。Umana等的PCT公开WO99/54342描述了这样的细胞系,该细胞系经改造以表达修饰糖蛋白的糖基转移酶(例如,β(1,4)-N乙酰葡糖氨基转移酶III(GnTIII)),使得在改造的细胞系中表达的抗体显示增加的二分型GlcNac结构,这导致抗体的ADCC活性提高(也参阅Umana等,(1999)Nat.Biotech.17:176-180)。在另一实施方案中,修饰抗体以增加其生物半衰期。可使用多种方法。例如,如Ward的美国专利号6,277,375中所述,可引入一个或多个以下突变:T252L、T254S、T256F。备选地,如Presta等人的美国专利号5,869,046和6,121,022中所述,为了增加生物半衰期,可在CH1或CL区内改变抗体,以含有取自IgG的Fc区CH2结构域的2个环的救助受体结合表位。(iv)改造改变的抗体的方法如上文所讨论,可以使用具有本文显示的VH和VL序列或全长重链和轻链序列的HER3结合抗体,通过修饰全长重链和/或轻链序列、VH和/或VL序列、或附着到其上的恒定区,产生新的HER3结合抗体。因此,在本发明的另一方面,用本发明的HER3结合抗体的结构特征来产生结构上相关的HER3结合抗体,所述相关抗体保留本发明抗体的至少一种功能性质,如结合人HER3以及也抑制HER3的一种或多种功能性质。例如,本发明的抗体的一个或多个CDR区或其突变体可与已知的构架区和/或其他CDR重组组合,以产生上文讨论的本发明的其他重组改造的HER3结合抗体。其他类型的修饰包括在先前部分中描述的那些。用于此改造方法的起始材料是本文提供的一个或多个VH和/或VL序列、或其一个或多个CDR区。为了产生改造的抗体,不必实际制备(即表达为蛋白质)具有本文提供的一个或多个VH和/或VL序列、或其一个或多个CDR区的抗体。而是可以将序列中包含的信息用作起始材料来产生衍生自该初始序列的“第二代”序列,然后制备该“第二代”序列并将其表达为蛋白质。因此,在另一实施方案中,本发明提供用于制备由重链可变区抗体序列和轻链可变区抗体序列组成的HER3结合抗体的方法,其中该重链可变区抗体序列具有选自SEQIDNO:2、8、20、26、38、44、56、62、74、80、92、98、110、116、128、134、146、152、164、170、182、188、200、206、218、224、236、242、254、260、272、278、290、296、308、314、326、332、344、350、362和368的CDR1序列;选自SEQIDNO:3、9、21、27、39、45、57、63、75、81、93、99、111、117、129、135、147、153、165、171、183、189、201、207、219、225、237、243、255、261、273、279、291、297、309、315、327、333、345、351、363和369的CDR2序列;和/或选自SEQIDNO:4、10、22、28、40、46、58、64、75、82、94、100、112、118、130、136、148、154、166、172、184、190、202、208、220、226、238、244、256、262、274、280、292、298、310、316、328、334、346、352、364和370的CDR3序列;其中该轻链可变区抗体序列具有选自SEQIDNO:5、11、23、29、41、47、59、65、77、83、95、101、113、119、131、137、149、155、167、173、185、191、203、209、221、227、239、245、257、263、275、281、293、299、311、317、329、335、347、353、365和371的CDR1序列;选自SEQIDNO:6、12、24、30、42、48、60、66、78、84、96、102、114、120、132、138、150、156、168、174、186、192、204、210、222、228、240、246、258、264、276、282、294、300、312、318、330、336、348、354、366和372的CDR2序列;和/或选自SEQIDNO:7、13、25、31、43、49、61、67、79、85、97、103、115、121、133、139、151、157、169、175、187、193、205、211、223、229、241、247、259、265、277、283、295、301、313、319、331、337、349、355、367和373的CDR3序列;改变该重链可变区抗体序列和/或轻链可变区抗体序列内的至少一个氨基酸残基,以产生至少一个改变的抗体序列;并将该改变的抗体序列表达为蛋白质。也可通过筛选抗体文库来制备该改变的抗体序列,所述抗体文库具有如US20050255552中所述的固定的CDR3序列或最小必需结合决定簇以及CDR1和CDR2序列上的多样性。可根据适于从抗体文库中筛选抗体的任何筛选技术(如噬菌体展示技术)进行筛选。标准分子生物学技术可用于制备和表达改变的抗体序列。由该改变的抗体序列编码的抗体是保留本文所述的HER3结合抗体的一种、一些或所有功能性质的抗体,该功能性质包括但不限于:与人和/或食蟹猴HER3特异性结合;抗体在磷酸-HER测定试验中结合HER3并通过抑制HER信号传导活性来中和HER3生物活性。可用本领域中可得的标准测定和/或本文描述的测定,如实施例中所示的那些(例如,ELISA),评估经改变的抗体的功能性质。在本发明的改造抗体的方法的某些实施方案中,可沿HER3结合抗体编码序列的全部或部分随机地或选择性地引入突变,可按本文所述筛选所得到的经修饰HER3结合抗体的结合活性和/或其他功能性质。在本领域中已经描述了突变方法。例如,Short的PCT公开WO02/092780描述了使用饱和诱变、合成连接装配或其组合来产生和筛选抗体突变体的方法。备选地,Lazar等的PCT公开WO03/074679描述了用计算筛选方法来优化抗体理化性质的方法。本发明抗体的表征可通过多种功能测定试验,表征本发明的抗体。例如,可表征:抗体在本文所述的磷酸-HER测定试验中通过抑制HER信号传导来中和生物活性的能力;抗体与HER3蛋白(例如,人和/或食蟹猴HER3)的亲和力;表位装箱(epitopebinning);抗体对蛋白酶解的抗性;及抗体阻断HER3下游信号传导的能力。可用多种方法测量HER3介导的信号传导。例如,可通过(i)测量磷酸-HER3、(ii)测量HER3或其他下游信号传导蛋白(例如Akt)的磷酸化、(iii)本文所述的配体阻断测定试验、(iv)异源二聚体形成、(v)HER3依赖性基因表达标签(signature)、(vi)受体内化、和(vii)HER3驱动的细胞表型(例如增殖),监测HER信号传导途径。可通过直接标记目的抗体来检测抗体结合HER3的能力,或可不标记抗体,而用本领域已知的多种夹心测定试验间接检测结合。在一些实施方案中,本发明的HER3结合抗体阻断参考HER3结合抗体与HER3多肽或蛋白质的结合、或与参考HER3结合抗体竞争结合HER3多肽或蛋白质。它们可以是上文所述的全人HER3结合抗体。它们也可以是与参考抗体结合相同表位的其他小鼠、嵌合或人源化的HER3结合抗体。阻断参考抗体结合或与参考抗体竞争结合的能力表明所测试的HER3结合抗体与参考抗体结合相同或相似的表位,或结合与参考HER3结合抗体所结合的表位足够接近的表位。此类抗体尤其可能享有针对参考抗体所定义的有利特性。可通过例如竞争结合测定试验,测定阻断参考抗体或与参考抗体竞争的能力。使用竞争结合测定,检查所测试的抗体抑制参考抗体与共同抗原(例如HER3多肽或蛋白质)特异性结合的能力。如果过量的测试抗体基本上抑制参考抗体的结合,则测试抗体与参考抗体竞争与抗原发生特异性结合。基本上抑制是指,测试抗体通常使参考抗体的特异性结合降低至少10%、25%、50%、75%或90%。许多已知的竞争结合测定试验可用来评估HER3结合抗体和参考HER3结合抗体与HER3蛋白质的竞争结合。这包括,例如固相直接或间接放射免疫测定(RIA)、固相直接或间接酶免疫测定(EIA)、夹心竞争测定(见Stahli等人,(1983)MethodsinEnzymology9:242-253);固相直接生物素-抗生物素蛋白EIA(见Kirkland等人,(1986)J.Immunol.137:3614-3619);固相直接标记测定试验、固相直接标记夹心测定(见Harlow&Lane,上文);使用I-125标记物的固相直接标记RIA(见Morel等人,(1988)Molec.Immunol.25:7-15);固相直接生物素-抗生物素蛋白EIA(Cheung等人,(1990)Virology176:546-552);及直接标记RIA(Moldenhauer等人,(1990)Scand.J.Immunol.32:77-82)。通常,这些测定试验涉及使用结合在固相表面或细胞上的纯化抗原、未标记的测试HER3结合抗体、和标记的参考抗体。通过在测试抗体的存在下测定与固相表面或细胞结合的标记物的量来测量竞争性抑制。测试抗体通常过量存在。通过竞争测定试验鉴定到的抗体(竞争性抗体)包括:与参考抗体结合相同表位的抗体、和与相邻表位结合的抗体,其中所述相邻表位距离参考抗体所结合的表位足够接近以致于引起空间位阻。为了测定所选择的HER3结合性单克隆抗体是否结合独特的表位,可用市售试剂(例如来自Pierce,Rockford,IL的试剂)对各个抗体进行生物素化。可用HER3多肽包被的ELISA板进行使用未标记的单克隆抗体和生物素化的单克隆抗体的竞争研究。可用链霉抗生物素-碱性磷酸酶探针检测生物素化的MAb的结合。为了测定纯化的HER3结合抗体的同种型,可进行同种型ELISA。例如,可用1μg/ml抗人IgG在4℃过夜包被微量滴定板的孔。在用1%BSA封闭后,使板与1μg/ml或更少的单克隆HER3结合抗体或纯化的同种型对照在环境温度反应1-2小时。然后可使孔与人IgGl或人IgM特异性碱性磷酸酶缀合的探针反应。然后对板显色和分析,从而可确定纯化的抗体的同种型。为证明单克隆HER3结合抗体与表达HER3多肽的活细胞的结合,可使用流式细胞术。简言之,可将表达HER3的细胞系(在标准生长条件下培养)与多种浓度的HER3结合抗体在含有0.1%BSA和10%胎牛血清的PBS中混合,并在4℃孵育1小时。洗涤后,在与第一抗体染色相同的条件下使细胞与荧光素标记的抗人IgG抗体反应。可通过FACScan仪器分析样品,使用光散射和侧向散射性能分选单细胞。除了流式细胞术测定以外或代替流式细胞术测定,可使用利用荧光显微术的备选测定。完全按上文所述对细胞进行染色并通过荧光显微镜检查细胞。此方法允许单个细胞的可视化,但取决于抗原密度可具有降低的灵敏性。可通过Western印迹进一步测试本发明的HER3结合抗体与HER3多肽或抗原片段的反应性。简言之,可制备纯化的HER3多肽或融合蛋白、或来自表达HER3的细胞的细胞提取物,然后进行十二烷基硫酸钠聚丙烯酰胺凝胶电泳。电泳后,将分开的抗原转移至硝酸纤维素膜,用10%胎牛血清封闭,并用待测单克隆抗体探测。可用抗人IgG碱性磷酸酶检测人IgG的结合,并用BCIP/NBT底物片剂(SigmaChem.Co.,St.Louis,MO)显色。多种读出方式可用在配体诱导的异源二聚体形成的基于细胞的测定试验中评估HER3抗体的效力和特异性。可通过以下的一种或多种来评估活性:(i)抑制靶细胞系(例如MCF-7乳腺癌细胞)中HER2与其他EGF家族成员的配体诱导的异源二聚化。可用受体特异性抗体从细胞裂解物免疫沉淀HER2复合物,在电泳/Western转移后通过用其他EGF受体的抗体探测,可分析复合物中其他EGF受体及其生物学相关配体的缺乏/存在。(ii)抑制由配体激活的异源二聚体导致的信号传导途径的激活。与HER3的结合似乎是EGF家族受体的其他成员在配体结合后引发最大细胞应答的关键。在激酶缺陷型HER3的情况下,HER2可以提供功能性酪氨酸激酶结构域,使得能够在生长因子配体结合后发生信号传导。因此,可在缺乏和存在抑制剂的情况下用配体(例如调蛋白)处理共表达HER2和HER3的细胞,并通过许多方式监测对HER3酪氨酸磷酸化的影响,这些方式包括从经处理的细胞裂解物免疫沉淀HER3,随后使用抗磷酸酪氨酸抗体进行Western印迹(有关细节见Agus上文)。备选地,可发展高通量测定试验,其中将来自增溶的裂解物的HER3捕获至用抗HER3受体抗体包被的96孔板孔上,并用例如Waddleton等人,(2002)Anal.Biochem.309:150-157所实施的铕标记的抗磷酸酪氨酸抗体,测量酪氨酸磷酸化水平。作为此方法的更广延伸,可以直接分析已知在激活的受体异源二聚体下游被激活的效应分子(如促分裂原激活蛋白激酶(MAPK)和Akt),其中从经处理的裂解物免疫沉淀这些效应分子,并用检测这些蛋白质的激活形式的抗体进行印迹,或分析这些蛋白质修饰/激活特定底物的能力。(iii)抑制配体诱导的细胞增殖。已知多种细胞系共表达ErbB受体组合,例如许多乳腺癌和前列腺癌细胞系。可在24/48/96-孔形式中进行测定,基于相关DNA合成(氚标记的胸苷掺入)、细胞数的增加(结晶紫染色)等进行读出。可用多种读出方式,在非配体依赖性同源和异源二聚体形成的基于细胞的测定中,评估HER3抗体的效力和特异性。例如,HER2过表达可以触发由自发二聚体形成导致的激酶结构域的非配体依赖性激活。过表达的HER2产生同源二聚体、或与其他HER分子(如HER1、HER3和HER4)产生异源二聚体。抗体或其片段阻断人肿瘤细胞系的肿瘤异种移植物的体内生长的能力,其中已知该细胞系的致瘤表型至少部分依赖于配体激活的HER3异源二聚体细胞信号传导,例如BxPC3胰腺癌细胞等。这可在免疫受损的小鼠中单独评估,或与对所讨论的细胞系合适的细胞毒性剂组合进行评估。在下文的实施例章节中也描述了功能测定试验的实例。预防和治疗用途本发明提供通过对有需要的个体施用有效量的本发明的抗体来治疗与HER3信号传导途径相关的疾病或病症的方法。在一个具体实施方案中,本发明提供通过对有需要的个体施用有效量的本发明的抗体来治疗或预防癌症(例如,乳腺癌、结肠直肠癌、肺癌、多发性骨髓瘤、卵巢癌、肝癌、胃癌、胰腺癌、急性髓性白血病、慢性髓性白血病、骨肉瘤、鳞状细胞癌、外周神经鞘肿瘤、施万细胞瘤、头颈癌、膀胱癌、食管癌、巴雷特食管癌、成胶质细胞瘤、软组织的透明细胞肉瘤、恶性间皮瘤、神经纤维瘤病、肾癌、黑素瘤、前列腺癌、良性前列腺增生(BPH)、男子乳腺发育和子宫内膜异位)的方法。在一些实施方案中,本发明提供通过对有需要的个体施用有效量的本发明的抗体来治疗或预防与HER信号传导途径相关的癌症的方法。在一个具体实施方案中,本发明提供治疗与HER信号传导途径相关的癌症的方法,该癌症包括但不限于乳腺癌、结肠直肠癌、肺癌、多发性骨髓瘤、卵巢癌、肝癌、胃癌、胰腺癌、急性髓性白血病、慢性髓性白血病、骨肉瘤、鳞状细胞癌、外周神经鞘肿瘤、施万细胞瘤、头颈癌、膀胱癌、食管癌、巴雷特食管癌、成胶质细胞瘤、软组织的透明细胞肉瘤、恶性间皮瘤、神经纤维瘤病、肾癌、黑素瘤、前列腺癌、良性前列腺增生(BPH)、男子乳腺发育和子宫内膜异位。在一个实施方案中,本发明涉及用HER3抗体或其片段治疗食管癌。在一个实施方案中,本发明涉及用HER3抗体或其片段治疗良性前列腺增生(BPH)。BHP是老年雄性中常见的疾病,其表征为前列腺的非赘生性增大,产生对尿道的压力,导致排尿和膀胱问题(Mahapokai1W,vanSluijsFJ&SchalkenJA.2000ProstateCancerandProstaticDiseases3,28-33)。在约55%的60-70岁男性中,尸检时存在BPH的解剖学证据或显微证据。经尿道前列腺切除是多年来的治疗选择。因此,在老年男性中,BPH是进行手术干预的最常见的原因之一。较低侵入性的治疗方法包括:(i)α1-阻断剂(多沙唑嗪(doxazosin)、哌唑嗪(prazosin)、坦洛新(tamsulosin)、特拉唑嗪(terazosin)和阿夫唑嗪(alfuzosin))是一类也用于治疗高血压的药物。这些药物松弛膀胱颈和前列腺的肌肉,从而允许更容易的排尿。(ii)非那雄胺(Finasteride)和度他雄胺(dutasteride)降低雄激素水平,从而减小前列腺的大小,提高尿流速,并减少BPH的症状。在观察到症状改善之前可能需花费3至6个月。与非那雄胺和度他雄胺的使用相关的潜在副作用包括性冲动减少和阳痿。实验章节中的结果首次证明,BPH是神经调节蛋白依赖性适应症。该发现还显示,MOR10703在性成熟的大鼠中显著减小前列腺大小而不影响激素水平,说明MOR10703可用于治疗BPH。为进一步测试MOR10703和其他HER3抗体作为BPH治疗剂,可将原代人BPH手术标本移植入无胸腺小鼠或大鼠,并用模型研究Her3抗体的作用(OttoU等人UrolInt1992;48:167-170)。备选地,可通过长期施用5α-雄甾烷-3α,17β-二醇加雌二醇在去势的犬中诱发BPH的方面,并在这些犬模型中测试HER3抗体(WalshPC,WilsonJD.JClinInvest1976;57:1093–1097)。在一个实施方案中,本发明涉及用HER3抗体或其片段治疗男子乳腺发育(gynecomastia)。男子乳腺发育的身体征象是男性乳房增大,它通常发生在双侧乳腺中,但有时可以仅发生在一侧,称为不对称男子乳腺发育或单侧男子乳腺发育。男子乳腺发育常由以下引起:(i)提高的雌激素水平,导致睾酮与雌激素的比例变得失衡。(ii)用于治疗前列腺癌或BPH的雄激素拮抗剂或抗雄激素。这些药物抑制睾酮,但通过抑制睾酮,雌激素开始上升。虽然目前正在评价许多实验性药物,但目前没有批准用于男子乳腺发育的治疗。因此,通过手术去除乳房组织来治疗男子乳腺发育。MOR10703诱导雄性乳腺的不可逆萎缩的观察结果指示,它在男子乳腺发育的治疗中可以是有利的。为了进一步测试MOR10703和其他HER3抗体用于治疗人类男子乳腺发育,可以使用男子乳腺发育的转基因小鼠模型。这些模型已经被开发出来,其中在小鼠乳腺中表达人芳化酶,这些模型重现了人类男子乳腺发育的许多方面(Li等人,Endocrinology2002;143:4074–4083;Tekmal等人,CancerRes1996;56:3180–318)。在一个实施方案中,本发明涉及用HER3抗体或其片段治疗男子乳腺发育。还可以检查MOR10703和其他HER3抗体用于治疗子宫内膜异位,子宫内膜异位是妇科病症,其中来自子宫衬里(子宫内膜)的细胞在子宫腔外出现并繁盛。子宫内膜异位的主要但并非普遍的症状是多种表现形式的盆腔疼痛。虽然子宫内膜异位的潜在原因未得到良好的表征,但认为其依赖于雌激素的存在。MOR10703在雌性小鼠中诱导子宫内膜萎缩,导致子宫重量减少,因此可以用MOR10703来治疗子宫内膜异位。为了进一步研究MOR10703和其他HER3抗体对子宫内膜异位的作用,可以将增生期的人子宫内膜植入正常循环和卵巢切除的无胸腺小鼠或循环非肥胖型糖尿病(NOD)-重症联合免疫缺陷(SCID)小鼠的腹膜腔,并用这些SCID小鼠作为模型(Grummer等,2001.HumanReproduction;16;1736-1743)。HER3抗体也可以用来治疗或预防与异常或缺陷的HER信号传导相关的其他疾病,该疾病包括但不限于呼吸道疾病、骨质疏松症、骨关节炎、多囊性肾病、糖尿病、精神分裂症、血管疾病、心脏疾病、非致癌性增生性疾病、纤维化和神经退行性疾病如阿尔茨海默病。适于与HER3结合抗体组合治疗的药物包括能够调节ErbB信号传导途径的本领域已知的标准治疗剂。用于HER2的标准治疗剂的适宜实例包括但不限于赫塞汀(Herceptin)和拉帕替尼(Tykerb)。用于EGFR的标准治疗剂的适宜实例包括但不限于易瑞沙(Iressa)、特罗凯(Tarceva)、爱必妥(Erbitux)和维克替比(Vectibix)。适于与HER3结合抗体组合治疗的其他药物包括但不限于调节受体酪氨酸激酶、G蛋白偶联受体、生长/生存信号转导途径、核激素受体、凋亡通路、细胞周期和血管发生的那些药物。诊断用途在一方面,本发明包括用于在生物样品(例如,血液、血清、细胞、组织)中或在患有癌症或有患癌风险的个体中测定HER3蛋白质和/或核酸表达以及HER3蛋白质功能的诊断测定试验。诊断测定(如竞争性测定)依赖于标记的类似物(“示踪物”)与测试样品分析物竞争共同的结合配偶体上有限数量的结合部位的能力。结合配偶体一般在竞争前或竞争后是不溶解的,然后结合到结合配偶体上的示踪物和分析物与未结合的示踪物和分析物分离。通过倾析(其中结合配偶体预先不溶解)或通过离心(其中结合配偶体在竞争反应后沉淀)来实现此分离。测试样品分析物的量与结合的示踪物的量成反比,可以通过标记物质的量来量度。用已知量的分析物制备剂量应答曲线,并与测试结果进行比较,以定量确定测试样品中存在的分析物的量。在用酶作为可检测标记物时,这些测定试验称为ELISA系统。在这种形式的测定中,抗体与HER3结合性抗体之间的竞争性结合,使结合的HER3蛋白质,优选本发明的HER3表位成为血清样品中的抗体的量度,最尤其是血清样品中的中和性抗体的量度。该测定的一个显著优势是直接对中和抗体(即干扰HER3蛋白质结合,尤其是表位结合的那些抗体)进行测量。这种测定(特别是ELISA测试形式)在临床环境和常规血液筛查中具有相当多的应用。本发明的另一方面提供用于测定个体中的HER3核酸表达或HER3蛋白质活性的方法,由此为该个体选择合适的治疗剂或预防剂(此处称为“药物基因组学”)。药物基因组学允许基于个体的基因型来选择活性剂(例如药物)用于个体的治疗性或预防性处理(例如,检查个体的基因型来确定该个体对特定活性剂应答的能力)。本发明的另一方面涉及在临床试验中监测活性剂(例如药物)对HER3蛋白质的表达或活性的影响。药物组合物为了制备包括HER3结合抗体(完整抗体或结合片段)的药物组合物或无菌组合物,将HER3结合抗体(完整抗体或结合片段)与可药用载体或赋形剂混合。组合物可另外含有适合用于治疗或预防癌症(乳腺癌、结肠直肠癌、肺癌、多发性骨髓瘤、卵巢癌、肝癌、胃癌、胰腺癌、急性髓性白血病、慢性髓性白血病、骨肉瘤、鳞状细胞癌、外周神经鞘肿瘤、施万细胞瘤、头颈癌、膀胱癌、食管癌、巴雷特食管癌、成胶质细胞瘤、软组织的透明细胞肉瘤、恶性间皮瘤、神经纤维瘤病、肾癌、黑素瘤、前列腺癌、良性前列腺增生(BPH)、男子乳腺发育和子宫内膜异位)的一种或多种其它治疗剂。可通过与生理上可接受的载体、赋形剂或稳定剂混合来制备治疗剂和诊断剂的制剂,制剂的形式可以是例如冻干的粉末、浆、水溶液、洗液或悬浮液的形式(见例如,Hardman等人,(2001)GoodmanandGilman'sThePharmacologicalBasisofTherapeutics,McGraw-Hill,NewYork,N.Y.;Gennaro(2000)Remington:TheScienceandPracticeofPharmacy,Lippincott,Williams,andWilkins,NewYork,N.Y.;Avis,等人(编)(1993)PharmaceuticalDosageForms:ParenteralMedications,MarcelDekker,NY;Lieberman,等人(编)(1990)PharmaceuticalDosageForms:Tablets,MarcelDekker,NY;Lieberman,等人(编)(1990)PharmaceuticalDosageForms:DisperseSystems,MarcelDekker,NY;Weiner和Kotkoskie(2000)ExcipientToxicityandSafety,MarcelDekker,Inc.,NewYork,N.Y.)。治疗剂施用方案的选择取决于若干因素,包括该实体的血清或组织周转率、症状水平、该实体的免疫原性、及靶细胞在生物基质中的可达性。在某些实施方案中,符合可接受的副作用水平,施用方案使递送给患者的治疗剂的量最大化。因此,递送的生物剂的量部分取决于具体实体和所治疗病症的严重性。可以获得用于选择合适剂量的抗体、细胞因子和小分子的指导(见例如,Wawrzynczak(1996)AntibodyTherapy,BiosScientificPub.Ltd,Oxfordshire,UK;Kresina(编)(1991)MonoclonalAntibodies,CytokinesandArthritis,MarcelDekker,NewYork,N.Y.;Bach(编)(1993)MonoclonalAntibodiesandPeptideTherapyinAutoimmuneDiseases,MarcelDekker,NewYork,N.Y.;Baert等人,(2003)NewEngl.J.Med.348:601-608;Milgrom等人,(1999)NewEngl.J.Med.341:1966-1973;Slamon等人,(2001)NewEngl.J.Med.344:783-792;Beniaminovitz等人,(2000)NewEngl.J.Med.342:613-619;Ghosh等人,(2003)NewEngl.J.Med.348:24-32;Lipsky等人,(2000)NewEngl.J.Med.343:1594-1602)。可以由临床医生确定合适的剂量,例如,使用本领域公知或疑似影响治疗的参数或因素或预计影响治疗的参数或因素。剂量一般从略低于最佳剂量的量开始,随后小幅增加,直至相对于任何负面副作用而言达到理想或最佳的效果。重要的诊断性衡量包括症状,例如炎症或产生的炎性细胞因子水平,的诊断性衡量。可改变本发明的药物组合物中活性成分的实际剂量水平,以获得这样的活性成份的量,该量就具体患者、组合物和施用方式而言可以有效达到所希望的治疗反应,并同时对患者无毒性。所选剂量水平将取决于多种药物代谢动力学因素,包括所用的本发明具体组合物或其酯、盐或酰胺的活性、施用途径、施用时间、所用的具体化合物的排泄速率、治疗的持续时间、与所用的具体组合物组合使用的其他药物、化合物和/或材料、待治疗患者的年龄、性别、体重、病症、一般健康和过往病史,以及医学领域已知的类似因素。可通过连续输注,或通过间隔给药(按例如1天、1周的间隔或每周1-7次给药),提供包含本发明的抗体或其片段的组合物。可通过静脉内、皮下、局部、口服、鼻、直肠、肌肉内、脑内或通过吸入来提供剂量。具体剂量方案可以涉及避免显著不良副作用的最大剂量或剂量频率。每周总剂量可以是至少0.05μg/kg体重、至少0.2μg/kg、至少0.5μg/kg、至少1μg/kg、至少10μg/kg、至少100μg/kg、至少0.2mg/kg、至少1.0mg/kg、至少2.0mg/kg、至少10mg/kg、至少25mg/kg或至少50mg/kg(见例如,Yang等人,(2003)NewEngl.J.Med.349:427-434;Herold等人,(2002)NewEngl.J.Med.346:1692-1698;Liu等人,(1999)J.Neurol.Neurosurg.Psych.67:451-456;Portielji等人,(2003)CancerImmunol.Immunother.52:133-144)。在摩尔/kg体重的基础上,抗体或其片段的理想剂量与用于抗体或多肽的理想剂量大致相同。抗体或其片段的理想血浆浓度大约在摩尔/kg体重的基础上。剂量可以是至少15μg、至少20μg、至少25μg、至少30μg、至少35μg、至少40μg、至少45μg、至少50μg、至少55μg、至少60μg、至少65μg、至少70μg、至少75μg、至少80μg、至少85μg、至少90μg、至少95μg或至少100μg。对个体施用的剂量次数可以是至少1、2、3、4、5、6、7、8、9、10、11或12次、或更多。对于本发明的抗体或其片段,对患者施用的剂量可以是0.0001mg/kg至100mg/kg患者体重。剂量可在0.0001mg/kg至20mg/kg、0.0001mg/kg至10mg/kg、0.0001mg/kg至5mg/kg、0.0001至2mg/kg、0.0001至1mg/kg、0.0001mg/kg至0.75mg/kg、0.0001mg/kg至0.5mg/kg、0.0001mg/kg至0.25mg/kg、0.0001至0.15mg/kg、0.0001至0.10mg/kg、0.001至0.5mg/kg、0.01至0.25mg/kg、或0.01至0.10mg/kg患者体重之间。可以用以千克(kg)计的患者体重乘以以mg/kg计的待施用剂量来计算本发明的抗体或其片段的剂量。本发明的抗体或其片段的剂量可以是150μg/kg或更低、125μg/kg或更低、100μg/kg或更低、95μg/kg或更低、90μg/kg或更低、85μg/kg或更低、80μg/kg或更低、75μg/kg或更低、70μg/kg或更低、65μg/kg或更低、60μg/kg或更低、55μg/kg或更低、50μg/kg或更低、45μg/kg或更低、40μg/kg或更低、35μg/kg或更低、30μg/kg或更低、25μg/kg或更低、20μg/kg或更低、15μg/kg或更低、10μg/kg或更低、5μg/kg或更低、2.5μg/kg或更低、2μg/kg或更低、1.5μg/kg或更低、1μg/kg或更低、0.5μg/kg或更低、或0.5μg/kg或更低患者体重。本发明的抗体或其片段的单位剂量可以是0.1mg至20mg、0.1mg至15mg、0.1mg至12mg、0.1mg至10mg、0.1mg至8mg、0.1mg至7mg、0.1mg至5mg、0.1至2.5mg、0.25mg至20mg、0.25至15mg、0.25至12mg、0.25至10mg、0.25至8mg、0.25mg至7mg、0.25mg至5mg、0.5mg至2.5mg、1mg至20mg、1mg至15mg、1mg至12mg、1mg至10mg、1mg至8mg、1mg至7mg、1mg至5mg、或1mg至2.5mg。本发明的抗体或其片段的剂量可在个体中达到至少0.1μg/ml、至少0.5μg/ml、至少1μg/ml、至少2μg/ml、至少5μg/ml、至少6μg/ml、至少10μg/ml、至少15μg/ml、至少20μg/ml、至少25μg/ml、至少50μg/ml、至少100μg/ml、至少125μg/ml、至少150μg/ml、至少175μg/ml、至少200μg/ml、至少225μg/ml、至少250μg/ml、至少275μg/ml、至少300μg/ml、至少325μg/ml、至少350μg/ml、至少375μg/ml、或至少400μg/ml的血清滴度。备选地,本发明的抗体或其片段的剂量可在个体中达到至少0.1μg/ml、至少0.5μg/ml、至少1μg/ml、至少2μg/ml、至少5μg/ml、至少6μg/ml、至少10μg/ml、至少15μg/ml、至少20μg/ml、至少25μg/ml、至少50μg/ml、至少100μg/ml、至少125μg/ml、至少150μg/ml、至少175μg/ml、至少200μg/ml、至少225μg/ml、至少250μg/ml、至少275μg/ml、至少300μg/ml、至少325μg/ml、至少350μg/ml、至少375μg/ml、或至少400μg/ml的血清滴度。本发明的抗体或其片段可重复给药,并可间隔至少1天、2天、3天、5天、10天、15天、30天、45天、2个月、75天、3个月或至少6个月施用。对具体患者有效的量可取决于诸如所治疗的病症、患者的总体健康、施用的方法途径和剂量以及副作用的严重性等因素而变(见例如,Maynard等人,(1996)AHandbookofSOPsforGoodClinicalPractice,InterpharmPress,BocaRaton,Fla.;Dent(2001)GoodLaboratoryandGoodClinicalPractice,UrchPubl.,London,UK)。施用途径可以是通过例如,局部或皮肤应用,通过静脉内、腹膜内、脑内、肌肉内、眼内、动脉内、脑脊髓内、病灶内注射或输注,或通过持续释放系统或植入物(见例如,Sidman等人,(1983)Biopolymers22:547-556;Langer等人,(1981)J.Biomed.Mater.Res.15:167-277;Langer(1982)Chem.Tech.12:98-105;Epstein等人,(1985)Proc.Natl.Acad.Sci.USA82:3688-3692;Hwang等人,(1980)Proc.Natl.Acad.Sci.USA77:4030-4034;美国专利号6,350,466和6,316,024)。必要时,组合物可还包括增溶剂和局部麻醉剂(如利多卡因)来缓解注射部位的疼痛。此外,也可以利用肺施用,例如,通过使用吸入器或喷雾器,及具有雾化剂的制剂。见例如,美国专利号6,019,968、5,985,320、5,985,309、5,934,272、5,874,064、5,855,913、5,290,540和4,880,078,及PCT公开号WO92/19244、WO97/32572、WO97/44013、WO98/31346和WO99/66903,其各自以其整体引入本文作为参考。也可用本领域已知的多种方法中的一种或多种,经由一种或多种施用途径,施用本发明的组合物。熟练技术人员将理解,施用的途径和/或模式将取决于所希望的结果而变。选择用于本发明的抗体或其片段的施用途径包括静脉内、肌肉内、皮内、腹膜内、皮下、脊柱或其他胃肠外施用途径,例如通过注射或输注。胃肠外施用可以是除了肠和局部施用以外的施用模式,通常通过注射进行,并包括但不限于静脉内、肌肉内、动脉内、鞘内、囊内、眶内、心脏内、皮内、腹膜内、经气管、皮下、表皮下、关节内、囊下、蛛网膜下、脊柱内、硬膜外和胸骨内注射和输注。备选地,本发明的组合物可经由非胃肠外途径,例如局部、表皮或黏膜施用途径施用,例如鼻内、口服、阴道、直肠、舌下或局部施用。在一个实施方案中,通过输注来施用本发明的抗体或其片段。在另一实施方案中,皮下施用本发明的多特异性表位结合蛋白。如果在受控释放系统或持续释放系统中施用本发明的抗体或其片段,则可用泵来实现受控释放或持续释放(见Langer,上文;Sefton,(1987)CRCCrit.RefBiomed.Eng.14:20;Buchwald等人,(1980),Surgery88:507;Saudek等人,(1989)N.Engl.J.Med.321:574)。可用聚合材料来达到本发明治疗的受控释放或持续释放(见例如,MedicalApplicationsofControlledRelease,Langer和Wise(编),CRCPres.,BocaRaton,Fla.(1974);ControlledDrugBioavailability,DrugProductDesignandPerformance,Smolen和Ball(编),Wiley,NewYork(1984);Ranger和Peppas,(1983)J.Macromol.Sci.Rev.Macromol.Chem.23:61;还见Levy等人,(1985)Science228:190;During等人,(1989)Ann.Neurol.25:351;Howard等人,(1989)J.Neurosurg.71:105);美国专利号5,679,377;美国专利号5,916,597;美国专利号5,912,015;美国专利号5,989,463;美国专利号5,128,326;PCT公开号WO99/15154;和PCT公开号WO99/20253。在持续释放制剂中使用的聚合物的实例包括但不限于,聚(甲基丙烯酸2-羟基乙酯)、聚(甲基丙烯酸甲酯)、聚(丙烯酸)、聚(乙烯-共-醋酸乙烯酯)、聚甲基丙烯酸、聚乙交酯(PLG)、聚酐、聚(N-乙烯吡咯烷酮)、聚乙烯醇、聚丙烯酰胺、聚乙二醇、聚乳酸(PLA)、聚(乳酸-共-乙醇酸)(PLGA)和聚原酸酯。在一个实施方案中,在持续释放制剂中使用的聚合物是惰性的、不含可沥滤的杂质、储存时稳定、无菌和可生物降解。受控释放系统或持续释放系统可置于预防性或治疗性靶标的附近,因此仅需要全身剂量的一部分(见例如,Goodson,inMedicalApplicationsofControlledRelease,上文,第2卷,第115-138页(1984))。在Langer,(1990),Science249:1527-1533的综述中讨论了受控释放系统。可用本领域技术人员已知的任意技术来产生包含本发明的一种或多种抗体或其片段的持续释放制剂。见,例如,美国专利号4,526,938;PCT公开WO91/05548;PCT公开WO96/20698;Ning等人,(1996),Radiotherapy&Oncology39:179-189;Song等人,(1995)PDAJournalofPharmaceuticalScience&Technology50:372-397;Cleek等人,(1997)Pro.Int'l.Symp.Control.Rel.Bioact.Mater.24:853-854;及Lam等人,(1997)Proc.Int'l.Symp.ControlRel.Bioact.Mater.24:759-760,其各自以其整体引入本文作为参考。如果局部施用本发明的抗体或其片段,则可将它们配制为软膏剂、霜、透皮贴剂、洗剂、凝胶、洗发液、喷雾、气雾剂、溶液、乳剂的形式,或本领域技术人员熟知的其他形式。见例如,Remington'sPharmaceuticalSciencesandIntroductiontoPharmaceuticalDosageForms,第19版,MackPub.Co.,Easton,Pa.(1995)。对不可喷雾的局部剂型,通常使用黏性至半固体或固体形式,该形式包含与局部施用相容的载体或一种或多种赋形剂,并在某些情况下具有大于水的动态黏度。合适的制剂包括但不限于,溶液、悬浮液、乳剂、霜、软膏剂、散剂、搽剂、油膏等等,如果希望,将该制剂灭菌或与助剂(例如防腐剂、稳定剂、润湿剂、缓冲液或盐)混合以影响多种性能,例如渗透压。其他合适的局部剂型包括可喷雾的气雾剂,其中将活性成分(在某些情况下与固体或液体惰性载体组合)包装在具有加压的挥发物(例如,气体推进剂,例如氟利昂)的混合物中或挤压瓶中。如果希望,也可在药物组合物和剂型中加入保湿剂或湿润剂。此类附加成分的实例是本领域熟知的。如果鼻内施用包含抗体或其片段的组合物,可将它配制为气雾剂形式、喷雾、薄雾或滴剂形式。尤其是,根据本发明使用的预防剂或治疗剂可方便地从加压包装或雾化器中,使用合适的推进剂(例如,二氯二氟甲烷、三氯氟甲烷、二氯四氟乙烷、二氧化碳或其他合适的气体),以气雾剂喷雾形式递送。在加压气雾剂的情况下,可通过提供阀门,确定剂量单位,以提供经计量的量。可配制用于吸入器或吹入器的胶囊和药筒(例如由明胶组成),其中含有本发明化合物和合适的粉末基料如乳糖或淀粉的粉末混合物。与第二治疗剂(例如,细胞因子、类固醇、化学治疗剂、抗生素或放射)共同施用或治疗的方法是本领域已知的(见例如,Hardman等人,(编)(2001)GoodmanandGilman'sThePharmacologicalBasisofTherapeutics,第10版,McGraw-Hill,NewYork,N.Y.;Poole和Peterson(编)(2001)PharmacotherapeuticsforAdvancedPractice:APracticalApproach,Lippincott,Williams&Wilkins,Phila.,Pa.;Chabner和Longo(编)(2001)CancerChemotherapyandBiotherapy,Lippincott,Williams&Wilkins,Phila.,Pa.)。有效量的治疗剂可使症状减少至少10%、至少20%、至少约30%、至少40%或至少50%。可与本发明的抗体或其片段组合施用的其它疗法(例如预防剂或治疗剂)可以与本发明的抗体或其片段相隔不到5分钟、相隔不到30分钟、相隔1小时、相隔约1小时、相隔约1至约2小时、相隔约2小时至约3小时、相隔约3小时至约4小时、相隔约4小时至约5小时、相隔约5小时至约6小时、相隔约6小时至约7小时、相隔约7小时至约8小时、相隔约8小时至约9小时、相隔约9小时至约10小时、相隔约10小时至约11小时、相隔约11小时至约12小时、相隔约12小时至18小时、相隔18小时至24小时、相隔24小时至36小时、相隔36小时至48小时、相隔48小时至52小时、相隔52小时至60小时、相隔60小时至72小时、相隔72小时至84小时、相隔84小时至96小时或相隔96小时至120小时施用。可在同一次患者就诊中施用2种或更多种疗法。可循环施用本发明的抗体或其片段和其他疗法。循环疗法涉及施用第一疗法(例如,第一预防剂或治疗剂)一段时间,接着施用第二疗法(例如,第二预防剂或治疗剂)一段时间,可选地,接着施用第三疗法(例如,预防剂或治疗剂)一段时间等等,并重复此相继施用,即循环以减少对疗法之一形成抗性,避免或减少疗法之一的副作用,和/或提高疗法的效力。在某些实施方案中,可配制本发明的抗体或其片段以确保在体内的恰当分布。例如,血脑屏障(BBB)排除许多高亲水性化合物。为了确保本发明的治疗性化合物跨过BBB(如果希望),可将它们配制在例如脂质体中。有关制备脂质体的方法,见例如美国专利号4,522,811、5,374,548和5,399,331。脂质体可包含一个或多个选择性转运至特定细胞或器官的部分,从而增强靶向药物递送(见例如,Ranade,(1989)J.Clin.Pharmacol.29:685)。示例性靶向部分包括叶酸或生物素(见例如,Low等人的美国专利号5,416,016);甘露糖苷(Umezawa等人,(1988)Biochem.Biophys.Res.Commun.153:1038);抗体(Bloeman等人,(1995)FEBSLett.357:140;Owais等人,(1995)Antimicrob.AgentsChemother.39:180);表面活性剂蛋白A受体(Briscoe等人,(1995)Am.J.Physiol.1233:134);p120(Schreier等人,(1994)J.Biol.Chem.269:9090);还见K.Keinanen;M.L.Laukkanen(1994)FEBSLett.346:123;J.J.Killion;I.J.Fidler(1994)Immunomethods4:273。本发明提供对有需要的个体单独施用或与其他疗法组合施用包含本发明的抗体或其片段的药物组合物的方案。可对个体同时或顺次施用本发明的组合治疗中的疗法(例如,预防剂或治疗剂)。也可循环施用本发明的组合治疗中的疗法(例如,预防剂或治疗剂)。循环疗法涉及施用第一疗法(例如,第一预防剂或治疗剂)一段时间,接着施用第二疗法(例如,第二预防剂或治疗剂)一段时间,并重复此相继施用,即循环,以减少对疗法之一(例如药物)产生抗性,避免或减少疗法之一(例如药物)的副作用,和/或提高疗法的效力。可对个体并行施用本发明的组合疗法中的疗法(例如,预防剂或治疗剂)。术语“并行”不限于在确切的同一时间施用疗法(例如,预防剂或治疗剂),而是指按一定顺序和时间间隔对个体施用包含本发明的抗体或其片段的药物组合物,使得本发明的抗体可与其他疗法一起作用,从而较之其原本的施用可以提供提高的益处。例如,可在同一时间或在不同时点以任意顺序顺次对个体施用各疗法;然而,如果不在同一时间施用,则应在足够接近的时间内施用,以提供希望的治疗效果或预防效果。可以以任意合适的形式和通过任意合适的途径对受试者分开施用各疗法。在多种实施方案中,以不到15分钟、不到30分钟、相隔不到1小时、相隔约1小时、相隔约1小时至约2小时、相隔约2小时至约3小时、相隔约3小时至约4小时、相隔约4小时至约5小时、相隔约5小时至约6小时、相隔约6小时至约7小时、相隔约7小时至约8小时、相隔约8小时至约9小时、相隔约9小时至约10小时、相隔约10小时至约11小时、相隔约11小时至约12小时、相隔24小时、相隔48小时、相隔72小时或相隔1周,对个体施用疗法(例如,预防剂或治疗剂)。在其他实施方案中,在同一次患者就诊中施用两种或更多种疗法(例如,预防剂或治疗剂)。组合疗法的预防剂或治疗剂可在同一药物组合物中施用给个体。备选地,可在分开的药物组合物中向个体并行施用组合疗法的预防剂或治疗剂。可通过相同或不同的施用途径对个体施用这些预防剂或治疗剂。现在已充分描述了本发明,通过以下实施例和权利要求进一步举例说明本发明,实施例和权利要求是举例说明性的,并非意在进一步限制。实施例实施例1:方法、材料和抗体筛选(i)细胞系BXPC-3、SK-Br-3、BT-474、MDA-MB-453、FaDu和MCF-7细胞系购自ATCC,并在补充10%胎牛血清(FBS)的生长培养基中常规维持。(ii)重组人、食蟹猴、小鼠和大鼠HER3载体的产生从小鼠脑cDNA(Clontech)PCR扩增鼠HER3胞外结构域并通过与RefseqNM_010153比较来验证序列。从Rat-2细胞mRNA逆转录大鼠HER3ECD并通过与NM_017218比较来验证序列。用来自多种食蟹猴组织的RNA(ZyagenLaboratories)产生食蟹猴HER3cDNA模板,并将RT-PCR产物克隆进-TOPO-XL(Invitrogen),然后进行双链测序。人HER3衍生自人胎儿脑cDNA文库(Source)并通过与NM_001982比较来验证序列。为了产生带标记(tag)的重组蛋白质,用PwoTaq聚合酶(RocheDiagnostics)PCR扩增人、小鼠、大鼠和食蟹猴HER3。扩增的PCR产物经凝胶纯化并克隆进pDonR201(Invitrogen)Gateway入门载体(entryvector),该载体先前已修饰为包括符合读框的N-端CD33前导序列和C-端TAG,例如FLAGTAG。TAG允许通过抗TAG单克隆抗体纯化单体蛋白质。靶基因侧翼具有AttB1和AttB2,允许用克隆技术(Invitrogen)以重组进入Gateway适应化的专有目的载体(例如,pcDNA3.1)。用GatewayLR反应与含有CMV启动子的专有目的载体,进行重组反应,以产生TAG表达载体,但也可使用任意市售载体。产生其他的重组HER3蛋白,其中将HER3ECD融合在C-端因子X切割位点和人IgG铰链和Fc结构域的上游来产生Fc标记的蛋白质。为此,PCR扩增各种HER3ECD并将其克隆入载体(例如,pcDNA3.1),该载体修饰为含有符合阅读框的C-端因子X位点-铰链-hFc融合物。产生的可读框侧翼具有AttB1和AttB2位点,用于进一步通过重组克隆技术(Invitrogen)克隆。用LRGateway反应,将HER3-Fc转移入含有CMV启动子的目的表达构建体。使用标准定点突变方案,产生HER3点突变表达构建体,并验证所得到的载体序列。表8.HER3表达载体的产生。HER3氨基酸编号基于NP_001973(人)、NP_034283(小鼠)和NP_058914(大鼠)。(iii)重组HER3蛋白的表达在先前适应了悬浮培养并在Novartis专有无血清培养基中生长的HEK293衍生细胞系中,表达希望的HER3重组蛋白。基于脂质转染,在瞬时6孔板转染测定试验中进行小规模表达验证。通过瞬时转染进行的大规模蛋白质生产,在WaveTM生物反应器系统(WaveBiotech)中以10-20L的规模进行。以1:3(w:w)的比例用DNA聚乙烯亚胺(Polysciences)作为质粒运载体。在转染后7-10天收获细胞培养物上清,并在纯化之前通过切向流过滤和渗滤浓缩。(iv)标记蛋白质的纯化通过收集细胞培养物上清并用10kDa截留滤器(Fresenius)通过切向流过滤浓缩10倍,纯化重组标记的HER3蛋白(例如,TAG-HER3)。按10mg抗体/mL树脂的最终比率,将抗TAG单克隆抗体与CNBr活化的Sepharose4B偶联,制备抗TAG柱。按1-2mL/分钟的流速,将浓缩的上清加至35ml抗Tag柱。在用PBS进行基线洗涤后,用100mM甘氨酸(pH2.7)洗脱结合的物质、中和并无菌过滤。通过测量在280nm处的吸光度并用0.66AU/mg的理论系数进行转化来测定蛋白质浓度。最后通过SDS-PAGE、N-端测序和LC-MS来表征纯化的蛋白质。(v)FcTag纯化按1ml/分钟的流速将浓缩的细胞培养物上清加至50ml蛋白质ASepharoseFastFlow柱。在用PBS进行基线洗涤后,用10倍柱体积的10mMNaH2PO4/30%(v/v)异丙醇pH7.3洗涤柱,接着用5倍柱体积的PBS洗涤。最后,用50mM柠檬酸盐/140mMNaCl(pH2.7)洗脱结合的物质、中和并无菌过滤。(vi)过表达细胞系的产生为了产生在细胞表面表达高水平HER3的细胞系,构建了哺乳动物表达载体,该载体含有插入片段,该插入片段编码在人HER3的氨基酸残基20-667上游的CD33前导序列,而且该HER3序列与人EGFR的氨基酸残基669-1210符合读框地融合。在哺乳动物细胞中表达时,得到的嵌合蛋白包含N-端HER3胞外结构域和跨膜结构域和C-端EGFR胞质结构域。将HER3/1载体转染进CHO-S细胞(Invitrogen),在抗生素选择后产生稳定的库。得到的细胞系(CHOHER3/1)在其细胞表面表达高水平的HER3胞外结构域。(vii)HuCAL淘选为了选择识别人HER3的抗体,利用了多重淘选策略。用市售噬菌体展示文库MorphoSysHuCAL文库作为抗体变体蛋白的来源,通过选择具有高结合亲和力的克隆,产生了针对人HER3蛋白的治疗性抗体。该噬菌粒文库基于的概念(Knappik等人,(2000)JMolBiol296:57-86),并利用技术在噬菌体表面展示Fab(Lohning的WO01/05950)。为了分离抗HER3抗体,用固相、溶液、全细胞和差异全细胞淘选方法,进行标准淘选策略和RapMAT淘选策略。(viii)固相淘选为了鉴定抗HER3抗体,用不同的重组HER3蛋白,实施多种固相淘选策略。为了进行每一轮固相淘选,用HER3蛋白包被Maxisorp板(Nunc)。用先前以抗Fc(山羊或小鼠抗人IgG,JacksonImmunoResearch)或抗Tag抗体包被的板或通过被动吸附来捕获标记的蛋白质。用PBS洗涤包被的板并封闭。用PBS洗涤包被的平板2次,然后加入HuCAL噬菌体-抗体,在摇床上室温孵育2小时。洗脱结合的噬菌体,加至大肠杆菌TG-1并孵育进行噬菌体感染。随后分离被感染的细菌并涂在琼脂板上。从板上刮下菌落,并拯救和扩增噬菌体。每种HER3淘选策略由多轮淘选组成,并含有独特的抗原、抗原浓度和洗涤严格度。(ix)溶液相淘选用多种生物素化的重组HER3蛋白,在存在或缺乏神经调节蛋白1-β1(R&DSystems)的情况下,进行每一轮溶液相淘选。用EZ-连接磺基-NHS-LC生物素化试剂盒(Pierce),根据制造商的说明书,生物素化蛋白质。用PBS洗涤800μl链霉抗生物素蛋白连接的磁珠(Dynabeads,Dynal)一次,并用Chemiblocker(Chemicon)封闭过夜。在反应管中孵育HuCAL噬菌体-抗体和合适的生物素化HER3。加入链霉抗生物素蛋白磁珠20分钟,并用磁性颗粒分离器(Dynal)收集磁珠。通过向每个管加入含DTT的缓冲液,从Dynabeads上洗脱结合的噬菌体,并加至大肠杆菌TG-1。用与在固相淘选中描述的方式相同的方式进行噬菌体感染。每种HER3淘选策略由多轮淘选组成,并含有独特的抗原、抗原浓度和洗涤严格度。(x)基于细胞的淘选对于细胞淘选,将HuCAL噬菌体-抗体与大约107个细胞在旋转器上室温孵育2小时,接着离心。分离细胞沉淀,从细胞上洗脱噬菌体。收集上清并加至大肠杆菌TG-1培养物,接着进行上述过程。利用两种基于细胞的策略来鉴定抗HER3抗体:a)全细胞淘选:在此策略中,用多种完整的细胞系作为抗原。b)差异全细胞淘选:在此策略中,抗原相继为细胞和重组HER3蛋白质(作为实例,见1981.09)。按上文所述进行基于细胞的淘选,而在用重组蛋白作为抗原时,利用固相淘选方案。用PBS(2-3X)和PBST(2-3X)进行洗涤。(xi)RapMATTM文库产生和淘选为了提高抗体结合亲和力同时维持文库的多样性,使溶液和固相淘选的第二轮输出物进入RapMATTM程序,而全细胞和差异全细胞淘选策略的第三轮输出物进入此程序(Prassler等人,(2009)Immunotherapy;1:571-583)。通过将经由淘选选择的噬菌体的Fab编码插入片段亚克隆入展示载体25_bla_LHC以产生RapMATTM文库,并通过用特异性限制酶进一步消化来产生H-CDR2RapMATTM文库和L-CDR3RapMATTM文库。根据汇合物(pool)组成,用TRIM成熟盒(Virnekas等人,(1994)NucleicAcidsResearch22:5600-5607)将插入片段替换为H-CDR2或L-CDR3。文库大小预计在8x106-1x108个克隆的范围内。产生了RapMAT抗体-噬菌体并用之前所述的实验方法再进行两轮溶液、固相或基于细胞的淘选。实施例2:抗HER3IgG的瞬时表达在BioWave20中培养适应悬浮的HEK293-6E细胞至约2x106活细胞/mL的密度。用相关的无菌DNA:PEI-MIX瞬时转染细胞并进一步培养。转染后7天,通过使用Fresenius滤器(0.2μm)的交叉流过滤,去除细胞。用10kDa截留滤器(Fresenius)通过交叉流过滤浓缩不含细胞的材料,将浓缩物通过stericup滤器(0.22μm)无菌过滤除菌。将无菌上清储存在4℃。实施例3:抗HER3IgG的纯化在冷却柜中在6℃在100explorerAir色谱系统上进行IgG的纯化,其中使用具有25mL自填装MabSelectSuRe树脂的XK16/20柱(均为GEHealthcare)。除了上样外,所有流速均为3.5mL/分钟,压力限制为5bar。用3倍柱体积的PBS平衡柱,然后按2.0mL/分钟上样经过滤的发酵上清。用8个柱体积的PBS洗涤柱。用pH梯度洗脱IgG,所述pH梯度为从50mM柠檬酸盐/70mMNaCl(pH4.5)开始并在12个柱体积中线性下降至50mM柠檬酸盐/70mMNaCl(pH2.5),接着是2个柱体积的相同pH2.5缓冲液的恒定步骤。合并含有IgG的级分,立即中和,并无菌过滤(MilliporeSteriflip,0.22um)。测量OD280,并基于序列数据计算蛋白质浓度。分开地测试合并物(pool)的聚集(SEC-MALS)和纯度(SDS-PAGE和MS)。实施例4:-Fab抗体在大肠杆菌中的表达和纯化用500mL补充了34μg/mL氯霉素的2xYT培养基,在摇瓶培养物中,进行X9_Fab_MH编码的Fab片段在TG-1细胞中的表达。在30℃摇动培养物直至OD600nm达到0.5。通过在30℃加入0.75mMIPTG(异丙基-β-D-硫代半乳糖苷)20小时来诱导表达。用溶菌酶破裂细胞。通过IMAC(Bio-Rad)分离His6-标记的Fab片段。用PD10柱将缓冲液更换为1xDulbecco′sPBS(pH7.2)。无菌过滤样品(0.2μm)。通过紫外分光光度法测定蛋白质浓度。在变性还原的15%SDS-PAGE中分析样品纯度。通过使用校准标准,以大小排阻层析(HP-SEC),确定在非变性状态下Fab制备物的同质性。实施例5:通过溶液平衡滴定(SET)测量HER3抗体亲和力(KD)基本上按之前所述(Friguet等人,(1985)JImmunolMethods77:305-19),进行溶液中亲和力测定。为了提高SET法的灵敏度和准确性,将其从经典的ELISA改变为基于ECL的技术(Haenel等人,(2005)Analbiochem339:182-84)。用之前所述的未标记的HER3-Tag(人、大鼠、小鼠或食蟹猴)通过SET进行亲和力测定。用XLfit软件(IDBusinessSolutions),应用自定义拟合模型评估数据。对于每种IgG的KD确定,使用以下模型(根据Piehler等人(Piehler等人,(1997)JImmunolMethods201:189-206修改)。[IgG]:应用的总IgG浓度x:应用的总可溶性抗原浓度(结合部位)Bmax:没有抗原的IgG的最大信号KD:亲和力。实施例6:通过FACS测定抗体细胞结合通过FACS评估抗体与人癌细胞上表达的内源人抗原的结合。为了测定抗体EC50值,用accutase收获SK-Br-3细胞并在FACS缓冲液(PBS/3%FBS/0.2%NaN3)中稀释至1x106细胞/mL。向96孔板(Nunc)的每个孔加入1x105细胞/孔并以210g在4℃离心5分钟,然后去除上清。将测试抗体的系列稀释液(用FACS缓冲液在1:4的稀释步骤中稀释)加入沉淀的细胞,并在冰上孵育1小时。用100μLFACS缓冲液洗涤并沉淀细胞3次。将用FACS缓冲液1/200稀释的PE缀合的山羊抗人IgG(JacksonImmunoResearch)加入细胞,并在冰上孵育1小时。用100μLFACS缓冲液再进行3次洗涤步骤,接着进行离心步骤(在4℃以210g离心5分钟)。最后,在200μLFACS缓冲液中重悬细胞,用FACSArray(BDBiosciences)测量荧光值。通过测量平均通道荧光来评估细胞表面结合的抗HER3抗体的量。实施例7:HER3结构域和突变体结合用200ng合适的重组人蛋白质(HER3-标签、D1-2-标签、D2-标签、D3-4-标签、D4-标签、HER3K267A-标签、HER3L268A-标签、HER3K267A/L268A和标记的无关对照)在4℃过夜包被96孔Maxisorp板(Nunc)。然后用PBS/0.1%Tween-20洗涤所有孔3次,用PBS/1%BSA/0.1%Tween-20封闭1小时,并用PBS/0.1%Tween-20洗涤3次。将抗HER3抗体加入相关孔,直到对合适的孔加入10μg/mL的终浓度,并在室温孵育2小时。用PBS/0.1%Tween-20洗涤板3次,然后加入1/10000稀释在PBS/1%BSA/0.1%Tween-20中的合适的过氧化物酶连接的检测抗体。使用的检测抗体为山羊抗小鼠(Pierce,31432)、兔抗山羊(Pierce,31402)和山羊抗人(Pierce,31412)。板在室温孵育1小时,然后用PBS/0.1%Tween-20洗涤3次。将100μlTMB(3,3’,5,5’四甲基联苯胺)底物溶液(BioFx)加入所有孔6分钟,然后用50μl2.5%H2SO4终止反应。通过用SpectraMax酶标仪(MolecularDevices)测量OD450,确定HER3抗体与每种重组蛋白质的结合程度。适当时,用GraphpadPrism分析剂量应答曲线。实施例8:用氢/氘交换质谱进行HER3表位作图材料通过在重水(Sigma)中溶解25mMTBS(pH7.5)/500mMNaCl制备D2O缓冲液。还原溶液是50mM甲酸盐缓冲液(pH4)500mMTCEP,猝灭溶液是0.5%(v/v)于水中的三氟乙酸(TFA)。缓冲液A是于水中的0.25%甲酸/10%甲醇/10%乙二醇,缓冲液B是0.25%于乙腈中的甲酸。所有化学品购自Sigma,HPLC级溶剂购自FisherScientific。液体处理和层析基于Wales等人,(2006)Anal.Chem.78:1005-1014)描述的方法和设备,设计自动化氢/氘交换质谱(HDXMS)实验。简言之,所有液体处理操作使用放置于维持在2℃的冷冻室中的PalHTS液体操作器(LEAPTechnologies)。在液体操作器轨道上安装6通道喷射阀和洗涤站,便于样品注入层析系统和注射洗涤。层析系统由另外的10通道阀、2.1mmx30mmPoroszyme胃蛋白酶柱(AppliedBiosystems)、反相0.5mmx2mmCapTrap柱(MichromBioresources)、和自填装的电喷雾发射器作为分析柱(100μmx~60mm,Kinetex2.6μmC18,Phenomenex)组成。10通道阀头、捕获柱(trapcartridge)和分析柱放置在铝制的单独室中并通过PeltierStack维持在-5℃。配置阀和柱,以允许线上蛋白质消化、肽脱盐和反相层析,之后将样品引入质谱仪(LTQ-Orbitrap,ThermoScientific)的电喷射离子化(ESI)源。由2个分开的HPLC泵提供操作所需的液流。第一个HPLC(SurveyorMS泵,ThermoScientific)以125μL/分钟的恒定流速递送缓冲液A,并用于将样品从固定的胃蛋白酶柱转移到跨10通道阀安装的反相捕获柱上。在上样和脱盐期之后,切换10通道阀,以在梯度泵(AQUITYUPLC,Waters)的帮助下从反相捕获柱洗脱样品,通过分析柱并进入质谱的离子源。在梯度洗脱期间分离固定化酶柱并废弃。梯度泵递送线性梯度区段——以5μL/分钟经35分钟递送0-40%的流动相B、以及以5μL/分钟经10分钟递送40-95%的流动相B。使用被动分流器在10通阀处分流来自泵的梯度流,使得梯度洗脱物通过捕获柱和分析柱的实际流速为~1μL/分钟。整个层析运行70分钟,包括洗涤和平衡步骤。质谱为了鉴定从在线消化得到的蛋白水解片段,进行了几个数据依赖性MS/MS实验。为了实现这些获取,用LTQ-Orbitrap混合质谱仪的LTQ分析器获取串联MS谱。前体质量选择基于Orbitrap分析仪获得的质谱扫描。通过Orbitrap(大于m/z400-2000)分析仪在60,000的分辨率上获得了为了氘化水平测定目的而进行的单级MS采集结果。蛋白质和蛋白质:Fab复合物的制备通过用25mMTBS(pH7.5)/500mMNaCl稀释50μgHER3-标签至50μL终体积,制备HER3蛋白。通过以1:1的摩尔比混合50μgHER3-标签和所研究的Fab,制备蛋白质:Fab复合物。然后用25mMTBS(pH7.5)/500mMNaCl将蛋白质:Fab混合物稀释至50μL终体积。制备蛋白质:Fab复合物并允许其在4℃孵育至少2小时。在每个实验开始前,将含有样品、稀释剂、猝灭溶液和还原溶液的4块96孔板装载在液体操作器上。用于交换实验(on-exchangeexperiment),用150μLD2O缓冲液稀释50μLHER3或HER3:Fab复合物。在用600μL猝灭缓冲液猝灭之前,通过加入200μL还原缓冲液1分钟还原混合物。在所有液体处理步骤后总体积为~1mL。一旦混合后,将猝灭后的溶液注入层析系统,样品在层析系统中自动消化、分离并通过LCMS分析。将样品和对照间的氘化平均变化计算为样品和对照的氘摄取水平间的差异。数据处理使用内部程序(RawXtract),将OrbitrapRAW文件转化为mzXML文件。随后使用SEQUEST(YatesLab,ScrippsResearchInstitute,LaJolla,CA)搜索串联质谱采集结果,并使用DTASelect2.0(YatesLab,ScrippsResearchInstitute,LaJolla,CA)自动过滤搜索结果。使用肽序列标识,使用内部编写的程序自动提取每个标识序列的单离子层析图,并生成跨层析峰的平均谱。使平均谱平滑并具有形心(centroid)。将氘摄取水平取为氘化样品和非氘化参考间的质量差异。手工验证处理的数据并调整以纠正来自自动化处理步骤的不准确性和错误。通过将氘含量跨每个肽离域(即用观察到的氘化水平除以该肽中氨基酸的数量),将氘摄取水平分配给蛋白质序列的每个残基。如果一个残基被多于一个肽覆盖,则对覆盖该残基的所有肽的标化氘摄取进行平均。实施例9:人HER3/MOR09823Fab和人HER3/MOR09825Fab复合物的X射线晶体结构测定本实施例呈现了与MOR09823的Fab片段和MOR09825的Fab片段结合的全长HER3的晶体结构,分别在和的分辨率上测定。在PBS(pH7.3)中平衡的HiLoad26/60Superdex200PrepGrade柱(GEHealthcare)上进一步纯化标记的人HER3。通过用溶菌酶裂解细胞,分离大肠杆菌表达的MOR09823和MOR09825Fab,并在HisTrap_HP(GEHealthcare)柱上捕获His6-标记的Fab片段。使用在25mMTris(pH7.5)、150mMNaCl中平衡的Superdex7516/60柱(GEHealthcare),通过凝胶过滤层析,进一步纯化MOR09823Fab片段。通过以1.3-1.8:1的摩尔比(通过在280nm处的吸光度估计的浓度,对HER3和Fab分别使用0.9和1.4(mg/ml)-1cm-1的计算的消光系数)混合过量的Fab和标记的HER3,制备HER3Fab复合物,并在25mMTris(pH7.5)、150mMNaCl中平衡的Superdex20010/300柱(GEHealthcare)上纯化该复合物。通过SDS-PAGE和LCMS分析峰级分。对于每种复合物,合并含有约等摩尔比的HER3和Fab的级分并浓缩。从含有150nlHER3/MOR09823复合物和150nl池液(100mM柠檬酸钠pH5.6、20%PEG4000和20%异丙醇)的液滴,通过坐滴蒸汽扩散,在293K生长HER3/MOR09823晶体。将晶体转移至含有额外的8%甘油的池液中并在液氮中速冻。从含有150nlHER3/MOR09825复合物和150nl池液(100mMbis-TrispH6.5、16%PEG10,000)的液滴,通过坐滴蒸汽扩散,在293K生长HER3/MOR09825晶体。将晶体转移至100mMBis-trispH6.5、18%PEG10,000和22%甘油,并在液氮中速冻。以AdvancedPhotonSource(ArgonneNationalLaboratory),在光束17-ID下,收集数据。处理HER3/MOR09823Fab复合物的数据,并使用HKL2000(HKLResearchInc)以按比例缩放,空间群I222,晶胞尺寸a=124.16、b=139.44、统计学良好。用Phaser(McCoy等人,(2007)J.Appl.Cryst.40:658-674),通过分子置换,解析HER3/MOR09823Fab的结构,用Fab片段和公开的HER3ECD结构1mb6作为搜索模型。在COOT(Emsley&Cowtan(2004)ActaCryst.60:2126-2132)中建立每个不对称单位含有1分子HER3/MOR09823Fab复合物的最终模型,并用BUSTER(GlobalPhasing,LTD),精化至R和R自由值分别为19.0和24.5%,键长和键角的rmsd分别为和1.37°。如PyMOL(LLC)中所鉴定的,含有在MOR09823Fab的任意原子以内的原子的HER3残基在表11和12中列出。处理HER3/MOR09825Fab复合物的数据,并用autoPROC(GlobalPhasing,LTD)以按比例缩放,空间群I222,晶胞尺寸a=124.23、b=140.94、统计性良好。用Phaser(McCoy等人,(2007)J.Appl.Cryst.40:658-674),通过分子置换,解析HER3/MOR09825Fab的结构,用HER3/MOR09823Fab结构作为搜索模型。在COOT(Emsley&Cowtan(2004)ActaCryst.60:2126-2132)中建立每个不对称单位含有1分子HER3/MOR09825Fab复合物的最终模型,并用BUSTER(GlobalPhasing,LTD)精化至R和R自由值分别为18.8和24.9%,键长和键角的rmsd分别为和1.21°。如PyMOL(LLC)中所鉴定的,含有在MOR09825Fab的任意原子以内的原子的HER3残基在表13和14中列出。实施例10:磷酸-HER3体外细胞测定试验在DMEM/F12、15mMHEPES、L-谷氨酰胺、10%FCS中常规维持MCF-7细胞,在McCoy5a、10%FCS、1.5mML-谷氨酰胺中常规维持SK-Br-3细胞。用accutase(PAALaboratories)收获在完全培养基中生长的近汇合的MCF7或SK-Br-3细胞,并在合适的培养基中以5x105细胞/mL的终浓度重悬。然后向96孔平底板(Nunc)的每个孔加入100μL细胞悬液,得到5x104细胞/孔的最终密度。允许MCF7细胞贴壁约3小时,然后将培养基更换为含有0.5%FBS的饥饿培养基。然后将所有板在37℃孵育过夜,之后用合适浓度的HER3抗体(在合适的培养基中稀释)在37℃处理80分钟。最后20分钟用50ng/mL神经调节蛋白1-β1EGF结构域(R&DSystems)处理MCF7细胞以刺激HER3磷酸化。缓慢地吸去所有培养基,用含有1mMCaCl2和0.5mMMgCl2(Gibco)的冰冷PBS洗涤细胞。通过加入50μL冰冷的裂解缓冲液(20mMTris(pH8.0)/137mMNaCl/10%甘油/2mMEDTA/1%NP-40/1mM正钒酸钠/抑肽酶(10μg/mL)/亮抑酶肽(10μg/mL))裂解细胞,在冰上振荡孵育30分钟。然后收集裂解物并在4℃以1800g离心15分钟以去除细胞碎片。将20μL裂解物加至预先制备的捕获板。用碳板(MesoscaleDiscovery)制备HER3捕获板,该碳板用20μL在PBS中稀释的4μg/mLMAB3481捕获抗体(R&DSystems)在4℃包被过夜,随后用在1xTris缓冲液(MesoscaleDiscovery)/0.1%Tween-20中的3%牛血清白蛋白封闭。通过将板在室温振荡孵育1小时从裂解物中捕获HER3,然后吸去裂解物,用1xTris缓冲液(MesoscaleDiscovery)/0.1%Tween-20洗涤孔。用在1%BSA/1xTris/0.1%Tween-20中制备的0.75μg/mL生物素化的抗磷酸酪氨酸抗体(R&DSystems),通过在室温振荡孵育1小时来检测磷酸化的HER3。用1xTris/0.1%Tween-20洗孔4次,并通过与在1%BSA/1xTris/0.1%Tween-20中稀释的S-Tag标记的链霉抗生物素(MesoscaleDiscovery)室温孵育1小时,检测生物素化的蛋白质。吸去每个孔,用1xTris/0.1%Tween-20洗涤4次,然后加入含有表面活性剂的20μL阅读缓冲液T(MesoscaleDiscovery),用MesoscaleSectorImager定量信号。在信号传导实验中包括抗体MOR06391或MOR03207作为同种型对照。实施例11:磷酸-Akt(S473)体外细胞测定试验用accutase(PAALaboratories)收获在完全培养基中生长的近汇合的SK-Br-3和BT-474细胞,并在合适的培养基中以5x105细胞/mL终浓度重悬。然后向96孔平底板(Nunc)的每个孔加入100μL细胞悬液,得到5x104细胞/孔的最终密度。然后将所有板在37℃孵育过夜,之后用合适浓度的HER3抗体(在合适的培养基中稀释)在37℃处理80分钟。缓慢吸去所有培养基,并用含有1mMCaCl2和0.5mMMgCl2(Gibco)的冰冷PBS洗涤细胞。通过加入50μL冰冷的裂解缓冲液(20mMTris(pH8.0)/137mMNaCl/10%甘油/2mMEDTA/1%NP-40/1mM正钒酸钠/抑肽酶(10μg/mL)/亮抑酶肽(10μg/mL))裂解细胞,在冰上振荡孵育30分钟。然后收集裂解物并在4℃以1800g离心15分钟以去除细胞碎片。将20μL裂解物加至先前已用3%BSA/1xTris/0.1%Tween-20封闭的多点384孔磷酸-Akt碳板(MesoscaleDiscovery)。将板在室温振荡孵育2小时,然后吸去裂解物,用1xTris缓冲液(MesoscaleDiscovery)/0.1%Tween-20洗涤孔4次。用在1%BSA/1xTris/0.1%Tween-20中稀释50倍的20μLSULFO-TAG抗磷酸-Akt(S473)抗体(MesoscaleDiscovery)通过在室温振荡孵育2小时来检测磷酸化的Akt。用1xTris/0.1%Tween-20洗涤孔4次,然后加入20μL含有表面活性剂的阅读缓冲液T(MesoscaleDiscovery),用MesoscaleSectorImager定量信号。在信号传导实验中包括抗体MOR06391或MOR03207作为同种型对照。实施例12:细胞系增殖测定试验在补充10%胎牛血清的改良的McCoy’s5A培养基中常规培养SK-Br-3细胞,并在补充10%FBS的DMEM中培养BT-474细胞。胰酶消化接近汇合的细胞,用PBS洗涤,用生长培养基稀释为5x104细胞/mL,并以5000细胞/孔的密度接种入96孔透明底黑色板(Costar3904)中。细胞在37℃孵育过夜,然后加入合适浓度的HER3抗体(通常终浓度为10或1μg/mL)。将板放回培养箱,6天后用CellTiter-Glo(Promega)评估细胞活力。向每个孔加入100μLCellTiter-Glo溶液并在室温下温和振荡孵育10分钟。用SpectraMax酶标仪(MolecularDevices)测定发光量。通过将使用每种HER3抗体获得的发光值与用标准同种型对照抗体(MOR06391)获得的发光值相比较,计算用每种抗体获得的生长抑制程度。对于增殖测定,在含有4mML-谷氨酰胺/15mMHEPES/10%FBS的DMEM/F12(1:1)中常规培养MCF-7细胞。胰酶消化接近汇合的细胞,用PBS洗涤,并用含有4mML-谷氨酰胺/15mMHEPES/10μg/mL人转铁蛋白/0.2%BSA的DMEM/F12(1:1)稀释为1x105细胞/mL。以5000细胞/孔的密度将细胞接种入96孔透明底黑色板(Costar)中。然后加入合适浓度的HER3抗体(通常终浓度为10或1μg/mL)。还向合适的孔加入10ng/mLNRG1-β1EGF结构域(R&DSystems)来刺激细胞生长。将板放回培养箱,6天后用CellTiter-Glo(Promega)评估细胞活力。通过减去背景(无神经调节蛋白)发光值并将每种抗HER3抗体获得的值与标准同种型对照抗体(MOR06391)获得的值相比较,计算用每种抗体获得的生长抑制程度。实施例13:配体阻断细胞测定试验漂洗在补充10%FBS和1μg/mL胰岛素(Sigma)的MEM中培养的MCF-7细胞并收集在小体积的FACSmax细胞解离缓冲液(Genlantis)中,然后加入5mLFACS缓冲液(PBS/1%FBS/0.1%叠氮化钠)。计数细胞密度并调整为1x106细胞/mL的终浓度。向96孔板的每个孔加入100μl细胞悬液,通过离心(220g,3分钟,4℃)沉淀细胞。在100μL用FACS缓冲液稀释的适合检测抗体中(一般最终抗体浓度范围在100至0.1nM)重悬细胞沉淀,在冰上孵育板45分钟。包括配体阻断性抗体MAB3481(R&DSystems)作为阳性对照。用染色缓冲液洗涤细胞2次,然后加入10nM用FACS缓冲液稀释的NRG1-β1EGF结构域(R&DSystems),在冰上孵育45分钟。用染色缓冲液洗涤细胞2次,通过在冰上孵育细胞和10nM抗人NRG1-β1EGF结构域抗体(R&DSystems)45分钟来检测结合的神经调节蛋白。用染色缓冲液洗涤细胞2次,并与用FACS缓冲液1/500稀释的PE连接的抗山羊抗体(JacksonImmunoResearch)在冰上孵育45分钟。然后通过离心沉淀细胞,在200μLFACS缓冲液中重悬沉淀。为了对每个样品进行定量,在LSRII流式细胞仪(BDBiosciences)上计数10,000个活细胞,并通过测量平均通道荧光来评估细胞表面结合的神经调节蛋白的量。实施例14:配体阻断生化测定试验本发明包括用基于表面等离子共振(SPR)的生物传感器(BiacoreTM,GEHealthcare,Uppsala,瑞典)检查HER3/抗体复合物结合神经调节蛋白的能力。BiacoreTM利用表面等离子共振(SPR)现象检测和测量结合相互作用。在典型的Biacore实验中,将相互作用分子之一(神经调节蛋白)固定在基质上,而相互作用配偶体(HER3)流经表面。结合相互作用导致传感器表面质量的增加和传感器表面附近介质的折射率的相应直接变化。以共振单位(R.U.)记录折射率或信号的变化。以非侵入方式连续或实时监控由于复合物的结合和解离导致的信号变化,其结果以传感图的形式报告。用BiacoreTMT100(GEHealthcare,Uppsala,瑞典)进行在此报导的所有实验。在25℃进行传感器表面制备和相互作用分析。缓冲液和Biacore试剂购自GEHealthcare。在测定全程使用含有10mMHepespH7.4/150mMNaCl、0.05%P20、0.5%BSA的运行缓冲液。以5:1的摩尔比在冰上孵育NRG-1β1胞外结构域(R&DSystems)和EZ连接的磺基-NHS-LC-LC-生物素(Pierce)45分钟。通过加入过量的乙醇胺使反应猝灭,使用脱盐离心柱(Zeba)从生物素化的NRG中去除未偶联的生物素。在预先固定了约3000R.U.的ssDNA-链霉抗生物素(BiotinCAPture试剂盒)的传感器芯片CAP上捕获生物素化的NRG,以获得400-600R.U.范围的神经调节蛋白表面密度。通过从注入步骤省略生物素化的NRG,产生参考流动池,在该流动池表面仅存在ssDNA-链霉抗生物素。通过室温孵育10nM人HER3-Fc和递增浓度的(0–50nM)合适的检测抗体15分钟,产生HER3/抗体复合物,然后在BiacoreTM中在10℃孵育。通过在180秒中以60μL/min的流速注入HER3/抗体复合物顺序流经参考表面和神经调节蛋白表面,进行相互作用分析。以流速60μL/min,监测复合物的解离达180秒。在每个分析循环结束时进行表面再生,其中以30μL/min的流速,使用120秒的8M胍:1MNaOH(3:1)注射,接着120秒的30%乙腈/0.25MNaOH注射。实施例15:体内PD研究培养BxPC3和BT-474细胞并按实施例16和17所述植入雌性无胸腺nu/nuBalb/C小鼠(HarlanLaboratories)中。在肿瘤达到合适大小后,检查动物的肿瘤质量。从研究中排除具有溃烂的肿瘤的动物或具有充满流体的肿瘤的动物。通过侧向尾静脉注射,用抗体对剩余动物进行静脉内给药。在给定的时点,通过CO2窒息对动物实施安乐死,并通过心脏穿刺收集全血并置于1.5mLEppendorf收集管。立即切出肿瘤组织,置于有螺旋盖的聚丙烯样品管并在液氮中速冻。在-80℃储存组织直到制备裂解物。实施例16:体内BT-474效力研究在含有10%热失活的胎牛血清而不含抗生素的DMEM中培养BT-474细胞直到植入时。在细胞接种前1天,对雌性无胸腺nu/nuBalb/C小鼠(HarlanLaboratories)皮下植入持续释放的17β-雌二醇颗粒(InnovativeResearchofAmerica)以维持血清雌激素水平。在17β-雌二醇颗粒植入后1天,将悬液中的5x106细胞同位注射进第四乳腺脂肪垫,该悬液含有在Hank平衡盐溶液中的50%无酚红matrigel(BDBiosciences)。含有悬浮细胞的总注射体积为200μL。细胞植入后20天,具有约200mm3的肿瘤体积的动物入选功效研究。大体上,每组共10只动物入选功效研究。对于单活性剂研究,通过侧向尾静脉注射,用MOR10701或MOR10703对动物进行静脉内给药。首次给药采用40mg/kg的初始负荷剂量。在初始给药后,在研究期间对动物采用每隔一天20mg/kg的方案。对于组合研究,用MOR10701或MOR10703(20mg/kg,静脉注射,q2d)和次优剂量的曲妥珠单抗(1mg/kg,静脉注射,2qw)对动物进行给药。在研究期间,每周2次通过卡钳测量肿瘤体积。用以下公式计算百分比治疗/对照(T/C)值:如果ΔT>0,%T/C=100xΔT/ΔC其中:T=研究最后一天药物治疗组的平均肿瘤体积;ΔT=研究最后一天药物治疗组的平均肿瘤体积–给药首日药物治疗组的平均肿瘤体积;C=研究最后一天对照组的平均肿瘤体积;和ΔC=研究最后一天对照组的平均肿瘤体积–给药首日对照组的平均肿瘤体积。每周测量2次体重,根据体重调整剂量。用(BW当前-BW初始)/(BW初始)x100计算体重的%变化。数据表示为从治疗开始日起的百分比体重变化。将所有数据表示为平均值±平均值的标准差(SEM)。用Δ肿瘤体积和体重进行统计学分析。用单因素ANOVA和事后Tukey进行组间比较。对所有统计学评估,将显著性水平设为p<0.05。报导了相比载体对照组的显著性。实施例17:体内BxPC3效力研究在含有10%热失活的胎牛血清而不含抗生素的RPMI-1640培养基中培养BxPC3细胞直到植入时。对雌性无胸腺nu/nuBalb/C小鼠(HarlanLaboratories)皮下植入在50%磷酸缓冲盐溶液和50%matrigel的混合物中的10x106细胞。含有悬浮细胞的总注射体积为200μL。一旦肿瘤达到约200mm3的大小,动物入选效力研究。大体上,每组共10只动物入选效力研究。如果在入选前动物显示不寻常的肿瘤生长特征,则将动物排除在入选之外。通过侧向尾静脉注射对动物静脉内给药。首次给药采用40mg/kg的初始负荷剂量。在初始剂量后,在研究期间(治疗25天)对动物采用每隔一天20mg/kg的方案。按之前详述计算肿瘤体积和T/C值。实施例18:磷酸-Akt(S473)体内PD测定试验在冰上解冻约50mm3冷冻的肿瘤(例如BT-474或BXPC-3)组织,向每个样品加入100-300μL含有磷酸酶(Roche)和蛋白酶抑制剂(Roche)的T-PER缓冲液(Pierce)。所加入的裂解缓冲液体积取决于肿瘤样品的大小。用1.5mL研杵(FisherScientific)破碎组织,得到的悬液在冰上孵育15分钟,然后在-80℃冷冻过夜。解冻样品并在4℃以13000g离心15分钟,然后通过BCA测定(ThermoScientific)定量上清蛋白质浓度。用裂解缓冲液(MesoscaleDiscovery)稀释组织上清,并将25μg加入先前用封闭溶液-A(MesoscaleDiscovery)封闭的多点96孔磷酸-Akt碳板(MesoscaleDiscovery)。在室温振荡孵育板1小时,然后吸去裂解物,用Tris洗涤缓冲液(MesoscaleDiscovery)洗涤孔4次。使用在抗体稀释缓冲液中稀释的25μLSULFO-TAG抗磷酸-Akt(S473)抗体(MesoscaleDiscovery),通过在室温振荡孵育1小时,检测磷酸化的Akt。用Tris洗涤缓冲液洗涤孔4次,然后加入150μL阅读缓冲液T(含有表面活性剂)(MesoscaleDiscovery),用MesoscaleSectorImager定量信号。实施例19:磷酸HER3(Y1197)体内PD测定试验在冰上解冻约50mm3冷冻的肿瘤(例如BXPC-3)组织,向每个样品加入100-300μL含有磷酸酶(Roche)和蛋白酶抑制剂(Roche)的T-PER缓冲液(Pierce)。用1.5mL研杵(FisherScientific)破碎组织,得到的悬液在冰上孵育15分钟,然后在-80℃冷冻过夜。解冻样品并在4℃以13000g离心15分钟,然后通过BCA测定(ThermoScientific)定量上清蛋白质浓度。用裂解缓冲液稀释组织上清,并将150μg加入先前用4μg/mLMAB3481(R&DSystems)过夜包被并用3%奶粉封闭的多点96孔碳板(MesoscaleDiscovery)。在室温振荡孵育板2小时,然后吸去裂解物,用Tris洗涤缓冲液(MesoscaleDiscovery)洗涤孔4次。使用以封闭缓冲液1/8000稀释的抗HER3pY1197结合磷酸化的HER3。在室温孵育1小时后用Tris洗涤缓冲液洗涤孔,并使用在封闭缓冲液中1/1000稀释的S-Tag标记的抗兔抗体(MesoscaleDiscovery),通过在室温振荡孵育1小时,检测抗pY1197抗体。用Tris洗涤缓冲液洗涤孔4次,然后加入150μL1/4稀释的阅读缓冲液T(含有表面活性剂)(MesoscaleDiscovery),用MesoscaleSectorImager定量信号。实施例20:体外药物组合研究为了评估HER3靶向抗体与靶向疗法组合的能力,在细胞活力测定试验中将MOR09825或MOR10703与曲妥珠单抗、拉帕替尼、BEZ235、BKM120、BYL719、RAD001、埃罗替尼和西妥昔单抗组合。将约1000-1500个SK-Br-3(McCoy’s)、MDA-MB-453(RPMI)、FaDu(EMEM)或L3.3(RPMI)细胞接种在384孔板中补充了2%FBS的合适培养基中,并允许在37℃贴壁过夜。随后将合适的药物组合(拉帕替尼、BKM120和BYL719的典型最终药物浓度范围在3μM至13nM;RAD001的范围在27nM至0.0041nM;埃罗替尼的范围在1μM至0.0025nM;MOR1073的范围在100nm至0.01nm;西妥昔单抗的范围在100nM至0.0015nM;和曲妥珠单抗的范围在300nM至0.046nM)加入孔,使得每块板以二维矩阵的形式含有每种药物的剂量应答曲线。将板放回培养箱,3-6天后用CellTiter-Glo(Promega)评估细胞活力。将CellTiter-Glo溶液加入每个孔,在室温温和振荡孵育10分钟。用SpectraMax酶标仪(MolecularDevices)测定发光量。计算每种组合所获得的生长抑制程度,并用Loewe相加模型突显出组合活性。实施例21:L3.3细胞中的体内药物组合研究在含有10%热失活的胎牛血清的DMEM培养基中培养胰腺L3.3细胞直至植入时。对雌性Foxn1裸鼠(HarlanLaboratories)皮下植入3x106在无FBS的DMEM中的细胞。含有悬浮细胞的总注射液体积为100μL。细胞植入后12天,动物入选功效研究,其中对于所有组,平均肿瘤体积约100mm3。大体上,每组共8只动物入选研究。如果在入选前动物显示不寻常的肿瘤生长特征,则将其排除在入选之外。通过侧向尾静脉注射,用MOR10703对动物进行静脉内给药,在研究期间(治疗14天)采用每隔一天20mg/kg的方案。埃罗替尼以每天50mg/kg(PO)的方案作为单活性剂或与MOR10703组合进行给药。按之前所述计算肿瘤体积和T/C值。结果和讨论综合地,这些结果显示,一类抗体结合HER3的构象表位的结构域2和结构域4内的氨基酸残基并将HER3稳定在失活或封闭构象。这些抗体的结合抑制配体依赖性和非配体依赖性信号传导。这些抗体还能与HER3配体同时结合。(i)亲和力测定通过上文所述的溶液平衡滴定(SET),测定了抗体亲和力。结果总结在表9中,并且MOR10701的实例滴定曲线包含在图1中。数据表明,鉴定到了许多紧密结合人、食蟹猴、大鼠和小鼠HER3的抗体。表9:通过溶液平衡滴定(SET)测定的抗HER3IgG的KD值。Hu(人)、Cy(食蟹猴)、Mu(小鼠)和ra(大鼠)。(ii)SK-Br-3细胞EC50测定通过计算所鉴定的抗体结合HER2扩增的细胞系SK-Br-3的EC50值,测定所述抗体结合HER3表达细胞的能力(见图2和表10)。表10:抗HER3IgG在SK-Br-3细胞上的FACSEC50值。n.d.(未测定)MOR#SK-Br-3FACSEC50(pM)09823630098243240982583909974n.d.10701n.d.10702n.d.107032454(iii)HER3结构域结合在ELISA测定中表征了一个抗HER3抗体子集结合人HER3的各种胞外结构域的能力。为此,将HER3的胞外结构域分为4个组成型结构域,并按上文所述将这些结构域的各种组合克隆、表达和纯化为独立的蛋白质。用此策略将以下结构域成功产生为可溶性蛋白质:结构域1和2(D1-2)、结构域2(D2)、结构域3和4(D3-4)及结构域4(D4)。作为阳性对照,还检测了若干内部产生的小鼠抗人HER3抗体(8D7、1F5和8P2),以证明每个分离的结构域的完整性。如图3中所示,观察到MOR09823和MOR09825都成功结合HER3的胞外结构域,但在此测定中用这些抗体观察到很少与分离的结构域结合。对此结合模式有几个可能的解释:a)MOR09823和MOR09825可能结合跨结构域边界的线性表位,因此在把结构域表达为分离的蛋白质时结合表位的一部分将发生丢失。b)MOR09823和MOR09825可能结合跨多个结构域的非线性表位。因此,将HER3分解为其组分单位可能破坏结合位点。c)HER3的形状/构象可能是MOR09823和MOR09825结合HER3的要素,这使得只有HER3的全长胞外结构域能够采取此形状/构象,而分离的结构域不能完全呈现此构象。(vi)用氢/氘交换质谱进行HER3表位作图在存在和缺乏Fab形式的MOR09823、MOR09824、MOR09825和MOR09974的情况下,通过HER3ECD的HDX-MS分析,进一步研究了HER3表位。图4A显示,在缺乏结合的Fab的情况下,约69%的HER3ECD序列被至少一个肽覆盖。覆盖缺口可能是由于这些区域中残基的糖基化或半胱氨酸富含区中二硫键的不充分还原,这在结构域2中尤其明显。有趣的是,尽管每种Fab产生各自的保护模式,但在MOR09823、MOR09824、MOR09825和MOR09974中一致观察到一个强保护区(见图4B),指示这些高度相关的抗体家族以相同的方式结合HER3。对结构域2残基269-286(TFQLEPNPHTKYQYGGVC)(SEQIDNO:146)观察到最强的保护,指示这附近的残基可能对mAb结合是重要的。将Fab保护的残基作图绘制在公开的HER3晶体结构(Cho&Leahy,(2002)Science297:1330-1333)上,突显出残基269-286在结构域2中位于功能上重要的β-发夹环内和附近(见图4C)。(vii)HER3/MOR09823晶体结构解析了与HER3胞外结构域结合的MOR09823Fab片段的分辨率的X射线晶体结构,以进一步定义由此相关的抗体家族识别的HER3表位(见图5A)。此外,解析了与人HER3结合的MOR09825Fab片段的结构。在MOR09823/HER3和MOR09825/HER3晶体结构中,HER3都处于束缚(失活)构象(见图5A、B、C和D)。此构象的特征在于由结构域2中的β-发夹二聚化环所介导的结构域2和4之间的显著相互作用界面。观察到的HER3构象与Cho等人(Cho&Leahy,(2002),Science297:1330-1333)之前描述的类似,他们公开了缺乏神经调节蛋白的情况下的HER3胞外结构域的晶体结构。由于神经调节蛋白可激活HER3,推测HER3的束缚构象是失活的。在相关EGFR家族成员HER4(Bouyain等人,(2005)Proc.Natl.Acad.Sci.USA,102:15024-15029)和HER1(Ferguson等人,(2003)Molec.Cell11:507-517)结晶时,也观察到类似的束缚构象。失活(束缚)态中HER3的结构域1至4之间的空间关系与伸展(激活)态中的空间关系显著不同。此发现所基于的是,相关EGFR家族成员HER2和配体结合的HER1的晶体结构(Cho等人,(2003)Nature421:756-760;Ogiso等人,(2002)Cell110:775-787;Garrett等人,(2002)Cell110:763-773),二者均处于伸展(激活)态。在伸展态中,结构域2的β-发夹二聚化环从其与结构域4的抑制性相互作用中被释放出来,并因此可自由地与其二聚化配偶体蛋白质相互作用。因此,结构域2的β-发夹二聚化环在维持束缚(失活)态、以及介导伸展态中EGF受体的二聚化从而导致胞内激酶结构域激活中具有重要功能。因此MOR09823/HER3和MOR09825/HER3的晶体结构(见图5)提示,MOR09823和MOR09825都通过稳定HER3的失活构象发挥功能。晶体结构也显示,MOR09823和MOR09825都识别的HER3表位是包括来自结构域2和4的残基的非线性表位(见图5C和D,表11、12、13和14)。因此,由此高度相关的抗体家族所识别的HER3表位可定义为:结构域2:残基265-277、315结构域4残基:571、582-584、596-597、600-602、609-615由此,MOR09823或MOR09825与结构域2和4的结合将稳定HER3的束缚构象,从而拮抗其发放信号的能力。在晶体结构中观察到的MOR09823/MOR09825结合模式与我们的其他表位作图研究一致。具体而言,ELISA结构域结合实验证明,MOR09823和MOR09825对完整的HER3胞外蛋白的亲和力显著大于对任何分离的结构域(例如D1、D1-D2、D3或D3-D4片段)的亲和力(见图3)。这也与HER3HDX-MS的数据(见图4B)一致,其鉴定了结构域2的β-发夹是抗体识别表位的一部分。最后,两个晶体结构都显示,MOR09823或MOR09825的结合都不封闭HER3的配体结合表面(见图5B),该配体结合表面通过与HER1类比已经被作图到结构域1和3(Ogiso等人,(2002)Cell,110:775-787;Garrett等人,(2002)Cell,110:763-773)。这与我们的发现一致,即MOR09823和MOR09825都不阻断神经调节蛋白结合MCF7细胞(见图9),且在biacore研究中HER3/MOR09823复合物可结合固定化的神经调节蛋白(见图10)。表11:MOR09823Fab重链和人HER3之间的相互作用。FabVH残基的编号基于其线性氨基酸序列(SEQIDNO:15)。HER3残基的编号基于NP_001973。显示的HER3残基具有至少一个原子在MOR09823Fab的原子内。表12:MOR09823Fab轻链和人HER3之间的相互作用。FabVL残基的编号基于其线性氨基酸序列(SEQIDNO:14)。HER3残基的编号基于NP_001973。显示的HER3残基具有至少一个原子在MOR09823Fab的原子内。表13:MOR09825Fab重链与人HER3的相互作用。FabVH残基的编号基于其线性氨基酸序列(SEQIDNO:51)。HER3残基的编号是基于NP_001973。显示的HER3残基具有至少一个原子在MOR09825Fab的原子内。14:MOR09825Fab轻链与人HER3的相互作用。FabVL残基的编号基于其线性氨基酸序列(SEQIDNO:50)。HER3残基的编号是基于NP_001973。显示的HER3残基具有至少一个原子在MOR09825Fab的原子内。目检MOR09823/MOR09825的晶体结构揭示了,HER3残基Lys267和Leu268与多个抗体CDR形成了多重相互作用,表明它们可能在抗体结合中重要。因此,将Lys267和/或Leu268突变为丙氨酸,表达并纯化所得到的重组蛋白质以评估它们对抗体结合的影响。ELISA结合测定显示,Lys267或Leu268的突变破坏了MOR10703与HER3的结合(图5E),表明这两个残基是HER3表位的有机部分,由此支持了提出的MOR09823/MOR09825和HER3之间的相互作用。(viii)细胞信号传导的抑制为了确定抗HER3抗体对配体依赖性HER3活性的影响,将MCF7细胞与IgG孵育,然后用神经调节蛋白进行刺激。实例抑制曲线在图6A中显示并总结在表15中。还用HER2扩增的细胞系SK-Br-3,研究了抗HER3抗体对HER2介导的HER3激活的影响(图6B和表15)。表15:抗HER3IgG在MCF7和SK-Br-3细胞中的pHER3IC50和抑制程度值为了确定HER3活性的抑制是否影响下游细胞信号传导,还在HER2扩增的细胞中在用抗HER3抗体处理后测量了Akt磷酸化(见图7和表16)。表16:抗HER3IgG在SK-Br-3、BT-474和MCF7细胞中的pAkt(S473)IC50和抑制程度值总之,MOR09823、MOR09824、MOR09825、MOR09974、MOR10701、MOR10702MOR10703、MOR12609和MOR12610各自能够抑制配体依赖性和非配体依赖性方式的细胞HER3活性。(ix)增殖抑制由于MOR09823、MOR09824、MOR09825、MOR09974、MOR10701、MOR10702和MOR10703都抑制HER3活性和下游信号传导,测试了它们阻断配体依赖性和非依赖性体外细胞生长的能力(实例数据显示于图8中并总结在表17中)。所测试的抗HER3抗体都是有效的细胞增殖抑制剂。表17:在用10μg/ml抗HER3IgG处理后SK-Br-3、BT-474和MCF7细胞中的增殖抑制(x)配体阻断评估通过检查神经调节蛋白与先前用MOR09823或MOR09825处理的MCF7细胞的结合,评估了所述抗HER3抗体阻断配体结合的能力。MOR09823或MOR09825的存在对神经调节蛋白结合MCF7细胞的能力没有显著影响,而在实验中使用的阳性对照(Mab3481)能够显著地干扰神经调节蛋白的结合(见图9)。这些结果与晶体结构相符合,因为MOR09823与结构域2和4相互作用,而神经调节蛋白与HER3相互作用的主要接触点被推定主要集中在结构域1和3内。考虑到神经调节蛋白能够结合HER3的失活构象(Kani等人,(2005)Biochemistry44:15842-15857),MOR09823和MOR09825很可能通过阻止信号传导所必需的HER3结构域重排或通过干扰受体二聚化而起作用。(xi)配体阻断评估(生化)为了研究MOR09823和神经调节蛋白是否可同时结合HER3,用BiacoreTM技术建立了生化测定试验。使用BiotinCAPture试剂盒(GEHealthcare),通过在BiacoreTM传感器芯片CAP(GEHealthcare)表面捕获生物素化的神经调节蛋白,进行了相互作用分析。通过孵育人HER3-Fc和浓度递增的MOR09823、105.5(ThermoScientific)或人IgG,产生HER3复合物。将预先形成的HER3/抗体复合物注射至参考表面和活性表面,观察HER3与神经调节蛋白的相互作用。对照IgG对HER3/神经调节蛋白复合物的形成没有影响,而观察到105.5明显抑制HER3与神经调节蛋白结合的能力,证明其为配体阻断性抗体的描述(图10)。相反,HER3/MOR09823复合物能够结合神经调节蛋白,证明MOR09823不阻止配体结合。有趣的是,在注射MOR09823/HER3复合物时独有地观察到RU值的剂量依赖性增加。此数据表明,在芯片表面上产生了含有神经调节蛋白、HER3和MOR09823的三聚体复合物。HER3/MOR09823晶体结构预测了形成此三聚体复合物的能力,因为MOR09823的结合不封闭HER3的配体结合位点,表明神经调节蛋白和MOR09823的结合不是互相排斥的。在另一实施方案中,抗体或其片段结合HER3的结构域2和结构域4二者而不阻断HER3配体(如神经调节蛋白)的同时结合。尽管不需要提供理论,但可能的是,抗体或其片段结合HER3的结构域2和结构域4二者,导致将HER3保持在失活构象而不封闭HER3上的配体结合部位。因此,HER3配体(例如,神经调节蛋白)能够与抗体同时结合HER3。本发明的抗体或其片段抑制HER3的配体依赖性和非依赖性激活而不阻止配体结合。基于以下原因认为这是有利的:(i)因为每种HER3激活机制驱动不同的肿瘤类型,故相比靶向单种HER3激活机制(即配体依赖性或非配体依赖性)的抗体,本发明治疗性抗体将在广谱肿瘤中具有临床用途。(ii)本发明治疗性抗体将在同时涉及两种HER3激活机制的肿瘤类型中有效。靶向单种HER3激活机制(即配体依赖性或非配体依赖性)的抗体将在这些肿瘤类型中展示低效力或无效力。(iii)抑制HER3的配体依赖性激活而不阻止配体结合的抗体的功效将较少可能受递增浓度的配体的不良影响。这将转化为在由极高浓度HER3配体驱动的肿瘤类型中的增加的效力,或在由HER3配体的上调介导抗性时减少的药物抗性倾向。(iv)通过稳定化失活形式来抑制HER3激活的抗体将不易出现由旁路HER3激活机制驱动的药物抗性。因此,本发明的抗体可用于治疗现有治疗性抗体临床无效的病症。(xii)HER3活性的体内抑制和对肿瘤生长的影响为了测定所述抗HER3抗体的体内活性,在BxPC-3和BT-474肿瘤模型二者中都测试了MOR09823。如通过肿瘤pHER3水平的显著降低所反映的,MOR09823被证明可以抑制HER3活性(图11)。如在BxPC-3和BT-474中降低的pAkt水平所证实的,HER3的下游信号传导类似地受到抑制(图11)。在HER2驱动的BT-474效力研究中,重复的MOR10701处理导致74%的肿瘤生长抑制(见图12A),而MOR10703导致83%的抑制。在BxPC3肿瘤生长模型中,MOR10701和MOR10703都有效抑制了配体驱动的肿瘤生长(见图13)。(xiii)体外药物组合和对细胞生长的影响由于肿瘤细胞生长常常由多个信号传导途径驱动,我们评估了MOR09823或MOR10703与多种靶向活性剂的组合是否有利于阻断细胞增殖。选择的靶向活性剂主要抑制HER2(曲妥珠单抗、拉帕替尼)、EGFR(西妥昔单抗、埃罗替尼)、PI3K/mTOR(BEZ235)、PI3K(BKM120)、PIK3CA(BYL719)和mTOR(RAD001),因为这些靶标在人肿瘤中通常被激活。等效应图分析(见图14)显示,MOR09823和MOR10703展示了与曲妥珠单抗、拉帕替尼、埃罗替尼、西妥昔单抗、BEZ235、BKM120、BYL719和RAD001的协同药物组合。此数据表明,HER3信号传导的抑制尤其有利于靶向受体酪氨酸激酶或PI3K信号传导途径的抑制剂。(xiv)体内MOR10703药物组合由于体外HER3抑制和受体酪氨酸激酶靶向活性剂组合,我们评估了MOR10701或MOR10703与曲妥珠单抗和埃罗替尼组合的体内影响。在BT-474异种移植物中(见图15A),MOR10701或MOR10703(20mg/kg)与次优剂量的曲妥珠单抗(1mg/kg)的组合足以诱导肿瘤消退(%T/C分别为-50和-37)。在L3.3胰腺异种移植物中,MOR10703(20mg/kg)与每日埃罗替尼(50mg/kg)的组合导致肿瘤停滞(%T/C=3,见图15B)。在两种模型中,两种药物的组合都比单独的任一种药物显著更有效,因此支持我们早先的体外发现,即组合HER3靶向抗体和ErbB靶向活性剂的益处。总之,此家族的抗体稳定化HER3的失活构象的独特能力,在HER3以配体依赖性或非依赖性方式激活的模型中,均导致显著的体内效力。此外,此家族的抗体导致的HER3抑制在与多种靶向疗法的组合中表现出益处。实施例22:HER3抗体用于良性前列腺增生(BPH)、男子乳腺发育和子宫内膜异位实验方案用30、75和200mg/kgMOR10703按每周两次的方案经静脉内注射对约9周龄的性成熟IGSWistarHannover大鼠给药。13周的给药期完成后,处死来自每个剂量组10只大鼠,收集主要器官用于进一步分析。此外,使来自200mg/kg剂量组的6只大鼠从MOR10703恢复10周,然后处死,以确定所观察到的任何变化的可逆性。处死动物后,记录器官重量,然后在10%中性缓冲的福尔马林中固定。制备组织切片,并通过镜检评估。结果在雄性大鼠中,在所有剂量下都观察到减小的前列腺重量,这与前列腺和精囊中减少的分泌相关(表18)。这些作用在10周的恢复后是可逆的。相对于对照,绝对平均值的差异如下:30mg/kg,-31%;75mg/kg,-40%;及200mg/kg,-35%。所有给药的雄性中都存在乳腺萎缩(大多数为中等或显著的),且在10周的恢复后不可逆。此变化的表征为:缺乏见于雄性乳腺中的正常丰富的腺泡和小叶发育。与对照相反,治疗的所有雄性的乳腺中都存在稀疏的管状元件。表18.雄性大鼠器官重量的MOR10703相关差异a表示为组平均值的百分比差异(%差异)。b相对。c基于组平均值的统计学分析,数值显著不同于对照组。在雌性中,在所有剂量下都观察到减小的子宫重量,其在10周的恢复后是可逆的(表19)。绝对平均值相对于对照的差异是:30mg/kg,-24%;75mg/kg,-27%;及200mg/kg,-19%。子宫内膜萎缩(在≥30mg/kg/天的所有剂量下观察到子宫中腺上皮的显著减少)与在治疗结束时观察到的子宫重量的减少相关。这在10周的恢复后轻微可逆,这是因为存在增加的腺上皮量,但没有对照动物中那么多。考虑可以观察的该周期的不同阶段,其他生殖器官(卵巢、输卵管、子宫颈和阴道)似乎在正常限之内。表19.雌性大鼠器官重量的MOR10703相关差异a表示为组平均值的百分比差异(%差异)。b相对的。c基于组平均值的统计学分析,值显著不同于对照组。实际显著性水平和所使用的检验参见数据表。讨论良性前列腺增生(BPH)是老年男性中常见的疾病,其特征为前列腺的非赘生性增大,产生对尿道的压力,并导致排尿和膀胱问题(Mahapokai1W,vanSluijsFJ&SchalkenJA.2000ProstateCancerandProstaticDiseases3,28-33)。在约55%的60-70岁男性中,尸检时存在BPH的解剖学证据或显微证据。经尿道前列腺切除是多年来的治疗选择。因此,在老年男性中,BPH是进行手术干预的最常见的原因之一。较低侵入性的治疗方法包括:(i)α1-阻断剂(多沙唑嗪、哌唑嗪、坦洛新、特拉唑嗪和阿夫唑嗪)是一类也用于治疗高血压的药物。这些药物松弛膀胱颈和前列腺的肌肉,从而允许更容易的排尿。(ii)非那雄胺和度他雄胺降低雄激素水平,从而减小前列腺的大小、提高尿流速、和减少BPH的症状。在观察到症状改善之前可能需花费3至6个月。与非那雄胺和度他雄胺的使用相关的潜在副作用包括性冲动减少和阳痿。实验章节中的结果首次证明,BPH是神经调节蛋白依赖性适应症。MOR10703在性成熟的大鼠中显著减小前列腺大小而不影响激素水平的发现提示,MOR10703可用于治疗BPH。为进一步测试MOR10703和其他HER3抗体作为BPH治疗剂,可将原代人BPH手术标本移植入无胸腺小鼠或大鼠,并用模型研究Her3抗体的作用(OttoU等人UrolInt1992;48:167-170)。备选地,可通过长期施用5α-雄甾烷-3α,17β-二醇加雌二醇在去势的犬中诱发BPH的方面,并在这些犬模型中测试HER3抗体(WalshPC,WilsonJD.JClinInvest1976;57:1093–1097)。男子乳腺发育的身体征象是男性中乳房增大,它通常发生在双侧乳腺中,但有时可以仅发生在一侧,称为不对称男子乳腺发育或单侧男子乳腺发育。男子乳腺发育常由以下引起:(i)提高的雌激素水平,导致睾酮与雌激素的比例变得失衡。(ii)用于治疗前列腺癌或BPH的雄激素拮抗剂或抗雄激素。这些药物抑制睾酮,但通过抑制睾酮,雌激素开始上升。虽然目前正在评价许多实验性药物,但目前没有批准用于男子乳腺发育的治疗。因此,通过手术去除乳腺组织,治疗男子乳腺发育。MOR10703诱导雄性乳腺的不可逆萎缩的观察结果指示,它在男子乳腺发育的治疗中可以是有利的。为了进一步测试MOR10703和其他HER3抗体用于治疗人类男子乳腺发育,可以使用男子乳腺发育的转基因小鼠模型。这些模型已经通过在小鼠乳腺中表达人芳化酶而开发出来,其重现了人类男子乳腺发育的许多方面(Li等人,Endocrinology2002;143:4074–4083;Tekmal等人,CancerRes1996;56:3180–318)。还可以检查MOR10703和其他HER3抗体用于治疗子宫内膜异位,子宫内膜异位是妇科病症,其中来自子宫衬里(子宫内膜)的细胞在子宫腔外出现并繁盛。子宫内膜异位的主要但并非普遍的症状是多种表现形式的盆腔疼痛。虽然子宫内膜异位的潜在原因未得到良好的表征,但认为其依赖于雌激素的存在。由于MOR10703在雌性小鼠中诱导子宫内膜萎缩,导致子宫重量减少,故可以用它来治疗子宫内膜异位。为了进一步研究MOR10703和其他HER3抗体对子宫内膜异位的作用,可以将增殖期的人子宫内膜植入正常循环和卵巢切除的无胸腺小鼠或循环非肥胖型糖尿病(NOD)-重症联合免疫缺陷(SCID)小鼠的腹膜腔,并用这些SCID小鼠作为模型(Grummer等,2001.HumanReproduction;16;1736-1743)。实施例23:评估HER3抗体用于食管癌的体外研究体外食管药物组合研究为了评估HER3靶向抗体与靶向疗法组合的能力,在细胞活力测定试验中将MOR10703与西妥昔单抗或BYL719组合。将约1000-1200个KYSE140和KYSE180细胞接种在384孔板中补充了2%FBS的合适培养基中,并允许在37℃贴壁过夜。随后将合适的药物组合(BYL719的典型最终药物浓度的范围在2.8μM至3.8nM;西妥昔单抗的范围在93nM至0.13nM;MOR10703的范围在100nM至4.1nM)相继加入孔,使得每块板含有每种药物的二维矩阵的剂量应答曲线。随后孵育经处理的细胞96-120小时。在药物处理结束时,将CellTiter-Glo试剂加入每个孔来裂解细胞,并用Envision酶标仪记录发光信号。计算用每种组合获得的生长抑制程度,并用Loewe加性模型突显出组合活性。食管体外药物组合和对细胞生长的影响由于肿瘤细胞生长常常由多个信号传导途径驱动,评估了MOR10703与西妥昔单抗或BYL719的组合,以确定它们是否有利于阻断食管癌细胞系的增殖。选择的靶向活性剂主要抑制EGFR(西妥昔单抗)和PIK3CA(BYL719),这是因为这些靶标在人肿瘤中通常被激活。等效应图分析(见图16)显示,MOR10703展示了与西妥昔单抗和BYL719的协同药物组合。此数据显示,HER3信号传导的抑制尤其有利于靶向受体酪氨酸激酶或PI3K信号传导途径的抑制剂。实施例24:评估HER3抗体用于食管癌的体内研究为了评估HER3靶向抗体与靶向疗法组合的体内能力,将MOR10703与西妥昔单抗或BYL719组合,并在两种体内异种移植模型中测试。(i)体内KYSE140异种移植在含有10%热失活的胎牛血清而不含抗生素的RPMI1640培养基中培养KYSE140细胞直至植入时。在指数生长期收获KYSE140细胞。将与PBS/matrigel(50:50)混合的一千万个细胞皮下植入SCID-Beige小鼠的右上侧。在第28天,测量肿瘤,使具有约200mm3的肿瘤体积的动物入选效力研究。大体上,每组共10只动物入选效力研究。对于单活性剂和组合研究,用MOR10703或西妥昔单抗,经侧向尾静脉注射,对动物静脉内给药。BYL719配制在0.5%甲基纤维素中,并经口腔管饲法给药。(ii)体内KYSE180异种移植在含有10%热失活的胎牛血清而不含抗生素的RPMI1640培养基中培养KYSE180细胞直至植入时。在指数生长期收获KYSE180细胞。将五百万个细胞皮下植入裸鼠的右上侧。在第18天,测量肿瘤,使具有约200mm3的肿瘤体积的动物入选效力研究。大体上,每组共10只动物入选效力研究。对于单活性剂和组合研究,用MOR10703或西妥昔单抗经侧向尾静脉注射对动物静脉内给药。BYL719配制在0.5%甲基纤维素中,并经口腔管饲法给药。(iii)体内原代食管异种移植物在小鼠中传代人食管原发肿瘤。在肿瘤大小达到约150mm3的大小时,使动物进入效力研究。对于单活性剂和组合研究,用MOR10703或西妥昔单抗经侧向尾静脉注射对动物静脉内给药。BYL719配制在0.5%甲基纤维素中,并经口腔管饲法给药。HER3的体内抑制和对食管肿瘤生长的作用为了测定所述抗HER3抗体的体内活性,在KYSE140和KYSE180食管肿瘤模型以及两种原发性食管肿瘤模型CHES007和CHES015中都测试了MOR10703。在KYSE140和KYSE180体内模型二者中,证明了用单活性剂MOR10703治疗有效地抑制肿瘤生长(图17)。在KYSE180中,MOR10703和BYL719的组合足以诱导显著的肿瘤消退。这些发现扩展至原发性食管肿瘤模型,其中MOR10703与西妥昔单抗或BYL719的组合也诱导了有效的肿瘤消退(图18)。总之,这些数据进一步支持我们早先的体外发现,即组合HER3靶向抗体和EGFR或PI3K靶向活性剂的益处。实施例25:在胃癌中评估HER3与BYL719的组合的体内研究为了在胃癌中评估HER3靶向抗体与靶向疗法组合的体内能力,将MOR10703与BYL719组合,并在体内异种移植模型中测试。(i)体内NCI-N87异种移植在补充了10%热失活的FCS、2mML-谷氨酰胺、1mM丙酮酸钠的含有4.5g/l葡萄糖的DMEM培养基中培养NCI-N87细胞直至植入时。通过皮下注射8x106至1x107个细胞(在含50%v/vMatrigel的HBSS中),建立了NCI-N87肿瘤。在第10天,测量肿瘤,使具有约250mm3的肿瘤体积的动物入选效力研究。对于单活性剂和组合臂,用MOR10703经侧向尾静脉注射对动物静脉内给药。BYL719配制在0.5%甲基纤维素中,并经口腔管饲法给药。组合治疗对N87胃肿瘤生长的影响如就食管肿瘤所见,MOR10703和BYL719的组合足以在N87胃肿瘤模型中诱导显著、延长的肿瘤消退,因此进一步支持组合HER3靶向抗体和PI3K靶向活性剂的益处(见图19)。实施例26:在头颈鳞状细胞癌(SCCHN)中评估HER3与西妥昔单抗的组合的体内研究为了在SCCHN中评估HER3靶向抗体与靶向疗法组合的体内能力,将MOR10703与西妥昔单抗组合,并在体内异种移植模型中测试。(i)体内A253异种移植在含有10%热失活的胎牛血清而不含抗生素的DMEM中培养A253细胞直至植入时。在指数生长期收获A253细胞。将200μlPBS中的五百万个细胞皮下植入裸鼠的右上侧。在第25天,测量肿瘤,使具有约200mm3的肿瘤体积的动物进入效力研究。大体上,每组共9只动物进入效力研究。对于单活性剂和组合研究,用MOR10703或西妥昔单抗经侧向尾静脉注射对动物静脉内给药。组合治疗对A253SCCHN肿瘤生长的影响在A253SCCHN模型中,用MOR10703或西妥昔单抗作为单活性剂治疗导致了肿瘤停滞。MOR10703与西妥昔单抗的组合显著更有活性,并导致肿瘤消退(见图20)。总的,这些结果显示,MOR10703作为单活性剂可抑制肿瘤生长。结果还显示,在将MOR10703与靶向其他受体酪氨酸激酶或PI3K信号传导途径的抑制剂组合时,在肿瘤消退上产生协同效应。并入作为参考本文引用的所有参考文献(包括专利、专利申请、论文、教科书等等)及其中引用的参考文献特此以其整体并入作为参考。等同物我们认为上述说明书足以使本领域技术人员实施本发明。上述描述和实例详述了本发明的某些优选实施方案并描述了发明人设想的最佳模式。然而应当理解,无论上文描述得有多详尽,本发明可以以多种方式实施,应根据随附的权利要求及其任何等同来解释本发明。当前第1页1 2 3
相关技术
网友询问留言
已有0条留言
- 还没有人留言评论。精彩留言会获得点赞!
1
- 一种阿法替尼有关物质的分离检测方法与流程
- 用于检测人血清中HER2含量的ELISA试剂盒、使用方法及用途与流程
- 用于预防或治疗皮疹的药物组合物的制造方法与工艺
- 用于汽车内饰表皮的30ST/R双面布的制造方法与工艺
- 检测EGFR耐药性突变的方法和组合物与制造工艺
- 一种肝素结合表皮生长因子的单域抗体及其应用的制造方法与工艺
- 3‑[(3‑{[4‑(4‑吗啉基甲基)‑1H‑吡咯‑2‑基]亚甲基}‑2‑氧代‑2,3‑二氢‑1H‑吲哚‑5‑基)甲基]‑1,3‑噻唑烷‑2,4‑二酮和EGFR TYR激酶抑制剂的组合的制造方法与工艺
- 一种二甲苯磺酸拉帕替尼片剂及其制备方法与制造工艺
- 苯并咪唑衍生物作为ERBB酪氨酸激酶抑制剂用于治疗癌症的制造方法与工艺
- 包含STP和生长因子的活性组合物及其化妆品或护肤品的制造方法与工艺