秀丽隐杆线虫体内活性氧水平失调动物模型的构建方法与流程
本发明涉及一种秀丽隐杆线虫体内活性氧水平失调动物模型的构建方法,属于生物技术领域。
背景技术:
当体内的活性氧水平失调,活性氧水平较高时,就会引起生物体氧化损伤,大量研究表明许多疾病如糖尿病、癌症、亨廷顿氏舞蹈症、阿兹海默症、帕金森综合症、躁郁症、精神分裂症、焦虑症、非酒精性脂肪肝炎、心血管疾病等病理过程都与活性氧导致的氧化损伤有关。
目前,体内活性氧水平失调的动物模型多以小鼠为主,但小鼠模型存在周期长,成本高,工作量大的问题,并且难以实现高通量。因此,大家急需一种方便、快速、低成本、高通量的体内活性氧水平失调动物模型。
上世纪70年代初,有研究者开始尝试使用秀丽隐杆线虫作为模式生物,开创了一个全新的科研领域。秀丽隐杆线虫(Caenorhabditis elegans)是一种常见的模式生物,秀丽隐杆线虫成虫体长1mm左右,全身透明,发育过程中很容易在显微镜下对其细胞和组织进行跟踪观察。秀丽隐杆线虫mev-1基因编码线粒体呼吸链复合体II内膜蛋白的亚基细胞色素b大亚基(cytochrome b,cytb)。MEV-1蛋白是呼吸链电子传递和氧化磷酸化的关键蛋白。mev-1基因RNAi后的秀丽隐杆线虫因体内活性氧增加而使细胞代谢异常,最引人关注的表型就是早衰。因此如果能建立以mev-1基因RNAi后的秀丽隐杆线虫为模型,将极大方便科研人员研究相关体内活性氧水平失调疾病。
本发明建立的是以体内活性氧水平失调的秀丽隐杆线虫为基础的动物模 型,该秀丽隐杆线虫模型可以模拟体内活性氧上升所致的氧化损伤而造成的体内代谢异常,可用于研究体内活性氧升高对机体各种生理生化代谢过程的影响,为研究相关体内活性氧水平失调疾病的科研工作者提供一种工具。
技术实现要素:
本发明主要提供一种简单易行、成本低廉的构建秀丽隐杆线虫体内活性氧水平失调动物模型的方法,可以升高动物模型体内活性氧水平,可以模拟体内活性氧上升所致的氧化损伤而造成的体内活性氧水平失调状态,可用于研究体内活性氧升高变化对机体各种生理生化代谢过程的影响,可作为体内活性氧水平失调动物模型用于体内活性氧水平失调病发病机制研究和开发相关疾病的药物。
本发明是通过以下技术方案实现的:
本发明提供的一种秀丽隐杆线虫体内活性氧水平失调动物模型的构建方法为:将秀丽隐杆线虫mev-1基因片段插入到质粒载体上,并将其转化到宿主细胞中,构建克隆菌,诱导转化后的克隆菌表达mev-1的dsRNA,给秀丽隐杆线虫饲喂克隆菌,即建立秀丽隐杆线虫体内活性氧水平失调动物模型。
其中,所述mev-1基因片段是用PCR的方法从秀丽隐杆线虫基因组中扩增出来的。
其中,所述质粒载体为质粒L4440(pPD129.36),宿主细胞为大肠杆菌HT115(DE3)。
其中,将mev-1基因片段插入到质粒L4440(pPD129.36)两个反向T7启动子之间的多克隆位点处构建重组质粒。
其中,所述诱导转化后的克隆菌时所用的诱导剂为异丙基硫代半乳糖苷。
另外,本发明还提供一种秀丽隐杆线虫体内活性氧水平失调动物模型在筛 选治疗体内活性氧水平失调药物中的应用,所述活性氧水平失调是由活性氧上升引起的。
本发明还提供一种秀丽隐杆线虫体内活性氧水平失调动物模型在筛选治疗体内代谢异常药物中的应用,所述代谢异常是活性氧上升所致的氧化损伤造成的。
本发明还提供一种秀丽隐杆线虫体内活性氧水平失调动物模型在研究体内活性氧升高对机体各种生理生化代谢过程的影响中的应用。
其中,上述所用的秀丽隐杆线虫体内活性氧水平失调动物模型均是是采用本发明所述方法构建的。
同以前的方法相比,本发明存在以下优势:
本发明采用RNAi的方法建立了秀丽隐杆线虫体内活性氧水平失调动物模型,通过秀丽隐杆线虫体内产生mev-1基因的干扰效应,可使秀丽隐杆线虫体内总活性氧含量升高,可以模拟体内活性氧上升所致的氧化损伤而造成的体内代谢异常,可用于研究体内活性氧升高变化对机体各种生理生化代谢过程的影响。
另外,该动物模型稳定可重复,可作为体内活性氧水平失调动物模型用于体内活性氧水平失调发病机制研究和筛选相关疾病的药物。
附图说明
图1为质粒L4440的图谱。
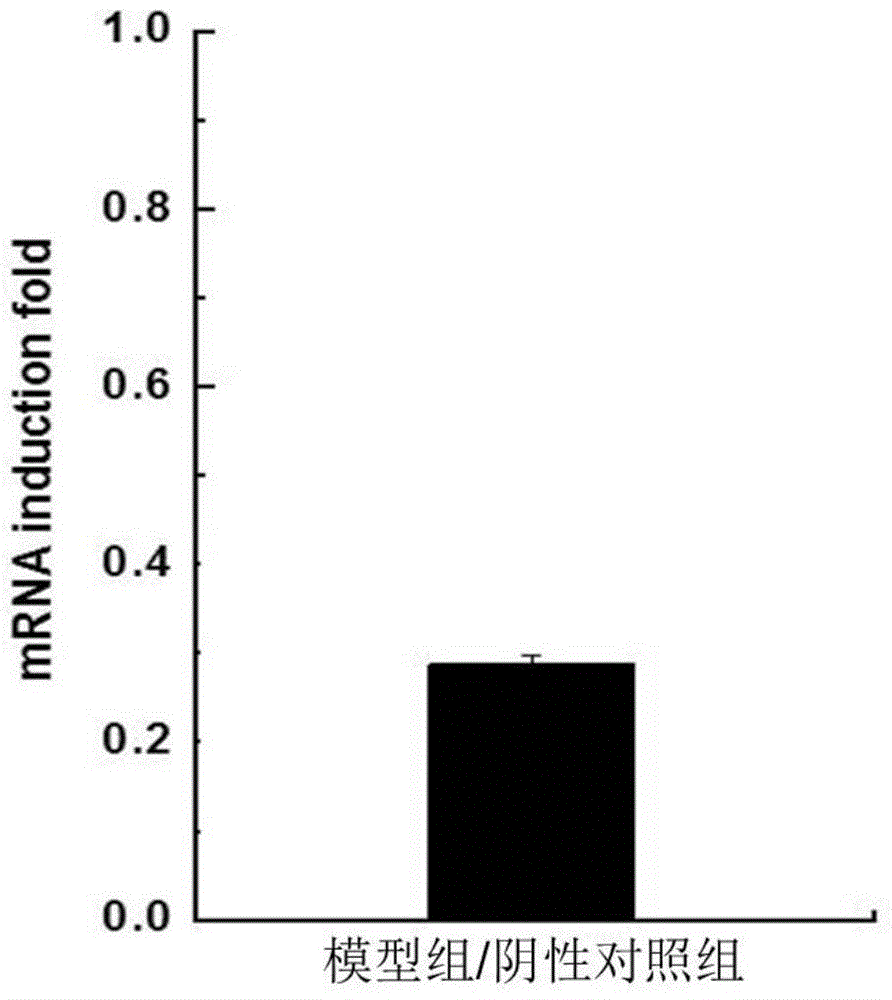
图2为秀丽隐杆秀丽隐杆线虫mev-1基因RNAi后对应基因mRNA表达量的变化。
图3为秀丽隐杆线虫mev-1基因RNAi后体内活性氧含量的变化。
具体实施方式
以下提供具体实施例以实现本发明所述的一种秀丽隐杆线虫体内活性氧水平失调动物模型的构建方法,但不限于这些实施例。
1.生物材料
(1)秀丽隐杆秀丽隐杆线虫株系:秀丽隐杆秀丽隐杆线虫野生型N2,购自Caenorhabditis Genetics Center(CGC)。
(2)大肠杆菌:E.coli HT115(DE3),作为重组质粒的宿主细胞,Caenorhabditis Genetics Center(CGC);E.coli OP50,作为秀丽隐杆秀丽隐杆线虫正常的食物,购自Caenorhabditis Genetics Center(CGC)。
(3)质粒载体:L4440(pPD129.36),RNAi质粒载体,购于Addgene。本实验已将其转化进E.coli HT115(DE3)菌株中。
2.试剂
(1)50×TAE Buffer:242g Tris碱,57mL乙酸,100mL 0.5mol/L的EDTA(pH 8.0),用蒸馏水定容至1000mL,使用时根据要求用蒸馏水进行稀释。
(2)1%琼脂糖粉:将1g琼脂糖粉溶于100mL 1×TAE Buffer中,用微波炉加热,使琼脂糖粉完全溶解,室温冷却至60℃左右时加入适量溴化乙锭(EB),充分混匀后倒入胶槽,插入合适的梳子,待凝胶完全凝固后拔去梳子即可使用。
(3)盐酸四环素(Tetracycline Hydrochloride,Tet):水溶,过滤除菌,母液浓度为25mg/mL,-20℃避光保存(生工生物工程(上海)股份有限公司)。
(4)氨苄青霉素(Ampicillin,Amp):水溶,过滤除菌,母液浓度为100mg/mL,-20℃避光保存(生工生物工程(上海)股份有限公司)。
(5)CaCl2:水溶,高温高压(121℃,20min)灭菌,储存浓度为1mol/L, 4℃保存。
(6)限制性内切酶:BglII、XhoI、HindIII(购自TaKaRa公司)
(7)T4连接酶(购自TaKaRa)
(8)DL-2000 DNA maker和DL-10000 DNA maker(购自TaKaRa)
(9)6×Loading Buffer(购自TaKaRa)
(10)胆固醇(Cholesterol):醇溶,过滤除菌,储存浓度为5mg/mL,4℃避光保存(天津市光复精细化工研究所)。
(11)MgSO4:水溶,高温高压(121℃,20min)灭菌,储存浓度为1mol/L,室温保存。
(12)S基础液:NaCl 0.585g,K2HPO4 0.1g,KH2PO4 0.6g,用蒸馏水定容至100mL。
(13)半饱和KCl溶液:向适量体积的蒸馏水中加入过量KCl,充分搅拌,使溶液达到饱和状态,过滤上清,将滤液与蒸馏水按照1:1(v:v)的比例混匀,即为半饱和KCl溶液。
(14)连二亚硫酸钠:保险粉,分子式:NaO2SSO2Na。
(15)4%Na2CO3溶液:4g Na2CO3溶解于100mL蒸馏水中,室温保存。
(16)2%NaOH溶液:0.8g NaOH溶解于100mL蒸馏水中,室温保存。
(17)0.04mol/L CuSO4溶液:1g硫酸铜(CuSO4·5H2O)溶解于100ml蒸馏水中,室温保存。
(18)0.1mol/L酒石酸钾溶液:2g酒石酸钾溶解于100ml蒸馏水中,室温保存。
(19)Folin-Ciocalteu’s:福林酚试剂(生工生物工程(上海)股份有限公司)。
(20)M9缓冲液:NaCl 5g,Na2HPO4 6g,KH2PO4 3g,MgSO4·7H2O 0.25g,用蒸馏水定容至1000mL。
(21)碱性硫酸铜溶液:(A)将0.1mol/L酒石酸钾溶液和0.04mol/L CuSO4溶液等体积混合均匀,(B)将4%Na2CO3溶液和2%NaOH溶液等体积混合均匀,然后将(A)液和(B)液按照50:1(v:v)的比例混合即可。现配现用。
3.试剂盒
(1)基因组提取试剂盒(购自天根生化科技(北京)有限公司)
(2)质粒DNA小量提取试剂盒(Plasmid Mini Kit I,TaKaRa)
(3)DNA胶回收试剂盒(Agarose Gel DNA Fragment Recovery Kit,购自TaKaRa)
(4)总RNA提取试剂盒(RNAiso Plus,购自TaKaRa)
(5)反转录试剂盒(Prime ScriptTM RT reagent Kit,购自TaKaRa)
(6)荧光实时定量PCR试剂盒(Premix Ex TaqTM II,购自TaKaRa)
4.培养基
(1)NGM(Nematode Growth Medium)培养基:配制如下(500mL):
NaCl 1.52g
KH2PO4 8.52g
K2HPO4 1.15g
胰蛋白胨 1.36g
琼脂粉 8.58g
配制方法:称取上述物质(除琼脂粉之外)于锥形瓶中,加入500mL蒸馏水,使各组分充分溶解,再加入琼脂粉。高温高压(121℃,20min)灭菌,分别加入1mol/L的MgSO4 500μL,1mol/L的CaCl2 500μL,5mg/mL的胆固 醇500μL,充分摇匀,待瓶内泡沫消失后倒板。
如需NGM(RNAi诱导)培养基,在NGM培养基经高温高压(121℃,20min)灭菌后,分别加入500μL 1mol/L的MgSO4,500μL 1mol/L的CaCl2,500μL 5mg/mL的胆固醇,待培养基冷却至60-70℃时加入100mg/mL Amp母液至终浓度为100μg/mL,25mg/mL Tet母液至终浓度为5μg/mL,1mol/L IPTG母液至终浓度为0.1mmol/L,充分摇匀,待瓶内泡沫消失后倒板。
(2)LB(Luria-Bertani)培养基:配置如下(50mL)
NaCl 0.50g
胰蛋白胨 0.50g
酵母膏 0.25g
配制方法:称取上述物质于锥形瓶中,加入50mL蒸馏水,使各组分充分溶解,用1mol/L的NaOH调节pH至7.0,高温高压(121℃,20min)灭菌,4℃保存。
如需LB固体培养基,按1.6-1.8%(w:v)的比例加入Agar Powder即可。
如需LB(Amp+Tet)液体培养基,在LB液体培养基经高温高压(121℃,20min)灭菌后,冷却至60-70℃时加入100mg/mL Amp母液至终浓度为100μg/mL,25mg/mL Tet母液至终浓度为5μg/mL。4℃保存。
如需LB(Amp+Tet)固体培养基,在LB固体培养基经高温高压(121℃,20min)灭菌后,冷却至60-70℃时加入100mg/mL Amp母液至终浓度为100μg/mL,25mg/mL Tet母液至终浓度为5μg/mL,充分摇匀,待瓶内泡沫消失后倒板。
5.主要仪器
超净工作台(苏州净化设备有限公司);高压灭菌锅(上海申安医疗器械厂);电子天平(北京赛多利斯仪器系统有限公司);台式离心机(日立);恒温 培养摇床(上海一恒科技有限公司);微量移液器(Eppendorf);PCR仪(ABI公司);水平电泳仪(Bio-Rad公司);凝胶成像系统(GE公司);超纯水仪(Millipore);恒温金属浴(北京鼎昊源科技有限公司);连续变倍体视显微镜(上海一恒科学仪器有限公司);紫外-可见分光光度计(上海精科);液态氧电极(Hansatech公司);荧光实时定量PCR仪(Bio-Rad公司);
实施例1秀丽隐杆线虫体内活性氧水平失调动物模型的建立
1.线粒体呼吸链mev-1基因RNAi克隆菌的构建
(1)引物设计
根据Wormbase数据库中的相关序列信息设计合成mev-1基因的特异性的引物。具体序列如下:
表1 mev-1基因片段扩增引物
mev-1基因的预期扩增产物长度为838bp,其余为酶切位点。
(2)秀丽隐杆线虫基因组DNA的提取
用基因组提取试剂盒提取秀丽隐杆线虫基因组DNA。具体操作步骤详见试剂盒说明书。
(3)mev-1基因片段的扩增
使用表1中引物,利用PCR技术从秀丽隐杆线虫基因组DNA中扩增mev-1基因的片段。
PCR反应体系如下:
表2 扩增mev-1基因片段的PCR反应体系
PCR的反应程序如下:
94℃3min;之后进入PCR循环,具体为:94℃30s,55℃30s,72℃1min,总共进行30个cycles;72℃5min;4℃保存。
1.0%的Agarose gel电泳鉴定PCR后得到的mev-1基因片段的纯度和浓度。
(4)mev-1基因片段的双酶切
使用HindIII和XhoI限制性内切酶对上一步骤中得到的mev-1基因片段进行双酶切。
37℃进行酶切2小时,将双酶切的产物进行1.0%的Agarose gel电泳,再用DNA胶回收试剂盒(Agarose Gel DNA Fragment Recovery Kit,TaKaRa)回收酶切产物片段。
(5)质粒L4440的制备
将带有L4440质粒的E.coli HT115(DE3)菌株在LB(Amp+Tet)固体培养基上划线,37℃培养16h,挑取平板上培养出的单菌落于5ml LB(Amp+Tet)液体培养基中,37℃,220rpm,震荡培养16h,用质粒DNA小量提取试剂盒 (Plasmid Mini Kit I,TaKaRa)提取质粒。
将提取的pPD129.36质粒进行双酶切。
37℃进行酶切2小时,将双酶切的L4440片段进行1.0%的Agarose gel电泳,用DNA胶回收试剂盒(Agarose Gel DNA Fragment Recovery Kit,TaKaRa)回收酶切产物中的L4440片段。
(6)mev-1基因片段和质粒的连接
通过1.0%的Agarose gel电泳鉴定质粒和mev-1基因片段之间的摩尔数关系,双酶切后回收的载体片段与回收的mev-1基因片段之间的摩尔数比为1:10,然后在连接酶的作用下将载体与mev-1基因片段连接。
连接体系如下:
表3 连接体系
16℃连接4h即完成连接,得到连接产物。
(7)E.coli HT115(DE3)感受态细胞的制备
参照《精编分子生物学实验指南》,制备感受态细胞,具体操作如下:
1、取HT115(DE3)菌液1.5ml于离心管中,4℃4000rpm离心5min,弃上清,重复此过程两次。
2、向留有沉淀的试管中加入预冷的0.1mol/L的CaCl2溶液800μL,清洗菌体,4℃4000rpm离心5min。
3、彻底除去残液,向试管内加入预冷的0.1mol/L的CaCl2溶液200μl,悬浮菌体。
即感受态细胞制备完成。
(8)连接产物转化E.coli HT115(DE3)、筛选阳性克隆及其鉴定
将10μL连接产物加入到200μL冰浴上放置的E.coli HT115(DE3)感受态细胞溶液中,42℃热激90s,然后迅速冰浴2min。向试管中加入800μL LB液体培养基,37℃,150rpm复苏1h,再将培养物涂到LB(Amp+Tet)固体平板上,37℃培养16h,之后挑单菌落于1ml LB液体(Amp+Tet)培养基中培养,37℃,220rpm,振荡培养5h,进行菌液PCR鉴定。
将得到的菌液进行菌液PCR。PCR反应体系如下:
表4 菌液PCR验证体系
PCR的反应程序如下:
94℃5mim;之后进入PCR循环,具体为:94℃15s,55℃15s,72℃1min,总共进行30个cycles;72℃15min;4℃保存。
将上述鉴定的PCR阳性克隆菌液用质粒DNA小量提取试剂盒(Plasmid Mini Kit I,TaKaRa)提取质粒,然后对质粒进行双酶切验证。
1.0%Agarose gel电泳鉴定,分子量大小与理论推断相符合,将样品送出测序,经blast在线比对,结果表明测序结果与已知的mev-1序列一致。即证 明RNAi克隆菌(L4440-mev-1-HT115)构建完成。
mev-1测序结果
ACGATATACGACTCCTATAGGGAGACCGGCAGATCTGATATCATCGATGAATTCGAGCTCCACCGCGGTGGCGGCCGCTCTAGAAGAAAATCAGCATTGTTTCAGGATGATTAACATTCCAACTGCGATTCTGTGCCGCTTGGGCGCCAGATCGTCGATTTCCCGCTCCTTTGGAACATCGATCGTCACCAAGGTGGGGATTTTTTGAATTTTTCCGTGAAAATTGTTGATTTTTTGTGTACGCATGAAGGAGAAATGTATAACAGACACATTCTTTTCAATTAATTATTTATAATATTCACAGTCCGAGGCAAAGACGCCAATCCAGAAGTTCGGATGGGAATACCTGTTGAAGCAGCGCTCCAAGAATCGCCCAATCGCTCCACATCTCACCGTCTACCAGCCACAATTGACCTGGATGCTCTCCGGATTCCATAGAATCAGCGGTTGTGTAATGGCCGGAACCCTTCTCGTCGGAGGAATCGGATTCGCAGTTTTGCCGTTCGATTTCACCGCTTTTGTGGATTTCATCCGTAGCTGGAACTTACCATGCGCGGTGACCGCTGTCTTCAAGTACATCATTGCTTTCCCCATCATTTTCCATACTCTTAACGGAATTCGCTTCTTAGGATTCGATTTGGCTAAGGGAGTCAATAATGTTGGACAGGTAGGAGTTGAAATTATTAATTTAATTGTTTTAAAATAAAAATTAATTTTCAGATCTACAAATCGGGATATCTCGTATCTGGACTTTCGGCTATTCTTGCTCTCGCCATTGTCTTCAACTCTTGCCAGAACAAGAGCAACAAGACTGCCTAGGCACAGATGCTCCGCCTTCTTTTTTCTTACTCCGCCCCAGCCCTCGACAATTCTCGTCAATTTACTTTTACCGTTGATTTCTTCGATTTTCTCTCTTTTCCGTAAGCTTATCGATACCGTCGACCTCGAGGGGGGGCCCGGTACCCAATTCGCCCTATAGTGAGTCGTATTACGCGCGCTCACTGGCCGTCGTTTTACAACGTCGTGACTGGGAAAACCCTGCGTTACCCAACTTAATCGCCTTGCAGCACATCCCCCTTTCGCCAGCTGGCGTAATAGCGAAGAGGCCCGCACCGATCGCCCTTCCCAACAGTTGCGCAGCCTGAA
2.秀丽隐杆线虫体内活性氧水平失调动物模型的建立
(1)秀丽隐杆线虫的同步化
①挑选成熟的秀丽隐杆线虫至装有1ml M9液的2ml离心管中,4000rpm离心 5分钟,去上清;
②向离心管中加入500μL 1M氢氧化钠,500μL6.4%(V/V)次氯酸钠,震荡裂解;
③去掉上清,向沉淀中加入1.5μL M9液,摇匀,4000rpm离心5分钟,重复该步骤三次;
④向洗净的卵中加入500μL M9液,18℃24小时孵化成L1期秀丽隐杆线虫。
(2)秀丽隐杆线虫的RNAi处理
使用NGM(RNAi诱导)培养基,在培养基表面均匀涂布RNAi克隆菌(L4440-mev-1-HT115),37℃培养16h,然后将同步化的L1期秀丽隐杆线虫N2接到涂有RNAi克隆菌的NGM(RNAi诱导)平板上(秀丽隐杆线虫以大肠杆菌作为唯一食物),20℃培养秀丽隐杆线虫N2至成虫,即得到体内活性氧水平失调动物模型。
(3)秀丽隐杆线虫总RNA的提取
收集经RNAi处理的秀丽隐杆线虫,用M9缓冲液清洗秀丽隐杆线虫3次,尽量除去秀丽隐杆线虫体壁附着的RNAi克隆菌。然后按照总RNA提取试剂盒(RNAiso Plus,TaKaRa)的说明书提取秀丽隐杆线虫的总RNA,取2μL所提的总RNA样品,加2μL ddH2O,1μL 6×Loading Buffer,共5μL加入点样空,1.0%的Agarose gel电泳。
将本步骤中验证的阳性克隆样品进行测序。经blast在线比对,结果表明测序结果与已知的mev-1序列一致。
(4)cDNA的合成
按照反转录试剂盒(Prime ScriptTM RT reagent Kit,TaKaRa)的说明书将(3)中提取的秀丽隐杆线虫总RNA反转录为cDNA。共两个反应,即去除基因组DNA反应和反转录反应,反应程序按照说明书进行。将得到的反转录产物cDNA放在4℃保存。如需长期保存,可放在-20℃。
(5)引物设计
通过Wormbase数据库(www.wormbase.org)检索C.elegans的mev-1及内参β-actin基因的序列,用Primer Premier 5.0,根据引物设计原则,设计引物。所设计的引物序列见表5。
表5 实时荧光定量PCR基因扩增引物
(6)标准曲线和溶解曲线的验证
将秀丽隐杆线虫cDNA以10倍稀释倍数稀释六个浓度,10-1,10-2,10-3,10-4,10-5,10-6,并以这些梯度cDNA作为模板,用mev-1及β-actin的引物,做荧光实时定量PCR,得到对应基因的标准曲线。
反应体系为:
表6 实时荧光定量PCR反应体系
实时荧光定量PCR反应程序如下:
1)STAGE1,95℃预变性 2min
2)STAGE2,95℃变性 10s
3)STAGE3,50℃退火 30s
STAGE2和STAGE3循环38次,并检测荧光;
4)STAGE4,60℃升温至95℃,每3s升温0.5℃;
分析溶解曲线,记录荧光值;
5)STAGE5,95℃ 10s
6)STAGE6,60℃ 30s
7)STAGE7,4℃ ∞
结果表明:所有基因的扩增效率均达到100%±10%,其标准曲线的R2值也达到了实验要求。mev-1及内参基因β-actin的溶解曲线均为单一对称峰,无引物二聚体,扩增反应特异性良好。
(7)荧光实时定量PCR检测对应基因的表达量
以(4)得到的cDNA为模板,荧光实时定量PCR检测对应基因的表达量。
(8)mev-1基因的相对表达量
以模型组的cDNA为模板进行荧光实时定量PCR。β-actin作为内参基因,2-△△Ct计算方法计算基因mRNA的相对表达量。
△△Ct法计算公式为:
相对含量%=2-△△Ct
△Ct=CT待测样品-CT对照样品
△△Ct=△Ct靶基因-△Ct内参基因
利用荧光实时定量PCR的方法检测秀丽隐杆线虫mev-1基因RNAi的效率。秀丽隐杆线虫RNAi组为模型组,秀丽隐杆线虫RNAi空载体组为阴性对照组,其mev-1基因表达量与喂食E.coli OP50的空白组秀丽隐杆线虫相关基因表达量相比无明显变化,这说明饲喂带有空载体L4440的E.coli HT115菌并不影响秀丽隐杆线虫中mev-1的基因表达。从图2中可以看出mev-1基因被沉默之后,其mRNA的表达量只有阴性对照组的28.74%,干扰效率达到了71.26%。
实施例2秀丽隐杆线虫体内活性氧水平失调模型的验证
1.秀丽隐杆线虫mev-1基因RNAi后体内总活性氧含量的测定
(1)秀丽隐杆线虫体内总活性氧含量的检测
取实施例1构建的体内活性氧水平失调的动物模型,用M9缓冲液清洗3次,洗去秀丽隐杆线虫虫体上的RNAi克隆菌。将每个模型组的秀丽隐杆线虫用S基础液进行稀释,使每20μL中含有25条秀丽隐杆线虫,将每个模型组的稀释好的秀丽隐杆线虫液准确转移至底透384微孔板中,每个孔加40μL秀丽隐杆线虫液,每个模型组做3个复孔,然后在避光条件下加活性氧荧光染料H2DCF-DA,染料浓度为50mmol/L,每个孔准确加入10μL。暗室反应15min后,用荧光酶标仪检测每个孔的荧光强度,激发波长为504nm,发射波长为529nm,检测温度为28℃。秀丽隐杆线虫RNAi空载体组为阴性对照组,按上面方法做同样处理,测定体内总活性氧含量。
(2)秀丽隐杆线虫mev-1基因RNAi后体内总活性氧含量的变化
用ROS荧光探针H2DCF-DA检测秀丽隐杆线虫体内总活性氧含量的变化,结果如图3所示mev-1基因的干扰会引起秀丽隐杆线虫体内活性氧含量的显著升高(p<0.01)。
综上所述,采用本发明公开的方法成功构建了秀丽隐杆线虫线体内活性氧水平失调的动物模型,可以升高动物模型体内活性氧水平,可以模拟活性氧上升所致的氧化损伤而造成的体内代谢异常,可用于研究体内活性氧升高变化对机体各种生理生化代谢过程的影响。该模型稳定可重复,可作为体内活性氧功能失调的动物模型用于体内活性氧水平失调病发病机制研究和开发相关疾病的药物。
- 还没有人留言评论。精彩留言会获得点赞!