一种抑制血管新生的蛋白Bach1及其应用的制作方法
本发明属于生物技术及医药领域,涉及一种抑制血管新生的蛋白及其应用。
背景技术:
现有技术公开了血管新生是指在原有的毛细血管网通过发芽或非发芽的方式长出新的血管网络,包括血管周围基质的降解、内皮细胞的增殖、迁移和管状结构的形成;随后这一初级的毛细血管网被平滑肌细胞和周细胞等血管支持细胞包裹,逐步形成具有完整结构的成熟的血管。研究显示血管新生在体内胚胎发育、损伤修复等生理过程中发挥重要作用,同时也是众多新生血管性疾病,如肿瘤生长与转移、增殖性糖尿病视网膜病变、老年性视网膜血管病变、早产儿视网膜病变、类风湿关节炎等疾病的主要病理变化。目前大分子抗新生血管药物如Avastin经过美国FDA的上市批准,已用于肿瘤等血管新生相关疾病的治疗,同时还有若干的药物处于不同的临床前和临床研究阶段。因此,新生血管抑制剂的研究与应用对于新生血管性相关疾病的治疗具有重要意义。
研究报道了血管新生是由多种因子参与调控的复杂的病理生理过程,其中转录因子起着关键的调控作用。Bach1(BTB and CNC homology 1,BTB-CNC同源体1)是一种细胞内的转录因子,属于碱性亮氨酸拉链蛋白家族成员;Bach1是一个血红素结合蛋白,它结构高度保守,广泛存在于哺乳动物各种组织中。研究显示,人的Bach1蛋白含736个氨基酸,分子量为92kDa,Bach1抑制血红素氧合酶-1(heme oxygenase-1,HO-1)的表达,参与调控细胞氧化应激反应以及细胞周期,但是Bach1在血管新生中的作用尚不清楚,迄今未见有关报道。
技术实现要素:
本发明的目的是提供一种抑制血管新生的蛋白。
本发明的另一目的在于提供上述抑制血管新生蛋白的制备方法。
本发明的进一步目的是提供上述抑制血管新生蛋白在用于制备治疗血管新生引起的疾病的制剂中的应用。
具体的,本发明提供的所述的Bach1蛋白,其氨基酸序列如SEQ ID NO.1所示的多肽。
所述的Bach1基因为如SEQ ID NO.2所示的多核苷酸序列。
本发明中,所述的Bach1蛋白的DNA序列由PCR合成后克隆到载体中,所用载体可以是分子生物学所常用的质粒、病毒或DNA片段;载体序列中包括用于驱动基因表达的启动子、蛋白质翻译起始和终止信号、以及多聚腺苷酸(PolyA)序列;载体中有抗菌素抗性基因,以利于载体在宿主细胞,如细菌中繁殖;另外,载体中还包括真核细胞选择性基因,用于稳定转染宿主细胞株的选择。
本发明中,将所述的Bach1蛋白作为干预血管新生相关疾病的药物靶点,进行了动物实验以及临床实验,结果显示,该Bach1蛋白能够显著抑制小鼠缺血下肢的血流恢复和血管新生;而Bach1基因被特异性敲除后能够显著促进小鼠缺血下肢的血管新生;
实验结果还显示,过表达Bach1能抑制斑马鱼发育过程中血管生成;
实验结果还显示,Bach1蛋白在人血管内皮细胞有一定的表达时,其抑制人血管内皮细胞的增殖,迁移和管状形成;反之,Bach1基因缺失时,则促进人血管内皮细胞的上述功能;实验结果表明,该Bach1蛋白能够抑制VEGF和IL-8的表达,进一步有效抑制疾病的血管新生。
本发明的上述抑制血管新生蛋白可用于制备治疗血管新生引起的疾病的制剂。所述由血管新生引起的疾病可为肿瘤或眼部新生血管疾病。
附图说明
图1为Bach1融合蛋白的表达。
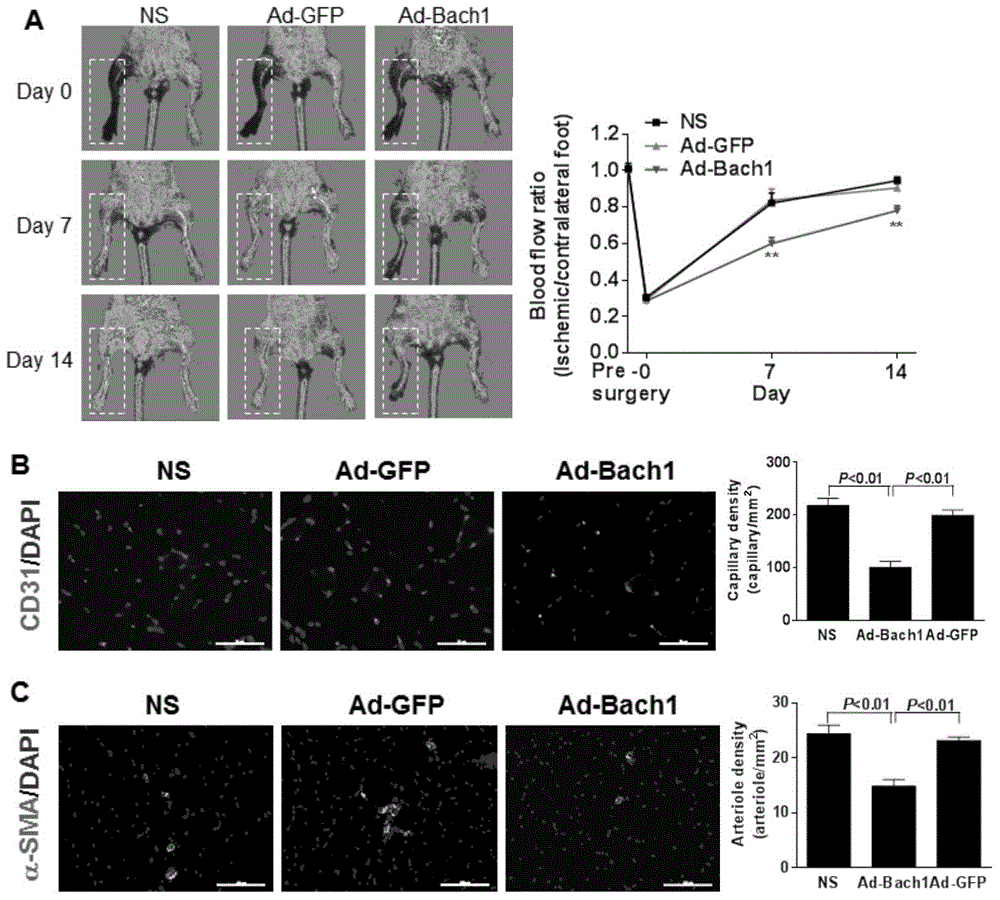
图2为Bach1过表达抑制小鼠缺血下肢血流的恢复和血管新生,
其中,在小鼠单侧肢体行股动脉结扎和切除术后,将Bach1腺病毒或对照GFP腺病毒,或生理盐水注射到缺血的小鼠内收肌肉内,然后在手术后第7、14天动态观察小鼠下肢血流的灌注情况;图2A显示过表达Bach1蛋白明显抑制小鼠下肢血流的恢复;图2B和2C显示Bach1过表达明显抑制缺血肌肉内毛细血管(图2B)和小动脉的生成(图2C)。
图3为Bach1基因敲除后显著促进小鼠缺血下肢的血管新生,
其中,图3A显示Bach1基因缺失明显促进小鼠下肢血流的恢复,图3B和3C显示Bach1基因缺失明显增加缺血肌肉内毛细血管(图3B)和小动脉的生成(图3C)。
图4为过表达Bach1引起斑马鱼血管发育缺陷,
其中,利用fli1:eGFP转基因斑马鱼(血管标记有绿色荧光),将体外转录的Bach1 mRNA(或空载体对照)1nl(100ng)显微注射到fli1:eGFP斑马鱼单细胞期,36小时后,观察斑马鱼的血管发育情况,与正常对照组(图4A)相比,Bach1基因表达增多引起的血管缺陷主要在节间血管与背部纵向吻合支(图4B),血管缺陷胚胎占总体的比例较对照组明显增高(图4C)。
图5为过表达Bach1抑制人血管内皮细胞迁移,增殖和管腔样结构形成以及VEGF和IL-8基因表达,其中,图5A显示Bach1蛋白在人脐静脉内皮细胞中有表达,在细胞浆和细胞核内均有定位;用Bach1腺病毒或对照GFP腺病毒感染的内皮细胞(图5B)结果显示,Bach1过表达抑制内皮细胞管腔样结构的形成(图5C)并抑制内皮细胞的迁移和增殖(图5D和5E),降低内皮细胞VEGF和IL-8基因表达(图5F)。
图6显示了Bach1基因缺失促进内皮细胞迁移,增殖和管腔样结构形成,其中,在Bach1基因敲除小鼠分离的原代细胞中发现Bach1基因敲除促进内皮细胞迁移(如图6A所示),增殖(如图6B所示)和管腔样结构形成(如图6C所示)。
具体实施方式
下述实施例中所使用的实验方法如无特殊说明,均为常规方法。
下述实施例中所用的材料、试剂等,如无特殊说明,均可从商业途径得到。
实施例1:Bach1表达载体的构建
依据人Bach1基因的两端序列合成如下引物,上游引物(5’-GGATCCATGTCTCTGAGTGAGAACTC-3’)含BamHI切割位点,下游引物(5’-GAATTCCTCATCAGTAGTACATTTAT-3’)含XhoI切割位点,用于构建Bach1原核或真核表达载体;采用Trizol试剂(美国invitrogen公司)抽提人血管内皮细胞的总RNA,采用SuperScript cDNA Synthesis Kit(美国Fermentas公司)合 成cDNA一链,以此合成的cDNA为模板,以上述引物进行PCR扩增,PCR扩增的Taq酶购于日本东洋纺公司,反应程序为94℃预变性3min;94℃变性30s、55℃退火30s、72℃延伸2min 30s,35个循环;72℃延伸5min。得到特异扩增的单一条带,产物大小在2200bp左右;将扩增得到的PCR扩增产物通过BamHI和XhoI两个酶位点,通过酶切连接后克隆到真核表达载体pCMV或原核表达载体PGEX-6P上,表达载体中的外源基因经测序鉴定正确。
实施例2:Bach1融合蛋白的表达
将上述构建的Bach1原核表达载体PGEX-Bach1转化大肠杆菌BL21,挑取单菌落接种于含有100ng/ml氨卞的2×YT培养基中,37℃振摇培养过夜活化菌种,按照1:100的体积比接种到500ml 2×YT液体培养基,37℃放大培养至OD600约为0.9时,加入IPTG至终浓度为1mM,18℃诱导培养24h后离心收集菌体,将总菌体用Tris缓冲液(50mM Tris,150mM NaCl,pH7.5)洗涤,再用适量的Tris缓冲液悬浮,超声处理后,裂解上清液和超声后的沉淀经SDS-PAGE电泳分析表明,在此条件下Bach1融合蛋白的表达量占菌体总蛋白的80%以上,大部分处于可溶状态;将该融合蛋白与GST-beads 4℃孵育过夜,结合在beads上的蛋白进行Western blot,用GST抗体检测,结果表明,菌株经诱导后有明显的特异表达产物带,分子量与预测的理论值相符,图1显示了Bach1融合蛋白的表达,其中,将PGEX-Bach1转化大肠杆菌BL21,培养繁殖后,基因工程菌超声破碎后上清液经GST pull down和Western blot分析表明,菌株经诱导后有明显的特异表达产物带,分子量与预测的理论值(130kD)相符。
实施例3:建立小鼠下肢缺血模型
将8周龄正常C57BL/6J小鼠用4.5%水合氯醛麻醉,将双下肢脱毛固定,常规处理小鼠,分离筋膜和脂肪组织,找到股动脉和股静脉,在股总动脉分支稍后,分离供应内侧肌群的动静脉,结扎动脉,再向下5cm处,分离动静脉,并结扎动脉,将两个结扎点之间的血管剪断,并剥离去除该段血管,缝合切口,在内收肌群内注射生理盐水或腺病毒(2×108病毒颗粒数);实验分三组:正常生理盐水对照组,对照腺病毒组,Bach1腺病毒组。Bach1腺病毒或对照病毒(Ad-GFP)由上海吉凯基因化学技术公司提供,分别于术前,术后0、7、14天用多普勒 血流仪检测双下肢血流,结果如图2所示;采用由美国Jackson实验室购买Bach1+/–小鼠,经过杂合子小鼠交配鉴定纯合子小鼠,用12周Bach1基因敲除小鼠或同窝对照小鼠进行下肢缺血模型实验,结果如图3所示。
实施例4:斑马鱼实验
斑马鱼(野生型)和tg(fli1:EGFP),饲养于复旦大学基础医学院斑马鱼平台;养殖条件:温度:28±1℃;pH值:6.5~7.5;电导率:400~500μs/cm。斑马鱼胚胎用胚胎培养液(egg water)置于28.5℃的恒温箱中进行培养,克隆斑马鱼Bach1真核表达T载体(PGEM-T-Bach1),上游引物(5’-GGATCCCGAAGAAGAAGTAAAAACAG-3’)含BamHI切割位点,下游引物(5’-GAATTCCTCATCAGTAGTACATTTAT-3’)含EchoR I切割位点;将此质粒DNA用体外转录试剂盒(美国Promega公司)体外合成斑马鱼Bach1 mRNA,并将100pg Bach1mRNA显微注射到斑马鱼刚刚受精的受精卵中,36小时后荧光显微镜下观察斑马鱼背部血管网结构,结果显示,与正常对照组(图4A)相比,Bach1基因表达增多引起的血管缺陷主要在节间血管与背部纵向吻合支(图4B),血管缺陷胚胎占总体的比例较对照组明显增高(图4C)。
实施例5:小鼠肺微血管内皮细胞的分离及培养
12周龄C57BL/6J小鼠,乙醚麻醉后脱臼处死,无菌条件下取出肺脏,放入37℃PBS中冲洗直至冲洗液清亮,剪碎肺组织,加入0.1%预热的胶原酶I,37℃振荡水浴45-60min;70μm滤网过滤后,100g离心10min,去上清,细胞中加入包被PECAM-1抗体的磁珠,4℃晃动30min,置于磁铁上2min,吸去上清,使用3ml内皮细胞培养基重悬细胞并接种到培养板中,以后隔天换液一次,当细胞长至80-90%时,进行第二次磁珠分选,消化的细胞加入包被ICAM-2抗体的磁珠,最后分选的细胞传代(2-6代)用于实验,细胞呈单层密集铺路石样生长,CD31,CD144,vWF染色90%以上阳性,90%以上细胞具有摄取Ac-LDL功能,结果如图5所示,其中,图5A显示Bach1蛋白在人脐静脉内皮细胞中有表达,在细胞浆和细胞核内均有定位。用Bach1腺病毒或对照GFP腺病毒感染的内皮细胞(图5B)的研究发现,Bach1过表达抑制内皮细胞管腔样结构的形成(图5C)并抑制内皮 细胞的迁移和增殖(图5D和5E),降低内皮细胞VEGF和IL-8基因表达(图5F)。
实施例6:人脐静脉血管内皮细胞的分离及培养
健康产妇的新鲜无菌脐带由上海国际和平妇幼保健院提供,PBS灌洗脐静脉2次,用止血钳钳夹固定脐带另一端,灌入预先37℃孵育的0.1%VI型胶原酶15-20ml,室温下在PBS中消化12min,再用PBS冲洗2次,。1000rpm离心8min,弃上清,加入内皮细胞培养基重悬沉淀后将细胞转移至培养皿中,置于37℃细胞培养箱中培养,内皮细胞的鉴定同实施例5。
实施例7:内皮细胞的增殖、迁移和管腔样结构形成实验
内皮细胞增殖实验用Brdu试剂盒(美国Merk公司)按照说明书进行,内皮细胞的迁移实验用Transwell进行,将细胞接种在Transwell上层,10小时后检测迁移到膜下的细胞数,管腔形成实验是将内皮细胞培养在Matrigel(美国BD公司,#356237)上,12-16小时后观察并测量内皮细胞管腔状结构的形成,结果如图5-图6所示。
实施例8:组织免疫荧光检测
取小鼠下肢肌肉组织制作石蜡切片,组织石蜡切片脱蜡、水化、抗原修复后,用5%驴血清室温封闭1小时,一抗4℃孵育过夜,PBST洗3次后孵育荧光标记二抗(1:200),37℃避光孵育1小时,PBST洗4-5次,DAPI避光染色15min,PBST洗3次,防淬灭封片剂封片,荧光显微镜下观察、拍照;免疫荧光染色CD31和α-SMA,CD31染色检测毛细血管密度,α-SMA是血管平滑肌细胞标记物。
实施例9:实时荧光定量PCR
收集细胞沉淀于1.5ml EP管中,完全弃上清,加入1ml Trizol,吹匀,室温裂解细胞10min;加入200μl氯仿,上下颠倒EP管使溶液混匀呈乳白色,室温静置5min,4℃离心机12,000rmp 15min;小心吸取上层水相,转移至另一新1.5ml EP管中,加入等体积异丙醇上下颠倒混匀,-20℃静置过夜使RNA充分沉淀;4℃12,000rmp离心10min,弃上清,保留沉淀;在沉淀中加入1ml预冷的75% 乙醇,悬浮沉淀,4℃7500rmp离心5min;小心弃上清,室温干燥10min;加入10-30μl DEPC水溶RNA;测定样品的浓度:Nano drop测量仪测RNA浓度,即可进行逆转录。逆转录反应:用Fermentas RevertAid strand cDNA Synthesis Kit,20μl体系;
第一步:
RNA 2μg
Oligo(dt)/(0.5μg/μl) 1μl
加water 至12μl
混匀,PCR仪中,65℃5min。
第二步:
取出第一步产物,加入第二步试剂混合物,混匀,PCR仪中,42℃60min→70℃5min,反应完毕后置于冰上备用,或-20℃保存;
Real-time PCR反应体系(20μl)
进行实时荧光定量PCR(方法按照SYBR green PCR master mix试剂盒的说明书),GAPDH作为表达内参。引物如下:
Bach1上游引物(5’-CACAATTCTTCCATAGACCCTC-3’),
Bach1下游引物(5’-TCTGCCACTTCTCGCTCC-3’);
VEGF上游引物(5’-ATCTTCAAGCCATCCTGTGTGC-3’),
VEGF下游引物(5’-CAAGGCCCACAGGGATTTTC-3’);
IL-8上游引物(5’-CTCTCTTGGCAGCCTTCCTGA-3’),
IL-8下游引物(5’-CCCTCTGCACCCAGTTTTCCTT-3’);
GAPDH上游引物(5’-CCATCTTCCAGGAGCGAGATC-3’),
GAPDH下游引物(5’-GCCTTCTCCATGGTGGTGAA-3’);
PCR反应体系如下,每一样品采用两复孔。
Real-time PCR循环:
用2-△△Ct方法进行定量分析。
实施例10:Western Blot检测蛋白表达
将样品提取蛋白并测其浓度;丙烯酰胺凝胶电泳,恒定电压100V;用甲醇泡PVDF膜15s,随后放入转膜缓冲液中与胶一起平衡15min,按顺序放入转膜容器中:阳极-海绵-滤纸-PVDF膜-胶-滤纸-海绵-阴极,置于冰盒内,恒流300mA,转膜2h,结束后取出PVDF膜,5%脱脂牛奶室温封闭1h,TBST洗3×5min,用5%牛奶按比例稀释一抗,4℃过夜,用TBST洗3×10min。5%牛奶稀释二抗,室温1h,用TBST洗3×10min。暗室内加入ECL显色,自动显影仪显影。图6显示了Bach1基因缺失促进内皮细胞迁移,增殖和管腔样结构形成,其中,在Bach1基因敲除小鼠分离的原代细胞中发现Bach1基因敲除促进内皮细胞迁移(如图6A所示),增殖(如图6B所示)和管腔样结构形成(如图6C所示)。
SEQUENCE LISTING
<110> 复旦大学
<120> 一种抑制血管新生的蛋白Bach1及其应用
<130> 20150119
<160> 2
<170> PatentIn version 3.3
<210> 1
<211> 736
<212> PRT
<213> Homo sapiens
<400> 1
Met Ser Leu Ser Glu Asn Ser Val Phe Ala Tyr Glu Ser Ser Val His
1 5 10 15
Ser Thr Asn Val Leu Leu Ser Leu Asn Asp Gln Arg Lys Lys Asp Val
20 25 30
Leu Cys Asp Val Thr Ile Phe Val Glu Gly Gln Arg Phe Arg Ala His
35 40 45
Arg Ser Val Leu Ala Ala Cys Ser Ser Tyr Phe His Ser Arg Ile Val
50 55 60
Gly Gln Ala Asp Gly Glu Leu Asn Ile Thr Leu Pro Glu Glu Val Thr
65 70 75 80
Val Lys Gly Phe Glu Pro Leu Ile Gln Phe Ala Tyr Thr Ala Lys Leu
85 90 95
Ile Leu Ser Lys Glu Asn Val Asp Glu Val Cys Lys Cys Val Glu Phe
100 105 110
Leu Ser Val His Asn Ile Glu Glu Ser Cys Phe Gln Phe Leu Lys Phe
115 120 125
Lys Phe Leu Asp Ser Thr Ala Asp Gln Gln Glu Cys Pro Arg Lys Lys
130 135 140
Cys Phe Ser Ser His Cys Gln Lys Thr Asp Leu Lys Leu Ser Leu Leu
145 150 155 160
Asp Gln Arg Asp Leu Glu Thr Asp Glu Val Glu Glu Phe Leu Glu Asn
165 170 175
Lys Asn Val Gln Thr Pro Gln Cys Lys Leu Arg Arg Tyr Gln Gly Asn
180 185 190
Ala Lys Ala Ser Pro Pro Leu Gln Asp Ser Ala Ser Gln Thr Tyr Glu
195 200 205
Ser Met Cys Leu Glu Lys Asp Ala Ala Leu Ala Leu Pro Ser Leu Cys
210 215 220
Pro Lys Tyr Arg Lys Phe Gln Lys Ala Phe Gly Thr Asp Arg Val Arg
225 230 235 240
Thr Gly Glu Ser Ser Val Lys Asp Ile His Ala Ser Val Gln Pro Asn
245 250 255
Glu Arg Ser Glu Asn Glu Cys Leu Gly Gly Val Pro Glu Cys Arg Asp
260 265 270
Leu Gln Val Met Leu Lys Cys Asp Glu Ser Lys Leu Ala Met Glu Pro
275 280 285
Glu Glu Thr Lys Lys Asp Pro Ala Ser Gln Cys Pro Thr Glu Lys Ser
290 295 300
Glu Val Thr Pro Phe Pro His Asn Ser Ser Ile Asp Pro His Gly Leu
305 310 315 320
Tyr Ser Leu Ser Leu Leu His Thr Tyr Asp Gln Tyr Gly Asp Leu Asn
325 330 335
Phe Ala Gly Met Gln Asn Thr Thr Val Leu Thr Glu Lys Pro Leu Ser
340 345 350
Gly Thr Asp Val Gln Glu Lys Thr Phe Gly Glu Ser Gln Asp Leu Pro
355 360 365
Leu Lys Ser Asp Leu Gly Thr Arg Glu Asp Ser Ser Val Ala Ser Ser
370 375 380
Asp Arg Ser Ser Val Glu Arg Glu Val Ala Glu His Leu Ala Lys Gly
385 390 395 400
Phe Trp Ser Asp Ile Cys Ser Thr Asp Thr Pro Cys Gln Met Gln Leu
405 410 415
Ser Pro Ala Val Ala Lys Asp Gly Ser Glu Gln Ile Ser Gln Lys Arg
420 425 430
Ser Glu Cys Pro Trp Leu Gly Ile Arg Ile Ser Glu Ser Pro Glu Pro
435 440 445
Gly Gln Arg Thr Phe Thr Thr Leu Ser Ser Val Asn Cys Pro Phe Ile
450 455 460
Ser Thr Leu Ser Thr Glu Gly Cys Ser Ser Asn Leu Glu Ile Gly Asn
465 470 475 480
Asp Asp Tyr Val Ser Glu Pro Gln Gln Glu Pro Cys Pro Tyr Ala Cys
485 490 495
Val Ile Ser Leu Gly Asp Asp Ser Glu Thr Asp Thr Glu Gly Asp Ser
500 505 510
Glu Ser Cys Ser Ala Arg Glu Gln Glu Cys Glu Val Lys Leu Pro Phe
515 520 525
Asn Ala Gln Arg Ile Ile Ser Leu Ser Arg Asn Asp Phe Gln Ser Leu
530 535 540
Leu Lys Met His Lys Leu Thr Pro Glu Gln Leu Asp Cys Ile His Asp
545 550 555 560
Ile Arg Arg Arg Ser Lys Asn Arg Ile Ala Ala Gln Arg Cys Arg Lys
565 570 575
Arg Lys Leu Asp Cys Ile Gln Asn Leu Glu Ser Glu Ile Glu Lys Leu
580 585 590
Gln Ser Glu Lys Glu Ser Leu Leu Lys Glu Arg Asp His Ile Leu Ser
595 600 605
Thr Leu Gly Glu Thr Lys Gln Asn Leu Thr Gly Leu Cys Gln Lys Val
610 615 620
Cys Lys Glu Ala Ala Leu Ser Gln Glu Gln Ile Gln Ile Leu Ala Lys
625 630 635 640
Tyr Ser Ala Ala Asp Cys Pro Leu Ser Phe Leu Ile Ser Glu Lys Asp
645 650 655
Lys Ser Thr Pro Asp Gly Glu Leu Ala Leu Pro Ser Ile Phe Ser Leu
660 665 670
Ser Asp Arg Pro Pro Ala Val Leu Pro Pro Cys Ala Arg Gly Asn Ser
675 680 685
Glu Pro Gly Tyr Ala Arg Gly Gln Glu Ser Gln Gln Met Ser Thr Ala
690 695 700
Thr Ser Glu Gln Ala Gly Pro Ala Glu Gln Cys Arg Gln Ser Gly Gly
705 710 715 720
Ile Ser Asp Phe Cys Gln Gln Met Thr Asp Lys Cys Thr Thr Asp Glu
725 730 735
<210> 2
<211> 2211
<212> DNA
<213> Homo sapiens
<400> 2
atgtctctga gtgagaactc ggtttttgcc tatgaatctt ctgtgcatag caccaatgtt 60
ttactcagcc ttaatgacca gcggaagaaa gatgtgctgt gcgatgtcac catctttgtg 120
gagggacagc ggttccgcgc tcaccggtcc gtgctggcgg catgcagcag ttacttccac 180
tcaagaatcg taggccaggc tgatggagag ctgaacatta ctcttccaga agaggtgaca 240
gttaaaggat ttgaaccttt aattcagttt gcctacactg ctaaactgat tttaagtaaa 300
gagaatgtgg atgaagtgtg caaatgtgtg gagtttttaa gtgtacataa tattgaggaa 360
tcctgctttc agtttctgaa atttaagttt ttggactcca ctgcagacca gcaagaatgc 420
ccaagaaaaa aatgcttttc atcacactgt cagaaaacag accttaaact ttcacttttg 480
gaccagaggg atctagaaac tgatgaagtg gaggaatttc tggaaaataa aaatgttcag 540
actcctcagt gtaaactccg caggtatcaa ggaaatgcaa aagcctcacc tcctctacaa 600
gacagtgcca gtcagacata tgagtccatg tgcttagaga aggatgctgc tctggccttg 660
ccttctttat gccccaaata cagaaaattc caaaaagcat ttggaactga cagagtccgt 720
actggggaat ctagtgtcaa agacattcat gcttctgttc agccaaatga aaggtctgaa 780
aatgaatgcc tgggaggagt cccggagtgt agagatttgc aggtgatgtt aaaatgtgac 840
gaaagtaaat tagcaatgga acctgaagaa acgaagaaag atcctgcttc tcagtgccca 900
actgaaaaat cagaagtgac tcctttcccc cacaattctt ccatagaccc tcatggactt 960
tattctttgt ctcttttaca cacatatgac caatatggtg acttgaattt tgctggtatg 1020
caaaacacaa cagtgttaac agaaaagcct ttgtcaggta cagacgtcca agaaaaaaca 1080
tttggtgaaa gtcaggattt acctttgaaa tccgacttgg gcaccaggga agatagtagt 1140
gttgcatcta gtgataggag tagtgtggag cgagaagtgg cagaacacct agcaaaaggc 1200
ttctggagtg acatttgcag cacggacact ccttgccaaa tgcagttatc acctgctgtg 1260
gccaaagatg gctcagaaca gatctcacag aaacggtctg agtgtccgtg gttaggtatc 1320
aggattagtg agagcccaga accaggtcaa aggactttca caacattaag ttctgtcaac 1380
tgccctttta taagtactct gagtactgaa ggctgttcaa gcaatttgga aattggaaac 1440
gatgattatg tttcagaacc ccagcaagaa ccttgcccat atgcttgtgt cattagcttg 1500
ggagacgact ctgagacgga caccgaagga gacagtgaat cctgttcagc cagagaacaa 1560
gaatgtgagg taaaactgcc attcaatgca caacggataa tttcactgtc tcgaaatgat 1620
tttcagtcct tgttgaaaat gcacaagctt actccagaac agctggattg tatccatgat 1680
attcgaagaa gaagtaaaaa cagaattgct gcacagcgct gtcgcaagag aaaacttgac 1740
tgtatacaga atcttgaatc agaaattgag aagctgcaaa gtgaaaagga gagcttgttg 1800
aaggaaagag atcacatttt gtcaactctg ggcgagacaa agcagaacct aactggactt 1860
tgccagaaag tttgtaaaga agcagctctg agtcaagaac aaatacagat actcgccaag 1920
tactcagctg cagattgccc actttcattt ttaatttctg aaaaagataa aagtactcct 1980
gatggtgaac tggcgttacc atcaattttc agtttatctg accggcctcc agcagtgctg 2040
cctccctgtg ccagaggaaa cagtgagcct ggctacgcgc gagggcagga gtcccagcag 2100
atgtccacag ccacctctga gcaagctggg cctgcggaac agtgtcgtca gagtggtggg 2160
atctcagatt tctgtcagca gatgactgat aaatgtacta ctgatgagta a 2211
- 还没有人留言评论。精彩留言会获得点赞!