储存稳定的中性金属蛋白酶的用途和制备的制作方法
本发明要求2005年10月12日提交的在审美国临时专利申请序列第60/726,448号的优先权。
发明领域
本发明提供含有至少一种具有改善储存稳定性的中性金属蛋白酶的方法和组合物。在一些实施方式中,中性金属蛋白酶在清洗和其它应用中找到应用。在一些特别优选的实施方式中,本发明提供含有从芽胞杆菌属某种(Bacillus sp)得到的中性金属蛋白酶(一种或多种)的方法和组合物。在一些更特别优选的实施方式中,中性金属蛋白酶从解淀粉芽胞杆菌(B.amyloliquefaciens)中得到。在又进一步优选的实施方式中,中性金属蛋白酶是解淀粉芽胞杆菌中性金属蛋白酶的变体。在又其它实施方式中,中性金属蛋白酶是解淀粉芽胞杆菌中性金属蛋白酶同系物。本发明在包括但不限于清洗、漂白和消毒的应用中找到具体用途。
发明背景
洗涤剂和其它清洗组合物一般包括活性成分的复合结合。例如,大多数清洗产品包括表面活性剂系统、用于清洗的酶、漂白剂、助洗剂、泡沫抑制剂(suds suppressors)、悬污剂(soil-suspending agents)、去污剂(soil-release agents)、荧光增白剂(optical brighteners)、软化剂、分散剂、染料传递抑制化合物、研磨剂、杀菌剂和香料。尽管目前洗涤剂的复杂性,但是仍有许多污迹难以完全除去。而且通常存在残余物积聚,其导致变色(例如变黄),并且由于清洗不完全使美感降低。由于低(例如冷水)洗涤温度和较短洗涤循环的增加使用,这些问题被增加。而且,许多污迹由纤维材料复合混合物构成,所述纤维材料复合混合物主要包括碳水化合物和碳水化合物衍生物、纤维和细胞壁成分(例如植物材料、木材、泥土/基于粘土的土壤和果实)。这些污迹给清洗组合物的配制和使用提出了难以解决的挑战。
另外,彩色衣服倾向于变旧,并表现出外观变差(appearance loss)。一部分这种颜色的损失是由于洗烫过程中的磨损,特别是在自动洗衣机和烘干机中的磨损。此外,织物拉伸强度的损失似乎是由于使用、穿戴和/或洗涤以及干燥引起的机械和化学作用的不可避免的结果。因此需要一种有效率和有效果地洗涤彩色衣服以使这些外观损失最小化的工具(方法)。
总之,尽管清洗组合物能力改善,但本领域仍需要去除污迹、保持织物色彩和外观、并且抑制染料传递的洗涤剂。另外,仍需要这样的洗涤剂和/或织物护理组合物(fabric care compositon),其提供和/或恢复拉伸强度,以及提供织物的抗皱性能、抗起毛(anti-bobbling)性能和/或抗收缩性能,以及提供静电控制(static control)、织物柔软、保持期望的颜色外观和织物防磨损的特性和益处。特别地,仍需要包括能除去污迹的彩色组分的组合物,所述污迹的彩色组分通常仍附着到正被洗烫的织物上。另外,仍需要适合漂白纺织品的改善的方法和组合物。
发明概述
本发明提供含有至少一种具有改善储存稳定性的中性金属蛋白酶的方法和组合物。在一些实施方式中,中性金属蛋白酶在清洗和其它应用中找到应用。在一些特别优选的实施方式中,本发明提供含有从芽胞杆菌属某种得到的中性金属蛋白酶(一种或多种)的方法和组合物。在一些更特别优选的实施方式中,中性金属蛋白酶从解淀粉芽胞杆菌中得到。又在进一步优选的实施方式中,中性金属蛋白酶是解淀粉芽胞杆菌中性金属蛋白酶的变体。又在其它实施方式中,中性金属蛋白酶是解淀粉芽胞杆菌中性金属蛋白酶的同系物。本发明在包括但不限于清洗、漂白和消毒的应用中找到具体用途。
本发明提供新型中性金属蛋白酶、编码所述中性金属蛋白酶的新型遗传物质、和从芽胞杆菌属某种特别是解淀粉芽胞杆菌获得的中性金属蛋白酶蛋白,以及从它们开发的变体蛋白。特别地,本发明提供从芽胞杆菌属某种特别是解淀粉芽胞杆菌获得的中性金属蛋白酶组合物、编码该蛋白酶的DNA、含有该编码中性金属蛋白酶的DNA的载体、用载体DNA转化的宿主细胞和通过宿主细胞产生的酶。本发明也提供清洗组合物(例如洗涤剂组合物)、动物饲料组合物(animal feed compositions)和纺织品以及皮革处理组合物,其包括从芽胞杆菌属的种特别是解淀粉芽胞杆菌获得的中性金属蛋白酶(一种或多种)。在可选的实施方式中,本发明提供从本文描述的野生型中性金属蛋白酶衍生的突变体(即变体)中性金属蛋白酶。这些突变体中性金属蛋白酶同样可应用于多种应用。
本发明提供从芽胞杆菌属的种特别是解淀粉芽胞杆菌获得的分离的中性金属蛋白酶。在进一步实施方式中,中性金属蛋白酶包括如在SEQ ID NOS:3、4或18列出的氨基酸序列。在另外的实施方式中,本发明提供分离的中性金属蛋白酶,其包括与包含SEQ ID NOS:3、4或18的中性金属蛋白酶具有至少45%的氨基酸同一性。在一些实施方式中,分离的中性金属蛋白酶与包含SEQ ID NOS:3、4或18的中性金属蛋白酶具有至少50%同一性、优选至少55%、更优选至少60%、又更优选至少65%、甚至更优选至少70、更优选至少75%、仍更优选至少80%、更优选85%、又更优选90%、甚至更优选至少95%以及最优选99%的同一性。
本发明也提供与从解淀粉芽胞杆菌获得的金属蛋白酶具有免疫交叉反应性的分离的中性金属蛋白酶,以及包含这些中性金属蛋白酶的组合物。在可选的实施方式中,中性金属蛋白酶与包含SEQ ID NOS:3、4或18所列出的氨基酸序列的中性金属蛋白酶具有免疫交叉反应性。在进一步的实施方式中,中性金属蛋白酶与解淀粉芽胞杆菌的中性金属蛋白酶的片段(即部分)和/或包含SEQ ID NOS:3、4或18所列出的氨基酸序列的中性金属蛋白酶具有交叉反应性。实际上,本发明意欲包括解淀粉芽胞杆菌金属蛋白酶的片段(例如表位),其在动物(包括但不限于人)中刺激免疫应答,和/或被任何类的抗体所识别。本发明进一步包括金属蛋白酶上的表位,其与解淀粉芽胞杆菌金属蛋白酶表位交叉反应。在一些实施方式中,金属蛋白酶表位被抗体所识别,但是在动物(包括但不限于人)中不刺激免疫应答,而在其它实施方式中,金属蛋白酶表位在至少一种动物种类(包括但不限于人)中刺激免疫应答,并且被任何类的抗体所识别。本发明也提供鉴别和评估交叉反应表位的方法和组合物。
在一些实施方式中,本发明提供SEQ ID NOS:3、4或18所列出的氨基酸序列。在可选的实施方式中,序列包括在SEQ ID NOS:3、4或18的至少一个氨基酸位置的取代。在一些特别优选的可选实施方式中,序列包括在SEQ ID NO:18的至少一个氨基酸位置的取代。在一些优选的实施方式中,本发明提供中性金属蛋白酶变体,所述变体含有包括至少一个氨基酸取代的氨基酸序列,该取代在与含有SEQ ID NOS:3、4或18所列出的氨基酸序列的解淀粉芽胞杆菌中性金属蛋白酶中位置相同的位置进行。在一些另外优选的实施方式中,本发明提供中性金属蛋白酶变体,所述变体含有包括至少一个氨基酸取代的氨基酸序列,该取代在与含有SEQ ID NO:18所列出的氨基酸序列的解淀粉芽胞杆菌中性金属蛋白酶中位置相同的位置。在可选的实施方式中,本发明提供中性金属蛋白酶变体,所述变体含有包括至少一个氨基酸取代的氨基酸序列,该取代在与含有SEQ ID NOS:3、4或18至少一部分的解淀粉芽胞杆菌中性金属蛋白酶中位置相同的位置进行。在一些可选的优选的实施方式中,中性金属蛋白酶在SEQ ID NOS:3、4或18的至少一部分含有多个突变。在一些可选的优选的实施方式中,中性金属蛋白酶在SEQ ID NO:18的至少一部分含有多个突变。
又在其它实施方式中,本发明提供在SEQ ID NO:18列出的氨基酸序列。在可选的实施方式中,序列在SEQ ID NO:18的至少一个氨基酸位置包括取代。在一些优选的实施方式中,本发明提供中性金属蛋白酶变体,所述变体含有包括至少一个氨基酸取代的氨基酸序列,该取代在与含有SEQ ID NO:18所列出的氨基酸序列的解淀粉芽胞杆菌中性金属蛋白酶中位置相同的位置进行。在可选的实施方式中,本发明提供中性金属蛋白酶变体,所述变体含有包括至少一个氨基酸取代的氨基酸序列,该取代在与含有SEQ ID NO:18至少一部分的解淀粉芽胞杆菌中性金属蛋白酶中位置相同的位置进行。在一些可选的优选的实施方式中,中性金属蛋白酶在SEQ ID NO:18的至少一部分含有多个突变。
在一些特别优选的实施方式中,与野生型解淀粉芽胞杆菌中性金属蛋白酶相比,这些变体具有提高的性能。本发明也提供中性金属蛋白酶变体,其与野生型中性金属蛋白酶相比,具有至少一个提高的性能。在一些另外特别优选的实施方式中,与野生型解淀粉芽胞杆菌中性金属蛋白酶相比,这些变体具有提高的稳定性。在一些进一步优选的实施方式中,与野生型解淀粉芽胞杆菌中性金属蛋白酶相比,这些变体具有提高的热稳定性。在又另外优选的实施方式中,与野生型解淀粉芽胞杆菌中性金属蛋白酶相比,这些变体在较低或较高pH条件下具有提高的性能。
本发明也提供中性金属蛋白酶,其包括SEQ ID NOS:3、4或18所列出的氨基酸序列的至少一部分。在一些实施方式中,编码这些中性金属蛋白酶的核苷酸序列包括选自SEQ ID NOS:1、2、12和/或13的核苷酸序列。在一些实施方式中,中性金属蛋白酶是具有与在SEQ ID NOS:3、4或18列出的氨基酸序列相似的氨基酸序列的变体。又在其它实施方式中,中性金属蛋白酶是变体和/或同系物。在进一步的实施方式中,中性金属蛋白酶是图3到图5任何一个所列出的中性金属蛋白酶。在其它实施方式中,中性金属蛋白酶是在图3、4和/或5列出的中性金属蛋白酶的变体。
本发明也提供表达载体,其包括编码SEQ ID NOS:3、4或18所列出的中性金属蛋白酶的至少一部分的多核苷酸序列。本发明进一步提供含有编码至少一种中性金属蛋白酶变体的多核苷酸序列的表达载体,所述变体含有包括至少一个氨基酸取代的氨基酸序列(一个或多个),该取代在与含有SEQ ID NOS:3、4或18所列出的氨基酸序列的芽胞杆菌中性金属蛋白酶中位置相同的位置进行。在进一步的实施方式中,本发明提供包括这些表达载体的宿主细胞。在一些特别优选的实施方式中,宿主细胞选自芽胞杆菌属某种。本发明也提供宿主细胞产生的中性金属蛋白酶。
本发明也提供组合物,其包含从芽胞杆菌属某种特别是解淀粉芽胞杆菌获得的分离的中性金属蛋白酶的至少一部分,其中中性金属蛋白酶的至少一部分是出选自SEQ ID NOS:1、2、12和/或13的多核苷酸序列编码的。在进一步的实施方式中,本发明也提供包括这些表达载体的宿主细胞。在一些特别优选的实施方式中,宿主细胞是芽胞杆菌属某种。本发明也提供宿主细胞产生的中性金属蛋白酶。
本发明也提供变体中性金属蛋白酶,其中中性金属蛋白酶在相应于SEQ ID NO:3和/或SEQ ID NO:18中的氨基酸位置含有至少一个取代,并且与野生型解淀粉芽胞杆菌金属蛋白酶相比,其中变体金属蛋白酶在至少一个特性上具有更好的性能。在一些特别优选的实施方式中,本发明也提供变体中性金属蛋白酶,其中中性金属蛋白酶在相应于SEQ ID NO:18中的氨基酸位置含有至少一个取代,并且与野生型解淀粉芽胞杆菌金属蛋白酶相比,其中变体金属蛋白酶在至少一个特性上具有更好的性能。
本发明也提供变体氨基酸,其中所述变体含有至少一个氨基酸取代,所述取代在与含有SEQ ID NO:18所列出的氨基酸的中性金属蛋白酶中位置相同的位置进行,其中所述位置(一个或多个)选自位置1,3,4,5,6,11,12,13,14,16,21,23,24,25,31,32,33,35,36,38,44,45,46,47,48,49,50,51,54,55,58,59,60,61,62,63,65,66,69,70,76,85,86,87,88,90,91,92,96,97,98,99,100,102,109,110,111,112,113,115,117,119,127,128,129,130,132,135,136,137,138,139,140,146,148,151,152,153,154,155,157,158,159,161,162,169,173,178,179,180,181,183,184,186,190,191,192,196,198,199,200,202,203,204,205,210,211,214,215,216,217,218,219,220,221,222,223,224,228,229,237,239,240,243,244,245,248,252,253,260,261,263,264,265,267,269,270,273,277,280,282,283,284,285,286,288,289,290,292,293,296,297,和299。
本发明也提供分离的中性金属蛋白酶变体,其具有包括至少一个氨基酸取代的氨基酸序列,所述取代在与含有SEQ ID NO:18所列出的氨基酸序列的中性金属蛋白酶中位置相同的位置进行。在一些实施方式中,分离的中性金属蛋白酶变体具有在与含有SEQ ID NO:18中列出的氨基酸序列的中性金属蛋白酶的下列位置相同的位置进行的取代:1,3,4,5,6,11,12,13,14,16,21,23,24,25,31,32,33,35,36,38,44,45,46,47,48,49,50,51,54,55,58,59,60,61,62,63,65,66,69,70,76,85,86,87,88,90,91,92,96,97,98,99,100,102,109,110,111,112,113,115,117,119,127,128,129,130,132,135,136,137,138,139,140,146,148,151,152,153,154,155,157,158,159,161,162,169,173,178,179,180,181,183,184,186,190,191,192,196,198,199,200,202,203,204,205,210,211,214,215,216,217,218,219,220,221,222,223,224,228,229,237,239,240,243,244,245,248,252,253,260,261,263,264,265,267,269,270,273,277,280,282,283,284,295,296,288,289,290,292,293,296,297,和299。
在另外的实施方式中,分离的中性金属蛋白酶变体包括选自下列的至少一个突变:T004C,T004E,T004H,T004I,T004K,T004L,T004M,T004N,T004P,T004R,T004S,T004V,T004W,T004Y,G012D,G012E,G012I,G012K,G012L,G012M,G012Q,G012R,G012T,G012V,G012W,K013A,K013C,K013D,K013E,K013F,K013G,K013H,K013I,K013L,K013M,K013N,K013Q,K013S,K013T,K013V, K013Y,T014F,T014G,T014H,T0141,T014K,T014L,T014M,T014P,T014Q,T014R,T014S,T014V,T014W,T014Y,S023A,S023D,S023F,S023G,S023I,S023K,S023L,S023M,S023N,S023P,S023Q,S023R,S023S,S023T,S023V,S023W,S023Y,G024A,G024D,G024F,G024G,G024H,G024I,G024K,G024L,G024M,G024N,G024P,G024R,G024S,G024T,G024V,G024W,G024Y,K033H,Q045C,Q045D,Q045E,Q045F,Q045H,Q045I,Q045K,Q045L,Q045M,Q045N,Q045P,Q045R,Q045T,Q045W,N046A,N046C,N046E,N046F,N046G,N046H,N046I,N046K,N046L,N046M,N046P,N046Q,N046R,N046S,N046T,N046V,N046W,N046Y,R047E,R047K,R047L,R047M,R47Q,R047S,R047T,Y049A,Y049C,Y049D,Y049E,Y049F,Y049H,Y049I,Y049K,Y049L,Y049N,Y049R,Y049S,Y049T,Y049V,Y049W,N050D,N050F,N050G,N050H,N050I,N050K,N050L,N050M,N050P,N050Q,N050R,N050W,N050Y,T054C,T054D,T054E,T054F,T054G,T054H,T054I T054K,T054L,T054M,T054N,T054P,T054Q,T054R,T054S,T054V,T054W,T054Y,S058D,S058H,S058I,S058L,S058N,S058P,S058Q,T059A,T059C,T059E,T059G,T059H,T059I,T059K,T059L T059M,T059N,T059P,T059Q,T059R,T059S,T059V,T059W,T060D,T060F,T060I,T060K,T060L,T060N,T060Q,T060R,T060V,T060W,T060Y,T065C,T065E,T065F,T065H,T065I,T065K,T065L,T065M,T065P,T065Q,T065R,T065V,T065Y,S066C,S066D,S066E,S066F,S066H,S066I,S066K,S066L,S066N,S066P,S066Q,S066R,S066T,S066V,S066W,S066Y,Q087A,Q087D,Q087E,Q087H,Q087I,Q087K,Q087L,Q087M,Q087N,Q087R,Q087S,Q087T,Q087V,Q087W,N090C,N090D,N090E,N090F,N090G,N090H,N090K,N090L,N090R,N090T,N096G,N096H,N096K,N096R,K097H,K097Q,K097W,K100A,K100D,K100E,K100F,K100H,K100N,K100P,K100Q,K100R,K100S,K100V,K100Y,R110A,R110C,R110E,R110H,R110K,R110L,R110M,R110N,R110Q,R110S,R110Y,D119E,D119H,D119I,D119L,D119Q,D119R,D119S,D119T,D119V,D119W,G128C,G128F,G128H,G128K,G128L,G128M,G128N,G128Q,G128R,G128W,G128Y,S129A,S129C,S129D,S129F,S129G,S129H,S129I,S129K,S129L,S129M,S129Q,S129R,S129T,S129V,S129W,S129Y,F130I,F130K,F130L,F130M,F130Q,F130R,F130T,F130V,F130Y,S135P,G136I,G136L,G136P,G136V,G136W,G136Y,S137A,M138I,M138K,M138L,M138Q,M138V,D139A,D139C,D139E,D139G,D139H,D139I,D139K,D139L,D139M,D139P,D139R,D139S,D139V,D139W,D139Y,V140C,Q151I,E152A,E152C,E152D,E152F,E152G,E152H,E152L,E152M,E152N,E152R,E152S,E152W,N155D,N155K,N155Q,N155R,D178A,D178C,D178G,D178H,D178K,D178L,D178M,D178N,D178P,D178Q,D178R,D178S,D178T,D178V,D178W,D178Y,T179A,T179F,T179H,T179I,T179K,T179L,T179M,T179N,T179P,T179Q,T179R,T179S,T179V,T179W,T179Y,E186A,E186C,E186D,E186G,E186H,E186K,E186L,E186M,E186N,E186P,E186Q,E186R,E186S,E186T,E186V,E186W,E186Y,V190H,V190I,V190K,V190L,V190Q,V190R,S191F,S191G,S191H,S191I,S191K,S191L,S191N,S191Q,S191R,S191W,L198M,L198V,S199C,S199D,S199E,S199F,S199I,S199K,S199L,S199N,S199Q,S199R,S199V,Y204H,Y204T,G205F,G205H,G205L,G205M, G205N,G205R,G205S,G205Y,K211A,K211C,K211D,K211G,K211M,K211N,K211Q,K211R,K211S,K211T,K211V,K214A,K214C,K214E,K214I,K214L,K214M,K214N,K214Q,K214R,K214S,K214V,L216A,L216C,L216F,L216H,L216Q,L216R,L216S,L216Y,N218K,N218P,T219D,D220A,D220E,D220H,D220K,D220N,D220P,A221D,A221E,A221F,A221I,A221K,A221L,A221M,A221N,A221S,A221V,A221Y,G222C,G222H,G222N,G222R,Y224F,Y224H,Y224N,Y224R,T243C,T243G,T243H,T243I,T243K,T243L,T243Q,T243R,T243W,T243Y,K244A,K244C,K244D,K244E,K244F,K244G,K244L,K244M,K244N,K244Q,K244S,K244T,K244V,K244W,K244Y,V260A,V260D,V260E,V260G,V260H,V260I,V260K,V260L,V260M,V260P,V260Q,V260R V260S,V260T,V260W,V260Y,Y261C,Y261F,Y261I,Y261L,T263E,T263F,T263H,T263I,T263L,T263M,T263Q,T263V,T263W,T263Y,S265A,S265C,S265D,S265E,S265K,S265N,S265P,S265Q,S265R,S265T,S265V,S265W,K269E,K269F,K269G,K269H,K269I,K269L,K269M,K269N,K269P,K269Q,K269S,K269T,K269V,K269W,K269Y,A273C,A273D,A273H,A273I,A273K,A273L,A273N,A273Q,A273R,A273Y,R280A,R280C,R280D,R280E,R280F,R280G,R280H,R280K,R280L,R280M,R280S,R280T,R280V,R280W,R280Y,L282F,L282G,L282H,L282I,L282K,L282M,L282N,L282Q,L282R,L282V,L282Y,S285A,S285C,S285D,S285E,S285K,S285P,S285Q,S285R,S285W,Q286A,Q286D,Q286E,Q286K,Q286P,Q286R,A289C,A289D,A289E,A289K,A289L,A289R,A293C,A293R,N296C,N296D,N296E,N296K,N296R,N296V,A297C,A297K,A297N,A297Q,A297R和G299N。
在又进一步的实施方式中,本发明提供分离的变体中性金属蛋白酶,其中所述金属蛋白酶包括选自下列的多个突变:S023W/G024M,T004V/S023W/G024W,S023W/G024Y/A288V,T004L/S023W/G024Y,N046Q/N050F/T054L,N050Y/T059R/S129Q,S023W/G024W,A273H/S285P/E292G,S023Y/G024Y,S023Y/G024W,T004S/S023Y/G024W,N046Q/T054K,S023W/G024Y,T004V/S023W,T059K/S066N,N046Q/N050W/T054H/T153A,T004V/S023W/G024Y,L282M/Q286P/A289R,N046Q/R047K/N050Y/T054K,L044Q/T263W/S285R,T004L/S023W/G024W,R047K/N050F/T054K,A273H/S285R,N050Y/T059K/S066Q,T054K/Q192K,N046Q/N050W,L282M/Q286K,T059K/S066Q,T004S/S023W,L282M/Q286R/A289R/K011N,L282M/A289R,N046Q/N050W/T054H,T059K/S 129Q,T004S/S023N/G024Y/F210L,T004V/S023W/G024M/A289V,L282M/Q286K/A289R/S132T,N050W/T054H,L282M/Q286R,L282F/Q286K/A289R,T059R/S066Q,R047K/N050W/T054H,S265P/L282M/Q286K/A289R,L282M/Q286R/T229S,L282F/Q286K,T263W/S285R,S265P/L282M/Q286K,T263H/A273H/S285R,T059R/S129V,S032T/T263H/A273H/S285R,T059R/S066Q/S129Q,T004S/G024W,T004V/S023W/G024M,T059K/S066Q/S129Q,L282M/Q286K/A289R/I253V,T004V/S023Y/G024W,T059R/S066N/S129Q,N050F/T054L,T004S/S023N/G024W,T059R/S066N,T059R/S066N/S129V, Q286R/A289R,N046Q/R047K/N050F/T054K,S265P/L282M/Q286P/A289R,S265P/L282M/Q286R/A289R Q062K/S066Q/S129I,S023N/G024W,N046Q/R047K/N050W/T054H,R047K/T054K,T004L/G024W,T014M/T059R/S129V,T059R/S066Q/N092S/S129I,R047K/N050W/T054K,T004V/G024W,N047K/N050F/T054K,S265P/L282F/Q286K/N061Y,L282F/Q286K/E159V,T004V/S023Y/G024M,S265P/L282F/A289R/T065S,T059K/F063L/S066N/S129V,T004L/S023W,N050F/T054H,T059R/S066Q/S129V,V190I/D220E/S265W/L282F,T004S/S023Y/G024M,T004L/S023N/G024Y,T059K/S066N/S129I,T059R/S066N/S129I,L282M/Q286R/A289R/P162S,N046Q/N050F/T179N,T059K/Y082C/S129V,T059K/S129I,N050Y/T054K,T059K/S066Q/V102A/S129Q,T059R/S066Q/S129I,T059W/S066N/S129V/S290R,T059R/S129I,T059K/S066Q/S129I,T059K/S066Q/S129V,S265P/L282M/Q286R/A289R/T202S/K203N,T004V/S023N/G024W,S265P/Q286K,S265P/L282F/A289R,D220P/S265W,L055F/T059W/S129V,T059R/S129Q/S191R,N050W/T054K,T004S/S023W/G024M,R047K/N050F/T054H,T059K/S066N/K088E,T059K/S066Q/S129I/V291L,L282M/Q286R/A289R,T059R/S066N/F085S/S129I,L282F/Q286P/A289R,L282F/Q286R/A289R,G099D/S265P/L282F/Q286K/A289R,N046Q/N050F,N050Y/T059W/S066N/S129V,T009I/D220P/S265N,V190F/D220P/S265W,N157Y/T263W/A273H/S285R,T263W/A273H/S285R,T263W/S285W,T004V/S023Y,N046Q/R047K/N050W,N050W/T054L,N200Y/S265P/L282F/Q286P/A289R,T059R/S066Q/P264Q,T004V/G024Y,T004L/G024Y,N050Y/S191I,N050Y/T054L,T004L/S023W/G024Y/N155K,F169I/L282F/Q286R/A289R,L282M/Q286K/A289R,F130L/M138L/E152W/D183N,N046Q/R047K/N050Y/T054H,T004V/G024M,N050Y/T059W/S066Q/S129V,S023N/G024Y,T054H/P162Q,T004S/S023W/G024Y,N050Y/T054H,L282F/Q286R/A289R/F169I,R047K/N050W,V190F/D220P,L282M/F173Y,T004L/S023Y,N050W/A288D,V190I/D220P/S265Q,S265P/L282F/Q286P/A289R,S265P/L282F/Q286R/A289R,N046Q/N050Y/T054K,T059W/S066Q,T263W/A273H/S285W T263W/A273H/S285P,S023Y/G024M,T004L/S023N/G024W,T004V/S023N/G024Y,T059W/S066N/S129Q,T004S/S023Y,T004S/S023N/G024M,T059W/S066N/A070T,T059W/S066Q/S129Q,T263W/A273H,A273H/285P,N046Q/R047K/N050Y/T054L,N046Q/R047K/N050Y,R047K/N050Y,T263H/S285W,R047K/N050F,N046Q/R047K/N050F/T054H,S023N/G024M,T004S/G024Y,R047K/N050Y/T054H,T059W/S066N/S129I,R047K/T054L,T004S/S023W/G024W,M138L/E152F/T146S,D220P/S265N,T004S/G024M,T004V/S023N,N046Q/N050F/T054K,N046Q/N050Y/T054H,Q062H/S066Q/S129Q,T059W/S129Q,T059W/S129V,N050F/T054K,R047K/N050F/T054L,V190I/D220P/S265W,N112I/T263H/A273H/S285R,T059W/S066N/S129V,T059W/S066Q/S129I,T059W/S129I,T263W/S285P,V190I/D220P,A289V/T263H/A273H,T263H/A273H/S285P,N90S/A273H/S285P,R047K/N050Y/T054L,T004S/S023N,T059R/S129Q,N046Q/R047K/T054H,T059W/S066Q/S129V,E152W/T179P, N050Y/S066Q/S129V,T202S/T263W/A273H,T263W/A273H/S285P,M138L/E152W/T179P,N046Q/R047K,N046Q/T054H/F176L,T004L/G024M,T004S/L282M,T263H/A273H,T263H/A273H/S285W,T004L/S023Y/G024M,L282F/Q286P,T004V/S023Y/G024Y,V190F/S265W,M138L/E152F,V190F/D220E/S265W,N046Q/N050F/T054H,N157Y/S285W,T004F/S023Y/G024M,T004V/S023N/G024M,L198I/D220E/S265Q,N046Q/N050Y/T054K/A154T,S016L/D220E/S265W,D220E/S265W,D220E/A237S/S265W,S066Q/S129Q,V190F/D220E/S265Q/T267I,L282M/F173Y/T219S,E152F/T179P,V190I/S265W,M138L/S066Q,M138L/E152W,T059W/S066Q/A070T/S129I,V190F/D220E/S265N,V190F/S265N,N046Q/N050Y和M138L/E152F/T179P。
在又进一步实施方式中,本发明提供分离的变体中性金属蛋白酶,其中所述金属蛋白酶包括选自下列的多个突变:V190I/D220P,V190I/D220P/S265Q,V190L/D220E,V190I/D220E/S265Q,V190I/D220E/S265W/L282F,V190L/D220E/S265Q,V190I/D220E/S265W,V190L/D220E/S265N,T059R/S066Q/S129I,V190I/D220E/S265N,V190L/D220E/S265W,V1901/D220E,T059W/S066N/S129V,T059K/S066Q/S129V,T059K/Y082C/S129V,T059R/S066N/S129I,S066Q/S129V,T059R/S066Q/S129V,T059R/S129I,N050Y/T059W/S066N/S129V,D220P/S265N,S066Q/S129I,T059W/S066Q/S129V,T059K/S066Q/S129I,T059R/S129V,N050Y/S066Q/S129V,T059W/S066Q/S129I,N050Y/T059W/S066Q/S129V,T059K/S129I,D220P/S265W,F130L/M138L/T179P,S066N/S129I,T059R/S066N/S129V,F130I/M138L/T179P,T059R/S066Q/N092S/S129I,S066N/S129V,D220E/S265Q,F130L/M138L/E152W/T179P,T059W/S129V,S265P/L282M/Q286R/A289R,S265P/L282F/Q286R/A289R,T059W/S066N/S129I,V190I/D220P/S265W,F130L/E152W/T179P,F130L/M138L/E152F/T179P,Q062K/S066Q/S129I,T059K/S066N/S129I,E152H/T179P,S265P/L282M/Q286K/A289R,F130L/M138L/E152H/T179P,T263W/A273H/S285R,D220E/S265N,F130I/M138L/E152H/T179P,F130V/M138L/E152W/T179P,F130I/M138L/E152W/T179P,T059W/S129I,D220E/S265W,F130V/M138L/T179P,F130L/E152V/T179P,T059R/S129Q,T263W/S285P,F130I/M138L/E152F/T179P,E152W/T179P,V190L/S265Q,F130L/E152F/T179P,L282M/Q286R/A289R/P162S,D220P/S265Q,M138L/E152F/T179P,F130I/E152H/T179P,M138L/E152W/T179P,F130L/T179P,F130L/M138L/E152W/T179P/Q286H,F130L/M138L/E152H,T263W/A273H/S285W,S265P/Q286K,T059W/S066Q/S129Q,T263W/S285R,T059W/S066N/S129Q,T263W/S285W,T059R/S066N/S129Q,S265P/L282M/Q286R/A289R/T202S/K203N,T059W/S129Q,Q062H/S066Q/S129Q,L282M/Q286R/A289R,V190L/D220E/S265N/V291I,V190L/S265N,F130L/M138L/E152W,N050Y/T059R/S129Q,F130I/T179P,T059K/S066Q/S129Q,T059K/S129Q,S265P/L282M/Q286P/A289R,S265P/L282F/Q286P/A289R,T263W/A273H/S285P,S265P/L282M/Q286K,S016L/D220E/S265W,S066Q/S129Q, S265P/L282M/Q286P,L282F/Q286R/A289R,F130V/E152W/T179P,L044Q/T263W/S285R L055F/T059W/S129V,V190L/S265W,Q286R/A289R,G99D/S265P/L282F/Q286K/A289R,F130L/M138L/E152F,T059R/S066Q/S129Q,F130L/E152H,S066N/S129Q,T004S/S023N/G024M/K269N,S265P/L282M,E152F/T179P,T059W/S066N/S129V/S290R,L282F/Q286K/A289R,F130L/M138L,F130I/M138L/E152W,S265P/L282F,F130I/M138L/E152H,F130V/M138L/E152H,V190I/S265Q,M138L/E152M,S265P/L282F/Q286P,M138L/E152H,T059K/S066N/K088E,V190I/S265W,F130L/E152W,L282M/Q286K/A289R,L282M/Q286K/A289R/I253V,T263W/A273H,V190I/S265N,M138L/E152W,A273H/S285R,F130I/M138L,F130L/E152F,F130V/M138L/E152W,T059K/S066Q/V102A/S129Q,F130V/E152H/T179P,F130I/M138L/E152F,F130V/M138L/E152F,M138L/E152F,L282M/Q286R,F130I/E152H,S265P/L282F/A289R/T065S,T263H/A273H/S285R,F130V/M138L,T014M/T059R/S129V,L282M/Q286R/A289R/K11N,A273H/S285P,L282M/Q286K/A289R/S132T,T263H/A273H/S285W,F130V/E152W,S265P/L282F/Q286K/N061Y,F130I/E152W,L198I/D220E/S265Q,V190I/S265L,T263H/S285W,S265P/L282F/A289R,M138L/S066Q,F130I/E152F,N90S/A273H/S285P,S032T/T263H/A273H/S285R,L282F/Q286P/A289R,N157Y/T263W/A273H/S285R,V105A/S129V,T263H/A273H/S285P,S129Q/L282H,T059W/S066Q,F130V/E152H,S023W/G024Y,T004V/S023N,T059R/S066Q,N050W/T054L,L282M/Q286P/A289R,A115V/V190L/S265W,L282M/Q286K,T059R/S066N,L282F/Q286P,T004V/S023W/G024M,S265P/L282F/Q286R/L78H,L282F/Q286K,T004V/S023W/G024Y,S023W/G024M,T059R/R256S,F130V/E152F,T004V/G024W,N050W/T054K,S023Y/G024M,T004V/S023Y,T004V/S023Y/G024M,N050Y/T054H,S023W/G024W,T004V/S023Y/G024Y,T004V/S023N/G024W,F130L/M138L/E152F/T179P/V291I,N050Y/T059K/S066Q,T004V/S023Y/G024W,T059K/S066N,T004V/S023N/G024Y,S023Y/G024W,N050F/T054L,R047K/T054K,S023N/G024W,L282M/A289R,S023Y/G024Y,T004V/G024M,R047K/N050F/T054K,N050F/T054K,T059K/S066Q,S023N/G024M,S023N/G024Y,T004L/S023N,R047K/N050W/T054H,T004L/S023W/G024Y,T004S/S023W,N046Q/N050W/T054H/A142T,T004L/S023Y,T004V/S023W,N050W/T054H,T004S/S023N,T004S/L282M,T004L/S023W,N050F/T054H,N050Y/T054L和R047K/N050W/T054K。
在又进一步实施方式中,本发明提供分离的中性金属蛋白酶,其包括选自下列的多个突变:S066Q/S129V,S066Q/S129I,N050Y/S066Q/S129V,S066N/S129I,T059K/S066Q/S129V,S066N/S129V,F130L/E152W/T179P,S265P/L282M/Q286R/A289R,F130L/E152V/T179P,T059K/S066Q/S129I,T263W/S285P,T059K/S066N/S129I,T263W/A273H/S285P,S265P/L282F/Q286R/A289R,F130V/E152W/T179P,T263W/A273H/S285R,V190I/D220P/S265W,F130L/E152H,S066N/S129Q,S265P/L282M/Q286K/A289R, V190I/D220E,T059R/S066N/S129I,V190I/D220E/S265W,T059K/S129I,T059R/S066Q/S129I,F130I/M138L/E152H/T179P,F130I/T179P,T263W/A273H/S285W,S016L/D220E/S265W,S066Q/S129Q,V190I/D220E/S265Q,T059R/S066Q/S129V,D220E/S265N,V190L/D220E,D220E/S265W,V190I/D220P,V190L/D220E/S265N,L044Q/T263W/S285R,S265P/L282M/Q286P/A289R,F130L/M138L/E152H/T179P,T263W/S285R,L282M/Q286R/A289R,T263W/S285W,F130I/E152H/T179P,V190I/D220E/S265N,V190L/D220E/S265W,V190I/D220P/S265Q,T059R/S066N/S129V,V190L/D220E/S265Q,E152H/T179P,F130L/M138L/E152F/T179P,Q062H/S066Q/S129Q,T059R/S129V,V190I/D220E/S265W/L282F,V190I/S265Q,F130L/E152F/T179P,D220E/S265Q,E152W/T179P,T059K/S066Q/S129Q,F130L/M138L/T179P,F130I/M138L/E152F/T179P,F130L/M138L/E152W/T179P,N050Y/T059W/S066Q/S129V,S265P/L282M/Q286K,T059R/S129I,F130V/E152H/T179P,D220P/S265N,S265P/L282M/Q286P,F130I/E152H,T059R/S066Q/N092S/S129I,F130L/T179P,G99D/S265P/L282F/Q286K/A289R,T263W/A273H,V190I/S265N,D220P/S265W,F130L/E152W,F130L/M138L/E152H,S265P/L282M,V190I/S265Q,F130L/E152F,T059K/S129Q,Q286R/A289R,M138L/E152W/T179P,F130I/M138L/E152H,D220P/S265Q,V190L/S265N,F130I/M138L/E152W,S265P/Q286K,V190L/S265Q,V190I/S265W,F130L/M138L/E152F,F130V/E152H,E152F/T179P,N050Y/T059W/S066N/S129V,T059R/S066N/S129Q,F130I/E152W,F130V/E152W,T059R/S066Q/S129Q,T263H/A273H/S285P,N90S/A273H/S285P,V190I/D220E/S265N/V291I,T059R/S129Q,A273H/S285P,F130I/M138L/E152W/T179P,F130V/M138L/E152F,N050Y/T059R/S129Q,T059W/S066Q/S129I,F130V/M138L/T179P,F130V/M138L/E152W/T179P,V190L/S265W,F130V/M138L/E152W,T059W/S066Q/S129V,V190I/S265Q,F130V/M138L/E152H,F130I/E152F,N157Y/T263W/A273H/S285R,T263H/S285W,M138L/E152F/T179P,A115V/V190L/S265W,M138L/E152M,T263H/A273H/S285W,F130L/M138L/E152W,T059K/S066N/K088E,F130I/M138L/E152F,F130I/M138L/T179P,T004V/S023N,T059K/S066Q/V102A/S129Q,F130L/M138L,N047K/N050F/T054K,T263H/A273H/S285R,F130L/M138L/E152W/T179P/Q286H,M138L/E152H,M138L/S066Q,L282M/Q286R/A289R/P162S,L282F/Q286R/A289R,Q062K/S066Q/S129I,A273H/S285R,S265P/L282F/Q286P,S265P/L282F/Q286P/A289R,S265P/L282M/Q286R/A289R/T202S/K203N,T059W/S066N/S129I,V190I/S265L,T059W/S066N/S129V,F130I/M138L,L282M/Q286K/A289R/I253V,R047K/N050F/T054K,M138L/E152F,N050W/T054K,L198I/D220E/S265Q,L282F/Q286K/A289R,N050F/T054K,L282M/Q286R,M138L/E152W,S265P/L282F,F130V/E152F,T059W/S066N/S129Q,F130V/M138L,T263H/A273H,L282M/Q286K/A289R,N046Q/N050W/T054H/A142T,T059W/S066Q/S129Q,S265P/L282F/A289R/T065S,N050F/T054H,S129Q/L282H,L282M/Q286K/A289R/S132T,L282M/Q286R/A289R/K11N,T059K/S066N, R047K/N050W/T054K,T059K/S066Q,T004V/S023Y,T059W/S066N/S129V/S290R,N050Y/T059K/S066Q和R047K/N050Y。
本发明也提供分离的多核甘酸,其包括下列核苷酸序列:(i)与SEQ ID NOS:1、2、12和/或13具有至少70%的同一性,或者(ii)在具有中到高严紧性的条件下,能与从本文列出的任何核苷酸序列得到的探针杂交,包括在实施例提供的引物序列,或(iii)与SEQ ID NOS:1、2、12和/或13列出的核苷酸序列互补。在一些实施方式中,本发明提供编码至少一种这类多核苷酸的表达载体。在进一步的实施方式中,本发明提供含有这些表达载体的宿主细胞。在一些特别优选的实施方式中,宿主细胞是芽胞杆菌属某种。本发明也提供宿主细胞产生的中性金属蛋白酶。在进一步的实施方式中,本发明提供与SEQ ID NOS:1、2、12和/或13列出的序列的至少一部分互补的多核苷酸。
本发明也提供制造具有中性金属蛋白酶活性的酶的方法,包括:用含有与SEQ ID NO:1、2、12和/或13具有至少70%序列同一性的多核苷酸的表达载体转化宿主细胞;在适合于宿主细胞的条件下,培养转化的宿主细胞。在一些优选的实施方式中,宿主细胞是芽胞杆菌属的种。
本发明也提供探针,其含有与SEQ ID NOS:1、2、12和/或13的相应片段基本上相同的4到150个核苷酸的序列,其中所述探针被用于检测编码具有金属蛋白酶活性的酶的核酸序列。在一些实施方式中,核酸序列从芽胞杆菌属某种获得。
本发明也提供清洗组合物(cleaning composition),其含有从芽胞杆菌属某种获得的至少一种中性金属蛋白酶。在一些实施方式中,至少一种中性金属蛋白酶从解淀粉芽胞杆菌获得。在一些特别优选的实施方式中,至少一种中性金属蛋白酶包括SEQ ID NOS:3、4和/或18列出的氨基酸序列。在一些进一步的实施方式中,本发明提供分离的中性金属蛋白酶,其包括与含有SEQ ID NOS:3、4和/或18的中性金属蛋白酶至少45%的氨基酸同一性。在一些实施方式中,分离的中性金属蛋白酶包括与SEQ ID NOS:3、4或18至少50%同一性、优选至少55%、更优选至少60%、又更优选至少65%、甚至更优选至少70%、更优选至少75%、仍旧更优选至少80%、更优选85%、又更优选90%、甚至更优选至少95%以及最优选99%的同一性。
本发明进一步提供含有至少一种中性金属蛋白酶的清洗组合物,其中至少一种中性金属蛋白酶与从芽胞杆菌属某种获得的中性金属蛋白酶具有免疫交叉反应性。在一些优选的实施方式中,中性金属蛋白酶与从解淀粉芽胞杆菌获得的中性金属蛋白酶具有免疫交叉反应性。在可选的实施方式中,中性金属蛋白酶与含有SEQ ID NOS:3、4和/或18列出的氨基酸序列的中性金属蛋白酶具有免疫交叉反应性。在进一步的实施方式中,中性金属蛋白酶与芽胞杆菌属某种中性金属蛋白酶和/或含有SEQ ID NOS:3、4和/或18列出的氨基酸序列的中性金属蛋白酶的片段(即部分)具有交叉反应性。本发明本发明进一步提供含有至少一种中性金属蛋白酶的清洗组合物,其中中性金属蛋白酶是变体中性金属蛋白酶,其具有包括至少一个氨基酸取代的氨基酸序列,该取代在与含有SEQ ID NOS:3、4或18所列出的氨基酸序列的芽胞杆菌属某种中性金属蛋白酶,特别是解淀粉芽胞杆菌中性金属蛋白酶中位置相同的位置进行。在一些特别优选的实施方式中,本发明也提供含有至少一种中性金属蛋白酶的清洗组合物,其中中性金属蛋白酶是变体中性金属蛋白酶,其具有包括至少一个氨基酸取代的氨基酸序列,该取代在与含有SEQ ID NO:18所列出的氨基酸序列的芽胞杆菌属某种中性金属蛋白酶,特别是解淀粉芽胞杆菌中性金属蛋白酶中位置相同的位置进行。
又在其它实施方式中,清洗组合物包括含有SEQ ID NOS:3、4和/或18的一组突变的至少一种中性金属蛋白酶。在一些特别优选的实施方式中,变体中性金属蛋白酶在相应于SEQ ID NOS:3、4和/或18中氨基酸位置具有至少一个取代,并且与野生型解淀粉芽胞杆菌中性金属蛋白酶比较,其中变体中性金属蛋白酶在至少一个特性上具有更好的性能。
本发明也提供含有清洗有效量的至少一种金属蛋白水解酶和适当的清洗制剂的清洗组合物,该酶含有与SEQ ID NOS:3、4和/或18具有至少70%序列同一性的氨基酸序列。在一些优选的实施方式中,清洗组合物进一步包括一种或多种另外的酶或酶衍生物,其选自蛋白酶、淀粉酶、脂肪酶、甘露聚糖酶(mannanases)、果胶酶、角质酶(cutinases)、氧化还原酶、半纤维素酶和纤维素酶。
本发明也提供含有从芽胞杆菌属某种特别是解淀粉芽胞杆菌获得的至少一种中性金属蛋白酶的组合物,其中组合物进一步包括至少一种稳定剂。在一些实施方式中,稳定剂选自硼砂、甘油、锌离子、钙离子和甲酸钙。在一些实施方式中,本发明提供适合将本发明的酶稳定到阴离子表面活性剂的竞争性抑制剂。在一些实施方式中,至少一种中性金属蛋白酶从芽胞杆菌属某种获得。在一些特别优选的实施方式中,至少一种中性金属蛋白酶从解淀粉芽胞杆菌获得。在一些特别优选的实施方式中,至少一种中性金属蛋白酶包括SEQ ID NOS:3、4和/或18列出的氨基酸序列。
本发明进一步提供含有从芽胞杆菌属某种获得的至少一种中性金属蛋白酶的组合物,其中中性金属蛋白酶是自溶稳定的变体。在一些实施方式中,至少一种变体中性金属蛋白酶从解淀粉芽胞杆菌获得。在一些特别优选的实施方式中,至少一种变体中性金属蛋白酶包括SEQ ID NOS:3、4和/或18列出的氨基酸序列。
本发明也提供含有至少0.0001重量百分比的本发明中性金属蛋白酶以及任选地含有辅助成分(adjunct ingredient)的清洗组合物。在一些实施方式中,组合物含有辅助成分。在一些优选的实施方式中,组合物含有足够量的pH调节物,以提供组合物大约3到大约5的净pH(neat pH),该组合物基本上不含在大约3到大约5的pH下水解的物质。在一些特别优选的实施方式中,该水解的物质包括表面活性剂物质。在另外的实施方式中,清洗组合物是液体组合物,而在其它实施方式中,清洗组合物是固体组合物,在进一步的实施方式中,清洗组合物是凝胶。实际上,本发明不意欲限于任何具体的制剂和/或组合物,因为各种制剂和/或组合物在本发明中都可使用。在进一步的实施方式中,表面活性剂物质包括含有环氧乙烷部分的烷基硫酸钠表面活性剂。
本发明另外提供清洗组合物,所述清洗组合物除了本发明的至少一种中性金属蛋白酶,进一步包括至少一种酸稳定的酶,该清洗组合物含有足够量的pH调节物,以提供组合物大约3到大约5的净pH,该组合物基本上不含大约3到大约5的pH下水解的物质。在进一步实施方式中,该水解的物质包括表面活性剂物质。在一些优选的实施方式中,清洗组合物是液体组合物。又在其它实施方式中,表面活性剂物质包括含有环氧乙烷部分的烷基硫酸钠表面活性剂。在一些实施方式中,清洗组合物含有适当的辅助成分。在一些另外的实施方式中,组合物含有适当的辅助成分。在一些优选的实施方式中,组合物含有大约0.001wt%到大约0.5wt%的中性金属蛋白酶。
在一些可选的优选实施方式中,组合物含有大约0.01wt%到大约0.1wt%的中性金属蛋白酶。
本发明也提供清洗的方法,其包括下列步骤:a)将含有织物的表面和/或物品与适当浓度的含有本发明中性金属蛋白酶的清洗组合物接触;和b)任选地洗涤和/或冲洗表面或材料。在可选的实施方式中,本文提供的任何适当的组合物在这些方法中找到应用。在一些实施方式中,织物含有至少一种草污迹。在一些特别优选的实施方式中,本发明的清洗组合物在从织物除去草和其它污迹中找到应用。
本发明也提供含有从芽胞杆菌属某种获得的至少一种中性金属蛋白酶的动物饲料。在一些实施方式中,至少一种中性金属蛋白酶从解淀粉芽胞杆菌获得。在一些特别优选的实施方式中,至少一种中性金属蛋白酶包括SEQ ID NOS:3、4或18列出的氨基酸序列。在一些可选的特别优选的实施方式中,至少一种中性金属蛋白酶包括SEQ ID NO:18列出的氨基酸序列。
本发明提供具有金属蛋白水解活性的分离的多肽,(例如中性金属蛋白酶)其具有SEQ ID NO:18列出的氨基酸序列。在一些实施方式中,本发明提供与SEQ ID NO:18列出的序列具有大约40%到98%同一性的分离的多肽。在一些优选的实施方式中,该多肽与SEQ ID NO:18列出的序列具有大约50%到95%的同一性。在一些另外优选的实施方式中,多肽与SEQ ID NO:18列出的序列具有大约60%到90%的同一性。又在其它实施方式中,多肽与SEQ ID NOS:3、4或18列出的序列具有大约65%到85%的同一性。在一些特别优选的实施方式中,多肽与SEQ ID NOS:3、4或18列出的序列具有大约90%到95%的同一性。
本发明进一步提供分离的多核苷酸,其编码含有与SEQ ID NOS:3、4或18具有至少40%氨基酸序列同一性的氨基酸序列的中性金属蛋白酶。在一些实施方式中,中性金属蛋白酶与SEQ ID NOS:3、4和/或18具有至少50%氨基酸序列同一性。在一些实施方式中,中性金属蛋白酶与SEQ ID NOS:3、4或18具有至少60%氨基酸序列同一性。在一些实施方式中,中性金属蛋白酶与SEQ ID NOS:3、4或18具有至少70%氨基酸序列同一性。在一些实施方式中,中性金属蛋白酶与SEQ ID NOS:3、4或18具有至少80%氨基酸序列同一性。在一些实施方式中,中性金属蛋白酶与SEQ ID NOS:3、4或18具有至少90%氨基酸序列同一性。在一些实施方式中,中性金属蛋白酶与SEQ ID NOS:3、4或18具有至少95%氨基酸序列同一性。本发明也提供含有上面提供的任何多核苷酸的表达载体。
本发明进一步提供用本发明的表达载体转化的宿主细胞,以致至少一种中性金属蛋白酶被宿主细胞所表达。在一些实施方式中,宿主细胞是细菌,而在其它实施方式中,宿主细胞是真菌。
本发明也提供包括下列核苷酸序列的分离的多核苷酸:(i)与SEQ ID NO:1、2、12和/或13具有至少70%的同一性,或(ii)在具有中到高严紧性的条件下,能与从SEQ ID NO:1、2、12和/或13的核苷酸序列得到的探针杂交,或(iii)与SEQ ID NO:1、2、12和/或13的核苷酸序列互补。在一些实施方式中,本发明提供含有这类多核苷酸的载体。在进一步的实施方式中,本发明提供用这类载体转化的宿主细胞。
本发明进一步提供产生具有中性金属蛋白酶活性的至少一种酶的方法,包括步骤:用含有与SEQ ID NO:1、2、12和/或13具有至少70%序列同一性的多核苷酸的表达载体转化宿主细胞,在适合于宿主细胞的条件下培养转化的宿主细胞以产生中性金属蛋白酶;和回收中性金属蛋白酶。在一些优选的实施方式中,宿主细胞是芽胞杆菌属某种,而在一些可选的实施方式中,宿主细胞是解淀粉芽胞杆菌。
本发明也提供编码本文提供的中性金属蛋白酶的DNA片段(即部分)。这些片段可用于获得局部长DNA片段,该局部长DNA片段能被用来从解淀粉芽胞杆菌分离或鉴定编码本文所述的成熟中性金属蛋白酶的多核苷酸,或其具有蛋白水解活性的片段。在一些实施方式中,在SEQ ID NO:2提供的DNA部分可用于从其它物种获得编码中性金属蛋白酶或其具有金属蛋白水解活性的部分的同源DNA片段。
本发明进一步提供至少一种探针,该探针含有与SEQ ID NOS:1,2,6,7,8,9,10,11,12,13,14,15的片段,和/或本文列出的任何引物序列基本上相同的多核苷酸,其中探针被用来检测编码具有金属蛋白水解活性的酶的核酸序列,并且其中核酸序列从细菌源获得。在一些实施方式中,细菌源是芽胞杆菌属某种。在一些优选的实施方式中,细菌源是解淀粉芽胞杆菌。
本发明进一步提供含有本文提供的至少一种中性金属蛋白酶的组合物。在一些优选的实施方式中,组合物是清洗组合物。在一些实施方式中,本发明提供含有清洗有效量的至少一种中性金属蛋白酶的清洗组合物,所述中性金属蛋白酶包含与SEQ ID NO:18具有至少40%序列同一性、与SEQ ID NO:18具有至少90%序列同一性的氨基酸序列,和/或具有SEQ ID NO:18的氨基酸序列。在一些实施方式中,清洗组合物进一步包括至少一种适合的清洗辅助剂。在一些实施方式中,中性金属蛋白酶从芽胞杆菌属某种获得。在一些优选的实施方式中,芽胞杆菌属某种是解淀粉芽胞杆菌。
在进一步的实施方式中,清洗组合物进一步包括至少一种另外的酶或酶衍生物,其选自蛋白酶、淀粉酶、脂肪酶、甘露聚糖酶和纤维素酶。
本发明也提供分离的天然发生的中性金属蛋白酶,其包括与SEQ ID NO:18具有至少45%序列同一性的氨基酸序列,与SEQ ID NO:18具有至少60%序列同一性的氨基酸序列,与SEQ ID NO:18具有至少75%序列同一性的氨基酸序列,与SEQ ID NO:18具有至少90%序列同一性的氨基酸序列,与SEQ D NO:18具有至少95%序列同一性的氨基酸序列,和/或具有SEQ ID NO:18序列的氨基酸序列,该中性金属蛋白酶从芽胞杆菌属某种分离。在一些实施方式中,中性金属蛋白酶从解淀粉芽胞杆菌分离。
在另外的实施方式中,本发明提供本发明的中性金属蛋白酶的基因工程变体。在一些实施方式中,该基因工程变体使用重组DNA技术进行基因修饰,而在其它实施方式中,该变体是天然发生的。本发明进一步包括同源酶的基因工程变体以及分离的酶同系物。在一些实施方式中,使用重组DNA技术基因修饰基因工程变体同源中性金属蛋白酶,而在其它实施方式中,变体同源中性金属蛋白酶是天然发生的。
本发明也提供制造中性金属蛋白酶的方法,包括:(a)用含有多核苷酸的表达载体转化宿主细胞,该多核苷酸与SEQ ID NO:2具有至少70%序列同一性、与SEQ ID NO:2具有至少95%序列同一性和/或具有SEQ ID NO:2的多核苷酸序列;(b)在适合于宿主细胞的条件下培养该转化的宿主细胞以产生中性金属蛋白酶;和(c)回收中性金属蛋白酶。在一些实施方式中,宿主细胞是芽胞杆菌属的种(例如枯草芽胞杆菌(B.subtilis)、克劳氏芽胞杆菌(B.clausii)或藓杨芽胞杆菌(B.lichenifonnis))。在可选的实施方式中,宿主细胞是解淀粉芽胞杆菌。
在进一步的实施方式中,本发明提供制造能相对大量产生本发明的中性金属蛋白酶的宿主细胞的方法。在特别优选的实施方式中,本发明提供制造具有需要多肽降解或合成的各种商业应用的中性金属蛋白酶的方法,所述商业应用包括清洗组合物,以及食物和/或饲料成分、纺织品处理、皮革修饰(leather finishing)、谷物处理(grain processing)、肉类处理、清洗、蛋白水解产物的制备、消化助剂、杀微生物组合物、制菌组合物、制真菌组合物、个人护理产品(例如,口腔护理(oral care)、头发护理(hair care)和/或皮肤护理)。
本发明也提供与野生型解淀粉芽胞杆菌中性金属蛋白酶相比具有提高性能的变体中性金属蛋白酶。在一些优选的实施方式中,与野生型解淀粉芽胞杆菌中性金属蛋白酶相比,提高的性能包括提高的热稳定性。在可选的优选实施方式中,与野生型解淀粉芽胞杆菌中性金属蛋白酶相比,提高的性能包括在较低或较高pH条件下提高的性能。在另外优选的实施方式中,与野生型解淀粉芽胞杆菌中性金属蛋白酶相比,提高的性能包括提高的自溶稳定性。在一些特别优选的实施方式中,与目前使用的中性金属蛋白酶相比,本发明的酶组合物具有比得上的或提高的洗涤性能。本发明的其它目标和益处在本文是显而易见的。
附图说明
图1提供如此图,该图示出分别使用荧光染料Fluo-Zn3和Fluo-3确定锌和钙阳离子的纯化中性结合蛋白的亲和常数的结果。
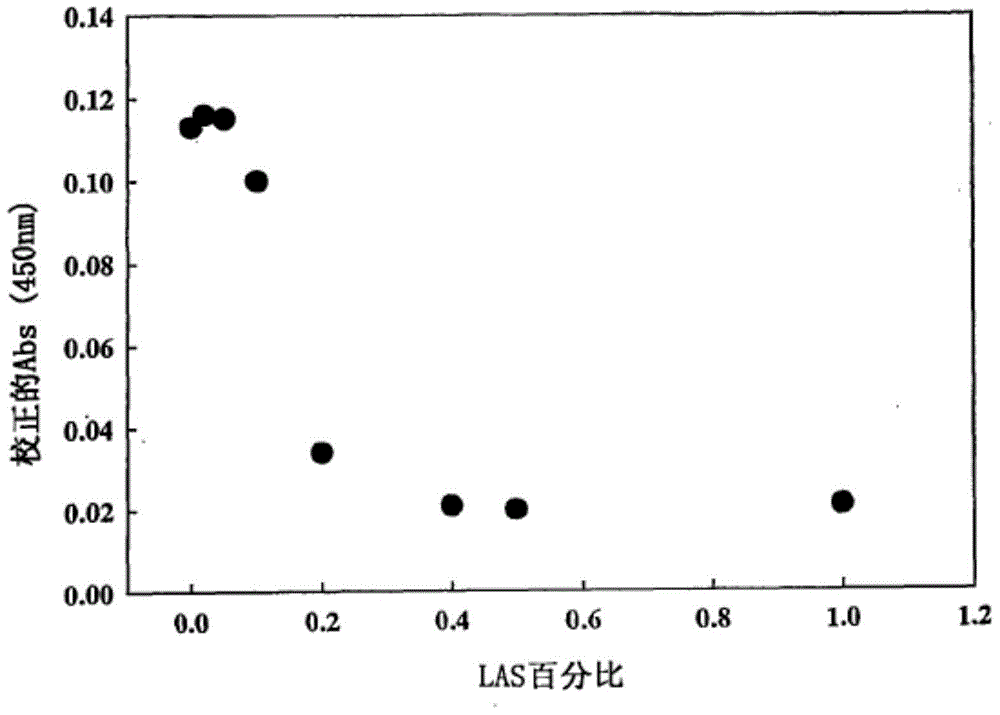
图2提供如此图,该图示出使用QuantiCleaveTM蛋白酶分析法分析的直链烷基苯磺酸酯(LAS)对0.36mg/ml配制的重组解淀粉芽胞杆菌的蛋白酶活性的抑制。
图3提供在本发明发现用途的多种金属蛋白酶同系物的序列对比(SEQ ID NOS:173-181)。
图4提供在本发明发现用途的多种金属蛋白酶同系物的序列对比(SEQ ID NOS:182-191)。在该图中,编号针对嗜热菌蛋白酶(嗜热溶蛋白芽胞杆菌(B. thermoproteolyticus))。如在图3中所示,″*″表示保守残基,″:″表示保守取代的残基,和″.″表示相似的残基。
图5提供通过同源模建方法(homology modeling)鉴别的多种金属蛋白酶同系物的序列对比(SEQ ID NOS:192-195)。
图6提供质粒pJ4:G01905的图。
图7提供质粒pJ4:G01 906的图。
图8提供质粒pJ4:G01907的图。
图9提供质粒pJ4:G01908的图。
图10提供质粒pJ4:G01909的图。
图11提供质粒pJ4:G01938的图。
图12提供质粒pJHT的图。
图13提供质粒pAC的图。
图14提供pUBnprE的图。
图15提供示意图,其示出aprE启动子和枯草芽胞杆菌nprE基因片段的扩增。
图16提供质粒pEL501的图。
图17提供示意图,其示出aprE启动子和枯草芽胞杆菌nprB基因片段的扩增。
图18提供质粒pEL508的图。
图19提供示意图,其示出aprE启动子和嗜热脂肪芽胞杆菌(B.stearothermophilus)nprT基因片段的扩增,其被用于菌株EL560的生产。
图20提供示出菌株EL560构建的图。
图21提供示意图,其示出aprE启动子和热溶芽胞杆菌(B.caldolyticus)npr基因片段的扩增,其被用于菌株EL561的生产。
图22提供示出菌株EL561构建的图。
图23提供示意图,其示出aprE启动子和结核芽胞杆菌(B.thruingiensis)nprB基因片段的扩增。
图24提供质粒pEL568的图。
图25提供如此图,该图示出在32℃下,在锌和钙离子的存在下,被设计以确定基本成分中0.36mg/ml UF浓度的中性金属蛋白酶(nprE)长期储存的实验结果。出于比较的目的,提供在没有盐和过量钙情况下检测得到的结果。
图26提供使用Terg-O-Tometer(TOM)和不同的污染基底的洗涤性能检测数据。图A提供的结果表示在15℃下、在洗涤液中洗涤后,枯草菌溶素(BPN′Y217L)和纯化的Neutral对EMPA 116(固定和没有固定在棉织品(cotton)上)的Δ(delta)污染物除去率(%)。图B提供的结果表示在15℃下、在洗涤液中洗涤后,枯草菌溶素(BPN′Y217L)和纯化的Neutral对棉织品上污染的草介质的Δ污染物除去率(%)。图C提供的结果表示在15℃下、在洗涤液中洗涤后,枯草菌溶素(BPN′Y217L)和纯化的Neutral对CFT C-10(颜料、油、牛奶在棉织物上)的Δ污染物除去率(%)。
图27提供示出使用VP-Cap DSC(MicroCalTM)获得的440ppm NprE和变体的DSC扫描结果的图。
图28提供示出使用VP-Cap DSC(MicroCalTM)所得到的440ppm NprE和变体在存在130mM柠檬酸盐的情况下的DSC扫描结果的图。
图29提供示出在存在多种添加剂的情况下并使用VP-Cap DSC(MicroCalTM)获得的440ppm NprE的热熔点的图。在该图中,水平线表示在没有添加剂的情况下野生型NprE的Tm。
图30提供示出25℃下,在25%中90分钟后,nprE和nprE同系物的残留活性的图。
图31提供示出nprE和nprE同系物的BMI洗涤性能的图。
图32提供示出在多种制剂混合物中NprE稳定性测量结果的图。
图33提供示出固定甲酸钙浓度下用不同DTPA%浓度的NprE失活速率的图(图A、B和C)。
图34提供的图表示DOE分析软件产生的基于响应目标(response goal)(衰变速率)的DTPA和甲酸钙组合物的预测曲线(图A、B和C)。
图35提供NprE的柠檬酸诱导的自溶片段的氨基酸序列(SEQ ID NOS:222-226),其突出显示自溶位点。片段1和2是第一夹子(clip),片段3-5表示第二夹子。斜体字表示测序的N-末端,粗体字突出显示从各自片段的凝胶内消化(in-gel digestion)鉴别的肽。
发明描述
本发明提供含有至少一种中性金属蛋白酶的方法和组合物,所述中性金属蛋白酶具有改善的储存稳定性。在一些实施方式中,中性金属蛋白酶在清洗和其它应用中找到应用。在一些特别优选的实施方式中,本发明提供含有从芽胞杆菌属某种得到的中性金属蛋白酶(一种或多种)的方法和组合物。在一些更特别优选的实施方式中,中性金属蛋白酶从解淀粉芽胞杆菌中得到。在又进一步优选的实施方式中,中性金属蛋白酶是解淀粉芽胞杆菌中性金属蛋白酶的变体。又在其它实施方式中,中性金属蛋白酶是解淀粉芽胞杆菌中性金属蛋白酶的同系物。本发明在包括但不限于清洗、漂白和消毒的应用中找到具体用途。
除非另有说明,本发明的实践包括通常用于分子生物学、微生物学、蛋白质纯化、蛋白质工程、蛋白质和DNA测序和重组DNA领域的传统技术,这些技术在本领域普通技术人员的范围内。这些技术对本领域技术人员是已知的,并且在大量教材和参考文件中描述(参见,例如Sambrook等,″Molecular Cloning:A Laboratory Manual",第二版(Cold Spring Harbor),[1989]);和Ausubel等,″Current Protocols in Molecular Biology″[1987])。本文提到的所有专利、专利申请、文章和出版物——前面提到和后面将提到的,在此明确地引入本文作为参考。
而且,本文所提供的标题并非是对本发明的各个方面或各种实施方式的限制,其可以通过整体参考说明书而被拥有。因此,通过整体参考说明书,紧接下面被定义的术语被更加充分地定义。但是,为了帮助理解本发明,下面定义了许多术语。
定义
除非本文中另外定义,本文中所使用的所有技术和科学术语具有与本发明所属领域的普通技术人员所通常理解的含义相同的含义。例如,Singleton和Sainsbury,Dictionary of Microbiology and Molecular Biology,2d Ed.,John Wiley and Sons,NY(1994);以及Hale和Marham,The Harper Collins Dictionary of Biology,Harper Perennial,NY(1991)为本领域普通技术人员提供了在本文中使用的许多术语的一般性诠释。尽管和本文中描述的那些相似或等同的任何方法和材料在本发明的实践中可以使用,但是优选的方法和材料仍在本文中被描述。因此,通过整体参考说明书,紧接下面被定义的术语被更全面地描述。同样,如本文所使用,单数形式的“一(a)”、“一(an)”和“该(所述,the)”包括复数含义,除非上下文另外地明确指出。除非另外指出,分别地,核酸以5′到3′的方向从左到右书写;氨基酸序列以氨基到羧基的方向从左到右书写。可以理解,本发明并不限于所述的具体方法、方案和试剂,因为根据本领域技术人员使用它们的情况,它们可以进行变化。
在本说明书中给出的每一个最大数字限制拟包括每一个更小的数字限制,如同这些更小的数字限制在本文明确写出。在本说明书中给出的每一最小的数字限制将包括每一个更大的数字限制,如同这些更大数字限制在本文明确写出。在本说明书中给出的每一数字范围将包括落在该更宽数字范围的每个更窄的数字范围,如同这些更窄数字范围在本文明确写出。
所有引用的文献在相关的部分引入本文作为参考;任何文献的引入不能被理解为承认其是相对于本发明的现有技术。
如本文使用,术语″漂白″指处理材料(例如织物、衣物、纸浆等)或表面足够长的时间并且在适当的pH和温度条件下,以实现材料的增亮(即增白)和/或清洗。适合漂白的化学品的实例包括但不限于ClO2、H2O2、过酸、NO2等。
如本文使用的术语"消毒″指从表面除去污染物,以及抑制或杀死物品表面上的微生物。本发明不拟限于任何具体的表面、物品、或待除去的污染物(一种或几种)或微生物。
如本文使用的术语″多聚体(multimer)″指共价或非共价结合并在溶液中以复合物的形式存在的两种或多种蛋白质或肽。″二聚体″是包含两个蛋白质或肽的多聚体;“三聚体”包含三个蛋白质或肽,等。如本文使用的″八聚体″指8个蛋白质或肽的多聚体。
如本文使用的“个人护理产品(personal care product)”指用于清洗、漂白和/或消毒毛发、皮肤、头皮和牙齿的产品,其包括但不限于洗发水、润肤露(body lotion)、沐浴乳、局部保湿霜(moisturizer)、牙膏和/或局部洗涤剂。在一些特别优选的实施方式中,这些产品被用于人,而在其它实施方式中,这些产品可用于非人类动物(例如在兽医应用中)。
如本文使用的″清洗组合物(cleaning composition)″和"清洗制剂(cleaning formulation)″,除非另有说明,指可用于从待被清洗的物品除去不想要的化合物的组合物,所述待被清洗的物品例如织物、器皿、隐形眼镜、其它固体基底、毛发(洗发水)、皮肤(肥皂和面霜)、牙齿(漱口水、牙膏)等。该术语包括选择用于期望的具体类型的清洗组合物和具体形式的产品(例如液体、凝胶、颗粒或喷雾组合物)的任何材料/化合物,只要该组分与用于该组合物中的中性金属蛋白酶和其它酶(一种或多种)相容。通过考虑待被清洗的表面、物品或织物以及对于应用过程中清洗条件(cleaning conditions)考虑组合物的期望形式,可以容易进行清洗组合物材料的选择。
该术语进一步指适合对物体和/或表面清洗、漂白、消毒和/或灭菌的任何组合物。该术语拟包括但不限于洗涤剂组合物(例如液体和/或固体的衣物洗涤剂和细薄织物洗涤剂;硬表面的清洗制剂如用于玻璃、木头、陶瓷和金属台面板(counter tops)和窗;地毯清洗剂;炉子洗涤剂;织物增鲜剂;织物软化剂;以及纺织品和衣物预洗剂、以及器皿洗涤剂)。
实际上,如本文使用的术语″清洗组合物″包括,除非另有说明,颗粒或粉末形式的通用(all-purpose)或重垢(heavy-duty)洗涤剂,特别是清洗洗涤剂;液体、凝胶或糊状通用洗涤剂特别是所谓的重垢液(LDL)型;液体细薄织物洗涤剂;手用洗碟剂(hand dishwashing agents)或轻垢(light duty)洗碟剂,特别是那些高发泡型的洗碟剂;机用洗碟剂(machine dishwashing agents),包括用于家用和公共机构的各种片、颗粒、液体和漂洗助剂的类型;液体清洗剂和消毒剂,包括抗菌手洗类型、洁肤皂(cleaning bars)、漱口水、牙齿清洗剂、车或地毯洗洁剂、洁厕剂(bathroom cleaners);洗发水和护发素;沐浴乳和泡浴用品(foam baths)和金属清洗剂;以及洗涤助剂如漂白添加剂和“去污棒(stain-stick)”或预处理类型。
如本文使用的术语″洗涤剂组合物″和″洗涤剂制剂"被用于指混合物,该混合物拟被用在清洗污染物体的洗涤介质中。在一些优选的实施方式中,该术语被用于指洗涤织物和/或服装(例如″衣物洗涤剂″)。在可选的实施方式中,该术语指其它洗涤剂,例如那些用来清洗器皿、餐具等的洗涤剂(例如″洗碟剂")。本发明不拟限于任何具体的洗涤剂制剂或组合物。实际上,除了中性金属蛋白酶,该术语拟包括这样的洗涤剂,其含有表面活性剂、转移酶(一种或多种)、水解酶、氧化还原酶、助洗剂、漂白剂、漂白活性剂、上蓝剂和荧光染料、结块抑制剂、掩蔽剂、酶活化剂、抗氧化剂和加溶剂。
如本文使用的″申请人酶(Applicant Enzyme)"指本发明的中性金属蛋白酶。
如本文使用,洗涤剂中的″增强的性能″被定义为增加了漂白敏感污迹(例如草、茶、酒、血、脏等)的清洗,如在标准洗涤循环后通常评估所确定的。在具体的实施方式中,本发明的中性金属蛋白酶在除去有色污迹和污垢方面提供增强的性能。在进一步实施方式中,本发明的酶在除去污迹和/或使污迹脱色方面提供增强的性能。
如本文使用的术语″硬表面的清洗组合物″指清洗硬表面的洗涤剂组合物,所述硬表面如地板、墙壁、瓷砖、浴室和厨房固定设备等。以任何形式提供该组合物,所述形式包括但不限于固体、液体、乳液等。
如本文使用的"洗碟剂组合物″指清洗器皿的组合物的所有形式,包括但不限于颗粒和液体形式。
如本文使用的″织物清洗组合物″指清洗织物的洗涤剂组合物的所有形式,包括但不限于颗粒、液体和条状形式。
如本文使用的″纺织品″指机织物,以及适合转化为或用作纱线、机织物、编织物和非机织物的短纤维和细丝。该术语包括由天然以及合成(例如制造的)纤维制造的纱线。
如本文使用的″纺织品材料″是纤维、纱线中间产物、纱线、织物和由织物制造的产品(例如服装和其它制品)的总括。
如本文使用的″织物″包括任何纺织品材料。因此,该术语拟包括衣物以及织物、纱线、纤维、非-机织材料、天然材料、合成材料和任何其它纺织品材料。
如本文使用的术语″相容的″指清洗组合物材料不将中性金属蛋白酶的酶活性减少至这样的程度:在正常应用情况中,中性金属蛋白酶不如预期的有效。下文详细示例了具体的清洗组合物材料。
如本文使用的″有效量的酶″指在具体应用(例如个人护理产品、清洗组合物等)中要求的预期酶活性必需的酶的量。该有效量容易被本领域普通技术人员所确定,并且该有效量基于许多因素,例如使用的具体酶的变体、清洗应用、清洗组合物的具体成分和是需要液体还是干燥的(例如粒状或条状)组合物等。
如本文使用的″非织物清洗组合物″包括硬表面清洗组合物、洗碟组合物、个人护理清洗组合物(例如口腔清洗组合物、牙齿清洗组合物、个人清洗组合物等)和适合用于纸浆和造纸工业的组合物。
如本文使用的″口腔清洗组合物"指洁齿剂(dentifrics)、牙膏、洁牙胶(toothgels)、牙粉(toothpowders)、漱口水、口腔喷雾剂(mouth sprays)、口腔凝胶(mouth gels)、口香糖、锭剂、囊剂、片剂、生物凝胶、预防糊剂、牙齿处理溶液等。
如本文使用的术语″转移酶"指催化功能化合物转移到底物范围的酶。
如本文使用的″离去基团″指在被另一亲核基团取代后,从酰基供体分离的亲核基团。
如本文使用的术语″酶转化"指通过将底物或中间物与酶接触,将底物修饰为中间物或者将中间物修饰为终产物。在一些实施方式中,通过直接将底物或中间物暴露于适当的酶进行接触。在其它实施方式中,接触包括将底物或中间物暴露于表达和/或分泌该酶的生物体,和/或将预期的底物和/或中间物分别代谢为预期的中间物和/或终产物。
如本文使用的短语″洗涤剂稳定性″指洗涤剂组合物的稳定性。在一些实施方式中,在应用洗涤剂期间评价稳定性,而在其它实施方式中,该术语指在储存期间洗涤剂组合物的稳定性。
如本文使用的短语″对蛋白质水解的稳定性″指蛋白质(例如酶)耐受蛋白质水解作用的能力。该术语不拟限于使用任何具体蛋白酶去评估蛋白质的稳定性。
如本文使用的"氧化稳定性(oxidative stability)″指在氧化条件下,蛋白质行使功能的能力。具体地,该术语指在存在各种浓度H2O2和/或过酸的条件下,蛋白质行使功能的能力。通过本领域技术人员已知的标准方法和/或通过本文描述的方法测量各种氧化条件下的稳定性。与在不存在氧化化合物下存在的酶活性相比,通过至少大约5%或更多的酶活性半衰期的增加或减少(在大多数实施方式中,优选增加),证明氧化稳定性的基本改变。
如本文使用的″pH稳定性″指在具体pH下,蛋白质行使功能的能力。一般而言,大多数酶具有有限的行使功能的pH范围。除了在中等范围pH内(即在大约pH7)行使功能的酶之外,存在能在非常高或非常低pH的条件下发挥作用的酶。通过本领域技术人员已知的标准方法和/或本文描述的方法可以测量各种pH条件下的稳定性。与在酶的最适pH下的酶活性相比,通过至少大约5%或更多的酶活性半衰期的增加或减少(在大多数实施方式中,优选为增加),证明pH稳定性基本改变。然而,本发明不拟限于任何pH稳定性水平或pH范围。
如本文使用的″热稳定性″指在具体温度下,蛋白质行使功能的能力。一般而言,大多数酶具有有限的行使功能的温度范围。除了在中等范围温度内(即在大约室温)行使功能的酶之外,存在能在非常高或非常低温度下发挥作用的酶。通过本领域技术人员已知的标准方法和/或本文描述的方法可以测量热稳定性。与暴露于酶活性的最适宜温度相比,通过当暴露于不同的温度(即更高或更低)下时至少大约5%或更多的突变体催化活性的半衰期的增加或减少(在大多数实施方式中,优选增加),证明热稳定性基本改变。然而,本发明不拟限于任何温度稳定性水平或温度范围。
如本文使用的术语″化学稳定性"指蛋白质(例如酶)对不利地影响其活性的化学品的稳定性。在一些实施方式中,这类化学品包括但不限于过氧化氢、过酸、阴离子洗涤剂、阳离子洗涤剂、非离子洗涤剂、螯合剂等。然而,本发明不拟限于任何具体的化学稳定性水平或化学稳定性范围。
如本文使用的术语″中性金属蛋白酶活性提高″指与标准酶相比较,中性金属蛋白酶活性的相对提高。在一些实施方式中,该术语指产物形成的提高速率,而在其它实施方式中,该术语包括产生更少水解产物的组合物。在另外的实施方式中,该术语指具有改变了的底物特异性的中性金属蛋白酶组合物。
如本文使用的短语″底物特异性的改变″指酶的底物特异性的变化。在一些实施方式中,底物特异性的变化被定义为用酶与酶变体或其它酶组合物比较所观察到的K催化剂/Km比率之间的差异。酶底物特异性依赖于被检测的底物而变化。通过对不同底物表现的催化效力进行比较,测定酶的底物特异性。在评估突变体酶的功效中,这些测定具有特别的用途,因为通常期望产生对特定目的底物更大比率的变体酶。然而,本发明不拟限于任何具体的底物组成和任何具体的底物特异性。
如本文使用的″表面特性″被用于指静电电荷以及特性例如蛋白质的表面所表现的疏水性和/或亲水性。
如本文使用的短语"独立地选自....″指选自提及的Markush(马库什)组的部分或成分可以是相同的,可以是不同的,或者可以是成分的任何混合物,如下列实例表示的:
具有3个R基团的分子,其中每一个R基团独立地选自A、B和C。这里三个R基团可以是:AAA、BBB、CCC、AAB、AAC、BBA、BBC、CCA、CCB或ABC。
关于化学组分,如本文使用的术语″取代的″指用到该术语的有机组分或基团是:
(a)通过去除至少一种成分或基团产生不饱和;或
(b)化合物或者基团中的至少一个氢被含有一个或多个(i)碳、(ii)氧、(iii)硫、(iv)氮或(v)卤原子的部分所取代;
(c)(a)和(b)。
在紧接上面(b)中描述的可以取代氢的部分——其仅包括碳和氢原子——是烃部分,其包括但不限于烷基、链烯基、炔基、烷基二烯基(alkyldienyl)、环烷基、苯基、烷基苯基、萘基、蒽基、菲基、芴基、甾族基团和这些基团彼此以及与多价烃基如亚烯基、烷叉基(alkylidene)和次烷基(alkylidyne)的组合。在紧接上面(b)中描述的可以取代氢的含有氧原子的部分包括但不限于羟基、酰基或含有酮、醚、环氧、羧基和酯的基团。在紧接上面(b)中描述的可以取代氢的含有硫原子的部分包括但不限于含硫的酸和酸性酯基团、硫醚基团、巯基和硫酮基团。在紧接上面(b)中描述的可以取代氢的含有氮原子的部分包括但不限于氨基、硝基、偶氮基、铵基、酰胺基、叠氮基、异氰酸酯基团、氰基和腈基团。在紧接上面(b)中描述的可以取代氢的含有卤原子的部分包括氯、溴、氟、碘的基团和任何前面描述的部分——其中氢或侧链烷基被卤素基团所取代以形成稳定的取代部分。
应当理解,上述(b)(i)到(b)(v)部分的任一个可以以单价取代或在多价取代中失去氢的方式彼此取代,以形成可在有机化合物或基团中取代氢的另一单价部分。
如本文使用的术语″纯化的″和″分离的″指从样品除去污染物。例如,通过除去溶液或制备物中污染的蛋白质和其它化合物——其不是中性金属蛋白酶,可纯化中性金属蛋白酶。在一些实施方式中,在细菌或真菌宿主细胞中表达重组中性金属蛋白酶,并且通过除去其它的宿主细胞成分,纯化这些重组中性金属蛋白酶;从而,重组中性金属蛋白酶多肽的百分比在样品中增加。在特别优选的实施方式中,本发明的金属蛋白酶基本上被纯化到至少大约99%的蛋白质组分的水平,如通过本领域已知的SDS-PAGE或其它标准方法测定。在可选的优选实施方式中,本发明的金属蛋白酶占组合物蛋白酶成分的至少大约99%。在另一可选的实施方式中,金属蛋白酶存在的范围是总蛋白和/或蛋白酶的大约至少90-95%。
如本文使用的″目的蛋白(protein of interest)"指被分析、鉴别和/或修饰的蛋白质(例如酶或“目的酶”)。天然发生的以及重组蛋白质在本发明中可应用。
如本文使用的″蛋白质″指由氨基酸组成并被本领域普通技术人员识别为蛋白质的任何组分。术语“蛋白质”、“肽”和“多肽”在本文中可以互换使用。其中,肽是蛋白质的一部分,本领域普通技术人员理解该术语在上下文中的应用。
如本文使用,功能和/或结构上相似的蛋白质被考虑为“相关蛋白质”。在一些实施方式中,这些蛋白质衍生自不同的属和/或种,包括在有机体类型之间的差异(例如细菌蛋白质和真菌蛋白质)。在一些实施方式中,这些蛋白质衍生自不同的属和/或种,包括在有机体类型之间的差异(例如细菌酶和真菌酶)。在另外的实施方式中,相关蛋白从同一种提供。实际上,本发明不拟限于来自任何具体来源(一个或多个)的相关蛋白质。另外,术语″相关蛋白质″包括三级结构同系物和一级序列同系物(例如本发明的中性金属蛋白酶)。例如,本发明包括在图3-5中提供的这类同系物。另外的同系物被考虑,包括但不限于从蜡样芽胞杆菌(B.cereus)、蜡样芽胞杆菌E33L、热溶芽胞杆菌(B.caldolyticus)、短小芽胞杆菌(B.pumulis)、巨大芽胞杆菌(B.megaterium)、枯草芽胞杆菌(B subtilis amylosacchariticus)、短短芽胞杆菌(Brevibacillus brevis)、多粘类芽胞杆菌(Paenibacillus Polymyxa)(多粘芽胞杆菌(Bacillus polymyxa))、嗜热脂肪芽胞杆菌(B.stearothermophilus)、结核芽胞杆菌(B.thuringiensis)、枯草杆菌(B.subtilis)和金黄色葡萄球菌(S.aureus)得到的金属蛋白酶,以及aureolysin、细胞外弹性蛋白酶和中性蛋白酶B。在进一步实施方式中,该术语包括免疫交叉反应的蛋白质。
如本文使用的术语″衍生物″指来源于一种蛋白质的蛋白质,通过如下方式形成:在C末端和N末端(一个或多个末端)的任一端或两端上加入一个或多个氨基酸,在氨基酸序列中一个或多个不同位置上取代一个或多个氨基酸,和/或在蛋白质的两个末端中的任意一个末端或两个末端上、或者在氨基酸序列的一个或多个位点上删除一个或多个氨基酸,和/或在氨基酸序列的一个或多个位点上插入一个或多个氨基酸。蛋白质衍生物的制备优选地通过修饰编码天然蛋白质的DNA序列、将该DNA序列转化进入合适的宿主以及表达被修饰的DNA序列以形成衍生的蛋白质而实现。
相关(和衍生物)蛋白质包括“变体蛋白质(variant protein)”。在一些优选的实施方式中,变体蛋白质与亲本蛋白质以及变体蛋白质彼此之间在少量氨基酸残基上不同。不同的氨基酸残基的数量可以是一个或更多个,优选地为1、2、3、4、5、10、15、20、30、40、50或更多个氨基酸残基。在一些优选的实施方式中,变体之间不同的氨基酸的数量在1到10之间。在一些特别优选的实施方式中,相关蛋白质和特定的变体蛋白质含有至少35%、40%、45%、50%、55%、60%、65%、70%、75%、80%、85%、90%、95%、97%、98%或99%的氨基酸序列同一性。此外,如本文使用的相关蛋白质或变体蛋白质,指在显著区域(prominent regions)的数量上不同于另一个相关蛋白质或亲本蛋白质的蛋白质。例如,在一些实施方式中,变体蛋白质具有不同于亲本蛋白质的1、2、3、4、5或10个相应的显著区域。
适合产生本发明的酶的变体的几种方法是本领域已知的,所述方法包括但不限于点饱和突变(site-saturation mutagenesis)、扫描诱变、插入诱变(insertional mutagenesis)、随机诱变(random mutagenesis)、定点诱变(site-directed mutagenesis)、和定向进化,以及各种其它的重组方法。
野生型和突变蛋白质的特性描述通过任何适合的方法完成,并且优选地基于目的特性的评估。例如pH和/或温度、以及洗涤剂和/或氧化稳定性在本发明的一些实施方式中得到确定。事实上,预期在这些一个或多个特性(pH、温度、水解稳定性、洗涤剂稳定性和/或氧化稳定性)中具有不同程度稳定性的酶将得到应用。
如本文使用的″表达载体″指含有DNA序列的DNA构建物,所述DNA序列可操作地连接到能实现该DNA在合适的宿主中表达的合适的控制序列上。这样的控制序列包括实现转录的启动子、控制这样的转录的任选的操纵子序列、编码合适的mRNA核糖体结合位点的序列,和控制转录和翻译的终止的序列。载体可以是质粒、噬菌体颗粒、或简单地是潜在基因组插入物。一旦转化到合适的宿主中,载体就可以复制,并且独立于宿主基因组而发挥功能,或者在某些情况下可以整合到基因组本身中。在本说明书中,“质粒”、“表达质粒”和“载体”通常可被交换使用,因为质粒目前是最普遍使用的载体形式。然而,本发明拟包括起着等效功能的其它形式的这类表达载体,它们在本技术领域是已知的,或者正在成为已知的。
在一些优选的实施方式中,中性金属蛋白酶基因被连接到适当的表达质粒。随后,克隆的中性金属蛋白酶基因被用于转化或转染宿主细胞,以便表达中性金属蛋白酶基因。该质粒可在宿主中复制,在这方面,其包含对于质粒复制所必需的已知元件,或者可以设计质粒以整合入宿主染色体中。提供必需的元件用于有效的基因表达(例如可操作地连接到目的基因的启动子)。在一些实施方式中,被提供的这些必需元件是基因自身的同源启动子,如果它可以被识别的话(即,被宿主转录);转录终止子(对于真核宿主细胞,为多腺苷酸化区域),该转录终止子是外源的,或者由中性金属蛋白酶基因的内源终止子区域提供。在一些实施方式中,选择性基因如抗生素抗性基因也包括在内,所述抗生素抗性基因能维持在含有抗微生物物质的培养基中进行培养的质粒感染宿主细胞的连续培养。
尽管可以使用其它方法,但下述的盒式诱变方法可用来帮助本发明的中性金属蛋白酶变体的构建。首先,如本文所述,获得天然发生的编码中性金属蛋白酶的基因,并对其完全或部分地进行测序。然后,扫描该序列,扫描到这样一个点,在该点处期望在被编码的中性金属蛋白酶中产生一个或多个氨基酸的突变(缺失、插入或取代)。对该点侧翼的序列,评价限制酶切位点的存在,以便用寡核苷酸库代替该基因的一个短片段,当其被表达时将编码各种突变体。这样的限制酶切位点优选地是蛋白质基因内的独特位点,以便有助于基因片段的取代。然而,可以使用在中性金属蛋白酶基因中非过度丰富的任何便利的限制酶切位点,只要限制酶切消化所产生的基因片段可以以适当顺序被重装配。如果在距离所选择的点的一个便利距离内(10个到15个核苷酸)的位置上不存在限制酶切位点,这样的位点通过以这样的方式取代基因中的核苷酸来产生——在最后的构建物中阅读框和被编码的氨基酸均不被改变。为了改变其序列以符合期望序列而对基因进行的突变,是通过与通常已知的方法一致的M13引物延伸来实现的。定位合适的侧翼区域以及为了获得两个便利的限制酶切位点序列而评价所需改变的任务,是通过遗传密码的冗余性、基因的限制酶切图谱和大量不同的限制酶,常规地进行。需要注意的是,如果便利的侧翼限制酶切位点是可以利用的,上述方法仅仅需要在不含位点的侧翼区域的情况下使用。
一旦天然发生的DNA和/或合成的DNA被克隆,用关联限制酶消化位于将要被突变的位置侧翼的限制酶切位点,并将一系列末端互补的寡核苷酸序列盒连接进基因中。该方法可以简化诱变,这是由于所有寡核苷酸可以被合成,使它们具有相同的限制酶切位点,并且不需要合成的接头来产生限制酶切位点。
如本文使用的“对应于”是指蛋白质或肽中位于列出的位置处的残基,或者与蛋白质或肽中列出的残基类似的、同源的或等价的残基。
如本文使用的“对应的区域”通常是指沿着相关蛋白质或亲本蛋白质的类似位置。
术语“编码......的核酸分子”、“编码......的核酸序列”、“编码......的DNA序列”和“编码......的DNA”是指沿着脱氧核糖核酸链的脱氧核苷酸的次序或序列。这些脱氧核苷酸的次序决定了沿着多肽(蛋白质)链的氨基酸的次序。因而DNA序列编码氨基酸序列。
如本文使用的术语“类似序列(analogous sequence)”是指,提供与目的蛋白质(即,典型地是目的原始蛋白质)相类似的功能、三级结构和/或保守残基的蛋白质内的序列。例如,在含有α螺旋或β折叠结构的表位区域中,在类似序列中的取代氨基酸优选地保留了相同的特异结构。该术语也指核苷酸序列,以及氨基酸序列。在一些实施方式中,类似序列被开发,以便取代氨基酸产生显示出相似或提高功能的变体酶。在一些优选的实施方式中,目的蛋白质中氨基酸的三级结构和/或保守残基位于目的节段或片段处或附近。因此,目的节段或片段含有例如α螺旋或β折叠结构,取代氨基酸优选地维持该特异结构。
如本文使用的“同源蛋白质”是指,与目的蛋白质(例如来自另一来源的中性金属蛋白酶)具有相似作用和/或结构的蛋白质(例如中性金属蛋白酶)。同系物(homolog)(本文也称为“同系物(homologues)”)不拟必须是进化相关的。因此,该术语拟包括从不同物种获得的相同或相似的酶(一种或多种)(即在结构和功能方面)。在一些优选实施方式中,期望鉴定出具有与目的蛋白质类似的四级、三级和/或一级结构的同系物,这是由于用来自同系物的类似片段取代目的蛋白质中的节段和片段将降低变化的破坏性。
如本文使用的“同源基因”是指来自不同物种的至少一对基因,该基因彼此对应,并且彼此具有同一性或非常相似。该术语包括通过物种形成过程(即,新物种的进化)分离开的基因(例如直向同源基因),以及通过遗传复制业已分离的基因(例如旁向同源基因)。这些基因编码“同源蛋白质”。
如本文使用的“直向同源物”和“直向同源基因”是指存在于不同物种中的基因,这些基因是通过物种形成过程,从一个共同的祖先基因(即,一个同源基因)进化而来的。通常地,直向同源物在进化过程中保留了相同的功能。直向同源物的鉴定,在最新测序的基因组中基因功能的可靠预测中是有用的。
如本文使用的“旁向同源物”和“旁向同源基因”是指在基因组内通过复制而相关的基因。直向同源物通过进化过程保留了相同的功能,而旁向同源物进化出了新的功能,即使一些功能与原始功能通常是相关的。旁向同源基因的实例包括,但不限于,编码胰蛋白酶、胰凝乳蛋白酶、弹性蛋白酶和凝血酶的基因,这些酶都是丝氨酸蛋白酶,并且在相同的物种中一起发生。
如本文使用的“野生型”和“天然”蛋白质是那些在自然界发现的蛋白质。术语“野生型序列”和“野生型基因”本文可以交替使用,用来指在宿主细胞中自然或天然发生的序列。在一些实施方式中,野生型序列是指,作为蛋白质工程项目的起始点的目的序列。编码天然发生的蛋白质的基因,可以通过本领域的普通技术人员已知的一般方法来获得。这些方法通常包括合成具有目的蛋白质的推定序列编码区域的标记探针,制备来自表达该蛋白质的生物的基因组文库,以及通过与探针杂交来筛选文库中目的基因。然后,对阳性杂交克隆作图并测序。
如本文使用的术语“重组DNA分子”是指由通过分子生物学技术结合在一起的DNA片段构成的DNA分子。
术语“重组寡核苷酸”指使用分子生物学操作产生的寡核苷酸,所述分子生物学操作包括但不限于,通过多核苷酸序列的限制酶消化所产生的两个或更多个寡核苷酸序列的连接,寡核苷酸的合成(例如引物或寡核苷酸的合成)等。
序列之间的同源性程度可以使用本技术领域已知的任何合适的方法来确定(例如参见Smith和Waterman,Adv.Appl.Math.,2:482[1981];Needleman和Wunsch,J.Mol.Biol.,48:443[1970];Pearson和Lipman,Proc.Natl.Acad.Sci.USA 85:2444[1988];程序例如Wisconsin Genetics Software Package中的GAP、BESTFIT、FASTA和TFASTA(Genetics Computer Group,Madison,WI);和Devereux 等人,Nucl.Acid Res.,12:387-395[1984])。
例如,PILEUP是一个确定序列同源性水平的有用程序。PILEUP使用渐进、两两比对的方式,由一组相关的序列产生多序列比对。它也可以绘出用于产生该比对的显示了成簇关系(clustering relationship)的树。PILEUP使用了Feng和Doolittle渐进比对方法的简化方法(Feng和Doolittle,J.Mol.Evol.,35:351-360[1987])。该方法类似于由Higgins和Sharp描述的方法(Higgins和Sharp,CABIOS5:151-153[1989])。有用的PILEUP参数包括3.00的缺省空位权重,0.10的缺省空位长度权重和加权的末端空位。有用算法的另一个实例是BLAST算法,由Altschul等人描述(Altschul等人,J.Mol.Biol.,215:403-410,[1990];和Karlin等人,Proc.Natl.Acad.Sci.USA 90:5873-5787[1993])。一个特别有用的BLAST程序是WU-BLAST-2程序(参见Altschul等人,Meth.Enzymol.,266:460-480[1996])。参数“W”、“T”和“X”决定了比对的灵敏度和速度。作为缺省参数,BLAST程序使用字符长度(W)为11,BLOSUM62计分矩阵(参见Henikoff和Henikoff,Proc.Natl.Acad.Sci.USA 89:10915[1989])比对(B)为50,期望值(E)为10,M’5,N′-4,以及两个链的比较。
如本文使用的“核酸序列同一性百分比(%)”被定义为,候选序列中与序列的核苷酸残基相同的核苷酸残基的百分比。
如本文使用的术语“杂交”指通过碱基配对,核酸链与互补链发生结合的过程,正如本领域所已知的。
如本文使用的短语“杂交条件”指杂交反应进行的条件。这些条件通过杂交被测量时条件的“严紧性(strigency)”程度来分类。例如,严紧性程度可以例如基于核酸结合复合体或探针的解链温度(Tm)。例如,“最大严紧性”通常在大约Tm-5℃发生(比探针的Tm低5℃):“高度严紧性”发生在低于Tm大约5-10℃;“中度严紧性”发生在低于探针Tm大约10-20℃;和“低度严紧性”发生在低于Tm大约20-25℃。可以选择地,或另外地,杂交条件可以基于杂交的盐或离子强度条件和/或一次或多次的严紧性洗涤。例如,6xSSC=非常低的严紧性;3xSSC=低度到中度严紧性;1xSSC=中度严紧性;和0.5xSSC=高度严紧性。从功能上来说,最大严紧性条件可以用于鉴定与杂交探针具有严格的同一性或近似严格的同一性的核酸序列;而高度严紧性条件被用于鉴定与探针具有大约80%或更高的序列同一性的核酸序列。
对于要求高度选择性的应用,通常期望应用相对严紧的条件来形成杂交体(例如使用相对低的盐和/或高温条件)。
在至少两个核酸或多肽的情形中,短语“基本上相似的”和“基本上同一的”通常指,多核苷酸或多肽包含与参考(即野生型)序列相比具有至少大约40%同一性、更优选地至少大约50%同一性、又更优选地至少大约60%同一性、优选地至少大约75%同一性、更优选地至少大约80%同一性、又更优选地至少大约90%、仍然更优选地大约95%、最优选地大约97%同一性,有时高达大约98%和大约99%的序列同一性的序列。序列同一性使用已知的程序如BLAST、ALIGN和CLUSTAL来确定,这些程序使用标准参数。(参见例如Altschul等人,J.Mol.Biol.215:403-410[1990];Henikoff等人,Proc.Natl.Acad Sci.USA 89:10915[1989];Karin等人,Proc.Natl Acad.Sci USA 90:5873[1993];和Higgins等人,Gene 73:237-244[1988])。进行BLAST分析的软件可以通过National Center for Biotechnology Information公开获得。也可以使用FASTA来搜索数据库(Pearson等人,Proc.Natl.Acad.Sci.USA 85:2444-2448[1988])。两个多肽是基本上同一的一个指征是,第一个多肽与第二个多肽是免疫交叉反应的。典型地,由于保守的氨基酸取代而有所不同的多肽是免疫交叉反应的。因此,例如,在两个肽的不同之处仅仅在于保守的取代时,该多肽与该第二个多肽是基本上同一的。两个核酸序列基本上同一的另一个指征是,这两个分子在严紧条件(例如,中度到高度严紧)下彼此杂交。
如本文使用的“等价残基(equivalent residues)”指共有特定的氨基酸残基的蛋白质。例如,等价残基可以通过在蛋白质(例如中性金属蛋白酶)的三级结构水平上确定同源性来鉴定,所述蛋白质的三级结构已经通过X射线晶体学确定。等价残基被定义为如此的残基,即对于这些等价残基,具有推定的等价残基的蛋白质和感兴趣的蛋白质的特定氨基酸残基的两个或多个主链原子的原子坐标(N对N、CA对CA、C对C、和O对O),在对齐之后,是在0.13nm以内,优选地在0.1nm以内。在对最佳模型进行定向和定位以获得被分析蛋白质的非氢蛋白原子的原子坐标的最大重叠之后,实现对齐。优选的模型是结晶学模型,其以可获得的最高分辨率给出了实验衍射数据的最低R因子,如使用结晶学和蛋白质表征/分析技术领域的普通技术人员已知的方法所测定。
如本文使用的术语“杂合中性金属蛋白酶”和“融合中性金属蛋白酶”是指,从至少两个不同的蛋白质或“亲本”蛋白质进行遗传工程而得到的蛋白质。在优选的实施方式中,这些亲本蛋白质是彼此的同系物。例如,在一些实施方式中,优选的杂合中性金属蛋白酶或融合蛋白质含有蛋白质的N末端和该蛋白质的同系物的C末端。在一些优选实施方式中,这两个末端被组合在一起,以对应于全长的活性蛋白质。
如本文使用的术语“调控元件(regulatory element)”指控制核酸序列表达的一些方面的遗传元件。例如,启动子是有助于可操作连接的编码区域的转录起始的调控元件。其它调控元件包括剪接信号、多腺苷酸化信号和终止信号。选择细胞,可导致编码在存在药物的情况下生长所需要的基因产物的内源基因的扩增,或者编码该基因产物的外源(即,输入的)序列的扩增,或者两者的扩增。
“扩增”是涉及模板特异性的核酸复制的特殊情况。这与非特异性的模板复制(即依赖于模板,但不依赖于特异性模板的复制)形成对照。模板的特异性在这里与复制的保真度(即,正确多核苷酸的合成)和核苷酸(核糖-或脱氧核糖-)特异性有所区别。模板的特异性通常是就“靶”特异性而描述的。就它们被寻求以从其它核酸中分选出来而言,靶序列是“靶”。主要针对这种分选,已设计出扩增技术。
如本文使用的术语“共扩增”是指,可扩增的标记物与其它基因序列(即,包括一个或多个非选择性的基因,如那些包含在表达载体中的基因)一起引入到单一细胞中,并应用适当的选择压力,这样,该细胞既扩增可扩增的标记物,也扩增其它的非选择性的基因序列。可扩增的标记物可以物理地连接到其它的基因序列上;或者可选择地,两个分离的DNA元件可以被引入到相同的细胞中,其中一个DNA元件含有可扩增的标记物,另一个DNA元件含有非选择性的标记物。
如本文使用的术语“可扩增的标记物”、“可扩增的基因”和“扩增载体”是指标记物、基因、或编码基因的载体,该载体允许该基因在适当的生长条件下进行扩增。
如本文使用的术语“可扩增的核酸”是指可以通过任何扩增方法进行扩增的核酸。应该预期到,“可扩增的核酸”通常包括“样品模板”。
如本文使用的术语“样品模板”指来源于被用来分析“靶”(在下面被定义)的存在的样品的核酸。相反,“背景模板”被用来指代除了样品模板以外的核酸,其可能存在于或可能不存在于样品中。背景模板是最通常容易被疏忽的。它可能是物质遗留(carryover)的结果,或者可能是由于存在需要从样品中纯化去掉的核酸污染物。例如,来自生物的但不是那些将被检测的核酸,可能在测试样品中作为背景而存在。
“模板特异性”在大多数扩增技术中是通过酶的选择来实现的。扩增酶是在它们被使用的条件下,在核酸的异源混合物中仅仅处理核酸的特异性序列的酶。例如,在Qβ复制酶的情况下,MDV-1 RNA是该复制酶的特异性模板(例如参见Kacian等人,Proc.Natl.Acad.Sci.USA 69:3038[1972])。其它核酸不被该扩增酶复制。类似地,在T7 RNA聚合酶的情况下,该扩增酶对其本身的启动子具有严格的特异性(参见Chamberlin等人,Nature 228:227[1970])。在T4 DNA连接酶的情况下,当寡核苷酸或多核苷酸底物与模板之间在连接处存在错配时,该酶不会将
如本文使用的“宿主细胞”通常是原核宿主或真核宿主,采用本领域已知的重组DNA技术构建的载体转化或转染宿主细胞。转化的宿主细胞能够复制编码蛋白突变体的载体或表达期望的蛋白突变体。在编码蛋白突变体的前形式或前原形式的载体的情况中,此类突变体当被表达时通常从宿主细胞分泌到宿主细胞培养基中。
在将核酸序列插入到细胞中的情形中,术语“被导入”是指转化、转导或转染。转化的手段包括原生质体转化、氯化钙沉淀、电穿孔、裸DNA以及本技术领域已知的类似手段。(参见Chang和Cohen Mol.Gen.Genet.168:111-115[1979];Smith等人,Appl.and Env.Microbiol.51:634[1986];和Ferrari等人的综述文章,在Harwood,Bacillus,Plenum Publishing Corporation pp.57-72[1989])。
术语“启动子/增强子”表示含有能提供启动子和增强子功能的序列的DNA片段(例如,反转录病毒的长末端重复单元既含有启动子,也含有增强子功能)。增强子/启动子可以是“内源的”或“外源的”或“异源的”。内源增强子/启动子是与基因组中给定的基因天然连接的增强子/启动子。外源(异源)增强子/启动子是通过遗传操作方法(即分子生物学技术)与基因并列放置的增强子/启动子。
表达载体上“剪接信号(splicing signal)”的存在,通常导致重组转录物更高水平的表达。剪接信号介导从初始RNA转录物中去除内含子,它由剪接供体位点和受体位点组成(Sambrook等人,Molecular Cloning:A Laboratory Manual,第二版,Cold Spring Harbor Laboratory Press,New York[1989],16.7-16.8页)。通常使用的剪接供体位点和受体位点是来自SV40的16S RNA的剪接点。
术语“稳定的转染”或“被稳定地转染”是指,将外来DNA引入和整合到被转染细胞的基因组中。术语“稳定的转染子”指已经将外来(foreign)或外源性(exogenous)DNA稳定地整合到被转染细胞的基因组DNA中的细胞。
如本文使用的术语“选择性的标记物”或“选择性的基因产物”指编码酶活性的基因的应用,一旦细胞中的选择性标记物被表达,该酶活性赋予对抗生素或药物的抗性。
如本文使用的术语“扩增”和“基因扩增”是指特定的DNA序列被不成比例地复制的过程,这样,被扩增的基因以比在基因组中初始存在的拷贝数量高的拷贝数量存在。在一些实施方式中,通过在存在药物(例如可抑制酶的抑制剂)的情况下的生长来选择细胞,导致编码在存在药物的情况下生长所需要的基因产物的内源基因的扩增,或者编码该基因产物的外源(即,输入的)序列的扩增,或者两者的扩增。通过在存在药物(例如可抑制酶的抑制剂)的情况下的生长来这两个寡核苷酸或多核苷酸连接(参见Wu和Wallace,Genomics 4:560[1989])。最后,Taq和Pfu聚合物,由于它们在高温下发挥作用的能力,被发现对于由引物结合而因此被限定的序列显示出高度特异性;高温导致有助于引物与靶序列杂交、而不与非靶序列杂交的热力学条件。
如本文使用的术语“引物”是指寡核苷酸,不管是在纯化的限制消化物中自然存在,还是合成产生,当置于与核酸链互补的引物延伸产物的合成被诱导的条件下(即,在存在核苷酸和诱导剂如DNA聚合酶的情况下,以及在合适的温度和pH下)时,它能作为合成的起始点发挥作用。为了在扩增上具有最大效率,引物优选地是单链的,但可选择地,可以是双链的。如果是双链的,首先对该引物进行处理,以便在被用于制备延伸产物之前分离其链。优选地,引物是寡脱氧核糖核苷酸。引物必须足够长,以便在存在诱导剂的情况下启动延伸产物的合成。引物的精确长度将依赖于许多因素,包括温度、引物的来源和方法的使用。
如本文使用的术语“探针”指寡核苷酸(即,核苷酸序列),不管是在纯化的限制消化物中天然存在,还是合成产生、重组产生或通过PCR扩增产生,所述寡核苷酸能与别的目的寡核苷酸杂交。探针可以是单链或双链的。探针在特定基因序列的检测、鉴定和分离中是有用的。应该考虑到,本发明中使用的任何探针都可以用任何“报告分子”标记,以便在任一检测系统中可检测到,包括但不限于酶(例如ELISA,以及基于酶的组织化学测定法)、荧光、放射性和发光的系统。本发明不拟限于任何具体的检测系统或标记物。
如本文使用的术语“靶”,当关于扩增方法(例如聚合酶链式反应)使用时,是指用于聚合酶链式反应的引物所结合的核酸区域。因此,“靶”寻求从其它核酸序列中分选出来。“片段”被定义为靶序列内的核酸区域。
如本文使用的术语“聚合酶链式反应”(“PCR”)指美国专利4,683,195、4,683,202和4,965,188的方法,此处引入作为参考,这些专利包括,不通过克隆或纯化,增加靶序列的片段在基因组DNA混合物中的浓度的方法。用于扩增靶序列的该过程,包括将大大过量的两种寡核苷酸引物引入到含有期望的靶序列的DNA混合物中,随后,在存在DNA聚合酶的情况下,进行精确顺序的热循环。这两个引物与双链靶序列中它们各自的链是互补的。为了实现扩增,对混合物进行变性,然后引物被退火到它们在靶分子内的互补序列。在退火之后,用聚合酶延伸引物,以便形成一对新的互补链。变性、引物退火和聚合酶延伸的步骤可以多次重复(即变性、退火和延伸构成一个“循环”;可以有多个“循环”),以获得高浓度的期望靶序列的扩增片段。期望的靶序列的扩增片段的长度由引物相对于彼此的相对位置决定,因此,该长度是一个可控制的参数。由于该过程的重复特征,该方法被称作“聚合酶链式反应”(下文为“PCR”)。由于靶序列的期望的扩增片段成为混合物中的优势序列(就浓度而言),所以它们被称作是“PCR扩增的”。
如本文使用的术语“扩增试剂”是扩增需要的那些试剂(脱氧核糖核苷三磷酸、缓冲液等),引物、核酸模板和扩增酶除外。典型地,扩增试剂以及其它反应组分被放置和装在反应容器(试管、微孔等)中。
借助PCR,在基因组DNA中将单个拷贝的特定靶序列扩增到可检测的水平是可能的,所述检测通过数个不同的方法进行(例如与标记探针的杂交;生物素化引物的整合,随后进行抗生物素蛋白-酶偶联物检测;将32P标记的脱氧核苷三磷酸如dCTP或dATP整合到扩增的片段中)。除了基因组DNA,任何的寡核苷酸或多核苷酸序列也可以用适当的引物分子组扩增。特别地,由PCR方法本身产生的扩增片段,它们本身可以是随后的PCR扩增的有效模板。
如本文使用的术语“PCR产物”、“PCR片段”和“扩增产物”指变性、退火和延伸的PCR步骤的两个或更多个循环完成后得到的化合物混合物。这些术语包括这样的情况,其中已经存在一个或多个靶序列的一个或多个片段的扩增。
如本文使用的术语“限制性内切酶”和“限制酶”指细菌酶,每一种这样的酶在特异性核苷酸序列处或在其附近切割双链DNA。
本发明详述
本发明提供含有至少一种中性金属蛋白酶的方法和组合物,所述中性金属蛋白酶具有改善的储存稳定性。在一些实施方式中,中性金属蛋白酶在清洗和其它应用中具有用途。在一些特别优选的实施方式中,本发明提供含有从芽胞杆菌属某种得到的中性金属蛋白酶(一种或多种)的方法和组合物。在一些更特别优选的实施方式中,中性金属蛋白酶从解淀粉芽胞杆菌中得到。在又进一步优选的实施方式中,中性金属蛋白酶是解淀粉芽胞杆菌中性金属蛋白酶的变体。又在其它实施方式中,中性金属蛋白酶是解淀粉芽胞杆菌中性金属蛋白酶的同系物。本发明在包括但不限于清洗、漂白和消毒的应用中具有具体用途。
此外,如在下面的实施例中更详细的描述,本发明提供清洗许多对象的许多益处,所述对象包括但不限于衣服、织物、医疗器械等。另外,本发明提供在宽范围洗涤温度和pH内有效清洗、漂白和消毒的组合物。
一般而言,蛋白酶通过将水分子加入到肽键(一个或多个)水解酰胺键。在肽键的羰基基团发生切割。在细菌种类中,例如芽胞杆菌,有两种主要类型的细胞外蛋白酶,即碱性或丝氨酸蛋白酶和中性金属蛋白酶。
中性金属内切肽酶(即中性金属蛋白酶)(EC 3.4.24.4)属于绝对需要锌离子的催化活性的蛋白酶类。这些酶在中性pH和在30到40kDa大小的范围内,具有最佳活性。中性金属蛋白酶结合2到4个钙离子,其有助于蛋白结构的稳定性。在金属蛋白酶活性位点的结合金属离子是允许水分子活化的必要特征。然后,水分子作为亲核试剂行使功能,并且切割肽键的羰基基团。
该中性结合锌的金属蛋白酶家族包括细菌酶嗜热菌蛋白酶和类嗜热菌蛋白酶(″TLPs″),以及羧肽酶A(一种消化酶),和在组织重塑和降解中催化反应的基质金属蛋白酶。关于稳定性和功能,这些蛋白酶唯一良好表征的是嗜热菌蛋白酶和其变体(TLPs)。事实上,大多数研究集中在人工改造枯(基因工程)草芽胞杆菌中性蛋白酶以提高该酶的热稳定性(参见例如Vriend等,在Tweel等(eds)的Stability and Stabilization of enzymes,Elsevier中,pp.93-99[1993])。
大多数尝试集中于通过改变由提出的分子模型的应用确定的结构决定子,增加蛋白酶的稳定性,以防止局部解折叠过程,该解折叠过程将导致蛋白质自溶,并引起中性蛋白酶在高温下变性(参见例如van den Burg等,在Hopsu-Havu等(eds)的Proteolysis in Cell Functions Manipulating the Autolytic Pathway of a BacillusProtease中.Biomedical and Health Research Vol.13,IOS Press[1997]p.576)。
本文提供人工改造中性金属蛋白酶具有提高的特性的组合物和方法。如本文指出,对于其它蛋白酶如嗜热菌蛋白酶,已报到钙离子防止自溶。通过加入钙,已稳定化嗜热脂肪芽胞杆菌中性蛋白酶以对抗自溶和蛋白水解降解(参见Durrschmidt等FEBS J.,272:1523-1534[2005])。
事实上,本发明提供适于人工改造中性金属蛋白酶的组合物和方法,其不依赖于钙以便保持其结构稳定性。在一些实施方式中,人工改造在特定二级结构元件中防止了局部解折叠,其可防止蛋白质水解。
天然和人工改造蛋白酶如枯草菌溶素通常在枯草芽胞杆菌中表达并且一些已被应用于洗涤剂配方以除去蛋白污迹。其它的已被应用于例如烘烤工业(例如源自嗜热溶蛋白芽胞杆菌的嗜热菌蛋白酶;参见例如Galante和Formantici,Curr.Organic Chem.,7,1399-1422[2003])。一般而言,丝氨酸蛋白酶已被更广的用于洗涤剂,这至少部分由于这些蛋白酶可相对容易地被稳定。
事实上,由于许多原因,金属蛋白酶在工业中较少使用,特别是在洗涤剂工业。因为该酶具有对分别用于稳定和功能的钙和锌离子的绝对需要,所以这些酶涉及更复杂的蛋白质系统。此外,在洗衣过程中使用的洗涤剂溶液以及水通常含有经常干扰所述离子通过酶结合或螯合这些离子的成分,这导致水解功能的减少或损失和蛋白酶不稳定性。
与目前使用的金属蛋白酶系统相比,本发明提供中性金属蛋白酶,其充分被稳定以有助于液体洗衣洗涤剂组合物的长期上架储存。在特别优选的实施方式中,通过用其必需的活性位锌分子络合该酶,保存金属蛋白酶稳定性和活性。重要地,钙和锌离子的组合对于酶的功能没有不良影响。在一些实施方式中,稳定的中性金属蛋白酶是源自解淀粉芽胞杆菌(例如纯化的Neutral;″PMN″)的野生型金属蛋白酶。在可选的优选实施方式中,重组中性金属蛋白酶(例如克隆到枯草芽胞杆菌(″nprE″)的解淀粉芽胞杆菌中性金属蛋白酶)。在另外的实施方式中,具有提高稳定性的金属蛋白酶包括对酶的一个或多个钙结合位点具有增加的亲和力的酶。在优选的实施方式中,本发明的中性金属蛋白酶在普通洗涤剂应用中得到使用,所述普通洗涤剂应用包括但不限于冷水温度、草污迹和/或低pH条件。
本发明提供稳定化结合锌的中性金属蛋白酶,以在洗涤剂基本成分和/或组合物中增加储存稳定性的条件。在优选的实施方式中,洗涤剂组合物包括至少一种金属蛋白酶(例如任何芽胞杆菌中性金属蛋白酶),通过洗涤剂配方内包括必需的锌和/或钙离子,该金属蛋白酶被稳定以对抗自溶和解折叠。在一些特别优选的实施方式中,源自解淀粉芽胞杆菌(PMN)的中性金属蛋白酶和在枯草芽胞杆菌(nprE)中表达的重组体——其对锌离子结合的亲和力比对钙离子的亲和力大10倍——在本发明中得到应用。当与不存在离子、相同蛋白酶的情况下相对比时,在存在必需的锌离子的情况下,稳定的蛋白酶具有对抗蛋白质水解的提高的稳定性。
尽管一些实验结果表明在加入洗涤剂基本成分一小时后,nprE损失了一些蛋白水解活性(~20%),但是在32℃下,在存在锌离子的情况下温育的nprE显示出在没有加入盐或钙离子的实验条件下明显的稳定性。钙和锌离子都存在没有显示出叠加的效果。在锌离子浓度在15mM以下时,中性金属蛋白酶足够稳定大约4周。因此,本发明提供含有加入锌的组合物,以在存在洗涤剂成分的情况下,增加中性金属蛋白酶的储存时间。
此外,在可选的实施方式中,用Co2+、Mn2+或Fe2+取代锌阳离子,因为所有这些离子已表现出结合并恢复中性金属蛋白酶的蛋白酶活性。然而,已确定Mn2+和Fe2+没有恢复所有的天然活性。尽管Co2+恢复了最高百分比的活性,但是其明显不如Zn2+结合稳定。在所有中性金属蛋白酶的活性位中,锌阳离子是必要特征,因为已知其在底物结合和酶催化中起作用(参见例如Holmquist和Vallee,J.Biol.Chem.,249:4601-4607[1974])。对于锌阳离子(~μM范围),中性金属蛋白酶相对紧的亲和力,和对该离子的亲和力比对钙的亲和力大约高10倍,表明锌行使稳定剂的功能,从而防止自溶、蛋白质水解和解折叠。然而,本发明不拟限于任何具体的机制。
对于在工业洗涤剂的生产和开发中的应用,本发明提供极有利的机会。由于具有除去蛋白质、淀粉和油迹的高度特异性,许多洗涤剂是可行的。具体而言,Equest Grass(Warwick)上的PMN或源自解淀粉芽胞杆菌的中性金属蛋白酶的更好的洗涤性能表明,同样含有锌的洗涤剂基本成分中本发明的中性金属蛋白酶在改善的洗涤剂组合物中具有用途。
本发明的清洗和洗涤剂制剂的详细描述
除非另有注释,本文提供的所有成分或组合物水平(含量)根据成分或组合物的活性水平产生,并且排除杂质,例如残留溶剂或副产品——其可能在商业可获得的来源中存在。
酶成分的重量基于全部活性蛋白。
除非另有说明,按重量计算所有的百分比和比例。除非另有说明,基于总组合物计算所有的百分比和比例。
在示例性的洗涤剂组合物中,按照纯酶占总组合物的重量表达酶水平,并且除非另有说明,按照总组合物的重量表达洗涤剂成分。
包括中性金属蛋白酶的清洗组合物
本发明的稳定的中性金属蛋白酶在配制多种洗涤剂组合物中是有用的。本发明的清洗组合物可被有利地用于例如洗衣应用、硬表面清洗、自动洗碟应用以及化妆品应用如假牙、牙齿、头发和皮肤。然而,由于其在较低温度溶液中提高的有效性和较高颜色安全属性(color-safety profile)方面的独特优势,本发明的酶理想地适用于洗衣应用例如织物漂洗。而且,本发明的酶在颗粒和液体组合物中具有用途。
本发明的酶也在清洗用添加剂产品中得到应用。当需要额外的漂白效果时,包括本发明至少一种酶的清洗用添加剂产品理想地适用于包括洗涤过程中。这类情况包括但不限于低温溶液清洗应用。在其最简单的形式中,添加剂产品可以是本发明提供的一种或多种中性金属蛋白酶。在一些实施方式中,添加剂被包装为加入到清洗过程中的剂型,在该清洗过程中使用过氧(peroxygen)并且需要增加漂白效力。在一些实施方式中,单一剂型包括丸剂、片剂、胶囊(gelcap)或其它单一剂量单位,其包括预测定的(pre-measured)粉末和/或液体。在一些实施方式中,包括填料和/或载体物质(一种或多种),以便增加这类组合物的体积。适合的填料或载体物质包括但不限于各种硫酸盐、碳酸盐和硅酸盐以及滑石、粘土等。在一些实施方式中,液体组合物的填料和/或载体物质包括水和/或小分子量伯醇和仲醇,其包括多元醇和二醇。这类醇的实例包括但不限于甲醇、乙醇、丙醇和异丙醇。在一些实施方式中,组合物包含大约5%到大约90%的该类物质。在另外的实施方式中,使用酸性填料来降低组合物的pH。在一些可选的实施方式中,清洗添加剂包括至少一种活化的如下面描述的过氧源和/或下面更充分描述的辅助成分。
本发明的清洗组合物和清洗添加剂需要如本发明提供的有效量的中性金属蛋白酶。在一些实施方式中,通过加入一种或多种本发明提供的中性金属蛋白酶达到需要的酶的水平。典型地,本发明的清洗组合物包括至少0.0001重量百分比、从大约0.0001到大约1、从大约0.001到大约0.5、或者甚至从大约0.01到大约0.1重量百分比的本发明提供的至少一种中性金属蛋白酶。
在一些优选的实施方式中,本文提供的清洗组合物一般配制成如此:在含水清洗操作中使用期间,洗涤水具有从大约5.0到大约11.5的pH,或者在可选的实施方式中,甚至从大约6.0到大约10.5。在一些优选的实施方式中,液体产品制剂通常被配制成具有从大约3.0到大约9.0的净pH,而在一些可选的实施方式中,制剂具有从大约3.0到大约5的净pH。在一些优选的实施方式中,粒状洗衣产品通常被配制成具有从大约8到大约11的pH。控制pH在推荐使用的水平的技术包括应用缓冲液、碱、酸等,其是本领域普通技术人员所熟知的。
在一些特别优选的实施方式中,当在颗粒组合物或液体中使用至少一种中性金属蛋白酶时,中性金属蛋白酶是封装颗粒(encapsulated particle)形式,以保护酶在储存期间免于颗粒组合物其它成分的破坏。另外,封装也提供了在清洗过程中控制中性金属蛋白酶(一种或多种)有效性的方法,并且可以增强中性金属蛋白酶(一种或多种)的性能。预期本发明的封装的中性金属蛋白酶将在多种情形(settings)中得到应用。中性金属蛋白酶也拟使用本领域已知的任何适合的封装材料(一种或多种)和方法(一种或多种)进行封装。
在一些优选的实施方式中,封装材料一般封装至少部分中性金属蛋白酶催化剂。在一些实施方式中,封装材料是水溶的和/或水分散的。在一些另外的实施方式中,封装材料具有0℃或更高的玻璃化转变温度(Tg)(参见,例如WO 97/11151,特别是从第6页第25行到第7页第2行,关于玻璃化转变温度的更多信息)。
在一些实施方式中,封装材料选自糖类、天然或合成橡胶、壳多糖和壳聚糖、纤维素和纤维素衍生物、硅酸酯(盐)、磷酸酯(盐)、硼酸酯(盐)、聚乙烯醇、聚乙二醇、石蜡和它们的组合。在其中封装材料是糖类的一些实施方式中,其选自单糖、寡糖、多糖和它们的组合。在一些优选的实施方式中,封装材料是淀粉(参见,例如EP 0 922 499;US 4,977,252、US 5,354,559和US 5,935,826,对于一些示例性适当淀粉的描述)。
在另外的实施方式中,封装材料包括由塑料制成的微球体(例如热塑性塑料、丙烯腈、甲基丙烯腈、聚丙烯腈、聚甲基丙烯腈和它们的混合物;得到应用的商业可获得的微球体包括但不限于[Casco Products,Stockholm,Sweden],PM 6545,PM 6550,PM 7220,PM 7228,和[PQ Corp.,Valley Forge,PA],和[Potters Industries,Inc.,Carlstadt,NJ and Valley Forge,PA])。
制造和使用本申请人的清洗组合物的方法
在一些优选的实施方式中,本发明的清洗组合物被配制成任何合适的形式,并且通过配制者选择的任何方法制备(参见,例如U.S.5,879,584,U.S.5,691,297,U.S.5,574,005,U.S.5,569,645,U.S.5,565,422,U.S.5,516,448,U.S.5,489,392和U.S.5,486,303,对于一些非限定性的实例)。在其中期望低pH清洗组合物的一些实施方式中,通过加入酸性物质如HCl,调节这类组合物的pH。
辅助物质
尽管对于本发明的目的不是必需的,在一些实施方式中,本文描述的辅助物的非限制性清单适合用于本发明的清洗组合物。事实上,在一些实施方式中,辅助物被掺入本发明的清洗组合物。在一些实施方式中,辅助物质帮助和/或增强清洗性能,处理待清洗的基底,和/或修饰清洗组合物的美观性(例如,香料、着色剂、染料等)。应该理解,此类辅助物是除本发明的中性金属蛋白酶之外的。这些额外的组分的精确特性和其掺入的水平取决于组合物的物理形式和它待被使用的清洗操作性质。合适的辅助物质包括但不限于表面活性剂、助洗剂、螯合剂、染料转移抑制剂(dye transfer inhibiting agents)、沉淀助剂、分散剂、额外的酶、和酶稳定剂、催化物质、漂白活化剂、漂白促进剂、过氧化氢、过氧化氢源、预制过酸、聚合物分散剂、粘土清除剂/抗再沉淀剂、增亮剂、抑泡剂、染料、香料、结构增弹剂(structure elasticizing agents)、织物柔软剂、载体、水溶助长剂、加工助剂和/或色素。除了本文明确提供的,其它的实例是本领域已知的(参见美国专利第5,576,282、6,306,812B1和6,326,348B1号)。在一些实施方式中,上述辅助成分构成本发明的清洗组合物的余量。
表面活性剂——在一些实施方式中,本发明的清洗组合物可以包括至少一种表面活性剂或表面活性剂系统,其中表面活性剂选自非离子表面活性剂、阴离子表面活性剂、阳离子表面活性剂、两性表面活性剂、两性离子表面活性剂、半极性非离子表面活性剂和它们的混合物。在一些低pH清洗组合物实施方式(诸如具有从大约3至大约5的净pH的组合物)中,组合物通常不含烷基乙氧基化物硫酸盐,因为认为此类表面活性剂可以被此类组合物的酸性内含物水解。
以清洗组合物重量计,在一些实施方式中,表面活性剂通常以从大约0.1%到大约60%的水平存在,而在可选的实施方式中,该水平为从大约1%到大约50%,而在进一步的实施方式中,该水平从大约5%到大约40%。
助洗剂——在一些实施方式中,本发明的清洗组合物可以包括一种或多种洗涤剂助洗剂或助洗剂系统。在掺入至少一种助洗剂的一些实施方式中,以清洗组合物的重量计,清洗组合物包括至少大约1%、从大约3%到大约60%、或甚至从大约5%到大约40%的助洗剂。
助洗剂包括但不限于多磷酸的碱金属盐、铵盐和烷醇铵盐,碱金属硅酸盐、碱土金属和碱金属碳酸盐、硅铝酸盐助洗剂聚羧酸化合物、羟基聚羧酸醚酯(etherhydroxypolycarboxylates)、马来酸酐和乙烯或乙烯基甲基醚的共聚物、1,3,5-三羟基苯-2,4,6-三磺酸和羧甲氧基琥珀酸(carboxymethyloxysuccinic acid),聚乙酸的各种碱金属盐、铵盐和取代铵盐,诸如乙二胺四乙酸和氨三乙酸,以及聚羧酸,诸如苯六甲酸、琥珀酸、柠檬酸、羟二琥珀酸(oxydisuccinic acid)、聚马来酸、苯1,3,5-三甲酸、羧甲氧基琥珀酸和它们的可溶性盐。事实上,预期任何适合的助洗剂将在本发明的多种实施方式中得到应用。
螯合剂——在一些实施方式中,本发明的清洗组合物含有至少一种螯合剂。合适的螯合剂包括但不限于铜、铁和/或锰螯合剂和它们的混合物。在至少一种螯合剂被使用的实施方式中,以目标清洗组合物的重量计,本发明的清洗组合物含有从大约0.1%到大约15%或甚至从大约3.0%到大约10%的螯合剂。
沉淀助剂——在一些实施方式中,本发明的清洗组合物含有至少一种沉淀助剂。合适的沉淀助剂包括但不限于聚乙二醇、聚丙二醇、聚羧酸酯、去污聚合物(soil release polymers)诸如聚对苯二甲酸,粘土诸如高岭土、蒙脱石、绿坡缕石、伊利石、膨润土、多水高岭土以及它们的混合物。
染料转移抑制剂——在一些实施方式中,本发明的清洗组合物包括一种或多种染料转移抑制剂。合适的聚合物染料转移抑制剂包括但不限于:聚乙烯吡咯烷酮聚合物、聚胺N-氧化物聚合物(polyamine N-oxide polymer)、N-乙烯吡咯烷酮和N-乙烯咪唑的共聚物、聚乙烯唑烷酮(polyvinyloxazolidone)和聚乙烯咪唑或它们的混合物。
在至少一种染料转移抑制剂被使用的实施方式中,以清洗组合物的重量计,本发明的清洗组合物包括从大约0.0001%到大约10%、从大约0.01%到大约5%或甚至从大约0.1%到大约3%的染料转移抑制剂。
分散剂——在一些实施方式中,本发明的清洗组合物含有至少一种分散剂。合适的水溶性有机物质包括但不限于;均聚物酸或共聚物酸或它们的盐,其中,聚羧酸包括至少两个羧基,相互之间被不超过两个的碳原子分开。
酶——在一些实施方式中,本发明的清洗组合物包括一种或多种洗涤剂酶,它们提供清洗性能和/或织物护理益处。合适的酶的例子包括但不限于半纤维素酶、过氧化物酶、蛋白酶、纤维素酶、木聚糖酶、脂酶、磷脂酶、酯酶、角质酶、果胶酶、角蛋白酶、还原酶、氧化酶、酚氧化酶、脂加氧酶、木质素酶、支链淀粉酶、鞣酸酶、戊聚糖酶、木聚糖酶、β-葡聚糖酶、阿拉伯糖苷酶、透明质酸酶、软骨素酶、漆酶和淀粉酶或它们的混合物。在一些实施方式中,使用酶组合(即“混合物”),使用的酶组合包括常规适用的酶如蛋白酶、脂酶、角质酶和/或纤维素酶以及淀粉酶。
酶稳定剂——在本发明的一些实施方式中,用于本发明洗涤剂制剂的酶被稳定化。预期多种酶稳定化技术将在本发明得到应用。例如,在一些实施方式中,本文中利用的酶可以通过锌(II)、钙(II)和/或镁(II)离子的水溶性来源——所述锌(II)、钙(II)和/或镁(II)离子的水溶性来源为酶提供此类离子——以及其它金属离子(例如钡(II)、钪(II)、铁(II)、锰(II)、铝(III)、锡(II)、钴(II)、铜(II)、镍(II)和氧络钒(oxovanadiurn)(IV))在成品组合物中的存在来稳定化。
催化性金属络合物——在一些实施方式中,本发明的清洗组合物包括一种或多种催化性金属络合物。在一些实施方式中,含金属的漂白催化剂得到应用。在一些优选的实施方式中,金属漂白催化剂包括这样的催化系统,该系统包括具有确定的漂白催化活性的过渡金属阳离子(例如铜、铁、钛、钌、钨、钼或锰阳离子)、具有较低或没有漂白催化活性的辅助金属阳离子(例如锌或铝阳离子)、以及对催化和辅助金属阳离子具有确定的稳定常数的螯合剂,特别是使用乙二胺四乙酸、乙二胺四(亚甲基膦酸)和它们的水溶性盐(参见,例如US 4,430,243)。
在一些实施方式中,本发明的清洗组合物借助锰化合物来催化。此类化合物和使用水平是本领域熟知的(参加,例如5,576,282)。
在另外的实施方式中,钴漂白催化剂在本发明的清洗组合物中得到应用。多种钴漂白催化剂是本领域已知的(参见,例如U.S.5,597,936和U.S.5,595,967)。此类钴催化剂通过已知的方法容易制备(参见,例如U.S.5,597,936和U.S.5,595,967)。
在另外的实施方式中,本发明的清洗组合物包括大多环刚性配体(macropolycyclic rigid ligand)(“MRL”)的过渡金属络合物。作为实例,而不是为了限制,在一些实施方式中,本发明提供的组合物和清洗方法被调整,以在含水洗涤介质中提供至少一亿分之一数量级的活性MRL种类,在一些优选的实施方式中,在洗涤液体中提供从大约0.005ppm到大约25ppm、更优选地从大约0.05ppm到大约10ppm、和最优选地从大约0.1ppm到大约5ppm的MRL。
在本过渡金属漂白催化剂中优选的过渡金属包括但不限于锰、铁和铬。优选的MRL也包括但不限于交联的特殊超刚性配体(例如5,12-二乙基-1,5,8,12-四氮杂双环[6.6.2]十六烷)。通过已知的方法(参见,例如WO 00/32601和U.S.6,225,464),容易制备适合的过渡金属MRLs。
制备和使用清洗组合物的方法
本发明的清洗组合物被配制成任何合适的形式,并且通过配制者选择的任何方法制备,(对于一些非限制性例子,参见例如U.S.5,879,584,U.S.5,691,297,U.S.5,574,005,U.S.5,569,645,U.S.5,565,422,U.S.5,516,448,U.S.5,489,392,U.S.5,486,303,U.S.4,515,705,U.S.4,537,706,U.S.4,515,707,U.S.4,550,862,U.S.4,561,998,U.S.4,597,898,U.S.4,968,451,U.S.5,565,145,U.S.5,929,022,U.S.6,294,514和U.S.6,376,445,所有这些被引入本文作为参考)。
使用方法
在优选的实施方式中,本发明的清洗组合物在清洗表面和/或织物中得到应用。在一些实施方式中,至少一部分的表面和/或织物与本发明的清洗组合物的至少一个实施方式相接触,所述组合物为纯的形式或稀释在洗涤液体中,然后表面和/或织物被任选地洗涤和/或漂洗。对于本发明的目的,“洗涤”包括但是不限于擦洗和机械搅拌。在一些实施方式中,织物包括能够在正常的消费者使用条件下被洗涤的任何织物。在优选的实施方式中,本发明的清洗组合物通常以在溶液中从大约500ppm到大约15,000ppm的浓度被应用。在其中洗涤溶剂是水的一些实施方式中,水温通常在从大约5℃到大约90℃范围内。在一些织物清洗的优选实施方式中,水与织物的质量比通常为大约1∶1到大约30∶1。
实验
提供下面的实施例以便展示和进一步阐明本发明的某些优选的实施方式和方面,这些实施例不能解释为限制其范围。
在下面的实验公开内容中,下面的缩写词被应用:℃(摄氏度);rpm(每分钟转速);H2O(水);HCl(盐酸);aa和AA(氨基酸);bp(碱基对);kb(千碱基对);kD(千道尔顿);gm(克);μg和ug(微克);mg(毫克);ng(纳克);μl和ul(微升);ml(毫升);mm(毫米);nm(纳米);μm和um(微米);M(摩尔);mM(毫摩尔);μM和uM(微摩尔);U(单位);V(伏特);MW(分子量);sec(秒);min(s)(分钟/几分钟);hr(s)(小时/几小时);MgCl2(氯化镁);NaCl(氯化钠);OD280(280nm处的光密度);OD405(405nm处的光密度);OD600(600nm处的光密度);PAGE(聚丙烯酰胺凝胶电泳);EtOH(乙醇);PBS(磷酸盐缓冲盐水[150mM NaCl、10mM磷酸钠缓冲液,pH 7.2]);LAS(十二烷基磺酸钠);SDS(十二烷基硫酸钠);Tris(三[羟甲基]氨基甲烷);TAED(N,N,N′N′-四乙酰基乙二胺);BES(聚酯砜(polyesstersulfone));MES(2-吗啉乙磺酸,一水合物;f.w.195.24;Sigma#M-3671);CaCl2(氯化钙,无水;f.w.110.99;Sigma#C-4901):DMF(N,N-二甲基甲酰胺,f.w.73.09,d=0.95);Abz-AGLA-Nba(2-氨基苯甲酰基-L-丙氨酰甘氨酰-L-亮氨酰-L-丙氨酸基(alanino)-4-硝基苄基酰胺,f.w.583.65;Bachem#H-6675,VWR catalog#100040-598):SBG1%(″含有葡萄糖的超级培养基(Super Broth with Glucose)”;6g Soytone[Difco],3g酵母提取物,6g NaCl,6g葡萄糖);在使用本领域已知的方法灭菌以前用NaOH将pH调节到7.1;w/v(重量与体积之比);v/v(体积与体积之比);Npr和npr(中性金属蛋白酶);(SEQUEST数据库搜索软件,University of Washington);Npr和npr(中性金属蛋白酶基因);nprE和NprE(解淀粉芽胞杆菌中性金属蛋白酶);PMN(纯化的金属蛋白酶);MS(质谱仪);SRI(污迹除去指标(Stain Removal Index));TIGR(The Institute for Genomic Research,Rockville,MD);AATCC(American Association of Textile and Coloring Chemists);Amersham(Amersham Life Science,Inc.Arlington Heights,IL);Corning(Corning International,Corning,NY);ICN(ICN Pharmaceuticals,Inc.,Costa Mesa,CA);Pierce(Pierce Biotechnology,Rockford,IL);Equest(Equest,Warwick International Group,Inc.,Flintshire,UK);EMPA(Eidgenossische Material Prufungs und Versuch Anstalt,St.Gallen,Switzerland);CFT(Center for Test Materials,Vlaardingen,The Netherlands);Amicon(Amicon,Inc.,Beverly,MA);ATCC(American Type Culture Collection,Manassas,VA);Becton Dickinson(Becton Dickinson Labware,Lincoln Park,NJ);Perkin-Elmer(Perkin-Elmer,Wellesley,MA);Rainin(Rainin Instrument,LLC,Woburn,MA);Eppendorf(Eppendorf AG,Hamburg,Germany);Waters(Waters,Inc.,Milford,MA);Geneart(Geneart GmbH,Regensburg,Germany);Perseptive Biosystems(Perseptive Biosystems,Ramsey,MN);Molecular Probes(Molecular Probes,Eugene,OR);BioRad(BioRad,Richmond,CA);Clontech(CLONTECH Laboratories,Palo Alto,CA);Cargill(Cargill,Inc.,Minneapolis,MN);Difco(Difco Laboratories,Detroit,MI);GIBCO BRL或Gibco BRL(Life Technologies,Inc.,Gaithersburg,MD);New Brunswick(New Brunswick Scientific Company,Inc.,Edison,NJ);Thermoelectron(Thermoelectron Corp.,Waltham,MA);BMG(BMG Labtech,GmbH,Offenburg,Germany);Greiner(Greiner Bio-One,Kremsmuenster,Austria);Novagen(Novagen,Inc.,Madison,WI);Novex (Novex,San Diego,CA);Finnzymes(Finnzymes OY,Finland)Qiagen(Qiagen,Inc.,Valencia,CA);Invitrogen(Invitrogen Corp.,Carlsbad,CA);Sigma(Sigma Chemical Co.,St.Louis,MO);DuPont Instruments(Asheville,NY);Global Medical Instrumentation或GMI(Global Medical Instrumentation;Ramsey,MN);MJ Research(MJ Research,Waltham,MA);Infors(Infors AG,Bottmingen,Switzerland);Stratagene(Stratagene Cloning Systems,La Jolla,CA);Roche(Hoffmann La Roche,Inc.,Nutley,NJ);Agilent(Agilent Technologies,Palo Alto,CA);S-Matrix(S-Matrix Corp.,Eureka,CA);US Testing(United States Testing Co.,Hoboken,NY);West Coast Analytical Services(West Coast Analytical Services,Inc.,Santa Fe Springs,CA);Ion Beam Analysis Laboratory(Ion Bean Analysis Laboratory,The University of Surrey Ion Beam Centre(Guildford,UK);TOM(Terg-o-Meter);BMI(blood,milk,ink);BaChem(BaChem AG,Bubendorf,Switzerland);Molecular Devices(Molecular Devices,Inc.,Sunnyvale,CA);Corning(Corning International,Corning,NY);MicroCal(Microcal,Inc.,Northhampton,MA);Chemical Computing(Chemical Computing Corp.,Montreal,Canada);NCBI(National Center for Biotechnology Information);Argo Bioanalytica(Argo Bioanalytica.Inc,New Jersey);Vydac(Grace Vydac,Hesperia,CA);Minolta(Konica Minolta,Ramsey,NJ);和Zeiss(Carl Zeiss,Inc.,Thornwood,NY)。
在这些实验中,在反应完成后,使用分光光度计测量形成产品的吸光度。使用反射计测量样品的反射系数。除非另有说明,通过Coomassie Plus(Pierce),使用BSA作为标准,估计蛋白质浓度。
在下面描述的实施例中使用下列分析。
A.在96孔微量滴定板(MTPs)中对蛋白质含量进行测定的考马斯亮蓝染色法(Bradford Assay)
在这些分析中,使用考马斯亮蓝染料试剂(Bradford dye reagent)(Quick Start)分析,以确定在MTP规模上NprE蛋白酶样品的蛋白质浓度。在该分析系统中,使用的化学品和试剂溶液是:
Quick Start考马斯亮蓝染料试剂BIO-RAD,#500-0205
稀释缓冲液10mM NaCl,0.1mM CaC12,0.005%
使用的设备是Biomek FX Robot(Beckman)和SpectraMAX(340型)MTP读数器;MTPs得自Costar(9017型)。
在检测中,200μl考马斯亮蓝染料试剂被移入每个孔,然后加入15μl稀释缓冲液。最后将10μl过滤的培养物肉汤加入到孔中。充分混合后,将MTP在室温下温育至少10分钟。将可能的气泡吹掉,并且在595nm下读出孔的OD。
为了确定蛋白质浓度,从样品读数中减去背景读数(即,未接种的孔的读数)。所得到的OD595值提供样品中蛋白质含量的相对测量。在0到5μg之间的NprE校准线的线性使得能用OD595nm值作为蛋白含量的相对测量。当在上清液中预期的NprE含量是200-300μg/ml时,在该检测中使用的10μl样品体积含有5μg以下的蛋白质,这提供线性范围内的值。
B.用于检测蛋白酶性能的微型样本分析(Microswatch Assay)
用于该分析的洗涤剂不含有酶。使用的设备是Biomek FX Robot(Beckman)和SpectraMAX(340型)MTP读数器;MTPs得自Costar(9017型)。
洗涤剂制备(冷水液体洗涤剂;US条件):
将Milli-Q水调节到6gpg水硬度(Ca/Mg=3/1),加入0.78g/l洗涤剂。强烈搅拌洗涤剂溶液至少15分钟。然后加入5mM HEPES(游离酸)并将pH调节为8.2。
微型样品
从CFT得到1/4”圆形直径的微型样本。在将样品切割之前,用水洗涤织物(EMPA 116)。将两份微型样本垂直置于96孔微量滴定板的每个孔中,以暴露整个表面积(即,不是平放在孔底上)。
检测方法
将培养箱设定为20℃。通过用10mM NaCl、0.1mM CaCl2和0.005%溶液的混合物稀释,在适当浓度下,检测过滤的培养物肉汤样品。期望的洗涤剂溶液依照上面描述制备。然后,将190μl的洗涤剂溶液加入到含有微型样品的MTP的每一个孔中。向该混合物,加入10μl稀释的酶溶液(以使得总体积为200μL/孔)。用胶带密封MTP,并置于培养箱中30分钟,以1400rpm的速度搅拌。在合适的条件下温育之后,从每一个孔移出100μl溶液,并置入新的MTP中。在405nm,在MTP读数器中,读出含有100μl溶液/孔的新MTP。也包括空白对照,以及含有微型样品和洗涤剂但是不含酶的对照。
BMI性能计算:
获得的吸光度值用空白值(即在无酶情况下温育微型样品后所获得的值)校正。所得的吸光度是水解活性的量度。对每一样品(例如nprE或变体),计算性能指数。性能指数比较了同样蛋白质浓度的变体的性能(实际值)和标准酶的性能(理论值)。此外,使用标准酶的Langmuir方程的参数,计算理论值。大于1的(PI>1)性能指数(PI)表示较好的变体(如与标准[例如野生型]相比),而PI为1(PI=1)表示性能与标准相同的变体,小于1的PI(PI<1)表示性能不如标准的变体。因此,PI鉴定了优胜者,以及在某些环境中较不期望使用的变体。
C.NprE蛋白酶柠檬酸盐稳定性分析
在将野生型NprE和变体在存在50mM柠檬酸盐的情况下温育后,测量柠檬酸盐稳定性。使用DMC水解分析法确定初始和残留活性。在该分析系统中,使用的化学品和试剂溶液是:
这些稀释缓冲液的浓度被表示为终浓度。初始浓度按比例得更高并且依赖于稀释比率。在可选的实验中,HEPES用于替换Tris。使用的设备是Biomek FX Robot(Beckman)和培养箱/摇床(Innova,4230型;New Brunswick)。用4N HCl调节PIPES缓冲液至pH 5.8(终浓度为55mM)。用4N HCl调节Tris缓冲液至pH 8.2(终浓度为25mM)。用4N NaOH调节50mM柠檬酸盐/25mM Tris缓冲液至pH 8.2。用4N NaOH调节HEPES缓冲液至pH 8.2(终浓度为25mM)。用4N NaOH调节50mM柠檬酸盐/25mM HEPES缓冲液至pH 8.2。
蛋白质测定
为了在柠檬酸盐稳定性分析中确定期望的稀释比率,使用TCA分析,确定每一平板野生型NprE对照的蛋白酶浓度。在该方法中,将25μl过滤的培养物肉汤加入到200μl16.875%(w/v)的TCA。在环境温度下温育10到15分钟后,在405nm下确定光散射/吸光度。通过应用纯NprE构建的校准线,测定蛋白质浓度。
检测方法
如上所述,使用TCA分析确定过滤的培养物肉汤的稀释比率。
应激条件(Stressed Conditions):
用稀释缓冲液2稀释过滤的培养物肉汤。用胶带覆盖MTP,摇动几秒并且将其置于200rpm、25℃的培养箱中60分钟。温育后,从每一个孔取出20μl混合物,并转移入含有180μl1%的DMC预热底物溶液(该底物在25℃下预热)的新MTP中。将MTP直接置于培养箱/摇床中,并在200rpm搅拌下于25℃培养30分钟。使用二甲基酪蛋白水解分析,确定残留蛋白酶活性,如下所述。
无应激条件(Unstressed Conditions)
用稀释缓冲液1稀释过滤的培养物肉汤。立即地,从每一个孔取出20μl混合物,并转移入含有180μl 1%的DMC预热底物溶液(该底物在25℃下预热)的新MTP中。将MTP直接置于培养箱/摇床中,并在200rpm搅拌下于25℃培养30分钟。使用二甲基酪蛋白水解分析,用TNBS确定残留蛋白酶活性,如下所述。
使用下列等式,计算所有残留活性值(用二甲基酪蛋白水解分析确定)。
残留活性%=OD60min值*100/OD00min值
D.二甲基酪蛋白水解分析
在该分析系统中,使用的化学品和试剂溶液是:
方法
为了制备底物,将4g二甲基酪蛋白溶解在400ml PIPES缓冲液中。将过滤的培养物上清液用PIPES缓冲液稀释。然后,将10μl的每一份稀释的上清液加入到MTP孔的200μl底物中。MTP用胶带覆盖,振荡数秒,置于25℃烘箱中30分钟,不搅动。从烘箱移出第一个板之前约15分钟,通过将每50ml试剂A混合以1ml TNBS溶液,制备TNBS试剂。MTPs每孔充以60μl TNBS试剂A。温育过的板振荡数秒,之后,将10μl转移到含有TNBS试剂A的MTP。板用胶带覆盖,在室温以500rpm在台式摇床(BMG Thermostar)中摇动20分钟。最后,将200μl的试剂B加入到孔中,在摇床上混合1分钟,并用MTP读数器确定在405nm的吸光度。
获得的吸光度值用空白值(即无酶底物)校正。所得的吸光度是水解活性的量度。通过除吸光度和测定的蛋白质浓度,计算(任意单位的)样品比活性。
E.稳定性分析
在存在25%浓缩洗涤剂下的温育步骤后,测量NprE和变体的稳定性。使用下面描述的AGLA分析,测定初始和残留活性。使用的设备是Biomek FX Robot(Beckman)、荧光计(FLUOstar Optima;BMG)、培养箱/摇床(iEMS;Thermoelectron)和培养箱/摇床(Innova;New Brunswick(4230型));MTP得自Costar(9017型)和Greiner(黑色平板,655076型)。
化学品和试剂:
在该分析系统中,使用的化学品和试剂溶液是:
检测方法:
无应激条件:
首先,用180μl MES稀释缓冲液稀释20μl过滤的培养物肉汤。然后,用180μl MES稀释缓冲液稀释20μl该稀释的肉汤。然后在25℃下预热的平板中,用190μl AGLA-底物溶液稀释10μl该稀释的溶液。吹掉任何存在的气泡,并且根据AGLA蛋白酶分析方法测量该板。
应激条件:
首先,用不含DTPA的180μl-浓缩洗涤剂溶液稀释20μl过滤的培养物肉汤,并且在iEMS摇床中预混5分钟后,进一步在Innova摇床中温育。在200rpm、32℃下温育该板总共60分钟。另外,用含有DTPA的180μl-浓缩洗涤剂溶液稀释20μl过滤的培养物肉汤,并且在iEMS摇床中预混5分钟后,进一步在Innova摇床中温育。在200rpm、20℃下温育该板总共40分钟。然后用180μl MES稀释缓冲液稀释20μl这些溶液中的任一个,并在25℃下预热的平板中,用190μl AGLA-底物溶液稀释10μl该稀释的溶液。吹掉任何存在的气泡,并且根据AGLA蛋白酶分析方法测量该板。
计算:
在350nm激发和415nm发射下,进行荧光测量。对于每一孔,根据线性回归线,分光荧光计软件计算毫RFU/min的荧光增加的反应速率:
残留活性百分比:(应激条件的斜率)*100/(无应激条件的斜率)
F.2-氨基苯甲酰基-L-丙氨酰甘氨酰-L-亮氨酰-L-丙氨酸基-4-硝基苄基酰胺蛋白酶分析(Abz-AGLA-Nba)
下面提供的方法提供产生独立于时间和空间的可重复蛋白酶分析数据的一定程度的技术细节。尽管该分析可改变用于给定实验室条件,但是通过修改的方法所获得的任何数据必须符合通过原始方法产生的结果。中性金属蛋白酶切割2- 氨基苯甲酰基-L-丙氨酰甘氨酰-L-亮氨酰-L-丙氨酸基-4-硝基苄基酰胺(Abz-AGLA-Nba)的甘氨酸和亮氨酸之间的肽键。溶液中游离2-氨基苯甲酰基-L-丙氨酰甘氨酸(Abz-AG)具有415nm处的最大荧光发射和340nm处的最大激发。完整Abz-AGLA-Nba分子中的硝基苄基酰胺猝灭了Abz-AG的荧光。
在这些实验中,通过荧光光谱学(340激发/415发射),监控通过Abz-AGLA-Nba蛋白酶切割对的Abz-AG释放。Abz-AG出现的比率是水解活性的量度。在非底物限制的初始比率条件下进行分析。
需要具有温度控制的微板混合器(例如Eppendorf Thermomixer),以得到可重复的分析结果。在加入酶之前,在微板混合器中将分析溶液温育到期望温度(例如25℃)。将酶溶液加入到混合器中的平板上,强力混合并快速转移到平板读数器。
需要能连续记录数据、线性回归分析并具有温度控制的分光荧光计(例如SpectraMax M5,Gemini EM,Molecular Devices)。读数器总是保持在期望温度(例如25℃)。设定读数器,以进行顶部读取荧光探测(top-read fluorescence detection),并且将激发设定为350nm,发射设定为415nm,而没有使用截止滤波器。设定PMT至中度灵敏,并且每个孔读5个数。打开自动校准,但是仅在第一次读数前校准。根据选择来被监控的孔的数量,最小化读数间隔,测量该试样3分钟。设定读数器以计算毫RFU/min(每分钟千分之一的相对荧光单位)的速率。设定用于计算速率(Vmax点)的读数数量为相当于2分钟的数量,如通过读数间隔所确定(例如,每10秒读数将使用12个点计算该速率)。最大的RFU被设定为50,000。
所有酶和底物原液的吸取用正位移移液管(positive displacement pipets)(Rainin Microman)进行。缓冲液、试样溶液和酶工作溶液被单路或多路排气移液管(air-displacement pipets)(Rainin LTS)从试管、试剂贮液器(reagent reservoirs)或原液微板(stock microplates)吸取。当使用很少孔时,可重复用吸管(repeater pipet)(Eppendorf)可用于将试样溶液转移到微平板孔中,以最小化试剂损失。自动吸取仪器如Beckman FX或Cybio Cybi-well也应用于将酶溶液从工作原液微板转移到分析微平板,以立刻启动整个微平板。
试剂和溶液:
52.6mM MES/NaOH,2.6mM CaCl2,pH 6.5-MES缓冲液
将MES酸(10.28g)和292mg无水CaCl2溶解于大约900mL的纯化水中。用NaOH滴定该溶液至pH 6.5(在25℃或使用温度调节pH探针)。使pH已调节的缓冲液达到1L的总体积。通过0.22μm无菌过滤器过滤最终溶液,并且将其保持在室温。
DMF中48mM Abz-AGLA-Nba-Abz-AGLA-Nba原液
将大约28mg的Abz-AGLA-Nba置于小的试管中。其被溶于mL级的DMF中(体积根据聚集的Abz-AGLA-Nba变化),并且旋转数分钟。将溶液避光储存在室温下。
50mM MES,2.5mM CaCl2,5%DMF,2.4mM Abz-AGLA-Nba pH 6.5-试样溶液
将1mL Abz-AGLA-Nba原液加入到19mL MES缓冲液并旋转。将溶液避光储存在室温下。
50mM MES,2.5mM CaCl2,pH 6.5-酶稀释缓冲液
通过将5mL纯化水加入到95mL MES缓冲液中产生该缓冲液。
50mM MES,2.5mM CaCl2,5%DMF,pH 6.5-底物稀释缓冲液
将5mL纯DMF加入到95mL MES缓冲液中。该缓冲液被用于确定动力学参数。
酶溶液
用酶稀释缓冲液稀释酶原液至大约1ppm(1ug/mL)的浓度。中性蛋白酶(野生型NprE)被稀释至6ppm(6ug/mL)以下浓度。优选连续稀释。在室温下1小时,溶液是稳定的,但是对于更长时期的储存,溶液被保持在冰上。
过程
首先,制备所有缓冲液、原液和工作溶液。除非另有说明,分析每一酶稀释溶液三次。当没有完全满时,酶工作溶液原液微板被排列成从平板左边开始的完全垂直的列(为了适应平板读数器)。相似地放置相应的分析平板。如前所述,放置微平板分光荧光计。
首先,将200uL等分试样溶液置于96-孔微平板的孔中。在温度控制的微平板混合器中、25℃下,避光温育该平板10分钟。通过将10uL的工作酶溶液从原液微平板转移到混合器中的分析微平板,开始分析。最理想地,应用96-孔移液管头(pipetting head),或者使用8-孔多路移液管,首先转移最左边的列。强力混合溶液15秒(Eppendorf热混合器中900rpm)。立刻,将分析微平板转移到微平板分光荧光计,并且开始在350nm激发和415nm发射下记录荧光测量。对于每一孔根据线性回归线,分光荧光计软件计算毫RFU/min的荧光增加的反应速率。在一些实验中,当第一块平板被读数时,将第二块平板置于微平板混合器中以便温度平衡。
对于达0.3mM产物的产物浓度(即释放的2-氨基苯甲酰基荧光),比率初始速度是线性的,这相应于开始2.3mM的Abz-AGLA-Nba的溶液中大约50,000 RFU,背景荧光大约22,000 RFU。将Abz-AGLA-Nba溶解于DMF中,并且在制备的当日使用。
洗涤剂组合物:
在示例性的洗涤剂组合物中,酶水平用总组合物重量中含有的纯酶量表达,除非另外指出,洗涤剂成分基于总组合物的重量来表达。其中,缩写的成分标识(abbreviated component identifications)具有下述含义:
缩写 成分
LAS: 线型C11-13烷基苯磺酸钠。
NaC16-17HSAS: C16-17高度可溶的烷基硫酸钠。
TAS: 牛脂烷基硫酸钠。
CxyAS: C1x-C1y烷基硫酸钠。
CxyEz: C1x-C1y主要为线性的伯醇,与平均为z摩尔的环 氧乙烷缩合。
CxyAEzS: C1x-C1y烷基硫酸钠,与平均为z摩尔的环氧乙烷 缩合。实施例中增加分子名称。
非离子: 混合的乙氧基化/丙氧基化脂肪醇,例如 PlurafacLF404,为平均乙氧基化程度为 3.8和平均丙氧基化程度为4.5的醇。
OAS: R2.N+(CH3)2(C2H4OH),R2=C12-C14。
硅酸盐: 无定型的硅酸钠(SiO2:Na2O比=1.6-3.2∶1)。
正硅酸盐: 正硅酸钠(SiO2∶Na2O比=1.0)。
A型沸石: 水合硅铝酸盐,分子式为Na12(AlO2SiO2)12·27H2O
SKS-6: 结晶分层硅酸盐,分子式为δ-Na2Si2O5。
硫酸盐: 无水硫酸钠。
STPP: 三聚磷酸钠。
MA/AA: 4∶1丙烯酸酯/马来酸酯的无规共聚物,平均分子 量约70,000-80,000。
AA: 聚丙烯酸钠聚合物,平均分子量4,500。
聚羧酸酯: 包括羧化单体诸如丙烯酸酯、马来酸酯和甲基丙 烯酸酯的混合物的共聚物,MW在2,000-80,000范 围内,诸如通过商业渠道购自BASF的Sokolan,为丙 烯酸的共聚物,MW 4,500。
BB1: 3-(3,4-二氢异喹啉)丙烷硫酸酯。
BB2: 1-(3,4-二氢异喹啉)-癸烷-2-硫酸酯。
PB1: 过硼酸钠一水合物。
PB4: 过硼酸钠四水合物,名义分子式NaBO3·4H2O。
过碳酸盐: 过碳酸钠,名义分子式2Na2CO3·3H2O2。
TAED: 四乙酰乙二胺。
NOBS: 钠盐形式的壬酰氧杂苯磺酸盐 (Nonanoyloxybenzene sulfonate)。
DTPA: 二亚乙基三胺五乙酸。
HEDP: 1,1-羟乙烷二膦酸 (hydroxyethane diphosphonic acid)。
DETPMP: 二乙三胺五(亚甲基)膦酸盐,由Monsanto以商品名 Dequest 2060出售。
EDDS: 乙二胺-N,N′-二琥珀酸,其钠盐形式的(S,S)异构 体。
二胺: 二甲基氨基丙胺;1,6-hezane diamine(1,6-己二 胺);1,3-丙二胺;2-甲基-1,5-戊二胺;1,3-戊二胺; 1-甲基-二氨基丙烷。
DETBCHD: 5,12-二乙基-1,5,8,12-四氮杂二环[6,6,2]十六 烷,二氯化物,Mn(II)盐。
PAAC: 五胺醋酸钴(III)盐。
石蜡: 石蜡油,由Wintershall以商品名Winog 70出售。
石蜡烃磺酸盐: 石蜡油或石蜡,其中一些氢原子已被磺酸基团取代。
醛糖氧化酶: 氧化酶,由Novozymes A/S以商品名Aldose Oxidase 出售。
半乳糖氧化酶: 来自Sigma的半乳糖氧化酶。
nprE: 在枯草芽胞杆菌表达的重组形式的中性金属蛋白酶。
PMN: 从解淀粉芽胞杆菌纯化的中性金属蛋白酶。
淀粉酶: 淀粉水解酶,由Genencor以描述于WO 94/18314、WO 96/05295中的商品名Ox出售: 都来自Novozymes A/S。
脂肪酶: 脂水解酶,由Novozymes A/S以商品名Ultra出售,和Gist-Brocades出售的 LipomaxTM。
纤维素酶: 纤维素水解酶,由Novozymes A/S以商品名 Carezyme、Celluzyme和/或Endolase出售。
果胶裂解酶: 来自Novozymes A/S的和
PVP: 聚乙烯吡咯烷酮,平均分子量为60,000。
PVNO: 聚乙烯呲啶-N-氧化物,平均分子量为50,000。
PVPVI: 乙烯咪唑和乙烯吡咯烷酮的共聚物,平均分子量为 20,000
增亮剂1: 4,4′-二(2-磺基苯乙烯基)联苯基二钠(Disodium 4,4′-bis(2-sulphostyryl)biphenyl)。
有机硅消泡剂: 聚二甲基硅氧烷泡沫控制剂(foam controller),用 硅氧烷-氧化烯共聚物作为分散剂,所述泡沫控制剂 与所述分散剂的比率是10∶1至100∶1。
泡沫抑制剂: 12%硅氧烷/硅石、18%十八烷醇、70%淀粉,粒状。
SRP 1: 阴离子封端的聚酯(Anionically end capped poly ester)
PEG X: 聚乙二醇,分子量为x。
: 乙烯吡咯烷酮均聚物(平均MW 160,000)。
: 来自Huntsman的封端聚乙二醇。
: 来自Enichem的支链醇烷基硫酸酯。
MME PEG(2000): 来自Fluka Chemie AG的单甲基醚聚乙二醇(MW 2000)
DC3225C: 有机硅泡沫抑制剂,Dow Corning的有机硅油和硅石 的混合物。
TEPAE: 四亚乙基戊胺乙氧基化物。
BTA: 苯并三唑。
甜菜碱: (CH3)3N+CH2COO-。
糖: 工业级D-葡萄糖或食品级糖。
CFAA: C12-C14烷基N-甲基葡糖酰胺(glucamide)。
TPKFA: C12-C14拔顶全切脂肪酸(topped whole cut fatty acids)。
粘土: 水合硅酸铝,通式Al2O3SiO2·xH2O。类型:高岭土、蒙脱 石、绿坡缕石、伊利石、膨润土、多水高岭土。
pH: 在20℃,作为蒸馏水中的1%溶液所测量。
实施例1
从解淀粉芽胞杆菌克隆中性金属蛋白酶基因
在该实施例中,描述了用于克隆解淀粉芽胞杆菌中性金属蛋白酶基因的方法。使用本领域良好确立的方法从解淀粉芽胞杆菌克隆该编码中性金属蛋白酶的基因。非免选(non-exempt)(即菌株携带非遗传DNA(除在免选菌株中允许的氯霉素选择标记之外),特别是质粒pJM102序列)菌株BC91504(BG3594::comK中aprE/nprE-pJM102)携带枯草芽胞杆菌aprE启动子和在整合质粒pJM102中与解淀粉芽胞杆菌nprE前肽/成熟基因融合的信号序列。
枯草芽胞杆菌和解淀粉芽胞杆菌的下列两个序列(SEQ ID NO:1和SEQ ID NO:2)通过与相应于下划线序列的寡核苷酸引物进行PCR而产生。
枯草芽胞杆菌染色体EcoRI限制性位点(GAATTC)和aprE起始密码子(GTG)和解淀粉芽胞杆菌nprE终止密码子在下面的序列中以黑体类型表述,并且合成引入的HindIIII限制性位点(AAGCTT)被设计到引物#4中。
解淀粉芽胞杆菌aprE 5′上游序列、启动子和信号序列编码区在下面的序列(SEQ ID NO:I)中显示。引物1(apr-f;GAGCTGGGTAAAGCCTATGAAT SEQ ID NO:5)在序列的起点以下划线表示,而引物2和3(npr-f和npr-r:GTTCAGCAACATGTCTGCGCAGGCT:SEQ ID NO:6)的aprE部分在序列的结尾以双下划线表示。
GAGCTGGGTAAAGCCTATGAATTCTCCATTTTCTTCTGCTATCAAAATAACAGACTCGTGATTTTCCAAACGAGCTTTCAAAAAAGCCTCTGCCCCTTGCAAATCGGATGCCTGTCTATAAAATTCCCGATATTGGTTAAACAGCGGCGCAATGGCGGCCGCATCTGATGTCTTTGCTTGGCGAATGTTCATCTTATTTCTTCCTCCCTCTCAATAATTTTTTCATTCTATCCCTTTTCTGTAAAGTTTATTTTTCAGAATACTTTTATCATCATGCTTTGAAAAAATATCACGATAATATCCATTGTTCTCACGGAAGCACACGCAGGTCATTTGAACGAATTTTTTCGACAGGAATTTGCCGGGACTCAGGAGCATTTAACCTAAAAAAGCATGACATTTCAGCATAATGAACATTTACTCATGTCTATTTTCGTTCTTTTCTGTATGAAAATAGTTATTTCGAGTCTCTACGGAAATAGCGAGAGATGATATACCTAAATAGAGATAAAATCATCTCAAAAAAATGGGTCTACTAAAATATTATTCCATCTATTACAATAAATTCACAGAATAGTCTTTTAAGTAAGTCTACTCTGAATTTTTTTAAAAGGAGAGGGTAAAGAGTGAGAAGCAAAAAATTGTGGATCAGCTTGTTGTTTGCGTTAACGTTAATCTTTACGATGGC(SEQ ID NO:1)
解淀粉芽胞杆菌前肽序列和编码成熟nprE的序列以及转录终止子在下面的序列中提供。在该序列中,引物2和3的nprE部分被下划线表示(GCTGAGAATCCTCAGCTTAAAGAAAACCTG;SEQ ID NO:7),而引物4的npr-r部分(GGCTTCACCATGATCATATATGTCAAGCTTGGGGGG;SEQ ID NO:8)被双下划线表示。
GCTGAGAATCCTCAGCTTAAAGAAAACCTGACGAATTTTGTACCGAAGCATTCTTTGGTGCAATCAGAATTGCCTTCTGTCAGTGACAAAGCTATCAAGCAATACTTGAAACAAAACGGCAAAGTCTTTAAAGGCAATCCTTCTGAAAGATTGAAGCTGATTGACCAAACGACCGATGATCTCGGCTACAAGCACTTCCGTTATGTGCCTGTCGTAAACGGTGTGCCTGTGAAAGACTCTCAAGTCATTATTCACGTCGATAAATCCAACAACGTCTATGCGATTAACGGTGAATTAAACAACGATGTTTCCGCCAAAACGGCAAACAGCAAAAAATTATCTGCAAATCAGGCGCTGGATCATGCTTATAAAGCGATCGGCAAATCACCTGAAGCCGTTTCTAACGGAACCGTTGCAAACAAAAACAAAGCCGAGCTGAAAGCAGCAGCCACAAAAGACGGCAAATACCGCCTCGCCTATGATGTAACCATCCGCTACATCGAACCGGAACCTGCAAACTGGGAAGTAACCGTTGATGCGGAAACAGGAAAAATCCTGAAAAAGCAAAACAAAGTGGAGCATGCCGCCACAACCGGAACAGGTACGACTCTTAAAGGAAAAACGGTCTCATTAAATATTTCTTCTGAAAGCGGCAAATATGTGCTGCGCGATCTTTCTAAACCTACCGGAACACAAATTATTACGTACGATCTGCAAAACCGCGAGTATAACCTGCCGGGCACACTCGTATCCAGCACCACAAACCAGTTTACAACTTCTTCTCAGCGCGCTGCCGTTGATGCGCATTACAACCTCGGCAAAGTGTATGATTATTTCTATCAGAAGTTTAATCGCAACAGCTACGACAATAAAGGCGGCAAGATCGTATCCTCCGTTCATTACGGCAGCAGATACAATAACGCAGCCTGGATCGGCGACCAAATGATTTACGGTGACGGCGACGGTTCATTCTTCTCACCTCTTTCCGGTTCAATGGACGTAACCGCTCATGAAATGACACATGGCGTTACACAGGAAACAGCCAACCTGAACTACGAAAATCAGCCGGGCGCTTTAAACGAATCCTTCTCTGATGTATTCGGGTACTTCAACGATACTGAGGACTGGGATATCGGTGAAGATATTACGGTCAGCCAGCCGGCTCTCCGCAGCTTATCCAATCCGACAAAATACGGACAGCCTGATAATTTCAAAAATTACAAAAACCTTCCGAACACTGATGCCGGCGACTACGGCGGCGTGCATACAAACAGCGGAATCCCGAACAAAGCCGCTTACAATACGATTACAAAAATCGGCGTGAACAAAGCGGAGCAGATTTACTATCGTGCTCTGACGGTATACCTCACTCCGTCATCAACTTTTAAAGATGCAAAAGCCGCTTTGATTCAATCTGCGCGGGACCTTTACGGCTCTCAAGATGCTGCAAGCGTAGAAGCTGCCTGGAATGCAGTCGGATTGTAAACAAGAAAAGAGACCGGAAATCCGGTCTCTTTTTTATATCTAAAAACATTTCACAGT(SEQ ID NO:2)。
全长NprE的氨基酸序列(前-、原-(pre-,pro-)和成熟序列)在下面提供:
MGLGKKLSVAVAASFMSLTISLPGVQAAENPQLKENLTNFVPKHSLVQSELPSVSDKAIKQYLKQNGKVKGNPSERLKLIDQTTDDLGYKHFRYVPVVNGVPVKDSQVIIHVDKSNNVYAINGELNNDVSAKTANSKKLSANQALDHAYKAIGKSPEAVSNGTVANKNKAELKAAATKDGKYRLAYDVTIRYIEPEPANWEVTVDAETGKILKKQNKVEHAATTGTGTTLKGKTVSLNISSESGKYVLRDLSKPTGTQIITYDLQNREYNLPGTLVSSTTNQFTTSSQRAAVDAHYNLGKVYDYFYQKFNRNSYDNKGGKIVSSVHYGSRYNNAAWIGDQMIYGDGDGSFFSPLSGSMDVTAHEMTHGVTQETANLNYENQPGALNESFSDVFGYFNDTEDWDIGEDITVSQPALRSLSNPTKYGQPDNFKNYKNLPNTDAGDYGGVHTNSGIPNKAAYNTITKIGVNKAEQIYYRALTVYLTPSSTFKDAKAALIQSARDLYGSQDAASVEAAWNAVGL(SEQ ID NO:3)
在一些可选的实施方式中,下列NprE序列用于本发明。
VRSKKLWISLLFALTLIFTMAFSNMSAQAAENPQLKENLTNFVPKHSLVQSELPSVSDKAIKQYLKQNGKVFKGNPSERLKLIDQTTDDLGYKHFRYVPVVNGVPVKDSQVIIHVDKSNNVYAINGELNNDVSAKTANSKKLSANQALDHAYKAIGKSPEAVSNGTVANKNKAELKAAATKDGKYRLAYDVTIRYIEPEPANWEVTVDAETGKILKKQNKVEHAATTGTGTTLKGKTVSLNISSESGKYVLRDLSKPTGTQIITYDLQNREYNLPGTLVSSTTNQFTTSSQRAAVDAHYNLGKVYDYFYQKFNRNSYDNKGGKIVSSVHYGSRYNNAAWIGDQMIYGDGDGSFFSPLSGSMDVTAHEMTHGVTQETANLNYENQPGALNESFSDVFGYFNDTEDWDIGEDITVSQPALRSLSNPTKYGQPDNFKNYKNLPNTDAGDYGGVHTNSGIPNKAAYNTTTKIGVNKAEQIYYRALTVYLTPSSTFKDAKAALIQSARDLYGSQDAASVEAAWNAVGL(SEQ ID NO:4)
在下面提供在这些PCR实验中使用的引物序列:
引物2和3是彼此的反向互补序列,并且相应于染色体DNA的非编码(#2)或编码(#3)链。对于编码链,它们相应于aprE信号序列的最后25个碱基对和nprE前肽的前30个碱基对。引物#4与下划线序列反向互补,包括nprE终止密码子的3′的24个碱基对和在引入的HindIII位点之前具有6个dCTP残基的终止子,以提供所谓的“夹(clamp)”,这允许使用HindIII限制性内切核酸酶更有效切割,因为如果限制性内切酶的识别序列恰好位于DNA片段的末端,一些限制性内切酶的切割无效。
使用下面的方法和试剂(除了DNA模版和寡核苷酸引物),从Applied Biosystems′的rTTH DNA聚合酶XL试剂盒产生两个PCR片段:
40.6μl H2O
30μl3.3x rTth PCR缓冲液
10μl 2mM dNTP混合物
4.4μl25mM Mg-乙酸盐
5μl 50μM引物#1或#3(正向引物)
5μl 50μM引物#2或#4(反向引物)
2μl枯草芽胞杆菌或解淀粉芽胞杆菌染色体DNA
2μl rTth聚合酶
1μlPfuTurbo聚合酶
总共100μl反应体积
在这些实验中使用的PCR条件是(95℃,30sec./58℃,30sec/68℃,1min.)x30循环,然后快速冷却到4℃。在1.2%琼脂糖/TBE制备型凝胶上进行反应,使用凝胶提取试剂盒(Gel Extraction Kit)剪切和纯化适当大小的片段。在第二步的融合中,进行PCR反应,其中染色体DNA用1ul两个分离片段中的每一个进行取代,并且仅使用外部引物#s 1和#2。使用如上面描述的相同的PCR条件。由于从第一次PCR中应用互补引物2和3得到的两个片段上形成的互补端,该两个片段精确融合。
用EcoRI和HindIII消化该融合片段,并且如上所述凝胶纯化。也用EcoRI和HindIII消化整合质粒pJM102,然后线型质粒被凝胶纯化并且通过标准技术连接到消化的apr/npr融合片段。接下来使用该连接反应直接转化木糖诱导的枯草芽胞杆菌菌株。
在纯化后,用源自野生型枯草芽胞杆菌染色体DNA的引物1和2以及源自解淀粉芽胞杆菌菌株的染色体DNA的引物3和4,通过PCR产生两种片段。该片段又如上述纯化,然后用如在整合质粒pJM102同样消化中的EcoRI和HindIII进行切割,并接下来将融合片段连接到质粒。数种转化体具有融合,从染色体测序以证实不存在任何PCR-来源的突变。然后,从5-25mg/mL氯霉素——pJM102选择标记,逐步扩增这些转化体中的一个,以共扩增连接的表达盒。
通过在含5mg/ml氯霉素(CMP)的LB/琼脂板上,选择对pJM102′s氯霉素抗性的标记,获得选定序列证实的转化体。然后,在10mg/ml CMP、37℃下将其接种入LB培养基过夜并伴随250RPM摇动。然后用10mg/ml CMP将该培养物划线(接种)到LB/琼脂板上以分离单一菌落。在25mg/ml CMP、37℃下将一个菌落接种入LB培养基过夜并伴随250RPM摇动。然后用25mg/ml CMP将该培养物划线(接种)到LB/琼脂板上以分离单一菌落。收集这些菌群并将其储存在-70℃甘油中,直到使用,如本领域所知。
存在于枯草芽胞杆菌(aprE和nprE)中的两种非必要蛋白酶以及淀粉酶的缺失,在金属蛋白酶产生过程中减少了总细胞外蛋白酶水平。将编码中性金属蛋白酶的DNA克隆到淀粉酶缺失的宿主中。用于感受态形成(competence development)的可诱导comK被插入到淀粉酶位置的中间,使得菌株是“amy(淀粉酶的)”。通过将编码信号序列的核苷酸插入到基因的编码序列之前,确保表达蛋白的分泌。
实施例2
纯化的中性和重组中性金属蛋白酶(nprE)的表达和发酵
如实施例1描述产生的重组枯草芽胞杆菌通过传统的批式发酵在营养培养基中进行培养,如下所述。含有解淀粉芽胞杆菌中性金属蛋白酶的枯草芽胞杆菌培养物的一甘油小瓶(如按实施例1中描述制备)被用来接种600ml含有200mg/L氯霉素的SBG1%培养基。在37℃下,生长该培养物48小时,然后,通过12,000rpm的离心回收该培养物流体,如在本领域已知的。该过程重复进行。得到的最终酶浓度在大约1.4和2g/L的范围内。
实施例3
中性金属蛋白酶的纯化和表征
该实施例描述了用于纯化实施例2描述的生物体表达的中性金属蛋白酶的方法。在37℃下温育36小时后,回收发酵培养基,并且在12000rpm(SORV离心机RC5B型)下离心。从培养物流体分离分泌的中性金属蛋白酶,并且使用具有BES(聚醚砜)10KDa截流(cutoff)的Amicon过滤器系统8400浓缩大约10倍。
浓缩的上清液在4℃下相对于含有10mM NaCl、pH 5.4的25mM MES缓冲液透析整夜。然后,将透析液加载到阳离子交换柱Porous HS20(总体积~83mL;结合量~4.5g蛋白质/mL柱;Waters),如下所述。用含有10mM NaCl、pH 5.4的25mM MES缓冲液预平衡该柱。然后,将大约200-300mL样品加载到该柱上。使用5.4到6.2的pH梯度,通过10柱体积的MES缓冲液洗脱结合的蛋白质。蛋白洗脱液在pH 5.82和6.0之间,并且使用本文所述的蛋白水解活性和10%(w/v) SDS-PAGE(Novex)对其进行评估。然后聚集含有中性蛋白酶的部分。在将pH调节到5.8之前,钙和锌的氯化物盐以3∶1的比率加入。使用Perceptive BiosystemsVision(GMI)进行蛋白质纯化。
使用10%(w/v)SDS-PAGE评估的纯化蛋白质被确定为同源的,并具有95%以上的纯度。典型地,当使用标准蛋白酶分析法、用小底物suc-p-AAPF-pNA(N-琥珀酰-L-Ala-L-Ala-L-Pro-L-Phe-p-硝基苯胺)(Sigma)时,1%以下的纯化制品表现出丝氨酸蛋白酶活性。在微量滴定平板形式(96孔)中,使用含有10mM CaCl2和0.005%的100mM、pH 8.5的Tris-HCl缓冲液,实施该分析。通过使160mM原液溶于DMSO(二甲基亚砜)(100mg/ml)和用含有CaCl2和0.005%的Tris-HCl缓冲液将该原液稀释100倍,制备该底物(p-AAPF NA)。然后,将10uL稀释的蛋白酶溶液(使用含有10mM CaCl2和0.005%的100mM、pH 8.5的Tris-HCl缓冲液制备稀释物)加入到190uLp-AAPF溶液中。混合该试样5分钟,并且在2到5分钟内读取410nm下的动力学变化。测量反应的斜率,并且将其用作丝氨酸蛋白酶活性的量的表示。使用含有1mM氯化锌、4mM氯化钙和40%丙二醇的25mM、pH 5.8的MES缓冲液配制该蛋白以便储存。
实施例4
纯化的中性金属蛋白酶(PMN)对钙和锌阳离子的亲和力
在该实施例中,描述确定按上述实施例所述制备的中性金属蛋白酶(PMN)的亲和力的方法。使用分别从Molecular Probes获得的荧光指示剂Fluo-3和FluoZin-3,实施PMN对钙和锌阳离子的亲和力。所有的荧光测量被记录在LS50B发光分光光度计(Perkin-Elmer)上。通过在500nm的激发,监控Fluo-3的结合,并且记录505到550nm的发射光谱。相似地,通过在495nm的激发,监控FluoZin-3的结合,并且收集500到550nm的发射光谱。激发和发射缝宽都被设定为2.5nm。
在这些测定中,用增加量的相关指示剂滴定pH 8.4的50mM Tris-HCl缓冲液中的100uM中性金属蛋白酶。在图1中示出滴定曲线。在该图中,三角表示使用FluoZin-3染料在516nm下监控的对于Zn2+得到的曲线结合数据,而圆圈表示使用Fluo-3染料在522nm下监控的对于Ca2+得到的数据。测定锌和钙(假设单一结合位点)的结合常数(Ka′s)分别为0.401nM和0.037nM。这些结果表明,纯化的中性金属蛋白酶结合锌离子的亲和力比钙离子大约10倍。基于钙的较弱结合,设计初始蛋白质工程学实验,以包括或者(i)设计更紧密的钙结合位点(一个或多个)和/或消除钙的结构稳定性需要(例如为了稳定蛋白质至80%以上)。
实施例5
储存稳定性
在该实施例中,描述评估在枯草芽胞杆菌中表达的PMN和重组解淀粉芽胞杆菌中性金属蛋白酶储存稳定性所进行的实验。在存在增加的LAS(十二烷基硫酸钠;Sigma)溶液(0%上至包含10%)的情况下,评估这些中性金属蛋白酶制剂的蛋白水解。使用10%(w/v)SDS-PAGE,观察从纯化中性金属蛋白酶(PMN)产生的蛋白水解片段。
在单独的缓冲液(50mM Tris-HCl缓冲液,pH 8.4)中和在存在得自Procter&Gamble的洗涤剂基本成分的情况下,测定如上所述产生的在枯草芽胞杆菌中表达的重组解淀粉芽胞杆菌中性金属蛋白酶的储存稳定性。缓冲液和/或洗涤剂基本成分含有锌离子、钙离子或它们的组合。锌离子和钙离子的浓度都在0到25mM变化。这些结果总是与在单独的缓冲液中温育的中性金属蛋白酶的结果进行比较。
蛋白酶分析
偶氮-酪蛋白分析:
偶氮-酪蛋白终点分析(azo-casein endpoint assay)被用来评估在某些条件下发生的蛋白水解的量。在这些分析中,75uL的酶与被加入到250μl的1%(w/v)偶氮-酪蛋白(Sigma)的过量钙或锌离子或者这两种离子一起温育。在30℃下,进行该反应15分钟,然后加入10%(w/v)三氯乙酸以停止该反应。通过在14000rpm下离心10分钟,除去沉淀的蛋白质和未反应的偶氮-酪蛋白。通过加入750μL 1M氢氧化钠,显现偶氮基团的颜色。该颜色显现进行5分钟,然后,停止反应并且测量440nm下的吸光度。
琥珀酰化酪蛋白和TNBSA分析:
使用QuantiCleave Protease Assay KitTM(Pierce)测定中性金属蛋白酶的活性。该分析基于酶消化琥珀酰化酪蛋白。然后,形成的伯氨基与三硝基苯磺酸(TNBSA)反应,并且形成在450nm具有最大吸光度的有颜色的络合物。在96-孔微量滴定板形式中实施该分析。该分析需要与琥珀酰化酪蛋白温育15分钟,并且与TNBSA反应15分钟。在两次温育中,将样品置于摇床。TPCK-胰蛋白酶(Pierce)是用于总蛋白酶活性测定的通常标准。然而,具体蛋白酶活性的最佳条件需要应用目的蛋白酶。在这些实验中实施分析的情况下,胰蛋白酶和目的蛋白酶都被使用,以便校准分析。分析的精确性要求由0.5mg/mL胰蛋白酶制成的标准稀释物总是产生0.5以下的吸光值(在450nm)。
相对于不含酪蛋白的对照,测量每一样品。报告的吸光度变化(ΔAbs(450nm))说明了酪蛋白的氨基干扰。此外,缓冲液和/或洗涤剂的其它成分中的伯氨基可能的干扰也以这种方式修正。在相同的时间长度和在相同的温度下,相对于没有加入中性金属蛋白酶的洗涤剂,以及对于温育在随同试剂盒提供的BupHTM硼酸盐缓冲液中的酶,检测所有样品的活性。
该检测是终点分析,其中pH 8.5的50mM硼酸盐缓冲液在32℃下应用。蛋白酶分析一般实施两次。尽管在一些实验中稀释也为1∶500或1∶200,但是在大多数测定稳定性量的实验中,使用上述的缓冲液按1∶1000稀释蛋白质和洗涤剂,以便得到空白的吸光度在0.5以下的读数。在这些实验中使用的微量滴定分光光度计是(Molecular Devices),并且所有分析在培养基蛋白结合的96孔平板(Corning)中进行。
在这些分析中得到的标准蛋白样品(例如胰蛋白酶和纯化的金属蛋白酶)的结果表明,存在非线性反应(仅在窄的分析范围内,线性数值范围可能是合适的)。因此,将曲线拟合为二次函数,其中f=y0+ax2+bx;f是对y的拟合(v.9;SPSS,Inc.)。因此,如果使用线性方程对蛋白质的数量定量,那么得到不精确的数据;发现需要二次方程以便得到精确的结果。注意,制造商(Pierce)的试剂盒插入物表明,可用为对数标度的″x″拟合该结果。
实施例6
pH和LAS对中性金属蛋白酶活性的影响
也确定对于0.36mg/mL配制的nprE的活性的最适pH。在该研究中调查的缓冲液是pH范围在3.5-5.5的50mM乙酸钠(pKa=4.76)、pH范围在5.5到7.0的50mM MES缓冲液(pKa=6.10)和pH 8.4的50mM Tris-HCl缓冲液。配制的nprE的最适pH被确定为在5.5和6.0之间。
通过在0到1%(w/v)LAS中温育,研究洗涤剂成分LAS对0.36mg/ml配制的nprE活性的影响。在图2提供的图表中示出该结果。如这些结果所表明的,蛋白酶明显被洗涤剂成分失活,从而必须一种手段来稳定蛋白酶以对抗这种有害影响。
在一些实验中,使用Procter&Gamble提供的、称为″2005″的高密度液体洗涤剂(HDL)组合物。如所提供的,该洗涤剂包含除了本发明的中性金属蛋白酶之外的所有必需成分。
作为时间函数的存液体洗涤剂基本成分中的储存稳定性
以小型储存方式进行该稳定性检测。使用用FusionProTM(S-Matrix)软件设计的矩阵(matrix),评估待改变的条件和待加入的氯化钙和氯化锌盐的不同浓度。下面的表格总结了被检测的条件以确定解淀粉芽胞杆菌的中性金属蛋白酶的长期储存稳定性。
每一个检测条件的最终体积是1mL。给予2005_0.÷36mg酶/mL。配制的培养物液体和纯化的重组金属蛋白酶在32℃下基本成分中温育大约4周期间。将洗涤剂中金属蛋白酶的储存稳定性与pH 5.8的50mM MES缓冲液中的中性金属蛋白酶的稳定性比较。
在检测之前,使用分析缓冲液(pH 8.5的50mM硼酸盐缓冲液)以5∶1000稀释样品。测定残留活性,并且相对于分析缓冲液中的中性金属蛋白酶进行比较。所有的测量一式两份加以确定。每一样品与适当的空白对照(即检测的洗涤剂、缓冲液和任何必需的添加剂)平行检测。然后如QuantiCleaveTM Protease Assay Kit(Pierce)提供的说明书所述,分析样品。
进行了3-4周期间的这些稳定性检测的结果在图22中示出。中,不存在离子(即没有加入盐)时的中性金属蛋白酶快速失去其对酪蛋白的全部蛋白水解/水解活性。实际上,确定的是,在1小时以内温育后,保留了20%以下的活性。与之相反,在含有锌离子(上至15mM并包括15mM)的中温育,在7天的时期内稳定蛋白酶和防止蛋白水解。因此,在该制剂中存在锌离子在保持至少60%的蛋白酶活性方面起良好的功能。同样地,7.5mM锌离子浓度产生相似的稳定效果。该浓度的锌离子是非常低的,并且被考虑应用于多种洗涤剂制剂中。在这些实验中,钙离子的包括没有提供附加的效果。而且,加入超过15mM和多至25mM以及包括25mM的钙离子,当加入到基本成分中时,引起沉淀。尽管本发明不拟限于任何特定机制,但是预期在这些实验中,加入的钙离子缺乏对蛋白酶稳定性的影响是洗涤剂组合物的原因。
对于嗜热菌蛋白酶——其表现与解淀粉芽胞杆菌中性金属蛋白酶具有55%的氨基酸序列同一性(使用CLUSTAL W,v.1.82进行的序列对比),其已明显表示出锌离子对于活性是必须的,而钙离子和钙离子结合位点工程已经表现起稳定作用(参见,例如Mansfield.等,J.Biol.Chem.,272:11152-11156[1997];和Van den Berg等,Biotechnol.Appl.Biochem.,30:35-40[1999])。
在可选的实施方式中,其它阳离子(例如Co2+、Mn2+和Fe2+)应用于本发明以稳定解淀粉芽胞杆菌中性金属蛋白酶。这与现有数据对比,该现有数据已表明这些离子没有一种导致特异性活性的100%恢复(Holmquist.和Vallee,J.Biol.Chem.,249:4601-4607[1974])。预期这些离子将通过防止解折叠和接下来的金属蛋白酶的蛋白水解降解来影响稳定性。然而,本发明不拟限于任何特定的作用机制。
实施例7
在枯草芽胞杆菌中使用nprE表达载体pUBnprE产生NprE蛋白酶
在该实施例中,描述了在枯草芽胞杆菌产生NprE蛋白酶所进行的实验,具体而言,描述了用于将质粒pUBnprE转化入枯草芽胞杆菌的方法。如本领域已知,进行转化(参见例如WO 02/14490,其被引入本文作为参考)。下面提供的DNA序列(源自解淀粉芽胞杆菌的nprE前导序列、nprE前DNA序列和nprE成熟DNA序列)编码NprE前体蛋白:
GTGGGTTTAGGTAAGAAATTGTCTGTTGCTGTCGCCGCTTCCTTTATGAGTTTAACCATCAGTCTGCCGGGTGTTCAGGCCGCTGAGAATCCTCAGCTTAAAGAAAACCTGACGAATTTTGTACCGAAGCATTCTTTGGTGCAATCAGAATTGCCTTCTGTCAGTGACAAAGCTATCAAGCAATACTTGAAACAAAACGGCAAAGTCTTTAAAGGCAATCCTTCTGAAAGATTGAAGCTGATTGACCAAACGACCGATGATCTCGGCTACAAGCACTTCCGTTATGTGCCTGTCGTAAACGGTGTGCCTGTGAAAGACTCTCAAGTCATTATTCACGTCGATAAATCCAACAACGTCTATGGGATTAACGGTGAATTAAACAACGATGTTTCCGCCAAAACGGCAAACAGCAAAAAATTATCTGCAAATCAGGCGCTGGATCATGCTTATAAAGCGATCGGCAAATCACCTGAAGCCGTTTCTAACGGAACCGTTGCAAACAAAAACAAAGCCGAGCTGAAAGCAGCAGCCACAAAAGACGGCAAATACCGCCTCGCCTATGATGTAACCATCCGCTACATCGAACCGGAACCTGCAAACTGGGAAGTAACCGTTGATGCGGAAACAGGAAAAATCCTGAAAAAGCAAAACAAAGTGGAGCATGCCGCCACAACCGGAACAGGTACGACTCTTAAAGGAAAAACGGTCTCATTAAATATTTCTTCTGAAAGCGGCAAATATGTGCTGCGCGATCTTTCTAAACCTACCGGAACACAAATTATTACGTACGATCTGCAAAACCGCGAGTATAACCTGCCGGGCACACTCGTATCCAGCACCACAAACCAGTTTACAACTTCTTCTCAGCGCGCTGCCGTTGATGCGCATTACAACCTCGGCAAAGTGTATGATTATTTCTATCAGAAGTTTAATCGCAACAGCTACGACAATAAAGGCGGCAAGATCGTATCCTCCGTTCATTACGGCAGCAGATACAATAACGCAGCCTGGATCGGCGACCAAATGATTTACGGTGACGGCGACGGTTCATTCTTCTCACCTCTTTCCGGTTCAATGGACGTAACCGCTCATGAAATGACACATGGCGTTACACAGGAAACAGCCAACCTGAACTACGAAAATCAGCCGGGCGCTTTAAACGAATCCTTCTCTGATGTATTCGGGTACTTCAACGATACTGAGGACTGGGATATCGGTGAAGATATTACGGTCAGCCAGCCGGCTCTCCGCAGCTTATCCAATCCGACAAAATACGGACAGCCTGATAATTTCAAAAATTACAAAAACCTTCCGAACACTGATGCCGGCGACTACGGCGGCGTGCATACAAACAGCGGAATCCCGAACAAAGCCGCTTACAATACGATTACAAAAATCGGCGTGAACAAAGCGGAGCAGATTTACTATCGTGCTCTGACGGTATACCTCACTCCGTCATCAACTTTTAAAGATGCAAAAGCCGCTTTGATTCAATCTGCGCGGGACCTTTACGGCTCTCAAGATGCTGCAAGCGTAGAAGCTGCCTGGAATGCAGTCGGATTGTAA(SEQ ID NO:12)
在上述序列中,黑体表示编码成熟NprE蛋白酶的DNA,标准字体表示前导序列(nprE前导序列),下划线表示前序列(nprE前序列)。下面提供的氨基酸序列(NprE前导序列、NprE前和NprE成熟DNA序列)(SEQ ID NO:13)编码NprE前体蛋白。在该序列中,下划线表示前序列,黑体表示成熟NprE蛋白酶。SEQ ID NO:17提供了与成熟NprE序列分离的NprE前序列,SEQ ID NO:18提供了成熟NprE序列。该序列被用作制造本文描述的变体文库的基础。
MGLGKKLSVAVAASFMSLTISLPGVQAAENPQLKENLTNFVPKHSLVQSELPSVSDKAIKQYLKQNGKVFKGNPSERLKLIDQTTDDLGYKHFRYVPVVNGVPVKDSQVIIHVDKSNNVYAINGELNNDVSAKTANSKKLSANQALDHAYKAIGKSPEAVSNGTVANKNKAELKAAATKDGKYRLAYDVTIRYIEPEPANWEVTVDAETGKILKKQNKVEHAATTGTGTTLKGKTVSLNISSESGKYVLRDLSKPTGTQIITYDLQNREYNLPGTLVSSTTNQFTTSSQRAAVDAHYNLGKVYDYFYQKFNRNSYDNKGGKIVSSVHYGSRYNN AAWIGDQMIYGDGDGSFFSPLSGSMDVTAHEMTHGVTQETANLNYENQPGALNESFSDVFGYFNDTEDWDIGEDITVSQPALRSLSNPTKYGQPDNFKNYKNLPNTDAGDYGGVHTNSGIPNKAAYNTITKIGVNKAEQIYYRALTVYLTPSSTFKDAKAALIQSARDLYGSQDAASVEAAWNAVGL(SEQ ID NO:13)
AENPQLKENLTNFVPKHSLVQSELPSVSDKAIKQYLKQNGKVFKGNPSERLKLIDQTTDDLGYKHFRYVPVVNGVPVKDSQVIIHVDKSNNVYAINGELNNDVSAKTANSKKLSANQALDHAYKAIGKSPEAVSNGTVANKNKAELKAAATKDGKYRLAYDVTIRYIEPEPANWEVTVDAETGKILKKQNKVEH(SEQ ID NO:17)
AATTGTGTTLKGKTVSLNISSESGKYVLRDLSKPTGTQIITYDLQNREYNLPGTLVSSTTNQFTrSSQRAAVDAHYNLGKVYDYFYQKFNRNSYDNKGGKIVSSVHYGSRYNNAAWIGDQMIYGDGDGSFFSPLSGSMDVTAHEMTHGVTQETANLNYENQPGALNESFSDVFGYFNDTEDWDIGEDITVSQPALRSLSNPTKYGQPDNFKNYKNLPNTDAGDYGGVHTNSGIPNKAAYNTITKIGVNKAEQIYYRALTVYLTPSSTFKDAKAALIQSARDLYGSQDAASVEAAWNAVGL(SEQ ID NO:18)
使用下列两种特异性引物,通过PCR从解淀粉芽胞杆菌的染色体DNA扩增nprE基因,构建pUBnprE表达载体:
Oligo AB 1740:
CTGCAGGAATTCAGATCTTAACATTTTTCCCCTATCATTTTTCCCG(S EQ ID NO:19)
Oligo AB1741:
GGATCCAAGCTTCCCGGGAAAAGACATATATGATCATGGTGAAGCC(SEQ ID NO:20)。
使用Phusion High Fidelity DNA聚合酶(Finnzymes),在热循环仪上实施PCR。该PCR混合物含有10μl 5x缓冲液(Finnzymes Phusion),1μl 10mM dNTP′s,1.5μlDMSO,1μl的每一种引物,1μl Finnzymes Phusion DNA聚合酶,1μl 50ng/μl的染色体DNA溶液,34.5μl MilliQ水。使用下列方案:
PCR方案:
1)30sec 98℃;
2)10sec 98℃;
3)20sec 55℃;
4)1min72℃;
5)第2步到第4步25个循环;和
6)5min 72℃。
这产生使用BglII和BclI DNA限制性酶消化的1.9kb DNA片段。使用BamHI消化多拷贝芽胞杆菌载体pUB110(参见例如Gryczan,J.Bacteriol.,134:318-329[1978])。然后,在pUBI 10x BamHl载体中连接PCR片段x BglII x BelI以形成pUBnprE表达载体(参见图14)。
将pUBnprE转化到枯草芽胞杆菌(ΔaprE,ΔnprE,oppA,ΔspoIIE,degUHy32,ΔamyE::(xylR,pxylA-comK)菌株。按照WO 02/14490中描述,进行转化到枯草芽胞杆菌,其被引入本文作为参考。在含有25ml MBD培养基(基于MOPS的确定成分培养基)、20mg/L新霉素的摇动烧瓶中,进行选择性生长容纳有pUBnprE载体的枯草芽胞杆菌转化体。基本上按照本领域已知的方法(参见Neidhardt等,J.Bacteriol.,119:736-747[1974])制备MBD培养基,除了NH4Cl2、FeSO4和CaCl2从基础培养基(base medium)中省去,使用3mM K2HPO4并对该基础培养基补充60mM尿素、75g/L葡萄糖和1%大豆胨(soytone)。同样,微量营养素被制成为100X原液,其在1升中含有400mg FeSO4·7H2O、100mg MnSO4·H2O、100mg ZnSO4·7H2O、50mg CuCl2·2H2O、100mg CoCl2·6H2O、100mg NaMoO4·2H2O、100mgNa2B4O7·10H2O、10ml的1M CaCl2和10ml的0.5M柠檬酸钠。在37℃下,在培养箱/摇床(Infors)中,温育该培养物3天。该培养物导致具有按蛋白酶分析所显示的水解活性的分泌型NprE蛋白酶的产生。使用NuPage Novex 10%Bis-Tris凝胶(Invitrogen,目录编号NP0301BOX),实施凝胶分析。为了制备用于分析的样品,将2体积上清液与1体积1M HCl、1体积4xLDS样品缓冲液(Invitrogen,目录编号NP0007)和1%PMSF(20mg/ml)一起混合,接下来将其在70℃下加热10分钟。然后,将25μL的每一样品和10μL的SeeBlueplus 2预先染色蛋白质标准品(Invitrogen,目录编号LC5925)一起加载到凝胶上。结果清楚表明,在该实施例中描述的nprE克隆方法得到枯草芽胞杆菌产生的活性NprE。
实施例8
nprE位点评估文库(Site Evaluation Libraries)(SELs)的产生
在该实施例中,描述了在构建nprE SELs中使用的方法。包括上面描述的nprE表达盒的pUBnprE载体被用作模板DNA。该载体含有独特的BglII限制性位点,其被用于位点评估文库构建中。
在Invitrogen合成的pUBnprE表达载体、引物(脱盐的,50nmol水平)被用于产生文库。引物的序列在表8-1中提供。
为了构建nprE位点评估文库,实施3个PCR反应,包括两个诱变PCR,以将突变的目的密码子引入成熟nprE DNA序列和使用第三个PCR融合该两个诱变PCRs,以便构建pUBnprE表达载体,其在成熟nprE序列中包括期望的突变密码子。
诱变的方法基于密码子特异性突变方法,其中使用正向和反向寡核苷酸引物在特异性DNA三联体中司时产生所有可能的突变,所述寡核苷酸引物具有25到45核苷酸长度,其包含特异性设计的三联DNA序列NNS((A、C、T或G)、(A、C、T或G)、(C或G))——相应于待被突变的密码子序列,并且在特异性nprE成熟密码子处随机引入核苷酸。在引物名称(参见表8-1)中列出的数字与特异性nprE成熟密码子位置相对应。
用于构建位点评估文库的两种另外的引物包括BglII限制性位点和一部分位于BglII限制性位点两侧的pUBnprE DNA序列。Invitrogen制造了这些引物(50纳摩尔水平,脱盐的),并将其在表8-1中列出。
每一位点评估文库的构建开始于使用pUB-BglII-FW引物和特异性nprE反向诱变引物的两个初级PCR扩增。对于第二个PCR,使用pUB-BglII-FW引物和特异性nprE正向诱变引物(对于正向和反向诱变引物,相司的nprE成熟密码子位置)。
使用Plusion High-Fidelity DNA聚合酶(Finnzymes目录编号F-530L),实施将突变引入成熟nprE序列。根据提供聚合酶的Finnzymes方案,实施所有的PCRs。初级PCRs的PCR条件是:
对于初级PCR 1:pUB-BglII-FW引物和特异性NPRE反向诱变引物——都为1μL(10μM);
对于初级PCR 2:pUB-BglII-RV引物和特异性NPRE正向诱变引物——都为1μL(10μM);以及
PCR程序是:30秒98℃、30x(10秒98℃、20秒55℃、1,5分钟72℃)和5分钟72℃,在PTC-200Peltier热循环仪(thermal cycle)(MJ Research)中实施。PCR实验产生大约2到3kB的两种片段,其在目的NPRE成熟密码子周围具有大约30个核苷酸碱基重叠。在第三个PCR反应中使用前述的两种片段以及正向和方向BglII引物融合片段。在下列溶液中实行融合PCR反应:
pUB-BglII-FW引物和pUB-BglII-RV引物——都为1μL(10μM)
PCR融合程序如下:30秒98℃、30x(10秒98℃、20秒55℃、2:40分钟72℃)和5分钟72℃,在PTC-200PeItier热循环仪(thermal cycler)(MJ Research)中。
使用QiaquickPCR纯化试剂盒(Qiagen,目录编号28106)纯化扩增的线型6.5Kb片段,并且用BglII限制性酶消化,以在融合片段的两端上产生粘性末端:
-35μL纯化的线型DNA片段
-4μL3缓冲液(Invitrogen)
-1μLBglII,10单位/ml(Invitrogen)
反应条件:1小时、30℃。
BglII消化的和使用QiaquickPCR纯化试剂盒(Qiagen,目录编号28106)纯化的片段的连接产生含有期望突变的环状和多聚体DNA:
-30μL纯化的BglII消化的DNA片段
-8μL T4DNA连接酶缓冲液(目录编号46300-018)
-1μLT4DNA连接酶,1单位/μL(目录编号15224-017)
反应条件:16-20小时、16°
接下来,将连接混合物转化到枯草芽胞杆菌(ΔaprE,ΔnprE,oppA,ΔspoIIE,degUHy32,ΔamyE::(xylR,pxylA-comK)菌株。按照在WO 02/14490中描述的实施转化到枯草芽胞杆菌,其被引入本文作为参考。对于每一文库,挑选96个单一菌落,并且在含有新霉素和1.25g/L的酵母提取物的MOPS培养基中生长,以进行序列分析(BaseClear)和筛选目的。每一文库包括最大19个nprE位点特异突变体。
通过将枯草芽胞杆菌SEL转化体在含有20mg/L新霉素和1.25g/L的酵母提取物的MBD培养基(参见上面)、96孔MTP中37℃下生长68小时,产生所述变体。
实施例9
nprE组合文库(RCLs)的产生
在该实施例中,描述用于产生nprE组合文库的方法。对于这种酶,选择一种特性作为需要最大改变的特性。该特性在本文被称为“主要特性(primary property)”。为了组合文库设计的目的,所有其它的特性是“次要特性(secondary properties)”。如本文使用的改进蛋白质的基本方法是结合提高主要特性并且也保持或提高次要特性的突变。使用位点评估数据识别提高主要特性同时保持或提高次要特性的那些突变。被结合的突变通过其性能指数(Performance Index)(PI或Pi)和相关的ΔΔGapp值进行识别。
如本文使用的“表观自由能变化(apparent Free Energy Change)”(ΔΔGapp)被定义为:
ΔΔGapp=-RT Ln(P变体/P亲本)
其中P变体是变体的性能值,P亲本是相同条件下亲本酶的性能值。P变体/P亲本的比被定义为特性的性能指标(Pi)。对于数据分布和可加性,预期ΔΔGapp值以与实际ΔΔG值相似的方式表现。然而,因为ΔΔG表示相比于亲本酶,变体可实行的最大量功,所以量ΔΔGapp通常低估ΔΔG,并且可导致表现增效的结果,这是因为两个附加位置的特性可以比通过将它们的ΔΔGapp值加在一起预测的值大。
例如,当稳定性是主要特性并且BMI活性是次要特性时,具有ΔΔGapp值<0(Pi>1)和BMIΔΔGapp值<0.06(Pi>0.9)的突变可被选择用于结合。事实上,在这些实验中探究了这些联系。
为了产生用于这些实验的变体,通过GeneArt(Geneart)产生在多个nprE成熟DNA位置含有多个突变的合成nprE文库片段。用DNA限制性内切酶PvuI和AvaI消化这些1.5kB nprE文库片段,并且通过连接酶反应、使用T4DNA Ligase(目录编号15224-017)在5kB pUB载体片段中进行纯化和连接(也用DNA限制性内切酶PvuI和AvaI消化)。
为了将连接反应混合物直接转化入芽胞杆菌细胞,使用TempliPhi试剂盒(Amersham目录编号25-6400)扩增文库DNA(在pUB载体片段中连接的nprE文库片段混合物)。为了该目的,1pL的连接反应混合物与得自TempliPhi试剂盒的5μL样品缓冲液混合,并且在95℃下加热3分钟,以使DNA变性。将该反应置于冰上冷却2分钟,然后短时间旋转。接下来,加入5μL的反应缓冲液和得自TempliPhi试剂盒的0.2μL的phi29聚合酶,在30℃下、MJ Research PCR仪中温育反应4小时。在反应中通过在65℃下、PCR仪中温育10分钟,使phi29酶热失活。
对于将文库转化入芽胞杆菌,混合0.1μL的TempliPhi扩增反应产物与500μL的感受态枯草芽胞杆菌细胞(ΔaprE,ΔnprE,oppA,ΔspoIIE,degUHy32,ΔamyE::(xylR,pxylA-comK),然后在37℃下强力摇动1小时。然后,将100和500μL铺于含有20mg/L新霉素和0.5%脱脂乳的HI-琼脂板。一般而言,如WO 02/14490中描述,进行到枯草芽胞杆菌的转化,其被引入本文作为参考。预期通过这种方法构建的枯草芽胞杆菌nprE组合文库,在诱变靶向的一个或多个位置包括野生型氨基酸。
然后,检测在这些文库中得到的变体在中的稳定性,和在BMI洗涤性能检测中的它们的性能,如本文描述的。表9提供在BMI分析中检测的变体的性能指数。在该表中,“Pos.”表示被改变的NprE氨基酸序列的位置,“AA”表示每一个变体所进行的氨基酸取代。
实施例10
通过诱变产生nprE位点评估文库(SELs)的另一种方法
在该实施例中,描述产生nprE SELs的另一种方法。如在上面实施例8中,pUBnprE载体用作产生nprE SELs的模板DNA来源。在这两种方法之间的主要差异是该方法需要使用互补的位点定向诱变引物扩增整个载体。
材料:
含有pUBnprE载体的芽胞杆菌菌株
Qiagen质粒中量试剂盒(Midi Kit)(Qiagen目录编号12143)
Ready-Lyse溶菌酶(Epicentre目录编号R1802M)
雌亲甲基化酶试剂盒(dam Methylase Kit)(New England Biolabs目录编号M0222L)
Zymoclean凝胶DNA回收试剂盒(Gel DNA Recovery Kit)(Zymo Research目录编号D4001)
nprE位点定向诱变引物,100nmole(纳摩尔)水平,5′磷酸化,PAGE纯化(Integrated DNA Technologies,Inc.)
QuikChange多位点定向诱变试剂盒(Multi Site-Directed Mutagenesis Kit)(Stratagene 目录编号200514)
MJ Research PTC-200 Peltier热循环仪(Thermal Cycler)(Bio-Rad Laboratories)
1.2%琼脂糖E-gels(Invitrogen目录编号G5018-01)
TempliPhi扩增试剂盒(GE Healthcare目录编号25-6400-10)
感受态枯草芽胞杆菌细胞(ΔaprE,ΔnprE,oppA,ΔspoIIE,degUHy32,ΔamyE::(xylR,pxylA-comK)
方法:
为了得到pUBnprE载体,含有pUBnprE载体的单一菌落的芽胞杆菌菌株被用来接种5ml LB+10ppm新霉素管。这是在这些方法中使用的起始培养物。37℃下伴随225rpm的摇动,生长该培养物6小时。然后,将100ml新鲜的LB+10ppm新霉素与1ml起始培养物接种。37℃下伴随225rpm的摇动,生长该培养物整夜。在该温育后,通过足够的离心,收集细胞团以提供细胞团。将该细胞团悬浮于10ml缓冲液P1(Qiagen质粒中量试剂盒)中。然后,将10μl Ready-Lyse溶菌酶加入到重悬的细胞团中,并且在37℃下温育30分钟。然后,继续Qiagen质粒中量试剂盒方案(使用10ml缓冲液P2和P3以导致细胞培养物增加体积)。在从芽胞杆菌分离pUBnprE载体后,量化pUBnprE载体的浓度。然后使用雌亲甲基化酶试剂盒(New England Biolabs),用试剂盒方案中列出的方法,将该载体雌亲甲基化,以每管甲基化大约2ug的pUBnprE载体。使用Zymoclean凝胶DNA回收试剂盒纯化和浓缩雌亲甲基化的pUBnprE载体。量化该雌亲甲基化的pUBnprE载体,然后将其稀释到50ng/ul的工作浓度。遵照制造商的方案(例如1ul雌亲甲基化的pUBnprE载体(50ng/ul),1ul nprE位点定向正向诱变引物(10uM),1ul nprE位点定向反向诱变引物(10uM),2.5ul 10x QuikChange多反应缓冲液,1ul dNTP混合物,1ul QuikChange多酶混合物(2.5U/ul)和17.5ul蒸馏高压灭菌水,以提供25ul总反应混合物),在QuikChange多位点定向诱变试剂盒(Stratagene)中,在PCR反应中使用互补的位点定向诱变引物(10uM,每种引物1ul)(参见表10-1)。使用下面的反应条件扩增nprE位点评估文库:95℃持续1min.(仅第一个循环),然后95℃持续1min.、55℃持续1min、65℃持续13.5min,并且重复循环23次。将反应产物在4℃下储存过夜。然后,使用制造商的方案(即将1.5ul DpnI限制性酶加入到每一管中,并且在37℃下温育3小时;然后,对于每一nprE SEL,在1.2%E-gel上分析2ul DpnI消化的PCR反应物,以确保PCR反应运作并且降解亲本模板),反应混合物经过DpnI消化处理(用QuikChange多位点定向诱变试剂盒提供)以消化亲本pUBnprE载体。然后,使用制造商的方案(即对于总反应物~11ul,1ul DpnI处理的QuikChange多位点定向诱变PCR,5ul TempliPhi样品缓冲液,5ul TempliPhi反应缓冲液和0.2ul TempliPhi酶混合物;在30℃下温育3小时;通过加入200ul蒸馏的、高压灭菌水稀释TempliPhi反应物,并短暂旋转。然后,将1.5ul稀释的TempliPhi物质转化入感受态枯草芽胞杆菌细胞,并且使用LA+10ppm新霉素+1.6%脱脂乳平板选择nprE SELs),使用TempliPhi滚环扩增,产生大量DNA,以增加每一nprE SEL的文库大小。表10-1提供在这些实验中使用的引物的名称、序列和SEQ ID NOS。通过整合DNA技术(Integrated DNA Technologies),100nmole水平上合成所有的引物、5′-磷酸化并且PAGE纯化。
实施例11
nprE同系物的识别
在该实施例中,描述识别nprE同系物所进行的实验。具体而言,在该实施例中,进行实验以从不同且紧密相关的芽胞杆菌种克隆中性蛋白酶(npr)同系物。选择不同的种以便探究差异和特性,从这些特性分离这些不同的种。
探究的多种npr同系物包括:
热溶芽胞杆菌npr(P23384)
蜡样芽胞杆菌nprC(P05806)
蜡样芽胞杆菌E33L npr(AAY60523)
嗜热脂肪芽胞杆菌nprT
枯草芽胞杆菌nprB
枯草芽胞杆菌nprE
结核芽胞杆菌nprB(AAK00602)
金黄色葡萄球菌aur(P81177)
图3提供这些同系物(SEQ TD NOS:173-181)的序列比对,图4(SEQ ID NOS:182-191)提供多种其它同系物的另一序列比对。
在这些实验中,物质包括:
枯草芽胞杆菌菌株I168的染色体DNA
在DNA2.0,使用枯草芽胞杆菌密码子优化,合成下列DNA质粒:
pJ4:G01905(结核芽胞杆菌nprB)(参见,图6)
pJ4:G01906(蜡样芽胞杆菌E33L npr)(参见,图7)
pJ4:G01907(蜡样芽胞杆菌nprC)(参见,图8)
pJ4:G01908(热溶芽胞杆菌npr)(参见,图9)
pJ4:G01909(金黄色葡萄球菌aur)(参见,图10)
pJ4:G01938(嗜热脂肪芽孢杆菌nprT)(参见,图11)
pJHT载体(参见,图12)
pAC载体(参见,图13)
MJ Research PTC-200Peltier热循环计(Bio-Rad Laboratories)
引物(Operon Inc)
PfuUltra II Fusion HS DNA聚合酶(Stratagene)
限制性内切核酸酶(Roche)
TOP10化学感受态大肠杆菌细胞(Invitrogen)
枯草芽胞杆菌感受态细胞((ΔaprE,ΔnprE,oppA,ΔspoIIE,degUHy32,ΔamyE::(xylR,pxylA-comK)
A.枯草芽胞杆菌nprE的克隆
为了构建枯草芽胞杆菌nprE质粒,分别制备扩增的aprE启动子片段(得自pJHT载体)和具有终止子片段(得自枯草芽胞杆菌菌株I168)的枯草芽胞杆菌nprE基因。图15提供示意图,图解了单独的DNA片段的扩增。
使用重叠延伸拼接(Splice Overlap Extension)(SOE)PCR反应将2个分离的DNA片段连接在一起。在该反应中,组合下列试剂:1ul aprE启动子DNA片段,1ul枯草芽胞杆菌nprE基因+终止子片段,1ul引物EL-689(25uM),1ul引物EL-695(25uM),5ul 10x PfuUltra II Fusion HS DNA聚合酶缓冲液,1ul dNTP(10mM),1ul PfuUltra II Fusion HS DNA聚合酶和39ul蒸馏的、高压灭菌水以提供50ul的总体积。PCR循环是:95℃持续2分钟(仅第一个循环),然后是95℃持续30秒、54℃持续30秒和72℃持续0:45秒的28个循环。
使用MfeI和BamHI限制性内切核酸酶消化aprE启动子-枯草芽胞杆菌nprE基因+终止子的PCR融合片段。使用EcoRI和BamHI限制性内切核酸酶消化pJHT载体。然后,使用限制性内切核酸酶消化的pJHT载体连接限制性内切核酸酶消化的aprE启动子-枯草芽胞杆菌nprE基因+终止子DNA片段。然后,将连接混合物转化入TOP10化学感受态大肠杆菌细胞,以针对LA+50ppm羧苄青霉素选择。在识别含有对于质粒pEL501(参见,图16)正确的DNA构建序列的质粒后,将其转化入感受态枯草芽胞杆菌细胞,以整合入aprE启动子位置。针对在LA+5ppm氯霉素+1.6%脱脂乳平板上的蛋白酶活性(即脱脂乳清除),选择转化体。然后,将扩增的菌株转移到LA+25ppm氯霉素+1.6%脱脂乳平板。然后将菌株转移到LA+25ppm氯霉素+1.6%脱脂乳平板,进行扩增。
B.枯草芽胞杆菌nprB的克隆
为了构建枯草芽胞杆菌nprB质粒,分别制备扩增的aprE启动子片段(得自pJHT载体)和枯草芽胞杆菌nprB基因片段(得自枯草芽胞杆菌菌株I168)以及终止子片段(得自pJHT载体)。图17提供了扩增单独DNA片段的示意图。
使用重叠延伸拼接(SOE)PCR反应将3个分离的DNA片段连接在一起。在该反应中,组合下列试剂:1ul aprE启动子DNA片段,1ul枯草芽胞杆菌nprB基因+终止子片段,1ul终止DNA片段,1ul引物EL-689(25uM),1ul引物EL-700(25uM),5ul 10x PfuUltra II Fusion HS DNA聚合酶缓冲液,1ul dNTP(10mM),1ul PfuUltra II Fusion HS DNA聚合酶和38ul蒸馏的、高压灭菌水以提供50ul的总体积。PCR循环是:95℃持续2分钟(仅第一个循环),然后是95℃持续30秒、54℃持续30秒和72℃持续0:45秒的28个循环。
使用MfeI和SphI限制性内切核酸酶消化aprE启动子-枯草芽胞杆菌nprB基因+终止子的PCR融合片段。使用EcoRI和SphI限制性内切核酸酶消化pJHT载体。然后,使用限制性内切核酸酶消化的pJHT载体连接限制性内切核酸酶消化的aprE启动子-枯草芽胞杆菌nprB基因+终止子DNA片段。然后,将连接混合物转化到TOP10化学感受态大肠杆菌细胞,以针对LA+50ppm羧苄青霉素选择。在识别含有对于质粒pEL508(参见,图18)正确的DNA构建序列的质粒后,将其转化入感受态枯草芽胞杆菌细胞,以整合入aprE启动子位置。针对在LA+5ppm氯霉素+1.6%脱脂乳平板上的蛋白酶活性(即脱脂乳清除),选择转化体。然后,将扩增的菌株转移到LA+25ppm氯霉素+1.6%脱脂乳平板。然后将菌株转移到LA+25ppm氯霉素+1.6%脱脂乳平板,进行扩增。
C.嗜热脂肪芽胞杆菌nprT的克隆
为了构建嗜热脂肪芽胞杆菌nprT质粒,分别制备扩增的aprE启动子片段(得自pJHT载体)和嗜热脂肪芽胞杆菌nprT基因片段(得自质粒pJ4:G01938)。图19提供了扩增该单独DNA片段的示意图。
使用重叠延伸拼接(SOE)PCR反应将2个分离的DNA片段连接在一起。在该反应中,组合下列试剂:1ul aprE启动子DNA片段,1ul嗜热脂肪芽胞杆菌nprT基因片段,1ul引物EL-755(25uM),1ul引物EL-735(25uM),5ul 10x PfuUltra II Fusion HS DNA聚合酶缓冲液,1ul dNTP(10mM),1ul PfuUltra II Fusion HS DNA聚合酶和39ul蒸馏的、高压灭菌水以提供50ul的总体积。PCR循环是:95℃持续2分钟(仅第一个循环),然后是95℃持续30秒、54℃持续30秒和72℃持续0:45秒的28个循环。
使用EcoRI和HindIII限制性内切核酸酶消化aprE启动子-嗜热脂肪芽胞杆菌nprT基因+终止子的PCR融合片段。使用EcoRI和HindIII限制性内切核酸酶消化pAC载体。然后,使用限制性内切核酸酶消化的pAC载体连接限制性内切核酸酶消化的aprE启动子-嗜热脂肪芽胞杆菌nprT DNA片段。然后,采用制造商的方案(即对于~11ul总反应物,1ul aprE启动子-嗜热脂肪芽胞杆菌nprT pAC连接反应物,5ul TempliPhi样品缓冲液,5ul TempliPhi反应缓冲液和0.2ul TempliPhi酶混合物;在30℃下温育3小时),使用TempliPhi滚环扩增产生大量连接的aprE启动子-嗜热脂肪芽胞杆菌nprT pAC DNA分子。然后,将TempliPhi反应物直接转化入感受态枯草芽胞杆菌细胞以整合入aprE启动子位置,从而产生芽胞杆菌菌株EL560,这通过DNA测序分析得以证实(参见,图20)。针对在LA+5ppm氯霉素+1.6%脱脂乳平板上的蛋白酶活性(即脱脂乳清除),选择转化体。然后,将菌株转移到LA+25ppm氯霉素+1.6%脱脂乳平板进行扩增。
D.热溶芽胞杆菌npr的克隆
为了构建热溶芽胞杆菌npr质粒,分别制备扩增的aprE启动子片段(得自pJHT载体)和热溶芽胞杆菌npr片段(得自质粒pJ4:G01908)。图21提供了扩增该单独DNA片段的示意图。
使用重叠延伸拼接(SOE)PCR反应将2个分离的DNA片段连接在一起。在该反应中,组合下列试剂:1ul aprE启动子DNA片段,1ul热溶芽胞杆菌npr基因片段,1ul引物EL-755(25uM),1ul引物EL-741(25uM),5ul 10x PfuUltra II Fusion HS DNA聚合酶缓冲液,1ul dNTP(10mM),1ul PfuUltra II Fusion HS DNA聚合酶和39ul蒸馏的、高压灭菌水以提供50ul的总体积。PCR循环是:95℃持续2分钟(仅第一个循环),然后是95℃持续30秒、54℃持续30秒和72℃持续0:45秒的28个循环。
使用EcoRI和HindIII限制性内切核酸酶消化aprE启动子-热溶芽胞杆菌npr基因+终止子的PCR融合片段。使用EcoRI和HindIII限制性内切核酸酶消化pAC载体。然后,使用限制性内切核酸酶消化的pAC载体连接限制性内切核酸酶消化的aprE启动子-热溶芽胞杆菌npr DNA片段。然后,采用制造商的方案(即对于~11ul总反应物,1ul aprE启动子-热溶芽胞杆菌npr pAC连接反应物,5ul TempliPhi样品缓冲液,5ul TempliPhi反应缓冲液和0.2ul TempliPhi酶混合物;在30℃下温育3小时),使用TempliPhi滚环扩增产生大量连接的aprE启动子-热溶芽胞杆菌npr pAC DNA分子。然后,将TempliPhi反应物直接转化入感受态枯草芽胞杆菌细胞以整合入aprE启动子位置,从而产生芽胞杆菌菌株EL561(参见,图22),这通过DNA测序分析得以证实。针对在LA+5ppm氯霉素+1.6%脱脂乳平板上的蛋白酶活性(即脱脂乳清除),选择转化体。然后,将菌株转移到LA+25ppm氯霉素+1.6%脱脂乳平板,进行扩增。
E.结核芽胞杆菌nprB的克隆
为了构建结核芽胞杆菌nprB质粒,分别制备扩增的aprE启动子片段(得自pJHT载体)和结核芽胞杆菌nprB片段(得自质粒pJ4:G01905)。图23提供了扩增该单独DNA片段的示意图。
使用重叠延伸拼接(SOE)PCR反应将2个分离的DNA片段连接在一起。在该反应中,组合下列试剂:1ul aprE启动子DNA片段,1ul结核芽胞杆菌nprB基因片段,1ul引物EL-755(25uM),1ul引物EL-744(25uM),5ul 10x PfuUltra II Fusion HS DNA聚合酶缓冲液,1ul dNTP(10mM),1ul PfuUltra II Fusion HS DNA聚合酶和39ul蒸馏的、高压灭菌水以提供50ul的总体积。PCR循环是:95℃持续2分钟(仅第一个循环),然后是95℃持续30秒、54℃持续30秒和72℃持续0:45秒的28个循环。
使用EcoRI和HindIII限制性内切核酸酶消化aprE启动子-结核芽胞杆菌nprB基因+终止子的PCR融合片段。使用EcoRI和HindIII限制性内切核酸酶消化pAC载体。然后,使用限制性内切核酸酶消化的pAC载体连接限制性内切核酸酶消化的aprE启动子-结核芽胞杆菌nprB DNA片段。然后,将连接混合物转化入TOP10化学感受态大肠杆菌细胞。在识别含有对于质粒pEL568正确的DNA构建序列的质粒后,将其转化入感受态枯草芽胞杆菌细胞。针对在LA+5ppm氯霉素+1.6%脱脂乳平板上的蛋白酶活性(即脱脂乳清除),选择转化体。DNA质粒制品表明在枯草芽胞杆菌中质粒pEL568是稳定的,并且不整合入aprE启动子位置。图24提供质粒pEL568的图。
E.同源模建
在又其它实施方式中,提供得自解淀粉芽胞杆菌的NprE的成熟结构域的同源模型。在这些实验中,NprE序列(SEQ ID NO:192)的成熟结构域的蛋白质序列通过程序BlastP(NCBI)处理。该程序将该序列与不同序列同一性的其它已知序列匹配。从该结果,鉴别X-射线晶体结构已知的序列。这些序列包括金黄色葡萄球菌Npr(pdb id 1BQB)、绿脓杆菌Npr(pdb idlEZM)、B.thermolyticus嗜热菌蛋白酶(pdb id 1KEI)和蜡样芽胞杆菌Npr(pdb id 1NPC)。图5提供所分析的各种序列的序列比对(SEQ ID NOS:192-195)。
发现蜡样芽胞杆菌Npr的序列与NprE最具有同一性。在接下来的步骤,排除B.thermolyticus嗜热菌蛋白酶(pdb id 1KEI),因为其与蜡样芽胞杆菌Npr非常相似。然后,如下详述,制备同源模型,并且使用程序MOE(Chemical Computing)进行所有计算。首先,使用已知的结构,比对金黄色葡萄球菌Npr(pdb id 1BQB:SEQ ID NO:193)、绿脓杆菌Npr(pdb idlEZM)(SEQ ID NO:194)和蜡样芽胞杆菌Npr(pdb id 1NPC)(SEQ ID NO:195)序列,以便得到最精确的序列比对(即,产生基于序列比对的结构)。接下来,将NprE成熟序列与基于序列比对的该结构进行比对。然后,使用蜡样芽胞杆菌Npr(pdb id 1NPC)作为模板并且使用上面产生的NprE与蜡样芽胞杆菌Npr的序列比对,产生NprE的最初同源模型。从该比对的检查,明显的是尽管蜡样芽胞杆菌Npr含有4个Ca2+离子结合位点,然而NprE仅含有2个Ca2+离子结合位点。
最后,在建立最初同源模型后,将金属离子(即Zn2+和两个Ca2+)在计算上固定,也固定它们各自的蛋白质配体。使用CHARMM22参数设定,在计算上最小化剩余的模型结构,产生最后的同源模型。
实施例12
洗涤性能检测
在该实施例中,描述确定本发明金属蛋白酶的洗涤性能所进行的实验。所有的洗涤性能检测在美国洗涤条件实施,如下面表示:
洗衣洗涤性能检测
设备:Terg-O-Tometer(US Testing)6罐台式型(pot bench top model)
温度:15℃/60°F
洗涤时间:12分钟
搅拌:100rpm
漂洗时间:3分钟
水硬度:CaCO3,每加仑6格令/105ppm(3/1Ca+2/Mg+2)
肥皂水(Sud)浓度:1.6g/l2005液体洗涤剂基本成分
酶剂量:0.00-0.55-2.75-5.50mg活性蛋白/I洗涤溶液
样品:固定的EMPA 116,在20℃固定:在棉织品上的血液、牛奶、墨水(10x7.5cm)
未固定的EMPA 116:在棉织品上的血液、牛奶、墨水(10x7.5cm)
Equest草:在棉织品上擦洗过的草介质(10x7.5cm)
CFT C-10:在棉织品上的颜料、油、牛奶(10x7.5cm)
EMPA 221:使用清洁的棉织品作为纺织品增重物(10x10cm)
将固定的6EMPA 116+2EMPA221置入一容器
将未固定的6EMPA 116+2EMPA221置入一容器
将6Equest草+2EMPA 221置入一容器
将6CFT C-10+2EMPA 221置入一容器
干燥条件:脱水机,草污迹在空气中干燥,用深色衣物覆盖。其它污迹被熨干。
测量样品:使用程式L(L*a*b)的Tristimulus Minolta Meter CR-300,D65 Std照明,在白色背景上。以△污染除去率%表示。
每个样品读数3次(在洗涤之前和洗涤之后)
污染除去率%=(洗涤后L值-洗涤前L值)/(L0白棉织品-洗涤前L值)x100%
所有实验重复四次
使用由下列污染的3种不同的棉织品样品,在特别开发的洗涤检测中检测蛋白酶:
(a)牛奶、血液和墨水(10.0x7.5cm;EMPA),用数字116表示,未固定的和固定的(污迹在20℃固定);
(b)草介质(10.0x7.5cm;Equest);和
(c)颜料、油和牛奶(10.0x7.5cm,用数字C-10 CFT表示)。
下面更详细的描述这些实验。洗涤检测在装备有6个不锈钢检测容器的台式Terg-O-Tometer(US Testing)上实施。每一不锈钢检测容器含有1.6g的2005液体洗涤剂基本成分,其被溶于1000ml 105ppm/每加仑6格令的水中,并且每一不锈钢检测容器加载6份相同的污染的棉织品样品和2份额外的纺织品增重物棉织品样品(EMPA 221)。将选定的蛋白酶(例如中性金属蛋白酶或其它的蛋白酶)以每升肥皂水0.00到5.50mg活性蛋白的浓度加入到每一容器中。
在15℃/60°F下,伴随100rpm搅拌,实行该检测12分钟。洗涤后,在冷的自来水下漂洗样品3分钟,并将其置于脱水机中。草样品被风干,并且用深色衣服覆盖,以限制草污迹对光的敏感性。其它所有样品被熨干。所有的实验实施四次。
使用程式L(L*a*b),用Tristimulus Minolta Meter CR-300,测量检测的样品的反射率。使用下列关系计算洗涤性能值:
污染除去率%=(洗涤后L值-洗涤前L值)/(L0白棉织品-洗涤前L值)x100%
对于纯化的Terg-O-Tometer(TOM)分析的结果在图26中示出,并且将其与枯草菌溶素(BPN′Y217L)、丝氨酸碱性蛋白酶的那些结果进行比较。TOM提供充分胜任和有效的方法,以鉴别各种蛋白酶(例如丝氨酸蛋白酶、中性金属蛋白酶和它们的变体)的不同洗涤性能。使用2005作为基本洗涤剂,在BMI和Equest介质污染的草表面,实施TOM检测。
如在图26中所示,明显地,纯化的中性金属蛋白酶在洗涤检测中比丝氨酸蛋白酶(BPN′Y217L)明显地表现得更好。具体地,对于Equest草污迹,需要2.75ppm的纯化的中性金属蛋白酶以表示出相比于仅0.55ppm的丝氨酸蛋白酶(BPN′Y217L)的~10%的Δ污染除去率%。也检测了低温下中性金属蛋白酶的洗涤性能,发现其对介质固体Equest污迹织物表现很好。用纯化的商业可获得的中性蛋白酶以及用前面描述产生的重组nprE得到相似的结果。
实施例13
2X性能分析中nprE变体的性能
在该实施例中,描述了在上面列出的BM1分析中评估各种nprE变体的性能所进行的实验。使用在实施例1前提供的方法(参见,″用于检测蛋白酶性能的微型样本分析″)。在下面的表中,提供了性能指数大于1(PI>1)和性能指数小于1(P1<1)的多取代变体的结果。
在表13.1中,提供了在2X性能分析中从所选择的单一取代变体得到的数据。该表提供了性能指数,对于变体当性能指数如上所述计算时,其相比于WT酶显示了提高的性能。性能指数大于1的那些变体具有提高的性能。
在表13.2,提供了在2X性能分析中从所选择的多取代变体得到的数据。该表提供了性能指数,对于变体当性能指数如上所述计算时,其相比于WT酶显示出提高的性能。性能指数大于1的那些变体具有提高的性能。
实施例14
nprE变体稳定性
在该实施例中,描述了确定nprE变体稳定性所进行的实验。在这些实验中,使用在实施例1前描述的方法来确定性能指标(参见,前面″在存在洗涤剂情况下,NprE稳定性分析″)。下面的表提供了具有和不具有DTPA检测的性能指数大于1(PI>1)的那些变体的结果。
通过在升高温度下,在温育之前和温育之后确定AGLA活性,测量稳定性。该表含有相比于在这些条件下WT的相对稳定性值。其是(变体残留活性/WT残留活性)的商。大于1的值表示在存在洗涤剂下具有更高的稳定性。在表14.1和14.2中,提供数据示出:在这些条件下,具有和不具有DTPA,相对于WT NprE稳定性,NprE的单取代变体的相对稳定性数据。
在表14.3和14.4中,提供数据示出:在这些条件下,具有和不具有DTPA,相对于WTNprE稳定性,NprE的多取代变体的相对稳定性数据。
下列表中(表14.5)的数据表示,在柠檬酸盐稳定性分析中,相对于WT NprE稳定性的稳定性,NprE变体的相对稳定性数据。通过在升高温度下,在温育之前和温育之后,确定AGLA活性而确定酪蛋白活性来测量稳定性(参见上文“柠檬酸盐稳定性分析”)。该表含有在这些条件下相比于WT的相对稳定性值。其表示为(变体残留活性/WT残留活性)的商。大于1的值表示在存在洗涤剂下具有更高的稳定性。
实施例15
与BPN′217L相比,nprE的pH性能曲线
在该实施例中,描述评估nprE和BPN′Y217L比较性能所进行的实验。在这些实验中,使用EMPA 116(BMI)和Equest草污迹。
材料:
NprE,8mg/mL
BPN’Y217L,25.6mg/mL
EMPA 116污染衣物,3” x 4.5”(Testfabrics)
Equest草(med.),3” x 4”(Warwick Equest)
EMPA 221白色棉织品样品,3” x 4.5”
Minolta Chromameter CR200
2005(Procter&Gamble提供)
水硬浓缩物:每加仑15,000格令(gpg),3∶1 Ca∶Mg
1M Bis-TRIS-丙烷缓冲液
浓硫酸
具有塞子和搅拌器的50L混合罐
Terg-O-Tometer
DI水
制备样品进行处理。每个处理使用18个样品,进行三次平行测定。在暗室制备草样品以防止褪色。使用Minolta Chromameter得到大约18份污染的样品的反射度值。每个样品得到三个读数。记录L值、平均L值和标准差。其是L初始值。
如下制备洗涤剂溶液(总共40L)。优选在检验前的晚上制备该溶液。将该溶液冷藏储存过夜。通过加入39.724Kg的DI水至50L混合物罐中、启动搅拌器、在60克的液体洗涤剂混合、在16mL的水硬性溶液中混合、以及混合200mL的1M Bis-TRIS-丙烷,制备溶液。使用浓硫酸调节pH(如果溶液储存过夜,那么将pH调节到期望pH以下0.2_pH单位,因为pH过夜缓慢升高)。终浓度是:=1.5g/L;水硬度=6gpg;和Bis-TRIS-丙烷=5mM。
对于在Terg-O-Tometer的检测,将1L的洗涤剂溶液加入每一Terg罐,并且使达到温度。将不同浓度的酶加入到罐内。对于BMI检测,使用的酶浓度为0mg/L、0.275mg/L、0.55mg/ml、1.65mg/L、2.65mg/L和5.50mg/L。对于草污迹,使用的nprE浓度为0mg/L、0.1925mg/L、0.385mg/L、1.155mg/L、1.925mg/L和3.85mg/L(BPN′Y217L的浓度与在BMI检测中使用的浓度相同)。开始搅拌并加入样品。在同一Terg-O-Tometer中,并排进行所有的平行测定(例如第一轮中 0X&1/2X,第二轮1X&3X以及第3轮5X&10X)。温度为15℃,搅拌速度是100cpm,并且洗涤时间是12分钟。在4L自来水(~6gpg)中漂洗处理的样品3遍。在纸巾上风干样品过夜。用纸巾覆盖草样品,并且使其在暗室中干燥。如上所述,确定干燥的样品的反射度值。每个样品得到三个读数。记录L值、平均L值和标准差。其是L最终值。
对于每一检测条件和两种酶,使用下面的等式,确定污染除去百分比(%SR):
其中:L0=清洁样品的反射度
L初始=污染样品的反射度
L最终=洗涤样品的反射度
使用下面的式子,确定相对于无酶对照的ΔSR%:
ΔSR%=SR处理%-SR无酶对照%
对于EMPA 116(BMI),在pH值6.7、7.5、8.5和9.5下,将BPN′Y217L与nprE比较。对于EMPA 116,nprE的性能在大约pH 8出现峰值,而BPN′Y217L的性能大约在pH8.8出现峰值。结果表示,尽管在pH6.7下nprE表现得不如BPN′Y217L好,但是在pH 7.5和8.5,nprE表现得比BPN′Y217L好。在pH9.5,这些酶的性能相同。另外,在pH 7.8-8.4,这些酶对于Equest草(med)的性能没有差异。
实施例16
在液体洗涤剂中PMN和nprE酶的比较
该实施例描述了确定PMN和nprE清洗性能的实验。对于蛋白酶敏感污迹,在液体洗涤剂中检测PMN和nprE酶的清洗性能,并与基准丝氨酸蛋白酶(蛋白酶A)进行比较。如在下面的表中所示,甚至在低酶水平,PMN和nprE比蛋白酶A除去污迹好得多。在下列的表中,SRI值越高,表明清洗性能越好。
表16.1在液体(标准大小洗涤机中)中PMN与蛋白酶A清洗性能的比较
表16.1在液体(标准大小洗涤机中)中PMN与蛋白酶A清洗性能的比较
表16.2.在液体(小尺寸洗涤机中)中PMP与蛋白酶A清洗性能的比较
表16.3在液体(小尺寸洗涤机中)中nprE与蛋白酶A清洗性能的比较
实施例17
NprE和NprE变体的热稳定性
在该实施例中,描述了确定NprE和NprE变体的热稳定性所进行的实验。如上所述,制造和纯化酶。判断纯化的酶是充分同源的——具有95%以上的纯度,如使用10%SDS-PAGE确定的,因在凝胶上观察到唯一主要的蛋白质。该蛋白质大约32kDa,其为成熟nprE序列的分子量。使用25mM、pH 5.8、含有1mM氯化锌、4mM氯化钙和40%丙二醇的MES缓冲液配制蛋白质以进行储存。用于这些实验中的分析是前面描述的使用荧光AGLA活性的蛋白酶分析和下面描述的差示扫描量热法(DSC)。
差示扫描量热法(DSC)
使用超灵敏扫描高通过量微热量计VP-Cap DSC(Microcal),测量过量热容曲线。对于DSC测量的标准过程和该技术的原理对本领域普通技术人员是公知的(参见例如Freire,1995)Meth.Mol.Biol.,41,191-218[1995])。简言之,需要大约500 uL的200-400ppm纯的或超滤浓度(UFC)蛋白样品。典型地,在5mM HEPES、pH 8.0缓冲液中,使用200℃/hr的扫描速率在20-100℃温度范围内,扫描400ppm的NprE和变体蛋白(在缺乏和存在130mM柠檬酸盐情况下)。然后,重新扫描同一样品以检查该过程的可逆性。对于NprE,热解折叠过程是不可逆的。在25到200℃/hr的扫描速率内,评估NprE热解链的扫描速率依赖性数据。也评估多种添加剂(例如伯醇和仲醇、盐、环糊精、PEG、山梨醇、甘油)对NprE的热解链温度的影响。
结果
在两个不同浓度下,确定野生型NprE的热稳定性,以显示蛋白质浓度对热解链温度的影响。确定220ppm和440ppm的Tm值分别为67.6+0.5℃和69.2+0.5℃。蛋白质浓度作用突出了二级事件(second-order event)。预期其为凝聚或自溶。然而,本发明不拟限于任何特定机制。但是,这些结果表明,对于NprE的热解链温度的精确测定和任何对比需要蛋白质浓度良好匹配。扫描速率对热解链温度的影响也表明了这样的依赖性:Tm依赖于扫描速率上至150℃/hr,然后在150-200℃/hr之间变平。基于这些结果,对于所有研究,选择200℃/hr为扫描速率上限以最小化Tm对扫描速率的依赖性。
对于NprE和变体,收集的所有数据在表4中示出。表4也包括在存在130mM柠檬酸盐情况下对于NprE和变体获得的DSC热解链温度。在多数情况下,扫描两个蛋白质浓度。如在该表表示的,在存在130mM柠檬酸盐的扫描情况下,不是所有蛋白质都表现出热解折叠情况。
对于NprE的野生型和各种变体,热解折叠曲线(DSC扫描)的代表性图在图27中示出。解折叠曲线表明了野生型中点(midpoint),并且显示了相对于野生型表现出增加的热解链温度的选择变体,以及相对于野生型表现出降低的解链温度的选择变体。该图明确表明,DSC区分稳定和较不稳定NprE变体,并且可用作次级筛选。在洗涤剂中,观察到变体的热解链温度和它们的稳定性之间的大体趋势。例如,在中,变体S66E、S199E、D220P/E、S 129I/V都是优胜者,并且相比于野生型NprE,其显示出大约1℃的热解链温度的增加。该1℃的热解链温度的增加是小的,但是重要的,因为热稳定性一般需要多氨基酸取代。
图28表示NprE变体的热解折叠,其显示在存在130mM柠檬酸盐的情况下的热解折叠曲线。柠檬酸盐是在不存在钙的情况下,快速引起NprE自溶的洗涤剂成分。对于野生型NprE,在存在柠檬酸盐的情况下,没有解折叠曲线,这与已经解折叠或缺少很好形成的疏水核的蛋白相一致。在存在柠檬酸盐的情况下,表现热解折叠曲线的变体被包括在表17中。这些变体在47-56℃的范围内,具有热解链温度。在存在130mM柠檬酸盐的情况下的DSC扫描表明了比野生型对柠檬酸盐更稳定的变体。例如,柠檬酸盐稳定的变体显示出含有S129I或S129V并且含有这些取代中的任一个的组合显示出+5℃的热解链温度增加。
添加剂对NprE热解链温度的影响:
图29表示包括各种添加剂的实验的结果。缓冲液是5mM HEPES,pH 8.0。使用200℃/hr的扫描速率从20-100℃扫描样品。在该图中,水平线表示没有添加剂的野生型NprE的Tm。在这些实验中,数据显示,在存在这些试剂时,对NprE的热解链温度(Tm)很少或没有影响。NprE活性抑制剂即磷酰二肽的包括显示出增加了大约1℃的Tm,这表明抑制剂可赋予NprE对抗热解折叠过程的一定稳定性。上面的条件没有一个有助于使热解折叠过程可逆。然而,本发明不拟限于任何特定的机制。
实施例18
在中NprE同源稳定性和同系物BMI洗涤性能
在该实施例中,描述了在中评估nprE同系物稳定性以及这些同系物洗涤性能所进行的实验。将纯化的NprE(″NprE″)、枯草芽胞杆菌NprE(B.S.NprE)、结核芽胞杆菌NprB(B.T.NprB)和嗜热溶蛋白芽胞杆菌嗜热菌蛋白酶(TLN)以ug/ml在25℃下,在pH8的10mM HEPES中的200ul 25%tide中温育90分钟。使用AGLA分析,测量初始活性和残留活性,如前所述。简言之,将的样品加入到200ul的AGLA缓冲液中(50mM MES,pH6.5,0.005%2.5mM CaCl2),然后将10ul稀释的样品加入到200ul的AGLA底物中(AGLA缓冲液中的2.4mM Abz-AGLA-Nba)。对于第一个100秒,监控在350nm的激发和在415nm的发射,最初的斜率被记录为酶活性。通过将残留活性除以最初活性,计算残留活性的百分比。图30提供示出90分钟后残留活性的图。
为了确定中这些同系物的洗涤性能,首先将预洗涤的BMI微量样品加入到96孔平板的每一孔中。然后,加入190ul的1x浓缩型(780ug/ml浓缩型5mM HEPES、pH8、6gpg水硬度)。然后,将10ul的纯化NprE、枯草芽胞杆菌NprE、结核芽胞杆菌NprB和嗜热溶蛋白芽胞杆菌嗜热菌蛋白酶加入到孔中,以产生0.25ug/ml的终浓度。在25℃,在热混合器上伴随1400rpm摇动,温育该平板30分钟。在温育最后,将100ul的上清液转移到新的96孔平板中。然后,测量在405nm下上清液的OD。用上清液OD减去没有加入酶的空白对照的OD。通过将每一同系物的OD除以NprE的OD,计算性能指数。图31提供了图,其显示出BMI是NprE以及本文描述的nprE同系物的性能。
实施例19
野生型nprE和变体的金属分析
在该实施例中,描述了确定nprE和nprE变体的锌和钙含量所进行的实验。在这些实验中,进行总痕量金属分析,以确认NprE的锌和钙含量,该分析通过感应耦合等离子体-质谱法(inductively coupled plasma-mass spectrometry(ICPMS))和利用微聚焦束的粒子激发X射线发射(micro-PIXE)进行。总的来说,一个锌和两个钙离子紧密结合。
在不含金属的缓冲液中,制备所有的ICPMS和micro-PIXE样品,以除去任何外源的金属污染物。典型地,用pH 8.2的20mM HEPES,使用YM-10微量透析仪器,缓冲液交换250uL的40mg/mL NprE样品3遍。通过将缓冲液通过用Chelax 100树脂填充的柱,产生不含金属的缓冲液。使用得自Sigma的Bicinchoninic酸蛋白测定分析试剂盒(BCA分析),检测最终蛋白质浓度。在West Coast Analytical Services,Inc.分析ICPMS样品。在Ion Beam Analysis Laboratory分析Micro-PIXE样品。
表19-1表示对于野生型NprE的钙和锌离子的金属分析结果。相对于蛋白质浓度,发现在样品中存在两个钙离子和两个锌离子。
MicroPIXE元素组成分析图测量了相对于蛋白质内标(internal standard)的金属浓度。相对于在NprE情况中三个甲硫氨酸引起的硫峰,计算使用Micro-PIXE检测的所有峰值。观察到的大氯离子峰是由于在缓冲液中存在盐。
表19-2表示通过Micro-PIXE检测的金属含量,其表示一般而言,NprE每个蛋白质分子含有两个紧密结合的钙离子和一个锌离子。野生型NprE表明1个锌离子和2个钙离子。预期,由于样品的制备,钙离子可能表示了低的占有率。S58D和T60D显示每个蛋白质接近2个锌离子,表明可能的额外锌离子结合到位点。双变体(double variant)具有两个增加的半胱氨酸,这增加了该技术的精确性。然而,本发明不拟限于具有特定数量离子的任何具体实施方式。
与其它很好表征的钙和锌依赖性中性蛋白酶例如嗜热菌蛋白酶或类嗜热菌蛋白酶的蛋白酶(ILPs)(参见例如Dahlquist等,Biochem.,15:1103-1111[1976];Srpingman等,(1995)Biochemistry 34,15713-15720[1995];和Willenbrock等,(1995)FEBS Lett.358:189-192[1995])一致,发现NprE每个分子含有至少两个紧密结合的钙离子和一个锌离子。提出了可能的第三个钙离子结合位点,但是期望其非常弱。因为对所用样品脱盐以除去任何外源的金属,所以期望这些弱的钙结合位点没有被占据。
实施例20
在浓缩型HDL洗涤剂中用甲酸钙稳定NprE
在该实施例中,描述了在浓缩型HDL洗涤剂中进行稳定NprE的方法所进行的实验。在这些实验中,研究了稳定NprE的方法,是通过在固定的柠檬酸盐浓度下增加甲酸钙水平同时降低实验用浓缩型制剂(″2x″)中DTPA含量进行的。使用统计学实验设计(DOE)的方法,以便简化实验以及数据分析。显示存在于的DTPA不利地影响了NprE稳定性,而加入甲酸钙有助于在大力(full strength)浓缩型制剂中克服有害影响。
使用具有两个中心点的完全中心复合响应曲面模型(full central composite response surface model)作为DOE方法。根据在表19.1列出的组成变化,预制四种成分变化的总共16个独特制剂。在固定浓度的柠檬酸(1.9%)下随着DTPA(0-0.25%)和甲酸钙(0-0.2%),从0-6%(w/w)改变LAS。保持洗涤剂的所有其它成分不变。基于不同混合物的相稳定性,确定成分浓度边界条件。用780ppm nprE在大力(~100%)制剂混合物中进行蛋白质稳定性检测并将其在32℃下温育。测量失活直至24小时。使用0.5ppm蛋白浓度的红色荧光标记酪蛋白分析试剂盒(Invitrogen)进行所有的分析。在三个独立的实验中,测量NprE失活的速率。使用DOE Fusion Pro(S-Matrix)分析DOE数据。
表20.2和图31显示在各种制剂混合物中NprE稳定性测量的结果。平均速率和标准偏差是三个独立测量的平均NprE失活速率(小时-1)。定性地,具有低DTPA含量、高钙加载量的制剂在大力浓缩型中倾向更稳定。作为实例,剂型#5——没有加入DTPA并具有高甲酸钙水平,表现最低的失活速率,这表明更高的NprE稳定性。与之相反,剂型#9,其具有高DTPA浓度而没有加入甲酸钙,表现最低的稳定性。在表20.2中,排名是基于测量的稳定性(即平均速率)。实验轮次来自三个独立的稳定性实验。
图33表示在不同水平的固定浓度的甲酸钙溶液中DTPA对NprE失活的影响。图A表示没有加入甲酸钙的情况下,DTPA引起的NprE失活速率。该相关性表明DTPA具有明显的有害影响。图B表示具有0.1%甲酸钙的情况下,DTPA的影响有一些降低。图C表示具有0.2%甲酸钙的情况下,DTPA的影响明显降低。
图34表示基于0.5hr-1以下(图A)、0.25hr-1以下(图B)和0.05hr-1以下(图C)的响应目标(衰减速率),DOE分析软件(Fusion Pro)产生的DTPA和甲酸钙组分的预测曲线。阴影区域表示DTPA和甲酸钙组分的比率,预示该比率表示具有设定目标之下的衰减速率的稳定性。例如,在存在0.04%DTPA情况下,0.16%甲酸钙提供具有0.25小时-1之下衰减速率的NprE稳定性,如图34图B所示。另一方面,在存在0.16%DTPA情况下,0.08%甲酸钙不能维持具有至少0.25小时-1的衰减速率的NprE稳定性。
实施例21
解淀粉芽胞杆菌中性金属蛋白酶NprE的柠檬酸盐诱导的自溶位点的识别
在该实施例中,描述了用来评估野生型和重组变体nprE(例如枯草芽胞杆菌变体)的柠檬酸盐诱导的自溶的方法。在这些实验中,使用柠檬酸钠(Sigma),诱导解淀粉芽胞杆菌中性金属蛋白酶(在枯草芽胞杆菌中表达的天然和重组变体)的自溶。通过在4℃下,在pH6.5的25mM MES缓冲液中进行反应,控制自溶过程。在这些实验中,通过改变下列任一条件,优化0.4mg/ml NprE的自溶:(a)在10mM柠檬酸盐中温育的时间(10-100分钟);或者(b)在100分钟内,柠檬酸盐浓度(10-100mM)。在单独的缓冲液中(即没有柠檬酸盐)稀释的中性金属蛋白酶的对照在相似的条件下温育。通过加入等体积的1N HCl,终止自溶反应,使用TCA沉淀样品,并且使用丙酮洗涤沉淀物和干燥。将所形成的沉淀物重悬于20uL、pH 6.5的缓冲液和4X LDS样品缓冲液(NuPage,Invitrogen)中。
用10%(w/v)SDS-PAGE解离自溶片段,并将其电印记到PVDF膜上。用Edman降解(Argo Bioanalytica),测序前10个氨基酸残基。使用胰蛋白酶凝胶内消化,检测自溶片段的部分氨基酸序列,并且使用LCQ-MS(Agilent)进行分析。凝胶内消化过程包括浸软含有蛋白质的凝胶片,除去考马斯蓝染色,然后在含有2M尿素的25mM NH4CO3中再水合凝胶片。在37℃下,将胰蛋白酶加入到再水合的凝胶片中大约6小时。在消化后,使用乙腈和TCA提取肽。在C4-疏水柱上(Vydac)上,使用乙腈-水梯度,将肽进行分离。用数据库检索程序,针对含有Genencor酶的数据库,检索所形成肽的图。
每一片段的前10个氨基酸的氨基酸序列与已知的解淀粉芽胞杆菌NprE的氨基酸序列进行比较。这能识别在N-末端的氨基酸,因此识别切割位点(一个或多个)。
柠檬酸盐诱导的片段的产生和它们的解离在10%SDS-PAGE上示出。使用得自Invitrogen的标准分子量标识,鉴别片段的大小。在存在10mM柠檬酸盐的情况下,在100分钟时间范围内,除了剩余的完整NprE外,观察两个片段。发现在低柠檬酸盐浓度下形成的两个片段在大小上为24kDa和9kDa。完整的nprE为32kDa。100分钟时间范围产生良好比例的切割蛋白质(即,初级自溶片段(primary autolysis fragments))。在这些条件下,没有观察或检测到额外的片段。在存在增加柠檬酸盐的情况下实施100分钟的研究以得到次级自溶片段。在该实验中,当使用10-30mM柠檬酸盐的浓度时,观察到上面描述的两个片段。在40mM柠檬酸盐下,较少的24-kDa较大片段是明显的,然而15-kDa片段也是明显的。在50-100 mM之间的柠檬酸盐,不再检测到24kDa片段和9-kDa片段,但是观察到三个其它大小的片段:21kDa、15kDa和11kDa。
使用Edman降解(Argo Bioanalytica),检测24kDa、9kDa(前两个片段)和21kDa、15kDa和11kDa(后面的自溶片段)的N-末端的同一性。
带A1、A3和A4具有与完整NprE的N-末端匹配的天然N-末端序列。带A2的测序报告显示三个片段,其中最不亮(least intense)的序列显示与较亮(more intense)的序列相同,除了其比较亮序列分别少2个残基和1个残基。这与该具体蛋白质片段的碎片(fraying)相一致。凝胶片段的图案和大小表明15kDa(带A4)可衍生自21-kDa片段(带A3),并且因此推测C-末端在或靠近位置198。然而,本发明不拟限于该具体实施方式。
图35提供各种片段的氨基酸序列(对于N-末端测序目标,1-5或)。片段1(A1)具有等同于完整天然蛋白质(SEQ ID NO:222)N-末端残基的N-末端残基,片段2(Ad2)N-末端开始于或靠近D220(SEQ ID NO:223)。也突出显示随后的两个氨基酸残基(A221和G222),因为该片段被识别为被磨碎的(frayed)。片段3(A3)(SEQ ID NO:224)和片段4(A4)(SEQ ID NO:225)具有完整蛋白质的N-末端,片段5(A5)(SEQ ID NO:226)起始于L198。片段4的C-末端可能在或靠近M138(基于A3和A4之间的大小差异)。没有检测到A3相应的片段。
胰蛋白酶消化,然后是片段1到5的肽图的LCQ-MS,在各片段内明确地识别了数个氨基酸肽。在图35中将这些突出显示。LCQ-MS提供识别片段的阳性对照。
基于切割片段的N-末端和LCQ-MS分析,鉴别初级切割位点在氨基酸位置D220、A221、G222、M138和L198。使用定点诱变靶向这些位点,并且产生D220、A221、G222、L198和M138、D139的位点评估文库。筛选变体蛋白质以增加在洗涤剂中的稳定性和BMI洗涤性能,如本文所指出的。在一些情况中,也筛选这些位点附近的氨基酸,进行蛋白质工程,以便确保剪除位点(clip site)被真正靶向。
蛋白质工程结果明显表明,在D220的Pro或Glu的氨基酸取代产生了在洗涤剂中更稳定的NprE分子。另外,通过用Cys取代G222和用Ile或Leu取代M138,为NprE分子提供了额外的稳定性。一般而言,这些特异性氨基酸取代提供给NprE洗涤剂稳定性益处而没有损害BMI洗涤性能。因此,这些实验提供柠檬酸盐诱导的自溶位点的重要绘图数据,有助于对改变和影响NprE总稳定性的主要氨基酸残基的识别。柠檬酸盐(加入到洗涤剂基质中的助洗剂)去稳定化和自溶NprE,并且建议通过螯合必要的钙结合原子进行该过程。在极端洗涤剂条件下,NprE的应用需要在这些设置中使用更稳定的NprE分子。在这些实验中,取代NprE的一个或多个自溶位点导致用于这些极端洗涤剂中的更洗涤剂稳定的nprE分子。
实施例22
液体洗衣洗涤剂组合物
在该实施例中,提供液体洗衣洗涤剂组合物的各种配方。制备下列本发明的液体洗衣洗涤剂组合物:
#1:加入1N HCl水溶液以调节该配方的净pH在大约3到大约5的范围内。
上面22(I)-(II)的实施例的pH为大约5到大约7,以及22(III)-(V)的为大约7.5到大约8.5。
实施例23
手用洗碟液体洗涤剂组合物
在该实施例中,提供各种手用洗碟液体洗涤剂配方。下面是本发明的手用洗碟液体洗涤剂组合物:
样品23(I)-(VI)的pH为大约8到大约11
实施例24
液体自动洗碟洗涤剂组合物
在该实施例中,提供各种液体自动洗碟洗涤剂配方。下面是本发明的手用洗碟液体洗涤剂组合物:
香料/染料和/或水,余量,至100%
实施例25
颗粒和/或片状洗衣组合物
该实施例提供各种颗粒和/或片状洗衣洗涤剂的配方。制备下面的本发明的洗衣组合物,其可以是颗粒状或片状。
水份和/或微量物质*,余量,至100%
*香料、染料、增亮剂/SRP1/羧甲基纤维素钠/光漂白/MgSO4/PVPVI/泡沫抑制剂/高分子PEG/粘土。
实施例26
液体洗衣洗涤剂
该实施例提供各种液体洗衣洗涤剂的配方。制备本发明的下面液体洗衣洗涤剂制剂:
香料/染料和/或水,余量,至100%
实施例27
高密度洗碟洗涤剂
该实施例提供各种高密度洗碟洗涤剂的配方。制备下面本发明的浓缩高密度洗碟洗涤剂:
水份和/或微量物质*,余量,至100%
*增亮剂/染料/SRP1/羧甲基纤维素钠/光漂白剂/MgSO4/PVPVI/泡沫抑制剂/高分子PEG/粘土。
实施例27(I)到(VI)的pH从大约9.6到大约11.3。
实施例28
片状洗涤剂组合物
该实施例提供各种片状洗涤剂制剂。通过将颗粒状洗碟洗涤剂组合物在13KN/cm2压力下,使用标准12头旋转压力机(12head rotary press)压缩,制备本发明的下列片状洗涤剂组合物:
水份和/或微量物质*,余量,至100%
*增亮剂/SRP1/羧甲基纤维素钠/光漂白剂/MgSO4/PVPVI/泡沫抑制剂/高分子PEG/粘土。
实施例28(1)到28(VII)的pH是大约10到大约11.5:15(VIII)的pH是8-10。实施例28(I)到28(VIII)的片重量是从大约20克到大约30克。
实施例29
液体硬表面清洗洗涤剂
该实施例提供各种液体硬表面清洗洗涤剂的配方。制备本发明下面的液体硬表面清洗洗涤剂组合物:
香料/染料和/或水,余量,至100%
实施例29(1)到(VII)的pH是从大约7.4到大约9.5。
尽管已经阐述了本发明的具体实施方式,但是对本领域普通技术人员显而易见的是,可以进行各种其它变化和修改,而不背离本发明的精神和范围。因此所附权利要求拟覆盖所有这些在本发明范围内的变化和修改。
本说明书中提及的所有专利和出版物表示了本发明所属技术领域的普通技术人员的水平。所有专利和出版物通过参考并入本文至这样的程度——如同每一单个的出版物都明确而独立地表明被通过引用并入本文。
已经描述了本发明的优选实施方案,对本领域普通技术人员显而易见的是,可以对公开的实施方案作各种修改,并且此种修改包括在本发明的范围内。
本领域技术人员容易认识到,本发明完全可以进行调整以实现目标并获得提及的以及其中固有的结果和优势。本文中描述的组合物和方法代表了优选的实施方案,是示例性的,并且不拟作为对本发明范围的限制。对本领域技术人员显而易见的是,可以对本文中公开的发明进行各种替换和修改,而不脱离本发明的范围和精神。
本文中被例证性地描述的发明可以在缺少本文中未具体公开的任何要素或许多要素、限定或许多限定的情况下适宜地被实施。已被使用的术语和表述被用作描述性而不是限定性术语,并且本发明的意图不是在使用这些术语和表述时排除所示出和描述的特征或其部分的任何等价物,但是应认识到,各种修改可能在要求保护的发明的范围内。因此,应该理解,尽管本发明通过优选的实施方式和任选的特征被具体公开,但本领域技术人员可以对本文公开的概念进行修改和变化,而这些修改和变化被认为在由所附权利要求限定的本发明范围内。在本文中,对本发明宽泛和概括地进行了描述。落入概括性公开内容中的每一较窄类型和亚类也形成本发明的一部分。这包括带有从该类中排除任何主题的限制性条件或否定性限制条件的本发明概括性描述,而不管该排除的内容是否在本文中被具体叙述。
本发明还涵盖如下实施方式:
1.分离的具有提高的储存稳定性的中性金属蛋白酶,其中所述中性金属蛋白酶是芽孢杆菌中性金属蛋白酶。
2.实施方式1所述的中性金属蛋白酶,其中所述芽孢杆菌是解淀粉芽孢杆菌。
3.实施方式1所述的中性金属蛋白酶,其中所述中性金属蛋白酶与包含SEQ ID NO:3或SEQ ID NO:18的中性金属蛋白酶具有至少45%的氨基酸同一性。
4.实施方式1所述的中性金属蛋白酶,其中所述中性金属蛋白酶包含SEQ ID NO:3或SEQ ID NO:18中列出的氨基酸序列。
5.编码至少一部分实施方式1所述的中性金属蛋白酶的核苷酸序列,其中所述核苷酸序列选自SEQ ID NOS:1、2、12和13。
6.表达载体,其含有编码SEQ I D NO:3列出的氨基酸序列的核苷酸序列。
7.含有实施方式6所述表达载体的宿主细胞。
8.从实施方式7所述的宿主细胞得到的储存稳定的中性金属蛋白酶,其中所述中性金属蛋白酶被所述表达载体编码。
9.分离的中性金属蛋白酶,其与实施方式1所述中性金属蛋白酶具有免疫交叉反应性。
10.在SEQ ID NO:18中列出的氨基酸序列。
11.在SEQ DI NO:3中列出的氨基酸序列。
12.实施方式10所述的氨基酸序列,其中所述序列含有至少一个氨基酸取代,所述取代在与含有SEQ ID NO:18所列出的氨基酸序列的中性金属蛋白酶中位置相同的位置进行,其中所述位置选自位置1,3,4,5,6,11,12,13,14,16,21,23,24,25,31,32,33,35,36,38,44,45,46,47,48,49,50,51,54,55,58,59,60,61,62,63,65,66,69,70,76,85,86,87,88,90,91,92,96,97,98,99,100,102,109,110,111,112,113,115,117,119,127,128,129,130,132,135,136,137,138,139,140,146,148,151,152,153,154,155,157,158,159,161,162,169,173,178,179,180,181,183,184,186,190,191,192,196,198,199,200,202,203,204,205,210,211,214,215,216,217,218,219,220,221,222,223,224,228,229,237,239,240,243,244,245,248,252,253,260,261,263,264,265,267,269,270,273,277,280,282,283,284,285,286,288,289,290,292,293,296,297和299。
13.分离的中性金属蛋白酶变体,其具有包含至少一个氨基酸取代的氨基酸序列,所述取代在与含有SEQ ID NO:18所列出的氨基酸序列的中性金属蛋白酶中位置相同的位置进行。
14.实施方式13所述的分离的中性金属蛋白酶变体,其中所述取代在与含有SEQ ID NO:18中列出的氨基酸序列的中性金属蛋白酶的下列位置相同的位置进行:行:1,3,4,5,6,11,12,13,14,16,21,23,24,25,31,32,33,35,36,38,44,45,46,47,48,49,50,51,54,55,58,59,60,61,62,63,65,66,69,70,76,85,86,87,88,90,91,92,96,97,98,99,100,102,109,110,111,112,113,115,117,119,127,128,129,130,132,135,136,137,138,139,140,146,148,151,152,153,154,155,157,158,159,161,162,169,173,178,179,180,181,183,184,186,190,191,192,196,198,199,200,202,203,204,205,210,211,214,215,216,217,218,219,220,221,222,223,224,228,229,237,239,240,243,244,245,248,252,253,260,261,263,264,265,267,269,270,273,277,280,282,283,284,285,286,288,289,290,292,293,296,297和299。
15.实施方式14所述的分离的中性金属蛋白酶变体,其中所述蛋白酶包含选自下列的至少一个突变:T004C,T004E,T004H,T004I,T004K,T004L,T004M,T004N,T004P,T004R,T004S,T004V,T004W,T004Y,G012D,G012E,G012I,G012K,G012L,G012M,G012Q,G012R,G012T,G012V,G012W,K013A,K013C,K013D,K013E,K013F,K013G,K013H,K013I,K013L,K013M,K013N,K013Q,K013S,K013T,K013V,K013Y,T014F,T014G,T014H,T014I,T014K,T014L,T014M,T014P,T014Q,T014R,T014S,T014V,T014W,T014Y,S023A,S023D,S023F,S023G,S023I,S023K,S023L,S023M,S023N,S023P,S023Q,S023R,S023S,S023T,S023V,S023W,S023Y,G024A,G024D,G024F,G024G,G024H,G024I,G024K,G024L,G024M,G024N,G024P,G024R,G024S,G024T,G024V,G024W,G024Y,K033H,Q045C,Q045D,Q045E,Q045F,Q045H,Q045I,Q045K,Q045L,Q045M,Q045N,Q045P,Q045R,Q045T,Q045W,N046A,N046C,N046E,N046F,N046G,N046H,N046I,N046K,N046L,N046M,N046P,N046Q,N046R,N046S,N046T,N046V,N046W,N046Y,R047E,R047K,R047L,R047M,R47Q,R047S,R047T,Y049A,Y049C,Y049D,Y049E,Y049F,Y049H,Y049I,Y049K,Y049L,Y049N,Y049R,Y049S,Y049T,Y049V,Y049W,N050D,N050F,N050G,N050H,N050I,N050K,N050L,N050M,N050P,N050Q,N050R,N050W,N050Y,T054C,T054D,T054E,T054F,T054G,T054H,T054I T054K,T054L,T054M,T054N,T054P,T054Q,T054R,T054S,T054V,T054W,T054Y,S058D,S058H,S058I,S058L,S058N,S058P,S058Q,T059A,T059C,T059E,T059G,T059H,T059I,T059K,T059L T059M,T059N,T059P,T059Q, T059R,T059S,T059V,T059W,T060D,T060F,T060I,T060K,T060L,T060N,T060Q,T060R,T060V,T060W,T060Y,T065C,T065E,T065F,T065H,T065I,T065K,T065L,T065M,T065P,T065Q,T065R,T065V,T065Y,S066C,S066D,S066E,S066F,S066H,S066I,S066K,S066L,S066N,S066P,S066Q,S066R,S066T,S066V,S066W,S066Y,Q087A,Q087D,Q087E,Q087H,Q087I,Q087K,Q087L,Q087M,Q087N,Q087R,Q087S,Q087T,Q087V,Q087W,N090C,N090D,N090E,N090F,N090G,N090H,N090K,N090L,N090R,N090T,N096G,N096H,N096K,N096R,K097H,K097Q,K097W,K100A,K100D,K100E,K100F,K100H,K100N,K100P,K100Q,K100R,K100S,K100V,K100Y,R110A,R110C,R110E,R110H,R110K,R110L,R110M,R110N,R110Q,R110S,R110Y,D119E,D119H,D119I,D119L,D119Q,D119R,D119S,D119T,D119V,D119W,G128C,G128F,G128H,G128K,G128L,G128M,G128N,G128Q,G128R,G128W,G128Y,S129A,S129C,S129D,S129F,S129G,S129H,S129I,S129K,S129L,S129M,S129Q,S129R,S129T,S129V,S129W,S129Y,F130I,F130K,F130L,F130M,F130Q,F130R,F130T,F130V,F130Y,S135P,G136I,G136L,G136P,G136V,G136W,G136Y,S137A,M138I,M138K,M138L,M138Q,M138V,D139A,D139C,D139E,D139G,D139H,D139I,D139K,D139L,D139M,D139P,D139R,D139S,D139V,D139W,D139Y,V140C,Q151I,E152A,E152C,E152D,E152F,E152G,E152H,E152L,E152M,E152N,E152R,E152S,E152W,N155D,N155K,N155Q,N155R,D178A,D178C,D178G,D178H,D178K,D178L,D178M,D178N,D178P,D178Q,D178R,D178S,D178T,D178V,D178W,D178Y,T179A,T179F,T179H,T179I,T179K,T179L,T179M,T179N,T179P,T179Q,T179R,T179S,T179V,T179W,T179Y,E186A,E186C,E186D,E186G,E186H,E186K,E186L,E186M,E186N,E186P,E186Q,E186R,E186S,E186T,E186V,E186W,E186Y,V190H,V190I,V190K,V190L,V190Q,V190R,S191F,S191G,S191H,S191I,S191K,S191L,S191N,S191Q,S191R,S191W,L198M,L198V,S199C,S199D,S199E,S199F,S199I,S199K,S199L,S199N,S199Q,S199R,S199V,Y204H,Y204T,G205F,G205H,G205L,G205M,G205N,G205R,G205S,G205Y,K211A,K211C,K211D,K211G,K211M,K211N,K211Q,K211R,K211S,K211T,K211V,K214A,K214C,K214E,K214I,K214L,K214M,K214N,K214Q,K214R,K214S,K214V,L216A,L216C,L216F,L216H,L216Q,L216R,L216S,L216Y,N218K,N218P,T219D,D220A,D220E,D220H,D220K,D220N,D220P,A221D,A221E,A221F,A221I,A221K,A221L,A221M,A221N,A221S,A221V,A221Y,G222C,G222H,G222N,G222R,Y224F,Y224H,Y224N,Y224R,T243C,T243G,T243H,T243I,T243K,T243L,T243Q,T243R,T243W,T243Y,K244A,K244C,K244D,K244E,K244F,K244G,K244L,K244M,K244N,K244Q,K244S,K244T,K244V,K244W,K244Y,V260A,V260D,V260E,V260G,V260H,V260I,V260K,V260L,V260M,V260P,V260Q,V260R V260S,V260T,V260W,V260Y,Y261C,Y261F,Y261I,Y261L,T263E,T263F,T263H,T263I,T263L,T263M,T263Q,T263V,T263W,T263Y,S265A,S265C,S265D,S265E,S265K,S265N,S265P,S265Q,S265R,S265T,S265V,S265W,K269E,K269F,K269G,K269H,K269I,K269L,K269M,K269N,K269P,K269Q,K269S,K269T,K269V,K269W,K269Y,A273C,A273D,A273H,A273I,A273K,A273L,A273N, A273Q,A273R,A273Y,R280A,R280C,R280D,R280E,R280F,R280G,R280H,R280K,R280L,R280M,R280S,R280T,R280V,R280W,R280Y,L282F,L282G,L282H,L282I,L282K,L282M,L282N,L282Q,L282R,L282V,L282Y,S285A,S285C,S285D,S285E,S285K,S285P,S285Q,S285R,S285W,Q286A,Q286D,Q286E,Q286K,Q286P,Q286R,A289C,A289D,A289E,A289K,A289L,A289R,A293C,A293R,N296C,N296D,N296E,N296K,N296R,N296V,A297C,A297K,A297N,A297Q,A297R和G299N。
16.实施方式13所述的分离的中性金属蛋白酶变体,其中所述蛋白酶包含选自下列的多个突变:S023W/G024M,T004V/S023W/G024W,S023W/G024Y/A288V,T004L/S023W/G024Y,N046Q/N050F/T054L,N050Y/T059R/S129Q,S023W/G024W,A273H/S285P/E292G,S023Y/G024Y,S023Y/G024W,T004S/S023Y/G024W,N046Q/T054K,S023W/G024Y,T004V/S023W,T059K/S066N,N046Q/N050W/T054H/T153A,T004V/S023W/G024Y,L282M/Q286P/A289R,N046Q/R047K/N050Y/T054K,L044Q/T263W/S285R,T004L/S023W/G024W,R047K/N050F/T054K,A273H/S285R,N050Y/T059K/S066Q,T054K/Q192K,N046Q/N050W,L282M/Q286K,T059K/S066Q,T004S/S023W,L282M/Q286R/A289R/K011N,L282M/A289R,N046Q/N050W/T054H,T059K/S129Q,T004S/S023N/G024Y/F210L,T004V/S023W/G024M/A289V,L282M/Q286K/A289R/S132T,N050W/T054H,L282M/Q286R,L282F/Q286K/A289R,T059R/S066Q,R047K/N050W/T054H,S265P/L282M/Q286K/A289R,L282M/Q286R/T229S,L282F/Q286K,T263W/S285R,S265P/L282M/Q286K,T263H/A273H/S285R,T059R/S129V,S032T/T263H/A273H/S285R,T059R/S066Q/S129Q,T004S/G024W,T004V/S023W/G024M,T059K/S066Q/S129Q,L282M/Q286K/A289R/1253V,T004V/S023Y/G024W,T059R/S066N/S129Q,N050F/T054L,T004S/S023N/G024W,T059R/S066N,T059R/S066N/S129V,Q286R/A289R,N046Q/R047K/N050F/T054K,S265P/L282M/Q286P/A289R,S265P/L282M/Q286R/A289RQ062K/S066Q/S129I,S023N/G024W,N046Q/R047K/N050W/T054H,R047K/T054K,T004I/G024W,T014M/T059R/S129V,T059R/S066Q/N092S/S129I,R047K/N050W/T054K,T004V/G024W,N047K/N050F/T054K,S265P/L282F/Q286K/N061Y,L282F/Q286K/E159V,T004V/S023Y/G024M,S265P/L282F/A289R/T065S,T059K/F063L/S066N/S129V,T004L/S023W,N050F/T054H,T059R/S066Q/S129V,V190I/D220E/S265W/L282F,T004S/S023Y/G024M,T004L/S023N/G024Y,T059K/S066N/S129I,T059R/S066N/S129I,L282M/Q286R/A289R/P162S,N046Q/N050F/T179N,T059K/Y082C/S129V,T059K/S129I,N050Y/T054K,T059K/S066Q/V102A/S129Q,T059R/S066Q/S129I,T059W/S066N/S129V/S290R,T059R/S129I,T059K/S066Q/S129I,T059K/S066Q/S129V,S265P/L282M/Q286R/A289R/T202S/K203N,T004V/S023N/G024W,S265P/Q286K,S265P/L282F/A289R,D220P/S265W,L055F/T059W/S129V,T059R/S129Q/S191R, N050W/T054K,T004S/S023W/G024M,R047K/N050F/T054H,T059K/S066N/K088E,T059K/S066Q/S129I/V291L,L282M/Q286R/A289R,T059R/S066N/F085S/S129I,L282F/Q286P/A289R,L282F/Q286R/A289R,G099D/S265P/L282F/Q286K/A289R,N046Q/N050F,N050Y/T059W/S066N/S129V,T009I/D220P/S265N,V190F/D220P/S265W,N157Y/T263W/A273H/S285R,T263W/A273H/S285R,T263W/S285W,T004V/S023Y,N046Q/R047K/N050W,N050W/T054L,N200Y/S265P/L282F/Q286P/A289R,T059R/S066Q/P264Q,T004V/G024Y,T004L/G024Y,N050Y/S191I,N050Y/T054L,T004L/S023W/G024Y/N155K,F169I/L282F/Q286R/A289R,L282M/Q286K/A289R,F130L/M138L/E152W/D183N,N046Q/R047K/N050Y/T054H,T004V/G024M,N050Y/T059W/S066Q/S129V,S023N/G024Y,T054H/P162Q,T004S/S023W/G024Y,N050Y/T054H,L282F/Q286R/A289R/F169I,R047K/N050W,V190F/D220P,L282M/F173Y,T004L/S023Y,N050W/A288D,V190I/D220P/S265Q,S265P/L282F/Q286P/A289R,S265P/L282F/Q286R/A289R,N046Q/N050Y/T054K,T059W/S066Q,T263W/A273H/S285W T263W/A273H/S285P,S023Y/G024M,T004L/S023N/G024W,T004V/S023N/G024Y,T059W/S066N/S129Q,T004S/S023Y,T004S/S023N/G024M,T059W/S066N/A070T,T059W/S066Q/S129Q,T263W/A273H,A273H/285P,N046Q/R047K/N050Y/T054L,N046Q/R047K/N050Y,R047K/N050Y,T263H/S285W,R047K/N050F,N046Q/R047K/N050F/T054H,S023N/G024M,T004S/G024Y,R047K/N050Y/T054H,T059W/S066N/S129I,R047K/T054L,T004S/S023W/G024W,M138L/E152F/T146S,D220P/S265N,T004S/G024M,T004V/S023N,N046Q/N050F/T054K,N046Q/N050Y/T054H,Q062H/S066Q/S129Q,T059W/S129Q,T059W/S129V,N050F/T054K,R047K/N050F/T054L,V190I/D220P/S265W,N112I/T263H/A273H/S285R,T059W/S066N/S129V,T059W/S066Q/S129I,T059W/S129I,T263W/S285P,V190I/D220P,A289V/T263H/A273H,T263H/A273H/S285P,N90S/A273H/S285P,R047K/N050Y/T054L,T004S/S023N,T059R/S129Q,N046Q/R047K/T054H,T059W/S066Q/S129V,E152W/T179P,N050Y/S066Q/S129V,T202S/T263W/A273H,T263W/A273H/S285P,M138L/E152W/T179P,N046Q/R047K,N046Q/T054H/F176L,T004L/G024M,T004S/L282M,T263H/A273H,T263H/A273H/S285W,T004L/S023Y/G024M,L282F/Q286P,T004V/S023Y/G024Y,V190F/S265W,M138L/E152F,V190F/D220E/S265W,N046Q/N050F/T054H,N157Y/S285W,T004F/S023Y/G024M,T004V/S023N/G024M,L198I/D220E/S265Q,N046Q/N050Y/T054K/A154T,S016L/D220E/S265W,D220E/S265W,D220E/A237S/S265W,S066Q/S129Q,V190F/D220E/S265Q/T267I,L282M/F173Y/T219S,E152F/T179P,V190I/S265W,M138L/S066Q,M138L/E152W,T059W/S066Q/A070T/S129I,V190F/D220E/S265N,V190F/S265N,N046Q/N050Y和M138L/E152F/T179P。
17.实施方式13所述的分离的中性金属蛋白酶变体,其中所述蛋白酶包含选自下列的多个突变:V190I/D220P,V190I/D220P/S265Q,V190L/D220E, V190I/D220E/S265Q,V190I/D220E/S265W/L282F,V190L/D220E/S265Q,V190I/D220E/S265W,V190L/D220E/S265N,T059R/S066Q/S129I,V190I/D220E/S265N,V190L/D220E/S265W,V190I/D220E,T059W/S066N/S129V,T059K/S066Q/S129V,T059K/Y082C/S129V,T059R/S066N/S129I,S066Q/S129V,T059R/S066Q/S129V,T059R/S129I,N050Y/T059W/S066N/S129V,D220P/S265N,S066Q/S129I,T059W/S066Q/S129V,T059K/S066Q/S129I,T059R/S129V,N050Y/S066Q/S129V,T059W/S066Q/S129I,N050Y/T059W/S066Q/S129V,T059K/S129I,D220P/S265W,F130L/M138L/T179P,S066N/S129I,T059R/S066N/S129V,F130I/M138L/T179P,T059R/S066Q/N092S/S129I,S066N/S129V,D220E/S265Q,F130L/M138L/E152W/T179P,T059W/S129V,S265P/L282M/Q286R/A289R,S265P/L282F/Q286R/A289R,T059W/S066N/S129I,V190I/D220P/S265W,F130L/E152W/T179P,F130L/M138L/E152F/T179P,Q062K/S066Q/S129I,T059K/S066N/S129I,E152H/T179P,S265P/L282M/Q286K/A289R,F130L/M138L/E152H/T179P,T263W/A273H/S285R,D220E/S265N,F130I/M138L/E152H/T179P,F130V/M138L/E152W/T179P,F130I/M138L/E152W/T179P,T059W/S129I,D220E/S265W,F130V/M138L/T179P,F130L/E152V/T179P,T059R/S129Q,T263W/S285P,F130I/M138L/E152F/T179P,E152W/T179P,V190L/S265Q,F130L/E152F/T179P,L282M/Q286R/A289R/P162S,D220P/S265Q,M138L/E152F/T179P,F130I/E152H/T179P,M138L/E152W/T179P,F130L/T179P,F130L/M138L/E152W/T179P/Q286H,F130L/M138L/E152H,T263W/A273H/S285W,S265P/Q286K,T059W/S066Q/S129Q,T263W/S285R,T059W/S066N/S129Q,T263W/S285W,T059R/S066N/S129Q,S265P/L282M/Q286R/A289R/T202S/K203N,T059W/S129Q,Q062H/S066Q/S129Q,L282M/Q286R/A289R,V190L/D220E/S265N/V291I,V190L/S265N,F130L/M138L/E152W,N050Y/T059R/S129Q,F130I/T179P,T059K/S066Q/S129Q,T059K/S129Q,S265P/L282M/Q286P/A289R,S265P/L282F/Q286P/A289R,T263W/A273H/S285P,S265P/L282M/Q286K,S016L/D220E/S265W,S066Q/S129Q,S265P/L282M/Q286P,L282F/Q286R/A289R,F130V/E152W/T179P,L044Q/T263W/S285R L055F/T059W/S129V,V190L/S265W,Q286R/A289R,G99D/S265P/L282F/Q286K/A289R,F130L/M138L/E152F,T059R/S066Q/S129Q,F130L/E152H,S066N/S129Q,T004S/S023N/G024M/K269N,S265P/L282M,E152F/T179P,T059W/S066N/S129V/S290R,L282F/Q286K/A289R,F130L/M138L,F130I/M138L/E152W,S265P/L282F,F130I/M138L/E152H,F130V/M138L/E152H,V190I/S265Q,M138L/E152M,S265P/L282F/Q286P,M138L/E152H,T059K/S066N/K088E,V190I/S265W,F130L/E152W,L282M/Q286K/A289R,L282M/Q286K/A289R/I253V,T263W/A273H,V190I/S265N,M138L/E152W,A273H/S285R,F130I/M138L,F130L/E152F,F130V/M138L/E152W,T059K/S066Q/V102A/S129Q,F130V/E152H/T179P,F130I/M138L/E152F,F130V/M138L/E152F,M138L/E152F,L282M/Q286R,F130I/E152H,S265P/L282F/A289R/T065S,T263H/A273H/S285R,F130V/M138L,T014M/T059R/S129V,L282M/Q286R/A289R/K11N,A273H/S285P, L282M/Q286K/A289R/S132T,T263H/A273H/S285W,F130V/E152W,S265P/L282F/Q286K/N061Y,F130I/E152W,L198I/D220E/S265Q,V190I/S265L,T263H/S285W,S265P/L282F/A289R,M138L/S066Q,F130I/E152F,N90S/A273H/S285P,S032T/T263H/A273H/S285R,L282F/Q286P/A289R,N157Y/T263W/A273H/S285R,V105A/S129V,T263H/A273H/S285P,S129Q/L282H,T059W/S066Q,F130V/E152H,S023W/G024Y,T004V/S023N,T059R/S066Q,N050W/T054L,L282M/Q286P/A289R,A115V/V190L/S265W,L282M/Q286K,T059R/S066N,L282F/Q286P,T004V/S023W/G024M,S265P/L282F/Q286R/L78H,L282F/Q286K,T004V/S023W/G024Y,S023W/G024M,T059R/R256S,F130V/E152F,T004V/G024W,N050W/T054K,S023Y/G024M,T004V/S023Y,T004V/S023Y/G024M,N050Y/T054H,S023W/G024W,T004V/S023Y/G024Y,T004V/S023N/G024W,F130L/M138L/E152F/T179P/V291I,N050Y/T059K/S066Q,T004V/S023Y/G024W,T059K/S066N,T004V/S023N/G024Y,S023Y/G024W,N050F/T054L,R047K/T054K,S023N/G024W,L282M/A289R,S023Y/G024Y,T004V/G024M,R047K/N050F/T054K,N050F/T054K,T059K/S066Q,S023N/G024M,S023N/G024Y,T004L/S023N,R047K/N050W/T054H,T004L/S023W/G024Y,T004S/S023W,N046Q/N050W/T054H/A142T,T004L/S023Y,T004V/S023W,N050W/T054H,T004S/S023N,T004S/L282M,T004L/S023W,N050F/T054H,N050Y/T054L和R047K/N050W/T054K。
18.实施方式13所述的分离的中性金属蛋白酶变体,其中所述蛋白酶包含选自下列的多个突变:S066Q/S129V,S066Q/S129I,N050Y/S066Q/S129V,S066N/S129I,T059K/S066Q/S129V,S066N/S129V,F130L/E152W/T179P,S265P/L282M/Q286R/A289R,F130L/E152V/T179P,T059K/S066Q/S129I,T263W/S285P,T059K/S066N/S129I,T263W/A273H/S285P,S265P/L282F/Q286R/A289R,F130V/E152W/T179P,T263W/A273H/S285R,V190I/D220P/S265W,F130L/E152H,S066N/S129Q,S265P/L282M/Q286K/A289R,V190I/D220E,T059R/S066N/S129I,V190I/D220E/S265W,T059K/S129I,T059R/S066Q/S129I,F130I/M138L/E152H/T179P,F130I/T179P,T263W/A273H/S285W,S016L/D220E/S265W,S066Q/S129Q,V190I/D220E/S265Q,T059R/S066Q/S129V,D220E/S265N,V190L/D220E,D220E/S265W,V190I/D220P,V190L/D220E/S265N,L044Q/T263W/S285R,S265P/L282M/Q286P/A289R,F130L/M138L/E152H/T179P,T263W/S285R,L282M/Q286R/A289R,T263W/S285W,F130I/E152H/T179P,V190I/D220E/S265N,V190L/D220E/S265W,V190I/D220P/S265Q,T059R/S066N/S129V,V190L/D220E/S265Q,E152H/T179P,F130L/M138L/E152F/T179P,Q062H/S066Q/S129Q,T059R/S129V,V190I/D220E/S265W/L282F,V190I/S265Q,F130L/E152F/T179P,D220E/S265Q,E152W/T179P,T059K/S066Q/S129Q,F130L/M138L/T179P,F130I/M138L/E152F/T179P,F130L/M138L/E152W/T179P,N050Y/T059W/S066Q/S129V,S265P/L282M/Q286K,T059R/S129I, F130V/E152H/T179P,D220P/S265N,S265P/L282M/Q286P,F130I/E152H,T059R/S066Q/N092S/S129I,F130L/T179P,G99D/S265P/L282F/Q286K/A289R,T263W/A273H,V190I/S265N,D220P/S265W,F130L/E152W,F130L/M138L/E152H,S265P/L282M,V190I/S265Q,F130L/E152F,T059K/S129Q,Q286R/A289R,M138L/E152W/T179P,F130I/M138L/E152H,D220P/S265Q,V190L/S265N,F130I/M138L/E152W,S265P/Q286K,V190L/S265Q,V190I/S265W,F130L/M138L/E152F,F130V/E152H,E152F/T179P,N050Y/T059W/S066N/S129V,T059R/S066N/S129Q,F130I/E152W,F130V/E152W,T059R/S066Q/S129Q,T263H/A273H/S285P,N90S/A273H/S285P,V190L/D220E/S265N/V291I,T059R/S129Q,A273H/S285P,F130I/M138L/E152W/T179P,F130V/M138L/E152F,N050Y/T059R/S129Q,T059W/S066Q/S129I,F130V/M138L/T179P,F130V/M138L/E152W/T179P,V190L/S265W,F130V/M138L/E152W,T059W/S066Q/S129V,V190I/S265Q,F130V/M138L/E152H,F130I/E152F,N157Y/T263W/A73H/S285R,T263H/S285W,M138L/E152F/T179P,A115V/V190L/S265W,M138L/E152M,T263H/A273H/S285W,F130L/M138L/E152W,T059K/S066N/K088E,F130I/M138L/E152F,F130I/M138L/T179P,T004V/S023N,T059K/S066Q/V102A/S129Q,F130L/M138L,N047K/N050F/T054K,T263H/A273H/S285R,F130L/M138L/E152W/T179P/Q286H,M138L/E152H,M138L/S066Q,L282M/Q286R/A289R/P162S,L282F/Q286R/A289R,Q062K/S066Q/S129I,A273H/S285R,S265P/L282F/Q286P,S265P/L282F/Q286P/A289R,S265P/L282M/Q286R/A289R/T202S/K203N,T059W/S066N/S129I,V190I/S265L,T059W/S066N/S129V,F130I/M138L,L282M/Q286K/A289R/I253V,R047K/N050F/T054K,M138L/E152F,N050W/T054K,L198I/D220E/S265Q,L282F/Q286K/A289R,N050F/T054K,L282M/Q286R,M138L/E152W,S265P/L282F,F130V/E152F,T059W/S066N/S129Q,F130V/M138L,T263H/A273H,L282M/Q286K/A289R,N046Q/N050W/T054H/A142T,T059W/S066Q/S129Q,S265P/L282F/A289R/T065S,N050F/T054H,S129Q/L282H,L282M/Q286K/A289R/S132T,L282M/Q286R/A289R/K11N,T059K/S066N,R047K/N050W/T054K,T059K/S066Q,T004V/S023Y,T059W/S066N/S129V/S290R,N050Y/T059K/S066Q和R047K/N050Y。
19.中性金属蛋白酶变体,其与野生型解淀粉芽孢杆菌中性金属蛋白酶相比具有提高的性能。
20.实施方式19所述的中性金属蛋白酶变体,其中与野生型解淀粉芽孢杆菌中性金属蛋白酶相比,所述提高的性能包括提高的热稳定性。
21.实施方式19所述的中性金属蛋白酶变体,其中与野生型解淀粉芽孢杆菌中性金属蛋白酶相比,所述提高的性能包括在较低或较高pH条件下的提高性能。
22.实施方式19所述的中性金属蛋白酶变体,其中与野生型解淀粉芽孢杆菌中性金属蛋白酶相比,所述提高的性能包括提高的自溶稳定性。
23.制造具有中性金属蛋白酶活性的酶的方法,包括:用含有与SEQ ID NO:3具有至少70%的序列同一性的多核苷酸的表达载体转化宿主细胞;和在适合制造所述中性金属蛋白酶的条件下,培养所述转化的宿主细胞。
24.实施方式23所述的方法,进一步包括收获所述产生的中性金属蛋白酶的步骤。
25.实施方式23所述的方法,其中所述宿主细胞是芽孢杆菌种。
26.分离的核酸探针,其含有与SEQ ID NOS:1、2、12和/或13的相应片段基本上相同的4到150个核苷酸的序列。
27.实施方式26所述的分离的核酸探针,其中所述探针被用于检测编码具有金属蛋白酶活性的核酸序列。
28.实施方式27所述的核酸序列,其中所述核酸序列从芽孢杆菌属物种获得。
29.含有从解淀粉芽孢杆菌获得的至少一种中性金属蛋白酶的组合物,其中所述组合物进一步包括至少一个钙和/或锌离子。
30.含有从解淀粉芽孢杆菌获得的至少一种中性金属蛋白酶的组合物,其中所述组合物进一步包括至少一种稳定剂。
31.实施方式30所述的组合物,其中所述稳定剂选自硼砂、甘油、锌离子、钙离子和甲酸钙。
32.实施方式30所述的组合物,其中所述稳定剂是至少一种竞争性抑制剂,所述竞争性抑制剂在存在阴离子表面活性剂下,稳定所述至少一种中性金属蛋白酶。
33.含有实施方式1所述的分离的中性金属蛋白酶的清洗组合物。
34.实施方式33所述的清洗组合物,其中所述清洗组合物是洗涤剂。
35.实施方式33所述的清洗组合物,进一步包括至少一种另外的酶或酶衍生物,其选自蛋白酶、淀粉酶、脂肪酶、甘露聚糖酶、果胶酶、角质酶、氧化还原酶、半纤维素酶和纤维素酶。
36.实施方式34所述的清洗组合物,其中所述组合物包括至少约0.0001重量百分比的所述中性金属蛋白酶。
37.实施方式34所述的清洗组合物,其中所述组合物包括约0.001到约0.5重量百分比的所述中性金属蛋白酶。
38.实施方式36所述的清洗组合物,其中所述组合物进一步包括至少一种辅助成分。
39.实施方式31所述的清洗组合物,进一步包括足够量的pH调节物,以提供所述组合物大约3到大约5的净pH,所述组合物基本上不含在大约3到大约5的pH下水解的物质。
40.实施方式39所述的清洗组合物,其中所述在大约3到大约5的pH下水解的物质包含至少一种表面活性剂。
41.实施方式40所述的清洗组合物,其中所述表面活性剂是含有环氧乙烷部分的烷基硫酸钠表面活性剂。
42.实施方式33所述的清洗组合物,其中所述组合物是液体。
43.实施方式33所述的清洗组合物,进一步包括至少一种酸稳定的酶。
44.清洗方法,其包括步骤:将含有织物的表面和/或物品与实施方式33的清洗组合物接触。
45.实施方式44所述的方法,进一步包括步骤:在将所述表面或物品与所述清洗组合物接触后,漂洗所述表面和/或物品。
46.实施方式44所述的方法,其中所述含有织物的表面和/或物品包括草污迹并且所述接触步骤包括将所述草污迹与所述清洗组合物接触。
47.含有实施方式1所述的分离的中性金属蛋白酶的动物饲料组合物。
48.含有实施方式1所述的分离的中性金属蛋白酶的纺织品处理组合物。
49.含有实施方式1所述的分离的中性金属蛋白酶的皮革处理组合物。
- 还没有人留言评论。精彩留言会获得点赞!